-
近年来,抗生素在水土环境中被频繁检出,其对硝酸盐降解的反硝化作用产生不同程度的影响已被多项研究证实[1-2]. 然而,这些研究大多是在单一抗生素暴露条件下进行的. 实际上,在水土环境中检测到四环素类、磺胺类、喹诺酮类、大环内酯类、林可霉素类等多种不同种类及不同功能的抗生素共同存在[3-6]. 不同种类抗生素之间可发生协同、累加、无关以及拮抗等联合作用,对反硝化作用各反应过程、微生物多样性以及反硝化功能基因产生不同于单一抗生素暴露条件下的抑制作用. 因此,通过研究抗生素联合作用效果,可以进一步了解抗生素对硝酸盐氮去除的影响.
由于常规模拟试验花费时间长且复杂多变,通过药敏试验可快速的获得抗生素复合对反硝化细菌的影响. 目前,药敏试验的主要方法有纸片扩散法和微量肉汤稀释法,纸片扩散法从定性角度通过测定抑菌圈直径大小及抑菌图形报告解释抗生素的敏感性及联合抑菌效果,微量肉汤稀释法则通过确定最低抑菌浓度(minimal inhibitory concentration, MIC),并以部分抑菌浓度指数(fractional inhibitory concentration index,FICI)法从定量角度对药物联合作用效果进行评价[7]. 张玉叶等选取氟喹诺酮类5种典型抗生素,通过纸片扩散法与微量肉汤稀释进行药敏试验解释了复合条件下的联合抑菌效应,可能由于抗生素的浓度效应以及两种方法结果解释机理的不同,导致两种方法分别确定的抗生素的联合作用结果存在不一致性[8],为回答此问题并准确确定复合抗生素对反硝化细菌的联合抑菌效应,本文选取5大类抗生素中7种典型的抗生素,通过两两复合探讨对于确定抗生素联合抑菌效应存在的问题及解决方案,以期为复合抗生素对水土环境中反硝化作用影响研究方法的选择和结果的确定提供参考.
-
实验选择选取的抗生素包括:控制蛋白质合成的克林霉素(clindamycin,CLI,含量>98.0%)、四环素(Tetracycline,TCY,含量>98.0%)、红霉素(erythromycin,ERY,含量>98.0%),控制DNA回旋酶的环丙沙星(ciprofloxacin,CIP,含量>98.0%)、氧氟沙星(levofloxacin,OFL,含量>98.0%)、恩诺沙星(enrofloxacin,ENR,含量>98.0%),控制叶酸代谢的磺胺甲恶唑(sulfamethoxazole,SMX,含量>98.0%),共7种. 以上抗菌药物均购置于上海麦克林生化科技有限公司. 将7种抗生素按照CLSI-2016标准配制成不同浓度的储备液,并经0.22 μm滤膜过滤除菌,于4 ℃冰箱中保存备用.
-
用打孔器制作直径6 mm、厚1 mm的圆形滤纸片,121 ℃灭菌15 min(0.11 MPa),烘干后根据半饱和法制作不同药物含量的药敏纸片,将加入抗菌药液的滤纸片无菌风吹扫10 min装入棕色瓶中密封,于−20 ℃冰箱中或阴暗干燥处保存. 选取英国OXOID公司的磺胺甲噁唑药敏纸片进行质控实验,药物含量为每片25 μg.
根据美国临床实验室标准委员会(CLSI)制定的临床实验标准要求[9-13],纸片扩散法使用MH-A琼脂培养基,(Mueller-Hinton Agar,英国OXOID公司);微量肉汤稀释法使用MH-B肉汤培养基(Mueller-Hinton Broth,英国OXOID公司).
-
反硝化菌剂购于上海甘度环境工程有限公司. 甘度反硝化菌分离于自然环境,其微生物菌属主要为Pseudomonas(假单胞菌属)和Enterobacter(肠杆菌属). 张玉叶等研究证实反硝化菌剂中作为典型兼性厌氧反硝化细菌的假单胞菌属相对丰度达39.95%,该菌种可以代表水土环境中反硝化细菌[8]. 质控菌选用美国临床实验室标准委员会(CLSI)推荐的粪肠球菌ATCC 29212,购于上海鲁微科技有限公司.
-
根据美国临床实验室标准委员会(CLSI)制定的临床实验标准及试验规范[7]. 通过纸片扩散法与微量肉汤稀释法两种方法进行抗生素敏感性实验,选取粪肠球菌ATCC 29212为质控菌.
纸片扩散法药敏纸片的药物含量如表1所示,每组设置3个平行样. 将贴好纸片的培养皿倒置,在35 ℃条件下厌氧培养16—18 h. 在反射光下肉眼观察无明显生长的区域,用游标卡尺,采用十字交叉法测量抑菌圈的直径(以整毫米数计),以直径表示抑菌圈的大小.
微量肉汤稀释法中将7种抗菌药物用Ca2+、Mg2+调节的MH-B肉汤(CA-MHB)进行lg2倍比稀释,取100 μL依次加入96孔细胞培养板中,再向每孔加入5 μL按1:10稀释后的0.5麦氏标准的菌悬液,每个浓度设置3组对照. 用封口膜缠绕96孔板接口处后于35 ℃下厌氧培养16—20 h,用酶标仪测定细菌培养板中的浊度变化,以细菌无明显生长的孔所对应浓度为MIC.
-
根据敏感性实验结果选取对反硝化细菌敏感性较强的5种抗菌药物根据Antibiotics in Laboratory Medicine-Antimicrobial combinations[14]进行联合药敏实验.
-
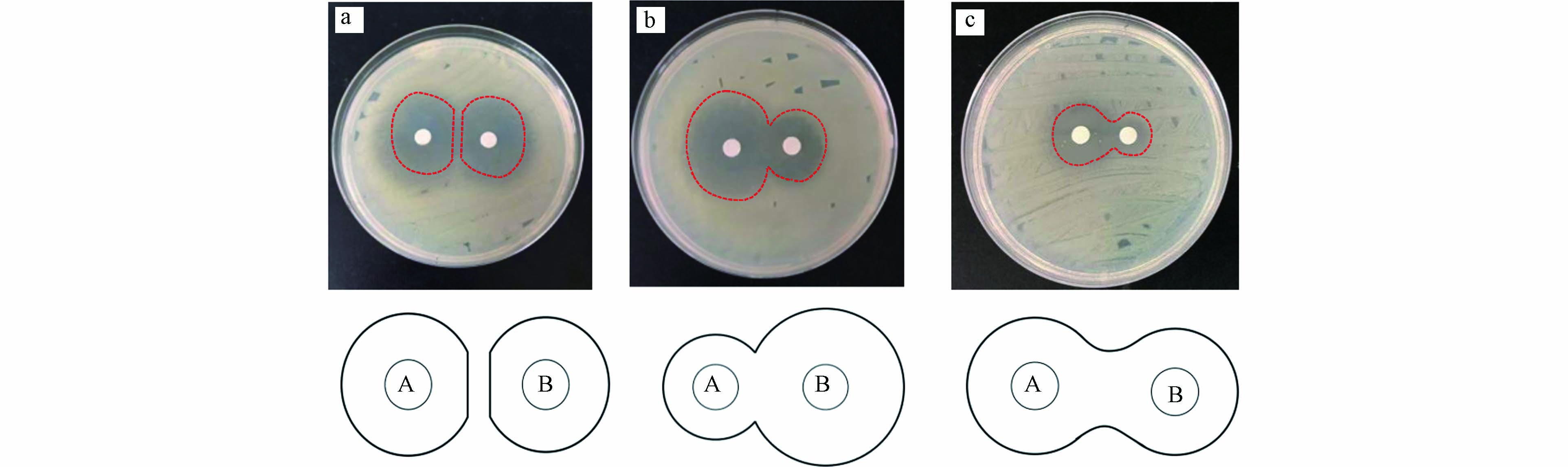
将5种抗生素药敏纸片两两组合共设计10个组合进行联合抑菌实验,编号为1#—10#,同时设定药物含量为0 μg的空白纸片进行对照组实验,每组进行3次重复实验. 药敏纸片药物含量与单一敏感性测定时药物含量保持一致. 用无菌棉拭子将0.5麦氏标准的菌悬液在培养皿上均匀涂布,并将两药敏纸片贴在培养皿上,两纸片中心间距为两种抑菌药物产生的抑菌圈半径之和[15]. 用封口膜缠绕封装培养皿,同时放入密封袋在35 ℃厌氧培养箱中培养16—18 h后读取抑菌图形报告.
若两个抑菌圈交界度>90°表明两种药物是累加或协同作用;交界角度<90°表明两种药物相互无关;两抑菌圈没有重叠表明两药相互拮抗[15].
-
按棋盘法的设计将lg2倍比稀释的抗菌药物两两组合,最高浓度为单药最小抑菌浓度(MIC)的4倍,选择其中7个连续的药物浓度梯度作为联合药敏试验梯度. 由低浓度到高浓度的顺序,取50 μL lg2倍比稀释的药物A溶液,依次加入到96孔板的第2—8列;取50 μL药物B溶液按照由高到低浓度顺序依次加入到第A—G行,将第1列和第H行设为空白对照. 每孔加入5 μL浓度为107 CFU·mL−1的菌悬液,用封口膜封装后于35 ℃下培养16—20 h观察结果.
本实验联合作用结果的评价采用部分抑菌浓度(fraction inhibitory concentration,FIC)法. FIC法是以Loewe additivity(LA)理论为基础发展出的非参数法模型,其公式为:
式中,MICA alone、MICB alone为药物A和B单用时的最低抑菌浓度,MICA comb和MICB comb为两种药物联用时达到与单独用药相同药效时各自的浓度.
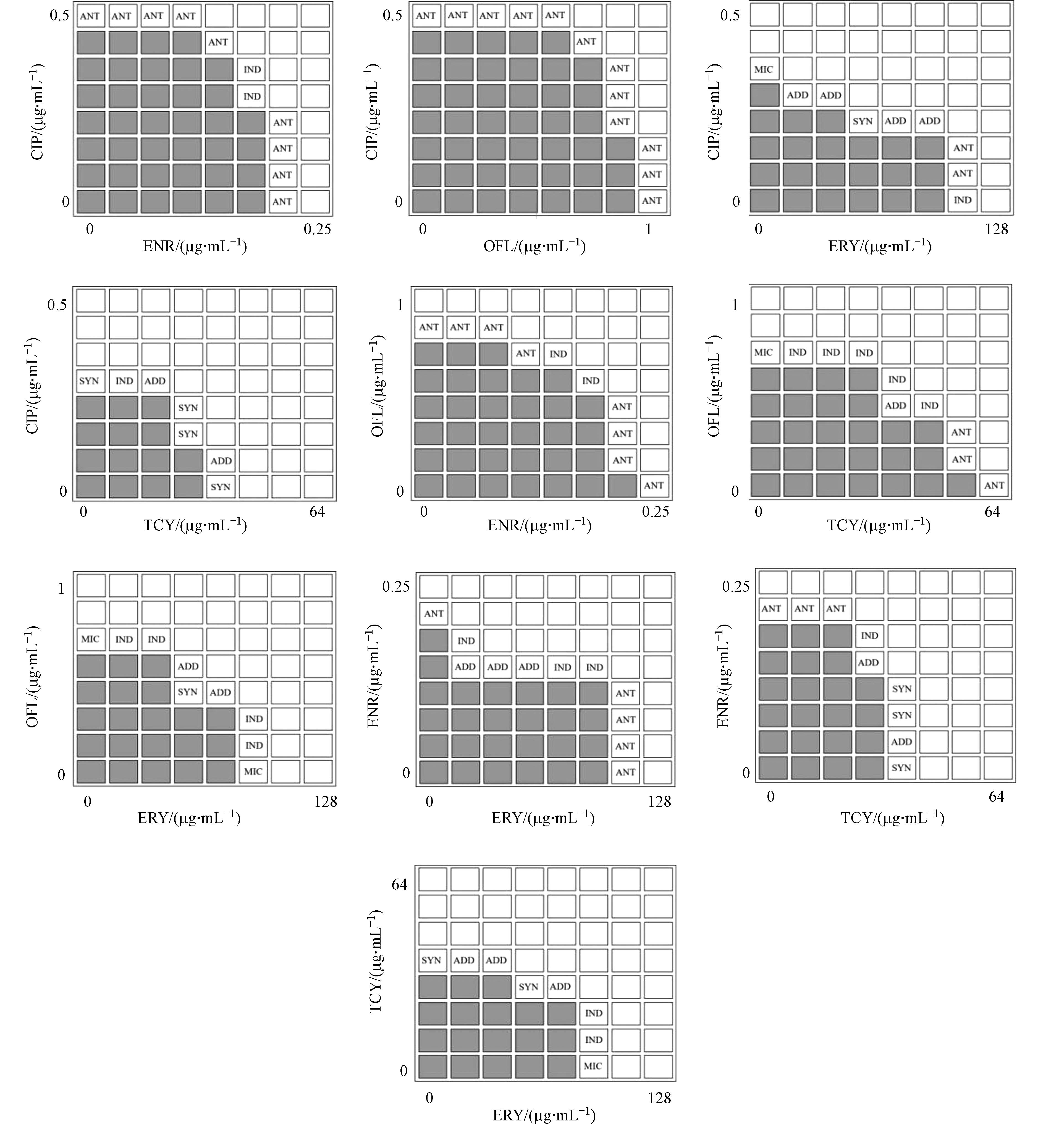
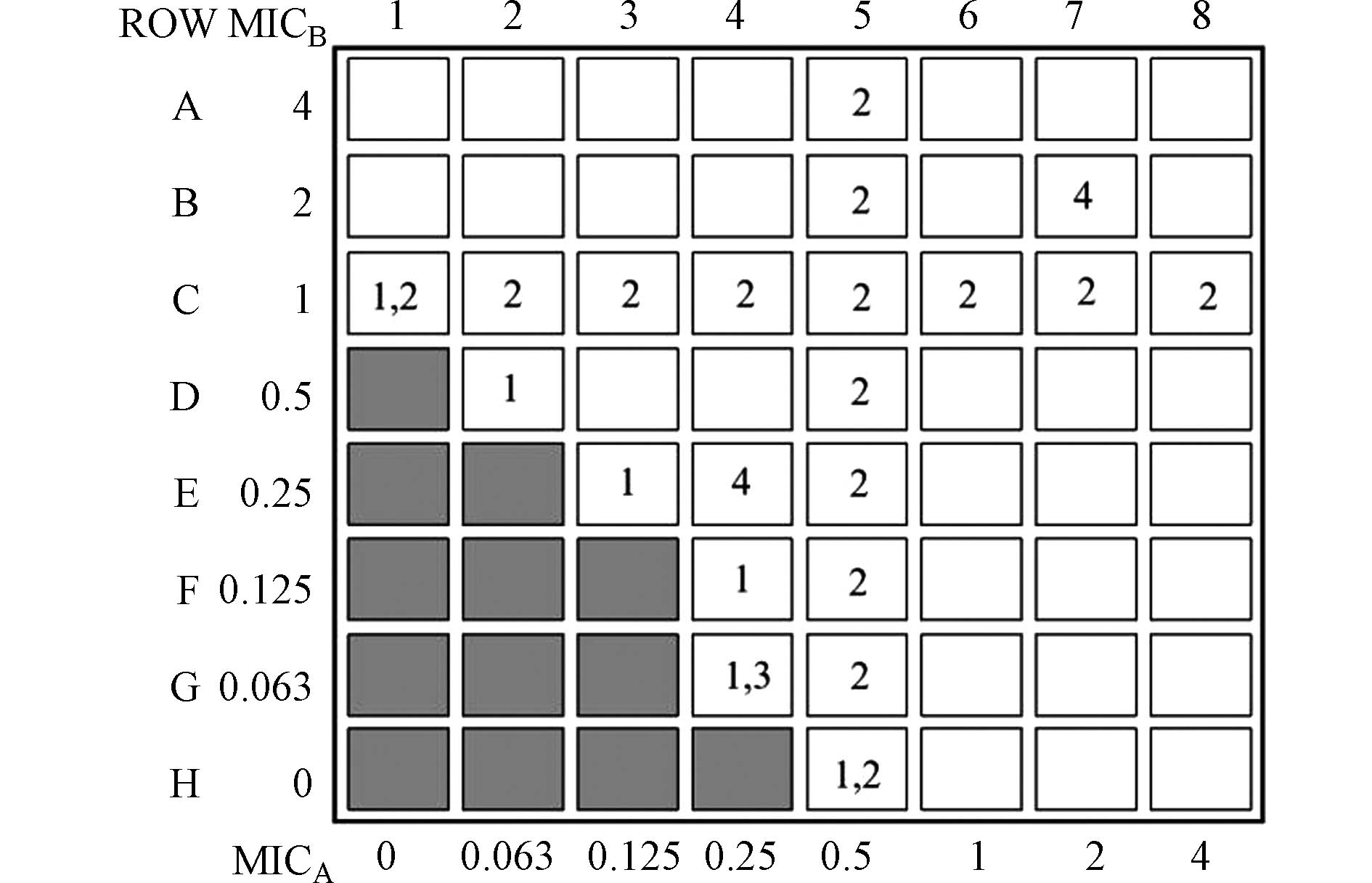
微量肉汤稀释法棋盘测试结果的解释由以下4种方法确定(图1). 方法1# (平均分数抑制浓度 (FIC)指数):沿浊度/非浊度界面的每一行和每一列中发现的第一个非浊度(透明)孔中所对应的药物A和药物B的相应浓度计算FIC值,然后取平均值[16-17],这种方法不需要整行或整列来完全抑制生长. 方法2# (整行/列):该方法使用最低浓度的列和行相交孔中对应的药物浓度计算每种药物的FIC指数,其中在整个行和列中没有观察到明显的细菌生长[18]. 方法3# (最低FIC指数):使用沿浊度/非浊度界面的所有非浊度孔的最低FIC指数[19]. 方法4# (双孔):观察0.25 MIC和2 MIC两孔中细菌生长情况确定药物间的作用关系. 协同作用定义为两个孔中不存在明显的细菌生长,拮抗作用定义为这两个孔中均存在混浊,而累加作用或无关作用定义为所有其他可能性[18,20].
当FIC≤0.5时,两药表现为协同作用;当0.5<FIC≤1时,表现为累加作用;当1<FIC≤2时,表现为无关作用;当FIC>2时,表现为拮抗作用[21].
-
抗生素对反硝化菌的抑制作用主要通过抑制细菌的生长而体现,微生物量(Abs)的多少是评价抗生素抑菌作用效果的重要指标. 通过测定单一与复合抗生素的培养体系中,细菌数量及生长特性之间的差异,确定抗生素之间的相关关系.
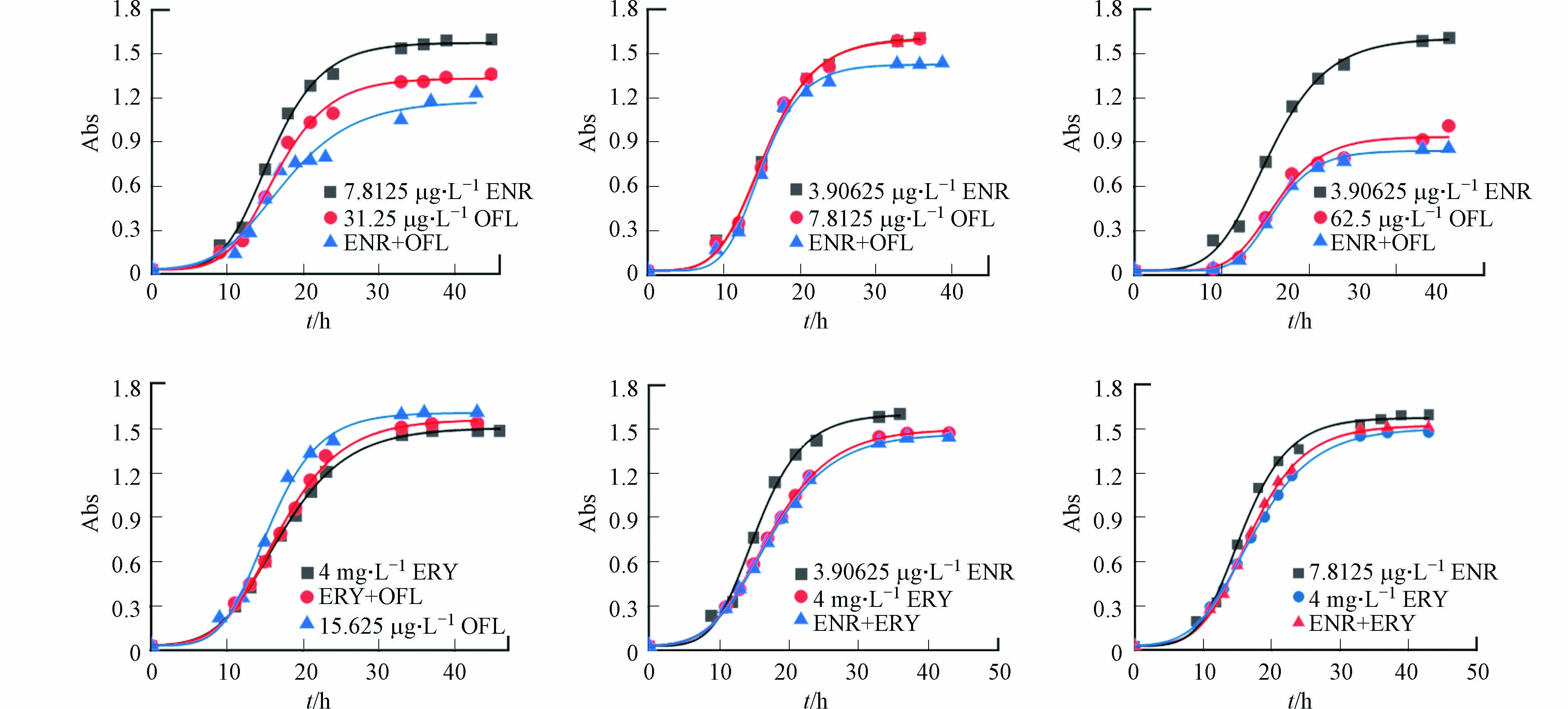
将ENR、OFL、ERY和TCY 4种抗生素溶液用Ca2+、Mg2+调节的MH-B肉汤(CA-MHB)进行稀释,设置不同浓度下抗生素单一与复合的培养体系,分别加入到48孔培养板中,并向每孔中加入5 μL 0.5麦氏标准的菌悬液,在30 ℃下厌氧培养,每组设置3个平行样,同时设置空白组进行对照实验. 通过酶标仪在630 nm波长测定不同浓度各培养体系不同时间间隔下单一与复合培养体系中反硝化细菌数量. 通过S-Gompenz模型拟合反硝化菌生长曲线,公式为:
式中, Nm表示细菌最大生长量cm−1;μm表示细菌最大生长速率cm∙d−1;λ表示迟滞时间d;N0 表示初始生物量;t表示生长时间d;N表示通过曲线拟合得到某生长时间t的细菌数量cm−1.
通过拟合获得最大生长量(Nm)、迟滞时间(λ)、最大生长速率(μm),确定联合作用关系.
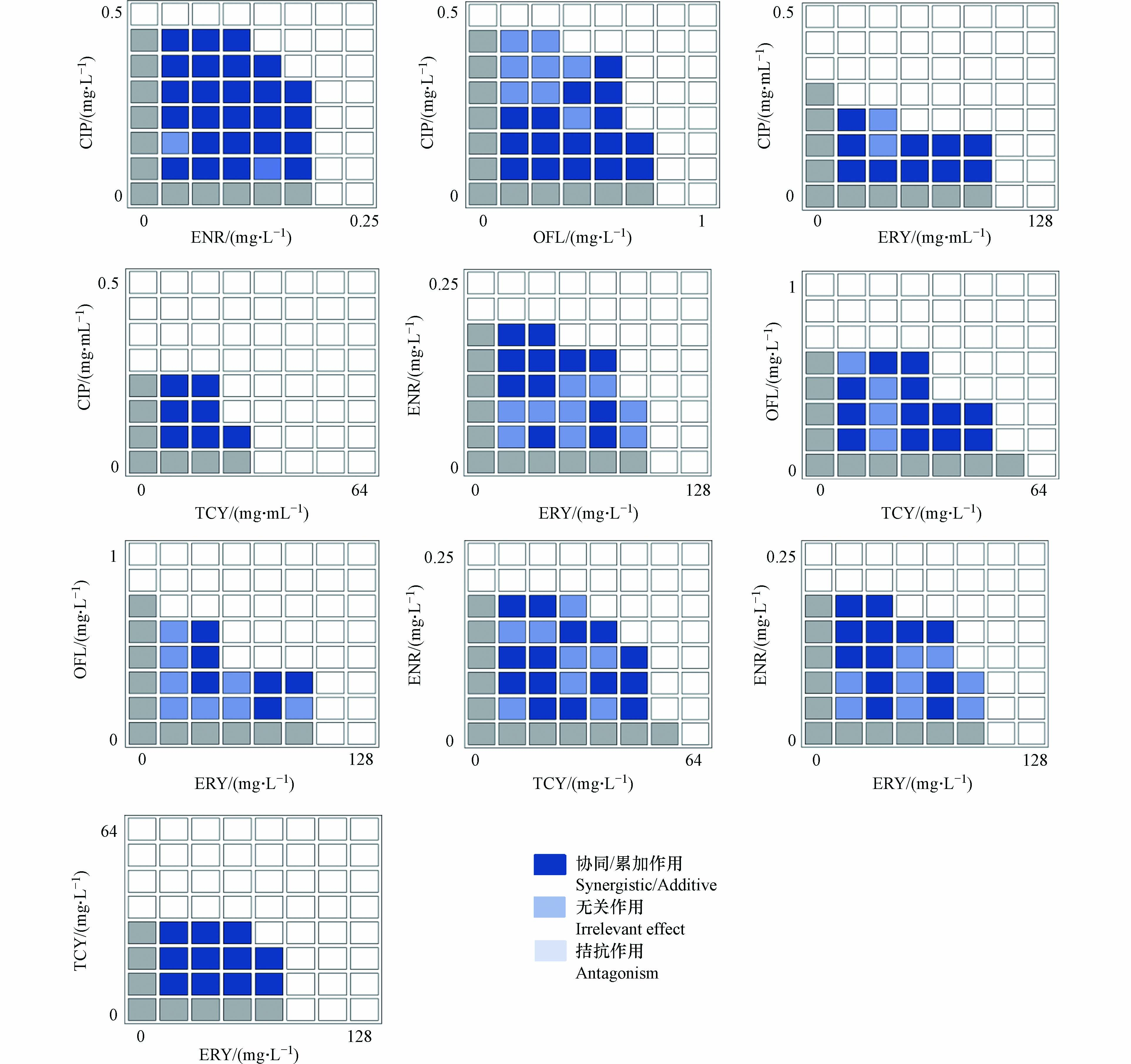
当ODA+B ≤ODmin(A,B)时,若λA+B≥λ(A,B),则两种抗生素复合表现为协同作用,若λA/B≥λA+B ≥λA/B时,表现为累加作用;当ODmin(A,B)≤ODA+B ≤ODmax(A,B)时表现为无关作用;当ODA+B ≥ ODmax(A,B)时表现为拮抗作用. 通过比较单一与复合抗生素培养体系中的生物量及迟滞时间可直观且准确可靠的解释了复合抗生素的作用关系.
-
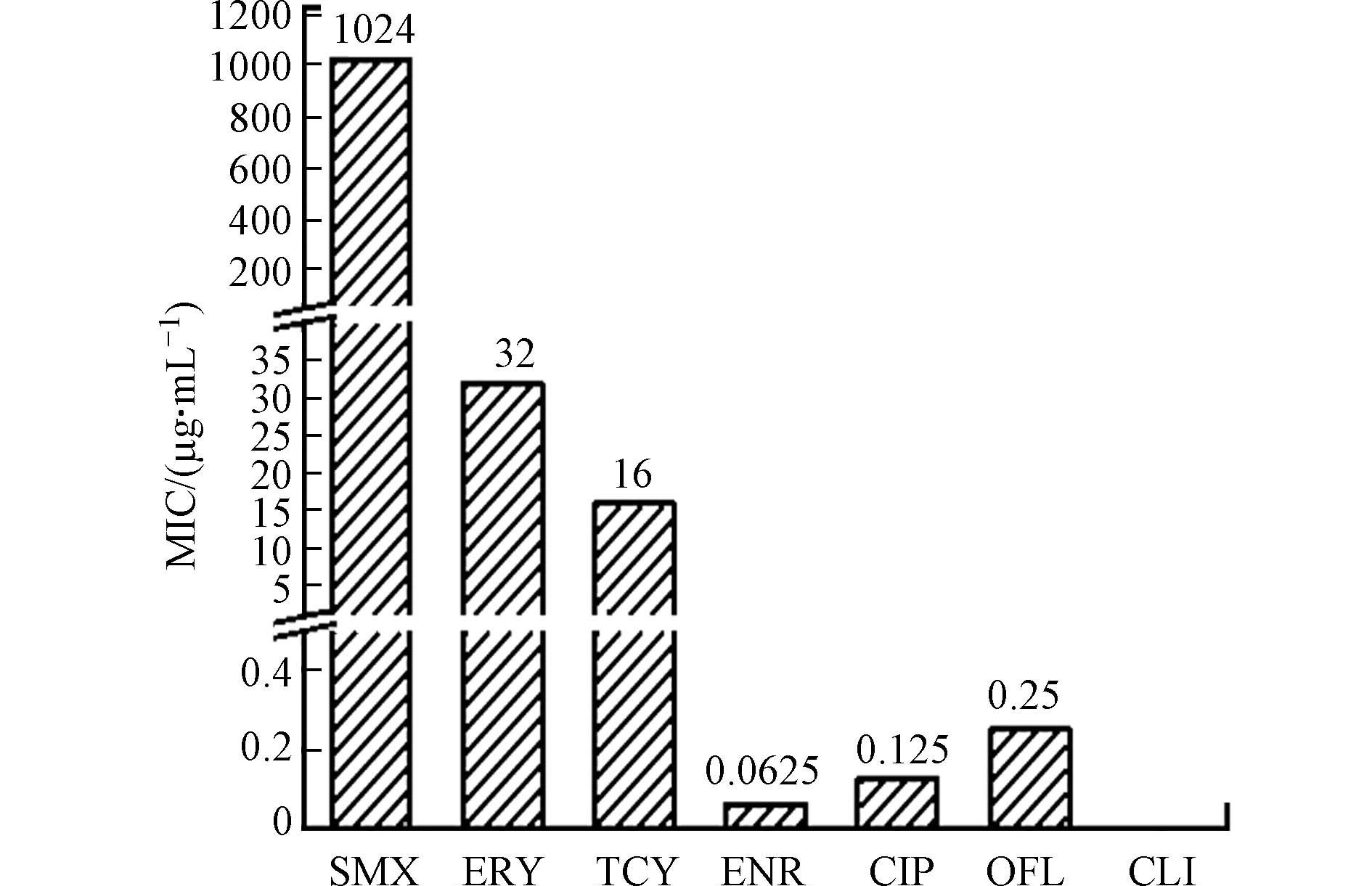
通过纸片扩散法对抗生素敏感性进行定性测定,每种抗生素抑菌圈直径的平均值和标准误差如图2所示. 质控菌对复方磺胺甲噁唑(SMZco)纸片的抑菌圈直径为26 mm,符合纸片扩散法药敏试验的规范要求. 反硝化细菌对ENR最敏感,抑菌圈直径为26 mm,CIP、OFL、TCY、ERY抑菌圈直径分别为24、22、19、15 mm,SMX、CLI无明显抑菌圈,说明SMX、CLI对反硝化菌无明显的抑制作用.
微量肉汤稀释法从定量的角度判断抑菌药物对反硝化菌的抑制效果. 磺胺甲恶唑对粪肠球菌ATCC 29212的抑菌浓度(MIC)为1 μg·mL−1 ,符合微量肉汤稀释法药敏试验的规范要求. 图3表示了不同种类及不同功能7种抗生素的最小抑菌浓度MIC值.
纸片扩散法定性测得的抑菌圈直径(mm)和微量肉汤稀释法定量测得的MIC值都可以反映反硝化菌对抗菌药物的敏感程度,二者大小呈负相关关系,即抑菌圈直径越大,则MIC越小,则反硝化细菌对抗菌药物越敏感. 两种方法测定反硝化细菌对抗生素的敏感性结果具有一致性,敏感性大小为:ENR>CIP>OFL>TCY>ERY>SMX>CLI. 氟喹诺酮类抗生素敏感性最高,可能是由于氟喹诺酮类抗生素作用于DNA回旋酶从而干扰细菌DNA复制,是一类通过杀死细菌达到抑菌效果的杀菌化合物. 此外,反硝化细菌作为革兰阴性菌其外膜的微孔蛋白结构只允许水溶性的小分子通过,喹诺酮类抗生素的分子较小,且亲水性能极强,可以快速穿透膜孔蛋白通道,所以反硝化细菌对这类药物十分敏感[22];大环内酯类与四环素类抗菌药物达到抑菌效果是抑制蛋白质的合成,具体为通过抑制蛋白质肽链的延伸和阻滞氨基酰tRNA与核蛋白体的相应位点结合. 然而大多数革兰氏阴性杆菌对红霉素和克林霉素具有天然抗药性,因而反硝化细菌对其敏感性较低.
-
选取控制蛋白质合成的四环素(TCY)、红霉素(ERY)和控制DNA回旋酶的诺氟沙星(NOR)、氧氟沙星(OFL)、恩诺沙星(ENR)5种对反硝化细菌敏感性较强的抗菌药物进行联合药敏实验.
-
5种抗生素10个组合采用纸片扩散法进行联合药敏试验,组合后每种抗菌药物的抑菌圈直径及联合作用效果如表2所示. 本实验中共产生3种抑菌图形报告(图4).
纸片扩散法是将含有定量抗菌药物的滤纸片贴在已接种反硝化细菌的琼脂表面上,纸片中的药物在琼脂中扩散,在纸片的周围形成抑菌圈,纸片中药物含量越高抑菌圈直径越大,反之则越小. 由于试验规范(NCCLS)要求纸片扩散法中药敏纸片的药物含量应对反硝化细菌产生10—30 mm的抑圈直径,因此该方法受制于纸片的药物含量. 同时联合作用关系通过观察抑菌图形报告中抑菌圈交界关系确定复合抗生素的作用关系,而纸片药物含量相同的条件下抑菌圈交界关系因两药敏纸片间距离变化而发生变化,导致结果的不确定性.
-
根据5种抗生素微量肉汤稀释法MIC值,测定抗生素组合后FIC值,以此判断复合抗生素的联合抑菌效应. 5种抗生素两两联合后细菌培养板内反硝化细菌生长情况如图5所示.
-
分别用4种不同的解释方法解释图5中微量肉汤稀释法的棋盘测试结果,两种抗生素的联合作用效果如表3所示.
表4说明了用4种不同的方法解释抗生素联合的作用结果会以何种方式变化. 微量肉汤稀释法确定复合抗生素间的作用关系时,其作用结果高度依赖于解释方法[16]. 不仅如此,在文献报道中可能存在除本文4种解释方法之外其他的棋盘法结果解释方法,并且通常无法确定研究中所使用的解释方法. 同时,微量肉汤稀释法通过FIC指数对联合作用结果进行判定,该方法中对无关作用与拮抗作用范围的定义也存在不同. Huang等将1<FIC≤2时确定为无关作用,当FIC>2时确定为拮抗作用[21];Matsumura与Pillai等将1<FIC≤4时确定为无关作用,当FIC>4时确定为拮抗作用[14,23]. 因此,这可能是不同研究报道中抗生素相互作用关系结果不一致的原因.
通过对纸片扩散法与微量肉汤稀释法两种方法联合作用关系结果的比较,结果表明两种方法确定的联合作用结果存在较大差异,无法准确确定两种抗生素间的联合作用效果. 微量肉汤稀释法也存在浓度设定的局限性,无法确定水土环境中低浓度条件下抗生素复合的作用效果. 同时鉴于纸片扩散法与微量肉汤稀释法存在的问题,如何确定联合作用关系就显得非常重要.
微量肉汤稀释法棋盘中各孔代表了不同浓度条件下抗生素的复合,可能是由于单一抗生素存在高低浓度效应,同一抗生素在不同浓度下对反硝化细菌所产生的效果不同,导致在不同浓度含量水平下与另一种抗生素复合所产生的联合作用结果也不同.
Zou等选取以恩诺沙星(ENR)为代表的氟喹诺酮类(FQ),对以假单胞菌为主的反硝化细菌进行敏感性实验,NER存在高浓度效应(500 μg∙L−1至100 mg∙L−1)和低浓度效应(100 ng∙L−1至10 μg∙L−1),约100 μg∙L−1作为边界[24]. 微量肉汤稀释法培养板各孔代表不同浓度抗生素组合,因此通过部分抑制浓度指数(FICI)的平均值确定联合作用关系存在其不合理性.
-
通过酶标仪对图5中微量肉汤稀释法棋盘测试结果进行测定,分别获得96孔板各孔中反硝化细菌的OD值(Abs),通过比较各单一抗生素孔中OD值与各复合抗生素孔中OD值的差异确定两种抗生素的联合作用关系. 当ODA+B ≤ ODmin(A,B)时,两种抗生素复合表现为累加/协同作用;当ODmin(A,B) ≤ ODA+B ≤ ODmax(A,B)时,两种抗生素复合表现为无关作用;当ODA+B ≥ ODmax(A,B) 时,两种抗生素复合表现为拮抗作用. 不同浓度下抗生素的联合抑菌效果如图6所示.
-
选取图6微量肉汤稀释法结果中6种抗生素浓度组合,测定不同浓度不同时间间隔下单一与复合培养体系中反硝化细菌数量(图7). 通过S-Gompenz模型拟合反硝化菌生长曲线,获得最大生长量(Nm)、迟滞时间(λ)、最大生长速率(μm)等相关参数,确定复合抗生素的联合作用关系(表5). 结果表明该方法与优化后的微量肉汤稀释法结果具有良好的一致性,并能够准确区分协同与累加作用.
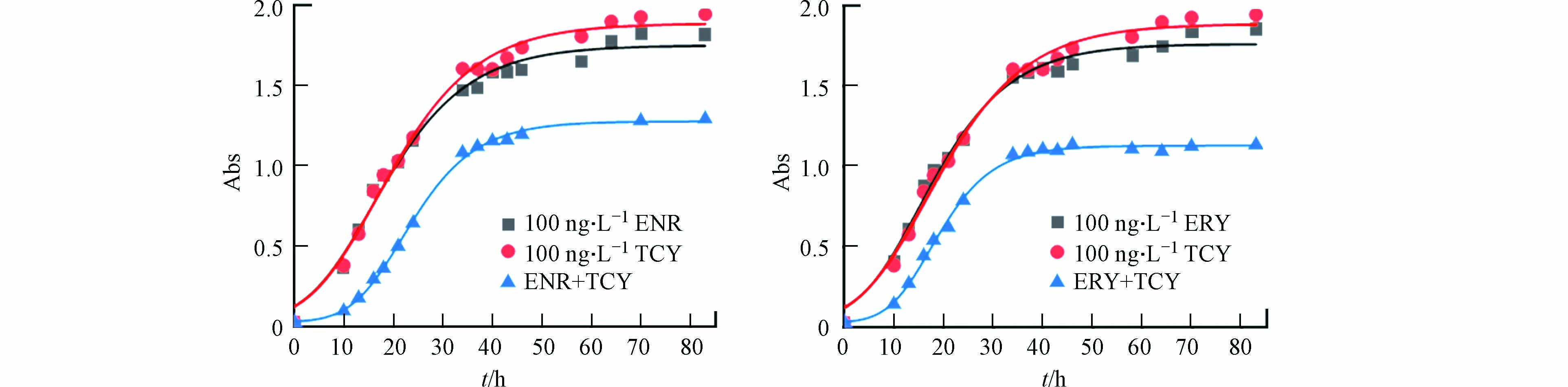
水土环境中抗生素的检出浓度一般在ng∙L−1—μg∙L−1的浓度含量水平,微量肉汤稀释法及纸片扩散法联合药敏实验的浓度含量水平为mg∙L−1,为探究地下水中抗生素浓度含量水平下抗生素组合的作用效果,将5种抗生素浓度设定为100 ng∙L−1,通过微生物量生长法在30 ℃条件下培养62 h测定单一与联合培养体系中反硝化细菌的生长量确定不同抗生素组合的作用关系. 未加抗生素的空白组OD值为1.515,实验组的Abs值及抗生素联合作用效果如表6所示.
比较单一与复合体系中最终反硝化细菌数量无法确定100 ng∙L−1 ENR+100 ng∙L−1 TCY浓度组合与100 ng∙L−1 ERY+100 ng∙L−1 TCY浓度组合的唯一作用关系,因而拟合细菌生长曲线,通过比较如表7所示的反硝化细菌基本生长特征参数,确定唯一的联合作用关系,图8表明,两种浓度组合下抗生素表现为协同作用.
微生物量测定法解决了联合药敏试验中纸片扩散法与微量肉汤稀释法两种方法存在的联合抑菌效果不唯一,以及两种方法同时存在的抗生素浓度设定局限性等问题,并且该方法与优化后的微量肉汤稀释法结果具有一致性. 微生物量法通过拟合微生物生长曲线更加直观且准确可靠的解释了复合抗生素的作用关系,因此,微生物量测定法可作为准确确定抗生素联合作用效果行之有效的方法.
联合药敏试验作为一种确定抗生素联合作用效果简单有效的手段,该方法可为水土环境条件下快速判定复合抗生素污染对反硝化作用影响提供一定的参考依据. 抗生素对反硝化细菌的作用机制较为复杂,并且反硝化作用也作为一个包括NO3−-NO2−-N2O-N2 的4个反应阶段且各阶段需要不同酶催化的复杂反应过程. 一种抗生素可能影响反硝化作用过程的几个环节,同一种类抗生素的对各环节的作用效果也会产生差别,并且同一抗生素在单一与联合作用下对细菌的作用机理及影响环节会有所不同. 因此,抗生素复合条件下对反硝化过程存在更为复杂的影响,可通过环境模拟条件下的硝酸盐降解实验进一步探讨抗生素对反硝化过程的影响机理,从而了解硝酸盐和抗生素的污染控制.
-
(1)通过纸片扩散法与微量肉汤稀释法从分别定性与定量角度测定以假单胞菌属为主要菌群的甘度反硝化菌对抗生素敏感性,两种方法测定结果具有一致性,敏感性大小为:ENR>CIP>OFL>TCY>ERY>SMX>CLI.
(2)联合药敏试验中纸片扩散法与微量肉汤稀释法联合作用结果分别受两药敏纸片间距离与解释方法及FIC计算标准的影响,导致抗生素联合作用结果的不唯一. 通过采用比较单一与复合抗生素各孔中微生物差异确定抗生素作用关系的方法对微量肉汤稀释法做出优化,解决了不同解释方法得出结果不一致的问题.
(3)通过微生物量测定法可以解决微量肉汤稀释法存在抗生素浓度设定的局限性问题,并且该方法通过拟合微生物生长曲线可以更加直观且准确可靠的解释复合抗生素的作用关系,因此,微生物量测定法可作为准确确定抗生素联合作用效果行之有效的方法.
抗生素联合对反硝化细菌作用效果的确定方法
Method for determining the effect of antibiotic combination on denitrifying bacteria
-
摘要: 抗生素在地下水环境中被频繁检出,其对硝酸盐降解的反硝化作用产生不同程度影响已被多项研究证实,多种不同功能的抗生素联合作用越来越受到关注. 本研究选取甘度反硝化细菌进行单一及联合药敏试验,探究了反硝化菌对喹诺酮类、四环素类、磺胺类、大环内酯类、林可霉素类抗生素的敏感性及抗生素的联合抑菌效果,对确定联合作用的方法进行了讨论. 结果表明,微量肉汤稀释法与纸片扩散法测得反硝化细菌对单一抗生素的敏感性具有一致性,敏感性大小主要与抗生素的种类有关. 在抗生素联合作用的试验中,纸片扩散法抑菌图形报告存在结果依赖于两圆盘之间的距离的问题,而微量肉汤稀释法存在结果解释方法及部分抑菌指数(FIC)标准不统一的问题. 以棋盘法的实验结果为基础,通过比较单一与复合抗生素各孔中微生物差异确定抗生素作用关系,优化了微量肉汤稀释法. 此外,进一步提出了微生物量测定法,解决了抗生素浓度设定的局限性问题. 新方法通过拟合微生物生长曲线,可以更直观、更准确地解释复合抗生素之间的关系. 本研究结果可为复合抗生素对水土环境中反硝化作用影响研究方法的选择和结果的确定提供参考.Abstract: Antibiotics are frequently detected in the groundwater environment, and their effects on the denitrification of nitrate degradation have been confirmed by a number of studies. The combined effect of antibiotics with different functions have been paid more and more attention. In this study, glycan denitrifying bacteria were selected for single and combined drug sensitivity tests, The sensitivities of denitrifying bacteria to quinolones, tetracycline, sulfonamides, macrolides and lincomycin antibiotics and the combined effects of antibiotics were investigated, and the method for determining the combined effect was discussed. The results showed that the sensitivities of denitrifying bacteria to a single antibiotic measured by the micro broth dilution method and the disc diffusion method were consistent, and the sensitivity was mainly related to the type of antibiotic. In determination of combined effects of antibiotics, the antibacterial graphic report of the disc diffusion method has the problem that the results were dependent distances between the two drug-sensitive discs, and the micro broth dilution method has the problem of inconsistence between result interpretation method and partial antibacterial index (FIC) standards. Based on the experimental results of the checkerboard method, the effects of antibiotics were determined by comparing the microbial differences in each hole of single and combined antibiotics and the micro broth dilution method was optimized. Furthermore, a microbial biomass determination method was proposed, which solved the limitation of antibiotic concentration setting. The new method can more intuitively and accurately explain the relationship of combined antibiotics by fitting the microbial growth curve. The findings obtained in this study can provide a reference for the selection of research methods and the determination of results for the impact of compound antibiotics on denitrification in the water and soil environment.
-

-
表 1 药敏纸片药物含量
Table 1. Drug content of drug-sensitive paper
抗菌药物
Antibacterial drugsERY TCY CLI SMX ENR OFL CIP 每片药物含量/μg 25 25 25 25 5 5 5 表 2 纸片扩散法联合药敏试验结果
Table 2. The results of the disk-diffusion method combined with the drug susceptibility test
组别
Group抗生素组合A+B
Antibiotic combination A+B联合效果
Combined effect药物A
Drug A抑菌圈直径/mm
Antimicrobial circle diameter药物B
Drug B抑菌圈直径/mm
Antimicrobial circle diameter1# CIP 20 ENR 24 拮抗作用 2# CIP 21 OFL 19 拮抗作用 3# ENR 24 TCY 16 拮抗作用 4# CIP 19 TCY 13 拮抗作用 5# ENR 25 OFL 18 拮抗作用 6# ENR 25 ERY 13 无关作用 7# CIP 22 ERY 11 无关作用 8# OFL 18 ERY 12 无关作用 9# OFL 21 TCY 18 无关作用 10# ERY 12 TCY 17 累加作用 表 3 不同解释方法之间复合抗生素作用结果的差异
Table 3. Difference in the results of combined antibiotic action between different explanatory methods
组别
Group药物A+B
Drug A+BMethod 1 Method 2 Method 3 Method 4 FIC 作用结果
Effect resultFIC 作用结果
Effect resultFIC 作用结果
Effect resultFIC 作用结果
Effect result1# CIP+ENR 2.8 拮抗作用 1.25 无关作用 8 拮抗作用 NA 累加/无关作用 2# CIP+OFL 2.8 拮抗作用 1.25 无关作用 8 拮抗作用 NA 拮抗作用 3# ENR+OFL 2.1 拮抗作用 1.25 无关作用 8 拮抗作用 NA 累加/无关作用 4# CIP+TCY 0.64 累加作用 0.38 协同作用 1 累加作用 NA 协同作用 5# ERY+TCY 0.79 累加作用 0.5 协同作用 1.5 无关作用 NA 协同作用 6# OFL+ERY 0.99 累加作用 0.5 协同作用 2 无关作用 NA 协同作用 7# ENR+ERY 1.45 无关作用 0.56 累加作用 4 拮抗作用 NA 累加/无关作用 8# CIP+ERY 0.95 无关作用 0.31 协同作用 3 无关作用 NA 协同作用 9# OFL+TCY 1.56 无关作用 0.75 累加作用 5 拮抗作用 NA 累加/无关作用 10# ENR+TCY 1.13 无关作用 0.38 协同作用 2.5 拮抗作用 NA 协同作用 表 4 纸片扩散法与微量肉汤稀释法联合药敏试验结果比较
Table 4. Comparison of drug sensitivity test results between disc diffusion method and broth dilution method
组别
Group药物A
Drug A药物B
Drug B纸片扩散法
disk-diffusion method微量肉汤稀释法 Microbroth dilution method 方法一
Method 1方法二
Method 2方法三
Method 3方法四
Method 41# CIP ENR 拮抗作用 拮抗作用 无关作用 拮抗作用 累加/无关作用 2# CIP OFL 拮抗作用 拮抗作用 无关作用 拮抗作用 拮抗作用 3# ENR OFL 拮抗作用 拮抗作用 无关作用 拮抗作用 累加/无关作用 4# CIP TCY 拮抗作用 累加作用 协同作用 累加作用 协同作用 5# ERY TCY 拮抗作用 累加作用 协同作用 无关作用 协同作用 6# OFL ERY 无关作用 累加作用 协同作用 无关作用 协同作用 7# ENR ERY 无关作用 无关作用 累加作用 拮抗作用 累加/无关作用 8# CIP ERY 无关作用 无关作用 协同作用 无关作用 协同作用 9# OFL TCY 无关作用 无关作用 累加作用 拮抗作用 累加/无关作用 10# ENR TCY 累加作用 无关作用 协同作用 拮抗作用 协同作用 表 5 生长曲线拟合相关参数
Table 5. Growth curve fitting related parameters
单一体系
Single systemNm λ μm 复合体系
Composite systemNm λ μm 相关作用
Related effects3.9063 μg∙L−1 ENR 1.6 4.27 0.352 3.9063 μg∙L−1 ENR+15.625 μg∙L−1 OFL 1.43 6.21 0.425 协同作用 7.8125 μg∙L−1 ENR 1.57 4.37 0.343 15.625 μg∙L−1 OFL+4 mg∙L−1 ERY 1.55 3.02 0.283 无关作用 15.625 μg∙L−1 OFL 1.6 4.39 0.355 7.8125 μg∙L−1 ENR+31.25 μg∙L−1 OFL 1.18 2.14 0.232 累加作用 31.25 μg∙L−1 OFL 1.33 4.88 0.318 3.90625 μg∙L−1 ENR+62.5 μg∙L−1 OFL 0.42 8.74 0.422 协同作用 62.5 μg∙L−1 OFL 0.94 7.58 0.375 7.8125 μg∙L−1 ENR+4 mg∙L−1 ERY 1.52 3.80 0.296 无关作用 4 mg∙L−1ERY 1.5 2.16 0.253 3.90625 μg∙L−1 ENR+4 mg∙L−1 ERY 1.47 2.00 0.251 累加作用 表 6 100 ng∙L−1抗生素浓度联合作用结果
Table 6. Results of combined action of 100 ng∙L−1 antibiotic concentration
组别
Group药物A/(Abs)
Drug A药物B/(Abs)
Drug BA+B/(Abs)
Drug A+B作用结果
Effect result1# CIP 1.595 ENR 1.514 1.545 无关作用 2# CIP 1.595 ERY 1.540 1.568 无关作用 3# ENR 1.514 OFL 1.568 1.553 无关作用 4# CIP 1.595 OFL 1.568 1.582 无关作用 5# OFL 1.568 ERY 1.540 1.542 无关作用 6# OFL 1.568 TCY 1.525 1.545 无关作用 7# ERY 1.540 TCY 1.525 1.415 累加作用 8# ENR 1.514 TCY 1.525 1.445 累加作用 9# CIP 1.595 TCY 1.525 1.779 拮抗作用 10# ENR 1.514 ERY 1.540 1.555 拮抗作用 表 7 生长曲线拟合相关参数
Table 7. Growth curve fitting related parameters
ENR TCY ERY ENR+TCY ERY+TCY Nm 1.751 1.888 1.763 1.279 1.13 λ −10.26 −10.17 −9.07 2.589 1.642 μm 0.141 0.136 0.151 0.171 0.198 -
[1] 邓璐, 何江涛, 邹华, 等. 洛美沙星对水中反硝化过程的影响模拟试验 [J]. 中国环境科学, 2020, 40(7): 2934-2942. doi: 10.3969/j.issn.1000-6923.2020.07.017 DENG L, HE J T, ZOU H, et al. Simulation experiments on effects of lomefloxacin on denitrification process in water [J]. China Environmental Science, 2020, 40(7): 2934-2942(in Chinese). doi: 10.3969/j.issn.1000-6923.2020.07.017
[2] 陈淋鹏, 黄福杨, 张冲, 等. 诺氟沙星对地下水中反硝化过程的影响: 反硝化酶活性的证据 [J]. 环境科学学报, 2020, 40(7): 2496-2501. CHEN L P, HUANG F Y, ZHANG C, et al. Effect of norfloxacin on denitrification process in groundwater: Evidence for denitrifying enzyme activity [J]. Acta Scientiae Circumstantiae, 2020, 40(7): 2496-2501(in Chinese).
[3] CHEN K, ZHOU J L. Occurrence and behavior of antibiotics in water and sediments from the Huangpu River, Shanghai, China [J]. Chemosphere, 2014, 95: 604-612. doi: 10.1016/j.chemosphere.2013.09.119 [4] LOOFT T, JOHNSON T A, ALLEN H K, et al. In-feed antibiotic effects on the swine intestinal microbiome [J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(5): 1691-1696. doi: 10.1073/pnas.1120238109 [5] YAN C X, YANG Y, ZHOU J L, et al. Antibiotics in the surface water of the Yangtze Estuary: Occurrence, distribution and risk assessment [J]. Environmental Pollution, 2013, 175: 22-29. doi: 10.1016/j.envpol.2012.12.008 [6] ZHAO H, ZHOU J L, ZHANG J. Tidal impact on the dynamic behavior of dissolved pharmaceuticals in the Yangtze Estuary, China [J]. Science of the Total Environment, 2015, 536: 946-954. doi: 10.1016/j.scitotenv.2015.06.055 [7] 倪语星, 王金良, 徐英春. 抗微生物药物敏感性试验规范[M]. 2版. 上海: 上海科学技术出版社, 2009: 18-37. NI Y X, WANG J L, XU Y C. Antimicrobial susceptibility testing good laboratory practices[M]. Shanghai: Shanghai Scientific & Technical Publishers, 2009: 18-37(in Chinese).
[8] 张玉叶, 何江涛, 张金刚, 等. 喹诺酮类典型抗生素对反硝化细菌的联合药敏试验研究 [J]. 环境科学学报, 2021, 41(2): 670-679. doi: 10.13671/j.hjkxxb.2020.0309 ZHANG Y Y, HE J T, ZHANG J G, et al. Combined susceptibility testing for denitrifying bacteria by typical quinolone antibiotics [J]. Acta Scientiae Circumstantiae, 2021, 41(2): 670-679(in Chinese). doi: 10.13671/j.hjkxxb.2020.0309
[9] Clinical and Laboratory Standards Institute. CLSI document M44-A. Method for antifungal disk diffusion susceptibility testing of yeasts; approved guideline. 2nd ed[S]. Wayne: Clinical and Laboratory Standards Institute; 2004. [10] Clinical and Laboratory Standards Institute. CLSI document M27-A3: Reference method for broth dilution antifungal susceptibility testing of yeasts; approved standard. 3rd ed[S]. Wayne: Clinical and Laboratory Standards Institute; 2008. [11] Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing[S]//TERTEL M L, CHRISTOPHER J P, PHUCAS A B(eds. ), Twenty-sixth informational supplement. CLSI document M100-S26. Wayne, PA, 2016: 52–59. [12] National Committee for Clinical Laboratory Standards. Reference method for broth dilution antifungal susceptibility testing of filamentous fungi[S]. Approved standard. Document M38-A. National Committee for Clinical Laboratory Standards, Wayne, Pa, 2008. [13] National Committee for Clinical Laboratory Standards. Reference method for broth dilution susceptibility testing of yeasts[S]. Approved Standard, 2nd ed. Document M27–A2. National Committee for Clinical Laboratory Standards, Wayne, Pa, 2002. [14] PILLAI S K, MOELLERING R C, Jr, ELIOPOULOS GM. Antimicrobial combinations//LORIAN V (ed), Antibiotics in Laboratory Medicine, 6th ed[M]. Lippincott Williams & Wilkins Co. , Philadelphia, PA, 2015. [15] LERER A L. Synergism testing: broth microdilution checkerboard and broth macrodilution methods[M]//Clinical Microbiology Procedures Handbook. Washington, DC, USA: ASM Press, 2016: 5.16. 1-5.16. 23. [16] BONAPACE C R, BOSSO J A, FRIEDRICH L V, et al. Comparison of methods of interpretation of checkerboard synergy testing [J]. Diagnostic Microbiology and Infectious Disease, 2002, 44(4): 363-366. doi: 10.1016/S0732-8893(02)00473-X [17] den HOLLANDER J G, MOUTON J W, VERBRUGH H A. Use of pharmacodynamic parameters to predict efficacy of combination therapy by using fractional inhibitory concentration kinetics [J]. Antimicrobial Agents and Chemotherapy, 1998, 42(4): 744-748. doi: 10.1128/AAC.42.4.744 [18] ELIOPOULOS G M. Synergism and antagonism [J]. Infectious Disease Clinics of North America, 1989, 3(3): 399-406. doi: 10.1016/S0891-5520(20)30277-4 [19] ANON. Synergism testing: broth microdilution checkerboard and broth macrodilution methods[M]//Clinical Microbiology Procedures Handbook. Washington, DC, USA: ASM Press, 2016: 5.16. 1-5.16. 23. [20] MARYMONT J H Jr, MARYMONT J. Laboratory evaluation of antibiotic combinations: A review of methods and problems [J]. Laboratory Medicine, 1981, 12(1): 47-55. doi: 10.1093/labmed/12.1.47 [21] HUANG Y Q, ZHOU Q, WANG W G, et al. Acinetobacter baumannii ventilator-associated pneumonia: Clinical efficacy of combined antimicrobial therapy and in vitro drug sensitivity test results [J]. Frontiers in Pharmacology, 2019, 10: 92. doi: 10.3389/fphar.2019.00092 [22] 冯建科, 王立新, 秦蓓蓓, 等. 烧伤科患者感染铜绿假单胞菌外排泵基因变异及耐药性分析 [J]. 中国病原生物学杂志, 2015, 10(8): 754-758. doi: 10.13350/j.cjpb.150820 FENG J K, WANG L X, QIN B B, et al. Study of efflux pump genes of Pseudomonas aeruginosa infecting patients in burn wards and analysis of the drug resistance of P. aeruginosa [J]. Journal of Pathogen Biology, 2015, 10(8): 754-758(in Chinese). doi: 10.13350/j.cjpb.150820
[23] MATSUMURA S O, LOUIE L, LOUIE M, et al. Synergy testing of vancomycin-resistant Enterococcus faecium against quinupristin-dalfopristin in combination with other antimicrobial agents [J]. Antimicrobial Agents and Chemotherapy, 1999, 43(11): 2776-2779. doi: 10.1128/AAC.43.11.2776 [24] ZOU H, HE J T, HE B N, et al. Sensitivity assessment of denitrifying bacteria against typical antibiotics in groundwater [J]. Environmental Science. Processes & Impacts, 2019, 21(9): 1570-1579. -



 下载:
下载: