-
作为一种典型的全氟化合物,全氟辛烷磺酸(PFOS)已被归类为一种新的持久性有机污染物[1-2]. PFOS具有很高的化学稳定性,不能被微生物和植物降解,因此对环境造成严重污染[3-5]. 到目前为止,已在水中检测到PFOS. 例如,从城市工厂和机场工业处理厂排放到美国旧金山湾的废水分别平均含有420 ng·L−1和560 ng·L−1 PFOS[6]. 在中国一家工厂的废水中发现了高浓度的PFOS[7],平均值达到1021 mg·L−1. 因此,去除PFOS并降低对水生环境的相关风险是一个重要的新兴话题.
人工湿地因其经济和能源成本低而被广泛用于废水处理. 人工湿地系统中污染物的去除主要基于基质吸附、拦截、植物吸收、富集和微生物降解. 人工湿地不仅可以去除重金属离子,还可以去除新出现的污染物[8-10]. 然而,人工湿地中全氟化合物(PFCs)的去除研究却很少. CHEN等[2]研究发现,中等规模的人工湿地对水体中全氟辛酸(PFOA)和PFOS的去除效率分别为77%—82%和90%—95%,其中植物萃取和土壤吸附是最重要的去除机制. YIN等[9]报告称,在芦苇床实验中,全氟烷基酸(PFAAs)的去除率最高可达42%—49%,这可能是由土壤和沉积物的吸附以及植物的吸收作用导致.
已有研究表明,人工湿地对单一的营养盐或PFOS污染的水体具有一定的修复效果[11-12],但关于其对于含有这些污染物复合污染水体的研究较少. 基于此,本研究以表面流人工湿地为对照,构建多级垂直流人工湿地,评估人工湿地对营养盐和PFOS复合污染水体的处理情况,并进一步探索两者在湿地水、土壤和植物中的分布和迁移,同时重点研究了PFOS对水体中总氮(TN)、氨氮(NH3-N)、总磷(TP)和化学需氧量(COD)的影响,以期为人工湿地在水体治理修复工程中的应用提供参考.
-
根据富营养化河道修复技术常用的植物类型,结合植物对全氟化合物富集作用的已有研究,选择风车草(Cyperus alternifolius)作为人工湿地种植植物进行研究. 植物购自江苏南京某花卉市场,实验中对所有植物进行5 d的预培养,以恢复植物的根系活性.
从未受污染的林地采集土壤样本,风干并取出残余枝叶后,在4°C下储存. 土壤特征为:pH值7.26;总氮,1.68 g·kg−1;TP为0.182 mg·kg−1.
实验用水为模拟生活污水,特性如表1所示,以1 µg·L−1、100 µg·L−1的PFOS浓度添加,以模拟营养盐和PFOS的复合污染水体.
-
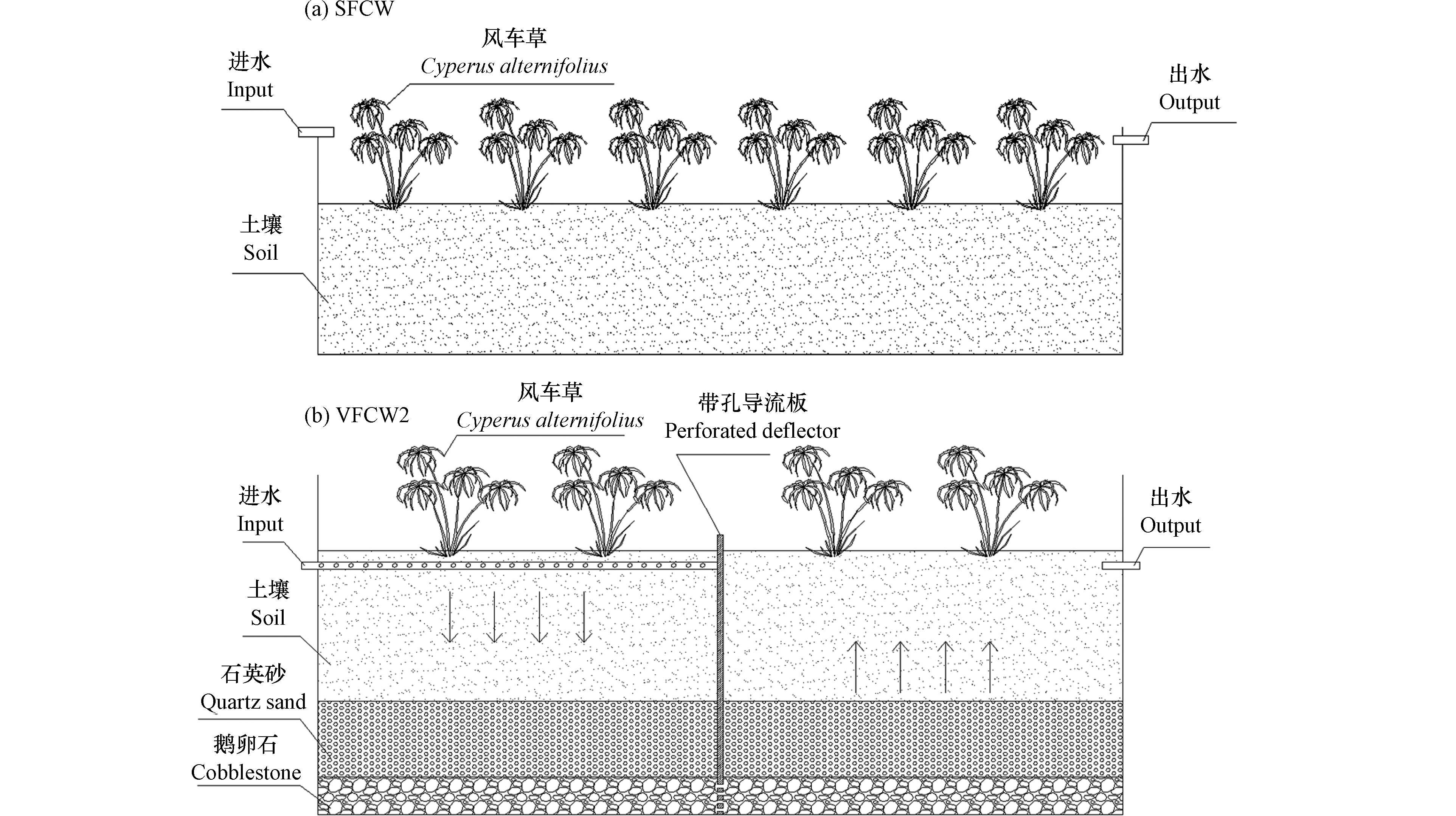
表面流人工湿地处理组(SFCW)、垂直流人工湿地处理组(VFCW1)和二级垂直流人工湿地处理组(VFCW2)均设置在露天试验场,3种湿地占地面积相同,剖面构造如图1所示. SFCW为120 cm(长)×40 cm(宽)×35 cm(高)的聚氯乙烯塑料槽,VFCW1为100 cm(长)×48 cm(宽)×45 cm(高)的聚氯乙烯塑料槽,VFCW2为在VFCW1中间部位沿宽边方向设置带孔导流板形成. SFCW底部基质由土壤(厚度:20 cm)填充,VFCW1、VFCW2从下到上由鹅卵石(粒径:8—32 mm;厚度:5 cm)、石英砂(粒径:2.8 mm;厚度:10 cm)和土壤(厚度:20 cm)填充;每个处理组实验开始时均种植16株长势一致的风车草,初始重量为(430±5) g. 在系统前部设置了1个调节池,以调蓄进出流量,保证进入系统的流量稳定. 3个处理组从10月到11月连续运行了40 d,运行期间天气基本晴朗,平均水温在9 ℃到20℃之间(白天和夜间). VFCW1为垂直下行的水流方式,VFCW2为垂直下行流+垂直上行的水流方式,进水模式为连续进水,停留时间为2 d,湿地运行42 d. 每个实验有3个重复,包括空白对照,空白对照为无PFOS的原水. 在实验期间,每3 天从进水和出水中收集水样,以确定人工湿地对氮磷及PFOS的去除效果. 实验结束后,采取植物和土壤样品,按照标准方法测定植物和土壤中污染物含量.
-
1)水样处理. 水样经过滤预处理后进行污染物浓度测定. 水体中氮磷的测定参照《水和废水监测分析方法(第4版)》[13],TN 质量浓度的测定用碱性过硫酸钾法,TP 质量浓度的测定用钼锑抗分光光度法,COD质量浓度的测定用重铬酸盐法,NH3-N质量浓度的测定用气相分子吸收光谱法.
水体中的PFOS测定采用HPLC(Dionex Ultimate 3000,USA)和API 3200三重四极杆串联质谱(AB Company,Canada)测定分析. 测定之前,所有样品均通过0.22 μm尼龙膜过滤器真空过滤,并超声10 min以消除水体中的气泡. MS/MS在电喷雾负电离和多反应监测模式下运行. 在最佳条件下,注入10 µL样品体积,使用HPLC BEH C18柱(3.0 mm×150 mm,3.5 µm,Waters,USA)以0.3 mL·min−1流速分离目标分析物;甲醇(A)和10 mmol·L-1的醋酸铵水溶液(B)作为流动相,流速0.3 mL·min−1;HPLC梯度洗脱起始状态为40% A和60% B,线性变化8min至90% A和10%B(保持4 min),然后立即恢复至40% A和60% B(保持3 min).
2)植物和土壤处理. 实验过程中,观察植物的生长情况,实验结束后测定植物生物量以及植物体内PFOS含量. 植物和土壤中PFOS的测定参照FELIZETER[14]的方法,用MTBE溶液提取出植物和土壤样品中的全氟烷基酸后氮吹浓缩,经过Florisil SPE柱进行萃取,用甲醇-MTBE溶液(体积比为30:70)洗脱,高纯氮吹之后经过ENVI-Carb净化再氮吹,最后经过滤膜过滤,收集样液上机测定待测物质.
采用excel 2003对数据进行处理、分析和图表绘制.
-
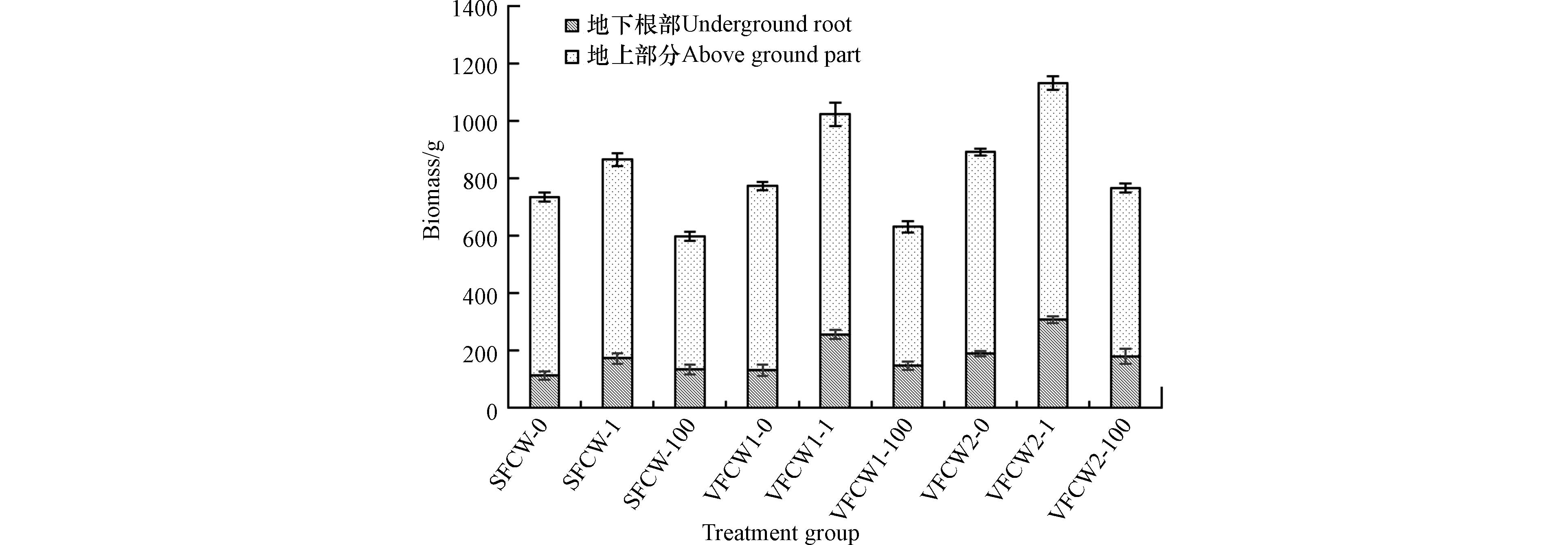
如图2所示,所有植物的生长量较实验开始前的(430±5) g均有所增加,表明该水体的污染程度在所选水生植物的耐受能力范围内. 随着PFOS浓度的增加,SFCW、VFCW1和VFCW2的风车草生物量均先增加后降低,表明高浓度的PFOS对植物的生长产生一定的抑制作用,而1 µg·L−1 PFOS 的处理促进了风车草的生长,这可能与PFOS作为一种表面活性剂,可以改变植物细胞膜的通透性,从而提高养分吸收有关,与范紫嫣[15]的研究结论相似. 表2给出了不同PFOS浓度下3种湿地植物的总生物量. 与对照SFCW相比,VFCW1和VFCW2风车草的总生物量在0、1、100 µg·L−1 PFOS浓度下分别增加了5.15%和21.30%、18.31%和30.75%、5.59%和28.26%,尤其是VFCW2在PFOS浓度为1 µg·L−1 时,风车草的总生物量达到了实验的最高值,为(1130.33±36.98) g,表明了不同的湿地构造影响着植物的生长,也影响着PFOS对植物的毒性效应,这与CHEN等关于污染物对植物生物量的影响因污染物类型、植物种类和湿地构造以及胁迫持续时间而异的结论一致[10]. VFCW2设定为垂直下行流+垂直上行的水流方式,含有PFOS的污水首先经过垂直下行段,通过土壤吸附沉淀和植物吸收作用,PFOS被大量吸附去除,流经上行段时,污水仍然先经过土壤,再一次吸附净化后抵达上行段的植物根系位置,此时PFOS浓度已降至很低,对植物生长影响大幅削弱,因此这也解释了VFCW2植物生物量均远远高于VFCW1和SFCW的原因.
-
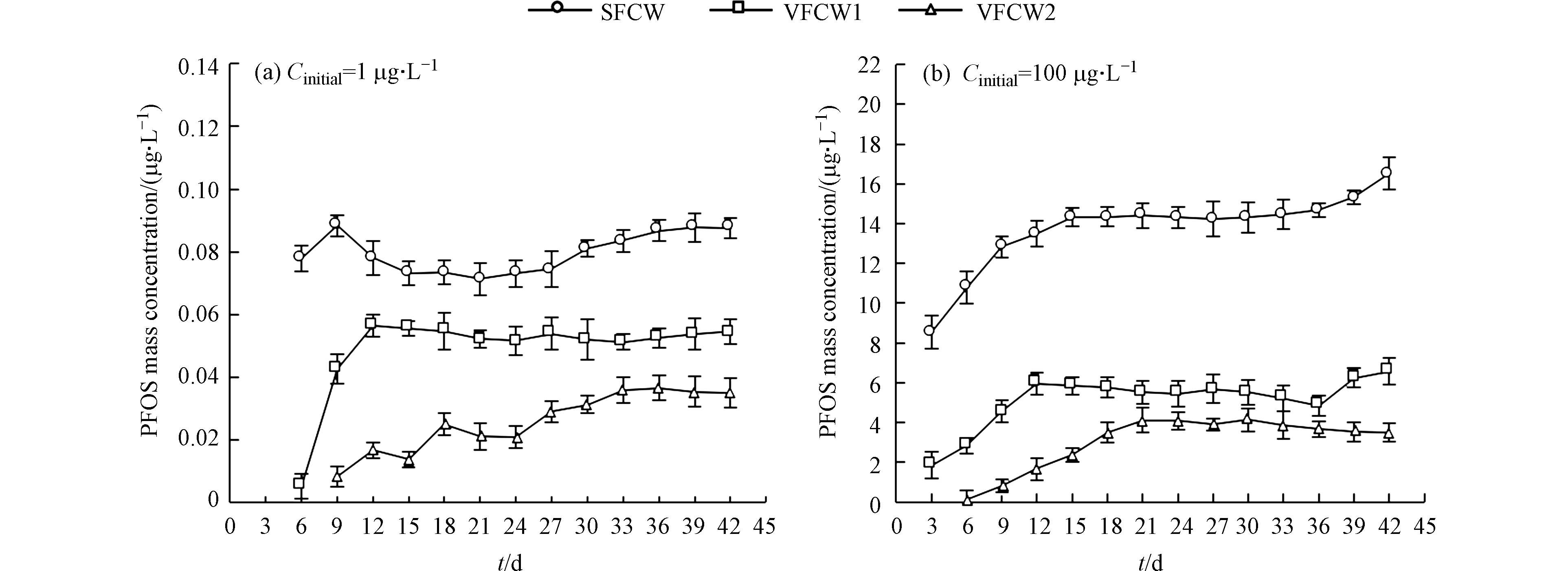
PFOS的去除效率和分布是通过测量系统中进水、出水、土壤和植物中PFOS的浓度来获得的. 实验过程中,各湿地处理组出水PFOS质量浓度变化如图3所示. 由图3(a)可知,由于PFOS浓度较低(1 µg·L−1),SFCW、VFCW1和VFCW2分别在实验第6 天、第6 天和第9 天的出水中检测到PFOS,截至实验结束,3种湿地水质处理效果保持稳定,去除效果:VFCW2>VFCW1>SFCW. 由图3(b)可知,SFCW和VFCW1在实验第3 d的出水中检测到PFOS,而VFCW2在实验第6 d才检测到,且随着处理时间的延长,SFCW和VFCW1出水PFOS质量浓度呈现先上升、趋于稳定后再上升的趋势,截至实验结束,VFCW2仍保持稳定出水. 当PFOS浓度较高时(100 µg·L−1)时,SFCW 、VFCW1和VFCW2对PFOS的去除率分别达到(83.47±4.68)%—(91.44±6.39)%、(93.42±7.51)%—(98.14±5.88)%、(95.87±6.72)%—(99.86±4.57)%,表明人工湿地可以有效去除废水中的PFOS,该结果与CHEN 等[2]的研究相似. 此外,当VFCW中PFOS的土壤吸收量和植物吸收量超过土壤和植物的最高负荷率时,出水废水中PFOS浓度的增加,PFOS的积累没有明显变化.
-
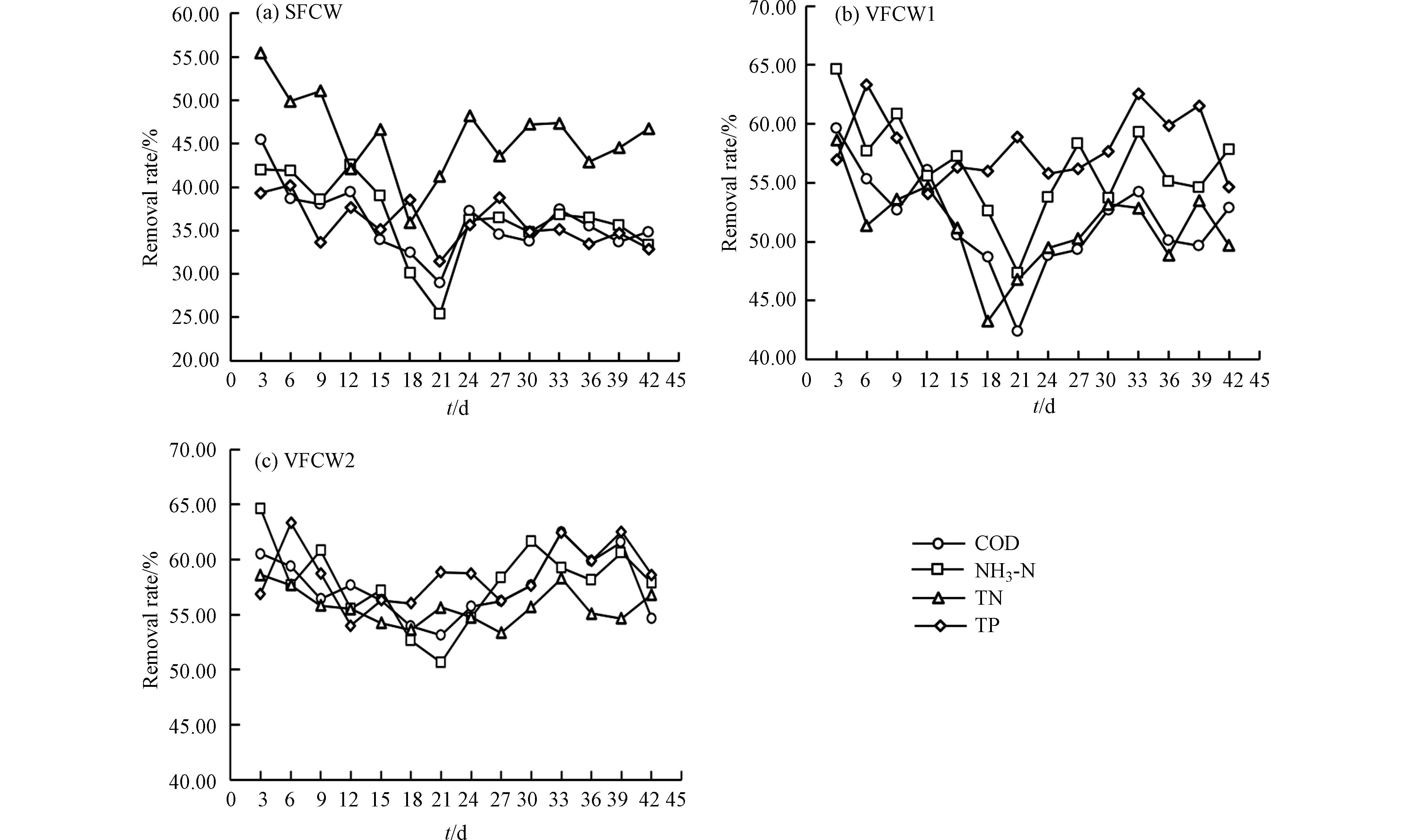
由图4可知,在实验开始时的前21 d,植物的根系处于生长阶段,根系尚未完全发育,没有供大量微生物生长和附着的能力,同时PFOS的毒性效应[16-17],生长缓慢,因此湿地运行不稳定,水处理效果基本呈下降趋势,21 d之后植物生长成熟,出水水质波动范围逐渐减小.
由表3可以看出,在加入PFOS后,湿地出水水质受到一定程度的影响,湿地稳定运行后营养盐去除效果:VFCW2>VFCW1>SFCW. 当PFOS浓度为100 µg·L−1时,3种湿地处理组对COD、NH3-N、TN和TP的去除均受到抑制,尤其是TN的去除率大幅下降,这表明高浓度(100 µg·L−1) PFOS对微生物活性和群落结构尤其是反硝化细菌形成了较强的毒性. 该研究成果与Bao等[18]研究结果一致,PFOS含量较高会对细菌的丰度和多样性产生负面影响. 然而,当PFOS浓度为1 µg·L−1时,3种湿地处理组对COD、TN的去除均受到抑制,而VFCW1和VFCW2的NH3-N去除率不降反增,分别达到60%—65%和68%—72%,远远超过未加入PFOS时的NH3-N去除率,这表明低浓度(1 µg·L−1)PFOS对垂直流湿地性能并没有产生抑制,反而低浓度的PFOS对土壤细菌群落尤其是硝化细菌产生了积极的影响,完全抵消了原本的毒性作用[19- 20]. 此时,SFCW的NH3-N去除率只有37%—42%,低于未加入PFOS时的41%—45%,这可能与湿地构造有关,表面流湿地植物和根际微生物直接与PFOS接触,受到的生物毒性强,而垂直流湿地经过土壤和基质吸附大量PFOS后植物和根际微生物受到的生物毒性大大减弱.
本研究中,SFCW中磷的去除效率较低,且受PFOS的影响较大,而VFCW1和 VFCW2中磷的去除受PFOS的影响较小,在PFOS浓度为100 µg·L−1时,VFCW2的TP去除率仍可达到57%—63%,优于VFCW1的56%—60%和SFCW的30%—34%. 人工湿地对磷的去除包括植物吸收、基质吸附沉淀和微生物同化及聚磷菌的过量摄磷作用等[21-22],其中基质吸附沉淀作用是去除磷素最主要的途径,贡献率高达70%—87%. 相比于SFCW单纯使用土壤作为基质的构造,VFCW1和VFCW2从下到上由鹅卵石、石英砂和土壤填充构成,鹅软石和石英砂对磷具有较好的吸附效果. 同时,VFCW2为垂直下行流+垂直上行的水流方式,污水经过好氧-厌氧-好氧等多重反应[23],满足聚磷菌工作要求,磷去除效果得到进一步强化.
-
人工湿地土壤和植物中的PFOS含量如表4所示. 人工湿地整个运行过程主要在中性pH范围内,PFOS在水溶液中带负电,这使得吸附到带负电荷的土壤变得困难[24]. 湿地中的碳含量、基质表面的表面积和官能团等[25]影响着PFOS的去向,因此湿地的构造形式便是关键. 在同等PFOS浓度下,VFCW2土壤PFOS含量最高,VFCW1次之,SFCW最差,当PFOS浓度为100 µg·L−1时,VFCW2、VFCW1土壤PFOS含量分别为(2.53±0.11) µg·g−1和(2.47±0.10) µg·g−1,比SFCW高出0.68 µg·L−1和0.62 µg·L−1. 然而,此时的SFCW植物PFOS含量达到了(181.93±8.28) µg·g−1,是VFCW1的3.03倍,VFCW2的2.39倍,表明其生理活动受到了高浓度PFOS胁迫影响,细胞的结构和功能遭到破坏,蛋白质和糖的合成受到抑制,因此其植物总生物量在所有处理组中最低(见表2),这与QIAO[26]等研究结果一致. 在本研究中,PFOS先在土壤中积累,风车草通过根部从土壤中吸收PFOS,在这传质过程许多因素会影响PFOS在植物中的积累,例如植物根系密度及其表面积[27],而植物根系对长链PFOS有很强的吸附能力,加上植物卡式带的阻力,PFOS便主要累积在植物根系中[28],而SFCW主要依靠植物去除水体中的PFOS,这也是导致SFCW植物PFOS含量很高的原因.
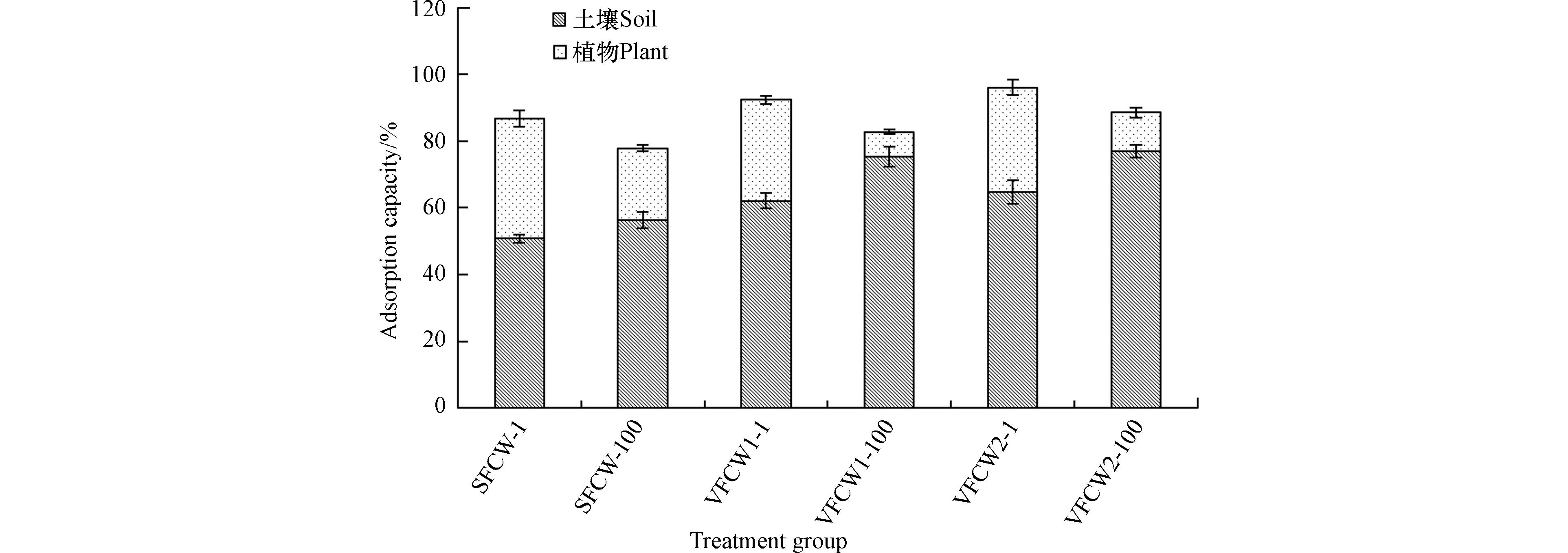
人工湿地土壤和植物对PFOS的吸附总量占比如图5所示. 运行42 d后,随着PFOS浓度的增加,土壤PFOS吸附占比增加,植物PFOS吸附占比降低,但最终的出水PFOS比例增加,这可能与土壤对PFOS的吸附是一个物理过程,比植物吸收快有关[9]. SFCW、VFCW1和VFCW2土壤PFOS吸附占比分别为(50.86±1.23)%—(56.32±2.35)%、(62.13±2.23)%—(75.28±3.01)%和(64.71±3.56)%—(76.96±1.98)%,均高于植物PFOS吸收占比(7.51±0.66)%—(35.84±2.36)%,说明土壤对PFOS的总吸收量远高于植物的吸收量,土壤和植物对PFOS的吸收总量占比(77.88±4.01)%—(96.09±6.33)%,也说明了土壤吸附和植物吸收是人工湿地去除PFOS的主要途径,这与QIAO等[26]的研究结论一致. 由于PFOS不能通过挥发、光解、水解、生物降解和植物降解等途径有效去除[4],人工湿地中PFOS的去除取决于土壤吸附和植物吸收,且土壤吸附和植物吸收之间的显着差异与植物中的高有机物含量有关,这与Chen等[2]的观点一致.
-
(1)在营养盐和PFOS复合污染水体中,高浓度(100 µg·L−1)PFOS抑制风车草生长,SFCW植物PFOS含量达到实验最高值,为(181.93±8.28) µg·g−1;低浓度(1 µg·L−1)PFOS促进了风车草的生长,VFCW2植物总生物量达到实验最高值,为(1130.33±36.98) g.
(2)三种人工湿地对营养盐和PFOS的去除效果有所差异,其中VFCW2对营养盐和PFOS的去除表现最优,在高浓度(100 µg·L−1)PFOS下,PFOS去除率仍然可达95.87%—99.86%;低浓度(1 µg·L−1)PFOS强化了VFCW1和VFCW2对NH3-N的去除,去除率分别为60%—65%和68%—72%.
(3)PFOS的去除主要取决于人工湿地的土壤吸附和植物吸收,SFCW、VFCW1和VFCW2土壤PFOS吸附占比分别为(50.86±1.23)%—(56.32±2.35)%、(62.13±2.23)%—(75.28±3.01)%和(64.71±3.56)%—(76.96±1.98)%,均高于植物PFOS吸收占比(7.51±0.66)%—(35.84±2.36)%.
多级人工湿地对复合污染水体中营养盐和PFOS的去除
Removal effect of nutrient salts and perfluoroalkyl acids in compound contaminated water by multi-stage constructed wetland
-
摘要: 选取表面流人工湿地和垂直潜流人工湿地为研究对象,通过露天实验研究了不同湿地类型对复合污染水体中营养盐和PFOS的去除效果. 结果表明,3种湿地对复合污染水体中营养盐和PFOS均具有较好的去除能力,且不同湿地类型对各污染物的去除效果有所差异. 高浓度(100 μg·L−1)PFOS抑制风车草生长,SFCW植物PFOS含量达到的实验最高值,为(181.93±8.28) μg·g−1;低浓度(1 μg·L−1)PFOS促进了风车草的生长,VFCW2植物总生物量达到的实验最高值,为(1130.33±36.98) g;VFCW2对营养盐和PFOS的去除表现最优,在高浓度(100 μg·L−1)PFOS下,PFOS去除率仍然可达95.87%—99.86%;低浓度(1 μg·L−1)PFOS强化了VFCW1和VFCW2对NH3-N的去除,去除率分别为60%—65%和68%—72%. PFOS的去除主要取决于人工湿地的土壤吸附和植物吸收,SFCW、VFCW1和VFCW2土壤PFOS吸附占比分别为(50.86±1.23)%—(56.32±2.35)%、(62.13±2.23)%—(75.28±3.01)%和(64.71±3.56)%—(76.96±1.98)%,均高于植物PFOS吸收占比(7.51±0.66)%—(35.84±2.36)%.Abstract: The study selected the surface flow constructed wetland and vertical subsurface flow constructed wetland as research object. Removal effects of different wetland types on nutrients and PFOS in compound polluted water were studied through open-air experiments. The results show that the three wetlands have good removal capacity of nutrients and PFOS in compound polluted water, and the removal effects of different wetland types were different. High concentration (100 μg·L−1) PFOS inhibited the growth of windmill grass, and the PFOS content of SFCW plants reached the highest in the experiment, which was (181.93±8.28) μg·g−1. Low concentration (1 μg·L−1) PFOS promoted the growth of windmill grass, and the total biomass of VFCW2 reached the highest in the experiment, which was (1130.33±36.98) g. VFCW2 was the best in the removal of nutrients and PFOS. Under high concentration (100 μg·L−1) PFOS, the removal rate of PFOS could still reach 95.87%—99.86%. Low concentration (1 μg·L−1) PFOS enhanced the removal of NH3-N by VFCW1 and VFCW2, with removal rates of 60%—65% and 68%—72% respectively. The removal of PFOS mainly depended on the soil adsorption and plant absorption of constructed wetland. The proportion of soil PFOS adsorption of SFCW, VFCW1 and VFCW2 was (50.86±1.23)%—(56.32±2.35)%, (62.13±2.23)%—(75.28±3.01)% and (64.71±3.56)%—(76.96±1.98)%, which were higher than that of plant PFOS absorption (7.51±0.66)%—(35.84±2.36)%.
-
Key words:
- constructed wetland /
- compound contaminated water /
- nutrients salts /
- PFOS
-

-
表 1 模拟生活污水特性
Table 1. Characteristics of simulated domestic sewage
pH COD/(mg·L−1) TN/(mg·L−1) TP/(mg·L−1) NH3-N/(mg·L−1) 浓度
Concentration6.88±0.31 175.22±10.68 36.42±1.68 9.31±0.56 20.41±1.79 表 2 不同PFOS浓度下湿地植物的总生物量
Table 2. Total biomass of wetland plants under different PFOS concentrations
PFOS /(µg·L−1) SFCW/g VFCW1/g VFCW2/g 0 734.90±23.64 772.81±15.47 891.41±32.43 1 864.51±30.98 1022.76±31.84 1130.33±36.98 100 597.25±18.56 630.63±25.43 766.04±25.11 表 3 不同湿地处理组出水稳定后营养盐的去除率
Table 3. Removal rate of nutrients concentration in different wetland treatment groups
PFOS /(µg·L−1) COD/% NH3-N/% TN/% TP/% SFCW 0 37—41 41—45 51—56 34—38 1 36—40 37—42 48—53 32—35 100 33—37 33—36 43—47 30—34 VFCW1 0 58—64 50—54 68—72 58—62 1 56—60 60—65 51—55 57—61 100 48—53 53—58 49—53 56—60 VFCW2 0 62—68 58—64 70—76 61—65 1 59—64 68—72 55—59 58—62 100 55—60 55—60 54—57 57—63 表 4 实验运行结束后土壤和植物中的PFOS平均含量
Table 4. Average content and of PFOS in soil and plants after the experiment
处理组
Processing groupPFOS浓度/(µg·L−1)
PFOS concentration土壤含量/(µg·g−1)
Content in soil植物含量/(µg·g−1)
Content in plantSFCW 1 0.017±0.003 2.09±0.06 100 1.85±0.07 181.93±8.28 VFCW1 1 0.021±0.002 1.49±0.04 100 2.47±0.10 60.02±1.25 VFCW2 1 0.022±0.001 1.40±0.05 100 2.53±0.11 76.06±2.36 -
[1] YIN T R, TE S H, REINHARD M, et al. Biotransformation of Sulfluramid (N-ethyl perfluorooctane sulfonamide) and dynamics of associated rhizospheric microbial community in microcosms of wetland plants [J]. Chemosphere, 2018, 211: 379-389. doi: 10.1016/j.chemosphere.2018.07.157 [2] CHEN Y C, LO S L, LEE Y C. Distribution and fate of perfluorinated compounds (PFCs) in a pilot constructed wetland [J]. Desalination and Water Treatment, 2012, 37(1/2/3): 178-184. [3] LI R, TANG T H, QIAO W C, et al. Toxic effect of perfluorooctane sulfonate on plants in vertical-flow constructed wetlands [J]. Journal of Environmental Sciences, 2020, 92: 176-186. doi: 10.1016/j.jes.2020.02.018 [4] WANG P, ZHANG M, LU Y L, et al. Removal of perfluoalkyl acids (PFAAs) through fluorochemical industrial and domestic wastewater treatment plants and bioaccumulation in aquatic plants in river and artificial wetland [J]. Environment International, 2019, 129: 76-85. doi: 10.1016/j.envint.2019.04.072 [5] LI X Q, HUA Z L, WU J Y, et al. Removal of perfluoroalkyl acids (PFAAs) in constructed wetlands: Considerable contributions of submerged macrophytes and the microbial community [J]. Water Research, 2021, 197: 117080. doi: 10.1016/j.watres.2021.117080 [6] HOUTZ E F, SUTTON R, PARK J S, et al. Poly- and perfluoroalkyl substances in wastewater: Significance of unknown precursors, manufacturing shifts, and likely AFFF impacts [J]. Water Research, 2016, 95: 142-149. doi: 10.1016/j.watres.2016.02.055 [7] WANG Y W, FU J J, WANG T, et al. Distribution of perfluorooctane sulfonate and other perfluorochemicals in the ambient environment around a manufacturing facility in China [J]. Environmental Science & Technology, 2010, 44(21): 8062-8067. [8] ZHANG D Q, LI X, WANG M, et al. Occurrence and distribution of poly-and perfluoroalkyl substances (PFASs) in a surface flow constructed wetland [J]. Ecological Engineering, 2021, 169: 106291. doi: 10.1016/j.ecoleng.2021.106291 [9] YIN T R, CHEN H T, REINHARD M, et al. Perfluoroalkyl and polyfluoroalkyl substances removal in a full-scale tropical constructed wetland system treating landfill leachate [J]. Water Research, 2017, 125: 418-426. doi: 10.1016/j.watres.2017.08.071 [10] CHEN Z A, REN G B, MA X D, et al. Perfluoroalkyl substances in the Lingang hybrid constructed wetland, Tianjin, China: Occurrence, distribution characteristics, and ecological risks [J]. Environmental Science and Pollution Research International, 2020, 27(31): 38580-38590. doi: 10.1007/s11356-020-09921-8 [11] 王皓, 钱琪卉, 丁瑞睿, 等. 电解强化人工湿地对农村生活污水中氮磷的去除性能 [J]. 环境工程学报, 2021, 15(3): 1006-1015. doi: 10.12030/j.cjee.202005147 WANG H, QIAN Q H, DING R R, et al. Performance of electrolysis enhanced constructed wetland system on nitrogen and phosphorus removal of rural domestic sewage [J]. Chinese Journal of Environmental Engineering, 2021, 15(3): 1006-1015(in Chinese). doi: 10.12030/j.cjee.202005147
[12] 郭鹤方, 甄志磊, 赵林婷, 等. 潮汐流-潜流人工湿地对城市污染水体中氮的去除 [J]. 环境化学, 2021, 40(12): 3887-3897. doi: 10.7524/j.issn.0254-6108.2021053002 GUO H F, ZHEN Z L, ZHAO L T, et al. Research on the removal effect of tidal flow–subsurface flow constructed wetland on nitrogen in urban polluted water [J]. Environmental Chemistry, 2021, 40(12): 3887-3897(in Chinese). doi: 10.7524/j.issn.0254-6108.2021053002
[13] 魏复盛主编. 国家环境保护总局, 水和废水监测分析方法编委会编. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002. State Environmental Protection Administration. Monitoring and analysis methods of water and wastewater (Fourth Edition) [M]. Beijing: China Environment Science Press, 2002(in Chinese).
[14] FELIZETER S, MCLACHLAN M S, de VOOGT P. Uptake of perfluorinated alkyl acids by hydroponically grown lettuce (Lactuca sativa) [J]. Environmental Science & Technology, 2012, 46(21): 11735-11743. [15] 范紫嫣. PFASs-Cd复合污染对土壤—植物系统的生态效应研究[D]. 大连: 大连理工大学, 2017. FAN Z Y. Interaction effects on uptake and toxicity of perfluoroalkyl substances and cadmium in wheat (Triticum aestivum L. )and rapeseed (Brassica campestris L. ) from co-contaminated soil[D]. Dalian: Dalian University of Technology, 2017(in Chinese).
[16] 李鹏扬. 水中全氟辛烷羧酸和全氟辛烷磺酸的植物毒性机制研究[D]. 北京: 北京交通大学, 2021. LI P Y. Characteristics of phytotoxicity induced by perfluorooctanoic acid and perfluorooctane sulfonate in water[D]. Beijing: Beijing Jiaotong University, 2021(in Chinese).
[17] 秦莉, 安毅, 韩建华, 等. PFOS对小油菜生长发育的毒性效应及机制 [J]. 农业环境科学学报, 2017, 36(12): 2401-2406. doi: 10.11654/jaes.2017-0705 QIN L, AN Y, HAN J H, et al. Toxic effects and mechanisms of PFOS on the growth of rape(Brassica campestris L. ) [J]. Journal of Agro-Environment Science, 2017, 36(12): 2401-2406(in Chinese). doi: 10.11654/jaes.2017-0705
[18] BAO Y X, LI B X, XIE S G, et al. Vertical profiles of microbial communities in perfluoroalkyl substance-contaminated soils [J]. Annals of Microbiology, 2018, 68(6): 399-408. doi: 10.1007/s13213-018-1346-y [19] 唐琳钦, 宿程远, 黄娴, 等. PFOA与PFOS对厌氧氨氧化污泥特性和微生物群落的影响 [J]. 中国环境科学, 2022, 42(1): 194-202. doi: 10.3969/j.issn.1000-6923.2022.01.021 TANG L Q, SU C Y, HUANG X, et al. Evaluation of sludge characteristics and microbial community of anammox sludge during exposure to perfluorooctane acid and perfluorooctane sulfonate [J]. China Environmental Science, 2022, 42(1): 194-202(in Chinese). doi: 10.3969/j.issn.1000-6923.2022.01.021
[20] 梁欢欢, 吴明红, 徐刚, 等. PFCs在水和底泥中的分布、毒性和去除 [J]. 上海大学学报(自然科学版), 2017, 23(5): 752-761. LIANG H H, WU M H, XU G, et al. Distribution of PFCs in water and sediment, and toxicity and removal [J]. Journal of Shanghai University (Natural Science Edition), 2017, 23(5): 752-761(in Chinese).
[21] 张弘弢, 谌书, 王彬, 等. 组合式人工湿地对分散型生活污水净化效果及其微生物群落结构特征 [J]. 环境化学, 2019, 38(11): 2535-2545. doi: 10.1002/etc.4547 ZHANG H T, CHEN S, WANG B, et al. Purification effect of combined artificial wetlands on dispersed domestic sewage and analysis of microbial community structure [J]. Environmental Chemistry, 2019, 38(11): 2535-2545(in Chinese). doi: 10.1002/etc.4547
[22] 刘莹, 刘晓晖, 张亚茹, 等. 三种人工湿地填料对低浓度氨氮废水的吸附特性 [J]. 环境化学, 2018, 37(5): 1118-1127. LIU Y, LIU X H, ZHANG Y R, et al. Adsorption properties of low concentration ammonia nitrogen wastewater by three constructed wetland fillers [J]. Environmental Chemistry, 2018, 37(5): 1118-1127(in Chinese).
[23] 崔海, 杨珊珊, 余鑫磊, 等. AAO-人工湿地耦合模型的建立及优化调控研究[J]. 给水排水, 2020, 56(S2): 80-87. CUI H, YANG S S, YU X L, et al. Study on development and optimization of AAO wastewater treatment and constructed wetland coupling model[J]. Water & Wastewater Engineering, 2020, 56(Sup 2): 80-87(in Chinese).
[24] JOHNSON R L, ANSCHUTZ A J, SMOLEN J M, et al. The adsorption of perfluorooctane sulfonate onto sand, clay, and iron oxide surfaces [J]. Journal of Chemical & Engineering Data, 2007, 52(4): 1165-1170. [25] ENEVOLDSEN R, JUHLER R K. Perfluorinated compounds (PFCs) in groundwater and aqueous soil extracts: Using inline SPE-LC-MS/MS for screening and sorption characterisation of perfluorooctane sulphonate and related compounds [J]. Analytical and Bioanalytical Chemistry, 2010, 398(3): 1161-1172. doi: 10.1007/s00216-010-4066-0 [26] QIAO W C, LI R, TANG T H, et al. Removal, distribution and plant uptake of perfluorooctane sulfonate (PFOS) in a simulated constructed wetland system [J]. Frontiers of Environmental Science & Engineering, 2020, 15(2): 1-11. [27] WEN B, WU Y L, ZHANG H N, et al. The roles of protein and lipid in the accumulation and distribution of perfluorooctane sulfonate (PFOS) and perfluorooctanoate (PFOA) in plants grown in biosolids-amended soils [J]. Environmental Pollution, 2016, 216: 682-688. doi: 10.1016/j.envpol.2016.06.032 [28] FELIZETER S T, VOOGT P D. Uptake of perfluorinated alkyl acids by hydroponically grown lettuce (Latuca sativa) and tomato (Solanum lycopersicum) [J]. Environmental Science & Technology, 2011, 46(21): 11735-11743. -



 下载:
下载: