-
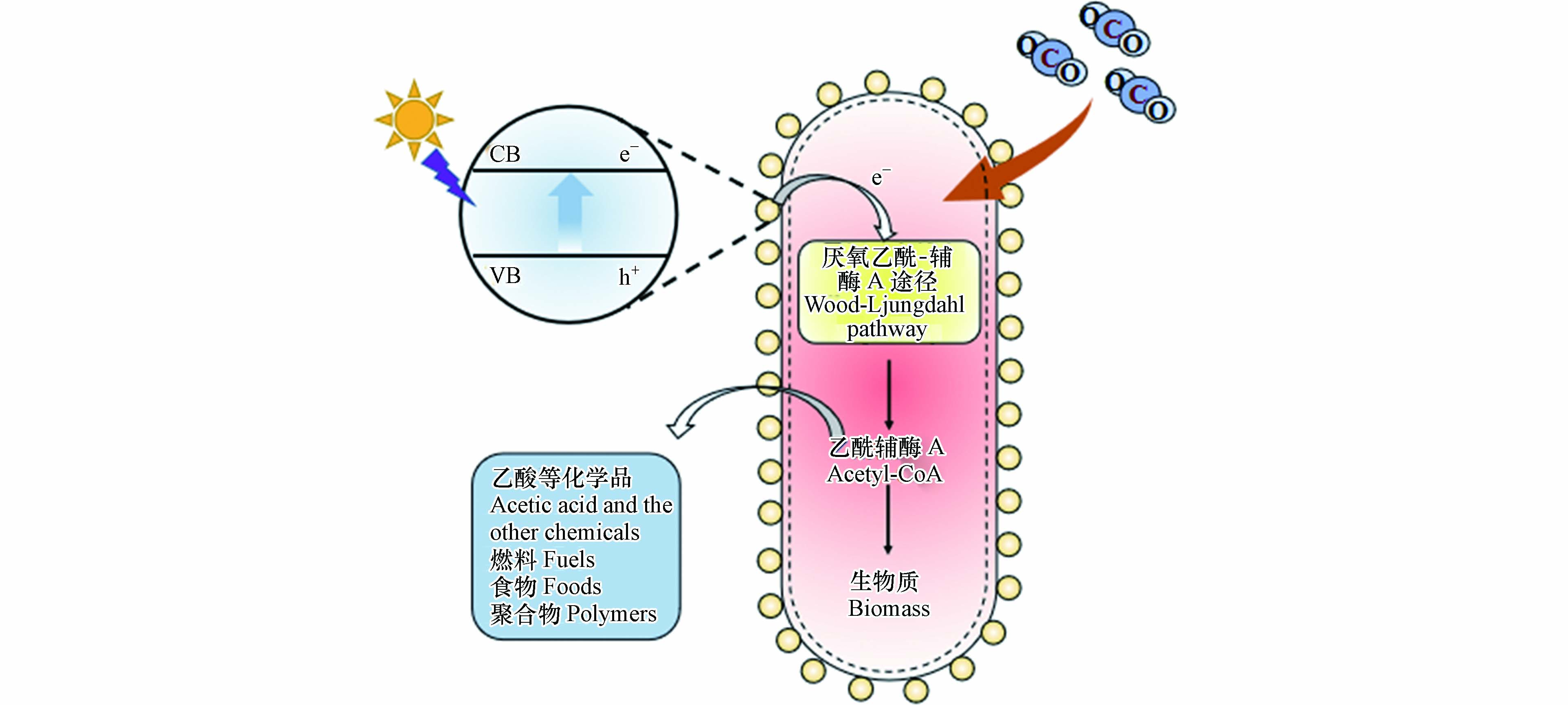
温室气体CO2的大量排放导致全球气候变化,成为人类面临的重大挑战. 应对该挑战,我国做出了2030年“碳达峰”、2060年“碳中和”的郑重承诺和战略部署. 碳捕集、利用与封存技术(CCUS)是我国实现双碳目标的关键性技术之一[1],预计到2050年CCUS技术可减排11—27亿t CO2[2]. 因其环境友好和节约能源的特征,光催化CO2还原技术成为新兴CCUS技术. 光催化CO2还原技术利用太阳能和光催化剂在常温常压下将CO2转化成高附加值化学制品或燃料. 在CO2还原反应过程中,光催化剂受光激发产生光生电子-空穴,电子迁移至光催化剂表面,与吸附CO2发生还原反应,将其还原为CO、CH4、CH3OH等高能量密度的燃料[3-7]. 光催化剂是光催化CO2还原技术的核心,其活性决定CO2利用的性能及应用潜力.
近年来,通过添加助催化剂、元素掺杂、构建异质结等改性方法[8-10],光催化剂的催化效果有所提高. 但因光生电子-空穴易复合、主要生成C1产物等问题,其催化效率及选择性尚不满足实际需求[11]. 光催化剂也存在制备成本较高、人工合成经济性差等应用瓶颈. 相对而言,通过卡尔文循环、厌氧乙酰-辅酶A(Wood-Ljungdahl)等固碳途径,自然界部分自养微生物可以将CO2转化为C2及C2+等多碳产物,并具有自我复制及修复等独特优势. 由于微生物将固碳作用优先用于光合生长,而非合成代谢产物,其碳合成转化较低[12]. 构建光催化剂-微生物杂化体系有望突破传统光催化剂高成本、低选择性和天然固碳途径低转化效率等瓶颈,实现太阳能捕获、催化反应活性和选择性方面优势互补[13]. 在光催化剂-微生物杂化体系中,光激发半导体产生电子,电子被微生物膜上的转运蛋白转运到细胞内部[14],为天然固碳途径提供充足的还原力[15],从而利用CO2和太阳光生产高价值燃料和化学品,如图1所示.
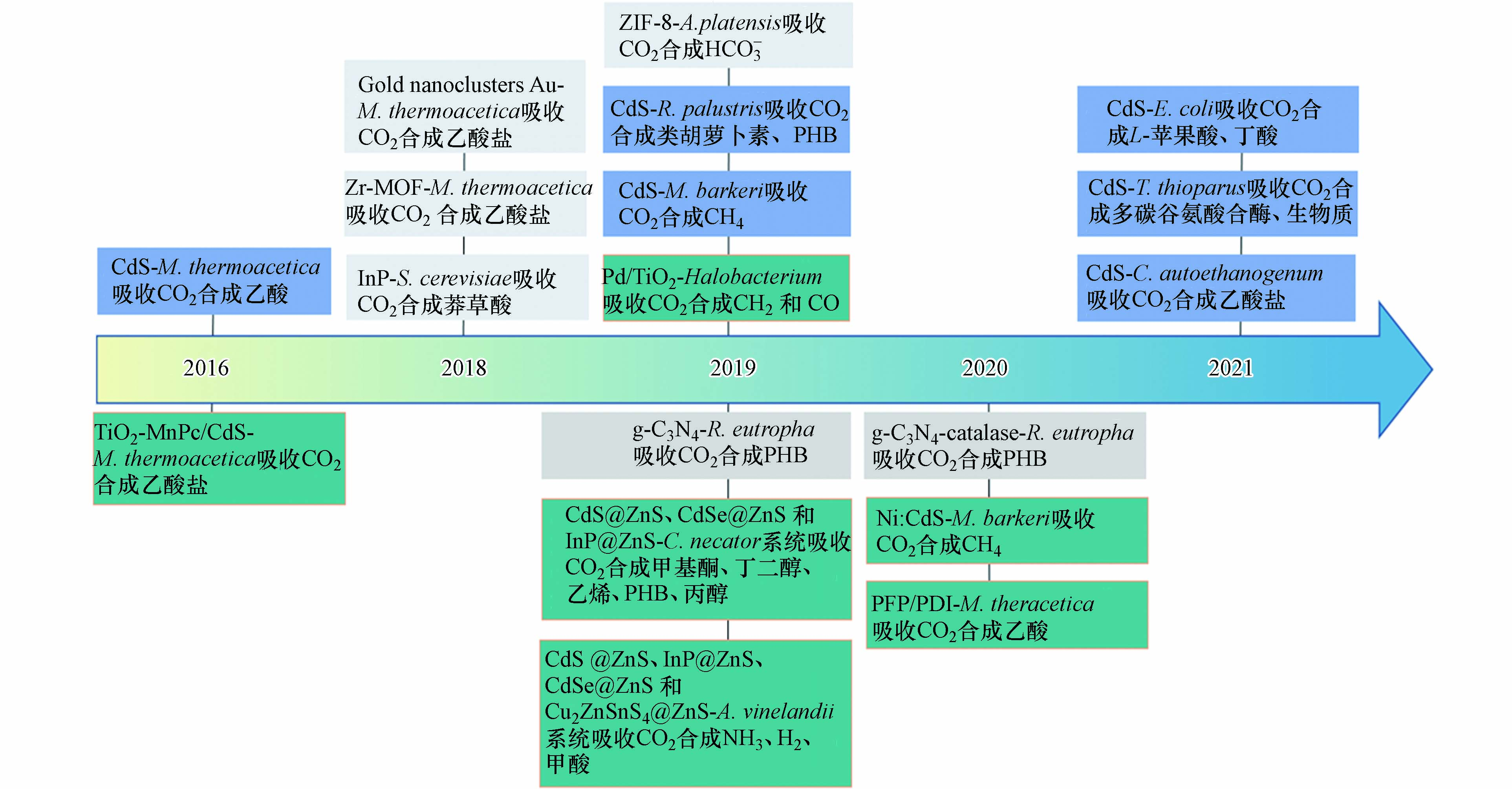
相对于光催化技术及单独微生物的碳转化研究,半导体-微生物杂化体系的研究开展较晚. 自2016年杨培东课题组报道了硫化镉-热醋穆尔氏菌(CdS-Moorella thermoacetica)杂化体系[16],为之后光催化剂-微生物复合体系碳转化提供了更多思路和参考,但此领域的研究才开展几年时间. 目前,以杨培东[16]和Daniel G. Nocera[17]课题组为代表的美国研究团队在该领域处于领先地位,在《Science》等发表多篇论文,但国内在该新兴领域尚处于萌芽阶段[18-21]. 现有少量报道汇总了半导体-微生物杂化体系的演变、发展[22-23]及CdS-微生物复合体系的光电应用[24],但尚缺乏对不同光催化剂构建微生物复合体系及其碳转化应用的系统归纳、总结. 含金属、非金属基及复合光催化剂在化学组成、光吸收特性及光催化性能等方面存在巨大差异,将大大影响构建复合体系的性能.
本文分类总结了不同光催化剂构建的微生物复合体系(图2),说明复合体系中光催化剂的引入方法、光催化剂的作用途径及碳转化产物、效率等关键因素,以启发和指导杂化体系中光催化剂的选择及优化;光催化剂-微生物界面的电荷转移决定杂化体系效率,本文分析了这一关键问题,以促进光催化剂与微生物的深度耦合.
-
金属硫化物由硫的3p轨道构成价带,拥有较高能级和较窄带隙,表现出良好的可见光激发性能,成为代表性光催化剂[25- 26]. CdS是典型的Ⅱ—Ⅵ族直接带隙半导体,具有合适的禁带宽度(2.4 eV)、氧化还原电位及可见光吸收性能,是用途最广泛的硫化物光催化剂之一[27-28]. 早在1995年,Holmes等[29-30]在含镉离子(Cd2+)的培养基中培养产气克雷伯氏菌(Klebsiella aerogenes),Cd2+与细胞内半胱氨酸产生的硫结合,生成CdS纳米颗粒,该纳米颗粒在细胞表面形成光保护层,并降低了重金属镉对细菌的毒害作用.
在2016年,杨培东课题组[16]将CdS与M. thermoacetica结合,诱导该非光合细菌的自我光敏化. 在低强度光照下,CdS产生的光生电子穿过细胞膜参与细菌Wood-Ljungdahl代谢途径,将CO2成功转化为乙酸,量子产率高达85%. 该系统证明了半导体与细菌复合系统的可行性,大大提高了自然光利用率以及CO2转化效率. 将立方体型CdS纳米颗粒沉积于产乙酸梭菌(Clostridium autoethanogenum)表面[31],在光照下,CdS产生的光生电子通过金属或黄素分子穿过细胞膜参与细菌Wood-Ljungdahl代谢途径,C. autoethanogenum通过自养途径将CO2转化为乙酸盐,光照条件下CO2转化生产0.8 mmol·L−1乙酸盐.
除与产乙酸菌结合生成乙酸、乙酸盐产物,CdS光催化剂还与其他异养菌种结合,将CO2转化为C1及C2+产物[32]. 巴氏甲烷八叠球菌(Methanosarcina barkeri)与CdS复合体系可将CO2转化为CH4,其生产率为0.19 μmol·h−1,量子效率达0.34%[33]. 可见光照射下,在CdS与沼泽红假单胞菌(Rhodopseudomonas palustris)生物杂化系统中,CdS纳米颗粒光激发驱动R. palustris将CO2转化为生物质、类胡萝卜素和聚β羟基丁酸酯(PHB)[34]. 通过自组装将CdS纳米颗粒与大肠杆菌(Escherichia coli)结合,使E. coli固定CO2的效率显著提高,其产物L-苹果酸和丁酸的产量分别增加到1.48 mol·mol−1葡萄糖和0.79 mol·mol−1葡萄糖[35]. 利用CdS与排硫硫杆菌(Thiobacillus thioparus)组成杂化系统,仅靠无机盐、太阳能和CO2可维持系统内细菌生长,依靠太阳能驱动将CO2高效转化为多碳谷氨酸合酶和生物质[36]. 较大多数有机营养和厌氧培养条件,CdS-T. thioparus系统显示出广泛适用性和实际应用潜力.
相较于TiO2等紫外光激发的光催化剂,CdS的可见光激发特性更适合于微生物的生长. 此外,可以通过S2-与Cd2+在培养基中反应制备CdS,通过细菌中脱硫酶催化半胱氨酸释放S2−[34],或向培养基中加入半胱氨酸得到S2−[36],生成CdS纳米颗粒具有较低的生物毒性且包覆在细胞表面. 由于上述特性,CdS被首先应用于光催化剂-微生物复合体系. 原位组装方法得到的CdS与细胞结合紧密,利于光催化剂与细胞界面的电子传递,有效提高了微生物的碳利用效率. 但该方法难以控制形貌、结构及颗粒粒度等影响CdS光催化效率的关键因素,局限CdS-微生物杂化体系CO2利用效率的进一步提升. 混合预合成CdS与细菌是一种构筑杂化体系的可行途径,方便调控CdS自身特性及改性优化,但需解决构建紧密结合界面及界面电子传递的关键问题.
-
在杂化体系中,CdS表现出诱导细胞氧化应激、对厌氧细菌具有细胞毒性,并存在镉污染等潜在问题[37-39],需开发其他金属光催化剂以构建高效、低毒性无机生物光合体系. 在CdS工作的基础上,杨培东课题组将具有良好生物相容性和优异光学性质的金纳米团簇与M. thermoacetica结合,利用太阳光固定CO2生产乙酸[40]. 越过缓慢的跨膜质量传输,胞内金纳米团簇的光生电子可通过Wood-Ljungdhal途径传递给细胞质,该杂化系统比CdS-M. thermoacetica具有更快的乙酸生产速率;金纳米团簇抑制活性氧、维持细胞的生物活性,实现长达6 d的持续碳固定.
金属有机框架(MOFs)具有丰富可调的催化活性位点、较大的表面积、独特的微孔/中孔和互连通道[41-42]. 同时,MOF具有良好的生物相容性[43],可以保护生物体免受有毒物质和紫外线照射的影响[44],允许细胞生存所必需的分子扩散[45]. 在CdS工作的基础上,杨培东课题组将Zr-MOF引入CdS-M. thermoacetica 杂化体系,在有氧条件下,Zr-MOF包裹杂化体系将CO2转化为乙酸盐的产率是未包裹杂化体系的2倍[46]. Zr-MOF拓宽了厌氧菌的应用领域,Zr-MOF外壳可以分解活性氧保护菌体,使其能够在氧化应激下持续固定CO2,过量Zr-MOF自发覆盖新生长细胞,传递保护作用. MOFs不仅可以与非光合细菌复合构建人工光合系统,还可以增强光合自养微生物的固碳能力. 将ZIF-8引入钝顶节旋藻(Arthrospira platensis)系统,ZIF-8的不饱和金属位点提高CO2转化为HCO3-的速度、提升相对电子传递率,进而增强光合作用和生物质产率[47]. 虽然,目前已经开发多种MOFs材料应用于分离和提纯,但与微生物体系结合的MOFs种类非常局限,需进一步探究其他典型MOFs的复合碳转化应用,如多孔、结构较稳定的MOF-5、HKUST-1等.
根据适合的禁带宽度(1.34 eV)和光谱吸收范围,Neel S. Joshi团队[48]将磷化铟(InP)光催化剂用于构建InP-异养酿酒酵母(Saccharomyces cerevisiae)杂化体系. InP的光生电子跨越细胞膜进入S. cerevisiae细胞内,促进NADPH再生,为生产莽草酸提供还原力. 该研究提出了一种增强光催化剂与细胞膜界面结合性的有效途径,将制备的InP进行多酚功能化,使其表面形成细胞亲和基团,通过多酚与酵母菌细胞壁的相互作用,自组装成无机生物杂化体系. 表1总结了已报道的含金属光催化剂与微生物杂化体系,光催化剂产生光生电子、为微生物提供还原力,驱动CO2向C1、C2、C2+等产品高效转化.
-
石墨相氮化碳(g-C3N4)是一种非金属光催化剂,具有类石墨烯的二维结构. 不同于金属基光催化剂,g-C3N4以含量丰富的碳、氮为构成元素,价格低廉、环境友好[49]. g-C3N4的禁带宽度为2.7 eV,可直接利用可见光,导带和价带电位分别为−1.1 V和1.6 V,是还原CO2的理想半导体[50]. g-C3N4可通过直接热缩聚、水热、离子交换热缩聚等方法合成,再加入到微生物体系中,具有较好的可控性. 同时,g-C3N4还具有生物相容性好、化学和热稳定性高、比表面积较大等优点[51-53]. 将g-C3N4应用于光催化剂-微生物杂化体系,发挥其光激发及生物兼容性优势,有利于推动其实际应用.
g-C3N4首先应用于异养微生物系统,张甜课题组构建了g-C3N4与真养产碱杆菌(Ralstonia eutropha)组成的杂化体系[54],生产可降解生物塑料PHB. 研究表明,无电子供体时,g-C3N4-R. eutropha体系的PHB产量是无g-C3N4时的1.2倍,向混合体系中加入电子供体三乙醇胺(TEOA),PHB产量提高至1.4倍,达(6.73±0.45) g·L−1. g-C3N4光激发产生光生电子光解水产生H2,促进细胞内还原当量及能量的产生,推动R. eutropha细胞内NADPH再生及乙酰辅酶A转化成PHB. 在此基础上,将g-C3N4与过氧化氢酶(Catalase)偶联,分解附着在其表面活位的H2O2提高g-C3N4活性,同时构筑g-C3N4-catalase-R. eutropha兼性自养/异养体系,以CO2为原料,该系统的PHB产量为(41.02±6.22) mg·L−1,是单独R. eutropha体系的2倍[55]. PHB产量提高是由于H2O2降解产生H2和O2促进细菌代谢,以及光催化剂与微生物之间电荷转移电阻降低. 大多数自养型杂化光合系统需要半胱氨酸等电子受体将还原当量转移至微生物,系统的可持续性受到电子供体的限制[55],而g-C3N4-R. eutropha杂化体系不需要电子供体运作[54],这一优点增加其实际应用的可行性.
纯g-C3N4光催化剂存在电子空穴复合较快、可见光吸收不足、低电荷迁移率等[56-58]缺点,需对其进行改性,如形貌调控、引入N/C缺陷、元素掺杂、助催化剂修饰、构建异质结等[59-68],以提升光催化效率. 现有研究主要是构建了纯g-C3N4与R. eutropha的杂化体系,需进一步研究改性g-C3N4与不同代谢路径菌株组成的复合系统,充分发挥g-C3N4基光催化剂的光激发性能以提高菌株的生产能力.
-
现有杂化体系大多将单一无机半导体作为光捕获材料,如CdS、金纳米团簇、g-C3N4等. 虽然这些光催化剂不同程度地提高了微生物的CO2转化能力,但单一光催化剂的电子-空穴易复合、光吸收能力较弱,往往需要添加空穴牺牲剂,影响其运行稳定性. 针对上述问题,需对单一光催化剂进行复合改性,以提升其能量转化效率及长期稳定性.
-
CdS半导体最早应用于生物杂化体系,但单相CdS存在光生电子-空穴对复合率高、催化效率低等问题,研究者通过结构改性、金属掺杂等提高其光催化性能[69]. 为优化CdS-M. thermoacetica体系,杨培东课题组[70]设计了Z型串联结构将CO2还原与O2氧化双催化过程结合,CdS-M. thermoacetica将半胱氨酸氧化为胱氨酸用于细菌的自光敏化,负载Mn(Ⅱ)酞菁(MnPc)的TiO2作为光氧化催化剂,氧化H2O并还原半胱氨酸. 耦合TiO2-MnPc与CdS-M. thermoacetica的Z型结构有效分离光生电子-空穴对,保持体系的强氧化还原能力及循环稳定性. 在CdS纳米粒子中掺杂Ni,使得Ni:CdS-M. barkeri体系的CH4产率比CdS-M. barkeri高约250%[71]. 0.75% Ni掺杂有效吸收电子,加速杂化体系的光生电子转移. Ni掺杂改变了M. barkeri的代谢状态,促进能量转换和CO2固定的蛋白质表达,利于M. barkeri捕获电子,提高胞内还原电位,从而推动CO2还原为CH4.
-
量子点作为一种零维的半导体纳米晶体,具有带隙及载流子易调控、表面位点丰富等优势. 其直径一般为1—10 nm,该纳米级小尺寸有利于量子点被细胞摄取,成为胞内感光元件. 将生物相容性量子点引入非光合细菌内,是构建胞内光催化剂与微生物杂化体系的可行途径. Ding等[72]预先制备一系列可调带隙的CdS、CdSe、InP、Cu2ZnSnS4量子点,在量子点表面包覆ZnS层,借助Zn外壳的化学亲和性,将量子点附着于细菌蛋白质,实现量子点与棕色固氮菌(Azotobacter vinelandii)、钩虫贪铜菌(Cupriavidus necator)的自组装,将两种非光合细菌转变为利用CO2、水和N2的光合细菌. 在光照激发下,该体系的化学转化效率高达13%,量子点-C. necator实现PHB克级量产.
利用细胞外膜和细胞质之间的周质空间,Luo等[73]将CuInS2/ZnS量子点转移到希瓦氏菌(Shewanella oneidensis MR-1)细胞中,构建了周质光敏化生物杂化体系. 在S. oneidensis MR-1细胞周质中,同时发生量子点光激发和电子传递过程,缩短了电子传递的距离,避免了跨膜过程中的额外能量损失. 该系统目前用于光催化产氢,为量子点基生物碳转化系统的设计提供参考. 量子点光催化剂因其纳米级尺寸优势,易实现光催化剂与微生物的胞内结合,有效减少了跨膜传输限制及能耗,已报道复合体系的高转化效率证明其具有规模化应用的潜力.
-
TiO2是应用最早的光催化剂,Chen等[7]在中空多孔的TiO2纳米颗粒上沉积Pb获得光催化剂,再将其与嗜盐杆菌(Halobacterium)制备的膜型囊泡结合. Pd作为助催化剂捕获电子,细菌膜结合蛋白积累质子并向TiO2导带传递电子,该过程有效分离光生电荷将CO2还原为CH4和CO. 该自上而下方法构建的杂化体系使Pb-TiO2与细菌间形成紧密的接触界面,有利于传质并减少电子损失.
现有报道的杂化体系,大多采用CdS等无机半导体与微生物结合,对微生物存在生物毒性及光毒性等问题. 比较而言,有机共轭半导体具有易调控的分子轨道能级及带隙结构,有望构建高效生物混合系统用于太阳能向化学能转化. Gai等[74]将n型苝二亚胺衍生物(PDI)和p型聚芴衍生物(PFP)涂覆在M. thermoacetica菌表面,形成p-n型π-共轭有机半导体(PFP/PDI). 有机半导体的阳离子侧链可以插入到细胞膜中,确保电子能够有效地转移到细菌中. 在杂化体系中,光生电子从PFP/PDI异质结有效转移至M. thermoacetica,驱动Wood-Ljungdahl途径将CO2合成乙酸,能量转化效率达1.6%.
采用光催化剂作为电极,构建光电极-微生物杂化体系,易于通过电极修饰改善光催化剂与微生物的耦合界面,并利用电化学结构促进光生电荷分离. 杨培东课题组[75]率先采用生物相容的硅纳米线阵列做光阴极,与卵形鼠孢菌(Sporomusa ovata)复合并向其提供电子,推动S. ovata通过Wood-Ljungdahl途径将CO2还原为乙酸,法拉第效率达到90%. 同时,TiO2纳米阵列作为光阳极,吸收光能发生析氧反应,向光阴极传递电子和质子. 微生物的自我复制性质及纳米线阵列创造的局部厌氧环境,使得该系统可以在有氧环境下稳定工作200 h. 将光活性n-TiO2阳极和p-InP阴极串联,插入至(M. barkeri)培养液中,用离子透膜分离阴极室和阳极室,实现了无辅助光驱动CH4的产生[76].
表2汇总了改性光催化剂、量子点、有机异质结、光阳极/光阴极等复合光催化剂与微生物构建的杂化体系,该碳转化体系的研究非常有限,特别是有机光催化剂,亟需开发高效杂化体系提高产量,并探索不同光催化剂对微生物基因表达及细胞代谢等的影响. 除碳转化应用,光催化剂与微生物杂化体系还用于产氢,并获得可观的析氢速率及量子效率,如TiO2-酪酸梭菌(Clostridium butyricum)[77]、TiO2-E. coli[78-79]、CdS-脱硫弧菌(Desulfovibrio desulfuricans)[80]、AglnS2/In2S3-E. coli[81]、Zn掺杂CdS-E. coli[82]、CdS-S. oneidensis MR-1[83]等体系. 此外,CdS-R. palustris[84]、CdS-脱氮硫杆菌(Thiobacillus denitrificans)[85]等体系被扩展应用于光驱动N2固定. 产氢、固氮体系的研究对于碳转化体系中光催化剂选择、光催化剂-微生物界面构建及界面电子传递具有重要的指导意义.
-
将高量子效率的光催化剂与高选择性、自我复制及修复的微生物结合,实现两者的优势互补[18, 86],是构建光催化剂-微生物杂化体系的核心目标. 目前,杂化体系尚存在CO2还原效率低、难以长时间稳定运行等问题,深入理解光催化剂与微生物的界面上能量和电荷转移过程,是构建稳定杂化碳转化体系的关键基础.
光催化剂与微生物间的电子转移主要分为直接电子转移和间接介导转移[87]. 在直接电子转移中,微生物直接从光催化剂表面获得电子,此时需要微生物与光催化剂相互匹配,两者之间形成紧密接触界面. 间接介导转移则需要通过H2、甲酸、NH3及Fe2+等氧化还原介质将电子传递给微生物细胞[88]. 因氧化还原介质传递电子的过程会造成能力损失,直接电子转移比间接介导转移具有更高理论电子转移效率. 但直接电子转移易受到光催化剂与微生物间亲和性、相容性及反应环境的影响. 由于电子传递过程涉及众多反应,过程较为复杂,电子转移的基本步骤及定速步骤等关键细节仍需探索.
当前对半导体/生物复合体系中电荷转移及相关细胞功能的表征及分析方式主要包括三类:一是基于光谱学的表征,如瞬态吸收光谱(TA)及时间分辨红外光谱(TRIR)等,通过对电荷转移动力学的瞬态及时间分辨光谱表征判断电荷吸收的途径;二是对于光敏化细菌的遗传分析,细胞中不同的生理过程涉及到不同的基因表达,通过在分子水平上对遗传物质进行分析,可分辨出半导体/生物复合体系的反应路径;三是蛋白组学和代谢组学的分析,可用于在遗传分析的基础上进一步阐明特定的细胞代谢路径[89].
Kornienko等[90]利用TA、TRIR等光谱技术及高灵敏度质谱技术,初步探索了CdS-M. thermoacetica杂化光合体系生产乙酸过程的两种电子转移途径. 一是,CdS受到光激发产生的光电子先被膜结合的氢化酶吸收,产生H2,随后H2被氧化为NADH/NADPH,为细胞代谢提供还原当量. 二是,光电子直接通过转运蛋白进入细胞内参与酶促反应. Huang等[91]利用基因敲除证实了膜结合蛋白介导对于微生物细胞中的光电子转移至关重要,发现硫还原地杆菌(Geobacter sulfurreducens)可以直接利用细胞外光电子. 同样,CdS NPs 光敏化的T. denitrificans[85]和M. barkeri[33]突变菌株中,耦合微生物光电化学性能受到抑制,也证实了膜结合蛋白在电子转移中的重要作用. Zhang等[92]利用非靶向/靶向蛋白质和代谢物定量方法探索了杂化细胞的蛋白质组和代谢组,发现铁氧还蛋白、黄素蛋白和NADH脱氢酶等膜结合蛋白在CdS-M. thermoacetica中上调,猜测这些蛋白质可能参与电子摄取过程. 细菌代谢循环中ATP合酶、参与三羧酸循环和糖酵解过程的蛋白质在CdS-M. thermoacetica杂化系统中均显著上调. 参与该途径酶的上调,表明对光催化剂的光照刺激改变了细菌的整个代谢状态.
-
光催化剂-微生物复合体系作为新兴技术起步较晚,但已成功结合多种光催化剂与微生物并获得不同碳转化产物. 目前在微生物体系中引入光催化剂的方法主要包括原位组装、预制备光催化剂两种. 原位组装是CdS-微生物体系的典型构建途径,该方法能够将CdS与细胞紧密结合. 由于制备条件的约束,多数体系预先合成光催化剂,再将其加入到微生物中,该过程易于调节光催化剂的结构及形貌,但难于控制两者的结合界面. 通过多酚功能化、涂覆化学亲和性外壳等,能促进光催化剂与细胞的结合. CdS等含金属光催化剂具有合适的带隙宽度和光谱吸收范围,其良好的光激发特性产生光生电子、为微生物提供还原力;非金属基催化剂成本低廉、环境友好且具有较好的生物相容性;由于单一光催化剂往往需要添加空穴牺牲剂来改善其性能,将单一催化剂进行复合改性形成复合催化剂可以提升其能量转化效率及长期稳定性. 为实现复合系统的工业应用,需进一步提高其效率,以追平甚至超越1%—7%的自然光合作用效率. 总结已有报道,应用于微生物复合碳转化体系光催化剂的面临挑战及发展趋势主要为:
(1)应用于微生物复合碳转化系统的光催化剂种类非常有限,目前主要为CdS、TiO2、g-C3N4等常规光催化剂,大量高效的金属氧化物、金属氮或磷化合物及有机光催化剂在杂化体系的应用亟待探索.
(2)改善光催化剂自身的光吸收及电荷分离特性,借助元素掺杂、制造缺陷、添加助催化剂、构建异质结等手段,提高其在杂化体系的电荷供给能力.
(3)对光催化剂表面进行功能化修饰,提高其细胞亲和性及生物相容性,使其与微生物细胞形成直接接触界面.
(4)目前,尚缺乏对光生电子从胞外半导体到胞内受体等扩膜传递及介导转移机制的深入认识,需采用原位表征及时间分辨光谱研究电子转移的全过程,以指导光催化剂与微生物的结合界面调控.
(5)现有杂化体系的碳转化产物主要为C1、C2、C2+等,需进一步开发新型杂化体系以生产C3+等长链碳氢化合物的目标产物.
光催化剂应用于微生物复合碳转化体系的研究进展
Research progress of photocatalyst application in microorganism hybrid system for carbon conversion
-
摘要: 结合具有光激发特性的光催化剂和有特定生物固碳途径的微生物,构建光催化剂-微生物复合体系,将实现太阳能捕获、催化反应活性和选择性等方面的优势互补. 不同类型光催化剂在光吸收特性及光催化性能等方面存在巨大差异,本文总结了含金属、非金属基或复合光催化剂与微生物构成的复合碳转化体系,对比光催化剂引入方法、光催化剂作用途径及碳转化产物、效率等关键因素. 针对率先与微生物结合的CdS光催化剂,系统阐述了其生产乙酸、甲烷、C2+产物及复合改性的发展历程. 分析杂化体系界面电荷转移的关键基础,概括其研究方法、现有成果及存在问题等. 分析了应用于微生物复合碳转化体系光催化剂的面临挑战及发展趋势.Abstract: Combining photocatalysts with photo-excited properties and microorganisms with specific biological pathways for carbon fixation to construct the photocatalyst-microorganism hybrid system will achieve complementary advantages in solar energy capture, catalytic activity and selectivity. Different types of photocatalyst have huge differences in light absorption characteristic and photocatalytic performance. This paper summarized the hybrid systems for carbon conversion composed of metal containing, nonmetal-based, or composite photocatalysts with microorganisms, and compared key factors such as binding methods, photocatalyst action pathways, the products and efficiencies of carbon conversion. For CdS photocatalyst firstly combined with microorganisms, its development process for the generations of acetic acid, methane, C2+ products, and the process of composite modification were systematically expounded. The key basis of interfacial charge transfer for hybrid system was analyzed. The research methods, existing achievements and problems were summarized. The challenges and development trends of photocatalyst applied in microorganism hybrid system for carbon conversion were analyzed.
-
Key words:
- carbon dioxide /
- photocatalyst /
- bioprocess /
- hybrid system.
-

-
表 1 含金属光催化剂与微生物复合体系及碳转化应用
Table 1. Metal containing photocatalyst and microorganism hybrid system for carbon conversion
含金属基催化剂
Metal containing
photocatalyst微生物
Microorganism光源
Light source产物
Product效率
Efficiency参考文献
ReferencesCdS M. thermoacetica 435–485 nm LED 乙酸 QE = 2.44% ± 0.62% [16] CdS C. autoethanogenum 20 W卤素灯 乙酸盐 0.8 mmol·L−1 [31] CdS R. palustris 荧光灯 类胡萝卜素、PHB PE = 5.98% [34] CdS M. barkeri (395 ± 5)nm LED CH4 QE = 0.34% [33] CdS T. thioparus 100 W LED+AM1.5滤光片 多碳谷氨酸合酶、生物质 — [36] CdS E. coli 蓝光LED(450 nm,
60 mW·cm−2)L-苹果酸、丁酸 — [35] Au nanoclusters M. thermoacetica 低强度模拟阳光
(2 mW·cm−2)乙酸盐 QE = 2.86% ± 0.38% [40] Zr-MOF M. thermoacetica 75 W氙灯+AM 1.5G滤光片 乙酸盐 产率200% [46] ZIF-8 A.platensis 6000 lux LED HCO3– 133.6 mmol·L−1 [47] InP S. cerevisiae 冷白光LED
(5.6 mW·cm−2)莽草酸 QE = 1.58% ± 0.05% [48] 注:QE为量子效率,PE为光合效率.
QE:Quantum efficiency,PE:Photosynthetic efficiency.表 2 复合光催化剂与微生物复合体系及碳转化应用
Table 2. Composite photocatalyst and microorganism hybrid system for carbon conversion
复合光催化剂
Composite photocatalyst微生物
Microorganism光源
Light source产物
Product效率
Efficiency参考文献
ReferencesTiO2-MnPc/CdS M. thermoacetica 75 W 氙灯 乙酸 1—1.25 mmol·L−1 (3.5 d) [70] Ni:CdS M. barkeri — CH4 (21.50 ± 0.98) µmol(6 d) [71] CdS @ZnS、InP@ZnS、CdSe@ZnS 和Cu2ZnSnS4@ZnS A. vinelandii 400 nm 紫外光 NH3、H2、甲酸 NH3、H2产率13.1% [72] CdS@ZnS、CdSe@ZnS 和 InP@ZnS C. necator 365 nm 紫外光 甲基酮、丁二醇、
乙烯、PHB、丙醇乙烯产率 0.6% [72] PFP/PDI异质结 M. theracetica — 乙酸 能量转化效率1.60% [74] Pd/TiO2 Halobacterium — CH4和CO — [7] 硅纳米线阵列 S. ovata (AM 1.5 G,100 mW·cm−2)下
产生约0.3 mA·cm−2的光电流乙酸 法拉第效率90%
在有氧环境下稳定工作200 h[75] TiO2/InP M. barkeri 电流2.5 mA(j = 0.29 mA·cm−2,
η = 360 mV)的电流下进行恒流
电解11.5 h,取样0.5 hCH4 法拉第效率 74%
7 d累积产生110 mL(4.3 mmol)[76] -
[1] 程强. 中国CCUS: 扩大规模 降低成本[N]. 中国石化报, 2021-08-23(005). CHENG Q, China CCUS: Expanding scale and lowering costs[N]. China Petrochemical News, 2021-08-23 (005) (in Chinese).
[2] 国网能源研究院有限公司. 中国能源电力发展展望-2019[M]. 北京: 中国电力出版社, 2019. State grid energy research institute company limited. Development prospect of China's energy and power 2019[M]. Beijing: China Electric Power Press, 2019(in Chinese).
[3] THOI V S, KORNIENKO N, MARGARIT C G, et al. Visible-light photoredox catalysis: Selective reduction of carbon dioxide to carbon monoxide by a nickel N-heterocyclic carbene-isoquinoline complex [J]. Journal of the American Chemical Society, 2013, 135(38): 14413-14424. doi: 10.1021/ja4074003 [4] LIU L J, ZHAO H L, ANDINO J M, et al. Photocatalytic CO2 reduction with H2O on TiO2 nanocrystals: Comparison of anatase, rutile, and brookite polymorphs and exploration of surface chemistry [J]. ACS Catalysis, 2012, 2(8): 1817-1828. doi: 10.1021/cs300273q [5] 晁显玉, 张宁, 简丽娟. Sm3+/TiO2催化剂对光催化还原CO2和H2O合成CH3OH的影响 [J]. 环境化学, 2010, 29(3): 481-485. CHAO X Y, ZHANG N, JIAN L J. Sm3+/TiO2 catalyzed photo-synthesis of methanol from carbon dioxide and water [J]. Environmental Chemistry, 2010, 29(3): 481-485(in Chinese).
[6] BARTON E E, RAMPULLA D M, BOCARSLY A B. Selective solar-driven reduction of CO2 to methanol using a catalyzed p-GaP based photoelectrochemical cell [J]. Journal of the American Chemical Society, 2008, 130(20): 6342-6344. doi: 10.1021/ja0776327 [7] CHEN Z W, ZHANG H, GUO P J, et al. Semi-artificial photosynthetic CO2 reduction through purple membrane re-engineering with semiconductor [J]. Journal of the American Chemical Society, 2019, 141(30): 11811-11815. doi: 10.1021/jacs.9b05564 [8] XU H P, REBOLLAR D, HE H Y, et al. Highly selective electrocatalytic CO2 reduction to ethanol by metallic clusters dynamically formed from atomically dispersed copper [J]. Nature Energy, 2020, 5(8): 623-632. doi: 10.1038/s41560-020-0666-x [9] BECERRA J, NGUYEN D T, GOPALAKRISHNAN V N, et al. Plasmonic Au nanoparticles incorporated in the zeolitic imidazolate framework (ZIF-67) for the efficient sunlight-driven photoreduction of CO2 [J]. ACS Applied Energy Materials, 2020, 3(8): 7659-7665. doi: 10.1021/acsaem.0c01083 [10] 齐中, 王熙, 李来胜, 等. 基于水热法制备的TiO2/MoS2复合光催化剂及其光催化制氢活性 [J]. 环境化学, 2016, 35(5): 1027-1034. doi: 10.7524/j.issn.0254-6108.2016.05.2015112403 QI Z, WANG X, LI L S, et al. Development of TiO2/MoS2 by hydrothermal method for photocatalytic hydrogen generation under solar light [J]. Environmental Chemistry, 2016, 35(5): 1027-1034(in Chinese). doi: 10.7524/j.issn.0254-6108.2016.05.2015112403
[11] LIU G Y, GAO F, GAO C, et al. Bioinspiration toward efficient photosynthetic systems: From biohybrids to biomimetics [J]. Chem Catalysis, 2021, 1(7): 1367-1377. doi: 10.1016/j.checat.2021.09.010 [12] 熊威, 冯建勇, 马为民, 等. 基于无机材料-微生物复合的半人工光合作用 [J]. 无机化学学报, 2019, 35(9): 1521-1534. doi: 10.11862/CJIC.2019.186 XIONG W, FENG J Y, MA W M, et al. Semi-artificial photosynthesis based on inorganic material-microbe hybrids [J]. Chinese Journal of Inorganic Chemistry, 2019, 35(9): 1521-1534(in Chinese). doi: 10.11862/CJIC.2019.186
[13] SAKIMOTO K K, KORNIENKO N, YANG P D. Cyborgian material design for solar fuel production: The emerging photosynthetic biohybrid systems [J]. Accounts of Chemical Research, 2017, 50(3): 476-481. doi: 10.1021/acs.accounts.6b00483 [14] LI L X, XU Z J, HUANG X. Whole-cell-based photosynthetic biohybrid systems for energy and environmental applications [J]. ChemPlusChem, 2021, 86(7): 1021-1036. doi: 10.1002/cplu.202100171 [15] 郭禹曼, 洪学明, 樊彬, 等. 光催化-微生物耦合固碳研究进展 [J]. 生物加工过程, 2022, 20(2): 148-159. doi: 10.3969/j.issn.1672-3678.2022.02.004 GUO Y M, HONG X M, FAN B, et al. Recent development of photocatalytic-biological hybrid systems for CO2 assimilation [J]. Chinese Journal of Bioprocess Engineering, 2022, 20(2): 148-159(in Chinese). doi: 10.3969/j.issn.1672-3678.2022.02.004
[16] SAKIMOTO K K, WONG A B, YANG P D. Self-photosensitization of nonphotosynthetic bacteria for solar-to-chemical production [J]. Science, 2016, 351(6268): 74-77. doi: 10.1126/science.aad3317 [17] LIU C, COLÓN B C, ZIESACK M, et al. Water splitting-biosynthetic system with CO2 reduction efficiencies exceeding photosynthesis [J]. Science, 2016, 352(6290): 1210-1213. doi: 10.1126/science.aaf5039 [18] KORNIENKO N, ZHANG J Z, SAKIMOTO K K, et al. Interfacing nature's catalytic machinery with synthetic materials for semi-artificial photosynthesis [J]. Nature Nanotechnology, 2018, 13(10): 890-899. doi: 10.1038/s41565-018-0251-7 [19] SAKIMOTO K K, KORNIENKO N, CESTELLOS-BLANCO S, et al. Physical biology of the materials-microorganism interface [J]. Journal of the American Chemical Society, 2018, 140(6): 1978-1985. doi: 10.1021/jacs.7b11135 [20] LEE Y V, TIAN B Z. Learning from solar energy conversion: Biointerfaces for artificial photosynthesis and biological modulation [J]. Nano Letters, 2019, 19(4): 2189-2197. doi: 10.1021/acs.nanolett.9b00388 [21] XU L, ZHAO Y L, OWUSU K A, et al. Recent advances in nanowire-biosystem interfaces: From chemical conversion, energy production to electrophysiology [J]. Chem, 2018, 4(7): 1538-1559. doi: 10.1016/j.chempr.2018.04.004 [22] SAHOO P C, PANT D, KUMAR M, et al. Material-microbe interfaces for solar-driven CO2 bioelectrosynthesis [J]. Trends in Biotechnology, 2020, 38(11): 1245-1261. doi: 10.1016/j.tibtech.2020.03.008 [23] CESTELLOS-BLANCO S, ZHANG H, KIM J M, et al. Photosynthetic semiconductor biohybrids for solar-driven biocatalysis [J]. Nature Catalysis, 2020, 3(3): 245-255. doi: 10.1038/s41929-020-0428-y [24] DONG G W, WANG H H, YAN Z Y, et al. Cadmium sulfide nanoparticles-assisted intimate coupling of microbial and photoelectrochemical processes: Mechanisms and environmental applications [J]. Science of the Total Environment, 2020, 740: 140080. doi: 10.1016/j.scitotenv.2020.140080 [25] HE W W, JIA H M, YANG D F, et al. Composition directed generation of reactive oxygen species in irradiated mixed metal sulfides correlated with their photocatalytic activities [J]. ACS Applied Materials & Interfaces, 2015, 7(30): 16440-16449. [26] SHEN S H, CHEN X B, REN F, et al. Solar light-driven photocatalytic hydrogen evolution over ZnIn2S4 loaded with transition-metal sulfides [J]. Nanoscale Research Letters, 2011, 6(1): 290. doi: 10.1186/1556-276X-6-290 [27] HOPFNER M, WEISS H, MEISSNER D, et al. Semiconductor photocatalysis type B: Synthesis of unsaturated alpha-amino esters from imines and olefins photocatalyzed by silica-supported cadmium sulfide [J]. Photochemical & Photobiological Sciences, 2002, 1(9): 696-703. [28] KOCA A, ŞAHIN M. Photocatalytic hydrogen production by direct Sun light from sulfide/sulfite solution [J]. International Journal of Hydrogen Energy, 2002, 27(4): 363-367. doi: 10.1016/S0360-3199(01)00133-1 [29] HOLMES J D, SMITH P R, EVANS-GOWING R, et al. Bacterial photoprotection through extracellular cadmium sulfide crystallites [J]. Photochemistry and Photobiology, 1995, 62(6): 1022-1026. [30] HOLMES J D, SMITH P R, EVANS-GOWING R, et al. Energy-dispersive X-ray analysis of the extracellular cadmium sulfide crystallites of Klebsiella aerogenes [J]. Archives of Microbiology, 1995, 163(2): 143-147. doi: 10.1007/BF00381789 [31] JIN S, JEON Y, JEON M S, et al. Acetogenic bacteria utilize light-driven electrons as an energy source for autotrophic growth [J]. Proceedings of the National Academy of Sciences of the United States of America, 2021, 118(9): e2020552118. doi: 10.1073/pnas.2020552118 [32] 王凯, 贺明丽, 王梦, 等. 以CO2为原料的绿色生物制造 [J]. 化工进展, 2019, 38(1): 538-544. WANG K, HE M L, WANG M, et al. Green biological manufacture with CO2 as raw material [J]. Chemical Industry and Engineering Progress, 2019, 38(1): 538-544(in Chinese).
[33] YE J, YU J, ZHANG Y Y, et al. Light-driven carbon dioxide reduction to methane by Methanosarcina barkeri-CdS biohybrid [J]. Applied Catalysis B:Environmental, 2019, 257: 117916. doi: 10.1016/j.apcatb.2019.117916 [34] WANG B, JIANG Z F, YU J C, et al. Enhanced CO2 reduction and valuable C2 + chemical production by a CdS-photosynthetic hybrid system [J]. Nanoscale, 2019, 11(19): 9296-9301. doi: 10.1039/C9NR02896J [35] HU G P, LI Z H, MA D L, et al. Light-driven CO2 sequestration in Escherichia coli to achieve theoretical yield of chemicals [J]. Nature Catalysis, 2021, 4(5): 395-406. doi: 10.1038/s41929-021-00606-0 [36] LIU G Y, GAO F, ZHANG H W, et al. Biosynthetic CdS-Thiobacillus thioparus hybrid for solar-driven carbon dioxide fixation[J]. Nano Research, 2021: 1-8. [37] BEGG S L, EIJKELKAMP B A, LUO Z Y, et al. Dysregulation of transition metal ion homeostasis is the molecular basis for cadmium toxicity in Streptococcus pneumoniae [J]. Nature Communications, 2015, 6: 6418. doi: 10.1038/ncomms7418 [38] LI K G, CHEN J T, BAI S S, et al. Intracellular oxidative stress and cadmium ions release induce cytotoxicity of unmodified cadmium sulfide quantum dots [J]. Toxicology in Vitro, 2009, 23(6): 1007-1013. doi: 10.1016/j.tiv.2009.06.020 [39] GODT J, SCHEIDIG F, GROSSE-SIESTRUP C, et al. The toxicity of cadmium and resulting hazards for human health [J]. Journal of Occupational Medicine and Toxicology (London, England), 2006, 1: 22. doi: 10.1186/1745-6673-1-22 [40] ZHANG H, LIU H, TIAN Z Q, et al. Bacteria photosensitized by intracellular gold nanoclusters for solar fuel production [J]. Nature Nanotechnology, 2018, 13(10): 900-905. doi: 10.1038/s41565-018-0267-z [41] MENG J S, LIU X, NIU C J, et al. Advances in metal-organic framework coatings: Versatile synthesis and broad applications [J]. Chemical Society Reviews, 2020, 49(10): 3142-3186. doi: 10.1039/C9CS00806C [42] 宋珂琛, 崔希利, 邢华斌. 二氧化碳直接空气捕集材料与技术研究进展 [J]. 化工进展, 2022, 41(3): 1152-1162. SONG K C, CUI X L, XING H B. Progress on direct air capture of carbon dioxide [J]. Chemical Industry and Engineering Progress, 2022, 41(3): 1152-1162(in Chinese).
[43] LIANG J Y, LIANG K. Nano-bio-interface engineering of metal-organic frameworks [J]. Nano Today, 2021, 40: 101256. doi: 10.1016/j.nantod.2021.101256 [44] LIANG K, RICHARDSON J J, CUI J W, et al. Metal-organic framework coatings as cytoprotective exoskeletons for living cells [J]. Advanced Materials, 2016, 28(36): 7910-7914. doi: 10.1002/adma.201602335 [45] LIANG K, RICHARDSON J J, DOONAN C J, et al. An enzyme-coated metal-organic framework shell for synthetically adaptive cell survival [J]. Angewandte Chemie, 2017, 129(29): 8630-8635. doi: 10.1002/ange.201704120 [46] JI Z, ZHANG H, LIU H, et al. Cytoprotective metal-organic frameworks for anaerobic bacteria [J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(42): 10582-10587. doi: 10.1073/pnas.1808829115 [47] CHENG J, ZHU Y X, XU X D, et al. Enhanced biomass productivity of Arthrospira platensis using zeolitic imidazolate framework-8 as carbon dioxide adsorbents [J]. Bioresource Technology, 2019, 294: 122118. doi: 10.1016/j.biortech.2019.122118 [48] GUO J L, SUÁSTEGUI M, SAKIMOTO K K, et al. Light-driven fine chemical production in yeast biohybrids [J]. Science, 2018, 362(6416): 813-816. doi: 10.1126/science.aat9777 [49] 郭雅容, 陈志鸿, 刘琼, 等. 石墨相氮化碳光催化剂研究进展 [J]. 化工进展, 2016, 35(7): 2063-2070. doi: 10.16085/j.issn.1000-6613.2016.07.018 GUO Y R, CHEN Z H, LIU Q, et al. Research progress of graphitic carbon nitride in photocatalysis [J]. Chemical Industry and Engineering Progress, 2016, 35(7): 2063-2070(in Chinese). doi: 10.16085/j.issn.1000-6613.2016.07.018
[50] YAN S C, LV S B, LI Z S, et al. Organic-inorganic composite photocatalyst of g-C3N4 and TaON with improved visible light photocatalytic activities [J]. Dalton Transactions (Cambridge, England:2003), 2010, 39(6): 1488-1491. doi: 10.1039/B914110C [51] ZHANG X D, XIE X, WANG H, et al. Enhanced photoresponsive ultrathin graphitic-phase C3N4 nanosheets for bioimaging [J]. Journal of the American Chemical Society, 2013, 135(1): 18-21. doi: 10.1021/ja308249k [52] WANG Y, WANG X C, ANTONIETTI M. Polymeric graphitic carbon nitride as a heterogeneous organocatalyst: From photochemistry to multipurpose catalysis to sustainable chemistry [J]. Angewandte Chemie International Edition, 2012, 51(1): 68-89. doi: 10.1002/anie.201101182 [53] SANO T, TSUTSUI S, KOIKE K, et al. Activation of graphitic carbon nitride (g-C3N4) by alkaline hydrothermal treatment for photocatalytic NO oxidation in gas phase [J]. Journal of Materials Chemistry A, 2013, 1(21): 6489-6496. doi: 10.1039/c3ta10472a [54] XU M Y, TREMBLAY P L, JIANG L L, et al. Stimulating bioplastic production with light energy by couplingRalstonia eutrophawith the photocatalyst graphitic carbon nitride [J]. Green Chemistry, 2019, 21(9): 2392-2400. doi: 10.1039/C8GC03695K [55] TREMBLAY P L, XU M Y, CHEN Y M, et al. Nonmetallic abiotic-biological hybrid photocatalyst for visible water splitting and carbon dioxide reduction [J]. iScience, 2020, 23(1): 100784. doi: 10.1016/j.isci.2019.100784 [56] 楚增勇, 原博, 颜廷楠. g-C3N4光催化性能的研究进展 [J]. 无机材料学报, 2014, 29(8): 785-794. doi: 10.15541/jim20130633 CHU Z Y, YUAN B, YAN T N. Recent progress in photocatalysis of g-C3N4 [J]. Journal of Inorganic Materials, 2014, 29(8): 785-794(in Chinese). doi: 10.15541/jim20130633
[57] ZHANG J S, CHEN Y, WANG X C. Two-dimensional covalent carbon nitride nanosheets: Synthesis, functionalization, and applications [J]. Energy & Environmental Science, 2015, 8(11): 3092-3108. [58] YIN S, HAN J Y, ZHOU T, et al. Recent progress in g-C3N4 based low cost photocatalytic system: Activity enhancement and emerging applications [J]. Catalysis Science \& Technology, 2015, 5: 5048-5061. [59] XU J, ZHANG L W, SHI R, et al. Chemical exfoliation of graphitic carbon nitride for efficient heterogeneous photocatalysis [J]. Journal of Materials Chemistry A, 2013, 1(46): 14766-14772. doi: 10.1039/c3ta13188b [60] LIN Q Y, LI L, LIANG S J, et al. Efficient synthesis of monolayer carbon nitride 2D nanosheet with tunable concentration and enhanced visible-light photocatalytic activities [J]. Applied Catalysis B:Environmental, 2015, 163: 135-142. doi: 10.1016/j.apcatb.2014.07.053 [61] MA W, WANG N, LI S T, et al. Synthesis and properties of B-Ni-TiO2/g-C3N4 photocatalyst for degradation of chloramphenicol (CAP) under visible light irradiation [J]. Journal of Materials Science:Materials in Electronics, 2018, 29(16): 13957-13969. doi: 10.1007/s10854-018-9529-7 [62] CHEN S C, WANG H, KANG Z X, et al. Oxygen vacancy associated single-electron transfer for photofixation of CO2 to long-chain chemicals [J]. Nature Communications, 2019, 10: 788. doi: 10.1038/s41467-019-08697-x [63] LI H L, GAO Y, XIONG Z, et al. Enhanced selective photocatalytic reduction of CO2 to CH4 over plasmonic Au modified g-C3N4 photocatalyst under UV-vis light irradiation [J]. Applied Surface Science, 2018, 439: 552-559. doi: 10.1016/j.apsusc.2018.01.071 [64] YU J G, WANG K, XIAO W, et al. Photocatalytic reduction of CO2 into hydrocarbon solar fuels over g-C3N4-Pt nanocomposite photocatalysts [J]. Physical Chemistry Chemical Physics:PCCP, 2014, 16(23): 11492-11501. doi: 10.1039/c4cp00133h [65] HE Y M, WANG Y, ZHANG L H, et al. High-efficiency conversion of CO2 to fuel over ZnO/g-C3N4 photocatalyst [J]. Applied Catalysis B:Environmental, 2015, 168/169: 1-8. doi: 10.1016/j.apcatb.2014.12.017 [66] WANG S B, LIN J L, WANG X C. Semiconductor-redox catalysis promoted by metal-organic frameworks for CO2 reduction [J]. Physical Chemistry Chemical Physics:PCCP, 2014, 16(28): 14656-14660. doi: 10.1039/c4cp02173h [67] GENG Z H, JIN X C, WANG R M, et al. Low-temperature hydrogen production via water conversion on Pt/TiO2 [J]. The Journal of Physical Chemistry C, 2018, 122(20): 10956-10962. doi: 10.1021/acs.jpcc.8b02945 [68] JIANG Z F, WAN W M, LI H M, et al. A hierarchical Z-scheme α-Fe2O3/g-C3N4 hybrid for enhanced photocatalytic CO2 reduction [J]. Advanced Materials, 2018, 30(10): 1706108. doi: 10.1002/adma.201706108 [69] WEI R B, HUANG Z L, GU G H, et al. Dual-cocatalysts decorated rimous CdS spheres advancing highly-efficient visible-light photocatalytic hydrogen production [J]. Applied Catalysis B:Environmental, 2018, 231: 101-107. doi: 10.1016/j.apcatb.2018.03.014 [70] SAKIMOTO K K, ZHANG S J, YANG P D. Cysteine-cystine photoregeneration for oxygenic photosynthesis of acetic acid from CO2 by a tandem inorganic-biological hybrid system [J]. Nano Letters, 2016, 16(9): 5883-5887. doi: 10.1021/acs.nanolett.6b02740 [71] YE J, REN G P, KANG L, et al. Efficient photoelectron capture by Ni decoration in Methanosarcina barkeri-CdS biohybrids for enhanced photocatalytic CO2-to-CH4 conversion [J]. iScience, 2020, 23(7): 101287. doi: 10.1016/j.isci.2020.101287 [72] DING Y C, BERTRAM J R, ECKERT C, et al. Nanorg microbial factories: Light-driven renewable biochemical synthesis using quantum dot-bacteria nanobiohybrids [J]. Journal of the American Chemical Society, 2019, 141(26): 10272-10282. doi: 10.1021/jacs.9b02549 [73] LUO B F, WANG Y Z, LI D, et al. A periplasmic photosensitized biohybrid system for solar hydrogen production [J]. Advanced Energy Materials, 2021, 11(19): 2100256. doi: 10.1002/aenm.202100256 [74] GAI P P, YU W, ZHAO H, et al. Solar-powered organic semiconductor-bacteria biohybrids for CO2 reduction into acetic acid [J]. Angewandte Chemie International Edition, 2020, 59(18): 7224-7229. doi: 10.1002/anie.202001047 [75] LIU C, GALLAGHER J J, SAKIMOTO K K, et al. Nanowire-bacteria hybrids for unassisted solar carbon dioxide fixation to value-added chemicals [J]. Nano Letters, 2015, 15(5): 3634-3639. doi: 10.1021/acs.nanolett.5b01254 [76] NICHOLS E M, GALLAGHER J J, LIU C, et al. Hybrid bioinorganic approach to solar-to-chemical conversion [J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(37): 11461-11466. doi: 10.1073/pnas.1508075112 [77] KRASNOVSKY A A, NIKANDROV V V. The photobiocatalytic system: Inorganic semiconductors coupled to bacterial cells [J]. FEBS Letters, 1987, 219(1): 93-96. doi: 10.1016/0014-5793(87)81197-3 [78] HONDA Y, HAGIWARA H, IDA S, et al. Application to photocatalytic H2 production of a whole-cell reaction by recombinant Escherichia coli cells expressing[FeFe]-hydrogenase and maturases genes [J]. Angewandte Chemie International Edition, 2016, 55(28): 8045-8048. doi: 10.1002/anie.201600177 [79] HONDA Y, WATANABE M, HAGIWARA H, et al. Inorganic/whole-cell biohybrid photocatalyst for highly efficient hydrogen production from water [J]. Applied Catalysis B:Environmental, 2017, 210: 400-406. doi: 10.1016/j.apcatb.2017.04.015 [80] MARTINS M, TOSTE C, PEREIRA I A C. Enhanced light-driven hydrogen production by self-photosensitized biohybrid systems [J]. Angewandte Chemie International Edition, 2021, 60(16): 9055-9062. doi: 10.1002/anie.202016960 [81] JIANG Z F, WANG B, YU J C, et al. AglnS2/In2S3 heterostructure sensitization of Escherichia coli for sustainable hydrogen production [J]. Nano Energy, 2018, 46: 234-240. doi: 10.1016/j.nanoen.2018.02.001 [82] HOU T F, LIANG J, WANG L, et al. Cd1-xZnxS biomineralized by engineered bacterium for efficient photocatalytic hydrogen production [J]. Materials Today Energy, 2021, 22: 100869. doi: 10.1016/j.mtener.2021.100869 [83] HAN H X, TIAN L J, LIU D F, et al. Reversing electron transfer chain for light-driven hydrogen production in biotic-abiotic hybrid systems [J]. Journal of the American Chemical Society, 2022, 144(14): 6434-6441. doi: 10.1021/jacs.2c00934 [84] WANG B, XIAO K M, JIANG Z F, et al. Biohybrid photoheterotrophic metabolism for significant enhancement of biological nitrogen fixation in pure microbial cultures [J]. Energy & Environmental Science, 2019, 12(7): 2185-2191. [85] CHEN M, ZHOU X F, YU Y Q, et al. Light-driven nitrous oxide production via autotrophic denitrification by self-photosensitized Thiobacillus denitrificans [J]. Environment International, 2019, 127: 353-360. doi: 10.1016/j.envint.2019.03.045 [86] FANG X, KALATHIL S, REISNER E. Semi-biological approaches to solar-to-chemical conversion [J]. Chemical Society Reviews, 2020, 49(14): 4926-4952. doi: 10.1039/C9CS00496C [87] 李锋, 宋浩. 微生物胞外电子传递效率的合成生物学强化 [J]. 生物工程学报, 2017, 33(3): 516-534. doi: 10.13345/j.cjb.160419 LI F, SONG H. Promoting efficiency of microbial extracellular electron transfer by synthetic biology [J]. Chinese Journal of Biotechnology, 2017, 33(3): 516-534(in Chinese). doi: 10.13345/j.cjb.160419
[88] TREMBLAY P L, ANGENENT L T, ZHANG T. Extracellular electron uptake: Among autotrophs and mediated by surfaces [J]. Trends in Biotechnology, 2017, 35(4): 360-371. doi: 10.1016/j.tibtech.2016.10.004 [89] CESTELLOS-BLANCO S, KIM J M, WATANABE N G, et al. Molecular insights and future frontiers in cell photosensitization for solar-driven CO2 conversion [J]. iScience, 2021, 24(9): 102952. doi: 10.1016/j.isci.2021.102952 [90] KORNIENKO N, SAKIMOTO K K, HERLIHY D M, et al. Spectroscopic elucidation of energy transfer in hybrid inorganic-biological organisms for solar-to-chemical production [J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(42): 11750-11755. doi: 10.1073/pnas.1610554113 [91] HUANG S F, TANG J H, LIU X, et al. Fast light-driven biodecolorization by a Geobacter sulfurreducens–CdS biohybrid [J]. ACS Sustainable Chemistry & Engineering, 2019, 7(18): 15427-15433. [92] ZHANG R T, HE Y, YI J, et al. Proteomic and metabolic elucidation of solar-powered biomanufacturing by bio-abiotic hybrid system [J]. Chem, 2020, 6(1): 234-249. doi: 10.1016/j.chempr.2019.11.002 -



 下载:
下载: