-
沉水植物不仅是水生态系统的主要生产者,也是水生态系统结构复杂性、空间异质性和功能稳定性的基础[1]。沉水植物可以吸收或降解水中污染物,吸附悬浮物和沉积物[2],因此,沉水植物恢复已被公认为是富营养化水体治理的有效途径[3]。
苦草作为沉水植物的典型代表,其生长生理状态决定了其净化水质效果及维持水质稳定性功能强弱,是我国南方水体常见沉水植物物种。因此,如何有效恢复污染水体或退化湖泊、水库的苦草,强化其水质净化效率成为水环境生态修复领域重点课题[4]。水体苦草恢复受到生物因素和非生物环境因素的影响,其中非生物环境因素有光照[5]、水温[6]、pH[7]、基质[8]和营养物质[9]。由于水体光照、水温、pH及水体营养物质组成人为调控难度大,而底泥基质调控相对容易,且工程推广应用可行性高,已成为强化水体苦草恢复及其净化能力的研究焦点[10]。GAO等[11]以具有吸附和缓释双重功能的颗粒活性炭负载纳米铁-氢氧化镁(AC-Fe-Mg)制备了一种控磷基质,黄菖蒲与AC-Fe-Mg联合作用对磷的去除率达到98.66%。宗小香等[12]以铁-碳电解质作为水生植物生长基质,研究了单种水生植物对污水中NH4+-N、COD、TP去除效果,其中,凤眼莲对氨态氮的去除率可达到100%。
生物炭是一种多孔碳材料,已广泛应用于去除污染物[13]、改善土壤质量[14]和固碳[15]。利用生物炭对土壤进行原位修复导致生态系统过程发生变化,如微生物群落[16],土壤氮循环[17],初级生产力[18]。生物炭的多功能特性为其用作沉水植物生长基质,强化沉水植物恢复及其净化能力提供了潜能。已有研究表明,在底泥基质中添加小颗粒生物炭能促进苦草种子萌发和幼苗生长,有助于降低水中氨氮浓度,但对磷的去除效果不佳[19]。
改性是一种有效强化生物炭固定水和土壤污染物的常用方法[20]。铁作为地壳中最广泛存在的金属元素[21],铁改性生物炭已广泛运用于水中污染物,尤其是氮、磷的吸附去除。若添加铁改性生物炭作为沉水植物生长基质,应能对水体水质净化产生显著效果,抑制水体富营养化进程;然而亦有少量学者指出,铁改性生物炭的使用不当可能不利于水生植物生长,过量施加可能影响植物酶活性,但此结论尚未得到证实,需要进一步探究[22-23]。因此,本研究以苦草(Vallisneria spiralis)作为沉水植物代表,利用苦草水质净化模拟系统,通过循环批次实验,考察了不同浓度铁改性生物炭对系统水质净化及苦草生理生长特性的影响,研究结果可为强化苦草水生态系统的净化功能提供技术支撑,对推动铁改性生物炭在污染水生态修复领域中的应用具有重要促进作用。
-
生物炭及铁改性生物炭的制备。选用竹屑,以10 ℃·min−1的升温速率,在500 ℃下热解1 h制备生物炭。竹屑生物质原料与0.05、0.10、0.20 mol·L−1 FeCl3溶液按照1 g:12.5 mL−1在150 r·min−1,25 ℃条件下恒温振荡4 h后,过滤烘干,在500 ℃条件下热解1 h制备铁改性生物炭,实验选择沉水植物苦草长度为14~16 cm。
-
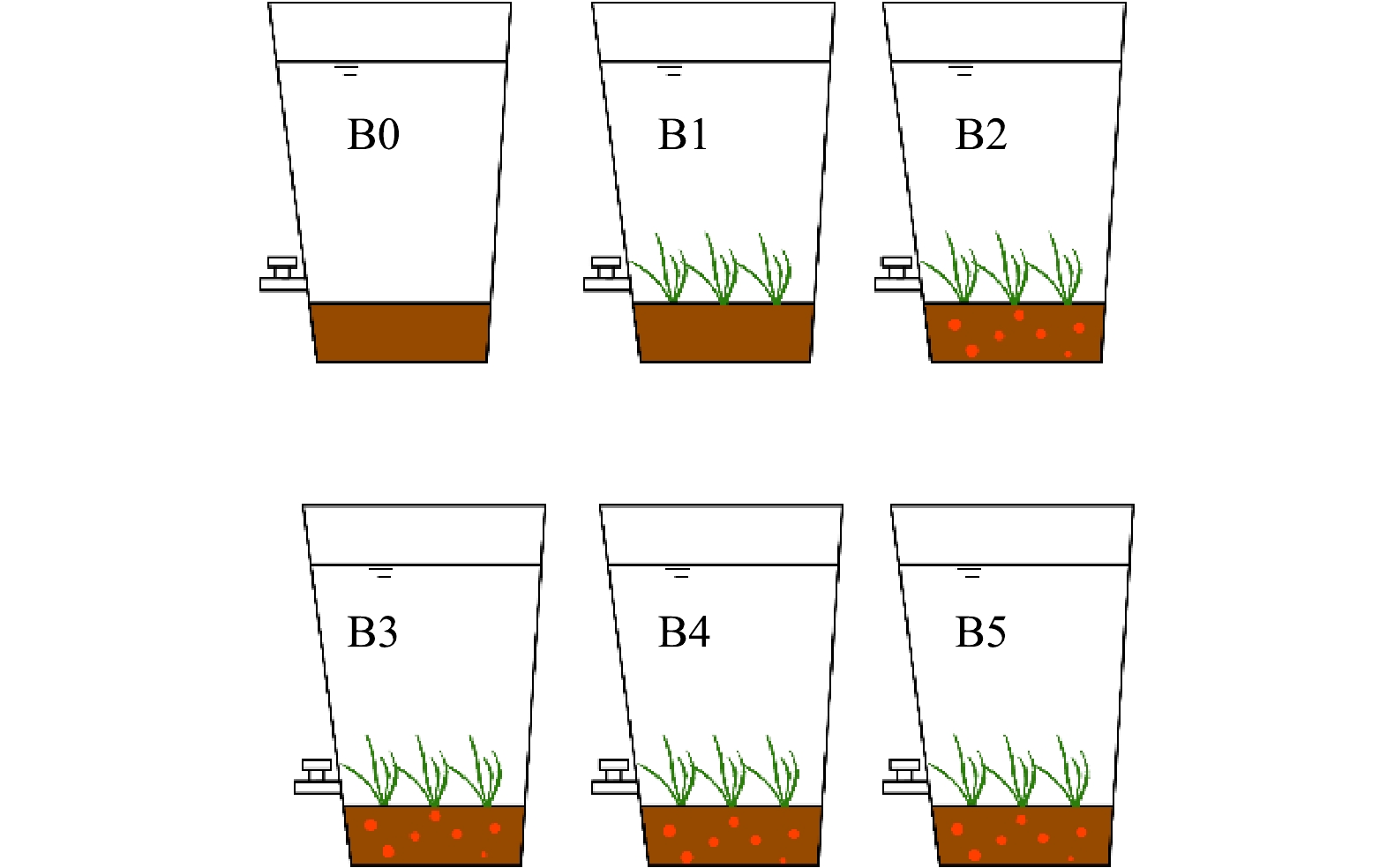
如图1所示,苦草水质净化模拟实验在聚乙烯塑料桶(直径60 cm,高80 cm)中进行,距地面20 cm处安装阀门,以便定期排水。实验装置被安置在一个人工搭建的温室大棚中,以避免雨水冲刷对实验过程干扰。
苦草栽培基质为土壤与生物炭或改性生物炭混合物,其中土壤采自安徽大学南门湿地,先风干、破碎、去枯枝落叶等杂质,后过60目筛网储存备用;实验开始前将生物炭及改性生物炭与处理后的土壤与按3%的比例混合,然后填充入聚乙烯塑料桶中,其中不加炭的实验组以土壤代替,记作B1,其他添加生物炭及改性生物炭的实验组分别记作B2、B3、B4、B5(改性剂FeCl3浓度分别为0.00、0.05、0.10、0.20 mol·L−1),每种基质设置3个平行,同时设置3组基质与B1组相同,但不种植苦草的实验装置作为空白对照组,记为B0,共18组。
移栽苦草幼苗前,往聚乙烯塑料桶中注入校园池塘水至水深10 cm左右,保持15 d后,在每个种植桶内均匀移栽株高14~16 cm的苦草植株40棵, 驯化培养15 d后于2022年5月1日开始苦草净化水质批次实验,每一批次实验周期为13 d。批次实验开始前先放空期种植桶中的残余水,注入人工配制的模拟地表污染水至液面距地面50 cm,水质如下:NH4+-N为(0.124±0.004) mg·L−1、TP为(0.58±0.02) mg·L−1、COD为(54.0±3.1) mg·L−1。
-
在循环批次实验期间,第2、5、8、11天从深10 cm处采集水样测定COD、NH4+-N、TP、TN浓度,每隔14 d采集种植桶中水生植物苦草样本,用自来水洗净后置于4 ℃冰盒保存,测定苦草生长、生理生化指标,叶片叶绿素含量的测定参照生理生化实验,根系活力采用TTC法,MDA含量采用硫代巴比妥酸法测定,POD采用愈创木酚法测定[23]。根据式(1)计算植物的相对伸长率。
式中:R为植物的相对伸长率,cm·d−1;L1为苦草植株实验开始的株高,cm;L2为实验结束时植物的株高,cm;t为植物的生长时间,d。
-
使用SPSS 26完成数据处理和分析, Origin进行绘图,采用单方差分析One-Way ANOVA方法,分析不同基质对苦草水质净化能力、生长特征以及生理生化特征的影响。
-
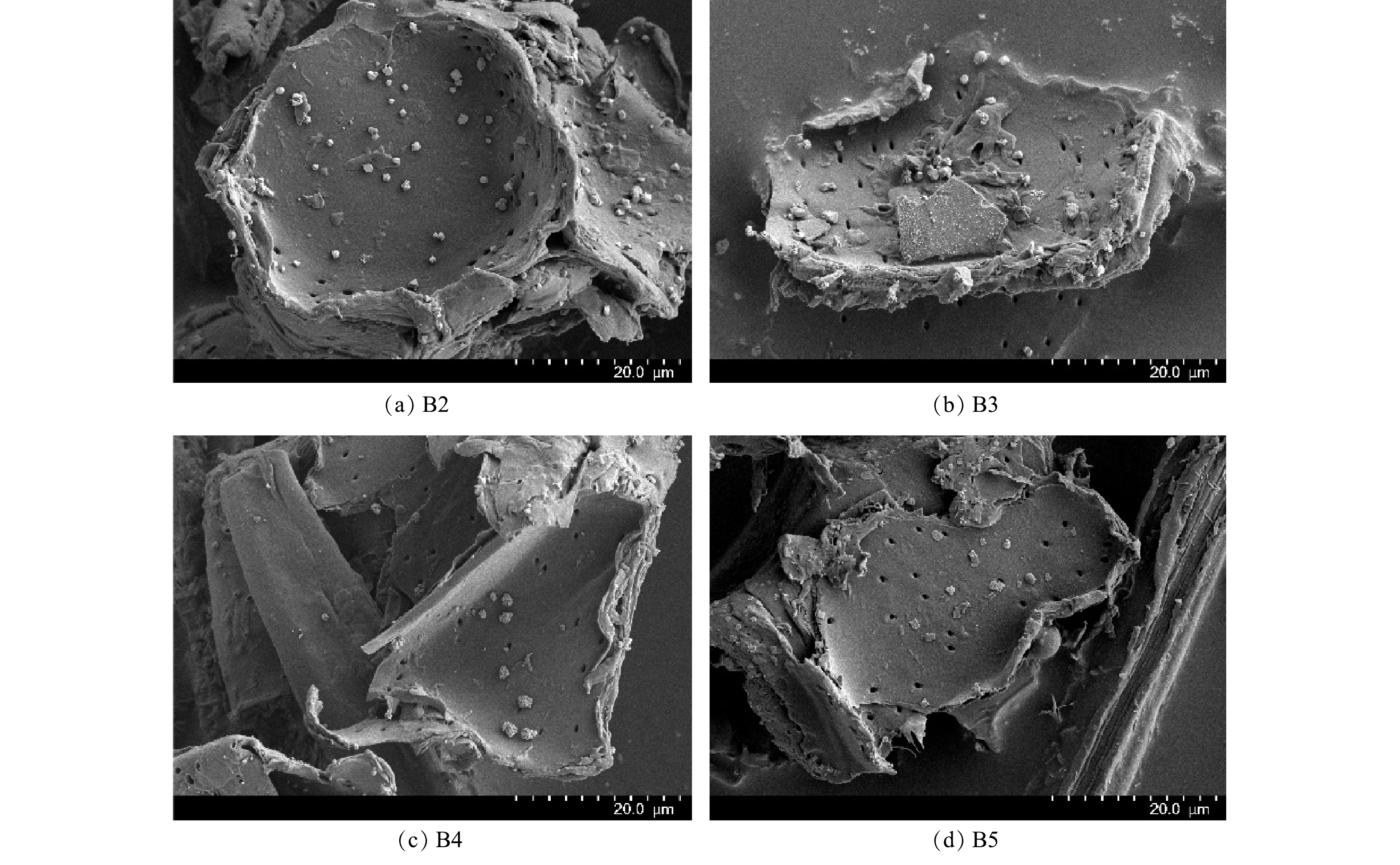
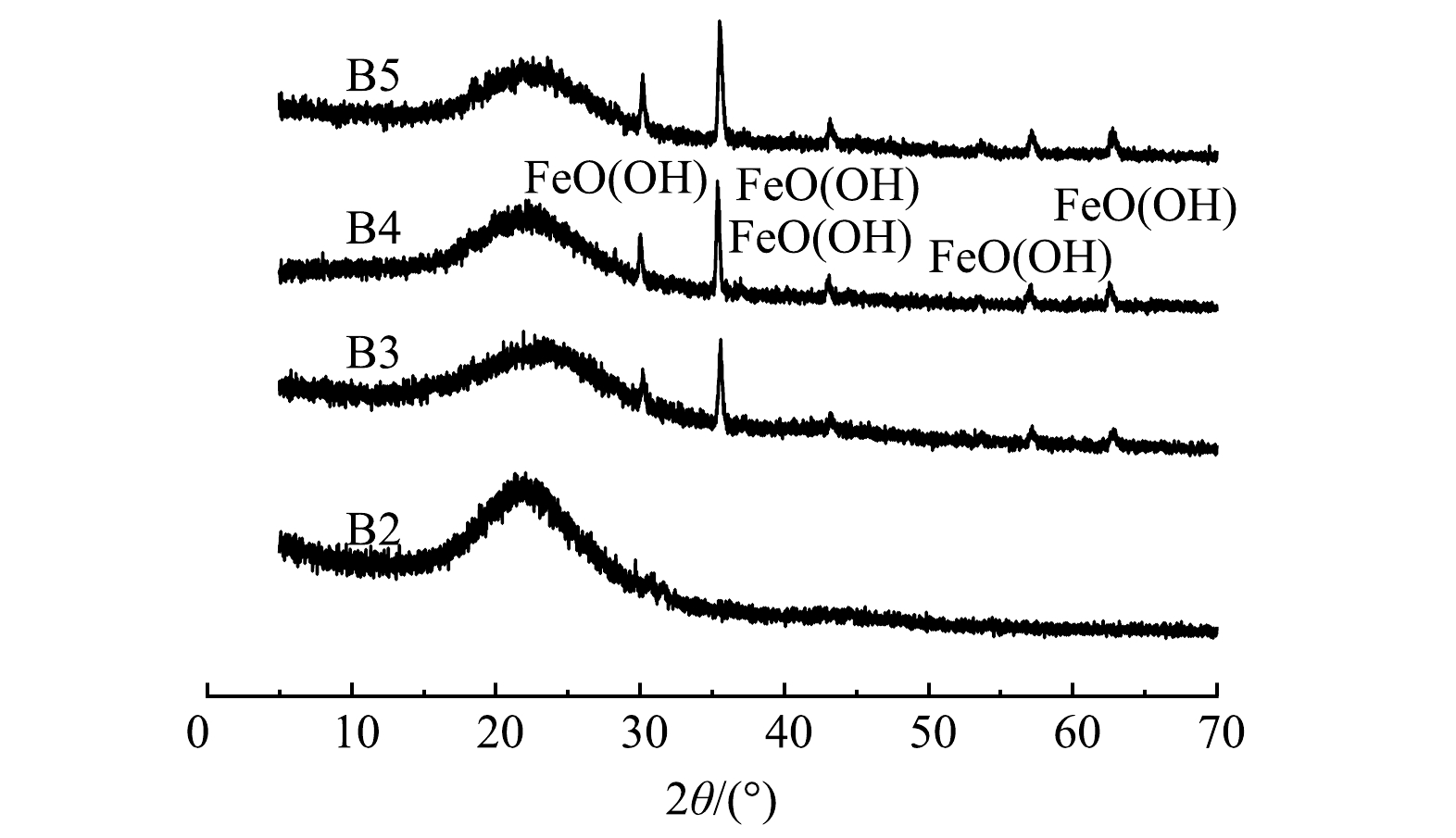
制备的铁改性生物炭的SEM表征结果和XRD图谱分别见图2和图3,由图2可以看出,经0.10 mol·L−1和0.20 mol·L−1 FeCl3改性的生物炭表面负载微米级絮状白色沉积颗粒。由图3可以看出,4种材料的XRD 图谱中在23.0°附近均出现碳的特征衍射峰。这主要是由于纤维素的存在。B3、B4、B5图谱衍射峰出现位置相同,均包含FeOOH的特征衍射峰,表明铁改性生物炭上负载了羟基氧化铁。
-
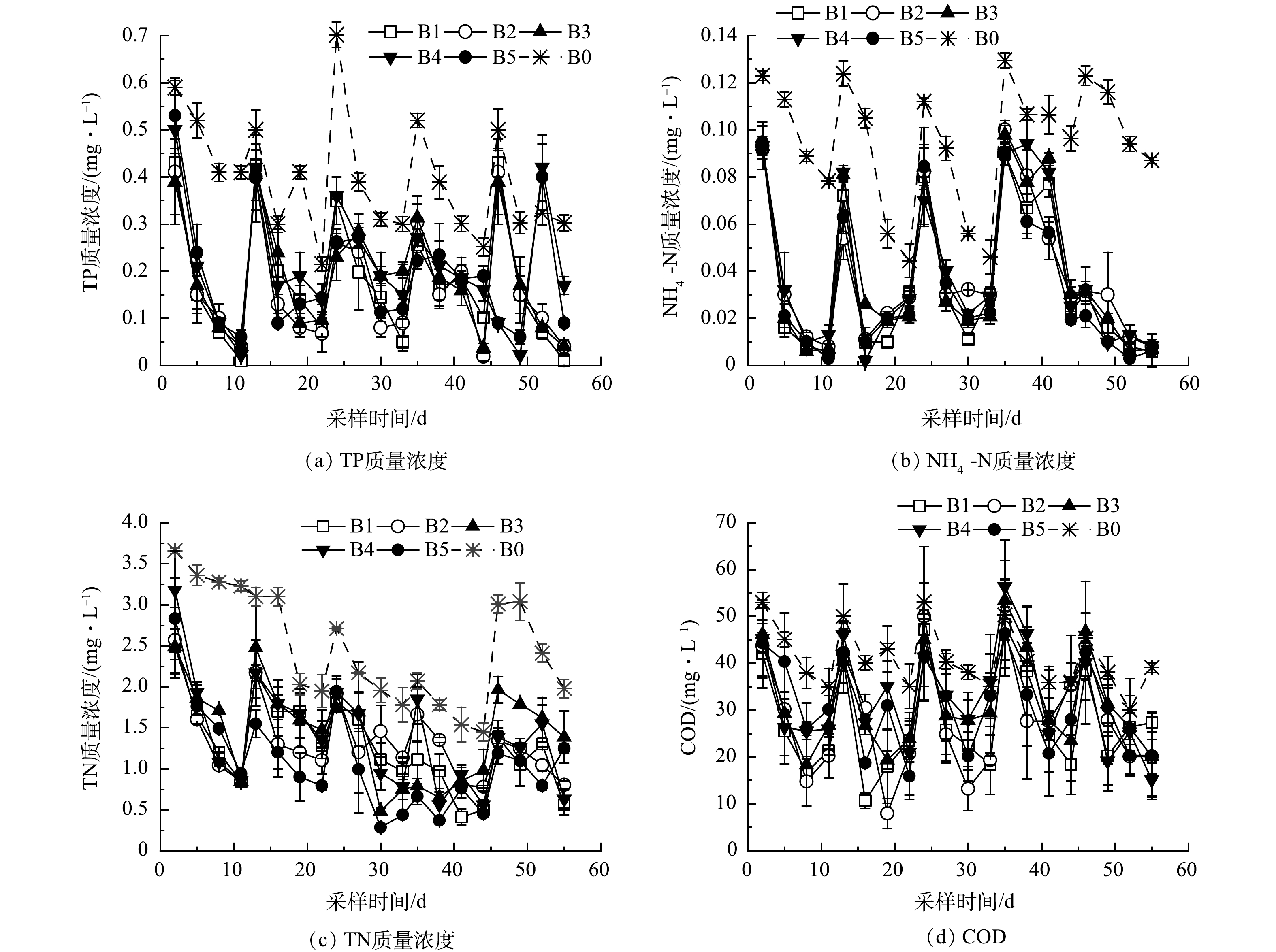
1)不同铁改性生物炭对TP净化的影响。循环批次实验周期内添加不同铁改性基质对系统TP 的影响如图4(a)所示,与初始进水质量浓度相比,B1组与B0组TP出水平均质量浓度分别下降了90.77%和47.18%。这表明苦草种植对水体TP去除起到重要作用,主要由于苦草生长对水中磷的吸收所致[19]。各实验组在批次循环实验周期内TP质量浓度均呈下降趋势,B2组TP平均去除率为91.13%,与B1组相差不大,表明基质中添加竹屑生物炭对其净化水中磷的影响不明显。
2)不同铁改性生物炭对N转化的影响。添加不同铁改性生物炭对系统净化NH4+-N、TN变化如图4(b)和图4(c)所示。与对照组相比,各实验组在批次实验期间出水质量浓度呈下降趋势。B0组NH4+-N平均去除率为42.84%,而B1组NH4+-N平均去除率为84.01%,表明苦草可增强水体中NH4+-N的去除;B2组NH4+-N平均去除率为82.90%,与B1组相比有所降低,可能是竹屑生物炭释放了少量NH4+-N所致;B3、B4、B5组NH4+-N平均去除率为86.09%、85.79%、88.59%,高于B2实验组,表明铁改性竹屑生物炭基质对水中NH4+-N去除有一定促进作用,这与铁改性竹屑生物炭对NH4+-N的吸附有关[24]。批次循环实验阶段B0、B1、B2、B3、B4、B5组TN的平均去除率分别为29.47%、71.47%、66.90%、61.65%、71.27%、73.88%。B1实验组TN去除率远高于B0,苦草对水中TN的去除有较好的强化作用;各实验组TN去除率均低于其NH4+-N去除率,实验过程中有一部分NH4+-N转化为硝酸盐或亚硝酸盐氮。
3) 不同铁改性生物炭对COD去除影响。添加不同铁改性生物炭对系统去除COD的特性如图4(d)所示,循环批次实验B0、B1组COD去除率分别为27.96%、56.21%,表明苦草种植对水中COD的去除具有增强效果。实验期间,COD去除率存在一定波动,可能与苦草根系分泌物释放有关[25-26];B2组COD平均去除率为53.90%,低于B1组,可能由于竹屑生物炭基质释放了COD所致。此外,B3、B4、B5组COD平均去除率分别为51.03%、46.97%、49.72%,与B2相比,随着改性铁负载量的增加,COD去除率呈现下降趋势。
-
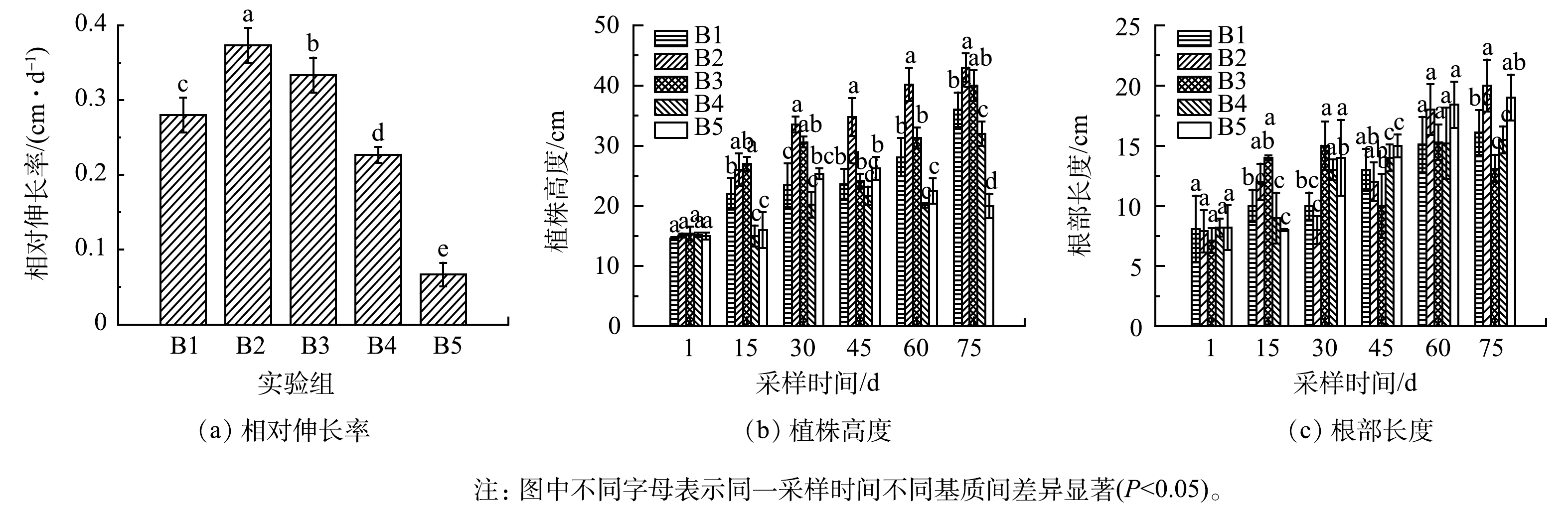
循环批次实验期间苦草株高和根长随时间的延长而不断增加,结果如图5所示。由此可以看出同时期B2组的苦草株高、根长和相对伸长率均高于其他实验组,循环批次实验期间B2组苦草相对伸长率达到0.373 cm·d−1,且B3、B4、B5组的相对伸长率呈下降趋势,其中B5相对伸长率只有0.070 cm·d−1,说明添加的0.10 mol·L−1和0.20 mol·L−1 FeCl3改性生物炭对苦草生长有抑制作用。
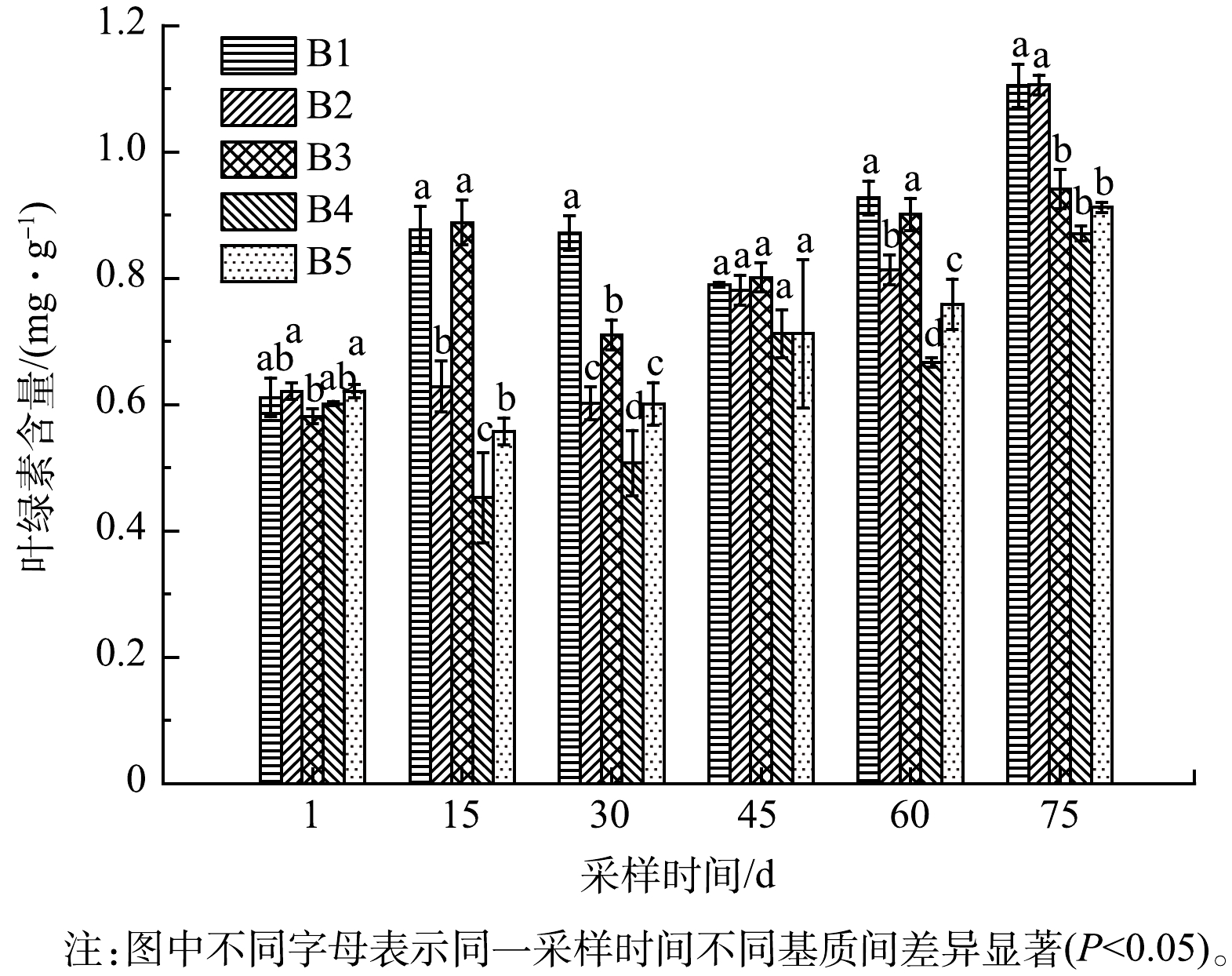
1)铁改性生物炭对净化系统苦草叶绿素含量的影响。叶绿素含量反映植物的光合速率和生长、衰老过程[27];植物生长基质不同,叶绿素含量也随之发生变化,可以确定植物对不同暴露环境的长期生化反应[28-29]。由图6可以看出,不同阶段苦草体内叶绿素含量不同。B1组基质为土壤,叶绿素chl-a 和chl-b含量在60 d和75 d时较高,为0.93 mg·g−1和1.11 mg·g−1,此阶段苦草生长旺盛,叶片叶绿素含量较高,B4、B5组在整个实验期间内叶绿素chl-a 和 chl-b的含量与B1组相比显著减少(P<0.05),表明高浓度铁改性的生物炭会抑制苦草光合作用,不利于其生长,植物叶绿素含量可以反映植物的光合作用水平[30],添加铁改性生物炭的B4、B5组植物光合作用明显较弱。
2)铁改性生物炭对净化系统苦草POD活性的影响。有毒物质的胁迫会降低植物代谢活性,诱导植物细胞中活性氧(ROS)的产生[31],一些活性氧自由基可能破坏细胞膜,导致植物生长减少和潜在死亡[32],为了避免ROS的有害影响,植物细胞中通过增加抗氧化酶活性、改变脂质过氧化、增加抗氧化防御能力,形成了一套抗氧化防御机制。POD是植物叶片衰老过程中产生的一种抗氧化酶,是植物抗衰老的重要成分,可以清除植物体内多余的氧自由基[33]。如图7(a)所示,实验中,B1组的POD活性保持稳定且较低,实验组不同基质和不同时间苦草叶片内POD活性存在显著性差异(P<0.05)。采样时间为60 d时,B5组 POD活性性最高,未添加铁改性生物炭基质的B2组PDO活性与B1组活性变化不大,添加铁改性生物炭基质的B3组在 60 d前,POD活性与B1、B2组接近,而B4、B5组POD活性在整个实验期间升高显著(P<0.05)。
3)铁改性生物炭对净化系统苦草根系活力的影响。根系活力反映植物根系的生长生理状况,如图7(b)所示,60 d各实验组根系活力达到最大值。与B1组相比,B2、B3实验组的根系活力更高,这与苦草根长变化规律基本一致,由此可知投加一定量的竹屑生物炭或低浓度铁改性竹屑生物炭能提供苦草生长所需要的微量元素,从而促进苦草根系生长[34];实验期间B4组、B5组根系活力较低,根系生长受到抑制。
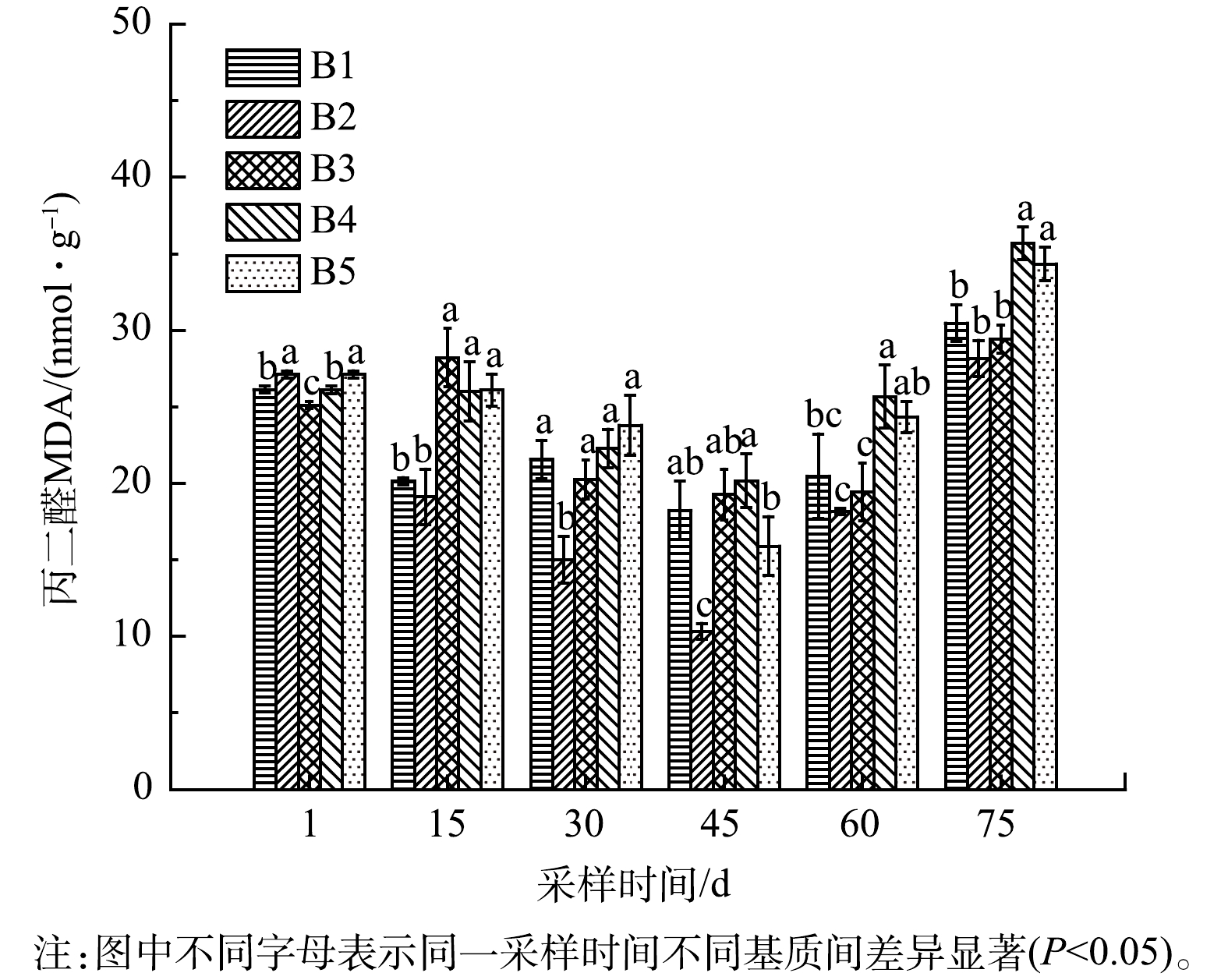
4) 铁改性生物炭对净化系统苦草MDA含量的影响。丙二醛(MDA)是脂质过氧化的最终产物,通常被用作氧化损伤的生物标志物[35]。如图8所示,各实验组苦草MDA含量均呈现先下降后升高的趋势,实验期间苦草MDA含量的增加,植物细胞膜质过氧化水平加深。MDA含量在不同实验组及苦草不同生长时间存在显著差异(P<0.05),生物炭和铁改性生物炭基质的添加,对水生植物苦草的影响不同,苦草栽种稳定生长阶段,添加3%的竹屑生物炭基质的B2组MDA含量显著低于其他各组,表明添加一定量的竹屑生物炭有助于提高苦草抗氧化损伤[36];实验组B3、B4、B5中苦草体内MDA含量差异显著(P<0.05),其中B3组MDA含量较低,对植物损伤较小,随着改性铁浓度升高,实验后期MDA含量逐渐增大,表明添加过高浓度的FeCl3改性生物炭基质,对植物生长不利,诱导了细胞脂质过氧化,导致细胞膜受损[37]。
-
已有研究[38]表明,生物炭或铁改性生物炭的添加对净化系统磷的去除影响复杂,在磷浓度较低的水体中添加生物炭或铁改性竹屑生物炭,存在抑制或促进苦草对磷的吸收,其自身亦可能会析出可溶性磷。铁改性生物炭中铁主要以非晶态羟基氧化铁的形式存在,其具有较强的吸附磷酸盐的能力[39];一方面铁改性生物炭负载的羟基氧化铁增强了其对磷的吸附能力,另一方面羟基氧化铁的负载导致生物炭吸附点位减少,从而降低了系统对磷的去除。本实验通过苦草水质净化模拟系统,结果表明,B3、B4、B5组平均去除率分别为86.29%、76.59%、78.03%,低于B2组,说明铁改性竹屑生物炭的添加对苦草净化磷具有一定抑制效果。本文研究结果表明,铁改性竹屑生物炭的添加对水中NH4+-N去除有一定的促进效果,与铁改性生物炭对NH4+-N的化学吸附有关,因为改性后活性炭表面负电荷增加,而NH4+-N带正电荷,铁阳离子与水体中NH4+-N发生交换,从而提高了净化系统对NH4+-N的去除效果[24] 。一方面由于添加的铁改性竹屑生物炭的吸附特性影响水质,另一方面添加的竹屑生物炭基质为苦草提供生长基础,影响植物根系向周围环境的延伸,进而改变植物根系对污染物的吸附,最终影响苦草自身对水质净化效果。各实验组COD在批次实验期间波动较大,部分天数去除率为负值,这是竹屑生物炭或铁改性生物炭的添加影响水中有机物的生物降解及土壤中溶解性有机质的释放的综合结果[40]。
苦草在氮、磷质量浓度较高的基质中生物量较大[41],基质中氮、磷可为苦草生长提供养分。本研究结果表明,添加不同基质对苦草生长有着显著影响。各实验组中,添加3%的竹屑生物炭作为苦草生长基质,苦草相对伸长率最高。这与生物炭对一些植物生长具有促进作用的研究结果相吻合[42]。B5组相对伸长率最低,添加铁改性生物炭作为苦草生长基质,对苦草生长有抑制作用,铁改性浓度越高,抑制作用越显著,同时高浓度铁改性的生物炭基质的苦草的生长代谢速率较低,与实验组苦草株高、根长和相对伸长率研究结果相一致。进一步研究苦草生理生化指标,B4、B5组POD活性在实验过程中处于较高水平,推断添加铁改性生物炭基质会产生的活性氧(ROS)导致氧化应激反应,诱导了抗氧化酶的合成,以使机体适应因基质改变诱导的环境压力[43],B4组、B5组根系活力较低,根系生长受到抑制,添加高浓度铁改性生物炭改变了植物生长根系周围氧化还原电位,造成厌氧环境和硫化物的积累,加剧了对植物的损害[44]。添加3%的竹屑生物炭的B2组MDA显著低于其他各组,表明添加一定量的竹屑生物炭有助于提高苦草抗氧化损伤。铁是植物生长所必需的营养元素,直接参与电子传递、氧化应激、固氮和激素合成[45],但苦草对其最适需用量和致毒用量之间存在一个阈值水平,添加3%、0.05 mol·L−1 FeCl3改性生物炭基质B3组,实验过程中,植物生长状况,生化指标与B0组接近,综合考虑该实验条件下根系活力、POD活性、叶绿素、株高和根长等生理生化及生长特性指标,认为在苦草生长基质中按3%比例投加0.05 mol·L−1 FeCl3改性生物炭可以作为强化苦草水质净化系统功能的基质调控策略。
-
1) 苦草对水体氮、磷具有较好的净化去除效果。
2) 苦草通过抗氧化防御系统表现出对低浓度FeCl3改性生物炭的耐受性,高浓度FeCl3改性生物炭的毒性抑制性。
3) 0.05 mol·L−1 FeCl3改性竹屑生物炭在强化苦草净化水质,促进苦草生长具有一定的应用潜力。
4) 3%比例添加0.05 mol·L−1 FeCl3改性生物炭可以作为强化苦草水质净化系统功能的基质调控策略。
铁改性竹屑生物炭的添加对苦草 (Vallisneria spiralis)水质净化及其生理特性的影响
Effect of adding iron-modified bamboo biochar on water purification and physiological characteristics of Vallisneria spiralis
-
摘要: 利用苦草水质净化模拟系统,通过循环批次实验考查在系统基质中添加3%的不同浓度FeCl3改性竹屑生物炭对系统水质净化效果和苦草生理生化特性的影响。结果表明,栽种苦草提高了系统净化NH4+-N、TN、TP、COD的效率。随着FeCl3浓度的升高,系统净化NH4+-N的效果增强,TN的效果影响不大,而COD、TP的效果降低。添加3%的0.10 mol·L−1和0.20 mol·L−1 FeCl3改性竹屑生物炭抑制苦草生长及其光合作用,导致苦草体内过氧化物酶 (POD) 活性增强及丙二醛(MDA)含量升高,诱导了细胞脂质过氧化;添加3%的0.05 mol·L−1 FeCl3改性竹屑生物炭,促进苦草根系生长,提升苦草根系活力。低浓度(0.05 mol·L−1)FeCl3改性竹屑生物炭在强化水质净化,促进苦草生长恢复具有一定的应用潜力。Abstract: In this study, a simulation system of water purification planted with Vallisneria spiralis was used to investigate the effect of adding 3% ration of bamboo biochar modified with different concentrations FeCl3 to the system as substrate on the water purification efficiency, physiological and biochemical characteristics of Vallisneria spiralis. The results showed that planting Vallisneria spiralis improved the purification effect of NH4+-N, TN, TP and COD in the system. With the increase of FeCl3 concentration, NH4+-N removal effect by the system increased, slight TN removal effect occurred, while the removal effects of COD and TP decreased. The addition of 3% ratio of bamboo biochar modified with 0.10 mol·L−1, 0.20 mol·L−1 FeCl3 could inhibit the growth and photosynthesis of Vallisneria spiralis, resulting in the increase of peroxidase (POD) activity and malondialdehyde (MDA) content in Vallisneria spiralis, and inducing cell lipid peroxidation. The addition of 3% biochar modified with 0.05 mol·L−1 FeCl3 could promote the roots growth of Vallisneria spiralis and enhance the root activity of Vallisneria spiralis. The addition of biochar modified with low concentration (0.05 mol·L−1) FeCl3 has a certain application potential in strengthening water purification and promoting the growth and recovery of Vallisneria spiralis.
-
Key words:
- iron-modified biochar /
- Vallisneria spiralis /
- substrate /
- water purification
-

-
-
[1] GAO H, QIAN X, WU H, et al. Combined effects of submerged macrophytes and aquatic animals on the restoration of a eutrophic water body: A case study of Gonghu Bay, Lake Taihu[J]. Ecological Engineering, 2017, 102: 15-23. doi: 10.1016/j.ecoleng.2017.01.013 [2] DHOTE S, DIXIT S. Water quality improvement through macrophytes-a review[J]. Environmental Monitoring and Assessment, 2009, 152(1-4): 149-153. doi: 10.1007/s10661-008-0303-9 [3] 陈灿, 王国祥, 朱增银, 等. 城市人工湖泊水生植被生态恢复技术[J]. 湖泊科学, 2006(5): 523-527. [4] RODRIGO M A. Wetland restoration with hydrophytes: A review[J]. Plants -Basel, 2021, 10(6): 1035. doi: 10.3390/plants10061035 [5] 朱义, 张群, 刘家霖, 等. 沿岸用地状况对中小河道沉水植物定居光照强度的影响[J]. 环境科学学报, 2021, 41(6): 2414-2420. [6] 闫志强, 刘黾, 吴小业, 等. 温度对五种沉水植物生长和营养去除效果的影响[J]. 生态科学, 2014, 33(5): 839-844. [7] YIN X, ZHANG J, HU Z, et al. Effect of photosynthetically elevated pH on performance of surface flow-constructed wetland planted with Phragmites australis[J]. Environmental Science and Pollution Research, 2016, 23: 15524-15531. doi: 10.1007/s11356-016-6730-1 [8] LIU Y, BAI G, ZOU Y, et al. Combined remediation mechanism of bentonite and submerged plants on lake sediments by DGT technique[J]. Chemosphere, 2022, 298: 134236. doi: 10.1016/j.chemosphere.2022.134236 [9] SONG Y Z, WANG J Q, GAO Y X. Effects of epiphytic algae on biomass and physiology of Myriophyllum spicatum L. with the increase of nitrogen and phosphorus availability in the water body[J]. Environmental Science And Pollution Research, 2017, 24(10): 9548-9555. doi: 10.1007/s11356-017-8604-6 [10] YAMG Y, ZHAO Y, LIU R, et al. Global development of various emerged substrates utilized in constructed wetlands[J]. Bioresource Technology, 2018, 261: 441-452. doi: 10.1016/j.biortech.2018.03.085 [11] GAO P, ZHANG Y, WANG S. Increasing the hydrophyte removal rate of dissolved inorganic phosphorus using a novel Fe-Mg-loaded activated carbon hydroponic substrate with adsorption-release dual functions[J]. Journal of Environmental Management, 2022, 313: 114998. doi: 10.1016/j.jenvman.2022.114998 [12] 宗小香, 闵梦月, 孙广芳, 等. 铁-碳内电解质下4种水生植物的净水效果[J]. 应用生态学报, 2016, 27(7): 2084-2090. [13] 孙耀胜, 么强, 刘竞依, 等. 生物炭材料在水体有机污染治理中的研究进展[J]. 环境科学与技术, 2021, 44(01): 170-180. [14] 费颖恒, 邓海燕, 李敏烯, 等. 富硅生物炭对重金属污染土壤的改良修复作用[J]. 环境科学与技术, 2021, 44(12): 177-184. [15] ZHANG C, LIU L, ZHAO M, et al. The environmental characteristics and applications of biochar[J]. Environmental Science And Pollution Research, 2018, 25(22): 21525-21534. doi: 10.1007/s11356-018-2521-1 [16] HUANG C, WANG W, YUE S, et al. Role of biochar and Eisenia fetida on metal bioavailability and biochar effects on earthworm fitness[J]. Environmental Pollution, 2020, 263(Pt A): 114586. [17] ASADVAR L, XU C Y, WALLACE H M, et al. Soil-plant nitrogen isotope composition and nitrogen cycling after biochar applications[J]. Environmental Science and Pollution Research, 2021, 28(6): 6684-6690. doi: 10.1007/s11356-020-11016-3 [18] GALE N V, THOMAS S C. Dose-dependence of growth and ecophysiological responses of plants to biochar[J]. Science of the Total Environment, 2019, 658: 1344-1354. doi: 10.1016/j.scitotenv.2018.12.239 [19] 张瑄文, 李三姗, 甘琳, 等. 生物质炭对苦草(Vallisneria spiralis)种子萌发与生长的影响[J]. 湖泊科学, 2018, 30(4): 1041-1051. doi: 10.18307/2018.0417 [20] MURAD H A, AHNAD M, BUNDSCHUH J, et al. A remediation approach to chromium-contaminated water and soil using engineered biochar derived from peanut shell[J]. Environmental Research, 2022, 204(Pt B): 112125. [21] FREY P A, REED G H. The ubiquity of iron[J]. ACS Chemical Biology, 2012, 7(9): 1477-1481. doi: 10.1021/cb300323q [22] FANG W C, KAO C H. Enhanced peroxidase activity in rice leaves in response to excess iron, copper and zinc[J]. Plant Science, 2000, 158(1): 71-76. [23] SUI F, KANG Y, WU H, et al. Effects of iron-modified biochar with S-rich and Si-rich feedstocks on Cd immobilization in the soil-rice system[J]. Ecotoxicological and Environmental Safety, 2021, 225: 112764. doi: 10.1016/j.ecoenv.2021.112764 [24] 高义霞, 周向军, 张继, 等. 山药过氧化物酶的特性及抑制研究[J]. 食品工业科技, 2011, 32(7): 105-108. [25] PANCHAL P, PREECE C, PENUELAS J, et al. Soil carbon sequestration by root exudates[J]. Trends in Plant Science, 2022, 27(8): 749-757. doi: 10.1016/j.tplants.2022.04.009 [26] 孙磊, 向平, 张智, 等. 潜流—表流复合人工湿地处理超TN含量废水[J]. 水处理技术, 2020, 46(4): 97-105. [27] CHAI Y N, SCHACHTMA D P. Root exudates impact plant performance under abiotic stress[J]. Trends in Plant Science, 2022, 27(1): 80-91. doi: 10.1016/j.tplants.2021.08.003 [28] JIAO L, DING H, WANG L, et al. Bisphenol A effects on the chlorophyll contents in soybean at different growth stages[J]. Environmental Pollution, 2017, 223: 426-434. doi: 10.1016/j.envpol.2017.01.042 [29] ZHANG M, CAO T, NI L, et al. Carbon, nitrogen and antioxidant enzyme responses of Potamogeton crispus to both low light and high nutrient stresses[J]. Environmental and Experimental Botany, 2010, 68(1): 44-50. doi: 10.1016/j.envexpbot.2009.09.003 [30] 李晓红, 晏再生, 江和龙. 直流电场对沉水植物苦草(Vallisneria natans)生长的影响[J]. 湖泊科学, 2016, 28(5): 1023-1030. [31] IMTIAZ M, ASHRAF M, RIZWAN M S, et al. Vanadium toxicity in chickpea (Cicer arietinum L. ) grown in red soil: Effects on cell death, ROS and antioxidative systems[J]. Ecotoxicological and Environmental Safety, 2018, 158: 139-144. doi: 10.1016/j.ecoenv.2018.04.022 [32] 陶正凯, 荆肇乾, 陈蕾, 等. 基于胁迫影响的人工湿地植物筛选研究进展[J]. 生态科学, 2019, 38(6): 184-189. [33] 徐荣乐, 海热提. 塑料地膜对小麦种子萌发及幼苗抗氧化酶系统的影响[J]. 生态环境学报, 2010, 19(11): 2702-2707. [34] 程扬, 刘子丹, 沈启斌, 等. 秸秆生物炭施用对玉米根际和非根际土壤微生物群落结构的影响[J]. 生态环境学报, 2018, 27(10): 1870-1877. [35] DAVEY M W, STALS E, PANIS B, et al. High-throughput determination of malondialdehyde in plant tissues[J]. Analytical Biochemistry, 2005, 347(2): 201-207. doi: 10.1016/j.ab.2005.09.041 [36] ELNAGGA A, ELNAGGA A H, SHAHEEN S M, et al. Biochar composition-dependent impacts on soil nutrient release, carbon mineralization, and potential environmental risk: A review[J]. Journal of Environmental Management, 2019, 241: 458-467. [37] YUAN L, RICHARDSON C J, HO M, et al. Stress responses of aquatic plants to silver nanoparticles[J]. Environmental Science & Technology, 2018, 52(5): 2558-2565. [38] WANG Q, XU L, GUO D, et al. The continuous application of biochar in field: effects on P fraction, P sorption and release[J]. Chemosphere, 2021, 263: 128084. doi: 10.1016/j.chemosphere.2020.128084 [39] WU L, ZHANG S, WANG J, et al. Phosphorus retention using iron (II/III) modified biochar in saline-alkaline soils: adsorption, column and field tests[J]. Environmental Pollution, 2020, 261: 114223. doi: 10.1016/j.envpol.2020.114223 [40] 王冬, 刘畅, 李檬, 等. 含腐殖酸还原菌的污泥降解底泥中溶解性有机质[J]. 环境工程, 2019, 37(6): 150-154. [41] 王磊, 胡效卿, 张卓伦, 等. 不同水深和基质下苦草(Vallisneria natans)的生理生态适应策略[J]. 生态学杂志, 2021, 40(8): 2421-2430. [42] LI W, ZHOU J, DING H, et al. Low-dose biochar added to sediment improves water quality and promotes the growth of submerged macrophytes[J]. Science of the Total Environment, 2020, 742: 140602. doi: 10.1016/j.scitotenv.2020.140602 [43] MALECKA A, KONKOLEWSKA A, HANC A, et al. Insight into the phytoremediation capability of brassica juncea (v. Malopolska): metal accumulation and antioxidant enzyme activity[J]. International Journal of Molecular Sciences. 2019, 20(18): 4355. [44] 魏秋, 王春荣, 宋俊学, 等. 硫/铁硫化物自养反硝化脱氮除磷研究进展[J]. 工业水处理, 2022, 42(12): 10-16. [45] 骆凤, 张义, 韩帆, 等. 硅酸盐矿物麦饭石对沉水植物苦草(Vallisneria spiralis)生长的促进效应[J]. 湖泊科学, 2020, 32(4): 999-1007. -



 下载:
下载: