-
镉是对人体健康影响很大且具有致癌作用的有毒重金属,其在环境中通常以Cd2+形式存在[1 − 4]. 据2014年发布的《全国土壤污染状况调查公报》,我国土壤镉含量的点位超标率达7.0%,成为土壤中最主要的污染物之一[5 − 7]. 由于镉的高毒性,世界卫生组织(WHO)将饮用水中允许浓度设为3 μg·L−1. 因此,镉污染水体和土壤的修复近年来受到广泛关注.
重金属污染水体或土壤修复的方法有很多,如吸附法、离子交换法、膜法、电化学和重力沉降法等[8 − 9]. 其中,吸附法因其简便、有效而被广泛应用[10 − 11],常用的吸附材料包括黏土矿物、金属氧化物、生物炭和纳米材料等[12],但目前来看,上述钝化材料仍存在制备工艺复杂、成本较高以及能否保持长效性的问题, 因此寻找一种能够价格低廉、制备工艺简单的吸附钝化材料十分关键.
纳米零价铁(nZVI)具有绿色环境友好、比表面积大、吸附位点丰富等优点,近年来广泛应用于镉污染土壤修复和含镉废水的处理[13 − 15]. 但nZVI在水溶液中会快速凝聚且易被氧化腐蚀,从而使吸附效果降低,如Zhang等报道nZVI吸附镉出现解吸现象[15]. 海泡石(SEP)是一种土壤中广泛应用的2:1型多孔结构黏土矿物之一,呈碱性,具有很强的表面吸附和阳离子交换能力[16 − 20],其具有较大的比表面积、结构稳定、极易获取和价格低廉等优点,其对镉也具有较好的吸附效果[21 − 24],如若用其作为nZVI的载体,可以极大程度上解决其易凝聚和腐蚀性过强等不足,并能够显著提高nZVI在土壤中对砷镉的吸附效果并维持其长效性的吸附作用. 据报道,添加30 g·kg−1纳米零价铁改性沸石可使土壤中酸提取态Cd降低30%以上,Habish等利用纳米零价铁改性的海泡石吸附Cd,并筛选出海泡石和纳米零价铁(S-nZVI)的最佳比例[25];亦有研究表明,S-nZVI可以更有效地去除水溶液中的Cr(Ⅵ),这是因为nZVI颗粒稳定性得到了改善,提供了与Cr(Ⅵ)相互作用的高表面积[26 − 28].
基于此,本研究以一种简便的工艺制备海泡石负载纳米零价铁,通过进行批量吸附实验和动力学实验,探讨pH、吸附剂添加量、共存离子等对S-nZVI吸附Cd的影响,利用X射线光电子能谱(XPS)和X射线衍射(XRD)等方法分析深度探究S-nZVI对Cd的吸附效果及其吸附机理,并最终用土壤实验验证其在土壤中的钝化效果,相关结果为应用S-nZVI修复Cd(Ⅱ)污染水体和土壤提供了一种有效制剂.
-
将60.0 g天然海泡石微粉浸泡在2 mol·L−1 HCl溶液中,在80 ℃下磁搅拌8 h. 然后用去离子水反复冲洗,直到用AgNO3测试无法检测Cl−. 然后,将样品分散在去离子水(75 mL)和乙醇(75 mL)的混合溶液中,超声处理(200 W, 24 kHz)2 h,对悬浮液中的团聚体进行破碎.
5000 r·min−1离心,收集上清液,用去离子水洗涤几次,105 ℃烘干,最终产物为酸化后的海泡石. 海泡石改性纳米零价铁(S-nZVI)的合成制备使用液相还原法[20,28],所有的合成操作都在常温常压条件下进行,不需要氮气保护. 将预处理后的海泡石与0.24 mol·L−1 FeCl3·6H2O溶液完全混合,搅拌均匀数小时制成悬浊液,超声30 min后,倒入三颈烧瓶中,与FeCl3·6H2O溶液按照1:1体积比制备后匀速向烧瓶中滴加0.98 mol·L−1 NaBH4溶液. 持续搅拌,滴加完毕后继续反应,反应结束后倒入烧杯中,立即用外加磁场沉降分离. 用去离子水洗涤改性材料3次,去除残留的氯化物和硼氢化物,快速磁分离收集后冷冻干燥,保存于干燥器内备用. -
制备500 mg·L−1的镉储备液并保存于4 ℃冰箱备用. 稀释储备液并配制不同初始浓度的溶液以开展批量吸附实验,溶液pH用0.1 mol·L−1的NaOH或HCl溶液调节,背景溶液为10 mmol·L−1 NaCl.
(1)吸附动力学实验
取0.5 g吸附材料加到500 mL的20 mg·L−1的Cd(Ⅱ)溶液,初始pH调至7.0,控制温度25 ℃,振荡速率为180 r·min−1,每个处理设置3组平行对照. 吸附时间为24 h,在一定的间隔时间时取2 mL上清液,随即用0.22 µm醋酸纤维滤膜过滤,滤液保存至4 ℃冰箱待测.
(2)等温吸附实验
设置一系列不同Cd(Ⅱ)初始浓度(5—500 mg·L−1)的溶液,S-nZVI添加量为1 g·L−1溶液初始pH=7,温度控制为25 ℃,振荡速率为180 r·min−1,吸附时间为14 h,在一定间隔时间取2 mL上清液,随即用0.22 µm醋酸纤维滤膜过滤,滤液保存至4 ℃冰箱待测.
(3)环境因素对吸附效果的影响
为探究不同pH对吸附效果的影响,设置溶液不同初始pHi梯度为3.0、4.0、5.0、6.0、7.0、8.0、9.0,各处理中添加等量吸附剂(0.03 g),用浓度为20 mg·L−1的Cd(Ⅱ)溶液(10 mmol·L−1NaCl为背景溶液)进行批量吸附试验,14 h后取上清液样品,随即用 0.22 µm 醋酸纤维滤膜过滤,取部分滤液测定反应终点pHf值,剩余滤液保存测定重金属浓度.
为进一步探究溶液中赋存离子和有机质对吸附效果影响,选用0.01 mol·L−1的Ca2+、Mg2+、NO3−、SO42−、PO43−和200 mg·L−1的腐殖酸(HA)等有机和无机离子测试其对S-nZVI吸附Cd(Ⅱ)的影响. Cd(Ⅱ)初始浓度为20 mg·L−1,pH=7.0,S-nZVI吸附剂添加量为1 g·L−1.
-
取100 g砷镉复合污染土壤,按照质量比添加不同质量的海泡石改性纳米零价铁(材料添加量为0、1%、3%、5%添加量),土壤水分条件分别设置为淹水、70%田间持水量和干湿交替,所有处理在25 ℃下培养36 d. 每个处理设置3个平行,分别在第2、10、18、28、36天取样,测定有效镉和铁的含量. 土壤有效Cd采用0.01 mol·L−1的CaCl2提取(土:溶液=1:10).
-
待上述溶液体系中吸附反应进行完毕后,使用电感耦合等离子体发射光谱法(ICP-OES,Agilent
5110 )测定上清液中Cd(Ⅱ)的浓度. 材料均通过冷冻干燥,取部分材料测定pH. 具体测试方法如下:取已过100目的材料1 g与去CO2水(煮沸10 min,冷却)以1:10(W/V)的比例混合,在25 ℃下磁力搅拌器30 min,静置1 h,用pH电极(Seven Excellence TM, S470, Mettler Toledo, Swit)进行测定.吸附前后的材料利用SEM、XRD和XPS技术对制备的材料进行光谱表征分析. 具体测试方法如下:使用全自动比表面积及孔隙度分析仪(BET,Belsorp-Mini Ⅱ analyzer,Japan)在氮气吸附-解吸实验中测定材料比表面积. 使用扫描电镜-能量散射仪(SEM, HITACHI SU8100)测定材料表面形貌和粒径;使用X射线衍射仪(XRD,Rigaku Ultima IV)测定材料的晶型结构,并应用JADE6.5软件对XRD图谱进行拟合分析;使用X射线电子能谱仪(XPS,Thermo Scientific K-Alpha)测定材料的价态和键合方式,并应用Avantage5.9921软件对XPS数据分析.
-
吸附量qe为单位质量的材料所能吸附重金属的量,单位为mg·g−1. 去除率为RE(%),分别通过下述公式(1)和(2)进行计算:
式中,qe是达到吸附平衡时的吸附量(mg·g−1),V是溶液体积(mL),Ce和C0是平衡浓度和初始浓度(mg·L−1), m是吸附剂质量(g).
一级动力学和二级动力学模型拟合方程利用公式(3)和(4)进行计算:
吸附等温线试验的结果用Langmuir和Freundlich模型进行拟合分析,拟合公式如(5)和(6)所示:
Langmuir方程模型:
Freundlich方程模型:
用分离因子(RL)的无因次平衡常数研究了Langmuir吸附等温线的适用性,RL>1是不稳定吸附,RL<1是有效吸附,RL=0是不可逆吸附[29],并给出了其表达式(7):
所有实验数据用Excel整理并用Origin pro 2021进行分析制图,数据结果以平均值±SD(标准差)表示.
-
如表1所示,原始海泡石(SEP)材料呈弱碱性,其表面的游离羟基可能会释放出来提升环境氢氧根离子浓度,有利于重金属阳离子的吸附[30 − 31]. 酸化后pH从8.26降低到7.62,但通过零价铁在其表面进一步负载后合成的S-nZVI,pH相比海泡石值增加到9.10. SEP、酸化后的SEP、零价铁负载后的SEP的水合粒径逐渐升高,其主要由于酸化和改性后的海泡石表面负载了更多的H+和Fe(Ⅱ)和Fe(Ⅲ),这些阳离子会进一步促进体系的水解过程,从而提高了改性材料的水合粒径.
-
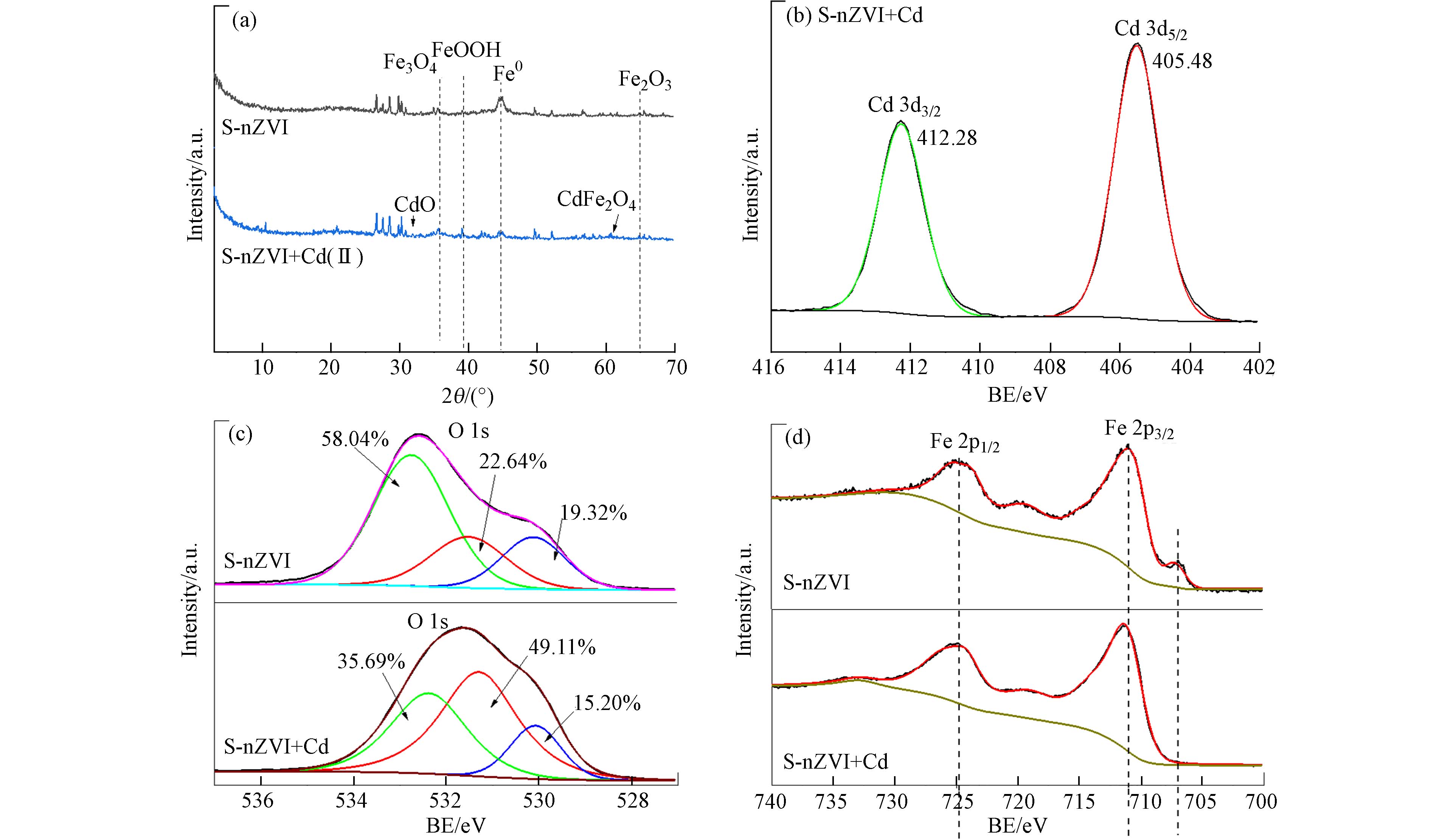
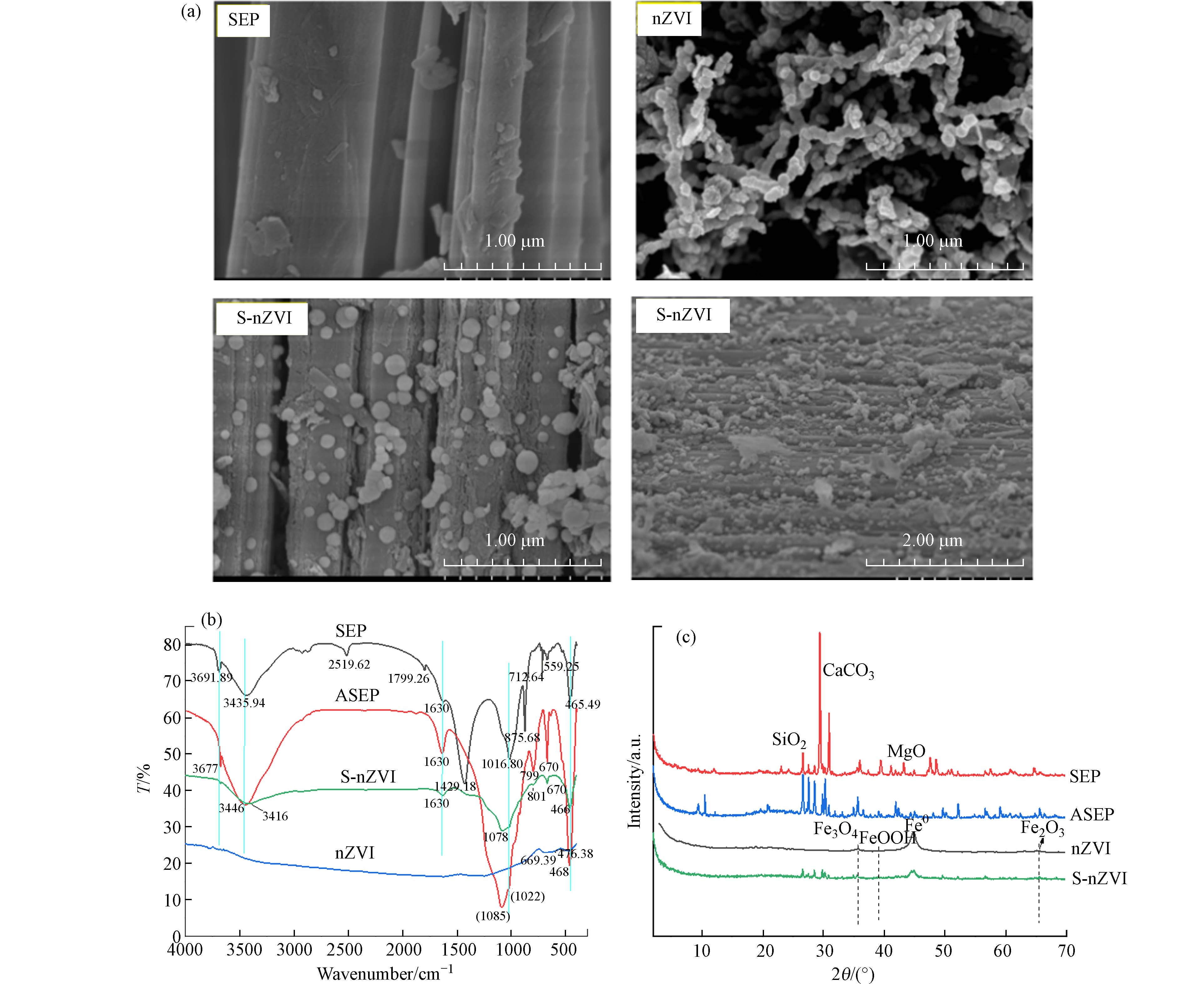
如图1a所示,扫描电镜结果显示,海泡石呈“书页状”结构,nZVI颗粒之间会团聚形成链状结构. S-nZVI纳米零价铁负载海泡石表面之后,球形纳米颗粒均匀地分散在海泡石表面和孔隙中[32 − 33]. FTIR的结果如图1b所示,天然海泡石的FTIR红外特征峰分别为
3691 、3435 、1630 、1016 、 465 cm−1[34]. 酸化海泡石后在SEP的FTIR光谱中,约1429 cm−1处的峰对应于结构OH2的羟基弯曲,3564 cm−1处的峰对应与Mg2+离子相连的—OH基团(Mg—OH)的拉伸,ASEP的光谱中这些都减弱或消失[35]. nZVI在海泡石表面负载后在624 cm−1处形成新的Fe—O峰. XRD的结果如图1c所示,海泡石的XRD峰集中在21°—31°处. 海泡石颗粒经盐酸溶液活化后,其晶体的特征峰强度明显降低,但改性后的海泡石的特征衍射峰位置没有发生变化,说明改性过程中海泡石的晶体结构没有被破坏[32,36]. nZVI在2θ=44.7°处出现了Fe0的特征峰,此外在2θ=35.7°、65.4°和39.05°处也分别出现了Fe3O4、Fe2O3和FeOOH的特征峰[16],说明纳米零价铁已成功制备,并已加载到海泡石上[26]. 表征结果表明海泡石负载的纳米零价铁解决了纳米零价铁的团聚和快速氧化问题,提高了其活性和使用寿命. -
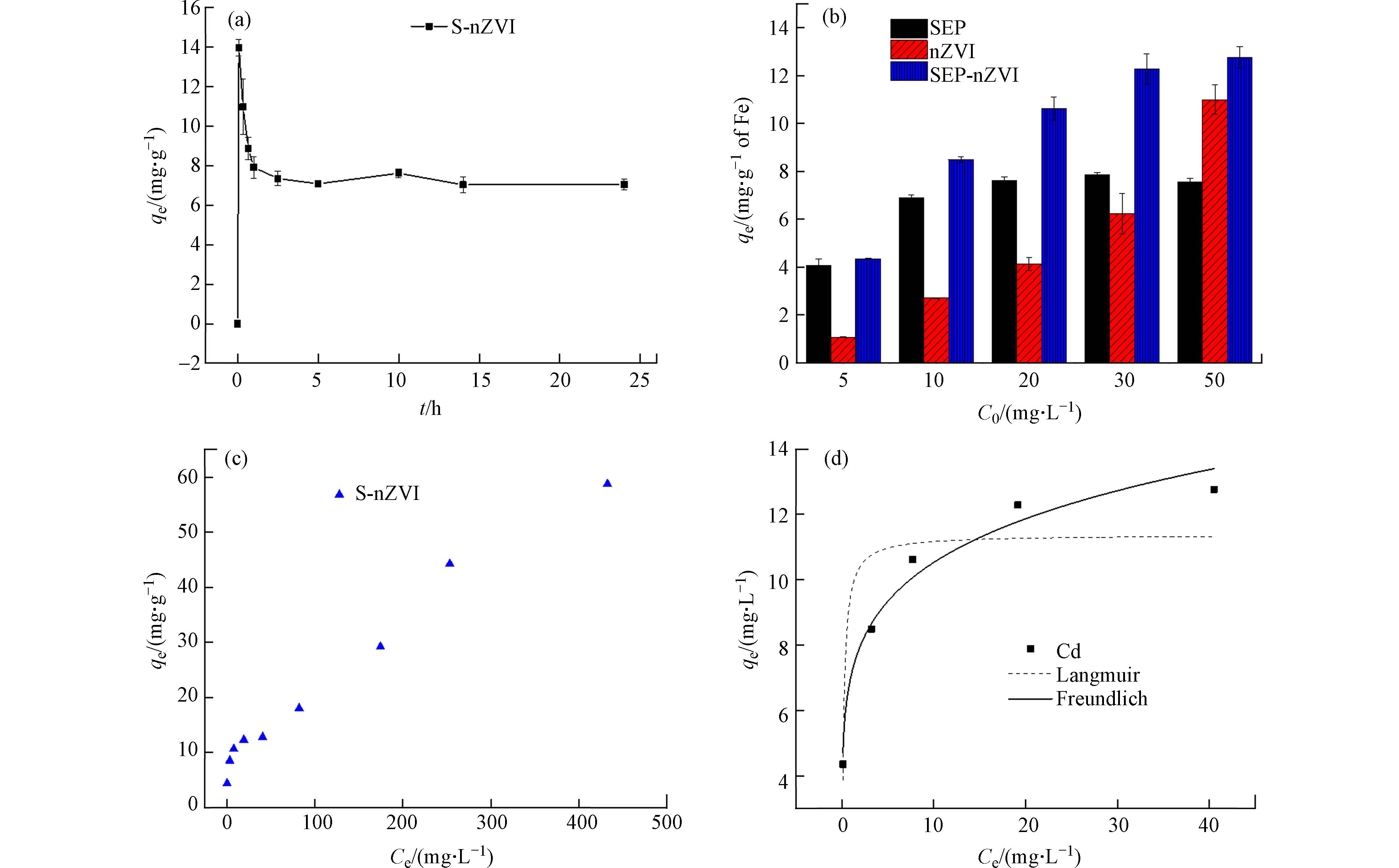
S-nZVI对Cd(Ⅱ)的吸附动力学曲线如图2a所示,动力学曲线包括3个阶段:第一阶段为Cd(Ⅱ)吸附量在5 min就能达到最高点为13.96 mg·g−1;第二阶段是解吸,5 min之后吸附量迅速降低,溶液中的Cd(Ⅱ)浓度增加,表明前5 min吸附在材料表面的Cd(Ⅱ)脱附,吸附量一直降到2.5 h的7.35 mg·g−1;第三阶段是缓慢降低达到平衡,从2.5 h到14 h吸附量缓慢降低,最终达到平衡时吸附量为7.03 mg·g−1,将近12 h吸附量没有显著降低,说明吸附在改性材料表面的Cd(Ⅱ)不会再脱附.
-
SEP、nZVI、S-nZVI对不同初始浓度的Cd(Ⅱ)吸附量如图2b所示. 随着初始浓度的增加不同材料对Cd(Ⅱ)的吸附量也逐渐升高. 海泡石对Cd(Ⅱ)的吸附量在初始浓度5—30 mg·L−1时高于nZVI的吸附量,S-nZVI对Cd(Ⅱ)的吸附量高于SEP和nZVI. 说明纳米零价铁改性之后的吸附剂对Cd(Ⅱ)的吸附量显著增加. 如图2c所示,Cd(Ⅱ)不同初始浓度对S-nZVI吸附Cd(Ⅱ)吸附量有一定的影响,从结果看主要分两个区域,低浓度吸附区,高浓度的沉淀区[36 − 37]. 在低浓度(5—50 mg·L−1)时,S-nZVI的吸附量qe从4.36 mg·g−1增加到12.77 mg·g−1. 高浓度(50—500 mg·L−1)时,吸附量曲线上升到58.75 mg·g−1. 如图2d所示,在低浓度时,S-nZVI对Cd(Ⅱ)吸附等温特征采用Langmuir和Freundlich模型拟合. 如表2所示,S-nZVI吸附Cd(Ⅱ)同时符合Langmuir和Freundlich模型,其中Langmuir模型拟合出其对Cd(Ⅱ)的最大吸附量为11.37 mg·g−1,Freundlich模型拟合结果表明该吸附过程是不均匀的多层吸附,对比Kf可知,Cd(Ⅱ)吸附能力参数1/n为0.17,其范围在0—1之间,说明S-nZVI对Cd(Ⅱ)的吸附过程容易进行.
-
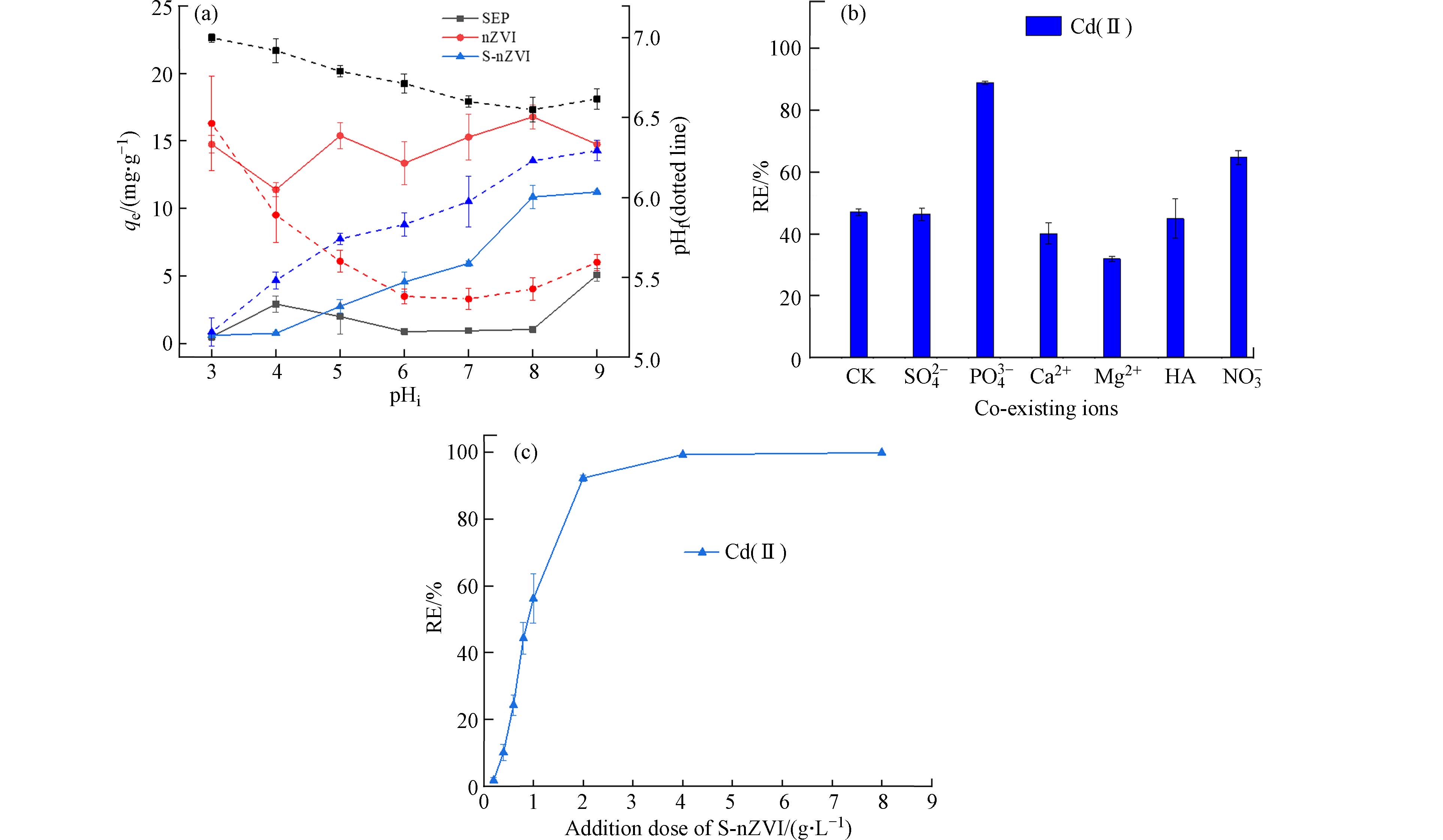
如图3a所示,3种不同材料在Cd(Ⅱ)吸附过程中pH表现出不同的变化趋势. SEP吸附Cd(Ⅱ)后溶液的最终pH(pHf)变化呈持续下降的趋势,从7.00降低到6.62. nZVI在初始pH(pHi)为3—7时,pHf从6.46降低到5.36,当pHi为7.0—9.0时,pH反而会再缓慢升高到5.59. 添加S-nZVI与前两者表现出明显不同的变化趋势,即pHf从5.15逐渐升高到6.29. 通过进一步探究Cd(Ⅱ)吸附量与pH的关系发现,不同材料对Cd(Ⅱ)的吸附量总体趋势是随着pHi的增加而增加. 当溶液pHi增大,SEP对Cd(Ⅱ)吸附量qe少量增加;但nZVI对Cd(Ⅱ)吸附量在该pH值范围内qe变化无规律. 与前两种材料不同,S-nZVI吸附Cd(Ⅱ)在pHi3.0—4.0时吸附量稳定不变,在pH4.0—8.0时吸附量从0.75 mg·g−1到10.85 mg·g−1,pH8.0—9.0时吸附量升高不显著. 说明镉的去除依赖于吸附溶液的pH,其主要原因是溶液pH增加可提高溶液负电荷浓度,镉在pH值为3.0—9.0之间时以正价离子形式存在,因此由于静电作用提高镉的吸附量. 结合上述的结果并综合考虑强酸可能加快对材料中纳米零价铁的腐蚀、实际污水的酸碱性等问题,设定溶液体系pH=7.0,进一步探究改性材料S-nZVI的吸附效果和机制.
-
实际的污水和土壤环境中主要为多种阳离子和阴离子共存的情况,共存离子会影响吸附剂对重金属的吸附效果,因此,共存离子对吸附效果的影响的研究尤为重要. 如图3b所示,PO43−和NO3−离子的加入显著提高S-nZVI对Cd(Ⅱ)的去除率,去除率分别从47.01%增加到88.71%和64.68%,主要因为带负电荷的共存离子有利于Cd的静电吸附[38]. Ca2+、Mg2+和腐殖酸离子的存在则少量降低Cd(Ⅱ)的吸附量,主要由于阳离子间在材料表面吸附位点竞争吸附作用[25].
如图3c所示,S-nZVI添加量0.2 g·L−1增加到2 g·L−1时Cd(Ⅱ)去除率快速增加,分别从1.80%升高到92.30%;S-nZVI添加量2.0—8.0 g·L−1时Cd(Ⅱ)吸附效果接近于100%. 随着添加量增加,提供的吸附位点就越多,Cd(Ⅱ)的去除率就越高[39].
-
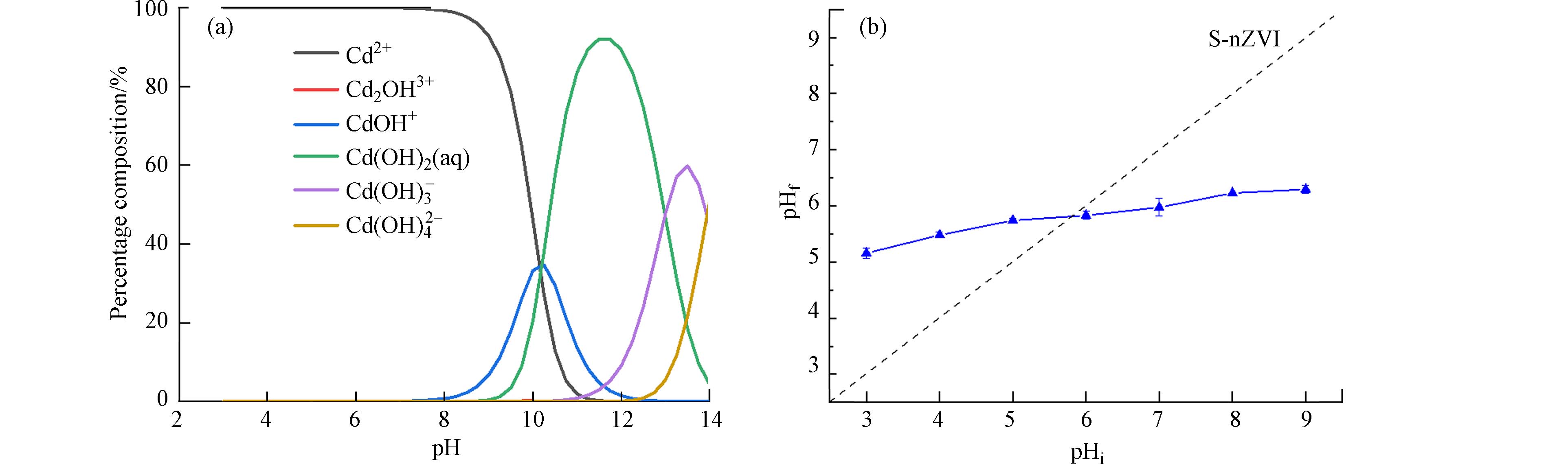
不同pH对Cd(Ⅱ)吸附量的影响的原因可能是溶液pH的变化会导致Cd(Ⅱ)在水溶液中形态的变化. 随着pH的变化,溶液中Cd(Ⅱ)的存在形式也会发生变化. 在不同pH条件下,Cd(Ⅱ)的主要存在形式及相互转化如下:
通过Visual MINTEQ模拟得到不同pH条件下以上几种存在形式的百分含量(图4a),当溶液pH较低时,Cd(Ⅱ)以二价的形式存在,当溶液pH逐渐升高到7.0时,也只有Cd2+一种存在形式,当溶液pH稍大于7.0呈弱碱性时溶液中即出现Cd(OH)+和Cd2(OH)3+,而Cd2+的量随pH的升高逐渐减少,当pH=9.0时溶液中Cd2+占92.86%,其余Cd(Ⅱ)则以Cd2+与OH−结合的形式Cd(OH)+和Cd2(OH)3+存在. 在本实验pH范围内,Cd均以正电荷存在,因此在低pH条件下,材料质子化而带正电荷,与Cd(Ⅱ)电荷排斥,吸附量低. 但随着pH升高,该过程则相反,主要Cd的阳离子形态与材料表面的羟基以通过静电吸附的方式吸附.
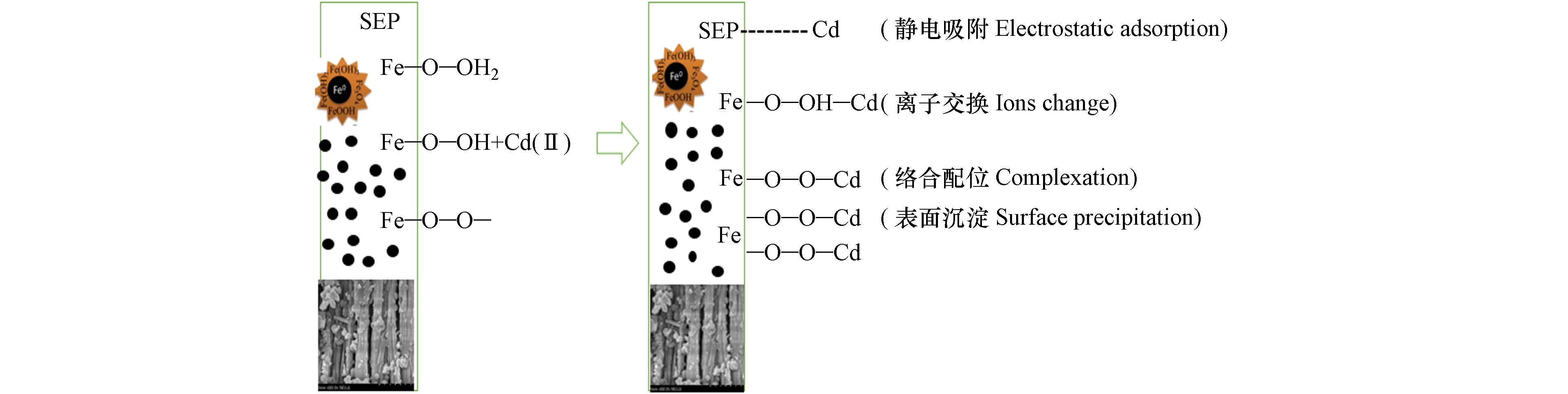
已有的研究表明,阳离子在铁氧化物上的吸附会伴随着质子的释放,从而降低溶液的pH[26,40]. 但是改性材料吸附Cd(Ⅱ)之后,溶液pHf逐渐降低趋于平稳,说明Cd与改性材料表面H+质子发生离子交换,pHf范围为5.16—6.29(图4b),是因为S-nZVI表面上的羟基基团起到缓冲作用[41]. 此外,已有的研究指出海泡石改性氧化铁在Cd吸附过程中表面的Mg(Ⅱ)和Fe(Ⅲ)会以离子交换的形式溶液中释放[42],因此推测除了H+质子外,S-nZVI在对Cd(Ⅱ)吸附过程中也可能会伴随着Fe(Ⅱ)和Fe(Ⅲ)与Cd(Ⅱ)发生离子交换. 因此改性材料对Cd(Ⅱ)的吸附主要包括静电吸附和离子交换两个过程.
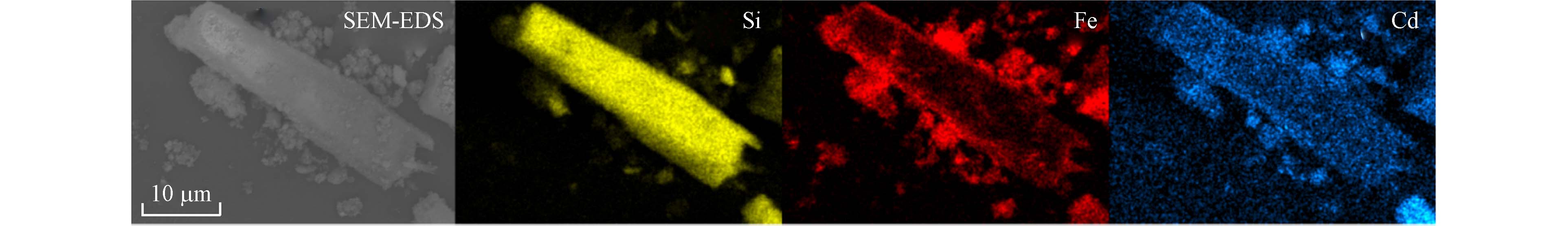
为进一步探究S-nZVI对Cd(Ⅱ)吸附作用机制,利用SEM、XRD和XPS等光谱技术分析了S-nZVI吸附Cd(Ⅱ)后的表面结构组成和相关元素结合方式的变化. 图5为S-nZVI吸附Cd后的表面EDS-mapping图,发现Cd均匀分布在S-nZVI表面,与Fe与Si的分布一致,说明Cd不仅吸附在海泡石表面,而且还被S-nZVI表面的铁氧化物结合[42]. 这表明除了离子交换吸附和静电吸附等非专性吸附,Cd(Ⅱ)可能还会与铁氧化物结合进行专性吸附. XRD的结果如图6a所示,S-nZVI吸附Cd(Ⅱ)后XRD表面出现新矿物CdO(2θ= 33.05°)和CdFe2O4 (2θ=60.05°)的特征峰,说明Cd(Ⅱ)在S-nZVI表面沉淀并以铁-镉络合物的形式存在[43]. 通过XPS Cd 3d轨道分峰后进一步分析发现,分出Cd 3d3/2和Cd 3d5/2的分别为Cd-Fe-OH和Cd(OH)+(图6b),这与XRD谱图中发现的新物相吻合[44],表明吸附前后没有发生还原. 研究报道nZVI和S-nZVI改性海泡石对Cd(Ⅱ)通过吸附或表面络合形成被隔离在nZVI内,Cd(Ⅱ)没有明显的还原[33 − 34]. 详细分析O1s的精细谱可知(图6c),S-nZVI吸附Cd(Ⅱ)之后羟基(—OH)百分含量从22.64%增加到49.11%,说明Fe—OH层可能有利于吸附Cd(Ⅱ),涉及到表面羟基官能团,表面形成Cd(OH)+[25,38,45]. 因此,S-nZVI专性吸附Cd(Ⅱ)包含表面沉淀和铁氧化物络合. XPS的Fe的精细谱可知(图6d),铁峰有偏移现象,因此S-nZVI吸附Cd(Ⅱ)存在内层络合物,以前有研究报道使用EXAFS证实Cd(Ⅱ)也在铁氢氧化物上形成内层表面络合物[46].
综上所述,一方面改性材料吸附Cd(Ⅱ)依赖于体系的pH,另一方面因为纳米零价铁改性材料中富含羟基离子,pH值的增加有利于内层络合物CdxFe(1-x)(OH)2沉淀的生成,表面沉淀以CdO和CdFe2O4方式存在. 因此对应专性吸附(离子交换和静电吸附)和非专性吸附(表面沉淀和络合)是Cd去除的主要方法(图7).
-
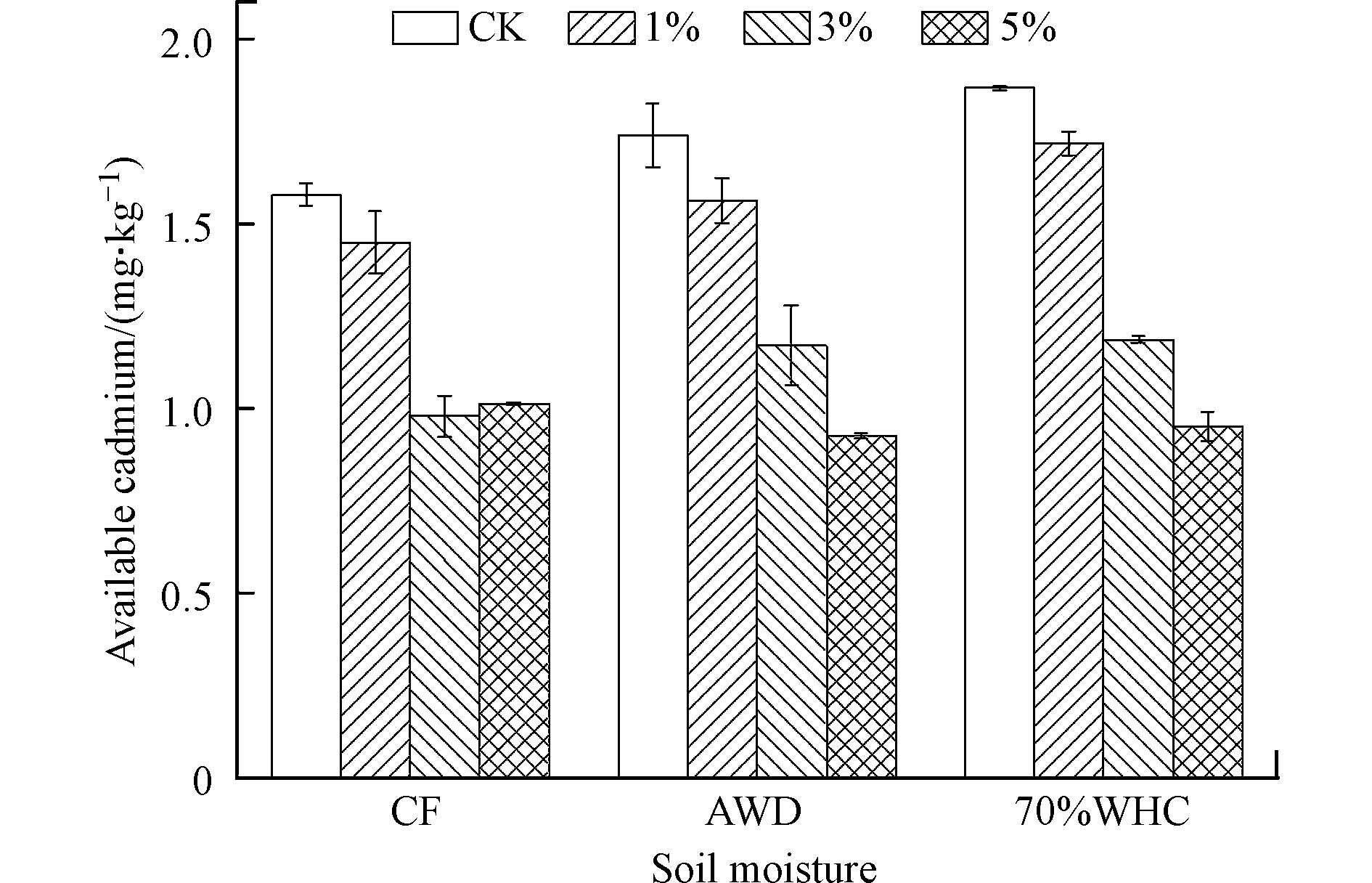
为进一步明确S-nZVI在镉污染农田土壤修复中的实际应用效果,本研究进一步的将制备的材料在不同的土壤水分处理条件下室内模拟试验. 如图8所示,不S-nZVI的添加量为1%、3%、5%时,淹水(CF)条件下有效镉去除率分别为8.23%、38.10%、35.85%;干湿交替(AWD)时为10.07%、22.62%、46.72%;70%持水量(70%WHC)时为7.98%、36.51%、49.04%. 不同水分处理条件下的有效镉的动态变化,空白处理中的有效镉浓度逐渐上升. 部分添加S-nZVI材料的处理也增加,但是始终显著低于空白处理(P<0.05).
-
(1)XRD、XPS、FTIR、SEM等光谱的结果证明海泡石负载纳米零价铁后提高了纳米零价铁的分散性,可以作为高效的吸附材料.
(2)S-nZVI去除Cd(Ⅱ)依赖体系的pH值,吸附量随着pH的增加而增加. Cd(Ⅱ)动力学吸附发现由于Fe2+进一步氧化导致S-nZVI表面上的Cd出现部分解吸;改性材料对Cd(Ⅱ)最大吸附量为11.37 mg·g−1,更符合Freundlich吸附模型;PO43−和NO3−离子的显著提高S-nZVI对Cd(Ⅱ)的吸附率,Ca2+、Mg2+、SO42−、腐殖酸离子少量降低S-nZVI对Cd(Ⅱ)的吸附率.
(3)Visual MINTEQ模拟分析以及SEM、XRD和XPS的光谱分析结果表明S-nZVI主要通过非专性(离子交换和静电吸附)和部分专性吸附(沉淀和络合)去除.
(4)土壤培养实验结果进一步验证了S-nZVI能显著降低有效镉含量,在未来镉污染土壤的修复中具有较高的应用前景.
海泡石改性纳米零价铁对Cd的吸附效果及其机制
Adsorption effect of Cd(Ⅱ) by sepiolite-modified nanoscale zero-valent iron and mechanistic study
-
摘要: 为明确海泡石改性纳米零价铁(S-nZVI)对Cd在水体和土壤中的吸附效果及其作用机制,本研究采用批量吸附和土培试验,结合现代光谱表征分析等方法,探究了S-nZVI对Cd的吸附及影响因素,并深入分析了S-nZVI对镉吸附的吸附作用机制. 结果表明,负载nZVI提高了海泡石对Cd的吸附能力,S-nZVI对Cd的饱和吸附量达到11.37 mg·g−1;S-nZVI对Cd的等温吸附更符合Freundlich模型,该过程属于多层吸附;S-nZVI对Cd(Ⅱ)的吸附量随pH的增加而显著增加,磷酸根和硝酸根离子的存在能促进S-nZVI对Cd的吸附. 不同S-nZVI的添加剂量均能显著降低土壤有效镉的含量,其中5% W/W的添加量表现效果最好. 综合批量吸附实验和光谱分析(XPS和XRD)的结果发现S-nZVI对Cd的吸附作用机制主要包括离子交换、静电吸附、沉淀和络合作用. 本研究的结果证明了S-nZVI可以作为一种对镉具有良好吸附作用的材料,并且在镉中轻度污染水体和土壤修复中具有较广泛的应用前景.Abstract: In order to investigate the adsorption effect of nano zero-valent iron modified by sepiolite (S-nZVI) on Cd in water and soil and its mechanism, this work used batch adsorption experiment and soil incubation experiment, combined with modern spectral characterization analysis methods, to explore the adsorption of S-nZVI on Cd, influencing factors and deeply analyze the adsorption mechanism of S-nZVI on cadmium. The results showed that nZVI loading improved the adsorption capacity of sepiolite for Cd(Ⅱ), and the adsorption capacity of S-nZVI for Cd(Ⅱ) was 11.37 mg·g−1, The isotherm adsorption of Cd(Ⅱ) by S-nZVI was better fitted with the Freundlich model, which belongs to multi-layer adsorption. The adsorption adsorption capacity increased with pH increment, and PO43− and NO3− promoted the removal of Cd(Ⅱ). Different dosage of S-nZVI can significantly reduce the content of available cadmium in soil, and the addition of 5% W/W has the best effect. The results of batch adsorption test and spectral analysis (XPS and XRD) found that ions exchange, electric attraction, precipitation and surface complexation were the main mechanisms for Cd(Ⅱ) to removal Cd. In conclusion, S-nZVI can be used as a stabilizing material for Cd remediation in mild and moderately polluted water and soil.
-
Key words:
- sepiolite /
- nano zero-valent iron /
- Cd /
- adsorption mechanism.
-

-
图 2 (a)吸附动力学;(b)SEP、nZVI、S-nZVI对Cd(Ⅱ)吸附量对比;(c)Cd(Ⅱ)吸附等温曲线(初始浓度C0=5—500 mg·L−1);(d)S-nZVI吸附Cd(Ⅱ)的Fruendlich和Langmuir吸附等温线模型(C0=5—50 mg·L-1)
Figure 2. (a) adsorption kinetic and; (b) compare adsorption capacity of Cd(Ⅱ) for SEP, nZVI, S-nZVI; (c) S-nZVI adsorption isotherm of Cd(Ⅱ) (C0=5—500 mg·L−1); (d) Fruendlich and Langmuir adsorption isotherm ofCd(Ⅱ) on S-nZVI(C0=5—50mg·L-1)
表 1 吸附材料pH和水合粒径
Table 1. The pH value and hydrate particle size of adsorbents
材料
MaterialspH 水合粒径/nm
Hydration radius天然海泡石(SEP) 8.26±0.08 286.7±10.7 酸化海泡石(ASEP) 7.62±0.17 466.0±30.6 海泡石改性纳米零价铁(S-nZVI) 9.10±0.04 611.3±3.1 表 2 S-nZVI对Cd(Ⅱ)吸附等温线的相关参数
Table 2. Adsorption isotherm of Cd(Ⅱ) adsorption on S-nZVI
模型
Models参数
Parameters参数值
Parameter valuesLangmuir 模型 Qmax/(mg·g−1) 11.37 KL 5.46 R2 0.95 RL 0.036— 0.0037 Freundlich 模型 Kf 7.08 1/n 0.17 R2 0.97 -
[1] JOMOVA K, JENISOVA Z, FESZTEROVA M, et al. Arsenic: Toxicity, oxidative stress and human disease[J]. Journal of Applied Toxicology, 2011, 31(2): 95-107. doi: 10.1002/jat.1649 [2] SISWOYO E, MIHARA Y, TANAKA S. Determination of key components and adsorption capacity of a low cost adsorbent based on sludge of drinking water treatment plant to adsorb cadmium ion in water[J]. Applied Clay Science, 2014, 97/98: 146-152. doi: 10.1016/j.clay.2014.05.024 [3] TAKDASTAN A, SAMARBAF S, TAHMASEBI Y, et al. Alkali modified oak waste residues as a cost-effective adsorbent for enhanced removal of cadmium from water: Isotherm, kinetic, thermodynamic and artificial neural network modeling[J]. Journal of Industrial and Engineering Chemistry, 2019, 78: 352-363. doi: 10.1016/j.jiec.2019.05.034 [4] JIN Y L, WANG L W, SONG Y N, et al. Integrated life cycle assessment for sustainable remediation of contaminated agricultural soil in China[J]. Environmental Science & Technology, 2021, 55(17): 12032-12042. [5] WANG Y, TANG X W, CHEN Y M, et al. Adsorption behavior and mechanism of Cd(Ⅱ) on loess soil from China[J]. Journal of Hazardous Materials, 2009, 172(1): 30-37. doi: 10.1016/j.jhazmat.2009.06.121 [6] 李烨, 孙约兵, 徐应明, 等. 镉污染区水稻土磷素含量特征及其形态分布规律[J]. 环境化学, 2017, 36(3): 542-548. doi: 10.7524/j.issn.0254-6108.2017.03.2016071302 LI Y, SUN Y B, XU Y M, et al. Characteristics and speciation distribution of phosphorus in Cd contaminated paddy soil[J]. Environmental Chemistry, 2017, 36(3): 542-548 (in Chinese). doi: 10.7524/j.issn.0254-6108.2017.03.2016071302
[7] PODGORSKI J, BERG M. Global threat of arsenic in groundwater[J]. Science, 2020, 368(6493): 845-850. doi: 10.1126/science.aba1510 [8] SINGH P, PAL P, MONDAL P, et al. Kinetics and mechanism of arsenic removal using sulfide-modified nanoscale zerovalent iron[J]. Chemical Engineering Journal, 2021, 412: 128667. doi: 10.1016/j.cej.2021.128667 [9] BASHIR A, AHMAD MALIK L, AHAD S, et al. Removal of heavy metal ions from aqueous system by ion-exchange and biosorption methods[J]. Environmental Chemistry Letters, 2019, 17(2): 729-754. doi: 10.1007/s10311-018-00828-y [10] CHAI W S, CHEUN J Y, KUMAR P S, et al. A review on conventional and novel materials towards heavy metal adsorption in wastewater treatment application[J]. Journal of Cleaner Production, 2021, 296: 126589. doi: 10.1016/j.jclepro.2021.126589 [11] 李钰婷, 张亚雷, 代朝猛, 等. 纳米零价铁颗粒去除水中重金属的研究进展[J]. 环境化学, 2012, 31(9): 1349-1354. LI Y T, ZHANG Y L, DAI C M, et al. The advance on removal of heavy metals in water by nanoscale zero-valent iron[J]. Environmental Chemistry, 2012, 31(9): 1349-1354 (in Chinese).
[12] LI X Q, ELLIOTT D W, ZHANG W X. Zero-valent iron nanoparticles for abatement of environmental pollutants: Materials and engineering aspects[J]. Critical Reviews in Solid State and Materials Sciences, 2006, 31(4): 111-122. doi: 10.1080/10408430601057611 [13] O’CARROLL D, SLEEP B, KROL M, et al. Nanoscale zero valent iron and bimetallic particles for contaminated site remediation[J]. Advances in Water Resources, 2013, 51: 104-122. doi: 10.1016/j.advwatres.2012.02.005 [14] SHEN Q, LIU S Y, OUYANG J, et al. Sepiolite supported stearic acid composites for thermal energy storage[J]. RSC Advances, 2016, 6(113): 112493-112501. doi: 10.1039/C6RA22015K [15] ZHANG Y L, LI Y T, DAI C M, et al. Sequestration of Cd(Ⅱ) with nanoscale zero-valent iron (nZVI): Characterization and test in a two-stage system[J]. Chemical Engineering Journal, 2014, 244: 218-226. doi: 10.1016/j.cej.2014.01.061 [16] 徐应明, 梁学峰, 孙国红, 等. 海泡石表面化学特性及其对重金属Pb2+、Cd2+、Cu2+吸附机理研究[J]. 农业环境科学学报, 2009, 28(10): 2057-2063. XU Y M, LIANG X F, SUN G H, et al. Surface chemical characteristics of sepiolites and their adsorption mechanisms of Pb2+, Cd2+ and Cu2+[J]. Journal of Agro-Environment Science, 2009, 28(10): 2057-2063 (in Chinese).
[17] 孙约兵, 王朋超, 徐应明, 等. 海泡石对镉-铅复合污染钝化修复效应及其土壤环境质量影响研究[J]. 环境科学, 2014, 35(12): 4720-4726. SUN Y B, WANG P C, XU Y M, et al. Immobilization remediation of Cd and Pb contaminated soil: Remediation potential and soil environmental quality[J]. Environmental Science, 2014, 35(12): 4720-4726 (in Chinese).
[18] 张韬, 贺洋. 海泡石环境吸附材料制备研究[J]. 非金属矿, 2016, 39(4): 46-47. doi: 10.3969/j.issn.1000-8098.2016.04.014 ZHANG T, HE Y. Environmental adsorbing material prepared by sepiolite[J]. Non-Metallic Mines, 2016, 39(4): 46-47 (in Chinese). doi: 10.3969/j.issn.1000-8098.2016.04.014
[19] AINIWAER M, ZHANG T, ZHANG N, et al. Synergistic removal of As(Ⅲ) and Cd(Ⅱ) by sepiolite-modified nanoscale zero-valent iron and a related mechanistic study[J]. Journal of Environmental Management, 2022, 319: 115658. doi: 10.1016/j.jenvman.2022.115658 [20] SUN Y B, SUN G H, XU Y M, et al. Assessment of sepiolite for immobilization of cadmium-contaminated soils[J]. Geoderma, 2013, 193/194: 149-155. doi: 10.1016/j.geoderma.2012.07.012 [21] LIANG X F, HAN J, XU Y M, et al. in situ field-scale remediation of Cd polluted paddy soil using sepiolite and palygorskite[J]. Geoderma, 2014, 235/236: 9-18. doi: 10.1016/j.geoderma.2014.06.029 [22] ZHOU F, YE G Y, GAO Y T, et al. Cadmium adsorption by thermal-activated sepiolite: Application to in situ remediation of artificially contaminated soil[J]. Journal of Hazardous Materials, 2022, 423: 127104. doi: 10.1016/j.jhazmat.2021.127104 [23] 许亚琼, 王雪佳, 李荣华, 等. 纳米零价铁改性生物炭对污染土壤中Cd稳定化效果及作用机制研究[J]. 农业环境科学学报, 2022, 41(11): 2478-2487. XU Y Q, WANG X J, LI R H, et al. Effects and mechanisms of nano zero-valent iron-modified biochar on Cd stabilization in contaminated soils[J]. Journal of Agro-Environment Science, 2022, 41(11): 2478-2487 (in Chinese).
[24] BOPARAI H K, JOSEPH M, O’CARROLL D M. Cadmium (Cd2+) removal by nano zerovalent iron: Surface analysis, effects of solution chemistry and surface complexation modeling[J]. Environmental Science and Pollution Research, 2013, 20(9): 6210-6221. doi: 10.1007/s11356-013-1651-8 [25] HABISH A J, LAZAREVIĆ S, JANKOVIĆ-ČASTVAN I, et al. Nanoscale zerovalent iron (nZVI) supported by natural and acid-activated sepiolites: The effect of the nZVI/support ratio on the composite properties and Cd2+ adsorption[J]. Environmental Science and Pollution Research, 2017, 24(1): 628-643. doi: 10.1007/s11356-016-7802-y [26] RAMAZANPOUR ESFAHANI A, HOJATI S, AZIMI A, et al. Enhanced hexavalent chromium removal from aqueous solution using a sepiolite-stabilized zero-valent iron nanocomposite: Impact of operational parameters and artificial neural network modeling[J]. Journal of the Taiwan Institute of Chemical Engineers, 2015, 49: 172-182. doi: 10.1016/j.jtice.2014.11.011 [27] LI Z T, WANG L, MENG J, et al. Zeolite-supported nanoscale zero-valent iron: New findings on simultaneous adsorption of Cd(Ⅱ), Pb(Ⅱ), and As(Ⅲ) in aqueous solution and soil[J]. Journal of Hazardous Materials, 2018, 344: 1-11. doi: 10.1016/j.jhazmat.2017.09.036 [28] MAHL C R A, TAKETA T B, BATAGLIOLI R A, et al. Chitosan functionalization with amino acids yields to higher copper ions adsorption capacity[J]. Journal of Polymers and the Environment, 2018, 26(12): 4338-4349. doi: 10.1007/s10924-018-1306-4 [29] ABAD-VALLE P, ÁLVAREZ-AYUSO E, MURCIEGO A, et al. Assessment of the use of sepiolite amendment to restore heavy metal polluted mine soil[J]. Geoderma, 2016, 280: 57-66. doi: 10.1016/j.geoderma.2016.06.015 [30] SONG N, HURSTHOUSE A, McLELLAN I, et al. Treatment of environmental contamination using sepiolite: Current approaches and future potential[J]. Environmental Geochemistry and Health, 2021, 43(7): 2679-2697. doi: 10.1007/s10653-020-00705-0 [31] FU R B, YANG Y P, XU Z, et al. The removal of chromium (Ⅵ) and lead (Ⅱ) from groundwater using sepiolite-supported nanoscale zero-valent iron (S-NZVI)[J]. Chemosphere, 2015, 138: 726-734. doi: 10.1016/j.chemosphere.2015.07.051 [32] DANESHKHAH M, HOSSAINI H, MALAKOOTIAN M. Removal of metoprolol from water by sepiolite-supported nanoscale zero-valent iron[J]. Journal of Environmental Chemical Engineering, 2017, 5(4): 3490-3499. doi: 10.1016/j.jece.2017.06.040 [33] MALAKOOTIAN M, DANESHKHAH M, HOSSAINI H. Removal of phosphates from aqueous solution by sepiolite-nano zero valent iron composite optimization with response surface methodology[J]. International Journal of Environmental Science and Technology, 2018, 15(10): 2129-2140. doi: 10.1007/s13762-017-1520-y [34] ALKAN M, TEKIN G, NAMLI H. FTIR and Zeta potential measurements of sepiolite treated with some organosilanes[J]. Microporous and Mesoporous Materials, 2005, 84(1/2/3): 75-83. [35] LAZAREVIĆ S, JANKOVIĆ-ČASTVAN I, JOVANOVIĆ D, et al. Adsorption of Pb2+, Cd2+ and Sr2+ ions onto natural and acid-activated sepiolites[J]. Applied Clay Science, 2007, 37(1/2): 47-57. [36] LIU K, LI F B, CUI J H, et al. Simultaneous removal of Cd(Ⅱ) and As(Ⅲ) by graphene-like biochar-supported zero-valent iron from irrigation waters under aerobic conditions: Synergistic effects and mechanisms[J]. Journal of Hazardous Materials, 2020, 395: 122623. doi: 10.1016/j.jhazmat.2020.122623 [37] YANG D, WANG L, LI Z T, et al. Simultaneous adsorption of Cd(Ⅱ) and As(Ⅲ) by a novel biochar-supported nanoscale zero-valent iron in aqueous systems[J]. Science of the Total Environment, 2020, 708: 134823. doi: 10.1016/j.scitotenv.2019.134823 [38] LUO H, WANG X Y, DAI R, et al. Simultaneous determination of arsenic and cadmium by hydride generation atomic fluorescence spectrometry using magnetic zero-valent iron nanoparticles for separation and pre-concentration[J]. Microchemical Journal, 2017, 133: 518-523. doi: 10.1016/j.microc.2017.04.030 [39] 彭瑜, 王海娟, 王宏镔. 农田土壤砷、镉协同钝化修复的研究进展[J]. 土壤, 2021, 53(4): 692-699. PENG Y, WANG H J, WANG H B. Advances in synergistic passivation remediation of arsenic and cadmium in farmland soil[J]. Soils, 2021, 53(4): 692-699 (in Chinese).
[40] LI B Y, WEI D N, ZHOU Y M, et al. Mechanisms of arsenate and cadmium co-immobilized on ferrihydrite inferred from ternary surface configuration[J]. Chemical Engineering Journal, 2021, 424: 130410. doi: 10.1016/j.cej.2021.130410 [41] XIE S, WANG L, XU Y M, et al. Performance and mechanisms of immobilization remediation for Cd contaminated water and soil by hydroxy ferric combined acid-base modified sepiolite (HyFe/ABsep)[J]. The Science of the Total Environment, 2020, 740: 140009. doi: 10.1016/j.scitotenv.2020.140009 [42] WANG L, LI Z T, WANG Y, et al. Performance and mechanisms for remediation of Cd(Ⅱ) and As(Ⅲ) co-contamination by magnetic biochar-microbe biochemical composite: Competition and synergy effects[J]. Science of the Total Environment, 2021, 750: 141672. doi: 10.1016/j.scitotenv.2020.141672 [43] LIU G F, MENG J, HUANG Y L, et al. Effects of carbide slag, lodestone and biochar on the immobilization, plant uptake and translocation of As and Cd in a contaminated paddy soil[J]. Environmental Pollution, 2020, 266: 115194. doi: 10.1016/j.envpol.2020.115194 [44] ZHANG C, YU Z G, ZENG G M, et al. Phase transformation of crystalline iron oxides and their adsorption abilities for Pb and Cd[J]. Chemical Engineering Journal, 2016, 284: 247-259. doi: 10.1016/j.cej.2015.08.096 [45] TIBERG C, GUSTAFSSON J P. Phosphate effects on cadmium(Ⅱ) sorption to ferrihydrite[J]. Journal of Colloid and Interface Science, 2016, 471: 103-111. doi: 10.1016/j.jcis.2016.03.016 [46] BOPARAI H K, JOSEPH M, O’CARROLL D M. Kinetics and thermodynamics of cadmium ion removal by adsorption onto nano zerovalent iron particles[J]. Journal of Hazardous Materials, 2011, 186(1): 458-465. doi: 10.1016/j.jhazmat.2010.11.029 -



 下载:
下载: