-
六氟化硫(SF6) 气体电负性强,能够通过吸附自由电子降低气体分子的碰撞电离,其绝缘强度是空气的2.5倍,灭弧能力达到空气的100倍,因而在电力行业中,被广泛应用于高压断路器的灭弧介质. 同时,SF6分子呈正八面体构型,且硫—氟键键合能高,是一种性质稳定、难以自然降解的温室气体[1],其全球升温潜能值(Global Warming Potential,GWP)高达
24300 [2],在大气中的寿命可达3200年[3],泄漏到大气中的1 kg SF6相当于约24.3 t CO2. 全球大气中SF6正在不断累积,其浓度已经从1994年的3.67×10−9 g·L−1上升到2020年的10.5×10−9 g·L−1,而且这个数值还在不停地上升[2, 4]. 相关调查研究表明,电力行业是SF6气体的主要使用主体和主要排放源. 世界上许多国家和地区已经深刻认识到SF6温室效应问题的严重性,并提出了控制SF6产生的当量碳排放量的要求[5 − 8]]. 自2011年以来,SF6的允许排放限值已经被限制为气体绝缘设备容量的10%,并且该限制值每年减少1%[4]. 此外,许多政府已经开始对SF6征收附加税,以敦促企业减少排放[9]. 因此,加强SF6废气处理,减少SF6气体排放,对于世界各国实现温室气体减排目标具有重要意义. 随着绿色环保的可持续发展理念的逐渐深入,SF6气体的安全减排已迫在眉睫[10]. 面对这一问题,科学家们展开了对SF6气体减排的相关研究.其中,降解转化技术的提出为SF6废气的无害化处理提供了可行的思路. 目前,降解SF6的方法有气体回收循环利用法、吸附法、热解法、光降解法、催化降解法、等离子体法[2,11 − 18],大多数方法在实际应用过程中都具有一定的限制,如气体回收循环利用法,一般使用气体回收装置将设备中的SF6气体抽取并压缩至储气罐中密封保存. 但是一套回收的设备大约需要50万人民币[19],价格高昂,且通过回收装置回收的SF6气体暂不能直接使用,需要进行一系列的净化处理后方可再利用;吸附法通常利用柱撑粘土、硅质岩、沸石、活性炭或碳纳米管等比表面积较大的材料来吸附SF6气体,但只能作用于小量SF6气体,对高浓度、大量的SF6无计可施;热解法需要极高的温度,SF6在
1100 ℃以上的高温条件才能发生热分解,操作困难,对设备的要求极高;光降解法消耗SF6的时间较长,且目前已开发的方法主要是用于特定有机化合物的固定转化,如德国的Wagenknecht课题组[6]报道了在365 nm紫外和520 nm 绿光的共同作用下,以N-苯基吩噻嗪作为光催化剂和铜作为稳定自由基的催化剂,实现了六氟化硫对烯烃的五氟磺酰化反应,反应时长为21 h,产率较低(30%—40%),且仅限于α-甲基苯乙烯型底物,应用有限. 美国的Jaminson 等[13]以烯丙基醇为底物,蓝色LED灯为光源,(4,4'-二叔丁基-2,2'-联吡啶)双[(2-吡啶基)苯基]铱(Ⅲ)六氟磷酸盐配合物为光催化剂,室温下反应14 h进行SF6降解,并实现了降解产物对烯丙醇的脱氧氟化;催化降解法的催化剂需要在高温环境下才表现出较高的活性,其过程能耗较大,且只能对低浓度的SF6作用,如Xu等研究了电镀污泥在高温下(600—700 ℃)对SF6的降解作用,其中SF6的使用浓度为29—174 mg·L−1[20];等离子体法是目前降解SF6较好的方法,但是等离子体处理装置需要添加额外的设备,这样显著增加了应用成本.目前,通过电化学方法降解SF6的研究报道尚很少见[21 − 22]. 本文采用电化学方法,在常温常压下,以三苯基膦为反应物对SF6进行降解,试剂成本大大降低;可在电化学条件下以短时间、高转化率对六氟化硫气体进行降解. 本方法不需要使用有毒的金属催化剂,且降解后的产物为化工原料,无有害气体产生,具有环境友好的特点,相比于其他降解方法,优势明显. 本文对影响转化率的因素以及反应的可能机理进行了一系列研究.
-
道冠实验室专用高纯锌棒,直径2.5 mm;友邦高纯度无铅焊锡棒,直径1.2 mm;8 mL透明玻璃螺口顶空瓶,磁力搅拌子.
-
伊莱科直流电流表指针式85C1-A直接式直流20 mA,优利德(UNI-T)数显高精度可直流稳压电源三通道UTP3303 [0—32 V, 0—3 A].
-
使用Bruker Avance 400 spectrometer仪器(400 MHz)对1H NMR、13C NMR、31P NMR和19F NMR进行测定. 测试温度为室温,溶剂为氘代氯仿(CDCl3),化学位移参考值:1H NMR,CHCl3为7.26 ppm; 13C NMR,CHCl3为77.0 ppm. 使用Agilent
8860 -5977B型气相色谱质谱联用仪(GC-MS)对相对分子质量进行测定,测试温度为300 ℃,溶剂为HPLC级甲醇. -
在装有磁力搅拌子的8 mL样品瓶中加入131.1 mg (0.5 mmol)三苯基膦(PPh3)、329.3 mg (1.0 mmol)电解质四丁基四氟硼酸铵(nBu4NBF4)和5 mL四氢呋喃(THF),混合后形成三苯基膦和四丁基四氟硼酸铵的溶液,盖上样品瓶盖,将长度约为12 cm的锡棒和锌棒通过瓶盖垫片处插入样品瓶. 用充有SF6气体的气球对溶液进行鼓泡,持续5 min后,以锡棒为正极,锌棒为负极接入电源,用电流表控制电流大小,在室温下进行电解反应,反应过程中用薄层色谱(TLC)进行监测. 在紫外灯照射下(365 nm),可以观察到TLC色谱板上反应物三苯基膦的荧光点消失,并在极性较大的区域出现产物的荧光点. 反应完成后关掉电源,向反应液中加入5 mL饱和碳酸钠溶液并继续搅拌水解2 h,用30 mL饱和氯化铵溶液稀释反应混合液,乙酸乙酯(3 mL× 15 mL)萃取,有机层经过无水NaSO4干燥,过滤,减压除去溶剂后进行柱层析(硅胶柱,石油醚和乙酸乙酯混合液做洗脱剂)得到产物,分别用0.5 mL氘代氯仿溶解约10 mg产物,并转移至核磁管,设置核磁共振仪条件及参数,对样品进行扫描并采集数据.
-
反应的分离产物由两部分组成,如图1所示,一部分产物是三苯基膦与SF6中的氟元素结合的产物:二氟三苯基膦(Ph3PF2),易发生水解转化为稳定的三苯基氧化膦(PPh3=O)产物.
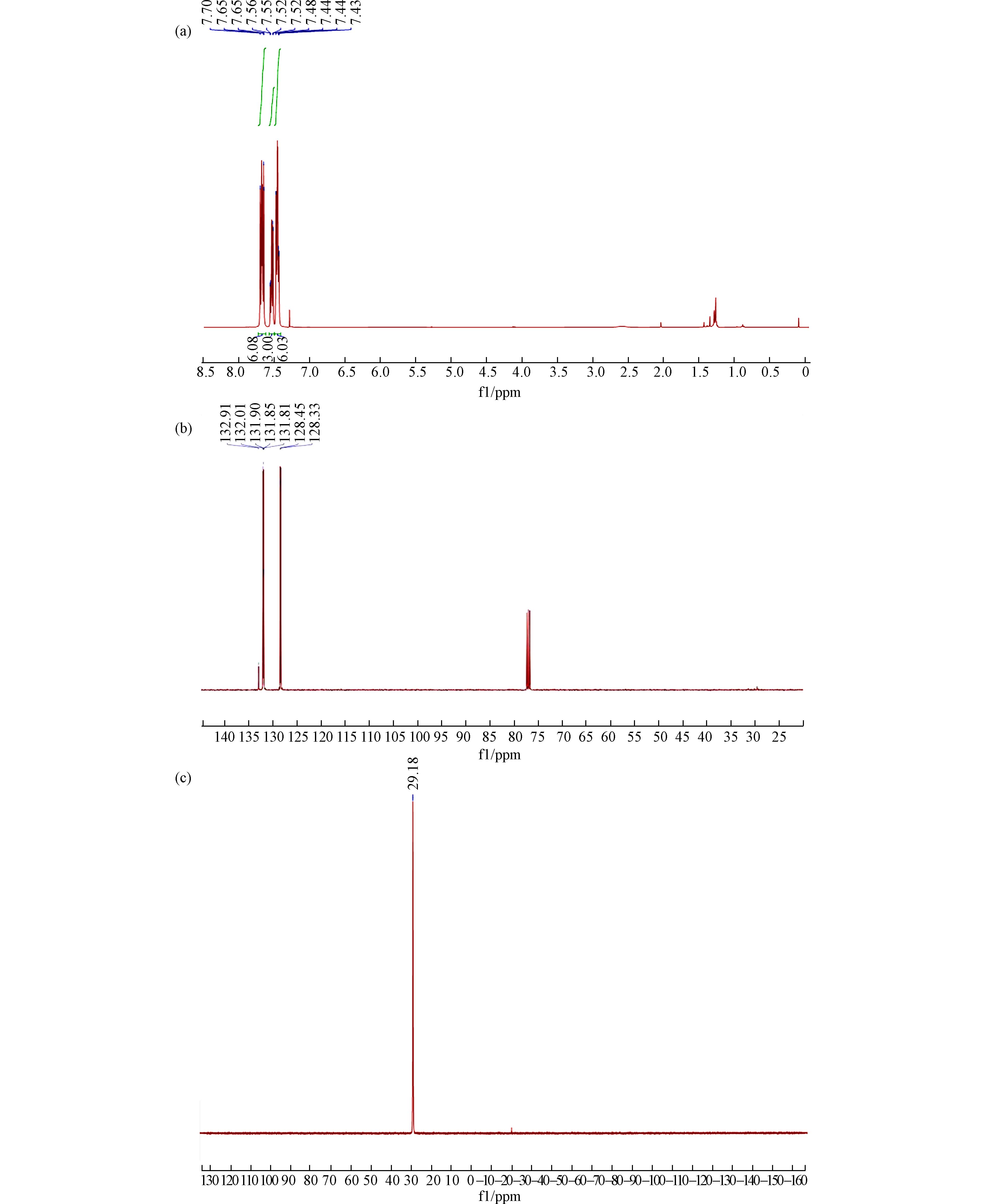
图2分别是产物三苯基氧化磷的核磁共振氢、碳、膦谱. 1H NMR (400 MHz, CDCl3) δ 7.70–7.60 (m, 6H), 7.54–7.48 (m, 3H), 7.47–7.40 (m, 6H) ppm. 13C NMR (101 MHz, CDCl3) δ 132.9, 132.0 (d, JC-P = 11.1 Hz), 131.8 (d, JC-P = 4.0 Hz), 128.4 (d, JC-P = 12.1 Hz) ppm. 31P NMR (162 MHz, CDCl3) δ 29.2 ppm.
利用气相色谱质谱联用仪(GC-MS)对三苯基氧化膦产物样品分析,检测到其相对分子量为278.1 g·mol−1, 与理论值相符.
-
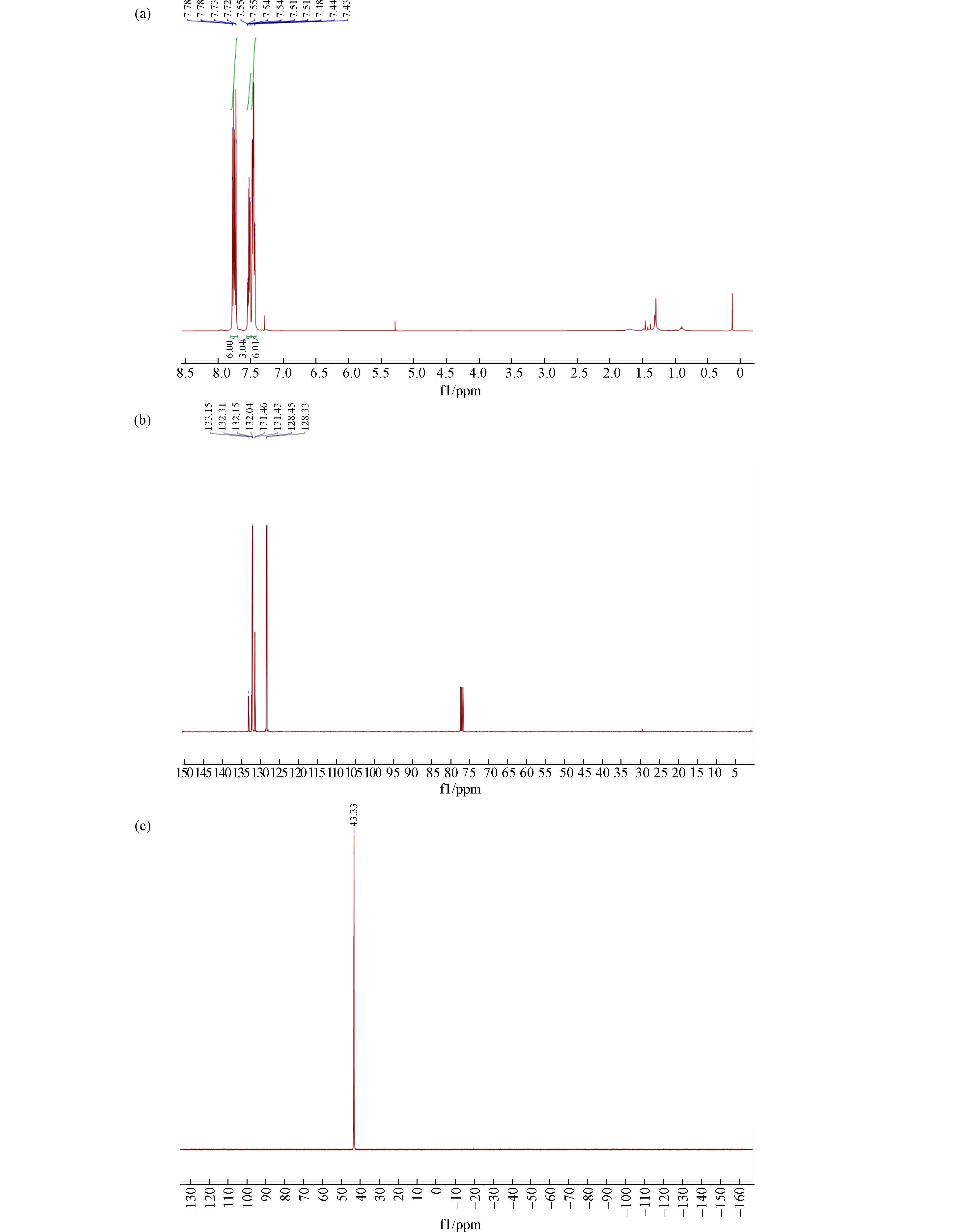
反应的另一部分产物是三苯基膦与SF6中的硫元素结合的产物:三苯基膦硫(PPh3=S). 图3分别是产物三苯基膦硫的核磁共振氢、碳、膦谱. 1H NMR (400 MHz, CDCl3) δ 7.78–7.67 (m, 6H), 7.55–7.46 (m, 3H), 7.46–7.38 (m, 6H) ppm. 13C NMR (101 MHz, CDCl3) δ 132.7 (d, JC-P = 84.8 Hz), 132.1 (d, JC-P = 11.1 Hz), 131.4 (d, JC-P = 3.0 Hz), 128.4 (d, JC-P = 11.1 Hz) ppm. 31P NMR (162 MHz, CDCl3) δ 43.3 ppm.
利用GC-MS对三苯基膦硫产物样品进行分析,检测到其相对分子质量为294.1 g·mol−1,与理论值相符.
-
针对三苯基膦的转化率进行研究:转化产物为三苯基膦硫和三苯基氧化膦(最终产物),将二者产率相加得到三苯基膦的综合转化率. 实验结果表明,电解质的种类和浓度、反应介质,以及反应时间等对反应的效率都有着重要的影响. 优化过程如表1所示,其他电解质如四丁基溴化铵(nBu4NBr)或四丁基氟化铵(nBu4NF)都不能使三苯基膦发生转化. 四氢呋喃(THF)是较为合适的溶剂促进该电化学反应;电流为10 mA时,反应可达到令人满意的效率.
-
根据以上实验结果,我们对反应机理进行推测. 首先,六氟化硫与三苯基膦反应后,通过TLC监测发现反应物三苯基膦被完全消耗;在电化学反应过程中,溶液里出现了一些白色浑浊,且正极锌电极被消耗(最优条件下锌电极质量变化:反应前
2.5630 g,反应后2.5520 g),推测该反应可能是牺牲阳极的电解反应. 使用柱层析方法分离极性不同的两种产物,核磁谱图确认其结构分别为三苯基氧化膦和三苯基膦硫. 结合已有关于六氟化硫在光、电化学条件下发生转化的可能机制[10,13,22],对该反应的可能历程进行了推导:电极正极锌与六氟化硫发生反应,正极锌失去电子产生二价锌离子,六氟化硫得到电子转化为四氟化硫和氟负离子,二价锌离子与氟负离子结合生成氟化锌无机盐,随后四氟化硫与三苯基膦反应,并将其转化为三苯基膦硫和二氟三苯基膦(水解前反应液核磁显示其氟谱化学位移为19F NMR (376 MHz, CD3CN) δ -38.10 (d, J = 655.6 Hz) ppm,与文献报道一致[11,21]),其中,二氟三苯基膦不稳定经水解转化为终产物三苯基氧化膦. -
(1)综合核磁共振图谱、GC-MS测试分析显示,三苯基膦硫和二氟三苯基膦为电化学反应的产物,其中二氟三苯基膦可经过水解转化为最终产物三苯基氧化膦.
(2)最优化条件下,三苯基膦发生转化,生成三苯基膦硫和三苯基氧化膦的综合效率可达81%,实现了电化学条件下高浓度六氟化硫的有效降解.
(3)电解质的种类、电流大小、电解时长等都对转化率有十分重要的影响,在电解质为nBu4NBF4、溶剂为THF、电流为10 mA,三苯基膦的转化率最高,六氟化硫的降解效果最好.
该方法能够在电化学条件下短时间、高转化率地对高浓度六氟化硫气体进行降解,从工业化角度来说,大大降低了废气处理的时间成本. 同时,电化学方法可以通过进一步原位反应,将其降解中间产物转化为可分离的基础化工原料,相比于其他降解方法,具有明显的优势.
电化学条件下三苯基膦对温室气体六氟化硫的降解反应
The degradation of greenhouse gas sulfur hexafluoride by triphenylphosphine under electrochemical conditions
-
摘要: 六氟化硫(SF6)是一种优秀的绝缘气体,在电力行业中使用广泛,但同时也是一种温室气体,且在大气层中非常稳定,几乎无法自然降解. 目前已开发工业降解SF6的方式,通常需要在高温高压下进行,成本较高,且降解产物常含有有毒和腐蚀性气体. 本文发现在常温常压下,利用电化学条件,可以使三苯基膦与六氟化硫气体以较高的转化率进行反应,实现其高效降解. 通过对反应体系的研究和产物的分离,确定了其降解终产物为有机合成常用的基本原料三苯基氧化磷和三苯基膦硫.Abstract: Sulfur hexafluoride (SF6) is one of the greenhouse gases, and is highly stable, almost impossible to be degraded naturally. Developed processes for the degradation of SF6 generally require extremely high temperature and pressure, which result in high cost, and the products of degradation contain toxic and corrosive gases. This investigation shows that utilizing electrochemical conditions, SF6 could react with triphenylphosphine (Ph3P) efficiently under atmospheric pressure and ambient temperature, thus achieving its degradation. By detailed studies on the electrochemical reaction system and the isolated products, final products of the reaction have been confirmed as triphenylphosphine oxide (Ph3P=O) and triphenylphosphine sulfide (PPh3=S), which are raw materials in organic synthesis.
-
Key words:
- sulfur hexafluoride /
- electrochemistry /
- degradation.
-

-
表 1 反应优化
Table 1. Optimization of the conditions
条目Entry 电解质Electrolyte 溶剂
Solvent时间/ h
Time电流/ mA
CurrentP(S)Ph3产率/ %
Yield of PPh3=SP(O)Ph3产率/ %
Yield of PPh3=O总产率/ %
Overall yield1 nBu4NBr THF 8 10 0 0 0 2 nBu4NF THF 8 10 0 0 0 3 nBu4NPF6 THF 8 10 23 45 68 4 nBu4NBF4 THF 8 10 15 66 81 5 nBu4NBF4 DCM 8 10 0 0 0 6 nBu4NBF4 THF 10 5 15 45 60 7 nBu4NBF4 THF 4 15 18 60 78 8 nBu4NBF4 THF 8 10 20 49 69 9 nBu4NBF4 THF 8 10 15 55 70 -
[1] WEITKAMP R F, NEUMANN B, STAMMLER H G, et al. Non-coordinated and hydrogen bonded phenolate anions as one-electron reducing agents[J]. Chemistry-A European Journal, 2021, 27(21): 6465-6478. doi: 10.1002/chem.202005123 [2] SHI S Y, LI Y, CUI Z L, et al. Recent advances in degradation of the most potent industrial greenhouse gas sulfur hexafluoride[J]. Chemical Engineering Journal, 2023, 470: 144166. doi: 10.1016/j.cej.2023.144166 [3] SHELDON D J, CRIMMIN M R. Complete deconstruction of SF6 by an aluminium(I) compound[J]. Chemical Communications, 2021, 57(58): 7096-7099. doi: 10.1039/D1CC02838C [4] WIGLEY T M L, SMITH S J, PRATHER M J. Radiative forcing due to reactive gas emissions[J]. Journal of Climate, 2002, 15(18): 2690-2696. doi: 10.1175/1520-0442(2002)015<2690:RFDTRG>2.0.CO;2 [5] WEITKAMP R F, NEUMANN B, STAMMLER H G, et al. Non-coordinated phenolate anions and their application in SF6 activation[J]. Chemistry-A European Journal, 2021, 27(21): 6460-6464. doi: 10.1002/chem.202003504 [6] ROMBACH D, WAGENKNECHT H A. Photoredox catalytic α-alkoxypentafluorosulfanylation of α-methyl- and α-phenylstyrene using SF6[J]. Angewandte Chemie International Edition, 2020, 59(1): 300-303. doi: 10.1002/anie.201910830 [7] SATO Y, NISHIMURA M, KAWAGUCHI S I, et al. Reductive rearrangement of tetraphenyldiphosphine disulfide to trigger the bisthiophosphinylation of alkenes and alkynes[J]. Chemistry-A European Journal, 2019, 25(27): 6797-6806. doi: 10.1002/chem.201900073 [8] MATSUMOTO K, HARUKI Y, SAWADA S, et al. Stabilization of SF5- with glyme-coordinated alkali metal cations[J]. Inorganic Chemistry, 2018, 57(23): 14882-14889. doi: 10.1021/acs.inorgchem.8b02655 [9] HANOTEAU J, TALBOT D. Impacts of the Québec carbon emissions trading scheme on plant-level performance and employment[J]. Carbon Management, 2019, 10(3): 287-298. doi: 10.1080/17583004.2019.1595154 [10] KIM S, KHOMUTNYK Y, BANNYKH A, et al. Synthesis of glycosyl fluorides by photochemical fluorination with sulfur(VI) hexafluoride[J]. Organic Letters, 2021, 23(1): 190-194. doi: 10.1021/acs.orglett.0c03915 [11] BUß F, MÜCK-LICHTENFELD C, MEHLMANN P, et al. Nucleophilic activation of sulfur hexafluoride: Metal-free, selective degradation by phosphines[J]. Angewandte Chemie International Edition, 2018, 57(18): 4951-4955. doi: 10.1002/anie.201713206 [12] FISCHBACH U, TRINCADO M, GRÜTZMACHER H. Oxidative formation of phosphinyl radicals from a trigonal pyramidal terminal phosphide Rh(i) complex, with an unusually long Rh-P bond[J]. Dalton Transactions, 2017, 46(11): 3443-3448. doi: 10.1039/C7DT00070G [13] McTEAGUE T A, JAMISON T F. Photoredox activation of SF6 for fluorination[J]. Angewandte Chemie International Edition, 2016, 55(48): 15072-15075. doi: 10.1002/anie.201608792 [14] RUEPING M, NIKOLAIENKO P, LEBEDEV Y, et al. Metal-free reduction of the greenhouse gas sulfur hexafluoride, formation of SF5 containing ion pairs and the application in fluorinations[J]. Green Chemistry, 2017, 19(11): 2571-2575. doi: 10.1039/C7GC00877E [15] YOGENDRA S, CHITNIS S S, HENNERSDORF F, et al. Condensation reactions of chlorophosphanes with chalcogenides[J]. Inorganic Chemistry, 2016, 55(4): 1854-1860. doi: 10.1021/acs.inorgchem.5b02723 [16] ZÁMOSTNÁ L, BRAUN T. Catalytic degradation of sulfur hexafluoride by rhodium complexes[J]. Angewandte Chemie International Edition, 2015, 54(36): 10652-10656. doi: 10.1002/anie.201505462 [17] 胡雄雄. 介质阻挡放电等离子体降解六氟化硫气体的实验研究[D]. 重庆: 重庆大学, 2017. HU X X. Experimental study on degradation of sulfur hexafluoride gas by dielectric barrier discharge plasma[D]. Chongqing: Chongqing University, 2017 (in Chinese).
[18] 沈燕, 黄丽, 张仁熙, 等. 介质阻挡放电降解SF6的研究[J]. 环境化学, 2007, 26(3): 275-279. doi: 10.3321/j.issn:0254-6108.2007.03.001 SHEN Y, HUANG L, ZHANG R X, et al. Decomposition of sf6 by dielectric barriers discharge[J]. Environmental Chemistry, 2007, 26(3): 275-279 (in Chinese). doi: 10.3321/j.issn:0254-6108.2007.03.001
[19] 李路, 王为民, 杨惠民, 等. SF6的回收与再生[J]. 有机氟工业, 1997(3): 23-26. LI L, WANG W M, YANG H M, et al. Recovery and regeneration of SF6[J]. Organo-Flnorine Industry, 1997(3): 23-26 (in Chinese).
[20] ZHANG J, ZHOU J Z, LIU Q, et al. Efficient removal of sulfur hexafluoride (SF6) through reacting with recycled electroplating sludge[J]. Environmental Science & Technology, 2013, 47(12): 6493-6499. [21] ROTERING P, MÜCK-LICHTENFELD C, DIELMANN F. Solvent-free photochemical decomposition of sulfur hexafluoride by phosphines: Formation of difluorophosphoranes as versatile fluorination reagents[J]. Green Chemistry, 2022, 24(20): 8054-8061. doi: 10.1039/D2GC02172B [22] KIM S, NAGORNY P. Electrochemical synthesis of glycosyl fluorides using sulfur(VI) hexafluoride as the fluorinating agent[J]. Organic Letters, 2022, 24(12): 2294-2298. doi: 10.1021/acs.orglett.2c00431 -



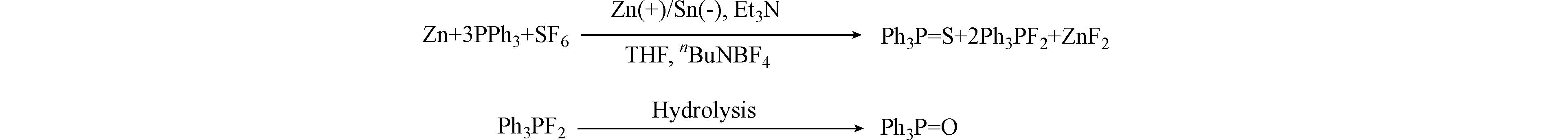
 下载:
下载: