-
赤泥是有色金属冶炼行业最主要的固体废弃物,具有强盐碱性、粒度细、重金属含量高以及具有可能的放射性污染等特点,其产量随着氧化铝工业的发展而不断增加[1 − 2]. 大量赤泥堆存对堆场周围的生态环境造成巨大威胁[3 − 5]. 目前,大量研究表明将赤泥转化为土壤状生长介质的生态工程策略是一种能够批量处理赤泥的有效手段[6 − 8]. 赤泥成分复杂但有机质匮乏,不足以提供植被正常生长所需的条件[9]. 在生态工程修复赤泥的过程中,有机质能够为土壤微生物提供能量与营养,支撑其生存与发展从而改善团聚体形态促进赤泥成土[10 − 12].
富里酸(Fulvic acid, FA)作为腐殖质的一种重要组成成分,在任何pH条件下均溶于水,在土壤中的移动性强[13]. FA分子量小、生物活性高,具有良好的络合、弱酸性、表面活性和离子交换等特性[14 − 16],能够充分参与赤泥成土的各个环节中的反应,是赤泥基质土壤化演化过程中重要的天然有机物质[17, 18]. 由于其分子量较低,FA能够较好地与赤泥中的矿物产生相互作用. 赤泥中约有70%的结晶物相和30%的无定型物质,方解石(calcite)、石榴石(garnet)、方钠石(sodalite)和钙霞石(cancrinite)是赤泥中碱性矿物的主要形式[19, 20]. 方钠石、钙霞石以及石榴石是氧化铝生产过程中典型的脱硅产物,其中方钠石和钙霞石是由铝土矿在高温高压溶出过程中添加苛性碱生成,方解石则是在沉淀分离过程中加入的絮凝剂和助滤剂与液相中的可溶性钙等杂质反应形成的. 赤泥中石榴石和钙霞石的含量约为0—50%,方钠石含量约为4%—40%,方解石含量约为2%—20%. 碱性矿物的赋存状态以及含量影响着赤泥堆场的盐碱性,因此赤泥的碱性调控是赤泥土壤化调控的基础[21]. 碱性矿物的存在将导致赤泥的碱度调节不稳定和pH值反弹等问题[22 − 23],这是有机改良剂功效降低和赤泥生态工程策略周期延长的主要原因. 探究有机物与碱性矿物的相互作用机制,可以为赤泥的生态修复面临的挑战提供科学解释. 如今,各种技术可用于探索有机物和矿物之间的相互作用过程,如原子力显微镜[24]、核磁共振波谱[25]、质谱[26]、分子光谱[27]和等温滴定量热法(isothermal titration calorimetry, ITC)[28]. 其中,分子光谱学可以快速提供丰富的定性和半定量信息,但是存在分辨率低,光谱重叠的问题[27, 29]. ITC是一种灵敏且无损的技术,用于获取相互作用的热力学信息. 然而,目前鲜少将光谱技术和ITC应用于赤泥中有机物和碱性矿物间相互作用的研究.
有机物和矿物在相互作用过程中两者都会发生变化[30 − 31]. 由于赤泥的成分复杂[32],在土壤形成过程中,难以直接表征有机物和碱性矿物之间的相互作用. 因此,本研究采用分子光谱技术、ITC以及X射线光电子能谱(X-ray photoelectron spectroscopy, XPS)等技术手段相结合的方法,选取方解石、石榴石、方钠石以及钙霞石这四种典型的碱性矿物为代表,追踪了FA-碱性矿物相互作用引起的有机物结构和反应热的变化,从而对赤泥生态工程修复过程中FA与碱性矿物的相互作用机制进行阐明.
-
FA(分子量为308.24)购自麦克林试剂(Macklin Reagent). 将1 g的FA粉末溶于去离子水中,对溶液进行搅拌,以确保FA完全溶解. 最后用去离子水定容至
1000 mL,从而获得1000 mg·L−1的FA储备液. 将储备液贮存于棕色试剂瓶中,4 ℃保存.矿物样品中,方解石(CaCO3)、石榴石(Ca3Al2Si3O12)以及方钠石(Na4(Al3Si3O12)Cl)购自百灵威试剂(J&K Scientific Reagent). 钙霞石(Na8(Si6Al6O24) (H0.88(CO3)1.44) (H2O)2)则通过水热合成法制备得到[32]:向反应釜中加入钾长石10 g、氢氧化钠(分析纯)10 g和碳酸钠(分析纯)5 g,按照固液比为5:3加入去离子水15 mL. 搅拌均匀后,将反应釜密封,放入260 ℃的烘箱中,整个反应在260 ℃下进行240 min. 在完成反应后进行固液分离,用去离子水冲洗所得滤渣后,将其放入高温烘箱进行干燥. 通过X射线衍射 (X-ray diffraction ,XRD, D/max 2500v/pc, Cu Kα radiation: 2θ ranges: 10 o —80o) 对所购及制备矿物进行表征,XRD图谱如图1所示. 与标准PDF卡的比较表明,四种矿物的特征峰都与标准PDF卡相对应. 赤泥中矿物粒度一般较细,均在0.2 mm以下. 为符合实际,本研究中所用的矿物均用100目的筛子进行筛分并用去离子水分别配制一系列浓度的储备悬浮液.
-
通过将计算质量的碱性矿物和FA储备溶液与去离子水混合,生成一系列FA浓度范围为2—40 mg·L−1的悬浮液,其中碱性矿物的最终浓度固定为5.0 g·L−1,总体积为20 mL. 悬浮液在温度为25 ℃的气浴摇床中避光振荡48 h以确保相互作用平衡,对悬浮液进行离心(
2800 g,30 min)取上清液,利用UV-2600 型紫外分光光度计(Shimadzu Corporation, Japan)进行UV-Vis光谱的测定. 波长扫描范围为200—800 nm,增量为0.5 nm. 254 nm处的吸光度(UV254)正相关于有机物的浓度(TOC),因此,可以利用UV254间接反映FA的浓度[33]. 吸附等温线的校准曲线是通过绘制光学吸光度(在254 nm处)与FA浓度的关系来创建的. 使用Langmuir (方程1)和Freundlich (方程2)吸附模型对从反应中获得的数据进行拟合:其中,Qe是每单位质量吸附的FA的量,qm是最大FA吸附量,Ce是平衡浓度.
在吸附动力学实验中,碱性矿物与40 mg·L−1 的FA溶液混合,其中碱性矿物的最终浓度固定为20.0 g·L−1,总体积为500 mL. 将混合液在室温下(25 ℃)避光搅拌,每隔一定时间收集大约1 mL样品(前12 h每隔2 h取样1次,12 h 后每隔12 h取样1次,整个反应持续48 h). 将得到的悬浮液先用 0.45 μm 的滤膜过滤然后稀释后25倍,用紫外分光光度计检测其中FA的浓度变化,以 254 nm 处的紫外吸光度来确定不同时间点溶液中FA的浓度. 使用准一级(方程3)、准二级(方程4)、颗粒内扩散(方程5)和Elovich模型(方程6)拟合从动力学实验获得的数据.
-
将浓度范围为0至3 g·L−1的一系列碱性矿物悬浮液与10.0 mg·L−1的FA溶液混合. 混合物在25 ℃下避光振荡48 h以确保相互作用平衡后,将样品离心(
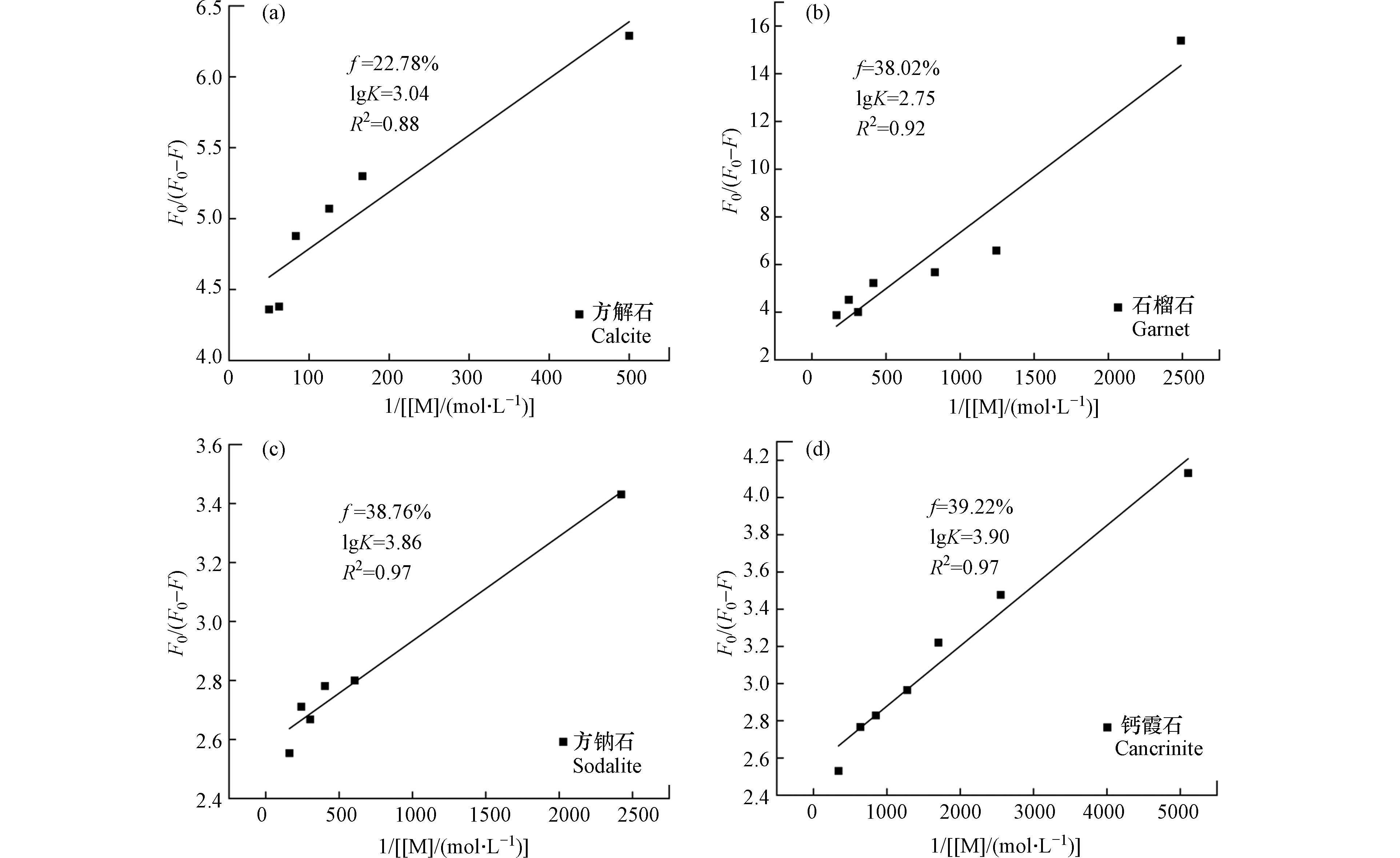
2800 g,30 min)后取上清液,使用F4600荧光分光光度计(Hitachi,Japan)对上清液进行三维荧光光谱分析. 激发和发射狭缝均设置为10 nm. 激发波长范围为200—500 nm,发射波长范围为250—650 nm,增量为5 nm,扫描速度为30000 nm·min−1,实验重复两次. 使用改进的Stern-Volmer模型对反应的条件稳定常数进行估算,具体见公式(7):其中,F0、F、f、[M]和K分别指不含碱性矿物的样品的初始荧光强度、添加碱性矿物后测量的荧光强度、参与结合的初始荧光团部分、碱性矿物浓度和条件稳定常数. K的对数和f的百分比是由F0/ΔF对1/[M]的线性图计算得到的.
-
使用VP-ITC型等温滴定微量热仪(Malvern, UK)进行ITC实验. 该仪器配备有290 μL滴定针和1.44 mL样品池. 为保证稳定的pH环境、减少中和热干扰,用磷酸盐缓冲液(pH 7.4, Macklin)配制4 g·L−1的碱性矿物悬浮液和5 g·L−1的FA溶液. 设置实验温度为25 ℃,等待温度稳定后向样品池中加入1.44 mL碱性矿物悬浮液,向滴定针中加入270 μL FA溶液并设定滴定针的搅拌速度为437 r·min−1. 将FA溶液以0.5 μL·s−1的速率分17次注射到样品池中. 每次注射15 μL,两次注射之间的时间间隔为5 min.
-
取与10 mg·L−1 的FA反应前后的碱性矿物悬液(1 g·L−1),分别用NaOH或HCl调节pH值为9—12,使用Zetasizer Nano ZS(Malvern,UK)电位仪进行Zeta电位测试. 每个样品重复测定5次,取平均值为最终的Zeta电位.
-
对与FA相互作用前后的矿物样品用扫描电子显微镜(scanning electron microscope, SEM,TESCAN MIRA4)进行微观形态分析,并且使用XPS(THERMO ESCALAB 250XI)测定C、O、Na和Ca的含量. 同时通过电感耦合等离子体发射光谱仪(inductively coupled plasma optical emission spectrometer, ICP-OES, Thermal Scientific ICAP7400 Radial)测定溶液中的元素含量.
-
吸附等温线可以用来描述吸附质和吸附剂之间的相互作用,本研究采用Langmuir和Freundlich模型拟合FA在碱性矿物上的吸附. 表1中的拟合结果表明,FA与方解石的吸附相互作用符合Langmuir模型,表明吸附过程主要由单层表面吸附控制;而FA与石榴石的吸附相互作用更符合Freundlich模型,属于多层吸附. 四种碱性矿物与FA吸附的动力学过程仅符合动力学准二级模型,这表明吸附过程主要由表面反应控制,吸附仅发生在吸附剂的外表面上,并有限地扩散到其颗粒中.
然而,Langmuir和Freundlich模型均不能较好地描述方钠石/钙霞石与FA的等温吸附作用,这表明FA和方钠石/钙霞石之间的相互作用机制不同于方解石和石榴石. 碱性矿物在与FA相互作用后,其XRD图谱的变化可忽略不计(图1),表明碱性矿物在该过程中晶体结构不变. 相比之下,碱性矿物的XPS图谱显示(图2),在与FA相互作用后,与碳元素有关的峰有明显的增强,尤其是对于方解石和钙霞石,这表明FA吸附在碱性矿物上.
与方解石和石榴石相比,方钠石和钙霞石矿物颗粒在与FA相互作用后表面形貌变得粗糙(图3),这可能是由碱性矿物的轻微溶解引起的. 元素分析证明了这一点(表2),表明与FA相互作用后,方钠石/钙霞石中的Na+有较明显的溶出. 因此,方钠石/钙霞石与FA的相互作用不是一个简单的吸附过程,伴随着碱金属的溶出. 此外,碱性矿物的溶解对溶液pH值有显著影响,进而影响FA浓度的测定[34],导致吸附等温线拟合不成功.
-
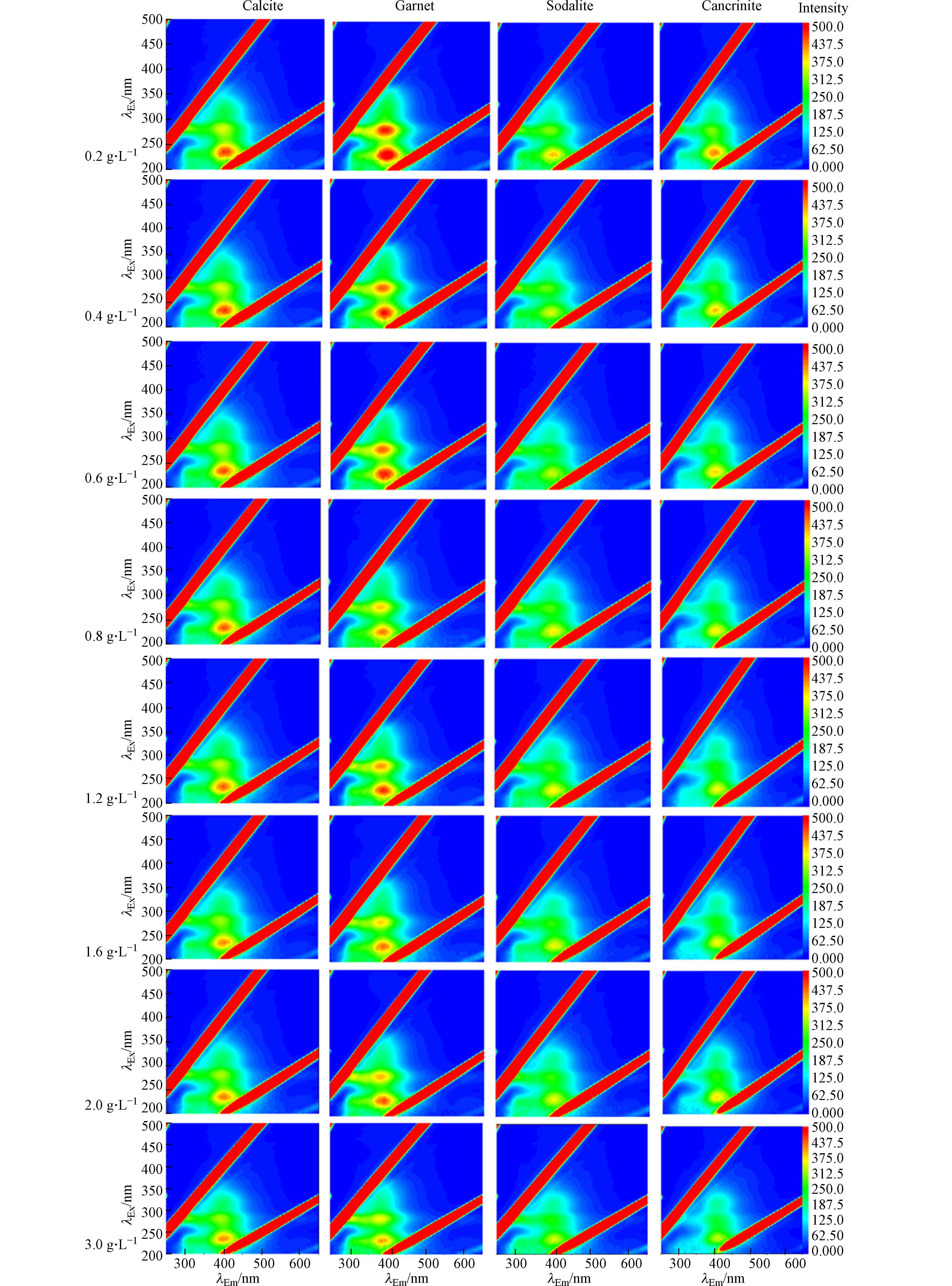
FA含有大量的荧光官能团,加入碱性矿物后体系荧光强度的变化可以反映FA与碱性矿物的相互作用. 在低浓度(0.2—0.6 g·L−1碱性矿物)下,FA的荧光强度有轻微的淬灭作用,表明碱性矿物和FA之间的相互作用导致FA的特定结构发生变化(图4). 在与FA相互作用的4种碱性矿物中,钙霞石对FA荧光淬灭作用最为显著.
不同碱性矿物与FA组分的荧光淬灭实验得到的 F0/F0-F与1/[M]数据有较好的线性相关性(图5),根据修正的Stern-Volmer方程计算了相关的结合参数. 不同碱性矿物与FA之间的lgK显示出较大差异,表明FA与不同碱性矿物之间的结合亲和力存在差异. 钙霞石和方钠石在与FA结合的过程中表现出较高的lgK值和络合百分比f,表明其具有较强的结合力. 与钙霞石相比,石榴石-FA配合物的f值较高,但lgK值较低,这可能是因为石榴石与FA荧光的亲和力较弱. 相较石榴石,方解石与FA结合的lgK值较高而络合百分比f较低,表明其仅与小部分FA荧光具有较强的亲和力.
-
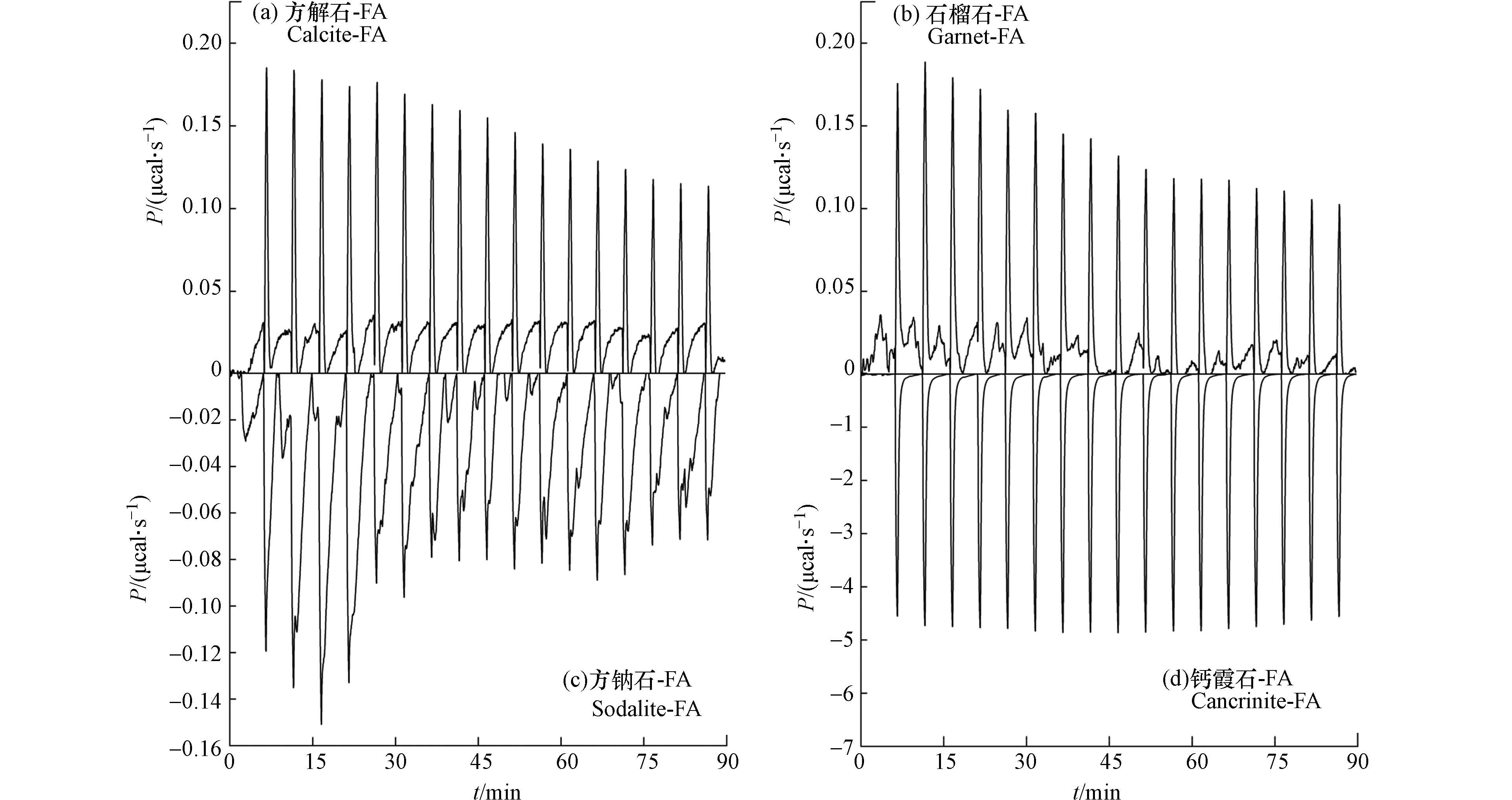
ITC提供FA与碱性矿物相互作用过程中实时的热量变化信息. 图6中的ITC曲线(μcal·s−1与时间的关系)描述了FA与四种碱性矿物相互作用过程中的热变化.
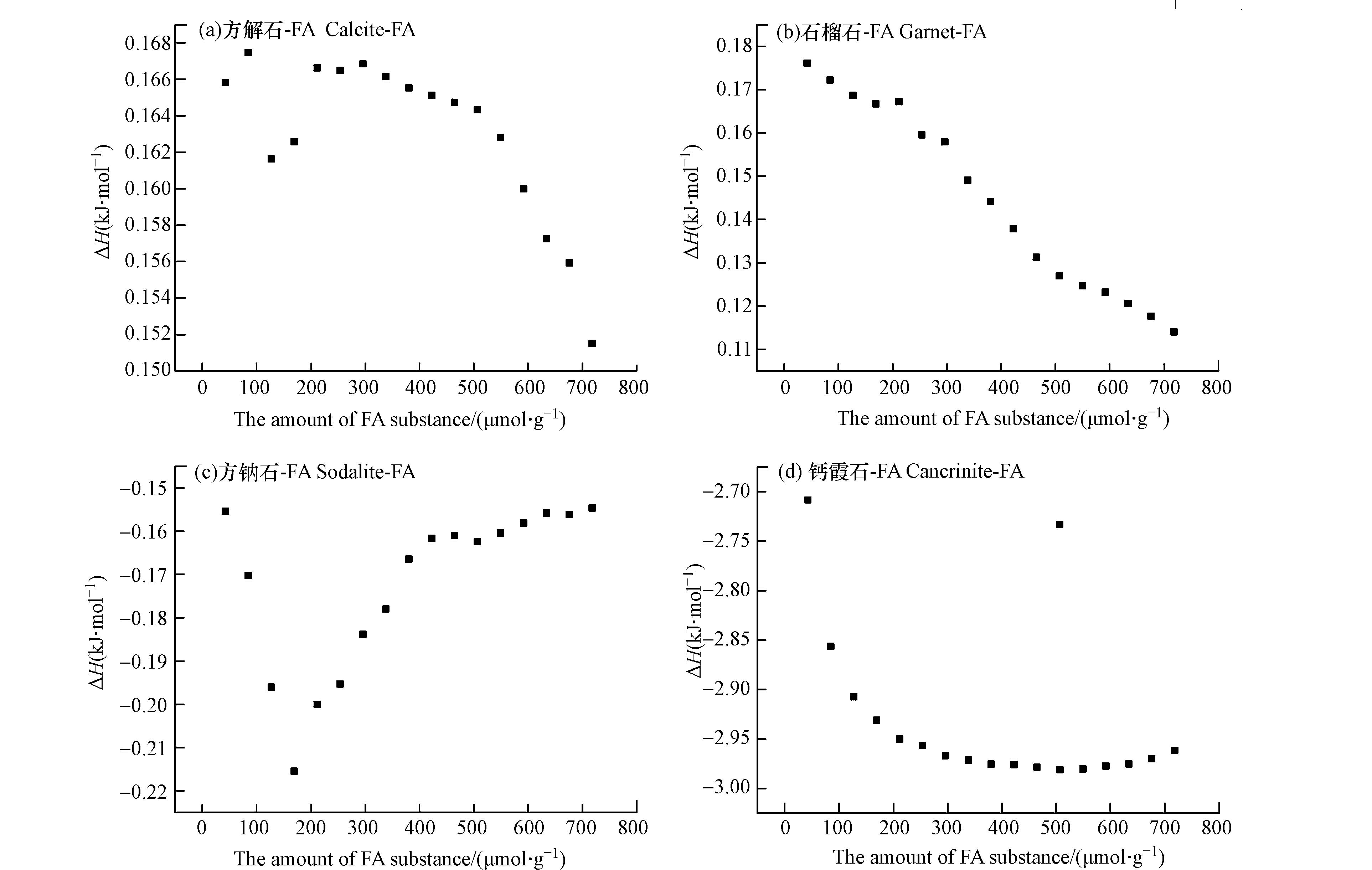
从图中可以清楚地观察到 FA 与方钠石和钙霞石的反应热为负值导致峰朝下,这表明结合是放热反应;与方解石和石榴石的结合为吸热反应. 随着滴定的进行和碱性矿物上的结合位点被占据,放热峰强度降低,直到达到饱和. 钙霞石和FA之间的相互作用始终表现出高水平的热效应,而没有达到饱和,这可能是因为钙霞石上结合位点的数量较多.
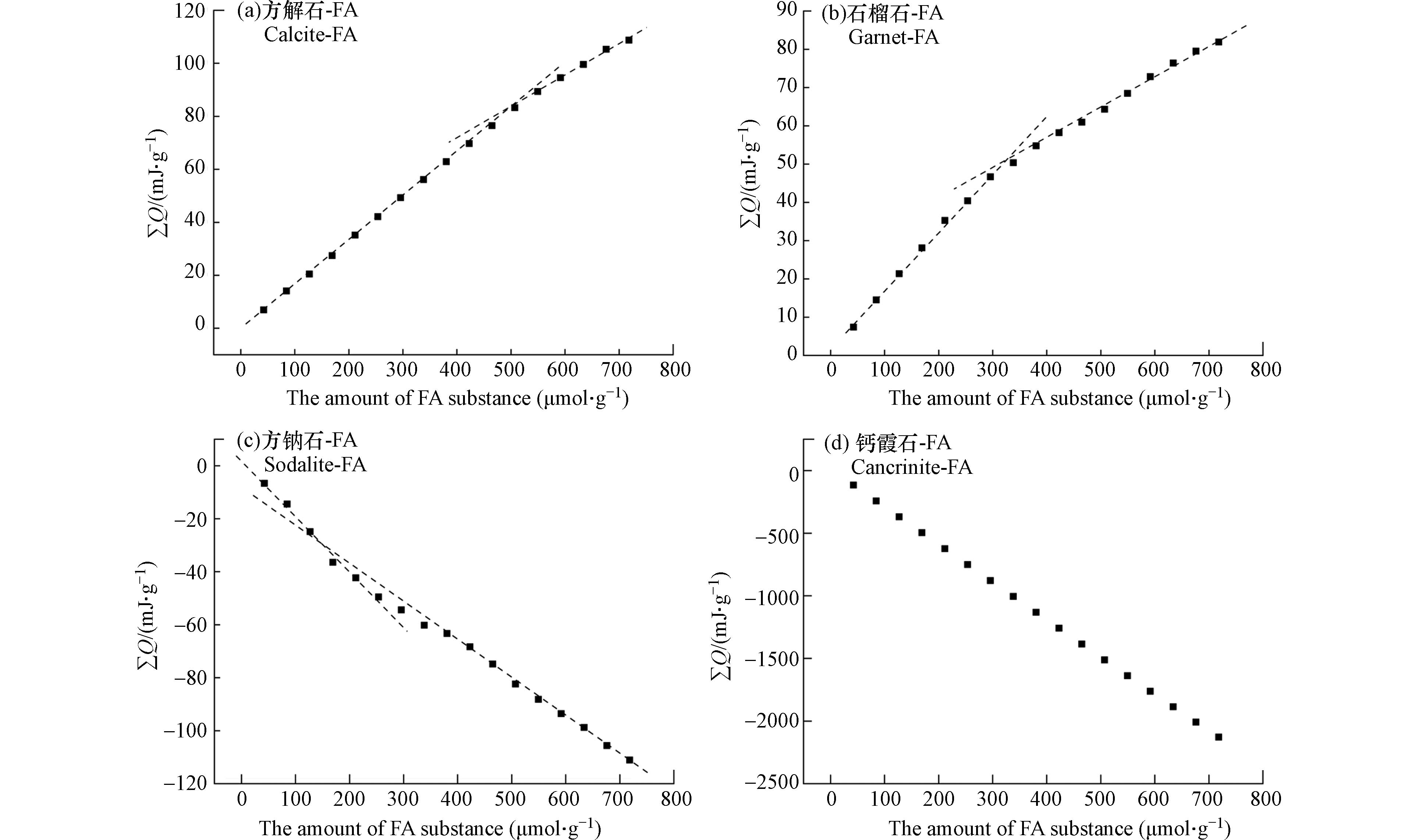
通过对等温滴定量热曲线图中的峰面积进行积分来计算每次FA滴定碱性矿物的反应热. 然后可以绘制累积吸附热ΣQ(mJ·g−1)与每克碱性矿物进行反应的FA物质的量(μmol·g−1)的关系图. ΣQ曲线(图7)的斜率提供了吸附的摩尔焓ΔH(kJ·mol−1),并且恒定斜率意味着恒定ΔH. FA与四种碱性矿物的曲线图的比较表明,在每次滴定的FA的量与样品池中矿物质量比相同的条件下,钙霞石与FA反应的热效应是最明显的,方钠石与FA相互作用产生的热效应是相对最微弱的. 此外,FA 吸附于四种碱性矿物表面的 ΣQ曲线差异也较明显. 随FA 在钙霞石表面吸附量的增加,ΣQ以相同的速率变化,形成斜率几乎不变的线性ΣQ曲线. 相反,其他3种碱性矿物的ΣQ曲线呈现出两个不同斜率的线性段. 这些结果表明,FA在钙霞石表面的吸附机制更加均一,而方解石、石榴石和方钠石与FA之间的相互作用机制异质性更强. ΔH曲线直观地显示了FA与不同矿物相互作用的驱动机制差异(图8). 方钠石和钙霞石与FA的相互作用均为放热反应,但是ΔH的变化趋势有所不同,钙霞石-FA的ΔH曲线表现为ΔH随着滴定FA量的增加而稳步下降;而方钠石-FA的ΔH曲线的变化相对复杂,这说明虽然两种矿物与FA的相互作用同为放热反应,但是驱动机制存在差异. 同样地,方解石和石榴石与FA的相互作用均为吸热反应,但是相较方解石-FA,石榴石-FA的ΔH曲线变化趋势较单一,表明这两种矿物与FA之间的驱动机制存在差异.
利用ITC实验得到FA与碱性矿物相互作用的热力学参数如表3所示,摩尔焓ΔH和摩尔熵ΔS由ITC的滴定曲线得到. 比较表3中四种碱性矿物的结合常数(KT),最大的为钙霞石,最小的为石榴石,此趋势与光谱结果相符. 然而,通过ITC得到的碱性矿物的结合常数与荧光淬灭常数大小存在差异,这是由于:ITC 提供了一种直接的热力学表征方法来确定小分子与大分子(如有机质)之间的非共价平衡相互作用,而荧光光谱只局限于提供关于荧光组分结合的信息,从而间接计算相互作用力 [35]. 通过ΔH和ΔS计算得到的ΔG的负值证实了反应的自发性,四种碱性矿物的ΔH没有显著差异,这种驱动机制的异质性没有反映在ΔH中. 从表3可以看到, 除方钠石以外,其他3种矿物的ΔS对ΔG的负值做出了贡献,这表示它们之间的反应是熵驱动的,而在方钠石与FA的相互作用过程中焓变占主导地位.
-
系统pH的变化和FA在矿物表面的吸附可以改变矿物的Zeta电位. 对于碱性矿物,其Zeta电位随着系统pH的增加而降低(图9a). 这归因于OH−在矿物表面的吸附. 除方解石外,其他三种碱性矿物在碱性条件下的Zeta电位均为负. 与10 mg·L−1的FA相互作用后,各pH下碱性矿物的Zeta电位出现了不同程度的下降(图9b),这是因为溶液中FA的羧基、酚羟基等含量较高的酸性官能团的解离,导致FA带有大量负电荷,FA吸附在矿物表面从而产生一个负电位的表面. 其中下降幅度最大的是方解石,在各个pH下反应前后的电位差均达到30 mV以上. 这可能是方解石表面带有的正电荷对FA的负电荷具有较强的静电吸引力[36],而其他碱性矿物在与FA反应前表面就带有负电荷,更多的是通过氢键、疏水作用等弱相互作用来影响矿物表面的Zeta电位,因此Zeta的电位变化较方解石要小.
-
本研究采用分子光谱与ITC相结合的手段对赤泥中典型碱性矿物与富里酸的相互作用进行研究,可以进一步指导优化赤泥的矿相调控与基质改良. 研究发现:
1) FA在方解石上的吸附过程主要受单层表面吸附,在石榴石表面的吸附为多层吸附,且均为表面反应控制. FA与方钠石和钙霞石的反应不只是简单的吸附,相互作用会导致这两种碱性矿物的溶解. 方钠石和钙霞石均与荧光FA具有较强的结合亲和力,石榴石与FA荧光的亲和力较弱,而方解石仅与小部分FA结合. 碱性矿物和FA之间的相互作用导致有机大分子结构的酸性官能团和分子构型的改变.
2) ITC结果表明不同碱性矿物在与FA的相互作用中具有不同的热力学性质,这与分子光谱的结果相对应. 钙霞石与FA表现出相对均匀的相互作用机制,熵变占主导地位,方解石和石榴石则表现出非均匀的熵驱动机制,而方钠石则为非均匀的焓驱动机制.
3) 碱性矿物相互作用后的Zeta电位发生了显著变化,表明FA吸附在碱性矿物表面,导致矿物颗粒表面的负电荷密度显著增加.
不同碱性矿物与FA之间的相互作用机制具有差异性,这可以为有机质改良策略应用于不同赤泥所表现出的差异化效果提供可参考的科学解释. 在赤泥的生态修复过程中,应根据赤泥中主要碱性矿物的组成来制定具有针对性的改性策略,为赤泥土壤化调控与碱性调控手段的有效选择提供理论依据和技术支撑.
富里酸与赤泥碱性矿物相互作用机制研究
Interactions between fulvic acid and alkaline minerals in bauxite residue
-
摘要: 赤泥的生态修复受到广泛关注,有机质在赤泥的成土过程中起着至关重要的作用. 然而,赤泥中有机物和碱性矿物之间的相互作用尚不清楚. 本工作采用分子光谱技术和等温滴定量热法(isothermal titration calorimetry,ITC)相结合的方法,研究了富里酸(fulvic acid,FA)与赤泥中4种具有代表性的碱性矿物(方解石、石榴石、方钠石和钙霞石)之间的相互作用. 结果表明,FA在方解石上的吸附过程主要为单层表面吸附,在石榴石表面的吸附为多层吸附,且均为表面反应控制. 而方钠石和钙霞石的吸附过程则涉及到矿物的溶解. 方钠石和钙霞石都与荧光FA具有很强的亲和力,相反,石榴石与荧光FA的结合较弱,而方解石仅与少量FA结合. ITC结果表明,不同碱性矿物在与FA的相互作用中具有不同的热力学性质. 钙霞石与FA表现出以熵变为主的相对均匀的相互作用机制,而其他碱性矿物则表现出非均匀熵或焓驱动机制. 这些发现有助于了解有机质-碱性矿物的相互作用及其对赤泥生态修复的影响.Abstract: Ecological restoration of bauxite residue has received widespread attention, with organic matter playing a crucial role in the soil formation process. However, the interactions between organic matter and alkaline minerals in bauxite residue remain unclear. In this work, molecular spectroscopic techniques combined with isothermal titration calorimetry (ITC) were employed to investigate the interactions between fulvic acid (FA) and four representative alkaline minerals in bauxite residue (i.e., calcite, garnet, sodalite, and cancrinite). The results indicate that the adsorption of FA on calcite primarily involves monolayer surface adsorption, while on garnet surfaces, it occurs as multilayer adsorption, both of which are governed by surface reactions. In comparison, the adsorption of FA on sodalite and cancrinite involves mineral dissolution. Sodalite and cancrinite exhibit strong binding affinity with fluorescent FA, whereas garnet shows weaker binding affinity, and calcite binds only with a small amount of FA. The ITC results indicate distinct thermodynamic properties of different alkaline minerals in the interaction with FA. Cancrinite shows a relatively uniform interaction mechanism dominated by entropy changes, while other alkaline minerals exhibit non-uniform entropy or enthalpy-driven mechanisms. These findings contribute to a better understanding on the interaction between organic matter and alkaline minerals and their possible effects on the ecological restoration of bauxite residue.
-

-
表 1 FA在方解石和石榴石上吸附的等温吸附模型和准二级动力学模型的拟合参数
Table 1. Parameters of the isothermal adsorption models and pseudo-second-order kinetic models for the adsorption of FA onto calcite and garnet
拟合模型
Fitting model参数
Parameters碱性矿物
Alkaline mineral方解石
Calcite石榴石
Garnet方钠石
Sodalite钙霞石
CancriniteLangmuir qm /(μmol·g−1) 0.88±0.07 — — — KL×106 0.15±0.04 — — — lnKL 11.92 — — — R2 0.92 0 0.69 0 Freundlich kF 0.45±0.16 0.22±0.04 — — n 2.74 2.78 — — R2 0.80 0.90 0 0 Pseudo-second-order
kinetic modelR2 0.99 0.99 0.99 0.99 —,未计算得到. —, uncalculated. 表 2 FA-碱性矿物相互作用后溶液中的元素含量
Table 2. Elemental contents in the solution after FA-alkaline mineral interactions
FA的浓度/(mg·L−1)
concentration of FACa/(mg·L−1) Na/(mg·L−1) Al/(mg·L−1) Si/(mg·L−1) calcite 0 23.4 0 0 0 100 25 0 0 0 garnet 0 0.9 0 0.5 1.7 100 1.8 0 0.6 2.5 sodalite 0 0 80 9.5 3.5 100 0 92.7 9.6 4.2 cancrinite 0 0 93 1.1 15.4 100 0 138.3 2.6 17.1 FA 100 0 0 0 0 表 3 碱性矿物上FA吸附的热力学参数
Table 3. Thermodynamic parameters of FA adsorption on alkaline minerals
碱性矿物
Alkaline mineralKT(M−1) ΔH (kJ·mol−1) TΔS (kJ·mol−1) ΔG (kJ·mol−1) Calcite 7.74×103 1.80 22.24 -20.44 Garnet 3.31×103 1.66 16.62 -14.96 Sodalite 7.32×104 -2.63 2.31 -4.94 Cancrinite 1.75×105 -3.08 32.73 -35.81 -
[1] COURTNEY R, HARRINGTON T, BYRNE K A. Indicators of soil formation in restored bauxite residues[J]. Ecological Engineering, 2013, 58: 63-68. doi: 10.1016/j.ecoleng.2013.06.022 [2] XUE S G, ZHU F, KONG X F, et al. A review of the characterization and revegetation of bauxite residues (Red mud)[J]. Environmental Science and Pollution Research, 2016, 23(2): 1120-1132. doi: 10.1007/s11356-015-4558-8 [3] LYU F, HU Y H, WANG L, et al. Dealkalization processes of bauxite residue: A comprehensive review[J]. Journal of Hazardous Materials, 2021, 403: 123671. doi: 10.1016/j.jhazmat.2020.123671 [4] KONG X F, LI M, XUE S G, et al. Acid transformation of bauxite residue: Conversion of its alkaline characteristics[J]. Journal of Hazardous Materials, 2017, 324(Pt B): 382-390. [5] 李瑜辉, 谢武明, 吕文东, 等. 赤泥基零价铁类芬顿降解罗丹明B和磺胺嘧啶的催化性能[J]. 环境化学, 2022, 41(2): 707-718. doi: 10.7524/j.issn.0254-6108.2020100402 LI Y H, XIE W M, LYV W D, et al. The Fenton-like catalytic performance of zero valent iron based red mud for degradation of rhodamine B and sulfadiazine[J]. Environmental Chemistry, 2022, 41(2): 707-718 (in Chinese). doi: 10.7524/j.issn.0254-6108.2020100402
[6] ZHU F, LI X F, XUE S G, et al. Natural plant colonization improves the physical condition of bauxite residue over time[J]. Environmental Science and Pollution Research, 2016, 23(22): 22897-22905. doi: 10.1007/s11356-016-7508-1 [7] 张雪, 王重庆, 曹亦俊. 赤泥固废土壤化修复研究进展[J]. 有色金属(冶炼部分), 2021(3): 84-92. ZHANG X, WANG C Q, CAO Y J. Research progress on soilification of red mud solid waste[J]. Nonferrous Metals(Extractive Metallurgy), 2021(3): 84-92 (in Chinese).
[8] LUO Y F, CHEN Y L, WAN Z Y, et al. Molecular insights into the chemodiversity of dissolved organic matter and its interactions with the microbial community in eco-engineered bauxite residue[J]. Chemosphere, 2023, 330: 138755. doi: 10.1016/j.chemosphere.2023.138755 [9] 薛生国, 李晓飞, 孔祥峰, 等. 赤泥碱性调控研究进展[J]. 环境科学学报, 2017, 37(8): 2815-2828. XUE S G, LI X F, KONG X F, et al. Alkaline regulation of bauxite residue: A comprehensive review[J]. Acta Scientiae Circumstantiae, 2017, 37(8): 2815-2828 (in Chinese).
[10] TIAN T, LIU Z, ZHU F, et al. Improvement of aggregate-associated organic carbon and its stability in bauxite residue by substrate amendment addition[J]. Land Degradation & Development, 2020, 31(16): 2405-2416. [11] XUE S G, LI M, JIANG J, et al. Phosphogypsum stabilization of bauxite residue: Conversion of its alkaline characteristics[J]. Journal of Environmental Sciences(China), 2019, 77: 1-10. doi: 10.1016/j.jes.2018.05.016 [12] 朱锋, 李萌, 薛生国, 等. 自然风化过程对赤泥团聚体有机碳组分的影响[J]. 生态学报, 2017, 37(4): 1174-1183. ZHU F, LI M, XUE S G, et al. Effects of natural weathering processes on the distribution characteristics of organic carbon and its composition in bauxite residue aggregates[J]. Acta Ecologica Sinica, 2017, 37(4): 1174-1183 (in Chinese).
[13] FLEURY G, del NERO M, BARILLON R. Molecular fractionation of a soil fulvic acid (FA) and competitive sorption of trace metals (Cu, Zn, Cd, Pb) in hematite–solution systems: Effect of the FA-to-mineral ratio[J]. RSC Advances, 2017, 7(68): 43090-43103. doi: 10.1039/C7RA06838G [14] HOARAU M, BADIEYAN S, MARSH E N G. Immobilized enzymes: Understanding enzyme–surface interactions at the molecular level[J]. Organic & Biomolecular Chemistry, 2017, 15(45): 9539-9551. [15] SAAR R A, WEBER J H. Fulvic acid: Modifier of metal-ion chemistry[J]. Environmental Science & Technology, 1982, 16(9): 510A-517A. [16] 肖骁, 何小松, 席北斗, 等. 生活垃圾填埋富里酸电子转移能力与影响因素[J]. 环境化学, 2018, 37(4): 679-688. doi: 10.7524/j.issn.0254-6108.2017082910 XIAO X, HE X S, XI B D, et al. Electron transfer capacity of fulvic acid and its factors during municipal solid waste landfill[J]. Environmental Chemistry, 2018, 37(4): 679-688 (in Chinese). doi: 10.7524/j.issn.0254-6108.2017082910
[17] 周岩梅, 张琼, 汤鸿霄. 多环芳烃类有机物在腐殖酸上的吸附行为研究[J]. 环境科学学报, 2010, 3(8): 1564-1571. ZHOU Y M, ZHANG Q, TANG H X. Sorption behavior of polycyclic aromatic hydrocarbons onto humic acid particulates[J]. Acta Scientiae Circumstantiae, 2010, 3(8): 1564-1571 (in Chinese).
[18] GOEBEL M O, WOCHE S K, ABRAHAM P M, et al. Water repellency enhances the deposition of negatively charged hydrophilic colloids in a water-saturated sand matrix[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2013, 431: 150-160. [19] CASTALDI P, SILVETTI M, SANTONA L, et al. XRD, FTIR, and thermal analysis of bauxite ore-processing waste (red mud) exchanged with heavy metals[J]. Clays and Clay Minerals, 2008, 56(4): 461-469. doi: 10.1346/CCMN.2008.0560407 [20] LIU Y, LIN C X, WU Y G. Characterization of red mud derived from a combined Bayer Process and bauxite calcination method[J]. Journal of Hazardous Materials, 2007, 146(1/2): 255-261. [21] PAN X L, YU H Y, TU G F. Reduction of alkalinity in bauxite residue during Bayer digestion in high-ferrite diasporic bauxite[J]. Hydrometallurgy, 2015, 151: 98-106. doi: 10.1016/j.hydromet.2014.11.015 [22] ZHANG D R, CHEN H R, NIE Z Y, et al. Extraction of Al and rare earths (Ce, Gd, Sc, Y) from red mud by aerobic and anaerobic bi-stage bioleaching[J]. Chemical Engineering Journal, 2020, 401: 125914. doi: 10.1016/j.cej.2020.125914 [23] PARADIS M, DUCHESNE J, LAMONTAGNE A, et al. Long-term neutralisation potential of red mud bauxite with brine amendment for the neutralisation of acidic mine tailings[J]. Applied Geochemistry, 2007, 22(11): 2326-2333. doi: 10.1016/j.apgeochem.2007.04.021 [24] ZHAI H, ZHANG W J, WANG L J, et al. Dynamic force spectroscopy for quantifying single-molecule organo–mineral interactions[J]. CrystEngComm, 2021, 23(1): 11-23. doi: 10.1039/D0CE00949K [25] OLIVELLI M S, FUGARIU I, TORRES SANCHEZ R M, et al. Unraveling Mechanisms behind Biomass-Clay Interactions Using Comprehensive Multiphase Nuclear Magnetic Resonance (NMR) Spectroscopy[J]. Acs Earth and Space Chemistry, 2020, 4(11): 2061-2072. doi: 10.1021/acsearthspacechem.0c00215 [26] LIU S Y, KLEBER M, TAKAHASHI L K, et al. Synchrotron-Based Mass Spectrometry to Investigate the Molecular Properties of Mineral-Organic Associations[J]. Analytical Chemistry, 2013, 85(12): 6100-6106. doi: 10.1021/ac400976z [27] CHEN W, WESTERHOFF P, LEENHEER J A, et al. Fluorescence excitation - Emission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environmental Science & Technology, 2003, 37(24): 5701-5710. [28] CHEN H, KOOPAL L K, XIONG J, et al. Mechanisms of soil humic acid adsorption onto montmorillonite and kaolinite[J]. Journal of Colloid and Interface Science, 2017, 504: 457-467. doi: 10.1016/j.jcis.2017.05.078 [29] SONG F, WU F, GUO F, et al. Interactions between stepwise-eluted sub-fractions of fulvic acids and protons revealed by fluorescence titration combined with EEM-PARAFAC[J]. Science of the Total Environment, 2017, 605: 58-65. [30] EUSTERHUES K, WAGNER F E, HAEUSLER W, et al. Characterization of Ferrihydrite-Soil Organic Matter Coprecipitates by X-ray Diffraction and Mossbauer Spectroscopy[J]. Environmental Science & Technology, 2008, 42(21): 7891-7897. [31] CHEN C, KUKKADAPU R, SPARKS D L. Influence of Coprecipitated Organic Matter on Fe2+(aq)- Catalyzed Transformation of Ferrihydrite: Implications for Carbon Dynamics[J]. Environmental Science & Technology, 2015, 49(18): 10927-10936. [32] WU Y, DENG D, JIANG J, et al. Ca-driven stable regulatory of alkalinity within desilication products: Experimental, modeling, transformation mechanism and DFT study[J]. Science of the Total Environment, 2023, 868. [33] YANG Z L, GAO B Y, YUE Q Y, et al. Effect of pH on the coagulation performance of Al-based coagulants and residual aluminum speciation during the treatment of humic acid–kaolin synthetic water[J]. Journal of Hazardous Materials, 2010, 178(1): 596-603. [34] BAIBARAC M, SMARANDA I, NILA A, et al. Optical properties of folic acid in phosphate buffer solutions: the influence of pH and UV irradiation on the UV-VIS absorption spectra and photoluminescence[J]. Scientific Reports, 2019, 9. [35] 王宁. 分子光谱和等温滴定量热法研究蛋白与小分子的相互作用[D]. 郑州大学, 2019. WANG N. Study of Interaction between Protein and Small Molecules by Molecular Spectroscopy and Isothermal Titration Calorimetry[D]. Zhengzhou University, 2019.
[36] ZHANG C, WEI S, HU Y, et al. Selective adsorption of tannic acid on calcite and implications for separation of fluorite minerals[J]. Journal of Colloid and Interface Science, 2018, 512: 55-63. doi: 10.1016/j.jcis.2017.10.043 -




 下载:
下载: