-
对苯二胺类物质(PPDs)是一类合成抗氧化剂,因其卓越的热稳定性、抗降解和抗臭氧诱导开裂能力而被广泛用于多种橡胶产品,如汽车轮胎、胶管、胶带等[1]. 此外,许多其他橡胶相关产品也是其潜在来源,如衣服、娱乐设施、运动器材、电线电缆等[2]. 其中,N-(1,3-二甲基丁基)-N′-苯基-对苯二胺(6PPD)是最常用的轮胎抗氧化剂,在2020年仅中国6PPD年产量就超过20万吨[3],其它PPDs,例如N-异丙基-N′-苯基-1,4-苯二胺(IPPD)、N,N′-二苯基-对苯二胺(DPPD)和N,N′-二甲苯基-对苯二胺(DTPD)的年产量也相当可观[4]. 然而,大规模的生产和消费导致大量的PPDs排放到环境中,可能经氧化转化为相应的醌类衍生物(PPDQs)[5]. 越来越多的证据表明,PPDs及PPDQs广泛存在于城市径流、沉积物、空气颗粒物和室内灰尘中[6 − 7],甚至在包括敏感人群(儿童和孕妇)在内的人体血液、尿液、母乳及脑脊液样本中也有检出[8 − 9].
PPDs及PPDQs对环境和健康的潜在威胁引起了人们的严重担忧[10]. 研究发现,6PPD对水生生物具有物种特异性毒性,当浓度达到10 μg·L−1时,会对斑马鱼仔鱼产生亚致死效应[11],影响斑马鱼胚胎的生长和发育,降低其孵化率、自主运动能力和体长,并导致畸形. DPPD暴露对大鼠表现出生殖发育毒性,可以通过影响怀孕大鼠的前列腺素水平来延长妊娠期并导致难产[12]. 另外,有研究发现,皮肤直接接触橡胶制品(如轮胎、鞋子、橡胶管)中的IPPD和N-苯基-N′-环己基-对苯二胺(CPPD)与人类过敏性接触性皮炎的发生有关[13]. 值得注意的是,环境中PPDQs的浓度与其母体PPDs相当甚至更高[14],对水生生物的毒性可能比其相应的PPDs更强[15]. 例如,幼年银鲑对于6PPDQ的半数致死浓度(95 ng·L−1)比6PPD(250 mg·L−1)低
1000 倍以上[16]. 此外,研究还揭示了6PPDQ对水生生物和哺乳动物的其他毒性作用,包括神经毒性、发育毒性、肝毒性和免疫毒性等[10, 17]. 水生细菌——费希弧菌暴露于PPDs和PPDQs的生物反应实验表明,PPDQs可降低酯酶活性,引起细胞膜损伤和细胞内氧化应激,并通过竞争结合对蛋白质的功能造成潜在影响,一些新PPDQs对水生细菌的毒性明显高于已研究的6PPDQ[15]. 目前,PPDQs对哺乳动物的不良影响尚未得到充分揭示和全面评估. 然而,与其他已知引发氧化应激和DNA损伤的醌类物质相似,这些PPDQs也可能导致类似的结果[18 − 19].考虑到PPDs及PPDQs在全球各种环境介质中的普遍存在,且在不同环境介质中的浓度分布存在显著差异,全面监测这些化合物在环境中的分布情况,了解人体的暴露水平以及探究其潜在的毒理学效应至关重要. 本文综述了PPDs及PPDQs的来源,在环境中的分布情况及浓度水平,并探讨了不同人群通过各种途径对PPDs和PPDQs的暴露水平及其潜在的健康影响,为后续的环境监测、风险评估和管理防控提供科学依据. 主要PPDs以及PPDQs名称信息见表1.
-
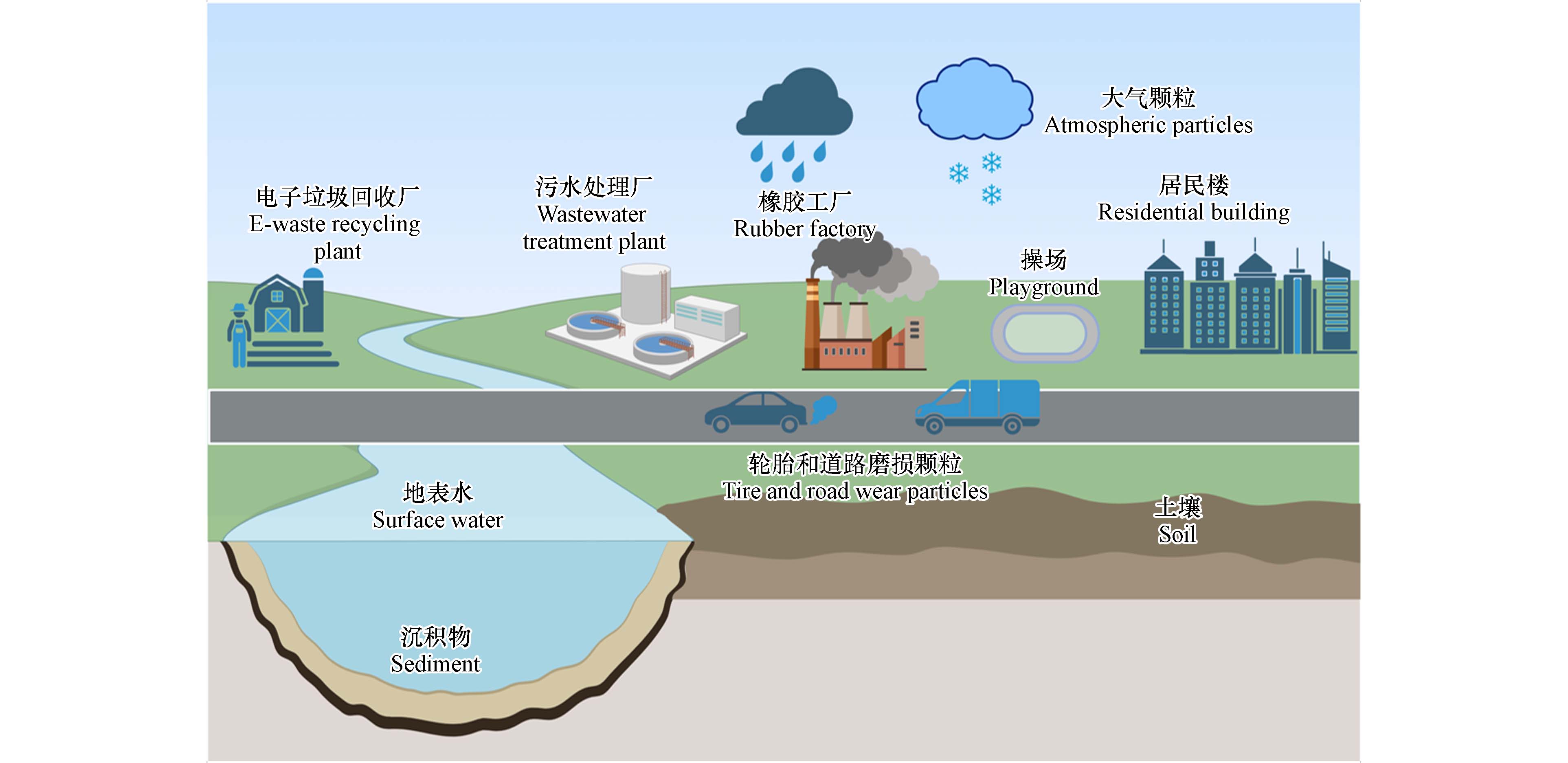
环境中的PPDs和PPDQs主要来源于车辆橡胶轮胎的磨损,除此之外,其他橡胶相关产品,如衣服、运动器材、橡胶管,再生橡胶以及电子垃圾等(如电线电缆),也是这些化合物的重要来源(图1). 这些产品和材料的广泛使用及处理过程释放出大量的PPDs和PPDQs(表2),并通过不同的途径进入环境,包括大气沉降、表面径流以及废水排放等.
-
轮胎及其他橡胶相关产品的大规模生产和广泛使用以及持续磨损,都会导致大量PPDs和PPDQs释放到环境中. 轮胎的构成复杂,主要包括合成/天然橡胶、各种填料和化学添加剂. PPDs被广泛用作抗氧化剂添加至汽车轮胎产品以延长其使用寿命[20],如6PPD在商用车轮胎配方中的质量分数通常为1%—4%[21]. PPDs抗氧化剂并不仅局限于在轮胎中使用,还广泛应用于其他非轮胎橡胶产品,如管道、皮带、软管和鞋类等[22]. Zhao等[2]在实验室瓶塞、运动鞋鞋底和花园橡胶软管等产品中广泛检测到PPDs和PPDQs类化合物,进一步证实了这些产品是PPDs及PPDQs类化合物的重要来源,尽管其浓度比轮胎产品低1—2个数量级,但成分组成更加多样化. 工业橡胶配方中常使用“混合PPDs”成分,例如,6PPD和7PPD通常作为1:2共混物使用,6PPD和IPPD(烷基芳基PPD)通常与DTPD或DPPD(二芳基PPD)联合使用,因为烷基芳基PPD提供短期保护,而较大的二芳基PPD在橡胶材料中的扩散速度较慢,因此提供较长期的保护[23],其他未记录的性能、成本和制造方面的考虑也可能影响消费品中PPD抗氧化剂的选择. 此外,在多种室内环境的灰尘样本中检测到多种PPDs和PPDQs,包括大学宿舍、购物中心、家用空调、住宅卧室以及公交车等[3]. 这一发现表明,其他橡胶相关产品,如服装、娱乐设施、家具和家用电器,也可能是PPDs和PPDQs的潜在排放源. 因此需要对更多类型的橡胶样品进行研究,以更好地了解消费产品和PPD系列化学成分之间的关系.
-
除了橡胶相关产品的直接排放,车辆在加速、制动和转弯等过程中,轮胎和道路的磨损颗粒也会释放PPDs及PPDQs到环境中,并产生新的降解和转化产物[24]. 全球每年轮胎磨损颗粒的排放量约为590万吨[25],这些轮胎磨损颗粒的尺寸范围广泛,较小的颗粒可以在空气中传播,对大气、土壤、沉积物和径流有很大贡献,其中3%—7%的PM2.5被认为是由轮胎磨损引起的[25],较大的颗粒则聚集在道路上或附近,在暴风雨天气容易通过不透水地面的径流输送,可能成为城市地表水的重要污染源[26]. PPDs可以轻易从轮胎磨损颗粒中浸出[27],日光照射和高温会促进PPDs向PPDQs转化[24],PPDs及PPDQs在简单的水相系统中通常具有较低的溶解性,且在短时间内相对稳定,这有助于其向道路径流迁移,并可能对当地水生环境造成显著的负面影响[26]. 较小的轮胎颗粒由于其更高的有机化合物溶出速率,更有可能将PPDs及PPDQs渗入水生系统,从而呈现出更高的环境风险[28]. Zhang等[2]发现轮胎磨损颗粒中∑PPDs的浓度高达
2600 μg·g−1,高于其转化产物∑PPDQs的浓度(19 μg·g−1),且PPDs及PPDQs的浓度高于其它工业添加剂(如轮胎黏合剂、硫化促进剂、腐蚀抑制剂等),表明PPDs相关化合物是一类在轮胎中含量丰富但以前被忽视的污染物. 研究还发现PPDs和PPDQs呈现功能区污染特征,城市隧道道路为污染严重区域,其次是城市主干道,住宅区和郊区道路尘土污染程度较低[29]. 这些研究结果表明交通相关来源对PPDs和PPDQs的重要贡献,强调了表征这些化合物相对浸出速率以及研究其环境和人类暴露的必要性. -
废旧橡胶的再利用也是PPDs和PPDQs的重要来源. 路面与车辆轮胎产生的磨损颗粒仅占轮胎橡胶总量的小部分,轮胎使用更换后产生的大部分废旧轮胎橡胶会被回收利用,生产各种再生橡胶产品,如人造草坪、操场铺装、健身垫、建筑材料、人行道、健身中心地板等[30 − 31]. 这些橡胶制品受到风化和各种环境条件的影响而释放[32],据估计每年每个标准尺寸运动场损失
1500 —2500 kg的橡胶颗粒[2]. 一项研究在再生橡胶门垫和人造草坪的橡胶颗粒中检测到了高浓度的7种PPDs(分别为800—900 μg·g−1和0.36—280 μg·g−1)以及5种PPDQs(11—30 μg·g−1和1.2—30 μg·g−1),其中6PPD、DTPD、DPPD及其对应的PPDQs为主要成分,PPDQs在橡胶颗粒中比母体PPDs更稳定,存在时间更长[2]. 人造草坪橡胶颗粒中的PPDs及PPDQs的总浓度与欧洲化学品管理局和美国环保署在橡胶颗粒化学品监管清单中优先考虑的多环芳烃、酚类或邻苯二甲酸酯的浓度相当,甚至高出多达10倍[2]. 在中国北京,采集到的室外橡胶游乐场灰尘中6PPD的浓度(30.4 ng·g−1)高于室内客厅物体表面灰尘中的浓度(16.4 ng·g−1),表明橡胶游乐场也是PPDs和PPDQs的重要来源[33]. 然而,由于再生橡胶消费品的化学成分通常被视为专有和保密的商业信息,其对环境和人类健康的风险评估仍然存在困难和不确定性,并且可能被低估[2]. -
最近的研究表明,除轮胎橡胶外,电子垃圾回收拆解活动是PPDs和PPDQs的重要来源之一. 在电子垃圾回收区周围住宅的室内灰尘样本中,6PPD的浓度(108.99 ng·g−1)显著高于参考区域灰尘样本的浓度(33.57 ng·g−1)[34]. 进一步对中国华南某大型电子垃圾回收产业园的车间灰尘进行分析,证实了PPDs和PPDQs的大量存在,且广泛检测到的6PPDQ的环境丰度(375 ng·g−1)高于其母体6PPD(113 ng·g−1)[35]. 此外,在中部电子垃圾回收工业园区车间内采集的灰尘样本中,发现∑6PPDQs(
1110 ng·g−1)的浓度明显高于母体∑6PPDs(147 ng·g−1)[36],同时,研究还发现PPDs与它们各自的衍生醌类之间存在显著的相关性,说明室内灰尘中PPDs和PPDQs之间的同源关系. 在电子垃圾的回收拆解过程中,PPDs可能转化为相应的PPDQs并释放到环境中. 此外,电线、电缆和电子塑料加工车间的粉尘中PPDs和PPDQs浓度明显高于电视机、电脑等电子垃圾加工车间的粉尘浓度[35],这表明电线、电缆和电子塑料是PPDs和PPDQs更为重要的排放源,通常情况下,电缆和电线会使用橡胶或塑料作为绝缘材料包裹. 因此,电子垃圾回收作为PPDs和PPDQs的重要排放源,需要引起重视和管控. -
PPDs和PPDQs广泛存在于多种环境介质中,如路边土壤、城市径流、沉积物、空气颗粒物及室内和室外灰尘等[6]. 不同环境介质中的PPDs和PPDQs组成和浓度分布存在显著差异,且受温度、光照、气候和水文条件等环境因素的影响. 表3和表4概括了这些化合物在不同环境介质中的浓度.
-
大气颗粒的比表面积较大,能够吸附多种有机和无机物质[37]. PPDs和PPDQs广泛存在于各种大气颗粒中,如PM2.5、PM10等(表3),并且其浓度呈现出显著的时空依赖性变化[3]. Zhang等[38]在中国6个典型特大城市的PM2.5中证实了PPDs和PPDQs的普遍分布. 另外,Wang等[39]揭示了在中国广州和太原这两个大城市的PM2.5中,6种PPDQs与8种PPDs总浓度范围分别为3.61—
8480 pg·m−3和3.61—13200 pg·m−3,并表明这些醌类化合物大多数源自其对应的母体PPDs的转化. 6PPD和6PPDQ是广州大气PM2.5中最主要的PPDs及PPDQs,6PPD及IPPD的浓度显著高于美国芝加哥大气颗粒样本中的浓度[40]. 车辆橡胶轮胎的磨损被认为是大气PM2.5中PPDs和PPDQs的主要来源,然而,在太原这样的重工业城市,电线电缆橡胶涂层的磨损也是一个重要的来源,这与该地区对电力的大量需求和电线电缆的广泛使用有关[41]. PM2.5中PPDs和PPDQs的日总浓度呈现出明显的季节性波动,夏季和冬季峰值较高,而春季和秋季较低,这可能是由于在炎热和寒冷的天气中,人们更倾向于使用私家车或公共汽车而不是步行[42]. 此外,冬季的逆温现象可能导致雾霾难以扩散,从而使城市PM2.5浓度升高,也有利于大气颗粒物中PPDs和PPDQs的大量积累[43]. PM2.5中6PPDQ与6PPD和O3呈正相关[38],表明在O3和6PPD浓度高的地区,PM2.5中6PPDQ的生成可能增强,这也可能是夏季6PPDQ浓度较高的原因之一. 当6PPD释放到环境中时,会发生反应形成羟基化的6PPD中间体,该中间体随后与气态臭氧快速反应生成6PPDQ[44]. 夏季其他PPDQs浓度水平的升高表明,除了6PPD,其他PPDs也可能经历类似的转化反应生成相应的醌.此外,6PPDQ倾向于聚集在较大的空气颗粒物中,在9—10 μm粗颗粒中的浓度(7.78—23.2 pg·m−3)显著高于1.1—2.1 µm粒径范围颗粒中的浓度(1.04—3.73 pg·m−3)[3]. 在PM2.5颗粒中6PPDQ的丰度与其氧化电位之间存在很强的正相关性,这表明6PPDQ对细颗粒物的氧化潜能也有一定的贡献[45]. 因此,通过大气颗粒吸入PPDQs可能对人类产生潜在的健康风险.
-
灰尘是室内和室外环境中各种化学物质的汇聚地[46],是人类接触PPDs和PPDQs的重要来源[14, 47]. 在室外灰尘中,轮胎磨损颗粒是道路和停车场等车辆相关微环境的重要组分. 室内灰尘中的PPDs相关化合物可能来自空气颗粒物和室外灰尘的沉积、以及橡胶相关消费品的开裂、浸出以及降解等[7]. 人们大约90%的生活时间是在室内度过,因此室内灰尘也是评估污染物暴露水平的重要指标[48]. 在室内和室外灰尘样本中广泛检测到多种PPDs和PPDQs(表3)[36]. 在杭州居民区的室内灰尘中检测到了9种PPDs(55 ng·g−1)以及5种PPDQs(14 ng·g−1),其中6PPD和6PPDQ的浓度最高,分别占总PPDs和PPDQs的41%和59%,其次是DTPD及DTPDQ[7]. 6PPD和IPPD的浓度远高于美国(1.84 ng·g−1和0.35 ng·g−1)和加拿大(0.83 ng·g−1和0.11 ng·g−1)居民区室内灰尘的浓度[40]. 电子垃圾拆解区车间室内收集的灰尘样本中,∑6PPDs和∑6PPDQs的总浓度(887 ng·g−1和
1110 ng·g−1)显著高于车间室外灰尘(27.4 ng·g−1和701 ng·g−1)和参考区室外灰尘(60.8 ng·g−1和935 ng·g−1)以及杭州居民区室内灰尘样本,且PPDQs的浓度显著高于母体PPDs[36]. 值得注意的是,DPPDQ(781 ng·g−1)和DNPDQ(156 ng·g−1)在电子垃圾回收区室内环境中普遍存在,且丰度很高,在天津居民区的室内灰尘中也发现了超高浓度的DPPDQ,占总PPDQs的95%[14],表明DPPDQ作为新兴的污染物在室内灰尘中浓度很高,需要引起重视. 电子垃圾拆解区室内和室外灰尘样本的成分组成特征及浓度水平存在差异,可能是由于不同来源导致的,汽车轮胎可能是室外灰尘中PPDs和PPDQs的主要来源,电子垃圾拆解活动是室内灰尘中PPDs和PPDQs释放的重要来源. 此外,较高的室温可能会加速室内环境中化学污染物的释放. 研究发现汽车内灰尘样本中的6PPDQ浓度远高于停车场灰尘和道路灰尘,表明密闭空间、强烈的太阳辐射或高温可能会促进6PPD从汽车非轮胎橡胶材料中的释放和转化[3]. 与室外环境相比,室内环境的气相氧化剂(O3、HONO和·OH自由基)和光照水平(尤其是紫外线辐射)较低,也可能导致PPDs和PPDQs在室内环境中的行为与室外有所不同[36]. PPDs和PPDQs的浓度在不同粒径组分中也存在差异,主要存在于粒径小于250 μm的灰尘颗粒中,占总浓度的70%以上,在细颗粒(<53 μm)中浓度更高[49]. 不同环境中的灰尘成分和浓度存在差异,室温、气相氧化剂和光照水平等因素可能影响PPDs和PPDQs的行为,不同灰尘粒径中PPDs和PPDQs的组分也存在差异,因此需要全面评估和监测多种环境中细灰尘颗粒的PPDs和PPDQs污染水平和潜在风险. -
轮胎磨损颗粒进入路面后,受到阳光和雨水的挥发、淋滤和转化作用,PPDs及PPDQs被浸出并释放到环境中[50],通过地表降雨径流和道路排水进入城市水循环系统,如污水处理厂和饮用水处理厂等[51],还可能通过河流输送到全球海洋[4]. PPDs及PPDQs在地表径流、河流、沉积物、雪和融雪以及污水处理厂废水和海洋水体中广泛存在(表4).
-
研究发现,珠江和东江水中6PPD、DPPD和DTPD的平均浓度为0.04—6.37 ng·L-1[1]. Cao等[6]在香港径流水中检测到5种PPDs和6种PPDQs,∑6PPDQs的总浓度(0.74—3.87 μg·L−1)高于母体∑5PPDs(0.04—3.00 μg·L−1). CPPD、6PPD、DPPDQ、IPPDQ和6PPDQ在径流水中的检出频率很高(100%),表明它们在水环境中广泛存在. 6PPDQ的浓度范围为0.21—2.43 μg·L−1,在径流水总PPDQs中占主导地位(48.8%)[6],高于澳大利亚(0.38—88 ng·L−1)[20]和加拿大(290—890 ng·L−1)[52]的河流样品中检测到的浓度,与美国河流样品的浓度相当(200—
3500 ng·L−1)[16]. 在珠江三角洲城市河流——椒江的地表水中检测到的∑9PPDs(1.7—88 ng·L−1)及∑6PPDQs的总浓度显著低于香港径流水,以6PPD和6PPDQ为主[53]. 另外在水体中发现6PPDQ、CPPDQ、IPPDQ和7PPD与其相应的母体化合物存在着显著的相关性,这表明地表水中的这些PPDQs主要来自其母体PDDs的转化[54]. 在模拟阳光照射、pH值为7.0的条件下,6PPD在水中转化为6PPDQ,90 min内的摩尔产率达到了1.01%[54],进一步证实了光诱导6PPD转化可能是水生环境中6PPDQ的重要来源. 这些研究揭示了PPDs和PPDQs在城市地表水环境中的普遍性和分布情况,强调需要进一步研究以更好地了解这些化合物对水生生态系统的影响. -
PPDs和PPDQs在水体中可以向沉积物迁移[55 − 56],优先附着在水体中细颗粒物(如淤泥和黏土)上[57],这些颗粒物容易以悬浮状态通过河流进行运输,并沉积在河口和邻近的海岸区域,在沿岸流和洋流的推动下被进一步输送到海洋[58],沉积物中∑7PPDs和∑4PPDQs的总浓度呈现出明显的空间趋势,从城市河流(39.7 ng·g−1和15.2 ng·g−1)到河口(14.0 ng·g−1和5.85 ng·g−1),再到海岸(9.47 ng·g−1和2.97 ng·g−1)和深海区域(5.24 ng·g−1和3.96 ng·g−1),随着迁移距离的增加,浓度逐渐降低[4]. 此外,6PPD与6PPDQ比率也随着空间变化呈现出明显的下降趋势,城市河流的比值(2.54)高于珠江口(1.45)、沿海(0.97)和深海(0.95)[4]. 这种趋势可能归因于6PPDQ比其母体化合物6PPD更稳定,且6PPD在环境中会转化为6PPDQ[50]. 椒江沉积物中的以6PPD和6PPDQ为主要的PPDs和PPDQs,其含量明显高于珠江三角洲(14.4 ng·g−1和9.03 ng·g−1)和珠江口沉积物(3.92 ng·g−1和2 ng·g−1),且6PPD和IPPD的浓度显著高于美国芝加哥船舶运河表层沉积物中的浓度[40],这种差异可能与河流流速、水环境条件和化学转化等因素有关[53]. 沉积物污染物的水平是反映水污染和评估底栖生物生态风险的指标,多种具有潜在的高水生毒性PPDQs在淡水和海洋沉积物中的普遍存在及空间变化趋势表明河流可能是将这些轮胎橡胶衍生化学物质输送到海洋的重要途径,其对水生生物的生态风险的需要引起特别关注.
-
污水处理厂是人类向水环境排放化学物质的重要来源之一[59 − 60]. 城市径流、道路雨水和橡胶工业废水中大量的PPDs和PPDQs通过市政污水管网进入污水处理厂,经过一系列的处理后,重新被排放到环境中[61]. 香港4个典型污水处理厂的进水、出水和生物固体中的PPDs和PPDQs的浓度检测结果显示,进水中∑5PPDs和∑5PPDQs的总浓度分别为2.7—90 ng·L−1和14—830 ng·L−1,低于在同一城市道路径流中测得的水平[6],可能是由于工业废水、生活污水以及雨水汇聚的稀释. 在出水中,它们的浓度分别降至0.59—40 ng·L−1和2.8—140 ng·L−1. DPPDQ是进水和出水中主要的PPDQs化合物,其次是6PPDQ、IPPDQ和CPPDQ[62]. PPDs和PPDQs在污水处理厂中主要通过一级处理(添加三氯化铁和聚合物进行快速沉淀)和紫外线消毒以及氯化过程(添加次氯酸钠)被去除. 氯化处理可去除约23.5%的PPDQs,而紫外线处理可去除81.5%,因此紫外线照射被视为从污水处理厂中去除PPDQs的有效方法. 在不同的污水处理厂中,PPDQs的去除率在53.0%至91.0%之间,这表明这些污染物中有相当一部分可能无法通过当前的处理技术完全去除. 因此,这些污染物以ng·L−1的水平从污水处理厂的出水排放到收纳水体中,据估算∑PPDQs人均日排放量(1.11—71.7 μg·d−1)高于其母体∑PPDs(0.259—19.6 μg·d−1),而PPDQs的半衰期比其相应的PPDs长,能在水系统中保留更长时间,可能对水生环境造成重大生态危害. 污泥中PPDQs的保留水平(20.0%)高于废水中的保留水平(16.9%)[62],污水处理厂中回收的生物固体中∑PPDQs和∑PPDs的人均每日排放水平相当,由于香港污水处理厂产生的生物固体有一部分被回收用作土壤改良剂,应特别注意含有这些污染物的生物固体在农业和土壤改良中的再利用.
-
与常见的环境基质(如水、灰尘和空气颗粒)相比,关于雪中环境污染物的研究文献相对较少. 大气雪作为空气污染物的有效清除剂,对水/土壤中污染物通量有显著的贡献[63]. 在城市环境中,积雪可能积累与交通有关的PPDs和PPDQs,随着春季气温的上升,这些化合物随着融雪径流释放到下水道系统和地表水,甚至可能通过河流输送到深海[64 − 65]. 在中国7个城市地区收集的大气雪中发现了6种PPDs(0.4—260 pg g−1)和5种PPDQs(0.7—104 pg g−1)的广泛分布. 相比于径流水和路边土壤[6],大气雪中PPDs和PPDQs的浓度较低,以IPPDQ和6PPDQ及其相应母体化合物为主要成分. 橡胶轮胎的磨损是城市大气雪中PPDs的主要来源,而高浓度的PPDs有利于PPDQs的形成. 值得注意的是,大气O3水平与雪中单个PPD及PPDQ的浓度存在负线性关系,鉴于O3在大气中具有强氧化性,过量的O3可能会进一步氧化PPDQs,降低其在大气雪中的污染水平,这可能类似于之前研究中报道的O3和苯醌之间的反应途径[66],Q3可能导致C—C键的断裂、醌环的打开,最终将PPDQ氧化成不同的羧酸,准确的机制有待深入研究. 此外,与降雪之前采集的湖泊水样进行比较,降雪之后观察到湖泊水样浓度明显的上升趋势[67],说明大气降雪和融雪对内陆湖泊中PPDs和PPDQs的污染水平可能存在放大作用,对水环境构成更大的潜在危害.
-
土壤作为各类化学物质的储存库,对区域尺度上PPDs和PPDQs的来源分析和储存具有重要意义[68]. PPDs和PPDQs可能通过灰尘和大气颗粒物的沉降、固体废物的排放、地表径流输送及废水灌溉等方式进入土壤[69]. 在香港新界和九龙路边采集的土壤样本中∑5PPDs和∑6PPDQs的总浓度范围分别为36.3—847 ng·g−1和12.4—1976 ng·g−1,其中6PPD和6PPDQ的浓度占比最高,检出率为100%. 相比于中国广州停车场灰尘样本(41.8 ng·g−1)、车内灰尘样本(80.9 ng·g−1)和室内房屋灰尘样本,香港路边土壤的6PPD(309 ng·g−1)和6PPDQ的浓度(234 ng·g−1)较高[6],意味着路边土壤可能是人类接触6PPDQ和其他PPDQs的重要来源. 除了含PPDQs的灰尘和颗粒物沉降及生物固体废物的堆积,土壤中轮胎磨损颗粒老化过程也会导致6PPDQ的形成和积累. 研究表明,在厌氧淹水土壤中6PPD更容易转化为6PPDQ. 土壤轮胎磨损颗粒在老化60 d后,淹水土壤中6PPDQ的积累量比湿润土壤高3.8倍. 在早期阶段,铁还原耦合6PPD促进了淹水土壤中6PPDQ的形成,后期轮胎磨损颗粒中环境中持久性自由基向超氧自由基(O2•−)的转化进一步促进了6PPDQ的形成[70]. 土壤作为人类接触PPDs和PPDQs的主要来源之一,需要深入地研究这些化学物质在土壤中迁移和转化机制,评估其对环境生态和人类健康的风险.
-
PPDs及PPDQs在尿液、血清、母乳和脑脊液等人体生物样本中被广泛检出(表5). Mao等[8]在151名中国成年人的尿液中检测到9种PPDs,总浓度范围为0.41—38 ng·mL−1. 其中,6PPD是主要的PPDs,其次是CPPD和7PPD. 女性参与者尿液的6PPD和CPPD平均浓度(1.4 ng·mL−1和1.0 ng·mL−1)明显高于男性(1.0 ng·mL−1和0.83 ng·mL−1). 此外,随着参与者年龄的增长,尿液中DPPD、CPPD、7PPD和6PPD的浓度总体呈下降趋势. 另一项研究在天津居民尿液样本中检测到了5种PPDs(0.04 ng·mL−1)和6种PPDQs(3.76 ng·mL−1). DPPDQ、CPPDQ和DNPDQ在尿液中的检出率和浓度相对较高,而其母体化合物CPPD、DNPD和DPPD在尿液样本中大多检测不到,这可能是由于它们在室内灰尘环境中的浓度相对较低,也表明人体内可能存在CPPD、DPPD和DNPD的代谢途径. 值得注意的是,天津居民尿液中6PPD和6PPDQ的检出率和浓度较低,明显低于中国广州普通成人(0.018 ng·mL−1和0.40 ng·mL−1)、儿童(0.015 ng·mL−1和0.076 ng·mL−1)和孕妇(0.068 ng·mL−1和2.91 ng·mL−1)尿液样本的浓度[71]. 这可能与地理差异以及使用橡胶、塑料等物品频率的差异有关. 此外,在中国华南地区广州的一般城市人口中,有52%的母乳样本中检测到了6PPD[9],与在尿液中的检出率相当[71]. 然而,所有母乳样本中均未检测到6PPDQ,这与之前在人类尿液中的测量结果相反. 从6PPD和6PPDQ的理化性质来看,6PPDQ的亲水性比母体6PPD高,可能使其易通过尿液排出,但不易穿过血乳屏障进入乳汁[9]. Liu等[72]收集了50名女性和50名男性参与者的配对血浆和尿液样本,发现尿液中6PPDQ浓度(0.116 μg·g−1)明显高于血浆中6PPDQ浓度(中值ND),表明6PPD和6PPDQ在血液中的残留量较差,尿液是一种实用的6PPD和6PPDQ暴露生物监测指标基质. 在中国143名健康个体和138名继发性非酒精性脂肪性肝病患者的血清样本中发现6PPDQ的浓度中值高于6PPD和IPPD[73],与Zhang等[74]测定的血液样本中的6PPDQ的浓度相当(0.24 ng·mL−1). 在帕金森病患者(n= 13)的脑脊液样本中6PPDQ的平均浓度(11.18 ng·mL−1)是对照组(n= 11)的两倍(5.07 ng·mL−1)[75]. 这些研究说明,人们普遍暴露于PPDs及PPDQs,且PPDQs的内暴露比其母体化合物更为严重,需要更多的研究来评估其暴露对人类的毒性和健康风险.
-
人类接触PPDs和PPDQs污染物的途径包括摄入、吸入和皮肤吸收(表6). Cao等[6]利用香港土壤和空气颗粒物中PPDs和PPDQs的浓度,估算了成人和儿童通过土壤摄入、空气吸入和皮肤吸收对这些污染物的每日摄入量,发现儿童每日摄入PPDs和PPDQs的量高于成人,提示儿童对PPDs和PPDQs的暴露剂量相对较高. 此外,摄入路边土壤是人体接触PPDs和PPDQs的主要因素,其次是皮肤吸收和空气吸入. 一项研究根据电子垃圾回收车间内灰尘和工人擦手巾样本中PPDs和PPDQs的浓度,估算了工人对PPDs和PPDQs的职业暴露,发现通过灰尘摄入和皮肤接触途径对∑6PPDQs每日摄入总量显著高于其母体化合物∑6PPDs,且灰尘摄入对人体暴露的贡献显著大于皮肤吸收. 这表明灰尘摄入是电子垃圾回收工业园区工人职业暴露于PPDs和PPDQs的主要途径. 在天津市的普通居民中,通过皮肤接触每日摄入的∑6PPD和∑6PPDQs剂量为0.05 ng·kg−1bw·d−1和14.8 ng·kg−1bw·d−1,比通过灰尘摄入分别高出近5倍和38倍. 这表明,与灰尘摄入相比,皮肤接触是普通人群中PPDs和PPDQs更主要的暴露途径. 根据尿液浓度计算女性的每日6PPDQ内暴露量(7.381 ng·kg−1bw·d−1)和明显高于男性(3.360 ng·kg−1bw·d−1),可能是因为女性接触橡胶制品的频率更高,包括家庭用品,药品和个人护理产品等[76],药代动力学的性别差异和尿液肌酐水平的变化也可能导致男性和女性体内6PPDQ浓度的不同[77]. 值得注意的是,通过尿液∑PPDs和∑PPDQs浓度计算的每日排泄水平评估的内暴露水平明显高于根据环境浓度评估的通过空气吸入、灰尘/土壤摄入、皮肤吸收的每日摄入量的外暴露水平,表明可能存在更多的暴露途径(如饮食)和暴露环境(如工作场所、户外和车内). 此外通过灰尘摄入和皮肤接触的每日总∑6PPDQs摄入量分别显著高于母体∑6PPDs摄入量的近40倍和297倍. 这表明需要更多地关注与PPDQs相关的暴露及健康风险,尤其是对于暴露水平相对较高且易受影响的婴儿和儿童[14].
目前关于PPDs和PPDQs对人类健康的潜在威胁的研究仍然有限. 流行病学研究发现,在华南人群中,6PPD浓度升高与继发性非酒精性脂肪性肝病的患病率增加有关. 血清6PPD浓度与脂质过氧化产物的浓度呈正相关,且与肝毒性相关的总胆红素(β = 0.180 μmol·L−1,95% CI:0.036—0.396)和直接胆红素的浓度(β = 0.321 μmol·L−1,95% CI:0.035—0.677)显著相关,提示脂质过氧化产物介导6PPD暴露相关的总胆红素水平的升高,表明6PPD暴露可能引起氧化应激和肝损伤[73]. 同时,在天津普通成人中发现每日通过尿液排出的6PPDQ的量与白细胞计数(诱导氧化应激增加,使炎症加剧)呈正相关,并且与丙氨酸氨基转移酶(肝功能损伤的重要指标)存在潜在相关性,在一定程度上提示6PPDQ对肝脏/免疫功能的影响[72]. Zhang等[78]也发现从室内灰尘中每日摄入较多6PPDQ与儿童的BMI较低和流感和腹泻的发生率较高有关,这表明6PPDQ可能对儿童的生长发育和免疫系统产生不利影响. 进一步对35种常见的外来化合物靶蛋白和12种PPDs/PPDQs进行分子对接,结果表明PPDs和PPDQs与肝脏X受体有较强的结合作用,表明其潜在的肝毒性作用[36]. 利用广泛使用的细胞模型——体外HepG2细胞系比较了PPDs(DPPD、DNPD和6PPD)与其对应的PPDQs(DPPDQ、DNPDQ和6PPDQ)之间的毒性差异,与母体PPDs相比,3种PPDQs的细胞活力呈剂量依赖性下降. 暴露于0.1—100 μg·L−1的PPDs和PPDQs导致细胞存活率下降了5.24%—34.42%,提示存在肝毒性风险. 因此,不仅应关注6PPD和6PPDQ,还应关注可能对人体健康造成危害且不可忽视的重要新兴污染物——PPDs和PPDQs[14].
-
本文综合分析了有关PPDs和PPDQs来源及其在各种环境介质和人体体液中的文献,探讨了PPDs和PPDQs暴露对人体健康的潜在风险. 环境中的PPDs和PPDQs主要来源于汽车轮胎橡胶的磨损,其他橡胶相关产品(如衣服、运动器材、橡胶管)以及再生橡胶和电子垃圾(如电线电缆等)也是其重要来源. 臭氧水平、温度和水文条件等因素可能会影响PPDs和PPDQs在环境中的浓度和分布. 人们通过多种暴露途径广泛接触到各类PPDs及PPDQs,且PPDQs的内暴露水平比其母体化合物更为严重,可能对人体健康造成威胁,尤其是对肝脏和免疫功能的影响,但其毒理学机制仍需进一步探讨. 目前尚未确定PPDs和PPDQs的每日摄入量限值,主要是因为对这些化合物暴露引起的生物学效应的研究有限. 因此建议将以下方面作为未来研究的重点.
(1)大部分研究主要关注于灰尘和水体环境中的PPDs和PPDQs,而对大气、土壤和沉积物中的浓度信息了解相对有限. 需要进行更多的环境监测研究来全面调查和了解这些化合物在各种环境介质中的分布情况. 同时,进一步研究PPDs和PPDQs在环境中的行为和转化方式对于评估其生物累积性、环境持久性以及确定其对环境生态与人体健康的影响至关重要.
(2)目前关于不同人群的PPDs和PPDQs暴露水平及其潜在的健康影响的流行病学证据有限. 应该寻找能够反映敏感群体内部暴露及健康结局的潜在生物标志物,有效评估人体暴露水平并探索其对公共卫生和疾病负担的潜在影响.
(3)对于PPDs和PPDQs类化学物质在生物体内的吸收、分布、代谢和排泄等过程的了解有限. 需要进一步研究这些化学物质在体内的生物转化以及降解产物的潜在危害及毒理学作用机制.
(4)需要确定不同类型PPDs和PPDQs的参考剂量及每日可接受的摄入量,特别是针对与橡胶相关抗氧化剂接触的职业暴露者. 考虑到个人可能同时接触多种混合物,需要综合评估混合物的安全参考阈值.
我国对苯二胺类抗氧化剂及其衍生醌类化合物污染现状及健康风险研究进展
A review of contaminations and health risks of p-phenylenediamine antioxidants and their derived novel quinones
-
摘要: 对苯二胺类物质(PPDs)通常被用作橡胶工业中的抗氧化剂,以延长橡胶产品(如轮胎)的使用寿命. PPDs的醌类转化产物(PPDQs)近来被视为一类新兴的污染物,因其对一系列水生生物的急性致死毒性而引起广泛关注. PPDs及PPDQs在环境中普遍存在,并可通过多种暴露途径进入人体而对健康造成潜在威胁. 本文回顾了目前关于PPDs和PPDQs的来源、浓度和分布的报道,比较不同人群通过各种途径的对PPDs和PPDQs的暴露水平及评估其潜在的健康风险. 研究发现,温度、光照、臭氧水平及水文条件等因素影响各环境介质中的PPDs和PPDQs的浓度和分布. 此外,人们也普遍暴露于多种PPDs及PPDQs,且PPDQs的内暴露水平比其母体化合物更为严重. 现有的流行病学证据表明PPDs和PPDQs可能对人类健康产生不利影响,干扰肝脏和免疫功能,但其毒理学机制尚不清楚. 迫切需要开展更多研究以全面了解PPDs和PPDQs对环境和人类健康的影响.Abstract: p-Phenylenediamines (PPDs) are widely used as antioxidants in the rubber industry to extend the service life of rubber products, such as tires. Their quinone derivatives (PPDQs) have recently garnered significant attention as emerging pollutants due to the acute lethal toxicity to various aquatic organisms. PPDs and PPDQs are ubiquitous in the environment and can enter the human body through various pathways, potentially posing adverse effects on human health. This article provides a comprehensive review of the existing literature on the sources, concentrations, and distributions of PPDs and PPDQs in the environment. Additionally, the exposure levels of PPDs and PPDQs among different populations through various pathways and their potential health risks are evaluated. The study results indicate that the concentrations and distributions of PPDs and PPDQs in the environment are influenced by numerous factors, such as temperature, light, ozone, and hydrological conditions. It is evident that people are commonly exposed to various PPDs and PPDQs, with higher internal exposure levels observed for PPDQs compared to their parent compounds. Existing epidemiological evidence suggests that exposure to PPDs and PPDQs may have adverse effects on human health, potentially disrupting liver and immune functions, whereas the toxicological mechanisms remain unclear. Further research is urgently needed to comprehensively understand the environmental and health impacts of PPDs and PPDQs.
-
Key words:
- p-phenylenediamine /
- 6PPD quinone /
- concentration /
- exposure route /
- health risk.
-

-
表 1 PPDs及其相对应的PPDQs的缩写及理化性质
Table 1. The abbreviations and physicochemical properties of PPDs and their corresponding PPDQs
橡胶抗氧化剂
Rubber antioxidant缩写
Abbreviation相对分子质量
Molecular
weightCAS 正辛醇/水
分配系数
lgKowPPD衍生物
PPD
derivative相对分子质量
Molecular
weightCAS 正辛醇/水
分配系数
lgKowN-1,3-dimethylbutyl-N'-phenyl-p-phenylenediamine 6PPD 268.19 793-24-8 4.64 6PPDQ 298.17 2754428 -18-53.94 N-(1,4-dimethylpentyl)-N′-phenylbenzene-1,4-diamine 7PPD 282.4 3081 -01-45.17 7PPDQ 312.37 NA 4.47 N-(1-methylheptyl)-N′-phenyl-1,4-benzenediamine 8PPD 296.45 15233 -47-35.74 8PPDQ 326.42 NA 5.03 N,N′-bis(1,4-dimethylpentyl)-p-phenylenediamine 77PD 304.29 3081 -14-96.30 77PDQ 334.26 NA 5.47 N-(1,4-dimethylpentyl)-N′-phenylbenzene-1,4-diamine IPPD 226.15 101-72-4 3.28 IPPDQ 256.12 68054 -73-92.58 N-phenyl-N'-cyclohexyl-p-phenylenediamine CPPD 266.18 101-87-1 3.28 CPPDQ 296.37 68054 -78-43.46 N,N'-diphenyl-p-phenylenediamine DPPD 260.13 74-31-7 4.47 DPPDQ 290.32 3421 -08-73.98 N,N'-bis(methylphenyl)-1,4-benzenediamine DTPD 288.38 15017 -02-45.13 DTPDQ 350.43 252950 -56-44.56 表 2 PPDs和PPDQs的来源以及浓度(μg·g−1) [2]
Table 2. The sources and concentrations of PPDs and PPDQs (μg·g−1)
污染物
Pollutant轮胎磨损颗粒
Tire wear particle人造草皮场橡胶粒
Crumb rubber再生轮胎橡胶门垫
Doormat运动鞋鞋底
Sneaker Sole实验室瓶塞
Laboratory stopper花园橡胶软管
Garden hose6PPD 2300 1.2 (0.047—95) 630 (500—770) 0.14 (0.051—0.41) 0.71 (ND—3.7) 0.071 7PPD 13 0.022 (ND—0.26) 0.55 (0.2—0.9) ND 0.026 (ND—0.034) ND 77PD ND ND ND ND ND ND IPPD 0.89 0.11 (ND—0.12) 0.24 (0.16—0.32) ND ND ND DPPD 30 1.1 (0.12—18) 26 (3.9—49) ND (ND—0.08) 0.34 (ND—1.7) ND DTPD 300 20 (0.2—160) 190 (20—360) 0.19 (ND—0.69) 5 (ND—16) ND DNPD ND ND (ND—0.03) 1.5 (ND—3) 0.27 (ND—1.1) ND 0.074 6PPDQ 12 9.8 (0.3—25) 18 (11—26) 0.48 (0.37—0.75) 0.74 (ND—1.7) ND 7PPDQ 0.1 0.077 (ND—0.23) 0.02 (ND—0.04) ND ND (ND—0.015) ND DPPDQ 5.7 1.6 (0.8—4) 1.5 (ND—3.1) ND ND (ND—0.84) ND DTPDQ 1.6 0.37 (0.099—1.2) 0.43 (0.066—0.79) 0.03 (0.027—0.048) ND (ND—0.075) ND ND,未检出. ND, Not detected. 表 3 大气、灰尘和土壤中PPDs和PPDQs的浓度
Table 3. Concentrations of PPDs and PPDQs in the atmosphere, dust, and soil
样本类型
Sample type大气细颗粒物/(pg·m−3)
PM2.5车间灰尘/(ng·g−1)
Indoor dust室外灰尘/(ng·g−1)
Outdoor dust室内灰尘/(ng·g−1)
Indoor dust室内灰尘/(ng·g−1)
Indoor dust路边土壤/(ng·g−1)
Soil采样区域 广州 太原 香港 华中地区 华中地区 杭州 天津 香港 采样点 广东工业大学 山西大学 香港浸会大学 电子垃圾回收区 电子垃圾回收区 住宅公寓 住宅 新界和九龙 采样时间 2017年5月—2018 年4月 2017年5月—2018年4月 2021年8—9月 2020年10—11月 2020年10—11 月 2022年7—8月 2022年7—12月 2021年8—9月 样本量 24 24 16 76 30 97 97 12 参考文献 [39] [39] [6] [36] [36] [7] [14] [6] 6PPD 1820 (22.2— 6050 )81 (1.02— 3190 )1.78 (0.82—6.30) 4.01 (0.854—310) 3.92 (0.708—76.6) 10 (0.48—135) 1.118 (ND—147.1) 309 (31.4—831) 7PPD 6.23 (ND—18.7) ND (ND—75.0) 77PD 413 (ND— 2980 )3.78 (ND— 4150 )IPPD 230 (1.71— 3690 )125 (0.49— 2830 )0.91 (0.44—2.73) 62.0 (ND—940) 8.10 (ND—78.7) 0.92 (ND—19) 1.703 (ND— 1359 )1.13 (0.66—24.5) CPPD 64.3 (ND—431) 5.7 (ND—27.5) 0.38 (ND—0.74) ND (ND—16.3) ND (ND—2.64) 1.9 (ND—19) 0.294 (ND—184.6) 1.19 (0.73—15.4) DPPD 553 (55.0— 2590 )374 (0.69—1940) 0.5 (ND—0.70) 2.21 (ND—26.0) 0.173 (ND—1.15) 0.97 (ND—12) ND (ND—4.742) 11.8 (3.63—84.4) DTPD 22.4 (14.7—27.1) 3.23 (ND—9.03) 2.86 (ND—2.88) 57.7 (5.64—684) 14.6 (3.94—38.9) 5.4 (ND—48) ND (ND—50.80) 4.82 (ND—6.78) DNPD 16.3 (ND—35.6) 5.22 (ND—36.7) ND (ND—44.3) 1.2 (1.2—20) ND (ND—0.687) 6PPDQ 1100 (3.04—2350 )744 (2.44— 1780 )1.18 (0.54—13.8) 36.4 (3.74—311) 10.2 (1.74—55.8) 9.5 (0.33—82) 11.87 (ND—104.1) 234 (9.50—936) 77PDQ 527 (0.57— 2990 )11.3 (ND— 2870 )IPPDQ 65.5 (ND—131) 2220 (ND—2940 )0.82 (ND—86.36) 23.9 (ND—312) 0.24 (ND—1.80) 0.2 (ND—0.94) 0.804 (ND—99.30) 3.06 (ND—564) CPPDQ 12.4 (ND—31.4) 1280 (ND—1380 )0.17 (ND—17.5) 31.5 (4.90—732) 3.75 (ND—17.6) 0.64 (ND—17) 15.49 (ND—597.7) 3.12 (ND—152) DPPDQ 41.5 (ND—512) 552 (ND—766) 1.91 (0.93—95.7) 781 (7.90— 3900 )315 (96.7— 2980 )1.2 (ND—11) 1565 (ND—11590 )60.2 (2.87—747) DTPDQ ND (ND—0.73) 0.36 (ND—3.23) 0.13 (ND—7.96) 16.5 (0.272—190) 0.77 (0.135—3.64) 3.3 (ND—31) 2.514 (ND—47.76) 7.94 (1.94—107) DNPDQ 156 (29.2—1920) 202 (40.5— 652) 48.65 (ND—517.7) ND,未检出. ND, Not detected. 表 4 水体介质中PPDs和PPDQs的浓度
Table 4. Concentrations of PPDs and PPDQs in water
样本类型 地表径流水/(ng·L−1)
Runoff water地表径流水/(ng·L−1)
Runoff water废水(进水)/(ng·L−1)
Wastewater influent废水(出水)/(ng·L−1)
Wastewater effluent废水处理生物固体/(ng·g−1)
Biosolids沉积物/(ng·g−1)
Sediment大气雪/(pg·g−1)
Atmospheric snow融雪/(pg·mL−1)
Snow melt采样区域 浙江 香港 香港 香港 香港 浙江 郑州 郑州 采样点 台州椒江入海口 九龙交通密集城区 污水处理厂 污水处理厂 污水处理厂 台州椒江入海口 天鉴湖公园 天鉴湖公园 采样时间 2022年10月 2021年8月 2021年10—11月 2021年10—11月 2021年10—11月 2022年10月 2022年1—2月 2022年1—2月 样本量 30 9 40 8 30 9 9 参考文献 [53] [6] [62] [62] [62] [53] [67] [67] 6PPD 10 (4.0—72) 0.32 (0.21—2.71) 12 (1.1—59) 0.30 (ND—15) 5.5 (2.1—71) 25 (1.6—172) 13 (10—16) 12 (9.5—15) 7PPD 0.31 (ND—4.6) 1.2 (ND—8.9) 77PD 0.087 (ND—0.67) 0.71 (ND—1.9) IPPD 1.9 (ND—8.9) 0.32 (0.21—2.71) 5.5 (0.63—33) 0.71 (0.13—28) 0.47 (0.25—1.9) 1.3 (ND—42) 17 (13—69) 16 (12—64) CPPD 1.5 (ND—7.0) 0.01 (ND—0.05) 0.40 (ND—1.2) 0.13 (0.05—0.2) 0.65 (0.48—0.83) 3.3 (ND—18) 10 (6.3—19) 9.4 (5.9—18) DPPD 1.5 (ND—7.0) 0.01 (0.01—0.02) 0.56 (0.39—1.2) 0.20 (ND—0.28) 0.64 (0.49—2.0) 6 (ND—17) 8.2 (5.1—10) 7.7 (4.8—9.4) DTPD ND (ND—0.81) 0.01 (ND—0.01) 0.35 (ND—1.3) ND (ND—0.3) 0.54 (0.53—0.74) 3.8 (ND—10) 4.5 (3.2—9.2) 4.2 (3—8.6) DNPD 15 (11—33) 14 (11—30) 6PPDQ 6.1 (ND—21) 1.12 (0.21—2.43) 53 (1.9—470) 3.4 (1.1—37) 6.4 (2.6—7.3) 19 (ND—46) 5.6 (3.7—10) 5.2 (3.5—9.5) 7PPDQ 0.15 (ND—0.63) 0.84 (ND—7.3) 77PDQ ND (ND—1.9) 1.12 (0.21—2.43) 0.1 (ND—0.54) IPPDQ 0.18 (ND—7.4) 0.56 (0.18—0.95) 0.96 (0.36—3.5) 0.41 (0.06—1.7) 0.19 (ND—0.39) 1.3 (ND—42) 7.9 (5.5—16) 7.4 (5.1—15) CPPDQ 1.5 (ND—8.6) 0.06 (ND—0.31) 0.20 (ND—0.36) 0.04 (ND—0.16) 1.2 (0.35—2.5) 2.8 (ND—25) 6.1 (5—12) 5.7 (5—12) DPPDQ ND (ND—4.0) 0.19 (0.11—0.35) 110 (11—360) 4.3 (1.1—100) 45 (19—240) 1.8 (ND—29) 17 (10—24) 16 (10—22) DTPDQ 0.02 (0.01—0.82) ND ND ND 6 (4.6—116) 5.6 (4.3—109) 表 5 人体PPDs和PPDQs的浓度
Table 5. Concentrations of PPDs and PPDQs in human body fluids
样本类型
Sample type尿液
Urine尿液
Urine母乳
Human milk血清
Serum血清
Serum采样区域 天津 浙江省衢州市 华南地区广州 中国南方地区 中国南方地区 采样点 普通居民 普通人群 一般城市人口 健康人群 非酒精性脂肪性肝病人群 采样时间 2022年7—12月 2019 年 4 月 2020—2021 年 2021年12月—2022 年6月 2021年12月—2022 年6月 样本量 97 151 120 143 138 参考文献 [14] [8] [9] [73] [73] 检出率 /%
Detection frequency浓度/(ng·mL−1)
Concentration检出率 /%
Detection frequency浓度/(ng·mL−1)
Concentration检出率 /%
Detection frequency浓度/(pg·mL−1)
Concentration检出率 /%
Detection frequency浓度/(ng·mL−1)
Concentration检出率/%
Detection frequency浓度/(ng·mL−1)
Concentration6PPD 34 ND (ND—0.119) 82 1.1 (ND—3.8) 52 4.10 (ND—57.4) 64 0.057 (ND—1.73) 72 0.071 (ND—0.65) 7PPD 75 0.61 (ND—2.3) 77PD 44 ND (ND—0.88) IPPD 65 0.040 (ND—0.952) 78 0.092 (ND—0.93) 15 ND (ND—161) 60 0.050 (ND—0.27) 62 0.040 (ND—1.78) CPPD 18 ND (ND—0.211) 69 0.84 (ND—2.5) DPPD 75 0.13 (ND—0.85) DTPD 17 ND (ND—0.426) 24 ND (ND—1.3) DNPD 3 ND (ND—0.015) 34 ND (ND—1.6) 6PPDQ 27 ND (ND—0.073) 0 ND 71 0.13 (ND—1.06) 73 0.20 (ND—0.78) IPPDQ 31 ND (ND—0.300) 0 ND 47 ND (ND—0.011) 64 0.0033 (ND—0.015)CPPDQ 90 0.165 (ND—1.118) DPPDQ 89 3.436 (ND—15.51) DTPDQ 22 ND (ND—3.511) DNPDQ 98 0.158 (ND—1.206) 表 6 不同人群通过多种途径对PPDs和PPDQs的每日摄入量
Table 6. Daily intakes of PPDs and PPDQs in different populations through multiple pathways
暴露类型
Exposure type地点
Area暴露方式
Exposure pathway暴露人群
Exposure population参考文献
ReferencePPDs PPDQs 污染物
Pollutant每日摄入量/(ng·kg−1bw·d−1)
Daily intake污染物
Pollutant每日摄入量/(ng·kg−1bw·d−1)
Daily intake职业暴露 华中地区 车间灰尘摄入 电子垃圾回收职业工人 [36] ∑6PPDs (DPPD, CPPD, 6PPD, IPPD, DNPD, and DTPD) 0.073 (0.021—0.094) ∑6PPDQs (DPPDQ,
CPPDQ, 6PPDQ, IPPDQ, DNPDQ, and DTPDQ)0.595 (0.258—0.687) 皮肤吸收 0.004 (4.18×10−6—0.016) 0.226 (0.002—1.00) 普通人群暴露 中国香港 空气吸入和土壤摄入 儿童 [6] ∑5PPDs (DPPD, CPPD, 6PPD, IPPD, and DTPD) 4.85 ∑5PPDQs (DPPDQ, CPPDQ, 6PPDQ, IPPDQ, and DTPDQ) 7.30 成人 0.71 1.08 普通人群暴露 杭州 室内灰尘暴露 婴儿 [7] DPPD, CPPD, 6PPD, IPPD, DNPD, and DTPD 2.6—54 DPPDQ, CPPDQ, 6PPDQ, and IPPDQ, DTPDQ 0.85—44 儿童 1.1—23 0.37—19 成人 0.55—11 0.18—9.5 普通人群暴露 中国多个省份 道路灰尘摄入 儿童 [29] ∑6PPDs (IPPD, CPPD, DPPD, 6PPD, 77PD, and DNPD) 0.143 6PPDQ 0.076 成人 0.081 0.043 皮肤吸收 儿童 0.021 0.011 成人 0.016 0.0084 普通人群暴露 中国香港 空气吸入 儿童 [39] ∑8PPDs (IPPD, CPPD, 6PPD, 7PPD, 77PD, DPPD, DTPD, and DNPD) 0.194 ∑6PPDQs (IPPDQ, CPPDQ, 6PPDQ, 77PDQ, DPPDQ, and DTPDQ) 0.161 成人居民 0.24 0.439 工人 0.408 0.338 普通人群暴露 杭州 自来水摄入 儿童 [79] ∑8PPDs (IPPD, CPPD, 6PPD, 7PPD, 77PD, DPPD, DTPD, and DNPD) 0.011—0.031 成人 0.014—0.04 -
[1] ZHANG H Y, HUANG Z, LIU Y H, et al. Occurrence and risks of 23 tire additives and their transformation products in an urban water system[J]. Environment International, 2023, 171: 107715. doi: 10.1016/j.envint.2022.107715 [2] ZHAO H N, HU X M, GONZALEZ M, et al. Screening p-phenylenediamine antioxidants, their transformation products, and industrial chemical additives in crumb rubber and elastomeric consumer products[J]. Environmental Science & Technology, 2023, 57(7): 2779-2791. [3] ZHANG Y J, XU T T, YE D M, et al. Widespread N-(1, 3-Dimethylbutyl)-N′-phenyl-p-phenylenediamine quinone in size-fractioned atmospheric particles and dust of different indoor environments[J]. Environmental Science & Technology Letters, 2022, 9(5): 420-425. [4] ZENG L X, LI Y, SUN Y X, et al. Widespread occurrence and transport of p-phenylenediamines and their quinones in sediments across urban rivers, estuaries, coasts, and deep-sea regions[J]. Environmental Science & Technology, 2023, 57(6): 2393-2403. [5] HU X M, ZHAO H N, TIAN Z Y, et al. Transformation product formation upon heterogeneous ozonation of the tire rubber antioxidant 6PPD (N-(1, 3-dimethylbutyl)-N′-phenyl-p-phenylenediamine)[J]. Environmental Science & Technology Letters, 2022, 9(5): 413-419. [6] CAO G D, WANG W, ZHANG J, et al. New evidence of rubber-derived quinones in water, air, and soil[J]. Environmental Science & Technology, 2022, 56(7): 4142-4150. [7] ZHU J Q, GUO R Y, JIANG S T, et al. Occurrence of p-phenylenediamine antioxidants (PPDs) and PPDs-derived quinones in indoor dust[J]. Science of the Total Environment, 2024, 912: 169325. doi: 10.1016/j.scitotenv.2023.169325 [8] MAO W L, JIN H B, GUO R Y, et al. Occurrence of p-phenylenediamine antioxidants in human urine[J]. Science of the Total Environment, 2024, 914: 170045. doi: 10.1016/j.scitotenv.2024.170045 [9] LIANG B W, GE J L, DENG Q, et al. Occurrence of multiple classes of emerging synthetic antioxidants, including p-phenylenediamines, diphenylamines, naphthylamines, macromolecular hindered phenols, and organophosphites, in human milk: Implications for infant exposure[J]. Environmental Science & Technology Letters, 2024, 11(3): 259-265. [10] HUA X, WANG D Y. Tire-rubber related pollutant 6-PPD quinone: A review of its transformation, environmental distribution, bioavailability, and toxicity[J]. Journal of Hazardous Materials, 2023, 459: 132265. doi: 10.1016/j.jhazmat.2023.132265 [11] VARSHNEY S, GORA A H, SIRIYAPPAGOUDER P, et al. Toxicological effects of 6PPD and 6PPD quinone in zebrafish larvae[J]. Journal of Hazardous Materials, 2022, 424(Part C): 127623. [12] MATSUMOTO M, YAMAGUCHI M, YOSHIDA Y, et al. An antioxidant, N, N′-diphenyl-p-phenylenediamine (DPPD), affects labor and delivery in rats: A 28-day repeated dose test and reproduction/developmental toxicity test[J]. Food and Chemical Toxicology, 2013, 56: 290-296. doi: 10.1016/j.fct.2013.02.029 [13] BACHAREWICZ-SZCZERBICKA J, REDUTA T, PAWŁOŚ A, et al. Paraphenylenediamine and related chemicals as allergens responsible for allergic contact dermatitis[J]. Archives of Medical Science: AMS, 2019, 17(3): 714-723. [14] GUO Z J, CHENG Z P, ZHANG S H, et al. Unexpected exposure risks to emerging aromatic amine antioxidants and p-phenylenediamine quinones to residents: Evidence from external and internal exposure as well as hepatotoxicity evaluation[J]. Environment & Health, 2024, 2(5): 278-289. [15] WANG W, CHEN Y, FANG J C, et al. Toxicity of substituted p-phenylenediamine antioxidants and their derived novel quinones on aquatic bacterium: Acute effects and mechanistic insights[J]. Journal of Hazardous Materials, 2024, 469: 133900. doi: 10.1016/j.jhazmat.2024.133900 [16] TIAN Z Y, ZHAO H Q, PETER K T, et al. A ubiquitous tire rubber-derived chemical induces acute mortality in coho salmon[J]. Science, 2021, 371(6525): 185-189. doi: 10.1126/science.abd6951 [17] JIANG Y, WANG C Z, MA L, et al. Environmental profiles, hazard identification, and toxicological hallmarks of emerging tire rubber-related contaminants 6PPD and 6PPD-quinone[J]. Environment International, 2024, 187: 108677. doi: 10.1016/j.envint.2024.108677 [18] WU J B, CAO G D, ZHANG F, et al. A new toxicity mechanism of N-(1, 3-Dimethylbutyl)-N'-phenyl-p-phenylenediamine quinone: Formation of DNA adducts in mammalian cells and aqueous organisms[J]. Science of the Total Environment, 2023, 866: 161373. doi: 10.1016/j.scitotenv.2022.161373 [19] LYU Y, GUO H B, CHENG T T, et al. Particle size distributions of oxidative potential of lung-deposited particles: Assessing contributions from quinones and water-soluble metals[J]. Environmental Science & Technology, 2018, 52(11): 6592-6600. [20] RAUERT C, CHARLTON N, OKOFFO E D, et al. Concentrations of tire additive chemicals and tire road wear particles in an Australian urban tributary[J]. Environmental Science & Technology, 2022, 56(4): 2421-2431. [21] HUANG W, SHI Y M, HUANG J L, et al. Occurrence of substituted p-phenylenediamine antioxidants in dusts[J]. Environmental Science & Technology Letters, 2021, 8(5): 381-385. [22] IKARASHI Y, KANIWA M A. Determination of p-phenylenediamine and related antioxidants in rubber boots by high performance liquid chromatography. Development of an analytical method for N-(1-Methylheptyl)-N'-phenyl-p-phenylenediamine[J]. Journal of Health Science, 2000, 46(6): 467-473. doi: 10.1248/jhs.46.467 [23] CATALDO F. On the ozone protection of polymers having non-conjugated unsaturation[J]. Polymer Degradation and Stability, 2001, 72(2): 287-296. doi: 10.1016/S0141-3910(01)00017-9 [24] WEYRAUCH S, SEIWERT B, VOLL M, et al. Accelerated aging of tire and road wear particles by elevated temperature, artificial sunlight and mechanical stress—A laboratory study on particle properties, extractables and leachables[J]. Science of the Total Environment, 2023, 904: 166679. doi: 10.1016/j.scitotenv.2023.166679 [25] KOLE P J, LÖHR A J, van BELLEGHEM F G A J, et al. Wear and tear of tyres: A stealthy source of microplastics in the environment[J]. International Journal of Environmental Research and Public Health, 2017, 14(10): 1265. doi: 10.3390/ijerph14101265 [26] HU X M, ZHAO H N, TIAN Z Y, et al. Chemical characteristics, leaching, and stability of the ubiquitous tire rubber-derived toxicant 6PPD-quinone[J]. Environmental Science. Processes & Impacts, 2023, 25(5): 901-911. [27] HIKI K, YAMAMOTO H. Concentration and leachability of N-(1, 3-dimethylbutyl)-N'-phenyl-p-phenylenediamine (6PPD) and its quinone transformation product (6PPD-Q) in road dust collected in Tokyo, Japan[J]. Environmental Pollution, 2022, 302: 119082. doi: 10.1016/j.envpol.2022.119082 [28] STACK M E, HOLLMAN K, MLADENOV N, et al. Micron-size tire tread particles leach organic compounds at higher rates than centimeter-size particles: Compound identification and profile comparison[J]. Environmental Pollution, 2023, 334: 122116. doi: 10.1016/j.envpol.2023.122116 [29] ZHANG Y Y, YAN L, WANG L X, et al. A nation-wide study for the occurrence of PPD antioxidants and 6PPD-quinone in road dusts of China[J]. Science of the Total Environment, 2024, 922: 171393. doi: 10.1016/j.scitotenv.2024.171393 [30] KOLE P J, van BELLEGHEM F G A J, STOORVOGEL J J, et al. Tyre granulate on the loose;How much escapes the turf?A systematic literature review[J]. Science of the Total Environment, 2023, 903: 166221. doi: 10.1016/j.scitotenv.2023.166221 [31] ARMADA D, MARTINEZ-FERNANDEZ A, CELEIRO M, et al. Assessment of the bioaccessibility of PAHs and other hazardous compounds present in recycled tire rubber employed in synthetic football fields[J]. Science of the Total Environment, 2023, 857: 159485. doi: 10.1016/j.scitotenv.2022.159485 [32] SCHNEIDER K, de HOOGD M, MADSEN M P, et al. ERASSTRI - European risk assessment study on synthetic turf rubber infill - Part 1: Analysis of infill samples[J]. Science of the Total Environment, 2020, 718: 137174. doi: 10.1016/j.scitotenv.2020.137174 [33] LIU R Z, LI Y L, LIN Y F, et al. Emerging aromatic secondary amine contaminants and related derivatives in various dust matrices in China[J]. Ecotoxicology and Environmental Safety, 2019, 170: 657-663. doi: 10.1016/j.ecoenv.2018.12.036 [34] ZHANG Z X, DAI C X, CHEN S Y, et al. Spatiotemporal variation of 6PPD and 6PPDQ in dust and soil from e-waste recycling areas[J]. Science of the Total Environment, 2024, 923: 171495. doi: 10.1016/j.scitotenv.2024.171495 [35] LIANG B W, LI J H, DU B B, et al. E-waste recycling emits large quantities of emerging aromatic amines and organophosphites: A poorly recognized source for another two classes of synthetic antioxidants[J]. Environmental Science & Technology Letters, 2022, 9(7): 625-631. [36] ZHANG S H, CHENG Z P, CAO Y H, et al. Aromatic amine antioxidants (AAs) and p-phenylenediamines-quinones (PPD-Qs) in e-waste recycling industry park: Occupational exposure and liver X receptors (LXRs) disruption potential[J]. Environment International, 2024, 186: 108609. doi: 10.1016/j.envint.2024.108609 [37] ARAUJO J A, NEL A E. Particulate matter and atherosclerosis: Role of particle size, composition and oxidative stress[J]. Particle and Fibre Toxicology, 2009, 6: 24. doi: 10.1186/1743-8977-6-24 [38] ZHANG Y H, XU C H, ZHANG W F, et al. p-Phenylenediamine antioxidants in PM2.5: The underestimated urban air pollutants[J]. Environmental Science & Technology, 2022, 56(11): 6914-6921. [39] WANG W, CAO G D, ZHANG J, et al. Beyond substituted p-phenylenediamine antioxidants: Prevalence of their quinone derivatives in PM2.5[J]. Environmental Science & Technology, 2022, 56(15): 10629-10637. [40] WU Y, VENIER M, HITES R A. Broad exposure of the North American environment to phenolic and amino antioxidants and to ultraviolet filters[J]. Environmental Science & Technology, 2020, 54(15): 9345-9355. [41] LI R J, KOU X J, GENG H, et al. Pollution characteristics of ambient PM2.5-bound PAHs and NPAHs in a typical winter time period in Taiyuan[J]. Chinese Chemical Letters, 2014, 25(5): 663-666. doi: 10.1016/j.cclet.2014.03.032 [42] XING F, HUANG H L, ZHAN Z Y, et al. Hourly associations between weather factors and traffic crashes: Non-linear and lag effects[J]. Analytic Methods in Accident Research, 2019, 24: 100109. doi: 10.1016/j.amar.2019.100109 [43] GRAMSCH E, CÁCERES D, OYOLA P, et al. Influence of surface and subsidence thermal inversion on PM2.5 and black carbon concentration[J]. Atmospheric Environment, 2014, 98: 290-298. doi: 10.1016/j.atmosenv.2014.08.066 [44] ROSSOMME E, HART-COOPER W M, ORTS W J, et al. Computational studies of rubber ozonation explain the effectiveness of 6PPD as an antidegradant and the mechanism of its quinone formation[J]. Environmental Science & Technology, 2023, 57(13): 5216-5230. [45] WANG W, CAO G D, ZHANG J, et al. p-Phenylenediamine-derived quinones as new contributors to the oxidative potential of fine particulate matter[J]. Environmental Science & Technology Letters, 2022, 9(9): 712-717. [46] HWANG H M, FIALA M J, WADE T L, et al. Review of pollutants in urban road dust: Part II. Organic contaminants from vehicles and road management[J]. International Journal of Urban Sciences, 2019, 23(4): 445-463. doi: 10.1080/12265934.2018.1538811 [47] MERCIER F, GLORENNEC P, THOMAS O, et al. Organic contamination of settled house dust, a review for exposure assessment purposes[J]. Environmental Science & Technology, 2011, 45(16): 6716-6727. [48] MUJAN I, ANĐELKOVIĆ A S, MUNĆAN V, et al. Influence of indoor environmental quality on human health and productivity - A review[J]. Journal of Cleaner Production, 2019, 217: 646-657. doi: 10.1016/j.jclepro.2019.01.307 [49] DENG C L, HUANG J L, QI Y Q, et al. Distribution patterns of rubber tire-related chemicals with particle size in road and indoor parking lot dust[J]. Science of the Total Environment, 2022, 844: 157144. doi: 10.1016/j.scitotenv.2022.157144 [50] SEIWERT B, NIHEMAITI M, TROUSSIER M, et al. Abiotic oxidative transformation of 6-PPD and 6-PPD quinone from tires and occurrence of their products in snow from urban roads and in municipal wastewater[J]. Water Research, 2022, 212: 118122. doi: 10.1016/j.watres.2022.118122 [51] ZHANG R L, ZHAO S Z, LIU X, et al. Aquatic environmental fates and risks of benzotriazoles, benzothiazoles, and p-phenylenediamines in a catchment providing water to a megacity of China[J]. Environmental Research, 2023, 216: 114721. doi: 10.1016/j.envres.2022.114721 [52] JOHANNESSEN C, HELM P, LASHUK B, et al. The tire wear compounds 6PPD-quinone and 1, 3-diphenylguanidine in an urban watershed[J]. Archives of Environmental Contamination and Toxicology, 2022, 82(2): 171-179. doi: 10.1007/s00244-021-00878-4 [53] ZHU J Q, GUO R Y, REN F F, et al. Occurrence and partitioning of p-phenylenediamine antioxidants and their quinone derivatives in water and sediment[J]. Science of the Total Environment, 2024, 914: 170046. doi: 10.1016/j.scitotenv.2024.170046 [54] ZHOU Y J, YIXI L C, KONG Q Q, et al. Sunlight-induced transformation of tire rubber antioxidant N-(1, 3-Dimethylbutyl)-N′-phenyl-p-phenylenediamine (6PPD) to 6PPD-Quinone in water[J]. Environmental Science & Technology Letters, 2023, 10(9): 798-803. [55] CHIAIA-HERNÁNDEZ A C, CASADO-MARTINEZ C, LARA-MARTIN P, et al. Sediments: Sink, archive, and source of contaminants[J]. Environmental Science and Pollution Research International, 2022, 29(57): 85761-85765. doi: 10.1007/s11356-022-24041-1 [56] AHRENS L, YAMASHITA N, YEUNG L W Y, et al. Partitioning behavior of per- and polyfluoroalkyl compounds between pore water and sediment in two sediment cores from Tokyo Bay, Japan[J]. Environmental Science & Technology, 2009, 43(18): 6969-6975. [57] MALMON D V, DUNNE T, RENEAU S L. Predicting the fate of sediment and pollutants in river floodplains[J]. Environmental Science & Technology, 2002, 36(9): 2026-2032. [58] MAI B X, CHEN S J, LUO X J, et al. Distribution of polybrominated diphenyl ethers in sediments of the Pearl River Delta and adjacent South China Sea[J]. Environmental Science & Technology, 2005, 39(10): 3521-3527. [59] XIE J W, JIN L, WU D, et al. Inhalable antibiotic resistome from wastewater treatment plants to urban areas: Bacterial hosts, dissemination risks, and source contributions[J]. Environmental Science & Technology, 2022, 56(11): 7040-7051. [60] XUE F F, TANG B, BIN L Y, et al. Residual micro organic pollutants and their biotoxicity of the effluent from the typical textile wastewater treatment plants at Pearl River Delta[J]. Science of the Total Environment, 2019, 657: 696-703. doi: 10.1016/j.scitotenv.2018.12.008 [61] KAZOUR M, TERKI S, RABHI K, et al. Sources of microplastics pollution in the marine environment: Importance of wastewater treatment plant and coastal landfill[J]. Marine Pollution Bulletin, 2019, 146: 608-618. doi: 10.1016/j.marpolbul.2019.06.066 [62] CAO G D, WANG W, ZHANG J, et al. Occurrence and fate of substituted p-phenylenediamine-derived quinones in Hong Kong wastewater treatment plants[J]. Environmental Science & Technology, 2023, 57(41): 15635-15643. [63] GRANNAS A M, BOGDAL C, HAGEMAN K J, et al. The role of the global cryosphere in the fate of organic contaminants[J]. Atmospheric Chemistry and Physics, 2013, 13(6): 3271-3305. doi: 10.5194/acp-13-3271-2013 [64] BIGOT M, HAWKER D W, CROPP R, et al. Spring melt and the redistribution of organochlorine pesticides in the sea-ice environment: A comparative study between Arctic and Antarctic regions[J]. Environmental Science & Technology, 2017, 51(16): 8944-8952. [65] LEI Y D, WANIA F. Is rain or snow a more efficient scavenger of organic chemicals?[J]. Atmospheric Environment, 2004, 38(22): 3557-3571. doi: 10.1016/j.atmosenv.2004.03.039 [66] JIAO W Z, YANG P Z, GAO W Q, et al. Apparent kinetics of the ozone oxidation of nitrobenzene in aqueous solution enhanced by high gravity technology[J]. Chemical Engineering and Processing - Process Intensification, 2019, 146: 107690. doi: 10.1016/j.cep.2019.107690 [67] ZHANG X, PENG Z F, HOU S J, et al. Ubiquitous occurrence of p-phenylenediamine (PPD) antioxidants and PPD-quinones in fresh atmospheric snow and their amplification effects on associated aqueous contamination[J]. Journal of Hazardous Materials, 2024, 465: 133409. doi: 10.1016/j.jhazmat.2023.133409 [68] YIN C Q, JIANG X, YANG X L, et al. Polycyclic aromatic hydrocarbons in soils in the vicinity of Nanjing, China[J]. Chemosphere, 2008, 73(3): 389-394. doi: 10.1016/j.chemosphere.2008.05.041 [69] HAVUGIMANA E, BHOPLE B S, KUMAR A, et al. Soil pollution—major sources and types of soil pollutants[J]. Environmental science and engineering, 2017, 11: 53-86. [70] XU Q, LI G, FANG L, et al. Enhanced formation of 6PPD-Q during the aging of tire wear particles in anaerobic flooded soils: The role of iron reduction and environmentally persistent free radicals[J]. Environmental Science & Technology, 2023, 57(14): 5978-5987. [71] DU B B, LIANG B W, LI Y, et al. First report on the occurrence of N-(1, 3-Dimethylbutyl)-N′-phenyl-p-phenylenediamine (6PPD) and 6PPD-Quinone as pervasive pollutants in human urine from South China[J]. Environmental Science & Technology Letters, 2022, 9(12): 1056-1062. [72] LIU C Y, ZHAO X C, GUO L Q, et al. Emerging N-(1, 3-dimethylbutyl)-N′-phenyl-p-phenylenediamine (6PPD) and 6PPD quinone in paired human plasma and urine from Tianjin, China: Preliminary assessment with demographic factors[J]. Journal of Hazardous Materials, 2024, 476: 134818. doi: 10.1016/j.jhazmat.2024.134818 [73] SONG S M, GAO Y X, FENG S, et al. Widespread occurrence of two typical N, N′-substituted p-phenylenediamines and their quinones in humans: Association with oxidative stress and liver damage[J]. Journal of Hazardous Materials, 2024, 468: 133835. doi: 10.1016/j.jhazmat.2024.133835 [74] ZHANG J, CAO G D, WANG W, et al. Stable isotope-assisted mass spectrometry reveals in vivo distribution, metabolism, and excretion of tire rubber-derived 6PPD-quinone in mice[J]. Science of the Total Environment, 2024, 912: 169291. doi: 10.1016/j.scitotenv.2023.169291 [75] FANG J C, WANG X X, CAO G D, et al. 6PPD-quinone exposure induces neuronal mitochondrial dysfunction to exacerbate Lewy neurites formation induced by α-synuclein preformed fibrils seeding[J]. Journal of Hazardous Materials, 2024, 465: 133312. doi: 10.1016/j.jhazmat.2023.133312 [76] WANG L, WU Y H, ZHANG W, et al. Characteristic profiles of urinary p-hydroxybenzoic acid and its esters (parabens) in children and adults from the United States and China[J]. Environmental Science & Technology, 2013, 47(4): 2069-2076. [77] SCHMIDTKUNZ C, KÜPPER K, WEBER T, et al. A biomonitoring study assessing the exposure of young German adults to butylated hydroxytoluene (BHT)[J]. International Journal of Hygiene and Environmental Health, 2020, 228: 113541. doi: 10.1016/j.ijheh.2020.113541 [78] ZHANG Z X, XU X J, QIAN Z Y, et al. Association between 6PPD-quinone exposure and BMI, influenza, and diarrhea in children[J]. Environmental Research, 2024, 247: 118201. doi: 10.1016/j.envres.2024.118201 [79] ZHU J Q, GUO R Y, REN F F, et al. p-Phenylenediamine derivatives in tap water: Implications for human exposure[J]. Water, 2024, 16(8): 1128. doi: 10.3390/w16081128 -



 下载:
下载:

