-
结肠癌是一种常见的消化道恶性肿瘤,至2022年,GLOBOCAN全球癌症统计结果显示:全球新发癌症病例近2000万,其中新增结肠癌病例192.6万,占新发癌症总病例数9.6%,居第三位;全球癌症死亡病例970万,因结肠癌死亡的患者90.4万人,占癌症总死亡病例数9.3%,居第二位[1]. 我国的结肠癌发病率及死亡率也居处于较高水平,给人们带来沉重的疾病和经济负担[2]. 且结肠癌早期缺乏典型临床症状,一经确诊多数患者已处于晚期,只能采取姑息性手术治疗或无法手术治疗,导致预后较差[3 − 4]. 因此需要不断探索研究新的治疗药物来解决这一难题.
硒是人体必需的微量营养元素,参与机体多种酶的合成[5]. 研究显示硒与人体的健康息息相关,如在某些国家或地区存在硒的缺乏会导致克山病、肿瘤的发生及死亡率的增加,而某些硒含量高的地区癌症发病率较低[6]. 自然界中的硒存在形式主要分为无机硒和有机硒,无机硒主要是亚硒酸盐,如亚硒酸钠,是膳食补充硒的重要来源,其作为四价硒,不仅化学性质稳定,还具有免疫调节、抗氧化作用,且抗癌作用特性优于有机硒化合物,适合应用于疾病临床前期的研究[7 − 8]. 研究显示亚硒酸钠可以通过抗氧化还原反应进而调节细胞凋亡、细胞周期、信号通路变化来起到抑制肿瘤生长的效果[9 − 10],也对结肠癌细胞具有凋亡诱导作用,并抑制癌细胞增殖[11 − 12],但相关机制尚不明确.
因此,本研究将参照前期研究基础[13],采用高效液相色谱-电感耦合等离子体质谱联用(HPLC-ICP-MS)测定富硒食品中无机硒的含量,接着以四价硒化合物亚硒酸钠为研究对象,探讨亚硒酸钠对HCT116结肠癌细胞生物学行为的影响及相关作用机制,以期为富硒食品功能的开发应用提供数据支撑,为结肠癌患者的治疗提供新的理论参考和策略.
-
Agilent
1260 型高效液相色谱仪、Agilent7900 型电感耦合等离子体质谱仪、LabTech EH20A plus微控数显电热板、MileStone ETHOS A微波消解系统、THERMO GENPURE纯水机、日本松下三洋MCO-170 CO2培养箱、日本Nikon ECLIPSE Ts2-FL倒置显微镜、日本Olympus IX51倒置荧光显微镜、上海伯乐ChemiDoc MP Imaging System、高速离心机、超声波清洗器、漩涡振荡仪等.硒酸根溶液[GBW
10033 ,以硒计:41.5 μg∙g−1]、亚硒酸根溶液[GBW10032 ,以硒计:42.9 μg∙g−1]、总硒溶液[GBW(E) 080215,100 μg∙mL−1]标准物质均购自中国计量科学研究院;实验样品为富硒茶叶、富硒铁皮石斛、富硒鸭蛋、富硒葛粉,实验中硒形态含量均以硒计.HCT116结肠癌细胞购自中国科学院上海细胞库;亚硒酸钠购自美国sigma公司;transwell小室购自美国Corning公司;兔抗Bcl-2、Bax、GAPDH单克隆抗体、Hoechst染色试剂盒购自南京碧云天生物技术有限公司;兔抗cleaved caspase 3、MMP-2、MMP -9、E-cadherin、intergrin αVβ3、PI3K、AKT、p-AKT、mTOR、p-mTOR多克隆抗体购自美国Abcam公司.
-
微波消解条件 消解功率
1500 W,升温程序:由室温升至120 ℃,升温3 min,恒温3 min;120 ℃升至190 ℃,升温5 min,恒温40 min.色谱条件 色谱柱:hamilton PRP-X100色谱柱(4.1 mm×250 mm,10 µm),流动相:40 mmol∙L−1磷酸氢二铵(pH=6.0,含1%甲醇),等度洗脱,流速:1.2 mL∙ min−1,进样量:20 μL.
ICP-MS条件 射频功率
1550 W,蠕动泵速率0.4 r∙min−1,雾化室温度2.0 ℃,载气流量1.09 L∙min−1,冷却气流量15 L∙min−1,采样深度:8.0 mm,积分时间1 s,氦气流量6.0 mL∙ min−1,检测同位素78Se.标准溶液配制 用超纯水稀释Se(Ⅳ)、Se(Ⅵ)标准溶液,配制Se(Ⅳ)、Se(Ⅵ)混合标准溶液,浓度分别为1、2、5、10、20 μg∙ L−1,临用现配.
-
总硒测定:依据《食品安全国家标准 食品中硒的测定》GB
5009.93 —2017[14],称取0.5000 g样品,加入6 mL 硝酸,按照1.2节条件微波消解. 直接用ICP-MS测定总硒含量. 同时做空白对照实验.硒形态测定:参照前期研究基础[13]. 称取
0.3000 g样品于15 mL离心管内,加入10 mL 0.1 moL∙L−1 氢氧化钠溶液,涡旋混匀后于90 ℃超声30 min,冷却,9000 r∙min−1离心15 min,上清液经0.22 µm滤膜过滤,得到待测液,同时做空白对照实验. -
细胞培养:将HCT116细胞接种到含有10%胎牛血清的DMEM培养基中培养,置于37 ℃、5% CO2培养箱中. 每隔2 d换液,当细胞生长到80%时候,胰酶消化细胞并以1:3分配到新的培养瓶进行扩大培养,取对数生长期细胞进行后续实验.
细胞分组:将HCT116细胞随机分为0(对照组)、2.5、5、10 μmol∙L−1亚硒酸钠组,每组6个复孔,除对照组加入等体积的DMEM培养液后,其余组分别加入0、2.5、5、10 μmol∙L−1的亚硒酸钠,与HCT116细胞共同培养48 h后进行后续实验.
CCK8检测细胞活力:96孔板每孔加入100 μL密度为4×104个·mL−1的HCT116细胞,每组设6个复孔,按1.4.2节进行分组处置细胞48 h,加入CCK8溶液孵育1 h,使用酶标仪测定每孔在450 nm处的吸光度(OD值),计算细胞增殖抑制率,细胞增殖抑制率=(亚硒酸钠组OD值-对照组OD值)/对照组OD值×100%.
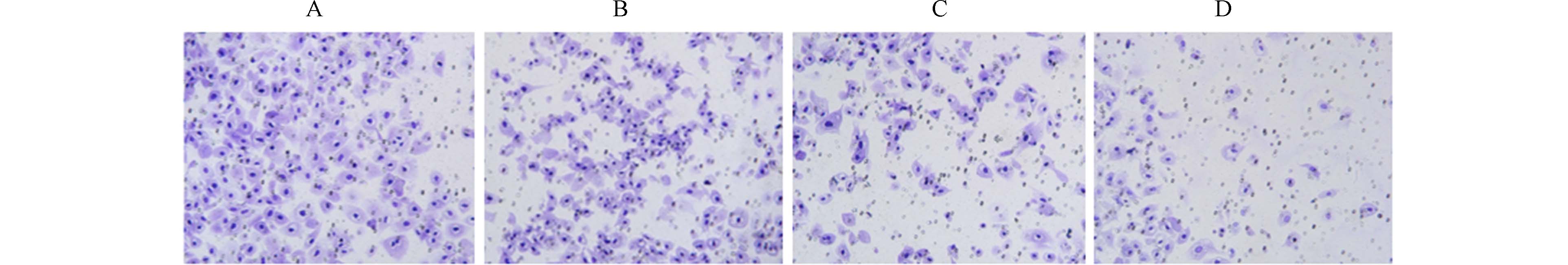
Hoechst检测细胞凋亡情况:6孔板每孔加入2 mL密度为1×106个·mL−1的HCT116细胞,每组设6个复孔,按1.4.2节进行分组处置细胞48 h,弃培养液,4%聚乙烯醇固定细胞10 min,PBS洗涤,Hoecsht染色液染色30 min,PBS洗涤,倒置荧光显微镜下观察细胞形态,浓染致密的颗粒块蓝色荧光被认为是细胞凋亡,Image J软件分析细胞凋亡率.
划痕实验检测能力:使用marker笔,直尺比着,每间隔0.5—1 cm在6孔板背面画水平线,每孔至少画5条水平线和一条垂直线. 6孔板每孔加入2 mL密度为1×106个·mL−1的HCT116细胞,每组设6个复孔,隔天使用200 μL移液枪轻划细胞,PBS洗涤掉细胞,倒置显微镜下观察细胞形态并拍照划痕距离(0 h,L0),48 h后显微镜下再次拍照划痕距离(48 h,L1),细胞迁移率=(L0-L1)/L1×100%.
Transwell实验检测细胞侵袭能力:将基质胶平铺于transwell上室待用. HCT116细胞接种到transwell上室,按1.4.2节进行分组处置,含有10%胎牛血清的DMEM培养基加入到transwell下室. 48 h后,棉签擦拭transwell上室未迁移的细胞,4%多聚甲醛固定迁移到transwell下室的细胞15 min,接着0.1%结晶紫染色20 min,倒置荧光显微镜下观察细胞染色情况,并取5个视野下染色细胞平均值作为细胞侵袭数目.
Western blot检测蛋白表达:6孔板每孔加入2 mL密度为1×106个·mL−1的HCT116细胞,每组设6个复孔,按1.4.2节进行分组处置细胞48 h,PBS洗涤,细胞刮刮下细胞,加入预先制冷的并含有磷酸酶抑制剂的细胞裂解液4℃裂解细胞30 min,取上清液,测定蛋白浓度,加上样缓冲液并煮沸使蛋白变性. 制作5%浓缩胶,12%分离胶,进行SDS-PAGE电泳,待目的蛋白分离后,采用“三明治”进行恒流冰浴转膜,3%BSA室温封闭1 h,TBST洗涤3次,一抗溶液4 ℃孵育过夜,TBST洗涤3次,二抗溶液室温孵育1.5 h,TBST洗涤3次,使用ECL化学发光液进行显色,并在凝胶成像系统中曝光,以GAPDH为内参,Image J软件分析目的蛋白灰度值.
-
所有实验均重复3次,SPSS20.0进行统计分析,计量资料以
ˉx±s 表示,采用单因素方差分析组间差异性,P<0.05说明差异具有统计学意义. -
按照《生活饮用水标准检验方法 第6部分:金属和类金属指标》GB/T
5750.6 —2023进行无机硒形态测定[15],四价(Se(Ⅳ))和六价硒(Se(Ⅵ))形态在9 min内实现了基线分离(图1),满足实验要求. -
对4种富硒食品中总硒及无机硒含量进行分析,测定结果见表1. 富硒食品中检出四价硒,未检出六价硒,这和方勇[16]、张俊杰[17]、周晓华[18]]等的研究结果一致,说明富硒食品中含有四价硒. 亚硒酸钠是主要的四价硒存在形式,是膳食补充硒的主要来源,且化学性质稳定,具有一定的抗癌作用[10 − 12, 19],因此本研究将以四价硒亚硒酸钠为研究对象,探讨亚硒酸钠对HCT116结肠癌细胞活力、凋亡、迁移、侵袭的影响及相关机制.
-
本研究参考相关文献[10 − 12, 19]并结合预实验证实,2.5、5、10 μmol∙L−1亚硒酸钠能显著的降低HCT116细胞活力,使细胞增殖抑制率提高(表2),差异均具有统计学意义(均P<0.05). 接着采用Hoechst染色、划痕实验、transwell实验检测2.5、5、10 μmol∙L−1亚硒酸钠对HCT116细胞凋亡、迁移及侵袭能力的影响,实验结果表明,与对照组比较,2.5、5、10 μmol∙L−1亚硒酸钠组HCT116细胞凋亡率提高(图2、表2),细胞迁移率降低(图3、表2),细胞侵袭数目减少(图4、表2),差异均具有统计学意义(均P<0.05). 而且有文献报道证实5、10 μmol∙L−1亚硒酸钠能通过ROS介导的NF-κB信号通路抑制肾癌症细胞增殖、迁移及侵袭,并诱导细胞凋亡[10],也能通过ERK信号通路抑制甲状腺癌细胞增殖[19]. 结合本实验结果及以上报道,本研究推测一定剂量亚硒酸钠能诱导HCT116细胞凋亡,并抑制细胞迁移、侵袭,进而发挥其抗癌作用,其作用机制值得进一步探讨.
-
细胞的增殖、凋亡、迁移、侵袭等生物学过程与细胞凋亡蛋白(Bax、Bcl-2、cleaved caspase 3)、细胞蛋白水解酶(MMPs)及黏附蛋白等有关,因此为了探讨亚硒酸钠对HCT116细胞增殖、凋亡、迁移及侵袭相关蛋白表达量的影响,本研究接着采用western blot检测亚硒酸钠对上述蛋白表达量的影响,western blot实验结果表明,与对照组比较,2.5、5、10 μmol∙L−1亚硒酸钠组中Bcl-2、MMP-2、
MMP-9及intergrin αVβ3蛋白表达量降低,Bax、cleaved caspase 3及E-cadherin蛋白表达量升高,差异均具有统计学意义(均P<0.05)(图5、表3),从而说明亚硒酸钠能通过增加凋亡蛋白表达,降低抗凋亡蛋白表达,抑制肿瘤侵袭转移相关蛋白表达水平,提高黏附蛋白E-cadherin的表达量,进而诱导HCT116细胞凋亡、抑制细胞增殖、迁移及侵袭.
-
研究表明PI3K/AKT/mTOR信号通路及其下游信号分子直接参与结肠癌细胞增殖、凋亡、细胞周期、迁移、侵袭及转移等恶性生物学过程,因此PI3K/AKT/mTOR信号通路成为结肠癌治疗药物研发的热点靶通路[20 − 22]. PI3K是一种异源二聚体,被上游的信号激活后,可作为第二信使激活下游靶蛋白AKT. mTOR是AKT的底物,被AKT激活磷酸化后,参与mRNA翻译相关蛋白及抑制蛋白表达的调控. 激活的mTOR能增加MMPs的表达促进细胞外基质降解,进而增强癌细胞侵袭及迁移能力[23]. AKT能够通过靶向Bcl-2、Caspase 3表达进而抵抗细胞凋亡[24]. 本研究前期已证实亚硒酸钠对Bcl-2、Caspase 3及MMPs的调节作用(图5、表3),也发现硒代蛋氨酸对结肠癌细胞的凋亡、黏附、侵袭具有显著的抑制作用,可能是通过抑制GSK-3β/PI3K/AKT信号通路实现的[25]. 且有表观遗传学实验证实亚硒酸钠能通过PI3K/AKT信号通路参与乳腺癌的发生发展[26],也能通过ROS介导的AKT/mTOR通路诱导甲状腺癌细胞周期阻滞和凋亡[27]. 进而推测亚硒酸钠对结肠癌细胞恶性生物学行为的抑制作用与调节PI3K/AKT/mTOR信号通路有关. 因此为了证实此推测,本研究继续采用western blot实验检测PI3K/AKT/mTOR信号通路相关蛋白的表达,结果表明亚硒酸钠可显著减少PI3K表达及AKT、mTOR磷酸化水平,而对总的AKT、mTOR表达没有显著的影响(图6、表4). 因此,本研究初步认为亚硒酸钠通过抑制PI3K/AKT/mTOR信号通路发挥其抗结肠癌作用.
-
综上所述,本研究采用HPLC-ICP-MS仅检出富硒食品中含有四价硒,接着采用2.5、5、10 μmol·L−1亚硒酸钠处理HCT116结肠癌细胞48 h,实验结果表明亚硒酸钠能降低HCT116结肠癌细胞活力,诱导细胞凋亡,抑制细胞迁移及侵袭能力,发挥其抗癌的作用,这可能是亚硒酸钠通过抑制PI3K/AKT/mTOR信号通路实现的. 研究结果为含有亚硒酸钠等硒化合物的富硒食品的深入研究、进一步开发及临床研究提供新的实验依据,为结肠癌的治疗提供新的线索. 但也需要采用结肠癌动物模型来进一步补充和验证本研究的结果,这将是下一步的研究方向.
富硒食品中四价硒含量的测定及对结肠癌细胞的抑制作用
Determination of tetravalent selenium content in Se-enriched foods and its inhibitory effect on colon cancer cells
-
摘要: 硒是人体必需微量营养元素,具有免疫调节、抗氧化、抗癌等生物学功能. 从富硒食品中获取无机硒,是一种安全、健康且有效的补充硒元素的方式. 为了解富硒食品中无机硒含量及其对HCT116结肠癌细胞凋亡、迁移、侵袭的影响及机制,采用高效液相色谱-电感耦合等离子体质谱联用(HPLC-ICP-MS)测定富硒食品中无机硒的含量,并以一定浓度的亚硒酸钠处理HCT116结肠癌细胞48 h,测定细胞活力、凋亡、迁移、侵袭能力及相关蛋白表达. 实验结果表明富硒食品中仅检测出四价硒,且四价硒亚硒酸钠能降低HCT116细胞活力、提高细胞凋亡率、抑制细胞迁移及侵袭能力,下调Bcl-2、MMP-2、MMP -9、intergrin αVβ3、PI3K、p-AKT及p-mTOR蛋白表达,上调Bax、cleaved caspase 3及E-cadherin蛋白表达,差异均具有统计学意义(P<0.05). 从而说明亚硒酸钠对结肠癌的抑制作用,可能是通过阻断PI3K/AKT/mTOR信号通路实现的,为富硒食品功能的深入研究、进一步开发及临床研究提供数据支撑,也为结肠癌的临床治疗的研究提供新的策略和理论参考.
-
关键词:
- 四价硒 /
- 亚硒酸钠 /
- 结肠癌细胞 /
- 细胞培养 /
- PI3K/AKT/mTOR信号通路.
Abstract: Selenium is an essential micronutrient element for the human body, which has biological functions such as immune regulation, antioxidant, and anti-cancer. Inorganic selenium obtaining from Se-enriched foods is a safe, healthy, and effective way to supplement selenium elements. The objective of this study was to explore the inorganic selenium content in Se-enriched foods as well as its mechanisms and effect on apoptosis, migration, and invasion of HCT1116 colon cancer cells. Inorganic selenium content in Se-enriched foods was detected by high performance liquid chromatography-inductively coupled plasma-mass spectrometry (HPLC-ICP-MS). HCT116 colon cancer cells were cultured with a certain concentration of sodium selenite for 48 hours. Cell viability, apoptosis, migration, invasion ability, and related protein expression was measured. The results showed that only tetravalent selenium was detected in Se-enriched foods. Sodium selenite could reduce HCT116 cell viablity, increase cell apoptosis rate, inhibit cell migration and invasion ability, down-regulate the expression of Bcl-2, MMP-2, MMP-9, intergrin αVβ3, PI3K, p-AKT, and p-mTOR, and up-regulate the expression of Bax, cleaved caspase 3, and E-cadherin. The differences were statistically significant (all P<0.05). The results suggest that the inhibitory effect of sodium selenite on colon cancer may be achieved by blocking the PI3K/AKT/mTOR signaling pathway. So it provides data support for the in-depth study, further development, and clinical research of Se-enriched foods, as well as new strategies and theoretical references for the clinical treatment of colon cancer. -
结肠癌是一种常见的消化道恶性肿瘤,至2022年,GLOBOCAN全球癌症统计结果显示:全球新发癌症病例近2000万,其中新增结肠癌病例192.6万,占新发癌症总病例数9.6%,居第三位;全球癌症死亡病例970万,因结肠癌死亡的患者90.4万人,占癌症总死亡病例数9.3%,居第二位[1]. 我国的结肠癌发病率及死亡率也居处于较高水平,给人们带来沉重的疾病和经济负担[2]. 且结肠癌早期缺乏典型临床症状,一经确诊多数患者已处于晚期,只能采取姑息性手术治疗或无法手术治疗,导致预后较差[3 − 4]. 因此需要不断探索研究新的治疗药物来解决这一难题.
硒是人体必需的微量营养元素,参与机体多种酶的合成[5]. 研究显示硒与人体的健康息息相关,如在某些国家或地区存在硒的缺乏会导致克山病、肿瘤的发生及死亡率的增加,而某些硒含量高的地区癌症发病率较低[6]. 自然界中的硒存在形式主要分为无机硒和有机硒,无机硒主要是亚硒酸盐,如亚硒酸钠,是膳食补充硒的重要来源,其作为四价硒,不仅化学性质稳定,还具有免疫调节、抗氧化作用,且抗癌作用特性优于有机硒化合物,适合应用于疾病临床前期的研究[7 − 8]. 研究显示亚硒酸钠可以通过抗氧化还原反应进而调节细胞凋亡、细胞周期、信号通路变化来起到抑制肿瘤生长的效果[9 − 10],也对结肠癌细胞具有凋亡诱导作用,并抑制癌细胞增殖[11 − 12],但相关机制尚不明确.
因此,本研究将参照前期研究基础[13],采用高效液相色谱-电感耦合等离子体质谱联用(HPLC-ICP-MS)测定富硒食品中无机硒的含量,接着以四价硒化合物亚硒酸钠为研究对象,探讨亚硒酸钠对HCT116结肠癌细胞生物学行为的影响及相关作用机制,以期为富硒食品功能的开发应用提供数据支撑,为结肠癌患者的治疗提供新的理论参考和策略.
1. 材料与方法(Materials and methods)
1.1 仪器与试剂
Agilent
1260 型高效液相色谱仪、Agilent7900 型电感耦合等离子体质谱仪、LabTech EH20A plus微控数显电热板、MileStone ETHOS A微波消解系统、THERMO GENPURE纯水机、日本松下三洋MCO-170 CO2培养箱、日本Nikon ECLIPSE Ts2-FL倒置显微镜、日本Olympus IX51倒置荧光显微镜、上海伯乐ChemiDoc MP Imaging System、高速离心机、超声波清洗器、漩涡振荡仪等.硒酸根溶液[GBW
10033 ,以硒计:41.5 μg∙g−1]、亚硒酸根溶液[GBW10032 ,以硒计:42.9 μg∙g−1]、总硒溶液[GBW(E) 080215,100 μg∙mL−1]标准物质均购自中国计量科学研究院;实验样品为富硒茶叶、富硒铁皮石斛、富硒鸭蛋、富硒葛粉,实验中硒形态含量均以硒计.HCT116结肠癌细胞购自中国科学院上海细胞库;亚硒酸钠购自美国sigma公司;transwell小室购自美国Corning公司;兔抗Bcl-2、Bax、GAPDH单克隆抗体、Hoechst染色试剂盒购自南京碧云天生物技术有限公司;兔抗cleaved caspase 3、MMP-2、MMP -9、E-cadherin、intergrin αVβ3、PI3K、AKT、p-AKT、mTOR、p-mTOR多克隆抗体购自美国Abcam公司.
1.2 硒测定仪器条件
微波消解条件 消解功率
1500 W,升温程序:由室温升至120 ℃,升温3 min,恒温3 min;120 ℃升至190 ℃,升温5 min,恒温40 min.色谱条件 色谱柱:hamilton PRP-X100色谱柱(4.1 mm×250 mm,10 µm),流动相:40 mmol∙L−1磷酸氢二铵(pH=6.0,含1%甲醇),等度洗脱,流速:1.2 mL∙ min−1,进样量:20 μL.
ICP-MS条件 射频功率
1550 W,蠕动泵速率0.4 r∙min−1,雾化室温度2.0 ℃,载气流量1.09 L∙min−1,冷却气流量15 L∙min−1,采样深度:8.0 mm,积分时间1 s,氦气流量6.0 mL∙ min−1,检测同位素78Se.标准溶液配制 用超纯水稀释Se(Ⅳ)、Se(Ⅵ)标准溶液,配制Se(Ⅳ)、Se(Ⅵ)混合标准溶液,浓度分别为1、2、5、10、20 μg∙ L−1,临用现配.
1.3 硒测定方法
总硒测定:依据《食品安全国家标准 食品中硒的测定》GB
5009.93 —2017[14],称取0.5000 g样品,加入6 mL 硝酸,按照1.2节条件微波消解. 直接用ICP-MS测定总硒含量. 同时做空白对照实验.硒形态测定:参照前期研究基础[13]. 称取
0.3000 g样品于15 mL离心管内,加入10 mL 0.1 moL∙L−1 氢氧化钠溶液,涡旋混匀后于90 ℃超声30 min,冷却,9000 r∙min−1离心15 min,上清液经0.22 µm滤膜过滤,得到待测液,同时做空白对照实验.1.4 细胞实验
细胞培养:将HCT116细胞接种到含有10%胎牛血清的DMEM培养基中培养,置于37 ℃、5% CO2培养箱中. 每隔2 d换液,当细胞生长到80%时候,胰酶消化细胞并以1:3分配到新的培养瓶进行扩大培养,取对数生长期细胞进行后续实验.
细胞分组:将HCT116细胞随机分为0(对照组)、2.5、5、10 μmol∙L−1亚硒酸钠组,每组6个复孔,除对照组加入等体积的DMEM培养液后,其余组分别加入0、2.5、5、10 μmol∙L−1的亚硒酸钠,与HCT116细胞共同培养48 h后进行后续实验.
CCK8检测细胞活力:96孔板每孔加入100 μL密度为4×104个·mL−1的HCT116细胞,每组设6个复孔,按1.4.2节进行分组处置细胞48 h,加入CCK8溶液孵育1 h,使用酶标仪测定每孔在450 nm处的吸光度(OD值),计算细胞增殖抑制率,细胞增殖抑制率=(亚硒酸钠组OD值-对照组OD值)/对照组OD值×100%.
Hoechst检测细胞凋亡情况:6孔板每孔加入2 mL密度为1×106个·mL−1的HCT116细胞,每组设6个复孔,按1.4.2节进行分组处置细胞48 h,弃培养液,4%聚乙烯醇固定细胞10 min,PBS洗涤,Hoecsht染色液染色30 min,PBS洗涤,倒置荧光显微镜下观察细胞形态,浓染致密的颗粒块蓝色荧光被认为是细胞凋亡,Image J软件分析细胞凋亡率.
划痕实验检测能力:使用marker笔,直尺比着,每间隔0.5—1 cm在6孔板背面画水平线,每孔至少画5条水平线和一条垂直线. 6孔板每孔加入2 mL密度为1×106个·mL−1的HCT116细胞,每组设6个复孔,隔天使用200 μL移液枪轻划细胞,PBS洗涤掉细胞,倒置显微镜下观察细胞形态并拍照划痕距离(0 h,L0),48 h后显微镜下再次拍照划痕距离(48 h,L1),细胞迁移率=(L0-L1)/L1×100%.
Transwell实验检测细胞侵袭能力:将基质胶平铺于transwell上室待用. HCT116细胞接种到transwell上室,按1.4.2节进行分组处置,含有10%胎牛血清的DMEM培养基加入到transwell下室. 48 h后,棉签擦拭transwell上室未迁移的细胞,4%多聚甲醛固定迁移到transwell下室的细胞15 min,接着0.1%结晶紫染色20 min,倒置荧光显微镜下观察细胞染色情况,并取5个视野下染色细胞平均值作为细胞侵袭数目.
Western blot检测蛋白表达:6孔板每孔加入2 mL密度为1×106个·mL−1的HCT116细胞,每组设6个复孔,按1.4.2节进行分组处置细胞48 h,PBS洗涤,细胞刮刮下细胞,加入预先制冷的并含有磷酸酶抑制剂的细胞裂解液4℃裂解细胞30 min,取上清液,测定蛋白浓度,加上样缓冲液并煮沸使蛋白变性. 制作5%浓缩胶,12%分离胶,进行SDS-PAGE电泳,待目的蛋白分离后,采用“三明治”进行恒流冰浴转膜,3%BSA室温封闭1 h,TBST洗涤3次,一抗溶液4 ℃孵育过夜,TBST洗涤3次,二抗溶液室温孵育1.5 h,TBST洗涤3次,使用ECL化学发光液进行显色,并在凝胶成像系统中曝光,以GAPDH为内参,Image J软件分析目的蛋白灰度值.
1.5 统计分析
所有实验均重复3次,SPSS20.0进行统计分析,计量资料以
ˉx±s 2. 结果与讨论(Results and discussion)
2.1 无机硒形态的色谱图
按照《生活饮用水标准检验方法 第6部分:金属和类金属指标》GB/T
5750.6 —2023进行无机硒形态测定[15],四价(Se(Ⅳ))和六价硒(Se(Ⅵ))形态在9 min内实现了基线分离(图1),满足实验要求.2.2 富硒食品中总硒及四价硒含量测定结果
对4种富硒食品中总硒及无机硒含量进行分析,测定结果见表1. 富硒食品中检出四价硒,未检出六价硒,这和方勇[16]、张俊杰[17]、周晓华[18]]等的研究结果一致,说明富硒食品中含有四价硒. 亚硒酸钠是主要的四价硒存在形式,是膳食补充硒的主要来源,且化学性质稳定,具有一定的抗癌作用[10 − 12, 19],因此本研究将以四价硒亚硒酸钠为研究对象,探讨亚硒酸钠对HCT116结肠癌细胞活力、凋亡、迁移、侵袭的影响及相关机制.
表 1 富硒食品中总硒及硒形态含量(mg·kg−1)Table 1. The content of total selenium and selenium form in Se-enriched foods (mg·kg−1)Se(Ⅳ) Se(Ⅵ) 总硒Total selenium 富硒茶叶 0.0275 <0.01 0.403 富硒铁皮石斛 0.121 <0.01 1.33 富硒鸭蛋 0.0492 <0.01 0.445 富硒葛粉 0.696 <0.01 2.26 2.3 亚硒酸钠对HCT116结肠癌细胞活力、凋亡、迁移、侵袭的影响
本研究参考相关文献[10 − 12, 19]并结合预实验证实,2.5、5、10 μmol∙L−1亚硒酸钠能显著的降低HCT116细胞活力,使细胞增殖抑制率提高(表2),差异均具有统计学意义(均P<0.05). 接着采用Hoechst染色、划痕实验、transwell实验检测2.5、5、10 μmol∙L−1亚硒酸钠对HCT116细胞凋亡、迁移及侵袭能力的影响,实验结果表明,与对照组比较,2.5、5、10 μmol∙L−1亚硒酸钠组HCT116细胞凋亡率提高(图2、表2),细胞迁移率降低(图3、表2),细胞侵袭数目减少(图4、表2),差异均具有统计学意义(均P<0.05). 而且有文献报道证实5、10 μmol∙L−1亚硒酸钠能通过ROS介导的NF-κB信号通路抑制肾癌症细胞增殖、迁移及侵袭,并诱导细胞凋亡[10],也能通过ERK信号通路抑制甲状腺癌细胞增殖[19]. 结合本实验结果及以上报道,本研究推测一定剂量亚硒酸钠能诱导HCT116细胞凋亡,并抑制细胞迁移、侵袭,进而发挥其抗癌作用,其作用机制值得进一步探讨.
表 2 亚硒酸钠对HCT116结肠癌细胞活力、凋亡、迁移、侵袭的影响 (ˉx±s Table 2. Effect of sodium selenite on on HCT116 cells viability, apoptotis, migration and invasion (ˉx±s 组别Experimental group n 细胞增值抑制率/%Cell proliferation inhibitory rate 细胞凋亡率/%Cell apoptotic rate 细胞迁移率/%Cell migration rate 细胞侵袭数目Cell invasion number 对照组 6 0 3.47±0.051 52.9±0.57 210.3±2.38 2.5 μmol∙L−1亚硒酸钠组 6 17.9±0.36** 13.6±0.04** 42.7±0.40** 154.4±2.80** 5 μmol∙L−1亚硒酸钠组 6 25.3±0.15** 24.1±0.15** 31.3±0.31** 111.3±2.55** 10 μmol∙L−1亚硒酸钠组 6 33.3±0.26** 35.3±0.26** 17.4±0.21** 77.1±1.11** **与对照组比较, P<0.01. Compared with control, P<0.01. 2.4 亚硒酸钠对HCT116结肠癌细胞中Bcl-2、Bax、cleaved caspase 3、MMP-2、MMP-9、intergrin αVβ3及E-cadherin蛋白表达量的影响
细胞的增殖、凋亡、迁移、侵袭等生物学过程与细胞凋亡蛋白(Bax、Bcl-2、cleaved caspase 3)、细胞蛋白水解酶(MMPs)及黏附蛋白等有关,因此为了探讨亚硒酸钠对HCT116细胞增殖、凋亡、迁移及侵袭相关蛋白表达量的影响,本研究接着采用western blot检测亚硒酸钠对上述蛋白表达量的影响,western blot实验结果表明,与对照组比较,2.5、5、10 μmol∙L−1亚硒酸钠组中Bcl-2、MMP-2、
MMP-9及intergrin αVβ3蛋白表达量降低,Bax、cleaved caspase 3及E-cadherin蛋白表达量升高,差异均具有统计学意义(均P<0.05)(图5、表3),从而说明亚硒酸钠能通过增加凋亡蛋白表达,降低抗凋亡蛋白表达,抑制肿瘤侵袭转移相关蛋白表达水平,提高黏附蛋白E-cadherin的表达量,进而诱导HCT116细胞凋亡、抑制细胞增殖、迁移及侵袭.
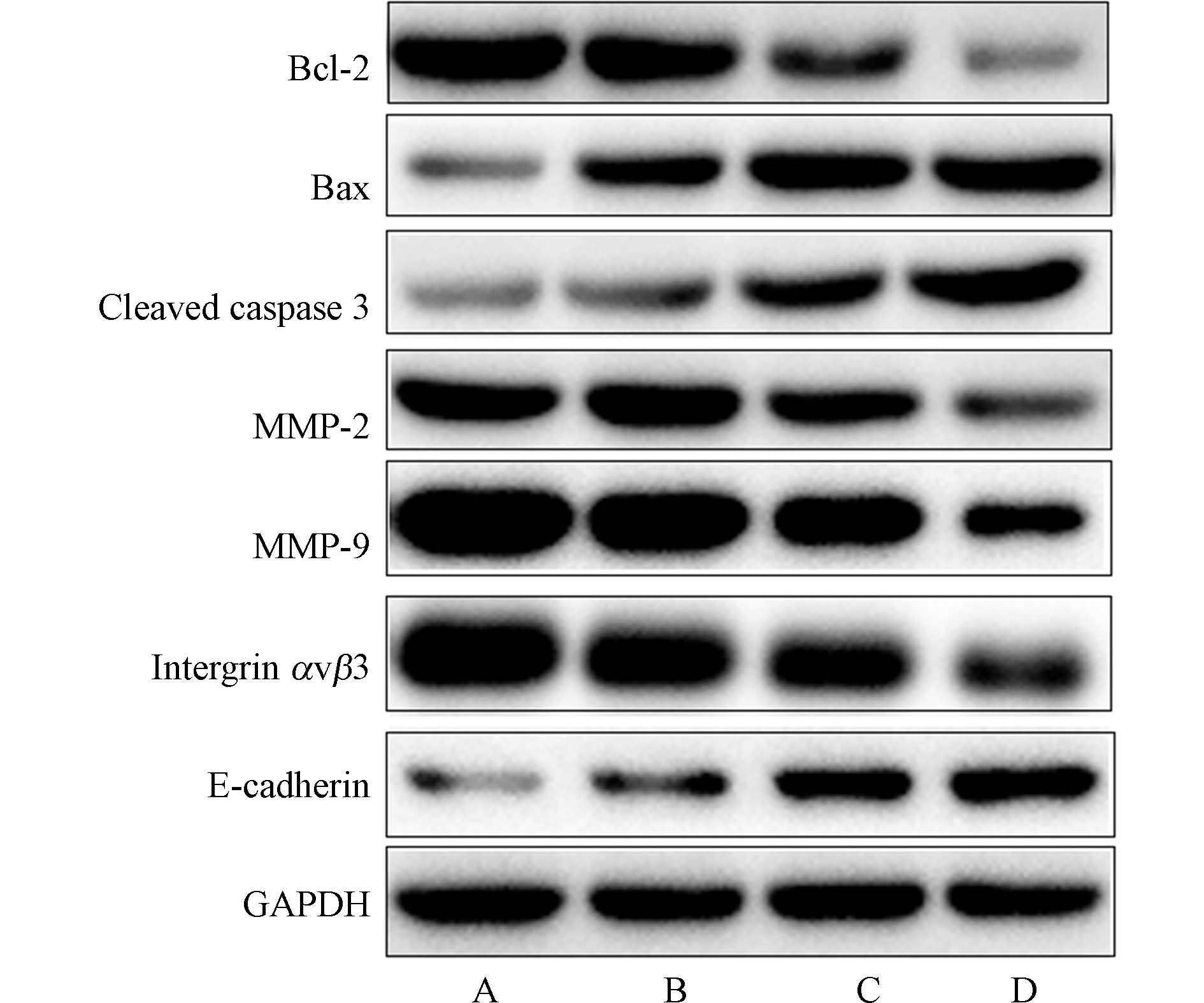 图 5 亚硒酸钠对HCT116结肠癌细胞中Bcl-2、Bax、cleaved caspase 3、MMP-2、MMP-9、intergrin αVβ3及E-cadherin蛋白表达量的影响Figure 5. The effect of sodium seleniteon on the expression of Bcl-2、Bax、cleaved caspase 3、MMP-2、MMP-9、intergrin αVβ3 and E-cadherin in HCT116 cells(A. 对照组;B. 2.5 μmol∙L−1亚硒酸钠组;C. 5 μmol∙L−1亚硒酸钠组;D. 10 μmol∙L−1亚硒酸钠组)(A. control;B. 2.5 μmol∙L−1 sodium selenite;C. 5 μmol∙L−1 sodium selenite;D. 10 μmol∙L−1 sodium selenite)表 3 亚硒酸钠对HCT116结肠癌细胞中Bcl-2、Bax、cleaved caspase 3、MMP-2、MMP-9、intergrin αVβ3及E-cadherin蛋白表达量的影响 (
图 5 亚硒酸钠对HCT116结肠癌细胞中Bcl-2、Bax、cleaved caspase 3、MMP-2、MMP-9、intergrin αVβ3及E-cadherin蛋白表达量的影响Figure 5. The effect of sodium seleniteon on the expression of Bcl-2、Bax、cleaved caspase 3、MMP-2、MMP-9、intergrin αVβ3 and E-cadherin in HCT116 cells(A. 对照组;B. 2.5 μmol∙L−1亚硒酸钠组;C. 5 μmol∙L−1亚硒酸钠组;D. 10 μmol∙L−1亚硒酸钠组)(A. control;B. 2.5 μmol∙L−1 sodium selenite;C. 5 μmol∙L−1 sodium selenite;D. 10 μmol∙L−1 sodium selenite)表 3 亚硒酸钠对HCT116结肠癌细胞中Bcl-2、Bax、cleaved caspase 3、MMP-2、MMP-9、intergrin αVβ3及E-cadherin蛋白表达量的影响 (ˉx±s Table 3. The effect of sodium selenite on the expression of Bcl-2、Bax、cleaved caspase 3、MMP-2、MMP-9、intergrin αVβ3 and E-cadherin in HCT116 cells (ˉx±s 组别Experimental group n Bcl-2 Bax cleaved caspase 3 MMP-2 MMP-9 intergrin αVβ3 E-cadherin 对照组 6 1.6±0.03 0.21±0.02 0.20±0.01 1.03±0.01 2.37±0.08 2.36±0.02 0.11±0.01 2.5 μmol∙L−1 亚硒酸钠组 6 1.25±0.06** 0.71±0.01** 0.31±0.02** 0.95±0.01** 2.07±0.03** 1.83±0.04** 0.36±0.01** 5 μmol∙L−1 亚硒酸钠组 6 0.57±0.02** 1.07±0.04** 0.73±0.02** 0.75±0.01** 1.65±0.03** 1.22±0.01** 0.69±0.04** 10 μmol∙L−1 亚硒酸钠组 6 0.11±0.01** 1.25±0.02** 1.27±0.03** 0.31±0.01** 0.43±0.01** 0.44±0.01** 1.00±0.02** **与对照组比较, P<0.01. Compared with control, P<0.01. 2.5 亚硒酸钠对HCT116结肠癌细胞中PI3K、p-AKT及p-mTOR蛋白表达量的影响
研究表明PI3K/AKT/mTOR信号通路及其下游信号分子直接参与结肠癌细胞增殖、凋亡、细胞周期、迁移、侵袭及转移等恶性生物学过程,因此PI3K/AKT/mTOR信号通路成为结肠癌治疗药物研发的热点靶通路[20 − 22]. PI3K是一种异源二聚体,被上游的信号激活后,可作为第二信使激活下游靶蛋白AKT. mTOR是AKT的底物,被AKT激活磷酸化后,参与mRNA翻译相关蛋白及抑制蛋白表达的调控. 激活的mTOR能增加MMPs的表达促进细胞外基质降解,进而增强癌细胞侵袭及迁移能力[23]. AKT能够通过靶向Bcl-2、Caspase 3表达进而抵抗细胞凋亡[24]. 本研究前期已证实亚硒酸钠对Bcl-2、Caspase 3及MMPs的调节作用(图5、表3),也发现硒代蛋氨酸对结肠癌细胞的凋亡、黏附、侵袭具有显著的抑制作用,可能是通过抑制GSK-3β/PI3K/AKT信号通路实现的[25]. 且有表观遗传学实验证实亚硒酸钠能通过PI3K/AKT信号通路参与乳腺癌的发生发展[26],也能通过ROS介导的AKT/mTOR通路诱导甲状腺癌细胞周期阻滞和凋亡[27]. 进而推测亚硒酸钠对结肠癌细胞恶性生物学行为的抑制作用与调节PI3K/AKT/mTOR信号通路有关. 因此为了证实此推测,本研究继续采用western blot实验检测PI3K/AKT/mTOR信号通路相关蛋白的表达,结果表明亚硒酸钠可显著减少PI3K表达及AKT、mTOR磷酸化水平,而对总的AKT、mTOR表达没有显著的影响(图6、表4). 因此,本研究初步认为亚硒酸钠通过抑制PI3K/AKT/mTOR信号通路发挥其抗结肠癌作用.
表 4 亚硒酸钠对HCT116结肠癌细胞中PI3K、p-AKT及p-mTOR蛋白表达量的影响 (ˉx±s Table 4. Effect of sodium selenite on the expression of PI3K, p-AKT and p-mTOR in HCT116 cells (ˉx±s 组别Experimental group n PI3K p-AKT p-mTOR 对照组 6 0.84±0.01 1.21±0.01 1.20±0.01 2.5 μmol∙L−1亚硒酸钠组 6 0.52±0.01** 0.97±0.01** 1.00±0.02** 5 μmol∙L−1亚硒酸钠组 6 0.50±0.02** 0.66±0.01** 0.42±0.01** 10 μmol∙L−1亚硒酸钠组 6 0.40±0.01** 0.29±0.01** 0.29±0.01** **与对照组比较, P<0.01. Compared with control, P<0.01.  图 6 亚硒酸钠对HCT116结肠癌细胞中PI3K、p-AKT及p-mTOR蛋白表达量的影响Figure 6. Effect of sodium seleniteon on the expression of PI3K, p-AKT and p-mTOR in HCT116 cells(A. 对照组;B. 2.5 μmol∙L−1亚硒酸钠组;C. 5 μmol∙L−1亚硒酸钠组;D. 10 μmol∙L−1亚硒酸钠组)(A. control;B. 2.5 μmol∙L−1 sodium selenite;C. 5 μmol∙L−1 sodium selenite;D. 10 μmol∙L−1 sodium selenite)
图 6 亚硒酸钠对HCT116结肠癌细胞中PI3K、p-AKT及p-mTOR蛋白表达量的影响Figure 6. Effect of sodium seleniteon on the expression of PI3K, p-AKT and p-mTOR in HCT116 cells(A. 对照组;B. 2.5 μmol∙L−1亚硒酸钠组;C. 5 μmol∙L−1亚硒酸钠组;D. 10 μmol∙L−1亚硒酸钠组)(A. control;B. 2.5 μmol∙L−1 sodium selenite;C. 5 μmol∙L−1 sodium selenite;D. 10 μmol∙L−1 sodium selenite)3. 结论(Conclusion)
综上所述,本研究采用HPLC-ICP-MS仅检出富硒食品中含有四价硒,接着采用2.5、5、10 μmol·L−1亚硒酸钠处理HCT116结肠癌细胞48 h,实验结果表明亚硒酸钠能降低HCT116结肠癌细胞活力,诱导细胞凋亡,抑制细胞迁移及侵袭能力,发挥其抗癌的作用,这可能是亚硒酸钠通过抑制PI3K/AKT/mTOR信号通路实现的. 研究结果为含有亚硒酸钠等硒化合物的富硒食品的深入研究、进一步开发及临床研究提供新的实验依据,为结肠癌的治疗提供新的线索. 但也需要采用结肠癌动物模型来进一步补充和验证本研究的结果,这将是下一步的研究方向.
-
表 1 富硒食品中总硒及硒形态含量(mg·kg−1)
Table 1. The content of total selenium and selenium form in Se-enriched foods (mg·kg−1)
Se(Ⅳ) Se(Ⅵ) 总硒Total selenium 富硒茶叶 0.0275 <0.01 0.403 富硒铁皮石斛 0.121 <0.01 1.33 富硒鸭蛋 0.0492 <0.01 0.445 富硒葛粉 0.696 <0.01 2.26 表 2 亚硒酸钠对HCT116结肠癌细胞活力、凋亡、迁移、侵袭的影响 (
ˉx±s Table 2. Effect of sodium selenite on on HCT116 cells viability, apoptotis, migration and invasion (
ˉx±s 组别Experimental group n 细胞增值抑制率/%Cell proliferation inhibitory rate 细胞凋亡率/%Cell apoptotic rate 细胞迁移率/%Cell migration rate 细胞侵袭数目Cell invasion number 对照组 6 0 3.47±0.051 52.9±0.57 210.3±2.38 2.5 μmol∙L−1亚硒酸钠组 6 17.9±0.36** 13.6±0.04** 42.7±0.40** 154.4±2.80** 5 μmol∙L−1亚硒酸钠组 6 25.3±0.15** 24.1±0.15** 31.3±0.31** 111.3±2.55** 10 μmol∙L−1亚硒酸钠组 6 33.3±0.26** 35.3±0.26** 17.4±0.21** 77.1±1.11** **与对照组比较, P<0.01. Compared with control, P<0.01. 表 3 亚硒酸钠对HCT116结肠癌细胞中Bcl-2、Bax、cleaved caspase 3、MMP-2、MMP-9、intergrin αVβ3及E-cadherin蛋白表达量的影响 (
ˉx±s Table 3. The effect of sodium selenite on the expression of Bcl-2、Bax、cleaved caspase 3、MMP-2、MMP-9、intergrin αVβ3 and E-cadherin in HCT116 cells (
ˉx±s 组别Experimental group n Bcl-2 Bax cleaved caspase 3 MMP-2 MMP-9 intergrin αVβ3 E-cadherin 对照组 6 1.6±0.03 0.21±0.02 0.20±0.01 1.03±0.01 2.37±0.08 2.36±0.02 0.11±0.01 2.5 μmol∙L−1 亚硒酸钠组 6 1.25±0.06** 0.71±0.01** 0.31±0.02** 0.95±0.01** 2.07±0.03** 1.83±0.04** 0.36±0.01** 5 μmol∙L−1 亚硒酸钠组 6 0.57±0.02** 1.07±0.04** 0.73±0.02** 0.75±0.01** 1.65±0.03** 1.22±0.01** 0.69±0.04** 10 μmol∙L−1 亚硒酸钠组 6 0.11±0.01** 1.25±0.02** 1.27±0.03** 0.31±0.01** 0.43±0.01** 0.44±0.01** 1.00±0.02** **与对照组比较, P<0.01. Compared with control, P<0.01. 表 4 亚硒酸钠对HCT116结肠癌细胞中PI3K、p-AKT及p-mTOR蛋白表达量的影响 (
ˉx±s Table 4. Effect of sodium selenite on the expression of PI3K, p-AKT and p-mTOR in HCT116 cells (
ˉx±s 组别Experimental group n PI3K p-AKT p-mTOR 对照组 6 0.84±0.01 1.21±0.01 1.20±0.01 2.5 μmol∙L−1亚硒酸钠组 6 0.52±0.01** 0.97±0.01** 1.00±0.02** 5 μmol∙L−1亚硒酸钠组 6 0.50±0.02** 0.66±0.01** 0.42±0.01** 10 μmol∙L−1亚硒酸钠组 6 0.40±0.01** 0.29±0.01** 0.29±0.01** **与对照组比较, P<0.01. Compared with control, P<0.01. -
[1] BRAY F, LAVERSANNE M, SUNG H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA, 2024, 74(3): 229-263. [2] 郑荣寿, 张思维, 孙可欣, 等. 2016年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2023, 45(3): 212-220. doi: 10.3760/cma.j.cn112152-20220922-00647 ZHENG R S, ZHANG S W, SUN K X, et al. Cancer statistics in China, 2016[J]. Chinese Journal of Oncology, 2023, 45(3): 212-220 (in Chinese). doi: 10.3760/cma.j.cn112152-20220922-00647
[3] LINGAS E C. Early-onset colon cancer: A narrative review of its pathogenesis, clinical presentation, treatment, and prognosis[J]. Cureus, 2023, 15(9): e45404. [4] TO Y H, GIBBS P, TIE J, et al. Health economic evidence for adjuvant chemotherapy in stage Ⅱ and III colon cancer: A systematic review[J]. Cost Effectiveness and Resource Allocation, 2023, 21(1): 11. doi: 10.1186/s12962-023-00422-2 [5] GARBO S, Di GIACOMO S, ŁAŻEWSKA D, et al. Selenium-containing agents acting on cancer-a new hope?[J]. Pharmaceutics, 2022, 15(1): 104. [6] GENCHI G, LAURIA G, CATALANO A, et al. Biological activity of selenium and its impact on human health[J]. International Journal of Molecular Sciences, 2023, 24(3): 2633. doi: 10.3390/ijms24032633 [7] LIPINSKI B. Sodium selenite as an anticancer agent[J]. Anti-Cancer Agents in Medicinal Chemistry, 2017, 17(5): 658-661. doi: 10.2174/1871520616666160607011024 [8] PFISTER C, DAWZCYNSKI H, SCHINGALE F J. Sodium selenite and cancer related lymphedema: Biological and pharmacological effects[J]. Journal of Trace Elements in Medicine and Biology, 2016, 37: 111-116. doi: 10.1016/j.jtemb.2016.05.005 [9] QI L, WANG Y Y, SU S Q, et al. Sodium selenite inhibits cervical cancer growth via ROS mediated AMPK/FOXO3a/GADD45a axis[J]. Chemico-Biological Interactions, 2022, 367: 110171. doi: 10.1016/j.cbi.2022.110171 [10] LIU X, JIANG M, PANG C G, et al. Sodium selenite inhibits proliferation and metastasis through ROS-mediated NF-κB signaling in renal cell carcinoma[J]. BMC Cancer, 2022, 22(1): 870. doi: 10.1186/s12885-022-09965-8 [11] LI Z, MENG J, XU T J, et al. Sodium selenite induces apoptosis in colon cancer cells via Bax-dependent mitochondrial pathway[J]. European Review for Medical and Pharmacological Sciences, 2013, 17(16): 2166-2171. [12] KRÁLOVÁ V, BRIGULOVÁ K, ČERVINKA M, et al. Antiproliferative and cytotoxic effects of sodium selenite in human colon cancer cells[J]. Toxicology in Vitro, 2009, 23(8): 1497-1503. doi: 10.1016/j.tiv.2009.07.012 [13] 陆秋艳, 张小鸿, 张文婷, 等. 富硒葛粉中硒形态分析及其对脂多糖诱导的AML12细胞氧化损伤的影响[J]. 环境化学, 2023, 42(10): 3603-3607. LU Q Y, ZHANG X H, ZHANG W T, et al. Determination of selenium species in Se-enriched puerarin powder and its effect on oxidative damage of AML12 cells induced by Lipopolysaccharide[J]. Environmental Chemistry, 2023, 42(10): 3603-3607 (in Chinese).
[14] 国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品中硒的测定: GB 5009.93—2017[S]. 北京: 中国标准出版社, 2017. National Health and Family Planning Commission of the People's Republic of China, China Food and Drug Administration. National food safety standard Determination of selenium in foods: GB 5009.93—2017[S]. Beijing: Standards Press of China, 2017 (in Chinese).
[15] 国家市场监督管理总局, 国家标准化管理委员会. 生活饮用水标准检验方法 第6部分: 金属和类金属指标: GB/T 5750.6—2023[S]. 北京: 中国标准出版社, 2023. State Administration for Market Regulation; Standardization Administration of the People's Republic of China, Standardization Administration of the People’s Republic of China. Standard examination methods for drinking water: Part 6: Metal and metalloid indices: GB/T 5750.6—2023[S]. Beijing: Standards Press of China, 2023 (in Chinese).
[16] 方勇, 罗佩竹, 胡勇, 等. 大蒜的生物富硒作用及其硒的形态分析[J]. 食品科学, 2012, 33(17): 1-5. FANG Y, LUO P Z, HU Y, et al. Bioaccumulation and speciation analysis of selenium in garlic (Allium sativum L. )[J]. Food Science, 2012, 33(17): 1-5 (in Chinese).
[17] 张俊杰, 郭志强, 王娟娟, 等. 施加硒代蛋氨酸和亚硒酸钠对韭菜总硒及硒形态的影响[J]. 山西大学学报(自然科学版), 2019, 42(3): 605-610. ZHANG J J, GUO Z Q, WANG J J, et al. Effects of selenomethionine and sodium selenite fertilizer on total selenium and selenium species in Chinese chives[J]. Journal of Shanxi University (Natural Science Edition), 2019, 42(3): 605-610 (in Chinese).
[18] 周晓华, 王铁良, 魏亮亮, 等. 高效液相色谱-原子荧光光谱联用技术测定富硒鸡蛋中的硒形态[J]. 中国无机分析化学, 2023, 13(12): 1451-1458. doi: 10.3969/j.issn.2095-1035.2023.12.026 ZHOU X H, WANG T L, WEI L L, et al. Determination of selenium species in Se-enriched eggs by high performance liquid chromatography-atomic fluorescence spectrometry[J]. Chinese Journal of Inorganic Analytical Chemistry, 2023, 13(12): 1451-1458 (in Chinese). doi: 10.3969/j.issn.2095-1035.2023.12.026
[19] KIM J B, YANG E Y, WOO J, et al. Sodium selenite enhanced the anti-proliferative effect of MEK-ERK inhibitor in thyroid cancer cells[J]. In Vivo, 2020, 34(1): 185-190. doi: 10.21873/invivo.11760 [20] DAI W, DAI Y G, REN D F, et al. Dieckol, a natural polyphenolic drug, inhibits the proliferation and migration of colon cancer cells by inhibiting PI3K, AKT, and mTOR phosphorylation[J]. Journal of Biochemical and Molecular Toxicology, 2023, 37(5): e23313. doi: 10.1002/jbt.23313 [21] ATANASOVA V S, RIEDL A, STROBL M, et al. Selective eradication of colon cancer cells harboring PI3K and/or MAPK pathway mutations in 3D culture by combined PI3K/AKT/mTOR pathway and MEK inhibition[J]. International Journal of Molecular Sciences, 2023, 24(2): 1668. doi: 10.3390/ijms24021668 [22] GLAVIANO A, FOO A S C, LAM H Y, et al. PI3K/AKT/mTOR signaling transduction pathway and targeted therapies in cancer[J]. Molecular Cancer, 2023, 22(1): 138. doi: 10.1186/s12943-023-01827-6 [23] ZHOU H K, LI X C, RANA M, et al. mTOR inhibitor rapalink-1 prevents ethanol-induced senescence in endothelial cells[J]. Cells, 2023, 12(22): 2609. doi: 10.3390/cells12222609 [24] ZHOU S K, GAO X Q, CHEN C, et al. Porcine cardiac blood - Salvia miltiorrhiza root alleviates cerebral ischemia reperfusion injury by inhibiting oxidative stress induced apoptosis through PI3K/AKT/Bcl-2/Bax signaling pathway[J]. Journal of Ethnopharmacology, 2023, 316: 116698. doi: 10.1016/j.jep.2023.116698 [25] 张小鸿, 陆秋艳. 硒代蛋氨酸对结肠癌细胞凋亡、粘附、侵袭的影响及机制[J]. 营养学报, 2023, 45(5): 436-440. doi: 10.3969/j.issn.0512-7955.2023.05.007 ZHANG X H, LU Q Y. Effects of selenomethionine on apoptosis, adhesion and invasion of colon cancer cells and the mechanism involved[J]. Acta Nutrimenta Sinica, 2023, 45(5): 436-440 (in Chinese). doi: 10.3969/j.issn.0512-7955.2023.05.007
[26] LIANG Z Z, ZHU R M, LI Y L, et al. Differential epigenetic profiles induced by sodium selenite in breast cancer cells[J]. Journal of Trace Elements in Medicine and Biology, 2021, 64: 126677. doi: 10.1016/j.jtemb.2020.126677 [27] CHENG Z, YU S, HE W M, et al. Selenite induces cell cycle arrest and apoptosis via reactive oxygen species-dependent inhibition of the AKT/mTOR pathway in thyroid cancer[J]. Frontiers in Oncology, 2021, 11: 668424. doi: 10.3389/fonc.2021.668424 -








 下载:
下载: