-
随着海水入侵、海水利用(海水冲厕、海水冷却)和工业废水(造纸、发酵、制药、食品生产和采矿等)排放,产生了大量含硫酸盐废水(简称含硫废水),使得污水生物处理受到较大影响[1]。为此,利用硫酸盐还原菌(sulfate-reducing bacteria,SRB)和硫氧化菌(sulfur-oxidizing bacteria,SOB),研究者们开发出了各种含硫废水处理工艺,包括硫酸盐还原沉淀重金属[2-3]、硫自养反硝化工艺[4-5]、自养反硝化和硝化一体化工艺(sulfate reduction,autotrophic denitrification and nitrification integrated,SANI®)[6-7]。相比这些工艺,新近开发的硫循环耦合反硝化除磷工艺(DS-EBPR)系统作为含硫废水脱氮除磷新工艺,同时利用了2种微生物,将硫(S)、碳(C)、氮(N)和磷(P)循环进行了耦合,从而实现了C、N、P源污染的共同去除[8-9]。
DS-EBPR系统的运行主要分为2个阶段(厌氧/缺氧):在厌氧阶段,SRB与SOB协同作用吸收挥发性脂肪酸(volatile fatty acid,VFA)并储存为聚羟基脂肪酸酯(polyhydroxyalkanoates,PHA),SRB将硫酸盐还原为聚硫,SOB则进行糖原的酵解与聚磷的释放;在缺氧阶段,SOB则会利用硝酸盐为电子受体,氧化PHA与聚硫,生成的能量用于生物质的生长、糖原的生成以及聚磷的储存。通过定时排除富磷污泥,可实现从污水中去除磷的目的[10]。相比于传统的生物强化除磷(EBPR)工艺,DS-EBPR工艺更能适应高盐度、高硫酸盐、高温的环境,同时可减少剩余污泥产量,满足了日益增长的含硫废水中脱氮除磷的需求[11]。
然而,在生物除磷过程中,存在一类微生物——聚糖菌(glycogen-accumulating organisms,GAOs),会与除磷细菌竞争碳源但不吸收磷酸盐[12]。在碳源不足的情况下,除磷细菌会逐渐丧失优势菌群的地位,导致DS-EBPR系统除磷效能波动甚至下降。如何有效抑制GAOs的生长,提升除磷细菌的活性,是每一种生物除磷工艺稳定运行的关键[13]。在传统的EBPR系统中,已经有学者们研究了各种参数,如C/P比、pH、温度等对聚磷菌(phosphate-accumulating organisms,PAOs)与GAOs竞争关系的影响[14-15],但DS-EBPR工艺不同于传统的EBPR工艺,其功能种群硫细菌(SRB和SOB)区别于传统的PAOs,与GAOs相互竞争的有关影响因素尚缺乏研究。因此,本研究首次向已富集有聚糖菌的DS-EBPR系统中投加单质硫,探究单质硫短期冲击对SRB、SOB与GAOs竞争关系的影响。
-
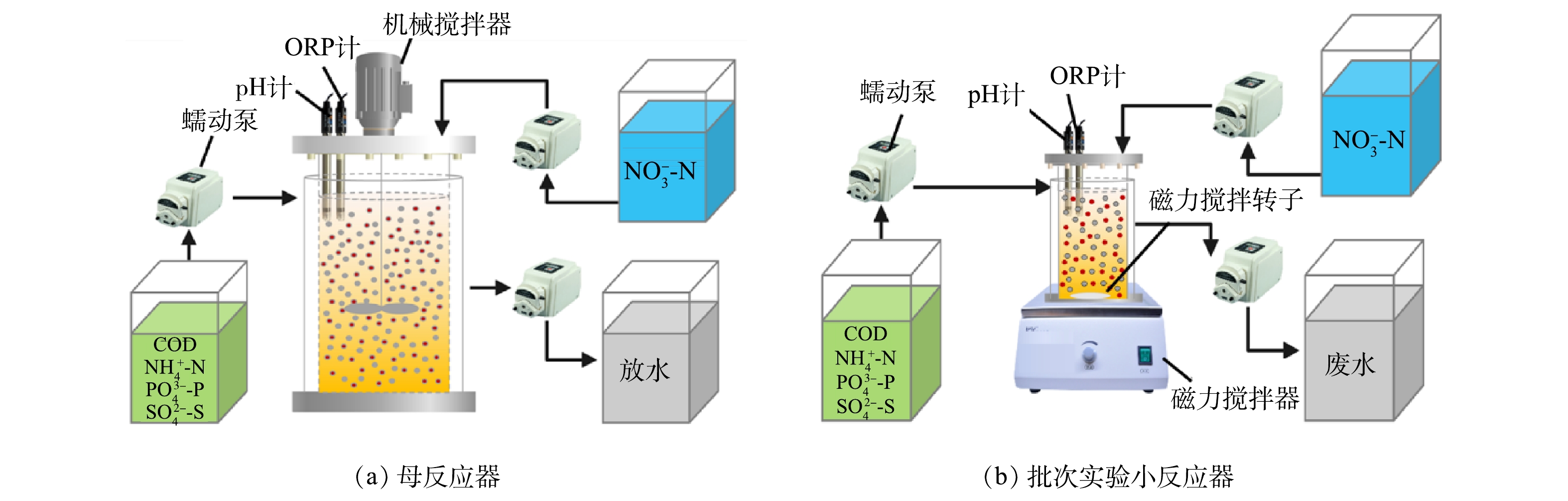
本实验分为2部分:序批式母反应器(sequencing batch reactor,SBR)由有机玻璃制成(图1(a)),有效容积20 L(高75 cm,内径20 cm),采用全自动控制和机械搅拌,用于长期培养驯化SRB、SOB与GAOs;4套小SBR由有机玻璃制成(图1(b)),每个反应器有效容积2 L(高17 cm,内径13 cm),配备磁力搅拌器搅拌,用于在批次实验中研究投加单质硫对SRB、SOB与GAOs竞争关系的短期影响,反应器编号分别为R1、R2、R3、R4。母反应器与4套小反应器均采用水浴加热控制温度为(30±1) ℃,通过添加1 mol·L−1 HCl或NaOH控制pH在6.5~7.9。
反应器的运行过程分为7个阶段:1)进水,用时10 min,模拟含硫废水;2)厌氧反应阶段,进水结束后开启搅拌器,当乙酸根的含量降为0 mg·L−1时,表明厌氧段结束;3)投加2 g·L−1的硝酸盐溶液(以N计),使得反应器中硝酸盐质量浓度达到40 mg·L−1左右(系统性能恶化后,硝酸盐间隔30 min分2次投加,投加总量不变);4)缺氧反应阶段,硝酸盐投加后开始反硝化,当硝酸根与亚硝酸根含量降为0 mg·L−1时,表明缺氧结束;5)沉淀30 min;6)排出上清液,用时10 min;7)闲置50 min。其中,厌氧和缺氧阶段的持续时间,会根据生化代谢反应的实际效果(如乙酸盐和硝酸盐的消耗情况)进行调整。
-
母反应器接种污泥来自连续运行500 d的DS-EBPR系统,接种后反应器起始污泥浓度(mixed liquid volatile suspended solids,MLVSS)为5.72 g·L−1。在整个污泥驯化过程中,母反应器运行分为4个阶段:第Ⅰ阶段为系统启动阶段(第1~20 d),第Ⅱ阶段为系统恶化阶段(第21~39 d),第Ⅲ阶段为微生物富集阶段(第40~545 d),第Ⅳ阶段为系统稳定运行阶段(第546~580 d)。各阶段的运行情况如下:第Ⅰ阶段,厌氧碳源投量为400 mg·L−1,缺氧硝酸盐投量为40 mg·L−1;第Ⅱ阶段,在该阶段的前5 d,提高缺氧段的硝酸盐投量至100 mg·L−1,之后恢复正常投量,诱导系统恶化;第Ⅲ阶段,在该阶段厌氧段按800、400 mg·L−1交替投加碳源,用于富集硫细菌与聚糖菌;第Ⅳ阶段,运行条件与第Ⅰ阶段保持一致。4个运行阶段的ORP均在-500 ~ -100 mV变化,控制污泥龄为30 d。
在母反应器运行的每个周期,定时在厌氧初期、厌氧末期和缺氧末期取2~4 mL泥水混合液,用0.22 μm针孔滤头过滤后,用于检测乙酸根、硫酸根、磷酸根、硝酸根和亚硝酸根等离子的质量浓度。在反应器进入微生物富集阶段后,为检测微生物种群结构组成,分别在第146、178、204和571 d取20 mL污泥样品并进行了16S rRNA高通量分析。同时,选择母反应器运行第570 d作为典型周期,参考GUO等[10]在DS-EBPR系统典型周期研究时的取样点分布,并考虑到厌/缺氧反应速率会随反应时间而变缓,决定在单个周期中每30~120 min取20 mL泥水混合液样品用于检测相关指标,观察系统稳定时的运行效果。
-
母反应器运行至第580 天时,污泥质量浓度达到5.69 g·L−1,在缺氧阶段结束后,取出全部20 L活性污泥,用去离子水清洗2次,沉淀后(总体积4 L)平均分成4份加入反应器中。随后,在每个小反应器开始运行时,加入1 L模拟含硫废水和0.53 g单质硫(约增加了400 mg·L−1 COD,保证单质硫在反应器内过量),使得泥水混合液体积达到2 L,污泥质量浓度分别为3.96、3.89、4.27和4.44 g·L−1。进水采用人工配水,除乙酸钠质量浓度分别按400(R1)、200(R2)、100(R3)和0 mg·L−1(R4)设置外,其他成分与母反应器第Ⅳ阶段进水相同。反应周期包括8 h厌氧阶段和2 h缺氧阶段,其中40 mg·L−1的硝酸盐分2次投加。实验过程中,每间隔30~120 min取20 mL泥水混合液样品用于检测相关指标。
-
进水成分包括乙酸钠(以COD计)400 mg·L−1,氯化铵(以N计)20 mg·L−1,磷酸钠(以P计)20 mg·L−1,硫酸钠(以S计)180 mg·L−1,微量元素0.3 mL·L−1。每周期加3 mL微量元素,其组分为1.5 g·L−1 FeCl3·6H2O,0.15 g·L−1 H3BO3,0.03 g·L−1 CuSO4·5H2O,0.18 g·L−1 KI,0.12 g·L−1 MnCl2·4H2O,0.06 g·L−1 Na2MoO4·2H2O,0.12 g·L−1 ZnSO4·7H2O,0.15 g·L−1 CoCl2·6H2O和10 g·L−1 EDTA[16]。
实验中需测定的指标及方法如下:Ac−-C、
${\rm{SO}}_4^{2-} $ -S、${\rm{PO}}_4^{3-} $ -P、${\rm{NO}}_3^{-} $ -N采用离子色谱法(Dionex ICS-900)测定;S2−含量采用亚甲基蓝分光光度法测定[17];pH和ORP采用电极法(Mettler Toledo FG2)测定;MLVSS、MLSS含量采用国标法测定[17];聚羟基脂肪酸酯(PHA)包括聚-β-羟基丁酸酯(poly-β-hydroxybutyrate,PHB)和聚-β-羟基戊酸酯(poly-β-hydroxyvalerate,PHV)采用气相色谱质谱联用(GC-MS)测定[18];糖原(glycogen,Gly)采用蒽酮法分析[19];聚硫(polyS2−/S0)通过亚硫酸盐法测定[20]。采用16S rRNA基因扩增子测序对富集培养的微生物群落结构进行分析,整个过程包括DNA提取、聚合酶链反应(PCR)扩增、测序和数据分析。样品送至上海美吉生物医药科技有限公司进行检测分析。 -
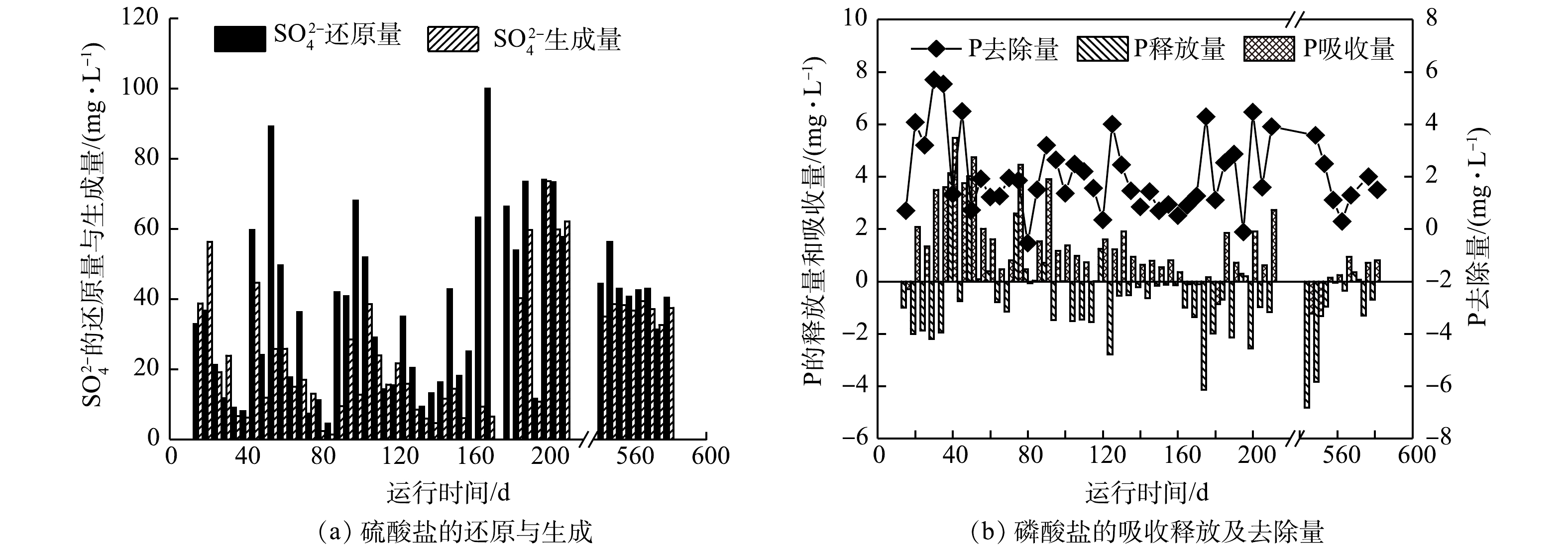
母反应器连续运行了580 d,整个运行过程经历系统启动、系统恶化、功能微生物(SRB、SOB和GAOs)富集、系统稳定4个阶段。图2显示了母反应器在长期运行过程中厌氧阶段硫酸盐还原和磷酸盐释放,缺氧阶段硫酸盐生成和磷酸盐吸收随时间的变化情况。
在系统启动阶段(1~20 d),由于实验接种污泥来源于较成熟的DS-EBPR系统,使得反应器运行初始阶段,硫、磷转化具有一定的效果。其中,厌氧阶段硫酸盐还原量和缺氧阶段硫酸盐生成量随着时间延长不断升高,硫酸盐还原量(以S计)由10.8 mg·L−1升高到36.8 mg·L−1,硫酸盐生成量(以S计)由22.4 mg·L−1升高到56.4 mg·L−1。与此同时,系统的除磷量(以P计)也逐渐升高,最高达到4.0 mg·L−1,除磷率达到19.8%,表明系统中已富集了较高丰度的SRB和SOB功能微生物[10]。
在系统恶化阶段(21~39 d),从第21天开始,系统运行状态急剧恶化,硫酸盐的还原量和生成量均降低到10 mg·L−1以下,同时除磷量也降低到1.5 mg·L−1左右。这主要是由于在第21~25天厌氧末向反应器投加了过量的硝酸盐(约100 mg·L−1 ),导致缺氧阶段亚硝酸盐积累,而亚硝酸盐对硫细菌有极强的毒害作用,同时会促进GAOs的繁殖[21]。随着反应器继续运行,GAOs不断富集,在与SRB、SOB竞争碳源的过程中取得优势,使得厌氧阶段SRB所能利用的碳源逐渐减少,导致硫酸盐还原量降低,硫化物的生成量不足。在缺少硫化物等低价态硫时,缺氧阶段SOB在与其他反硝化菌的竞争中也会处于劣势地位,使得硫酸盐生成量降低。
在功能微生物富集阶段(40~545 d),为恢复SRB和SOB微生物的活性,本阶段首先在第40~45天的厌氧阶段向反应器投加了2倍碳源(800 mg·L−1),硫酸盐的还原量由8.0 mg·L−1升高至59.7 mg·L−1,硫酸盐生成量也得到恢复,由6.2 mg·L−1升高至44.6 mg·L−1。但当碳源投量恢复至400 mg·L−1时,硫酸盐的还原量和生成量又逐渐降低。经过反复多次加倍、减少碳源投量,硫酸盐和磷酸盐的变化趋于稳定,其中硫酸盐还原量和生成量分别达到44.3 mg·L−1和35.0 mg·L−1,磷酸盐的去除量达到3.5 mg·L−1。这与预期通过调整碳源量以进一步提高除磷量的目标不一致。这主要因为,在硫细菌富集阶段,当短期投加过量碳源时,硫细菌(SRB和SOB)能够获得充足的碳源进行硫酸盐还原,生成的还原性硫也能促进SOB的生长,与此对应的现象是厌氧段硫酸盐还原量和缺氧段硫酸盐生成量的提高。同时,较高浓度的硫化物对GAOs以及其他反硝化微生物的活性也有一定的抑制作用,使得除磷效果有所提升。因此,由图2可以看出,第170~210 d与第140~160天相比,硫酸盐的生成量和还原量相对较高,除磷量也较高。一旦有GAOs开始存活于系统中,则通过加倍投加碳源的方式并不能将其淘汰掉,GAOs反而在与硫细菌竞争碳源更具优势,并不断富集,导致系统除磷效果下降[11,22]。
在稳定运行阶段(546~580 d),硫、磷转化量基本达到稳定状态,硫酸盐的平均还原量和生成量分别为42.5 mg·L−1和37.2 mg·L−1,而磷酸盐的平均去除量仅保持在1.5 mg·L−1左右,系统长期维持着较高的硫转化和较低的磷去除。这可能是因为,硫细菌(SRB和SOB)和GAOs的富集度在反应器中保持相对稳定[10]。
-
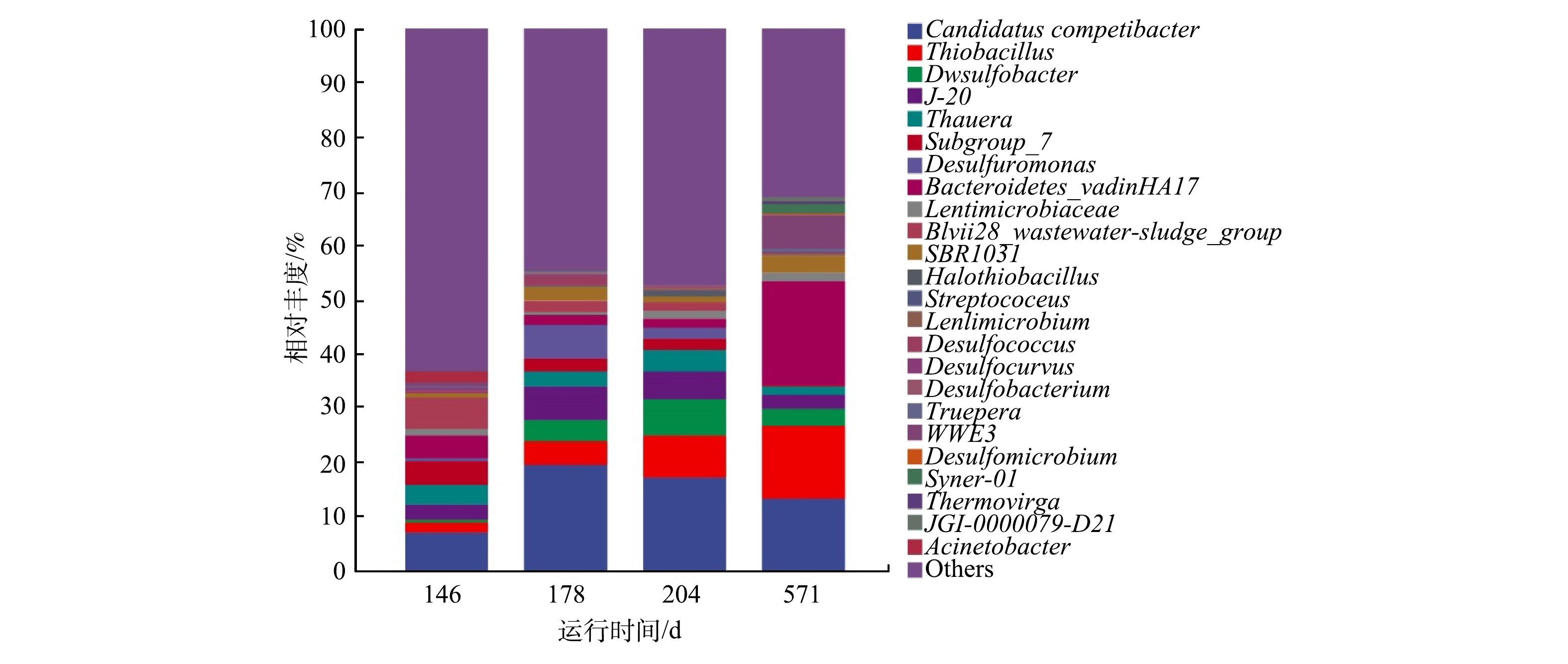
在母反应器长期运行过程中,利用16S rRNA高通量技术分别检测了第146、178、204和571天微生物群落组成,结果如图3所示。图3表明,系统在第III阶段,GAOs(主要是Candidatus_Competibacter)的丰度由第146 d的7.0%升高到了第178 d的19.6%,而硫细菌(主要是SRB-Desulfobacter和SOB-Thiobacillus)的丰度由4.0%升高到了16.3%,这与GUO等报道的DS-EBPR系统恶化后微生物群落组成结果一致[10]。这是因为采取交替投加双倍和单倍碳源时,硫细菌与聚糖菌均能获得足够的碳源,用于自身的生长和繁殖,使得其富集度都有所增加。由此可见,通过提高碳源浓度可以恢复SRB和SOB的生长,但无法淘汰GAOs,因而不能有效提高系统的除磷效能。在第204和571天,系统内聚糖菌和硫细菌的丰度基本保持稳定,聚糖菌的丰度分别为17.1%和13.2%,硫细菌的丰度为16.8%和16.6%,这与前述系统运行效果达到稳定保持一致。
在系统稳定阶段的第571 d,通过微生物检测发现,系统内主要微生物包括Bacteroidetes_vadinHA17、Thiobacillus、Candidatus_Competibacter、WWE3、SBR1031和Desulfobacter(图3)。其中Candidatus_ Competibacter(13.2%)是典型聚糖菌,Thiobacillus(13.5%)是SOB中的一种,Desulfobacter(3.1%)为SRB中的一种,其他微生物均是厌氧活性污泥中常见的微生物。母反应器经过长期运行,实现了SRB、SOB与GAOs的长期共存,并且富集度达到均衡的状态,从而有利于后续短期冲击实验研究其相互竞争关系。
-
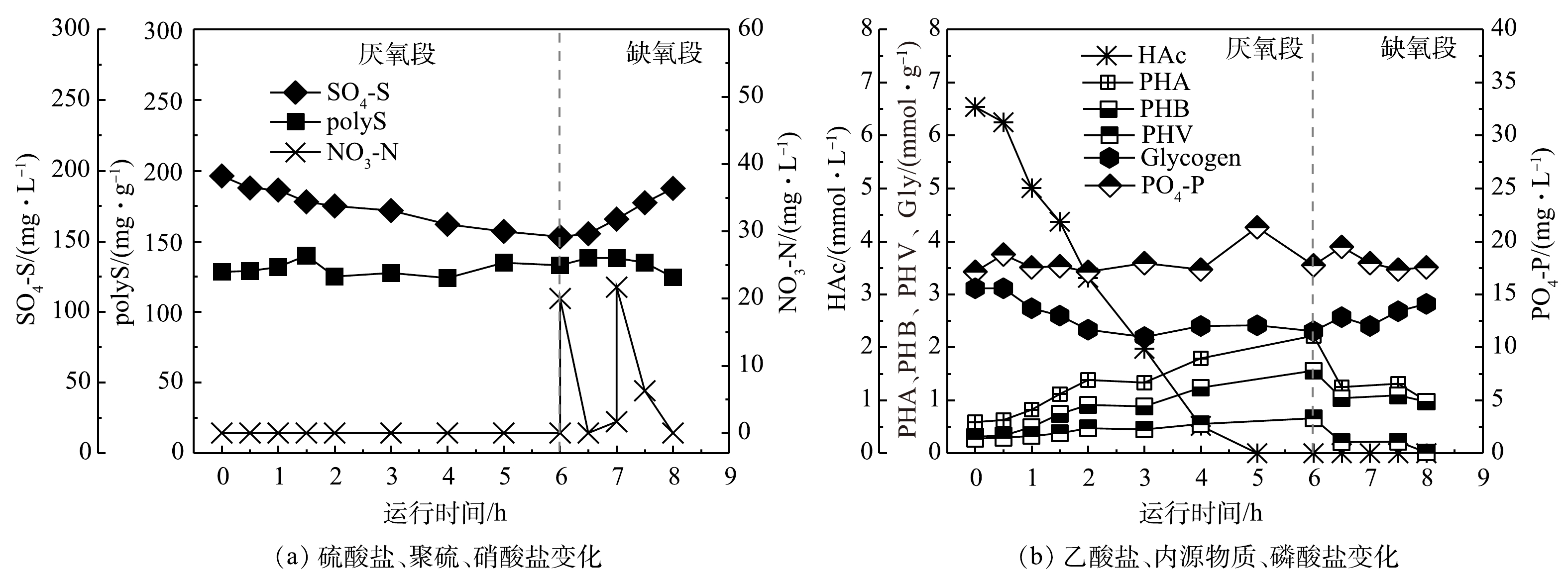
图4显示了母反应器在稳定阶段(546~580 d)第570天的典型周期实验运行效果。在厌氧阶段,乙酸盐的吸收和硫酸盐的还原同时发生,被用于合成PHA和聚硫,储存在微生物体内,同时伴随着糖原的降解和磷的释放。其中,乙酸盐在6 h内被完全吸收,硫酸盐还原量为43.0 mg·L−1,磷酸盐释放量为0.6 mg·L−1,糖原降解量(单位MLVSS消耗的糖原含量,以C计)为0.81 mmol·g−1。在缺氧阶段,40 mg·L−1的硝酸盐投加后,硫转化驱动的反硝化除磷现象少量出现,微生物体内的PHA和聚硫被利用,硫酸盐和糖原被重新生成。在2 h内,硫酸盐生成量为34.3 mg·L−1,糖原生成量(单位MLVSS生成的糖原含量,以C计)为0.52 mmol·g−1,少量磷酸盐(0.2 mg·L−1)被吸收。总体而言,系统在8 h内完成了厌氧-缺氧反应,硫酸盐转化平均量为38.6 mg·L−1,但磷去除率非常低(−0.02%),基本没有磷的去除效果;与此同时,糖原转化量为0.66 mmol·g−1,这进一步表明GAOs在系统内大量富集。
-
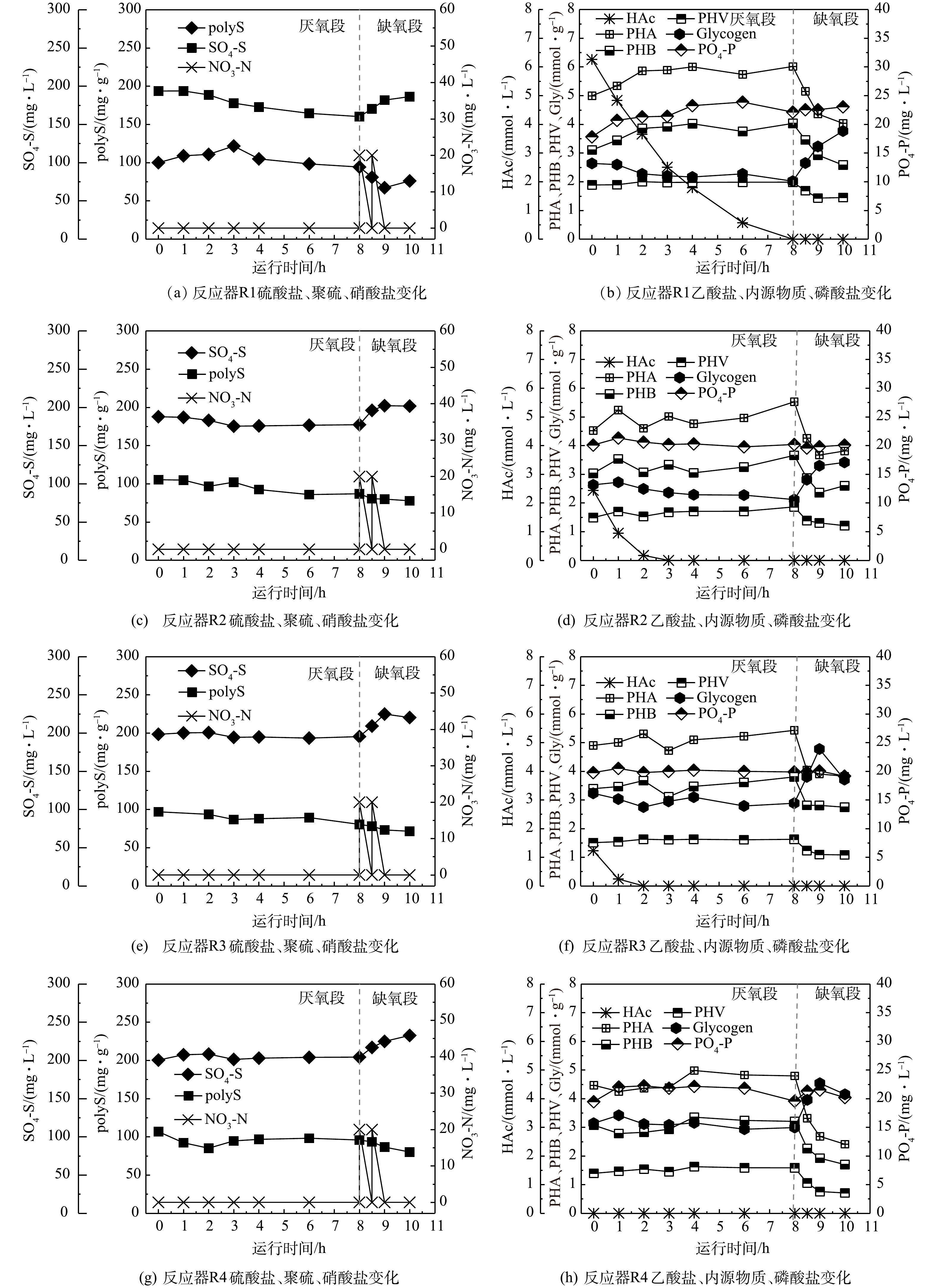
1)单质硫冲击对VFAs、PHA和糖原转化的影响。本实验中,在投加0.53 g单质硫的情况下,分别向反应器R1、R2、R3、R4进水中投加400、200、100和0 mg·L−1的碳源(以COD计)进行批次实验,监测了微生物体内的内源物质(PHA、PHB、PHV和糖原)和水体中挥发性脂肪酸(VFAs)的变化。
如图5所示,在厌氧阶段,系统内功能微生物(SRB、SOB与GAOs)会消耗水体中碳源,进水中的乙酸盐分别在8、3、2和0 h被消耗完毕;同时,降解糖原并促进PHA(包括PHB和PHV)合成。上述结果表明,随着进水碳源由0 mg·L−1(R4)升高至400 mg·L−1(R1),微生物体内储存的PHA(单位MLVSS储存的PHA含量,以C计)储存量由0.32 mmol·g−1升高至1.02 mmol·g−1;同时,降解的糖原生成量也越高,由0.15 mmol·g−1升高至0.62 mmol·g−1。从污泥体内储存的PHA和糖原量来看,其均处在较高水平。这是因为,污泥中有大量聚糖菌的富集,易于合成糖原和PHA并在微生物体内积累。在缺氧阶段,随着硝酸盐的投加,微生物会利用PHA生成能量供其生长,同时可促进糖原的合成。
通过比较分装前母反应器典型周期实验与反应器R1批次实验过程,厌氧阶段Gly/VFA与PHA/VFA变化量均介于GAOs的代谢模型和DS-EBPR系统代谢模型之间(表1)。这是因为,这2个反应器在该阶段均富集SRB、SOB和GAOs,且硫细菌与聚糖菌丰度相对一致。系统运行过程中2类微生物同时吸收碳源并降解糖原用来合成PHA,使得Gly/VFA与PHA/VFA值比DS-EBPR模型高,比GAOs模型低。有趣的是,相比于分装前的母反应器典型周期实验结果,反应器R1的相关参数更靠近DS-EBPR模型,这可能是因为单质硫的加入使得硫细菌的活性大于聚糖菌的活性。另外,尽管降低了批次实验反应器R2~R4的碳源投加量,但SRB、SOB与GAOs仍保持活性,在厌氧段有较高的PHA生成量和糖原酵解量,因此Gly/VFA和PHA/VFA的值较高。
2)单质硫冲击对硫转化的影响。在批次实验过程中,监测了硫酸盐和聚硫生成量的变化,结果如图5所示。图5表明,乙酸盐投量越低,厌氧阶段硫酸盐还原量越低,其中反应器R1、R2和R3硫酸盐还原量分别为33.5、10.5和3.0 mg·L−1,反应器R4没有硫酸盐还原,反而生成了3.9 mg·L−1硫酸盐,没有硫酸盐的还原。除了反应器R1(投加400 mg·L−1碳源)中硫酸盐含量在厌氧段一直处于下降外,其他反应器(R2~R4)一旦消耗完碳源,硫酸盐含量均有上升趋势。这是因为,在反应器 R2~R4中,SRB摄取的碳源量不足,使得硫酸盐还原动力较弱,在碳源被消耗完后,即使在厌氧环境下还原性硫也会被进水少量复氧氧化成硫酸盐。在缺氧阶段,反应器R1~R4中硫酸盐生成量分别为26.1、24.4、24.9、28.3 mg·L−1,表明硫酸盐的生成受硫单质冲击和碳源减少影响不大。这是因为,在有足够还原性硫(包括单质硫、聚硫等)的情况下,由于缺氧段投加的硝酸盐量相同,使得该阶段SOB氧化还原性硫而生成的硫酸盐基本相同。
另外,聚硫含量在厌氧阶段呈先上升后下降或持续缓慢下降的趋势,结果如图5(a)、图5(c)、图5(d)、图5(e)所示。其中,反应器R1的聚硫含量在0~3 h处于上升状态,3 h后一直处于下降状态。这可能是因为,在前3 h反应器R1中碳源的含量充足,硫细菌的活性较高,生成的聚硫含量逐渐提高;3 h以后碳源含量降低,在与聚糖菌的竞争中处于劣势,聚硫的生成停止。此外,批次实验反应器容积较小,受复氧影响较大,聚硫缓慢被氧化。而反应器R2~R4由于一开始碳源含量就较低,聚硫的生成受到了影响,在复氧的影响下反而缓慢下降。
反应器R1的聚硫含量在0~3 h由100.0 mg·g−1升高至121.7 mg·g−1,增加了21.8 mg·g−1,受复氧影响之后缓慢下降。而未投加单质硫的母反应器聚硫变化趋势和反应器R1相似(图4(a)),在0~1.5 h由128.3 mg·g−1升高至139.9 mg·g−1,升高了11.6 mg·g−1。这是由于母反应器容积较大,受复氧影响程度较小,在厌氧末聚硫含量维持在了133.0 mg·g−1左右。对比投加单质硫前后的聚硫变化情况可发现,反应器R1聚硫生成的时间更长,生成量更多。这表明单质硫的投加在短期内提高了硫细菌的活性,在与聚糖菌的竞争中能够获得更多的碳源,生成更多的聚硫。
3)单质硫冲击对氮和磷去除效果的影响。本实验中比较了批次实验中4个反应器的N和P转化的情况。4个反应器在缺氧段均能实现完全反硝化,与未投加单质硫的母反应器运行效果相同,显示投加单质硫短期内对反硝化没有明显的影响。这主要是因为,虽然投加单质硫并降低碳源量,但冲击实验前各反应器微生物体内均已经积累有一定量的内源物质,能够支持微生物在较少反应周期内完成完全反硝化。然而,如果持续降低碳源,反硝化可能会不完全。
在厌氧阶段,4个反应器中的乙酸盐投加量越低,磷酸盐释放越少。除了反应器R1磷酸盐释放量达4.3 mg·L−1以外,其他反应器(R2~R4)磷酸盐释放量均在0.1 mg·L−1左右。这主要是因为,厌氧段碳源较低的情况下,聚糖菌在碳源竞争上处于优势,降低了磷的释放。而在缺氧阶段,4个反应装置均没有明显的吸磷现象发生,磷酸盐吸收量均在1.0 mg·L−1以下。这主要是因为,短期的冲击实验不能根本上改变微生物群落结构,系统除磷效果始终较低。总之,投加单质硫前后的典型周期实验与冲击实验,脱氮除磷效果基本相同,单质硫的投加短期内对系统脱氮除磷影响不大。
本研究成果有助于揭示单质硫对硫细菌与聚糖菌竞争关系的影响,包括效果及反应机理,对于实现DS-EBPR系统长期稳定运行具有科学指导价值。
-
1)母反应器经过长期运行,实现了SRB、SOB和GAOs的长期共存,并且富集度达到均衡的状态。
2)在小反应器批次实验单个周期内,单质硫的投加对硫细菌与聚糖菌体内储存的内源物质(PHA和糖原)转化量、氮磷去除效果影响不大。
3)单质硫短期冲击会提高硫细菌的活性,增加硫转化量,使得硫细菌在与聚糖菌在竞争中处于优势。
单质硫冲击对含硫废水中硫细菌与聚糖菌竞争关系的影响
Effects of elemental sulfur shock on the competition between sulfur bacteria and glycogen-accumulating organisms in sulfate-containing wastewater
-
摘要: 聚糖菌的富集会与硫循环耦合反硝化除磷系统(denitrifying sulfur conversion-associated enhanced biological phosphorous removal,DS-EBPR)内功能种群微生物——硫细菌发生竞争,从而导致除磷效果波动。因此,首先对母反应器中微生物进行了长期驯化,然后通过向批次实验小反应器中投加单质硫,研究单质硫短期冲击对含硫废水中硫细菌与聚糖菌竞争关系的影响。结果表明,经过长期驯化,在母反应器中发现了硫细菌与聚糖菌共存的现象;而短期冲击实验结果表明,在单个周期反应过程中,虽然单质硫的投加对微生物内源物质(聚羟基脂肪酸酯、糖原)转化量、氮磷去除效果影响不大,但其可以提高硫细菌的活性,增加硫转化量,使得硫细菌在与聚糖菌的竞争中取得优势地位。Abstract: Glycogen-accumulating organisms (GAOs) can compete with the functional microorganism of denitrifying sulfur conversion-associated enhanced biological phosphorous removal (DS-EBPR) system, i.e. sulfur bacteria, and lead to the fluctuations of phosphorus removal performance. Therefore, this study firstly cultivated the sulfur bacteria in the parent reactor during the long-term operation, and then conducted the experiments of the short-term shock effects of adding elemental sulfur on competition between sulfur bacteria and GAOs in batch tests. The results showed that sulfur bacteria and GAOs could coexist in one ecosystem during the long-term operation. At the same time, the short-term batch tests indicated that although adding elemental sulfur insignificantly affected the production of endogenous substances (such as PHA, glycogen), while it could improve the activity of sulfur bacteria and increase sulfur conversion, subsequently lead to the dominance of sulfur bacteria during the competition with GAOs.
-

-
表 1 以乙酸为碳源,本研究不同反应器与相关代谢模型中碳硫转化、磷释放和内源物质转化比较
Table 1. Comparison of the anaerobic carbon sulfur transformations, P release, endogenous substance conversion with the studied reactors and various metabolic models, with acetate as carbon sources
mmol·mmol−1 反应器 碳源 P/VFA polyS/VFA Gly/VFA PHA/VFA PHB/VFA PHV/VFA R1 HAc 0.022 −0.14 0.47 0.78 0.71 0.07 R2 HAc 0.001 −1.16 1.03 2.01 1.26 0.75 R3 HAc 0.027 −2.12 1.43 2.17 1.69 0.48 R4 HAc — — — — — — 母反应器 HAc 0.003 0.13 0.70 1.42 1.08 0.34 DS-EBPR系统[23] HAc 0.24 0.16 0.06 0.58 0.58 0 DPAO代谢模型[24] HAc 0.16 0 0.50 1.37 1.10 0.27 DGAO代谢模型[25] HAc 0 0 1.15 1.87 1.40 0.47 GAOs代谢模型[26] HAc 0 0 1.12 1.86 1.36 0.46 PAO代谢模型[16] HAc 0.50 0 0.50 1.33 1.33 0 -
[1] 蒋玲燕, 周振, 王英俊, 等. 硫化物对污水处理厂硝化菌活性的抑制作用[J]. 环境工程学报, 2012, 6(11): 4065-4068. [2] 余飞, 万俊锋, 赵雅光, 等. 硫酸盐还原菌SRB除砷的影响因素[J]. 环境工程学报, 2016, 10(7): 3898-3904. doi: 10.12030/j.cjee.201502116 [3] ZHU Y P, WU M, GAO N Y, et al. Removal of antimonate from wastewater by dissimilatory bacterial reduction: Role of the coexisting sulfate[J]. Journal of Hazardous Materials, 2018, 341: 36-45. doi: 10.1016/j.jhazmat.2017.07.042 [4] MORAES B S, SOUZA T S O, FORESTI E. Effect of sulfide concentration on autotrophic denitrification from nitrate and nitrite in vertical fixed-bed reactors[J]. Process Biochemistry, 2012, 47(9): 1395-1401. doi: 10.1016/j.procbio.2012.05.008 [5] 贾妍艳, 李璇, 杨伟明, 等. 硫自养反硝化工艺去除布洛芬[J]. 环境工程学报, 2017, 11(6): 3461-3467. doi: 10.12030/j.cjee.201603018 [6] LAU G N, SHARMA K R, CHEN G H, et al. Integration of sulphate reduction, autotrophic denitrification and nitrification to achieve low-cost excess sludge minimisation for Hong Kong sewage[J]. Water Science and Technology, 2006, 53(3): 227-235. doi: 10.2166/wst.2006.101 [7] WANG J, LU H, CHEN G H, et al. A novel sulfate reduction, autotrophic denitrification, nitrification integrated (SANI) process for saline wastewater treatment[J]. Water Research, 2009, 43(9): 2363-2372. doi: 10.1016/j.watres.2009.02.037 [8] WU D, EKAMA G A, WANG H G, et al. Simultaneous nitrogen and phosphorus removal in the sulfur cycle-associated enhanced biological phosphorus removal (EBPR) process[J]. Water Research, 2014, 49: 251-264. doi: 10.1016/j.watres.2013.11.029 [9] 赵晴, 余美, 程娜, 等. 碳硫比和硝酸根投加量对DS-EBPR工艺的影响研究[J]. 水处理技术, 2016, 42(10): 71-75. [10] GUO G, WU D, HAO T W, et al. Functional bacteria and process metabolism of the denitrifying sulfur conversion-associated enhanced biological phosphorus removal (DS-EBPR) system: An investigation by operating the system from deterioration to restoration[J]. Water Research, 2016, 95: 289-299. doi: 10.1016/j.watres.2016.03.013 [11] GUO G, EKAMA G A, WANG Y Y, et al. Advances in sulfur conversion-associated enhanced biological phosphorus removal in sulfate-rich wastewater treatment: A review[J]. Bioresource Technology, 2019, 285: 121303. doi: 10.1016/j.biortech.2019.03.142 [12] LAW Y, KIRKEGAARD R H, COKRO A A, et al. Integrative microbial community analysis reveals full-scale enhanced biological phosphorus removal under tropical conditions[J]. Scientific Reports, 2016, 6(1): 25719. doi: 10.1038/srep25719 [13] OEHMEN A, LEMOS P C, CARVALHO G, et al. Advances in enhanced biological phosphorus removal: From micro to macro scale[J]. Water Research, 2007, 41(11): 2271-2300. doi: 10.1016/j.watres.2007.02.030 [14] LOPEZ-VAZQUEZ C M, OEHMEN A, HOOIJMANS C M, et al. Modeling the PAO-GAO competition: Effects of carbon source, pH and temperature[J]. Water Research, 2009, 43(2): 450-462. doi: 10.1016/j.watres.2008.10.032 [15] 彭党聪, 张晓霞, 樊香妮, 等. 温度对SBR强化生物除磷工艺除磷性能的影响[J]. 环境工程学报, 2016, 10(11): 6106-6110. doi: 10.12030/j.cjee.201506073 [16] SMOLDERS G J F, MEIJ J, LOOSDRECHT M C M, et al. Model of the anaerobic metabolism of the biological phosphorus removal process: Stoichiometry and pH influence[J]. Biotechnology and Bioengineering, 1994, 43(6): 461-470. doi: 10.1002/bit.260430605 [17] 国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002. [18] OEHMEN A, KELLER-LEHMANN B, ZENG R J, et al. Optimisation of poly-β-hydroxyalkanoate analysis using gas chromatography for enhanced biological phosphorus removal systems[J]. Journal of Chromatography A, 2005, 1070(1/2): 131-136. doi: 10.1016/j.chroma.2005.02.020 [19] JENKINS D, RICHARD M G, DIGGER G T. Manual on the cause and control of activated sludge bulking and foaming[M]. Third. Florida: CRC Press, 2004. [20] JIANG G M, SHARMA K R, GUISASOLA A, et al. Sulfur transformation in rising main sewers receiving nitrate dosage[J]. Water Research, 2009, 43(17): 4430-4440. doi: 10.1016/j.watres.2009.07.001 [21] SAITO T, BRDJANOVIC D, LOOSDRECHT M C M. Effect of nitrite on phosphate uptake by phosphate accumulating organisms[J]. Water Research, 2004, 38(17): 3760-3768. doi: 10.1016/j.watres.2004.05.023 [22] GUO G, WU D, HAO T, et al. Denitrifying sulfur conversion-associated EBPR: The effect of pH on anaerobic metabolism and performance[J]. Water Research, 2017, 123: 687-695. doi: 10.1016/j.watres.2017.07.020 [23] WU D, EKAMA G A, LU H, et al. A new biological phosphorus removal process in association with sulfur cycle[J]. Water Research, 2013, 47(9): 3057-3069. doi: 10.1016/j.watres.2013.03.009 [24] CARVALHO G, LEMOS P C, OEHMEN A, et al. Denitrifying phosphorus removal: Linking the process performance with the microbial community structure[J]. Water Research, 2007, 41(19): 4383-4396. doi: 10.1016/j.watres.2007.06.065 [25] ZENG R J, YUAN Z G, KELLER J. Enrichment of denitrifying glycogen-accumulating organisms in anaerobic/anoxic activated sludge system[J]. Biotechnology and Bioengineering, 2003, 81(4): 397-404. doi: 10.1002/bit.10484 [26] ZENG R J, LOOSDRECHT M C M, YUAN Z G, et al. Metabolic model for glycogen-accumulating organisms in anaerobic/aerobic activated sludge systems[J]. Biotechnology and Bioengineering, 2003, 81(1): 92-105. doi: 10.1002/bit.10455 -



 下载:
下载: