-
喹诺酮类抗生素 (fluoroquinolones,FQs) 作为目前使用最广泛的一类人畜通用药物,因其具有抗菌力强、抗菌谱广、降解快、毒副作用低、价格低廉和安全性高等特性[1],被长期应用于畜牧业和水产养殖业中[2-5]。有研究表明,FQs在人体内或者动物体内约有70%~80%不能被完全地吸收或代谢,而是以原药或代谢体的形式排泄到体外[6],最终通过河流输入和地表径流等面源污染途径进入海洋环境[7],FQs对微生物进行持续选择,导致细菌迅速进化,产生抗生素抗性菌 (antibioticresistant bacteria,ARB) ,从而诱导动物以及微生物体内产生抗生素抗性基因 (Antibiotics resistance genes,ARGs) 。这可能改变海洋生态系统的群落结构,阻止海洋生态系统物质循环与稳定,导致物种多样性降低,威胁生物生存[8],同时对生态环境的稳定和人类生存也存在潜在危害[9]。在了解抗生素在海洋环境中的行为及其对海洋的影响的过程中,抗生素的检测分析是关键[10]。由于海水基质复杂,因而需要对海水进行前处理,以减少环境中的机制干扰,富集更多目标物。目前使用最多的检测分析方法为具有高选择性和高灵敏度的液相色谱串联质谱 (HLP-MS/MS) 法,而样品前处理过程海水的pH值、上样流速、针式滤膜填充料以及洗脱剂的用量均会直接影响目标物的富集,从而影响仪器的灵敏度和稳定性,最终导致分析结果与环境中的浓度相差较大,因此,海水中喹诺酮类抗生素提取前处理方法的建立及优化尤为重要。
1990年,已有关于液相微萃取技术前处理方法的报道[11],但由于分子结构、大小、物理化学性质及药物浓度的巨大差异,该方法很难满足多种抗生素的分析。之后也有研究者[12-13]对FQs进行了前处理条件的优化,包括pH、不同种类的固相萃取柱等的条件优化,这些方法均为单因素分析,没有考虑到多因素共同作用的影响。目前,关于海水中喹诺酮类抗生素检测前处理方法优化鲜有报道。
本研究采用正交实验设计,从优化待测样品的pH值、全自动固相萃取过柱流速、洗脱剂甲醇的用量和针式滤膜过滤器填充料的前处理条件等方面,比较海水中19种喹诺酮类抗生素在不同条件下的回收率并对喹诺酮类抗生素检测前处理方法进行优化筛选,利用优化的前处理方法测定文昌冯家湾12个不同采样点的FQs结果并分析其分布特征,为海洋环境中喹诺酮类抗生素的精准检测提供技术支撑,也为海水养殖中抗生素的使用和管控提供科学依据。
-
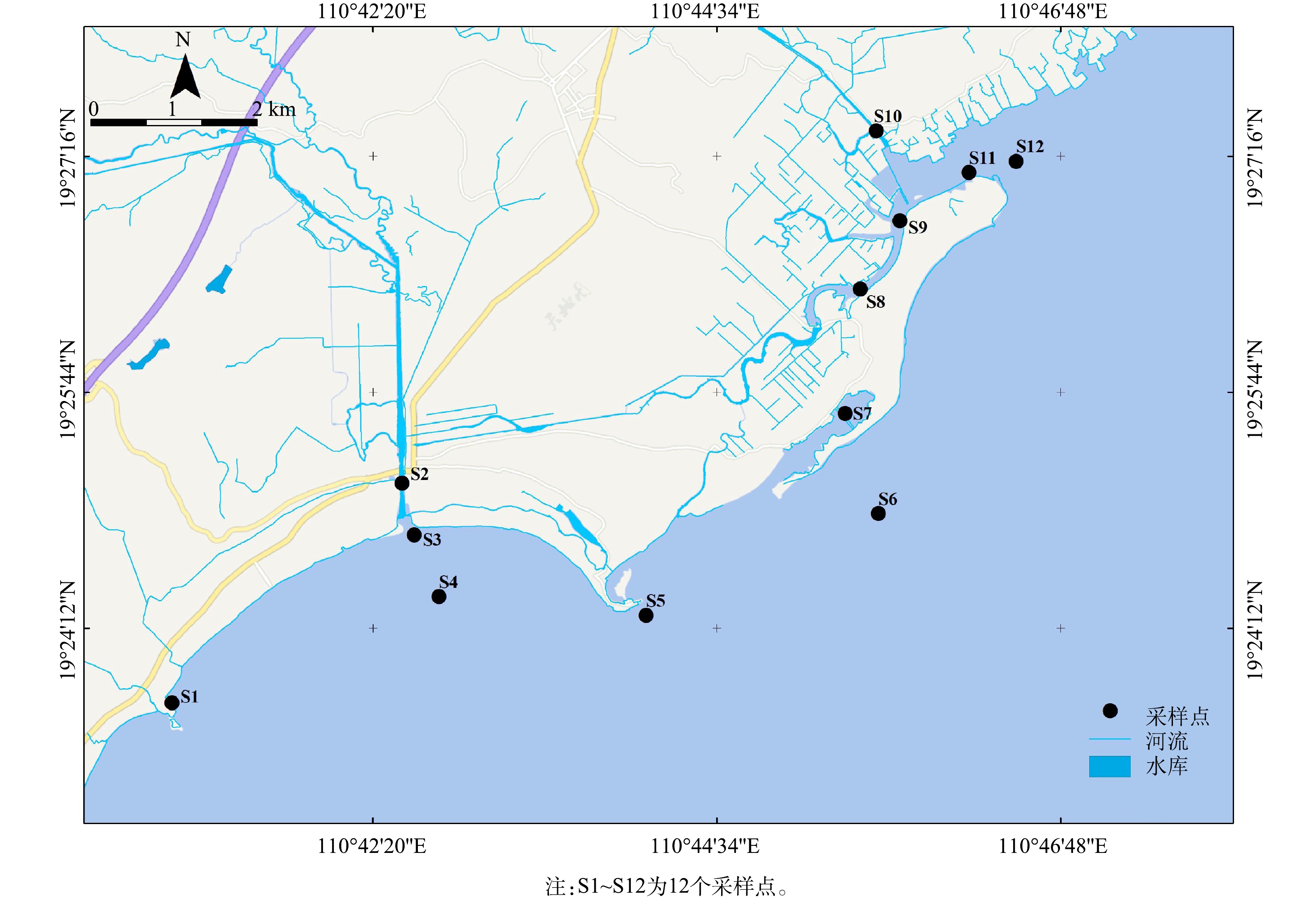
文昌冯家湾位于海南东部沿海,长度为15 km左右,宽度为1~4 km;文昌冯家湾作为海南省重要的养殖区,周边分布着会文镇最主要的东风螺养殖以及虾苗养殖基地,虾苗产值曾占到海南产值70%以上,约占全国的30%。经过数十年的发展,冯家湾海水养殖产业逐渐形成规模,主要繁育养殖石斑鱼、东风螺等,也养殖南美白对虾,并以工厂化养殖和池塘养殖为主,养殖户数量达千家,养殖水面超万亩,养殖户将长长的抽水管道伸到大海中央,把海底的海水抽取到家中养殖池,再用长长的排水管道,把废水送回大海。本研究按照生态环境部发布的《污水监测技术规范》[14]进行水样采集,于2021年4月采集文昌冯家湾近岸海域的表层水样,共计12个,采样点位置见表1和图1。采集水样分装于棕色瓶中并放置于4 ℃保温箱中,避光冷藏保存。
-
喹诺酮类抗生素内外标 (由北京曼哈格生物科技有限公司提供) ,乙二胺四乙酸二钠 (Na2EDTA) (分析纯,广州化学试剂) ,甲酸 (色谱纯,ROESCINTIFICINC) ,甲醇 (色谱纯,Honeywell,上海霍尼韦尔贸易有限公司) ,乙腈 (色谱纯,赛默飞世尔科技中国上海有限公司,ThermoFisher) 。亲水亲油固相萃取Oasis HLB柱 (沃特德福Waters,英国) ,液相色谱仪-三重四极杆串联质谱仪 (AB SCIEX Triple Quad6500+,美国) ,全自动固相萃取仪 (盛康 E9000,中国) 。
-
本研究采用外标法对所测19种抗生素 (奥比沙星、吡哌酸、达氟沙星、恶喹酸、恩诺沙星、氟甲喹、氟罗沙星、环丙沙星、洛美沙星、萘啶酸、麻保沙星、诺氟沙星、培氟沙星、沙拉沙星、双氟沙星、司帕沙星 、西诺沙星 、氧氟沙星、依诺沙星) 进行定量分析,使用标准品母液 (100 mg·L−1) 用甲醇稀释至1 000 μg·L−1的储存液,再用储存液分别稀释为1、2、5、10、20、50、100 μg·L−1的混合工作液,用以制作标准曲线。
海水样品采用直径50 mm、孔径0.45 μm的微孔过滤膜除去水中杂质,将过膜后的海水 (1 L) 用棕色瓶避光保存于4 ℃冰箱中。剩余未处理的水样放于4 ℃冰箱遮光保存,待用。在过滤后的水样中加入0.25 g·L−1 Na2EDTA,用于保护抗生素,防止其与金属离子发生反应;用盐酸或氨水,调节过滤后水样的pH值 (表2) ;每个样品中加入50 ng的标样,用于测定回收率,每组实验测定3个平行样。用20 mL的甲醇和6 mL纯水淋洗活化HLB柱;按设定的速率进行过滤 (表2) ,样品过滤完后真空氮吹干燥HLB柱 (55 min) ,之后用甲醇进行洗脱。洗脱后,使用氮吹仪进行干燥,之后使用甲醇定容至1 mL。使用不同材料的针式过滤膜过滤,针式滤膜填充料名称见表2,转移至棕色进样瓶中,保存于 −20 ℃,待上机检测,在上机前,将进样小瓶涡旋混匀。为防止抗生素的分解,全程避光操作,正交实验条件见表2。
-
色谱柱为00B-4723-Y0(LC Column 50 mm×3.0 mm,2.6 μm),进样量为10 μL,柱温为40 ℃,流速为0.40 mL·min−1。流动相A为0.1%甲酸水溶液;流动相B为0.1%甲酸-乙腈溶液。梯度洗脱程序为: 起始1 min内使用3%流动相B,然后在13.5 min内从3% 流动相B线性变化至95%流动相 B。质谱离子源为电喷雾离子源,采用正离子模式采集,检测方式为多反应离子扫描模式。
按照朱正锋等[15]的海水配比方案配制海水,在1 L水中加入50 ng的FQs标准品,每个实验组重复3次,使用空白加标回收的方法计算回收率 (式 (1) ) 。
式中:η为回收率;C为回收到的抗生素浓度;m为加入到1 L水样中的FQs标准品的质量,m取50 ng。
-
根据正交实验得出最适的前处理条件,利用该最适前处理条件对海水水样进行前处理,然后采用液相色谱串联质谱 (HLP-MS/MS) 法对前处理后的水样进行检测,同时与文献中的前处理条件[16-17]所测FQs质量浓度进行对比,以验证正交实验后较优方法的可行性。
-
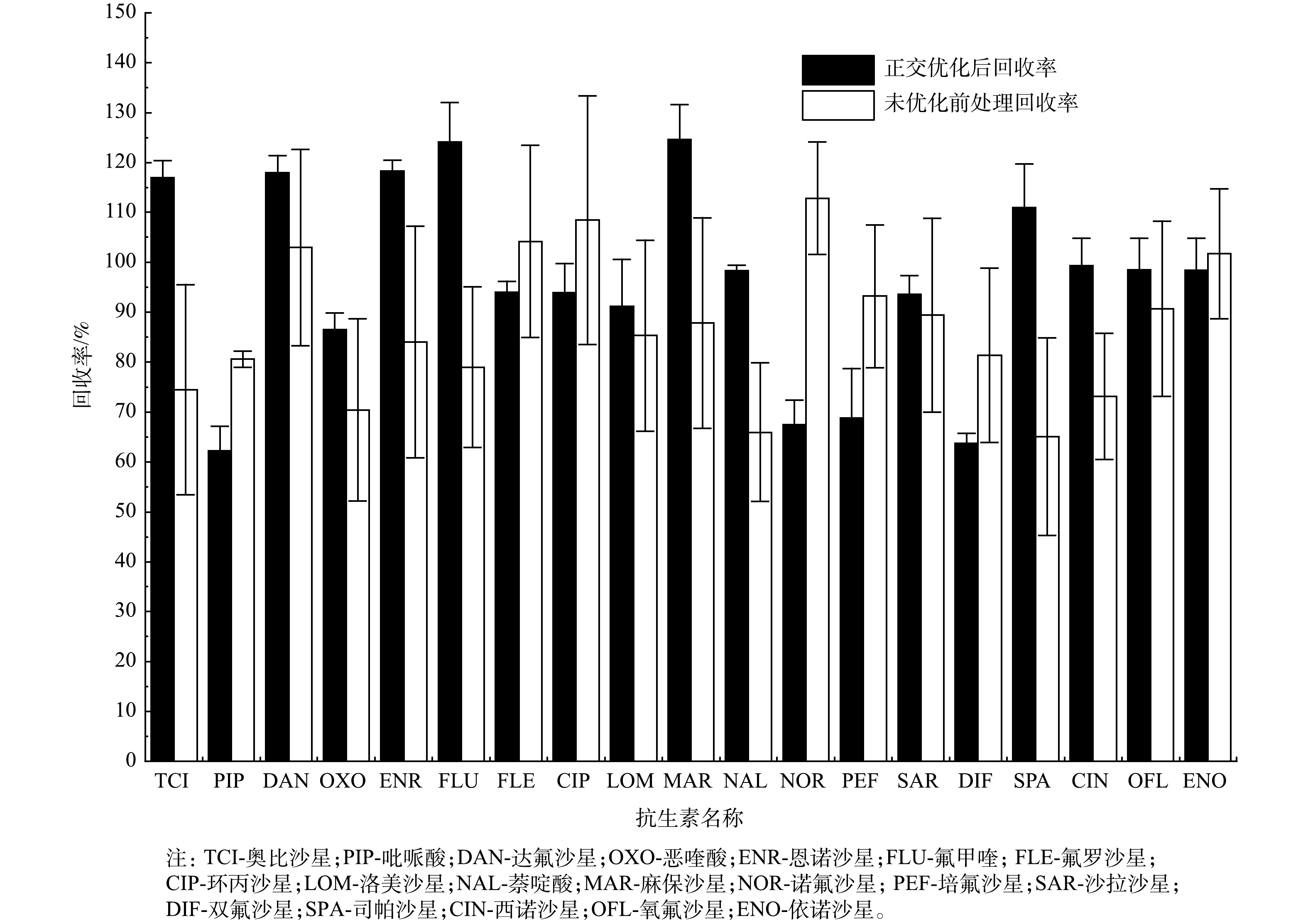
不同的前处理方法对抗生素的回收率有一定的影响,在水样前处理过程中样品pH、过柱流速的大小、洗脱剂用量的不同以及针式滤膜的材质均会对回收率造成影响。按照《实验室质量控制规范》 (GB/T 27404-2008) 中的要求,抗生素回收率为60%~120%。正交实实验结果见表3和表4。可以看出:在实验编号3、编号4、编号7、编号8、编号9、编号10、编号11、编号12、编号13及编号15中,均出现喹诺酮类抗生素的回收率低于60%的情况,实验编号1、编号2、编号5、编号6及编号14均出现超过7种喹诺酮类抗生素的回收率>120%的情况;在16组实验中,实验编号16的结果与最佳回收率范围相当,平均回收率为62.31%~124.60%,相对标准偏差为1.15%~9.90%。在实验编号16中,有14种FQs回收率>90%,有12种FQs的回收率为90%~120%,有8种FQs的回收率为90%~100%。出现这种情况的原因可能是4种条件共同作用的结果。
水样pH值可以改变目标物/吸附剂的离子化或质子化程度,从而影响回收率[18]。有研究[6]表明,pH为2~6时,pH=2的喹诺酮类抗生素回收率最好,为71.3%~87.2%,而随着pH值的升高,回收率反而下降,但未对碱性条件进行研究创作;也有研究[19]表明,当pH值超过7时,喹诺酮类抗生素的回收率上升,这可能与喹诺酮的pka值有关。而本研究的最适pH值为10,与pH=2的研究结果有一定的差别。这可能是正交实验过程中4种影响因子共同作用导致抗生素的损耗,并非单因素造成的;还可能与碱性条件下静电作用力中的阳离子作用力与喹诺酮类抗生素作用的吸附剂萃取效果最理想有关[20]。也有研究者[21]通过调节pH至11,采用液相色谱-荧光法测定对水中5种(NOR、FLE、CIP、ENR、SAR)FQs回收率进行测定,FQs回收率为84.8%~114%。此结果与本研究结果相比,除了NOR回收率较高外,其他4种FQs回收率均比正交实验低,说明正交实验优化后的前处理方法更适用于同时测定海水中多种FQs的情况。
在利用HLB柱富集目标化合物时,过柱流速是SPE条件的一个重要参数,同时也是一个重要的优化参数。一般来说,过柱流速越慢,回收率越高,但样品预处理时间相对较长;如果过柱流速过快,目标化合物在HLB柱上的吸附往往不充分,会导致回收率偏低[6]。此外,洗脱剂用量不同时,会对HLB柱上富集的目标化合物洗脱效果有一定的影响,洗脱剂用量少,可能导致洗脱不充分而降低样品的回收率;对于过柱流速以及洗脱剂用量而言,本研究的最优上样流速及洗脱剂用量与已有研究[20]基本一致,在将定容后的样品转移至进样小瓶时,针式滤膜的填充料对目标化合物的过滤也有一定的影响,不同的填充料对目标物的吸附效果也不同,有关针式滤膜过滤器填充料对抗生素回收率的影响鲜有报道。本研究对4种条件进行正交实验,得出的较优FQs前处理方法条件如下:pH调节至10,上样流速为10 mL·min−1,洗脱剂用量为8 mL,针式滤膜过滤器填充料为MCE。
-
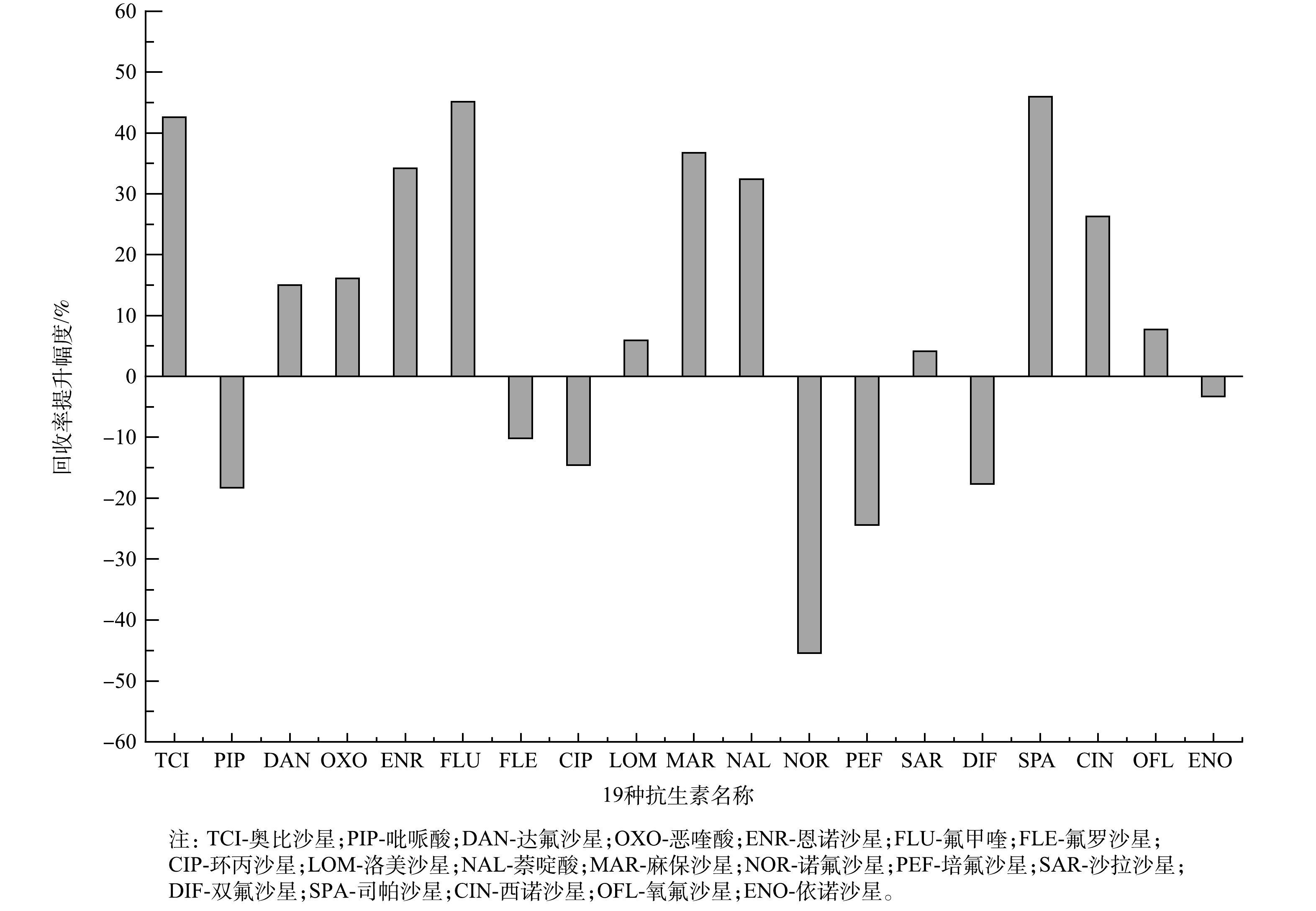
回收率的结果会直接影响到后续LC-MS/MS检测的结果。优化后与未优化的前处理方法的回收率比较结果见图2和图3。由图2可以看出,正交实验优化条件后的FQs回收率为62.31%~124.60%,相对标准偏差为1.15%~9.90%;未优化前处理的回收率为65.07%~112.83%,相对标准偏差为1.60%-24.88%;在优化后的19种抗生素中,有14种FQs抗生素回收率达到90%以上,而未优化前处理条件下只有7种FQs达到90%以上。由图3可看出,在优化前处理后,12种FQs回收率有提高,其中有3种FQs回收率提高了40%以上,有7种FQs回收率提高了20%以上,但是也有7种FQs较未优化前处理回收率低。这可能与FQs是一类人工合成的4-喹诺酮母核的化学合成抗菌药具有2个pKa有关,即pKa1=5.5~6.5 (—COOH),pKa2=7.8~10 (—RNH)[22],且这7种FQs的pKa属于5.5~6.5 (—COOH) 。针对2种前处理方法进行分析,可以看出7种FQs在2种条件下的回收率均达到60%~120%,相比而言,优化后的前处理方法更适用于海水中的19种FQs的前处理。
-
为了验证本研究建立的前处理方法,根据前处理正交实验结果筛选出较优条件,测定喹诺酮类抗生素的残留情况。按照优化后前处理方法,调节采集后的样品pH值至10±0.05,低温避光保存,送往实验室进行前处理;同时与未优化前处理条件[15-16]下所测FQs回收率、各抗生素质量浓度以及总质量浓度进行对比。
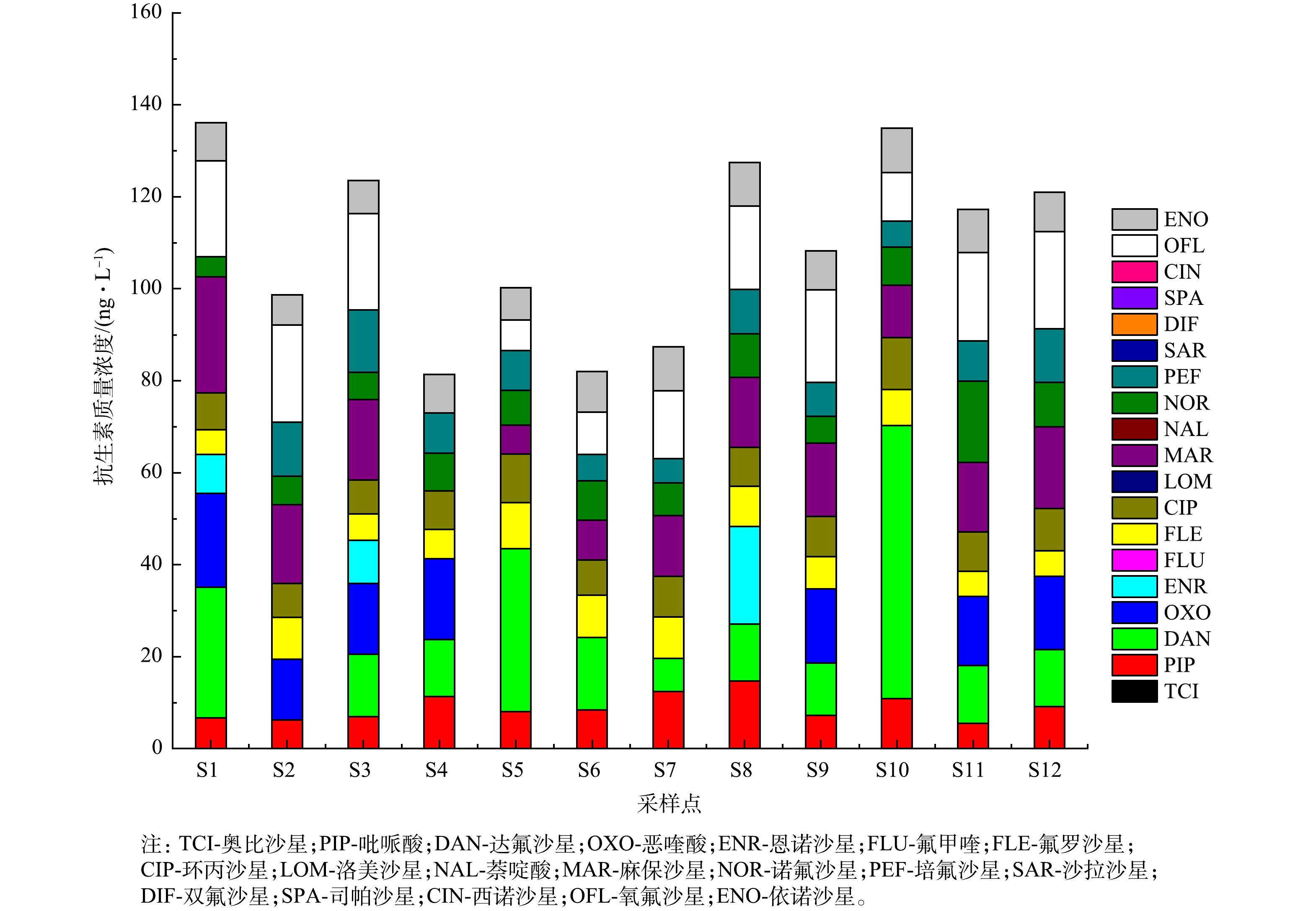
1) 冯家湾海水中喹诺酮类抗生素检出结果。采用优化后的前处理方法对冯家湾12个采样点中19种FQs进行检测,结果见图4。在12个采样点中,共检出11种FQs,位于采样点S1和S3。PIP、CIP、FLE、PEF、NOR、ENO在12个采样点中均有检出。FQs作为广谱抗生素,对抗菌均有明显的作用,PIP、FLE、CIP、NOR、PEF、ENO等主要用于治疗敏感菌所导致的各种感染和细胞内病原体感染,因此,这类药物被广泛用于水产养殖中杀菌消毒[15]。此外,在《无公害食品 水产中渔用药物使用准则》中,CIP被列为禁用药[23],但是在冯家湾近岸养殖区12个采样点均检出CIP,虽然CIP已经被禁止使用,但是可能以前使用量太大,导致海水中还残留有该抗生素,或者是当地居民生活废水中残留的CIP进入海水中。DAN除了在采样点S2未检出外,在其他采样点均被检出;MAR、OFL除了在采样点S4未检出外,其他采样点均被检出;ENR只在采样点S1、S3、S8被检出;OXO在采样点S5、S6、S7、S8、S10未检出,在其他采样点均被检出。在所有检出的FQs中,采样点S10中的DAN质量浓度最高,达59.39 ng·L−1,其他FQs的质量浓度为4~30 ng·L−1,且绝大多数FQs质量浓度低于10 ng·L−1。在不同的采样点检测出不同的抗生素,这可能与当地的养殖情况以及养殖物种发病情况有一定的关系,也可能是各采样断面抗生素的使用情况、地理特性、水文特性和理化物质[23-24]等有所不同导致的。采样点S10中的DAN质量浓度最高,可能是采样点S10靠近红树林,红树林附近树荫导致光照强度较弱、海水温度较其他地方低,从而不利于DNA的降解[25-26],进而导致DAN浓度偏高。
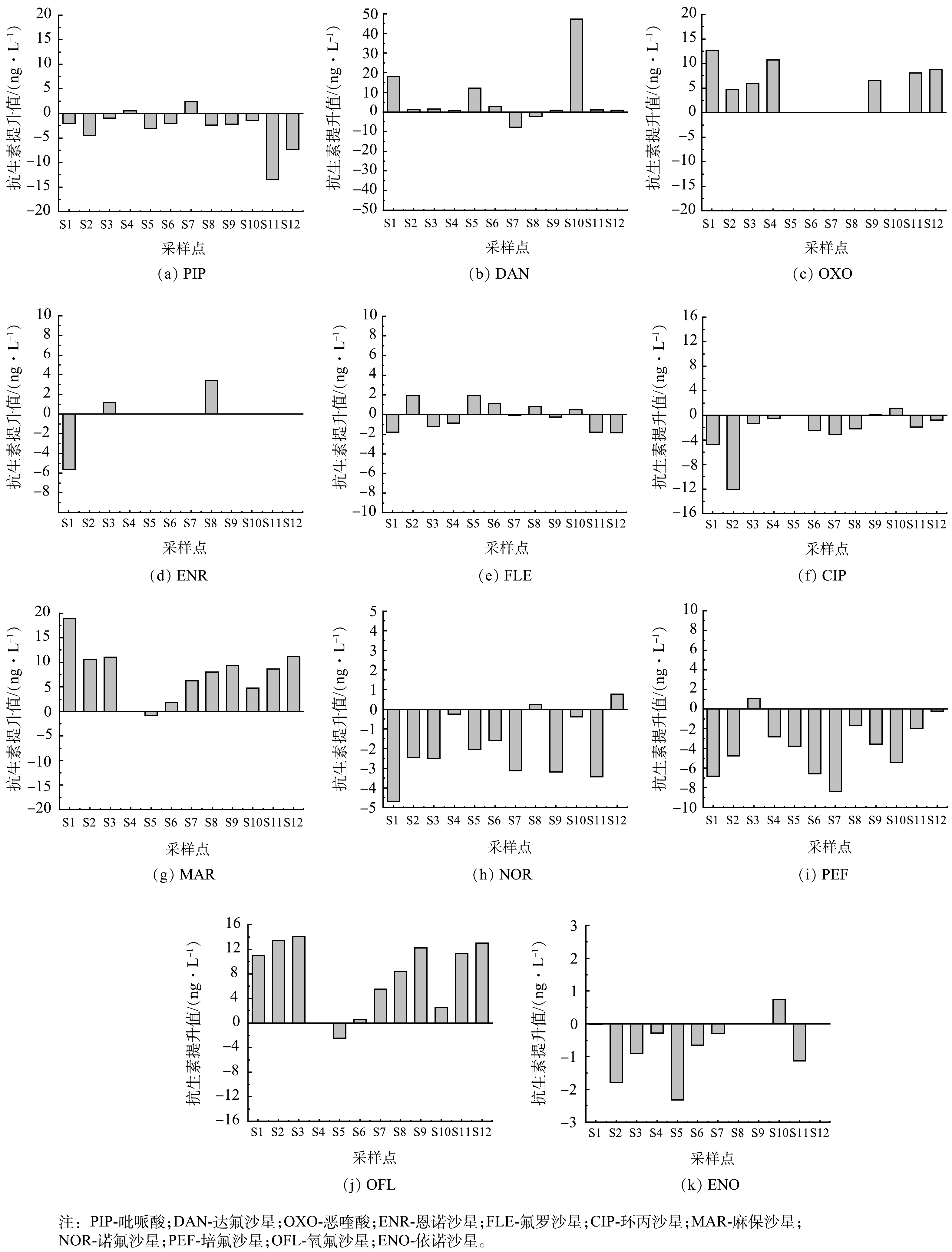
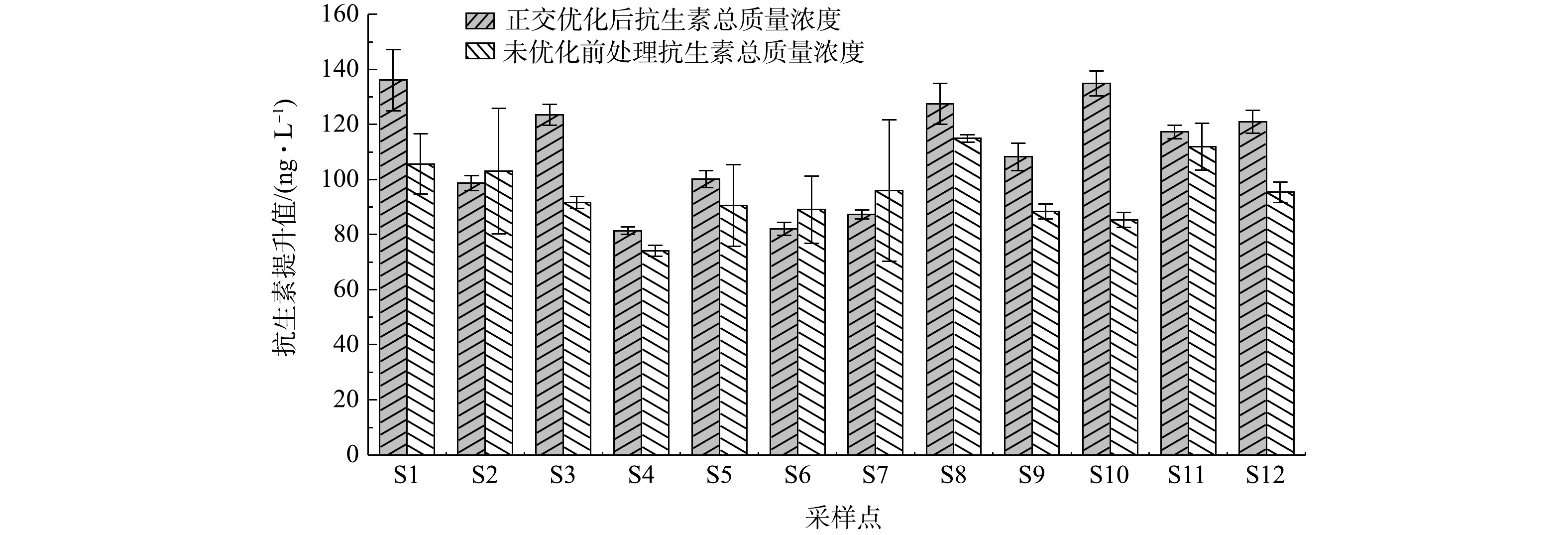
2) 不同前处理方法测定冯家湾养殖废水的浓度比较。对比2种不同的前处理方法结果可以看出,在2种前处理条件下,所测抗生素质量浓度存在一定的差异。由图5可以看出,DAN、OXO、ENR、MAR和OFL在优化前处理条件后所测质量浓度明显高于未优化前处理条件下所测得质量浓度,这可能是水样pH值的改变导致这几种抗生素的富集效果不同。在pH=10时,更有利于富集DAN、OXO、ENR、MAR和OFL5种抗生素,但在这些抗生素中,PIP、CIP、FLE、NOR、PEF以及ENO质量浓度有所下降。这可能与抗生素理化性质以及稳定性有关,同时也与抗生素降解及抗生素质量浓度较低有关,这些综合因素导致抗生素质量浓度下降。如图6所示,正交实验优化条件后冯家湾各采样点19种FQs总质量浓度为81.31~136.07 ng·L−1,而未优化前处理条件下所测总质量浓度为74.02~114.89 ng·L−1,通过正交实验改变前处理条件后,FQs总质量浓度有所提高。在采样点S2、S6、S7中,正交优化后抗生素总质量浓度比未优化前处理条件下所测总质量浓度低,而PIP、FLE、CIP、NOR、PEF、ENO在正交优化条件下比未优化前处理条件下浓度低,从而导致抗生素总浓度下降。这与回收率存在一定的关系,但这几种抗生素在2种前处理条件下所测浓度相差不大。因此,优化后前处理方法更适用于海水中多种FQs前处理。
-
1) 通过优化喹诺酮类抗生素前处理方法,建立了一种准确测定海水中19种FQs的HLP-MS/MS检测前处理方法。此方法的条件如下:pH调为10,上样流速为10 mL·min−1,洗脱剂用量为8 mL,针式滤膜过滤器填充料为MCE。此方法测定19种FQs的平均回收率为62.31%~124.60%,相对标准偏差为1.15%~9.90%,可满足19种FQs的分析要求,适用于FQs前处理。
2) 在正交优化前处理后的19种FQs中,有14种FQs回收率达90%以上,未优化前处理条件下有7种FQs回收率达90%以上,正交优化筛选后的前处理更有利于富集海水中的FQs。
3) 采用优化后的前处理方法对冯家湾12个采样点中19种FQs进行检测,共检出11种FQs,位于采样点S1、S3。PIP、CIP、FLE、PEF、NOR、ENO在12个采样点中均被检出。海南文昌冯家湾FQs总质量浓度分析结果表明,正交实验优化条件后所测19种FQs质量浓度为81.31~136.07 ng·L−1,而未优化前处理条件下所测质量浓度为74.02~114.89 ng·L−1。由此可以看出,正交优化前处理条件后可更准确测定出海水中多种FQs的质量浓度。
海水中喹诺酮类抗生素液质联用测定前处理方法的优化
Optimization of pre-treatment method for liquid-mass spectrometry of quinolone antibiotics in seawater
-
摘要: 为快速建立海水中喹诺酮类抗生素(fluoroquinolones,FQs)检测前处理方法,准确地检测海南文昌冯家湾FQs的质量浓度,采用正交实验对海水中FQs前处理过程进行分析并与未优化前处理方法的回收率进行对比,同时对文昌冯家湾近岸养殖区海水中的FQs进行检测。结果表明:pH=10、上样流速为10 mL·min−1、洗脱剂用量为8 mL、针式滤膜过滤器填充料使用MCE是正交实验后最优前处理条件;正交实验优化后,FQs回收率为62.31%~124.60%,相对标准偏差为1.15%~9.90%,未优化前处理条件FQs回收率为65.07%~112.83%,相对标准偏差为1.60%~24.88%;2种方法在冯家湾均检测出11种FQs,有6种FQs在12个采样点中均有检出,前处理方法优化后所测冯家湾FQs总质量浓度为81.31~136.07 ng·L−1,未优化前处理条件所测冯家湾FQs总质量浓度为74.02~114.89 ng·L−1。通过比较2种前处理方法,发现正交实验优化后的前处理方法能够更准确检测出FQs在海水中的质量浓度,可适用于海水中19种FQs的测定。以上研究结果可为精准检测海洋环境中FQs打下基础,也可为冯家湾FQs的管控提供科学依据。Abstract: In order to quickly establish a pretreatment method for fluoroquinolones(FQs) detection in seawater and accurately test the mass concentration of FQs in Fengjiawan, Wenchang, Hainan. The orthogonal experiments were conducted to analyze the pretreatment process of FQs in seawater and compare it with the recovery of the unoptimized pretreatment method, and the FQs in seawater from the nearshore culture area of Fengjiawan, Wenchang were also tested. The results showed that the optimal pretreatment conditions determined by the orthogonal experiment were following: pH=10, the loading flow rate of 10 mL·min−1, the amount of eluent of 8 mL, and the use of MCE as the filler of the needle membrane filter. After the optimization of the orthogonal experiment, the recovery of FQs was 62.31%~124.60% with the relative standard deviations of 1.15%~9.90%, and the recovery of FQs without the optimized pretreatment conditions was 65.07%~112.83% with the relative standard deviations of 1.60%~24.88%; 11 kinds of FQs were detected in Fengjiawan by both methods, 6 kinds of FQs were detected in 12 sampling points, the total mass concentrations of FQs measured in Fengjiawan after optimization of the pretreatment method were 81.31~136.07 ng·L−1, the total mass concentrations of FQs measured in Fengjiawan without optimization of the pretreatment condition were 74.02~74.02 ng·L−1. By comparing the two pretreatment methods, it was found that the optimized pretreatment method after orthogonal experiment could detect the mass concentration of FQs in seawater more accurately and could be feasible for the determination of 19 kinds of FQs in seawater. The above results can lay the foundation for accurate FQs detection in the marine environment, and also provide a scientific basis for the control of FQs in Fengjiawan.
-

-
表 1 采样点信息
Table 1. Sampling point information
采样区域 采样点编号 采样点位置 纬度 经度 文昌新村港 S1 废水排放河流入海口 19°23′42.98"N 110°41′1.74"E 文昌新村港 S2 渔船停泊与农业废水排放处 19°25′8.56"N 110°42′31.4"E 文昌新村港 S3 入海口处 19°24′48.41"N 110°42′36.13"E 文昌新村港 S4 外海海湾 19°24′24.29"N 110°42′45.78"E 文昌边海村管理区 S5 灯塔 (养殖污水排放处) 19°24′16.97"N 110°44′6.43"E 外海 S6 自然保护区外海 19°24′56.66"N 110°45′36.99"E 外海 S7 废弃养殖塘附近 19°25′35.71"N 110°45′23.98"E 文昌长歧河 S8 养殖排放口密集处 19°26′24.24"N 110°45′29.93"E 文昌长歧河 S9 网箱养殖区 19°26′50.79"N 110°45′45.29"E 文昌长记港 S10 渔船停泊处 19°27′25.88"N 110°45′36.09"E 文昌长记港 S11 入海口处 19°27′9.6"N 110°46′12.28"E 文昌长记港 S12 外海养殖区 19°27′14.01"N 110°46′30.69"E 表 2 抗生素检测前处理正交实验设计
Table 2. Design of orthogonal experiments for pretreatment of antibiotic test
正交实验编号 pH值(A) 上样流速(B) 针是滤膜填充料 (C) 洗脱剂用量(D) 数值 水平 数值/(mL·min−1) 水平 名称 水平 数值/mL 水平 1 8 1 4 1 MCE 1 4 1 2 8 1 6 2 尼龙 2 6 2 3 8 1 8 3 PTFE 3 8 3 4 8 1 10 4 PVDF 4 10 4 5 3 2 4 1 尼龙 2 8 3 6 3 2 6 2 MCE 1 10 4 7 3 2 8 3 PVDF 4 4 1 8 3 2 10 4 PTFE 3 6 2 9 7 3 4 1 PTFE 3 10 4 10 7 3 6 2 PVDF 4 8 3 11 7 3 8 3 MCE 1 6 2 12 7 3 10 4 尼龙 2 4 1 13 10 4 4 1 PVDF 4 6 2 14 10 4 6 2 PTFE 3 4 1 15 10 4 8 3 尼龙 2 10 4 16 10 4 10 4 MCE 1 8 3 注: MCE为混合纤维素酯,PTFE为聚四氟乙烯,PVDF为聚偏二氟乙烯。 表 3 TCI、PIP、DAN、OXO、ENR、FLU、FLE、CIP、LOM、MAR 10种抗生素回收率正交实验结果
Table 3. Results of orthogonal experiments for the recovery of 10 antibiotics: TCI, PIP, DAN, OXO, ENR, FLU, FLE, CIP, LOM and MAR
实验
编号pH(A) 上样流
速(B)针式滤膜
填充料(C)洗脱剂
用量(D)回收率/% TCI PIP DAN OXO ENR FLU FLE CIP LOM MAR 1 1 1 1 1 147.22 144.2 70.51 123.39 127.61 152.18 128.12 126.07 118.89 117.61 2 1 2 2 2 112.51 155.24 87.98 154.65 111.76 125.53 152.76 124.87 105.71 106.12 3 1 3 3 3 91.67 91.13 22.61 155.95 35.49 161.17 69.13 50.45 45.16 44.55 4 1 4 4 4 124.91 166.09 94.53 90.64 116.81 116.85 155.6 133.3 111.08 108.59 5 2 1 2 3 126.59 181.47 115.25 168.87 132.99 155 125.82 146.99 121.05 125.74 6 2 2 1 4 106.02 179.24 94.35 75.21 129.1 116.02 151.13 163.83 104.75 112.39 7 2 3 4 1 56.6 89.00 62.77 56.5 72.14 47.05 86.71 79.49 60.51 66.31 8 2 4 3 2 139.34 117.65 63.52 169.63 112.86 129.28 131.37 127.81 126.56 96.84 9 3 1 3 4 37.25 51.19 89.38 76.34 27.33 63.71 50.85 30.21 63.94 108.49 10 3 2 4 3 81.13 39 56.79 75.64 88.85 102.54 105.93 46.55 72.8 75.08 11 3 3 1 2 96.45 31.37 63.22 87.16 86.88 122.07 112.74 42.82 82.81 81.11 12 3 4 2 1 40.59 13.93 20.18 31.21 52.57 71.68 64.17 44.92 45.91 13.88 13 4 1 4 2 86.89 129.97 62.67 103 89.93 76.01 129.83 107.79 90.43 95.61 14 4 2 3 1 123.95 123.99 70.09 141.77 113.17 160.52 142.55 105.39 104.83 102.07 15 4 3 2 4 77.03 101.4 55.49 88.35 68.44 115.35 113.69 80.57 78.71 77.53 16 4 4 1 3 117.01 62.31 117.95 86.53 118.27 124.15 93.98 93.88 91.23 124.6 K1 8 066.28 7 836.1 7 228.41 6 525.73 K2 8241.34 8 076.91 7 745.29 7 637.62 K3 4968.75 5 548.23 7 082.94 7 101.66 K4 7261.28 7 076.4 6 481.01 7 272.63 ${\overline K}_1 $ 106.14 103.11 95.11 85.86 ${\overline K}_2 $ 108.44 106.28 101.91 100.5 ${\overline K}_3 $ 65.38 73 93.2 93.44 ${\overline K}_4 $ 95.54 93.11 85.28 95.69 R 43.06 33.27 16.64 14.63 表 4 NAL、NOR、PEF、SAR、DIF、SPA、CIN、OFL、ENO 9种抗生素回收率正交实验结果
Table 4. Results of orthogonal experiments for the recovery of 9 antibiotics: NAL, NOR, PEF, SAR, DIF, SPA, CIN, OFL and ENO
实验
编号pH(A) 上样流
速(B)针式滤膜
填充料(C)洗脱剂
用量(D)回收率/% NAL NOR PEF SAR DIF SPA CIN OFL ENO 1 1 1 1 1 158.22 129.01 64.16 99.37 143.94 95.27 135.69 117.7 126.33 2 1 2 2 2 133.71 123.96 80.41 91.01 107.81 68.46 132.71 111.98 116.09 3 1 3 3 3 118.99 58.32 27.65 40.6 54.57 31.89 157.68 36.49 51.31 4 1 4 4 4 42.93 135.62 82.53 106.45 115.68 76.15 168.42 118.19 128.37 5 2 1 2 3 133.08 147.06 95.66 105.89 126.45 72.34 170.35 136.7 142.29 6 2 2 1 4 100.44 150.39 68.43 127.37 139.03 72.43 124.55 116.66 138.68 7 2 3 4 1 20.17 74.98 52.37 64.32 67.01 38.05 56.36 70.23 70.43 8 2 4 3 2 120.98 116.65 49.17 127.69 150.28 123.01 133.84 100.38 113.87 9 3 1 3 4 58.23 63.25 75.46 110.11 122.93 46.89 85.95 53.19 67.37 10 3 2 4 3 37.11 56.18 50.93 79.67 92.2 46.79 110.65 78.09 102.31 11 3 3 1 2 55.41 57.25 55.56 83.59 100.07 70.02 74.02 79.95 102.09 12 3 4 2 1 30.17 16.35 20.62 58.57 88.4 50.13 50.51 33.73 56.36 13 4 1 4 2 27.43 111.83 60.68 70.32 75.47 37.57 143.01 95 105.56 14 4 2 3 1 135.15 108.71 63.35 81.21 116.87 83.37 221.24 106.23 100.93 15 4 3 2 4 98.63 86.09 49.73 51.09 58.38 32.66 132.16 80.34 82.21 16 4 4 1 3 98.31 67.45 68.84 93.61 63.7 110.99 99.35 98.47 98.43 K1 8 066.28 7 836.1 7 228.41 6 525.73 K2 8 241.34 8 076.91 7 745.29 7 637.62 K3 4 968.75 5 548.23 7 082.94 7 101.66 K4 7 261.28 7 076.4 6 481.01 7 272.63 ${\overline K}_1 $ 106.14 103.11 95.11 85.86 ${\overline K}_2 $ 108.44 106.28 101.91 100.5 ${\overline K}_3 $ 65.38 73 93.2 93.44 ${\overline K}_4 $ 95.54 93.11 85.28 95.69 R 43.06 33.27 16.64 14.63 -
[1] 王岩. 氟喹诺酮类药物左氧氟沙星联合黄连素治疗细菌性痢疾的效果分析[J]. 中国医药指南, 2020, 18(2): 153-154. [2] 杨晓辉. 抗生素在水中的污染及其对环境的危害[J]. 科技信息, 2012(29): 431. doi: 10.3969/j.issn.1001-9960.2012.29.319 [3] 龙泉鑫, 何颖, 谢建平. 喹诺酮类药物作用的生理和遗传的分子机制[J]. 药学学报, 2012, 47(8): 969-977. [4] 谢燕萍. 喹诺酮类药物研究进展[J]. 临床合理用药杂志, 2012, 5(1): 143-146. doi: 10.3969/j.issn.1674-3296.2012.01.123 [5] 张石云, 宋超, 陈家长. 喹诺酮类抗生素在水产养殖中应用的研究进展[J]. 江苏农业科学, 2019, 47(3): 32-36. [6] 丁紫荣, 黎玉清, 王雄, 等. 固相萃取-液相色谱-三重四极杆串联质谱测定养殖废水中17种氟喹诺酮类抗生素[J]. 环境工程学报, 2022, 16(2): 674-683. [7] JIA A, HU J, WU X, et al. Occurrence and source apportionment of sulfonamides and their metabolites in Liaodong Bay and the adjacent Liao River basin, North China[J]. Environmental Toxicology and Chemistry, 2011, 30(6): 1252-1260. doi: 10.1002/etc.508 [8] RYSZ M, ALVAREZ P J. Amplification and attenuation of tetracycline resistance in soil bacteria: Aquifer column experiments[J]. Water Research, 2004, 38(17): 3705-3712. doi: 10.1016/j.watres.2004.06.015 [9] 刘桂英, 葛坤, 王召会, 等. 近岸海域抗生素污染状况的研究进展[J]. 渤海大学学报(自然科学版), 2017, 38(4): 331-336. [10] PRIETO A, SCHRADER S, BAUER C, et al. Synthesis of a molecularly imprinted polymer and its application for microextraction by packed sorbent for the determination of fluoroquinolone related compounds in water[J]. Analytica Chimmica Acta, 2011, 685(2): 146-152. doi: 10.1016/j.aca.2010.11.038 [11] URIARTE D, DOMINI C, GARRIDO M. New carbon dots based on glycerol and urea and its application in the determination of tetracycline in urine samples[J]. Talanta, 2019, 201: 143-148. doi: 10.1016/j.talanta.2019.04.001 [12] LEFEUVRE S, BOIS-MAUBLANC J, HOCQUELOUX L, et al. A simple ultra-high-performance liquid chromatography-high resolution mass spectrometry assay for the simultaneous quantification of 15 antibiotics in plasma[J]. Journal of Chromatography B:Analytical Technologies in the Biomedical and Life Sciences, 2017, 1065-1066: 50-58. doi: 10.1016/j.jchromb.2017.09.014 [13] 叶蕾, 张聪, 徐丽. 液相微萃取技术在药物分析中的应用[J]. 分析科学学报, 2011, 27(5): 665-670. [14] 佚名. 生态环境部发布《污水监测技术规范》等十一项国家环境保护标准[J]. 电力科技与环保, 2020, 36(1): 11. [15] 朱正锋, 齐大鹏, 王军华, 等. 超声波处理对对位芳纶纤维侵蚀性能的影响[J]. 纺织学报, 2012, 33(1): 24-28. [16] 姜春霞, 黎平, 李森楠, 等. 海南东寨港海水和沉积物中抗生素抗性基因污染特征研究[J]. 生态环境学报, 2019, 28(1): 128-135. [17] 曾若菡, 齐钊, 张腾云, 等. 海南东部海水养殖区抗生素残留的生态风险评估[J]. 热带生物学报, 2021, 12(1): 41-48. [18] HERRERA-HERRERA A V, HERNANDEZ-BORGES J, BORGES-MIQUEL T M, et al. Dispersive liquid-liquid microextraction combined with ultra-high performance liquid chromatography for the simultaneous determination of 25 sulfonamide and quinolone antibiotics in water samples[J]. Journal of Pharmaceutical and Biomedical Analysis, 2013, 75: 130-137. doi: 10.1016/j.jpba.2012.11.026 [19] 祁彦洁. 水中抗生素的检测方法与非生物衰减行为研究[D]. 北京: 中国地质大学, 2014. [20] 吕敏, 陈令新. 近海环境中抗生素分析样品前处理技术的研究进展[J]. 色谱, 2020, 38(1): 95-103. [21] 陈文胜, 谭慧嘉, 钟志雄, 等. 固相萃取-液相色谱法测定水中喹诺酮类抗生素[J]. 华南预防医学, 2020, 46(2): 178-182. [22] VOLMER D A, MANSOORI B, LOCKE S J. Study of 4-quinolone antibiotics in biological samples by short-column liquid chromatography coupled with electrospray ionization tandem mass spectrometry[J]. Analytical Chemistry, 1997, 69(20): 4143-4155. doi: 10.1021/ac970425c [23] 陈昌福, 王玉堂. 水产养殖中抗生素类药物使用现状、问题与对策(连载一)[J]. 中国水产, 2015(4): 65-68. [24] LIANG X, CHEN B, NIE X, et al. The distribution and partitioning of common antibiotics in water and sediment of the Pearl River Estuary, South China[J]. Chemosphere, 2013, 92(11): 1410-1416. doi: 10.1016/j.chemosphere.2013.03.044 [25] 张力媛. 喹诺酮类抗生素检测方法的优化及其在水中光解、水解特性研究[D]. 长春: 吉林农业大学, 2016. [26] 彭艳, 丁世敏, 刘蕖, 等. 水环境中抗生素的光化学降解研究进展[J]. 广州化工, 2016, 44(10): 14-17. -



 下载:
下载: