-
高级氧化工艺(advanced oxidation processes, AOPs)通过产生强氧化性的羟基自由基(·OH)、活性氯自由基(RCS,包括Cl·、ClO·等)和超氧自由基(O2·-)等可对水体中药物与个人护理品(pharmaceuticals and personal care products, PPCPs)类污染物进行有效去除[1]。
基于NaClO的AOPs已被广泛地研究并应用于实践[2]。紫外/次氯酸钠(UV/NaClO)工艺对污染物有高效的去除能力,同时在中性、酸性条件下对污染物的降解效果高于其他AOPs[3]。然而,有研究表明,基于NaClO的AOPs由于氯的引入可能产生多种具有“三致”作用的消毒副产物(disinfection by-products, DBPs),如何确保高效去除污染物同时降低DBPs的生成成为了当前UV/NaClO工艺的研究热点[4]。近年来,过碳酸钠(SPC)因相较于液态H2O2具有便于运输、价格便宜的优点已被应用于水处理中[5]。基于紫外的紫外/过碳酸钠(UV/SPC)工艺能产生·OH、O2·-和碳酸根自由基(CO3·-),可有效去除污染物[6-7]。
目前关于传统的UV/NaClO和新兴的UV/SPC工艺单独降解PPCPs的研究有许多报道[3,6],但对2种工艺降解PPCPs的对比研究报道较少,降解过程中2种工艺的效能差异需要进一步研究。水杨酸(salicylic acid, SA)是一种典型的PPCP,一项针对广州地表及地下水的PPCPs调查表明SA存在于所有调查水样中,其质量浓度最高达到2 014.4 μg·L−1[8]。本文以SA为目标物,对比考察了UV/NaClO和UV/SPC 2种工艺对SA的去除,引入协同因子(R),考察了氧化剂投加量、pH、阴离子(NO3−、HCO3−)和腐殖酸(HA)等因素对SA去除的影响,通过分析SA的密度泛函理论(DFT)且结合LC-MS与GC-MS的鉴定产物,进一步分析可能的降解路径,采用ECOSAR程序对产物进行了毒性模拟,以期为去除水中PPCPs的不同工艺选择提供参考。
-
水杨酸(SA,纯度>99.9%,德国Dr.Ehrenstorfer);过碳酸钠(SPC,CP);五水硫代硫酸钠(Na2S2O3·5H2O2,AR)、乙腈(C2H3N,HPLC)等购于安谱实验科技股份有限公司。NaClO、H2O2、NaOH、HCl、NaHCO3、CH3COOH、HA等购于国药集团化学试剂有限公司,除NaClO为化学纯外其余均为分析纯。实验用水为Milli-Q超纯水。
高效液相色谱仪(HPLC)(LC-20A,日本岛津)、液相色谱质谱联用仪LC-MS(LCMS-1200,安捷伦科技有限公司)、气相色谱质谱联用仪(GCMS-QP2010,日本岛津)、总有机碳分析仪(TOC-VCPH,日本岛津)、便携式余氯计(CL200,上海三信仪表厂)、pH计(ST2100,常州奥豪斯仪器有限公司)、磁力搅拌器(HJ-6A,江苏金坛峥嵘仪器)、纯水机(Milli-Q,美国Milipore)。
-
在1个容积为500 mL的圆柱形容器中进行实验,容器置于磁力搅拌器上。光源为套有石英套管的低压汞灯(辐射照度0.18 mW·cm−2,波长254 nm)。实验溶液为300 mL 500 μg·L−1的SA溶液,实验前用0.1 mol·L−1的NaOH或HCl将其调节pH至7。实验开始时投加一定浓度的NaClO或SPC,同时开启汞灯与磁力搅拌器,开始计时,在设定时间取样经0.22 μm滤膜过膜后送入HPLC分析。进样瓶在实验开始前预先加入10 μL浓度为0.01 mol·L−1的Na2S2O3·5H2O2以确保完全淬灭剩余氧化剂。在预实验中,NaClO与SPC的投加量分别为3 mg·L−1和12 mg·L−1时2种工艺得到较好去除效果,故后续实验以此投加量为基础进行。所有实验重复3次并取平均值。
-
SA的浓度采用HPLC进行检测。流动相A为0.1%乙酸溶液,流动相B为乙腈,A与B体积比为65:35,流速为1 mL·min−1,紫外检测器波长为292 nm,柱温为40 ℃,进样体积20 μL。
-
SA的降解产物采用GC-MS和LC-MS进行检测。其中GC-MS分析前样品需经富集和预处理。将反应溶液以1 mL·min−1的流速通过固相萃取小柱,完成填料的富集后用10 mL的甲醇以0.5 mL·min−1的流速进行洗脱,完成洗脱后进样。
GC-MS条件:进样量1 μL,离子源温度230 ℃,进样口温度280 ℃,溶剂切除时间4 min,阈值1 000;全扫描模式,扫描间隔0.3 s,检测范围为35~450。LC-MS条件:采用负离子模式,进样量10 μL,流动相A为10%乙腈,流动相B为90%浓度为0.1%的乙酸溶液,等度洗脱,流速为1 mL·L−1,柱温40 ℃,切除溶剂3 min,源温度100 ℃,全扫描模式,扫描间隔0.3 s,质荷比(m/z)为35~450。
-
毒性模拟利用美国环保署开发的ECOSAR程序,在软件中输入产物的结构式,软件通过计算物质的氧化副产物及化学结构来计算其生态毒性,可以评估对鱼类、水蚤和绿藻的急性、慢性毒性。
-
引入协同因子(R)来定量评估UV/NaClO和UV/SPC体系去除SA的协同效应[9],由式(1)~式(2)来描述。通过计算RUV/NaClO和RUV/SPC评估不同因素对协同效应的影响。
式中:RUV/NaClO和RUV/SPC分别为UV/NaClO和UV/SPC体系的协同因子;kUV/NaClO为UV/NaClO降解SA的拟一级反应动力学常数,min−1;kUV/SPC为UV/SPC降解SA的拟一级反应动力学常数,min−1;kNaClO为NaClO降解SA的拟一级反应动力学常数,min−1;kSPC为SPC降解SA的拟一级反应动力学常数,min−1;kUV为UV降解SA的拟一级反应动力学常数,min−1。
-
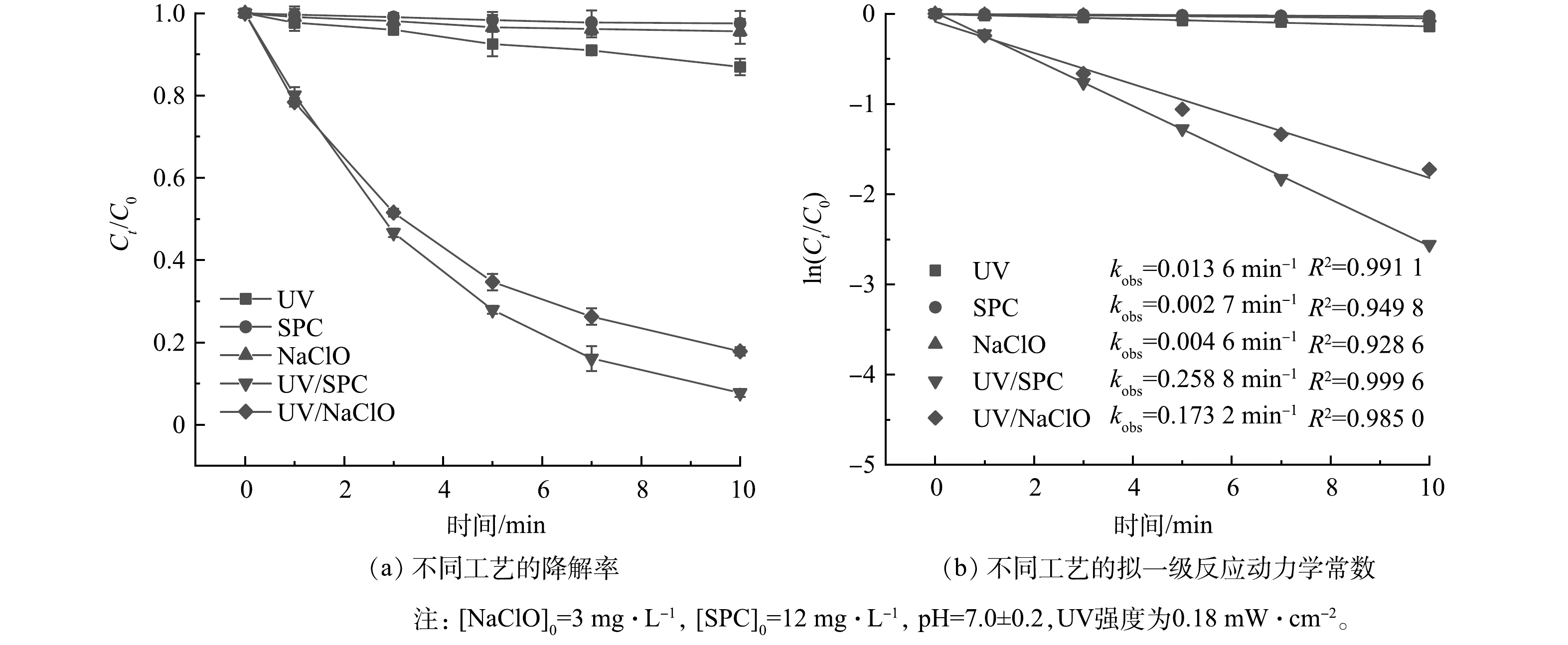
对比考察了UV、NaClO、SPC、UV/NaClO和UV/SPC对SA的去除,结果如图1所示。在反应10 min时,NaClO和SPC对SA的去除率仅为4.5%和2.5%,UV对SA的去除率为13%。UV/NaClO和UV/SPC对SA的去除率分别达到82.2%和92.3%,其拟一级反应动力学常数(kobs)分别为0.173 2 min−1和0.258 8 min−1,为NaClO和SPC降解SA的37.6倍和95.8倍。这说明UV与氧化剂的协同作用大大提高了SA的去除率。UV/NaClO和UV/SPC的R分别达到9.5和15.9,原因是UV/NaClO工艺中产生了·OH和RCS(式(3)~式(8))[10],UV/SPC工艺中产生了·OH、O2·−和CO3·-(式(9)~式(15))[11],自由基的产生可显著提高SA的去除率。
-
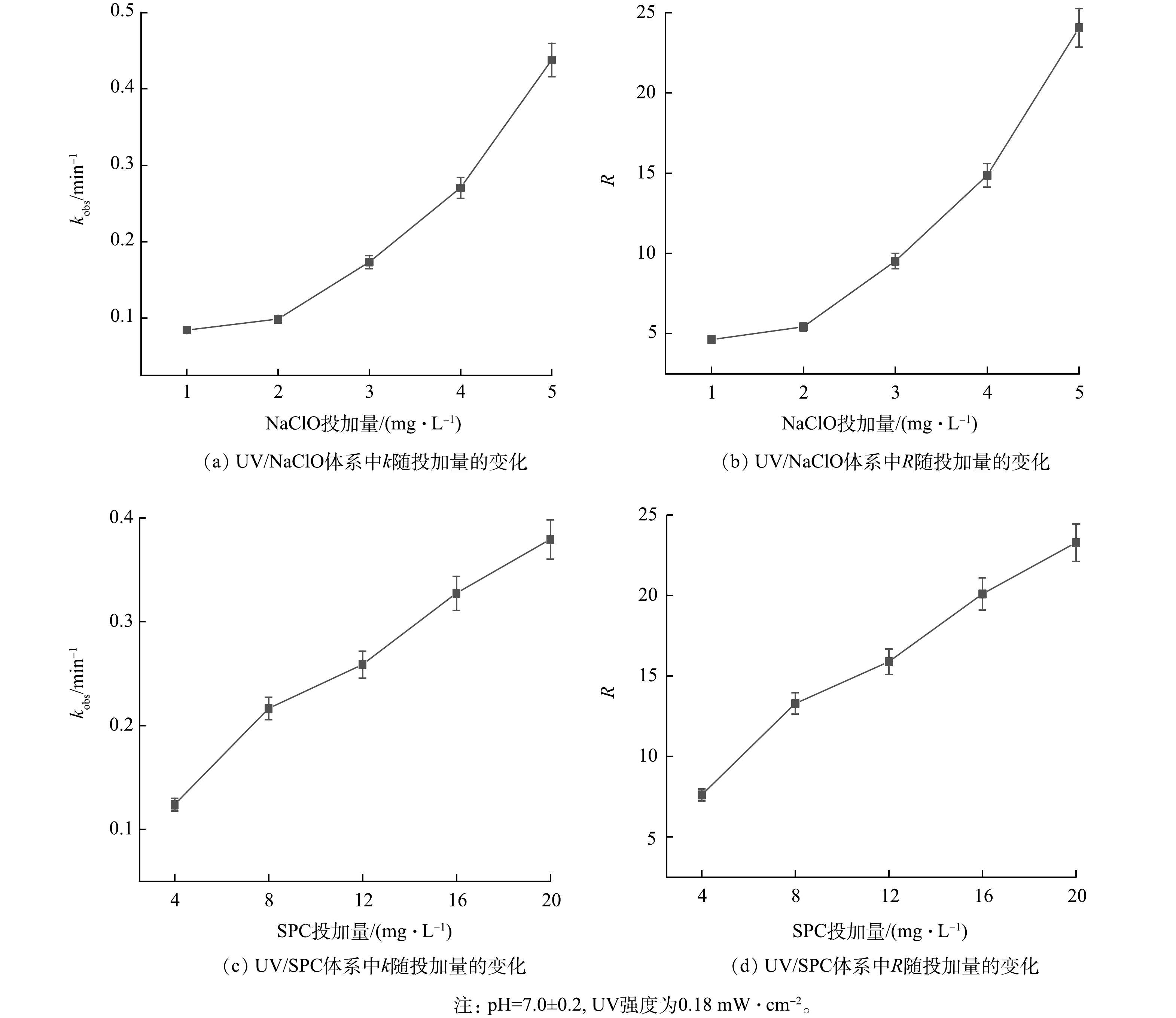
1)氧化剂投加量对降解SA的影响。基于UV的AOP中氧化剂浓度对有机污染物降解有重要影响[12],考察了NaClO和SPC浓度对SA降解的影响,kobs和R随NaClO和SPC浓度的变化如图2所示。由图2可见,UV/NaClO工艺中NaClO的投加量从1 mg·L−1增加至5 mg·L−1,kobs从0.084 2 min−1增加至0.437 8 min−1,RUV/NaClO从4.6增加至24;UV/SPC工艺中SPC的投加量从4 mg·L−1增加至20 mg·L−1,kobs从0.123 9 min−1增加至0.379 4 min−1,RUV/SPC从7.6增加至23.2。2种工艺去除SA的kobs与R均随着氧化剂投加量的增加而增大。这是因为氧化剂的增加可产生更多自由基,进而提高了kobs与R [2]。R和kobs随NaClO和SPC投加量的增加呈相同的变化趋势,由于NaClO和SPC难以去除SA,这也表明了SA的去除主要归因于协同作用。
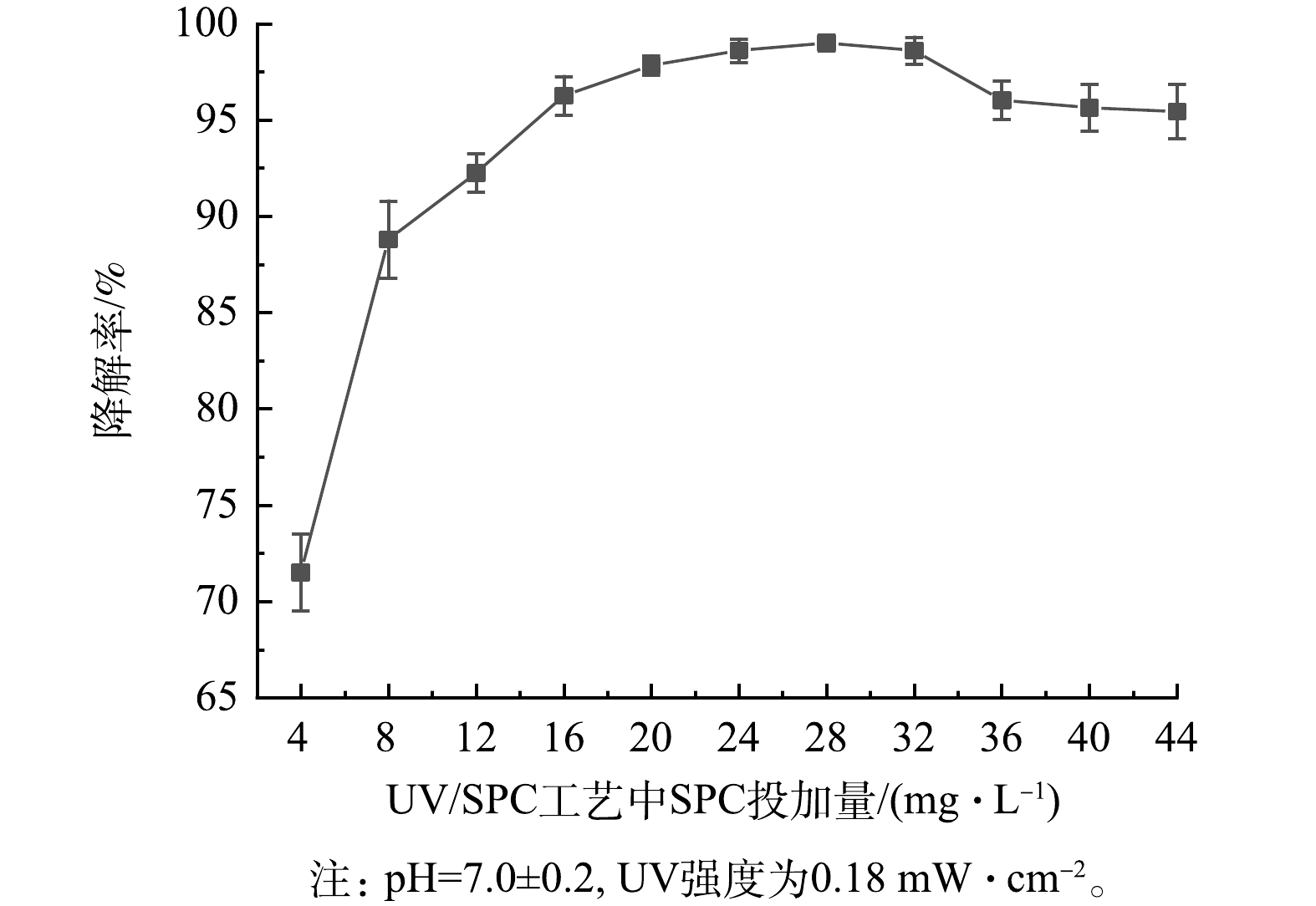
值得注意的是,UV/SPC工艺的kobs增速随SPC投加量的增加变缓。进一步增大SPC的投加量(20~28 mg·L−1),SA的去除率由97.8%提升至99.1%,当SPC的投加量大于28 mg·L−1时,SA的去除率开始下降,并最终保持在约95%(图3)。这是因为过量的SPC生成了大量的CO32-,而CO32-会消耗溶液中的·OH从而降低kobs(式(9)~(13))。GUO等[7]研究O3活化SPC降解水中磺胺甲恶唑(SMX)时同样发现过量的SPC会降低SMX的去除率。
2)初始pH对降解SA的影响。pH是AOPs中重要的影响因素[13],为此,探究了不同pH下UV/NaClO和UV/SPC工艺对SA的去除(图4)。如图4,初始pH对SA去除有显著的影响。随着pH从11下降至3,UV/NaClO工艺中kobs从0.101 7 min−1逐步升至0.287 6 min−1,RUV/NaClO从5.6增至15.8。而UV/SPC工艺中kobs和RUV/SPC在pH为7时最大,达到0.288 9 min−1和17.5,kobs与RUV/SPC则随着pH的增大或减小而减小。当pH为11时,kobs和RUV/SPC分别降低为0.150 2 min−1和9.4;当pH为3时,kobs与RUV/SPC分别降至0.083 4 min−1和5.2;
pH可通过影响NaClO溶于水后HOCl和ClO−的存在形式进而影响UV/NaClO工艺对的SA的去除,HOCl和ClO−在254 nm处的摩尔吸光系数相同,pH小于7.5时,溶液中主要以HOCl的形式存在,而pH大于7.5时,主要以ClO−的形式存在[14]。SA是一种弱酸,溶于水中时可以电离出H+,同时SA变为SA−。因此溶液pH越大ClO−与SA−含量均会增加,两者电荷相同产生排斥导致kobs下降。CAO等[15]研究UV/NaClO工艺降解对乙酰氨基酚(AAP)时同样得出了溶液pH增大时AAP−与ClO−的排斥导致AAP的降解速率下降的结论。
随着pH的增加,·OH氧化电位从2.62 V下降至2.15 V,同时·OH与溶液中存在的OH−反应生成氧化电位为1.78V的O·−[16]。当pH小于7时,kobs与RUV/SPC随着pH的减小而降低,原因是酸性体系中SA主要以分子的形式存在,具有一定的疏水性,故kobs随着pH的降低而降低,PANDA等[17]研究声光催化SPC降解氧氟沙星(OFX)时发现不同pH下污染物的去除率、降解速率与污染物的亲水、疏水性有关。此外,HPESHI等[18]以SPC作为氧化剂降解OFX也同样得出了在pH为中性时反应速率与去除率最佳的结论。
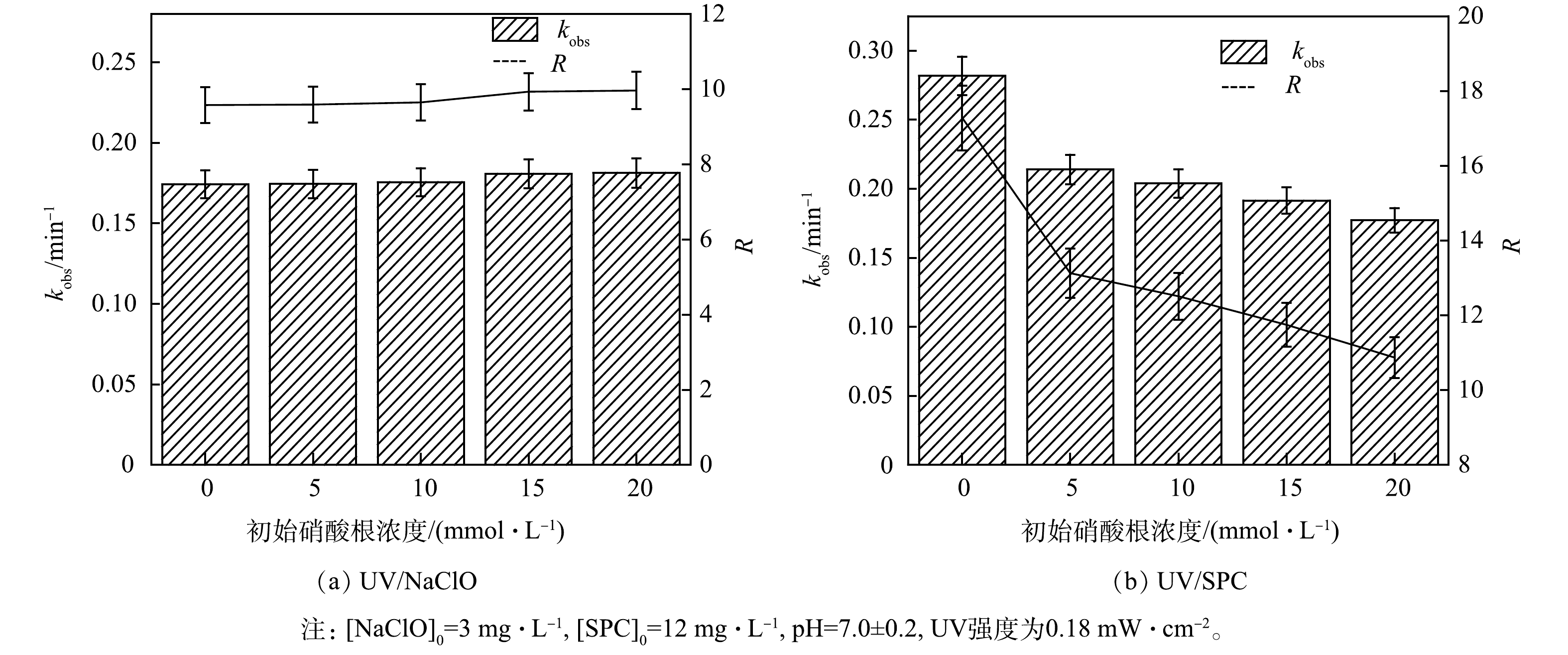
3) NO3−对降解SA的影响。天然水环境中普遍含有NO3–,其质量浓度为0.3 mg·L−1[10]。为探究其影响,实验中考察了溶液初始NO3−浓度对SA去除的影响(图5)。
如图5所示,NO3−对UV/NaClO工艺去除SA有轻微促进作用,NO3−浓度从0增加至20 mmol·L−1,kobs从由0.174 2 min−1增大至0.181 3 min−1,R由9.5增至9.9,kobs与RUV/NaClO增长不显著。UV辐照NO3−可生成硝酸根自由基(NO3·-)和亚硝酸根自由基(NO2·-),如式(16~17)所示[19]。其中NO3·-的氧化电位2.3~2.5V低于·OH,NO2·-可与·OH可以进一步反应消耗·OH(式(18))[20],因此,UV/NaClO体系中少量存在的·OH与溶液中的NO2·-反应降低·OH的浓度,但是光解生成的NO3·-和NO2·-仍对去除SA有所贡献,故kobs呈现略微的增大。随着NO3−浓度由0增加至20 mmol·L−1,UV/SPC工艺中kobs由0.281 7 min−1降至0.177 2 min−1,RUV/SPC由17.3降低至10.8,NO3−对SA的去除有抑制作用,可能的原因是UV/SPC工艺体系中·OH对降解起着主要贡献[5],而NO3−的加入将大量生成的·OH转化为氧化性较弱的NO3·-及其他产物(式(16)~式(18)),因此UV/SPC工艺的去除率与反应速率均受到了降低和抑制。
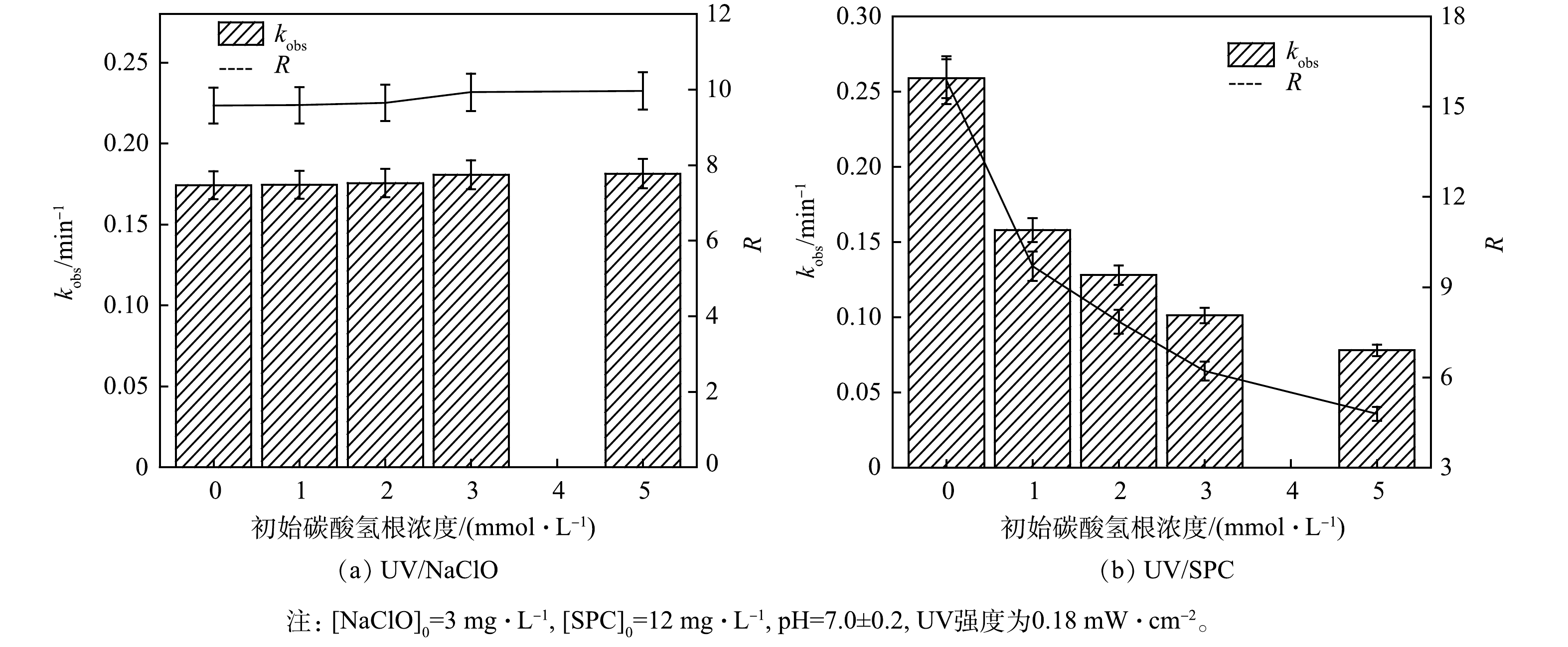
4) HCO3−对降解SA的影响。HCO3− 广泛存在于地表水中,可能会影响高级氧化工艺中污染物的降解[21]。因此,考察了溶液初始HCO3−浓度对SA去除的影响(图6)。
如图6所示,UV/NaClO工艺的kobs和RUV/NaClO随HCO3−浓度的增加而增大,HCO3−的浓度由0增加至5 mmol·L−1时,kobs由0.173 2 min−1增加至0.181 3 min−1,RUV/NaClO由9.5增加至9.9,但两者增加幅度不明显。HCO3−和CO32-均能与·OH反应生成CO3·-(式(11)~式(13)),UV/NaClO工艺体系中HCO3−消耗了产生的·OH,但UV/NaClO工艺中起主要贡献的为RCS,故HCO3−对·OH 的消耗并没有降低kobs[3]。此外,转化生成的CO3·-对含有苯胺等富电子的污染物具有选择性,这可能促进了SA的降解[21]。综合·OH的消耗与CO3·-的生成,实验中SA去除率不变,kobs和RUV/NaClO增加不明显的现象。ZHU等[22]研究UV/NaClO工艺降解卡马西平(CBZ)同样得出了HCO3−对CBZ去除影响较小的结论。
HCO3−对UV/SPC工艺SA的去除起抑制作用。当HCO3−的浓度从0增加至5 mmol·L−1,kobs由0.258 8 min−1降至0.078 0 min−1,相应的RUV/SPC由15.8降至4.7,两者下降幅度明显。不同于UV/NaClO工艺,UV/SPC工艺溶液中本身存在HCO3−与CO32-,故体系中会产生CO3·-,然而UV/SPC工艺中的有效氧化剂为H2O2,CO3·-可以与H2O2反应并消耗H2O2(式(19))[5]。此外,溶液中HCO3−与CO32-与反应生成的·OH(式(11)~式(13))反应,生成的CO3·-进一步消耗H2O2,故随着HCO3−浓度的增加,kobs和RUV/SPC均明显下降。
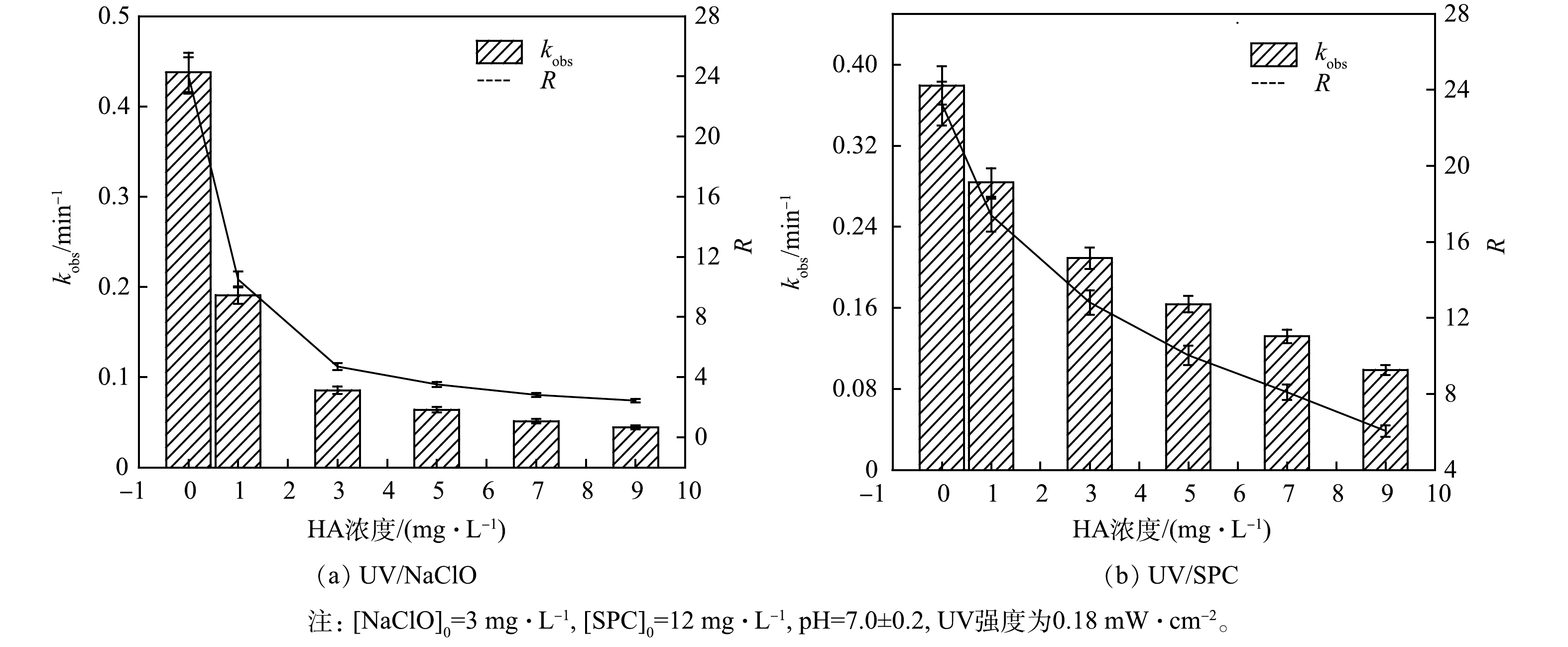
5)腐殖酸对降解SA的影响。NOM是天然水环境中普遍存在的一种有机组分,实验中采用腐殖酸(HA)模拟有机物,考察了HA对SA去除的影响(图7)。
如图7所示,HA对2种工艺去除SA均有明显的抑制作用。当HA的质量浓度由0增加至9 mg·L−1,UV/NaClO工艺的kobs从0.437 8 min−1下降至0.044 3 min−1,RUV/NaClO则从24降至2.4;UV/SPC工艺的kobs从0.379 4 min−1下降至0.098 7 min−1,RUV/SPC从23.2降至6。HA是天然有机物(NOM)的典型代表,其对2种工艺kobs的抑制有相同的原因:(1) UV产生的光子在入射时被HA吸收了,导致SA的光降解效率降低、氧化剂的激活光子数量减少;(2) HA具有清除作用,消耗溶液中激发产生的自由基,降低自由基的浓度[20]。LI等[23]人研究UV/NaClO降解水中双氯芬酸钠(DS)时探究NOM对DS降解的影响,同样得出了NOM会抑制DS降解的结论。
-
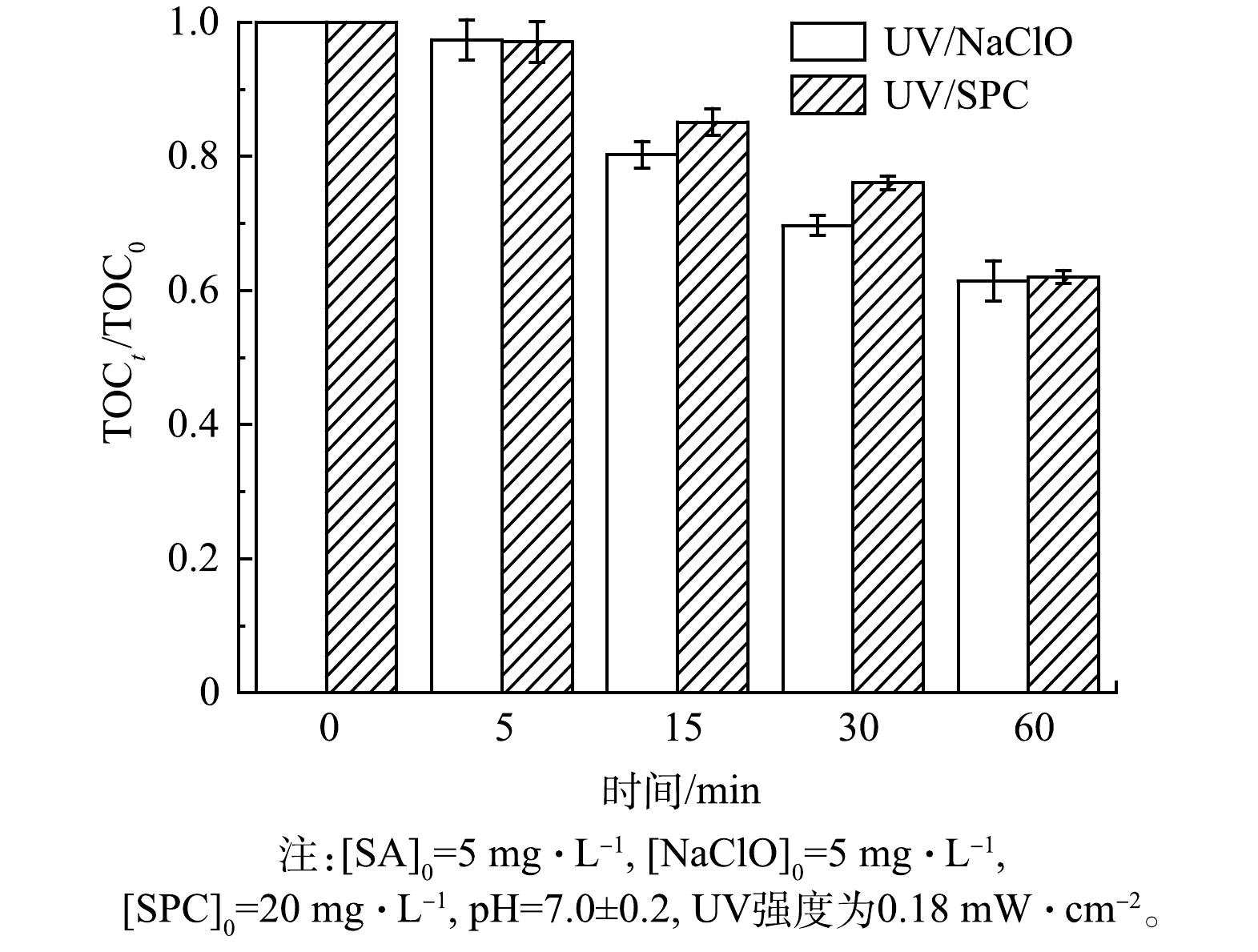
1) TOC分析。UV/NaClO和UV/SPC工艺降解SA的过程中溶液TOC的变化情况如图8所示。由图8可知,15 min和30 min时,UV/NaClO工艺中TOC去除率分别为20%和31%,而UV/SPC工艺中TOC去除率则分别为15%和24%,60 min后2种工艺TOC的去除(矿化度)均在40%左右[24]。UV/NaClO工艺对TOC的去除略优于UV/SPC工艺。溶液TOC的去除是因为UV/NaClO和UV/SPC工艺产生的自由基将SA氧化为CO2和H2O,然而实验结果表明SA去除后并没有完全转化为CO2和H2O,而是生成了其他有机副产物[25]。PATIL等[25]对比研究了超声/H2O2、光芬顿、超声/光芬顿等工艺对啶虫脒(ACP)的去除表明此类AOPs难以将污染物完全矿化。有研究[26]表明,加大氧化剂的浓度或者提高UV的功率可以提高矿化度,该方法可为后续在实际处理水中完全矿化PPCPs提供参考。
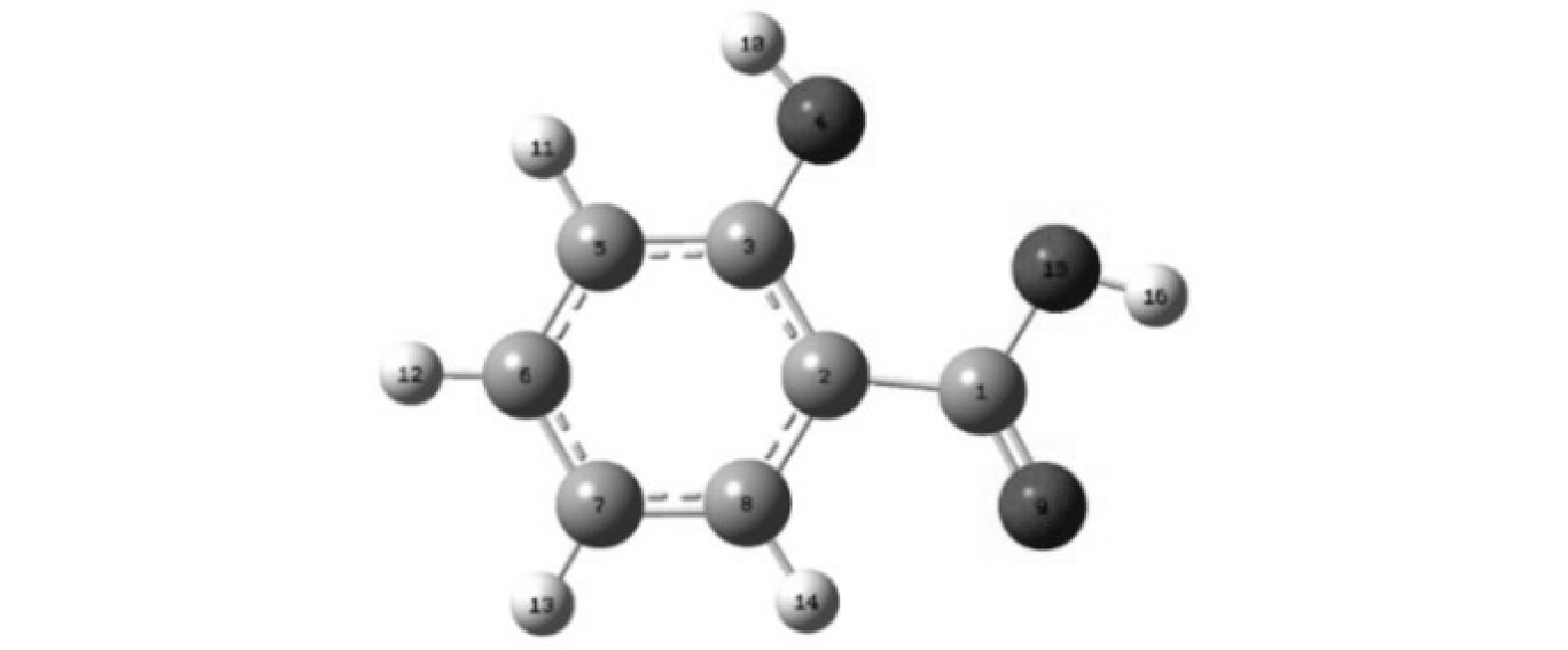
2) DFT计算。将SA结构优化并编号如图9,并进行DFT计算,结果见表1。分子之间的反应机理主要包括亲核反应、亲电反应和自由基攻击反应,在AOPs中主要是自由基与PPCPs之间的亲电反应[27]。其中福井指数可以反应各个原子位点易受攻击的种类,主要包括:亲核攻击(f+)、亲电攻击(f-)和自由基攻击(f0),且福井指数越大,表明该原子位点是主要的进攻电位[28]。根据DFT计算结果,易受攻击的电位主要是C和O。其中O4、C7易受亲电攻击,C1、C6和C7易受亲核攻击,O4、C6和O9易受自由基攻击。可以看出易受攻击的电位主要集中在SA酚羟基、羧基的的对位和间位,DFT的结果为分析SA降解产物与路径提供理论依据。
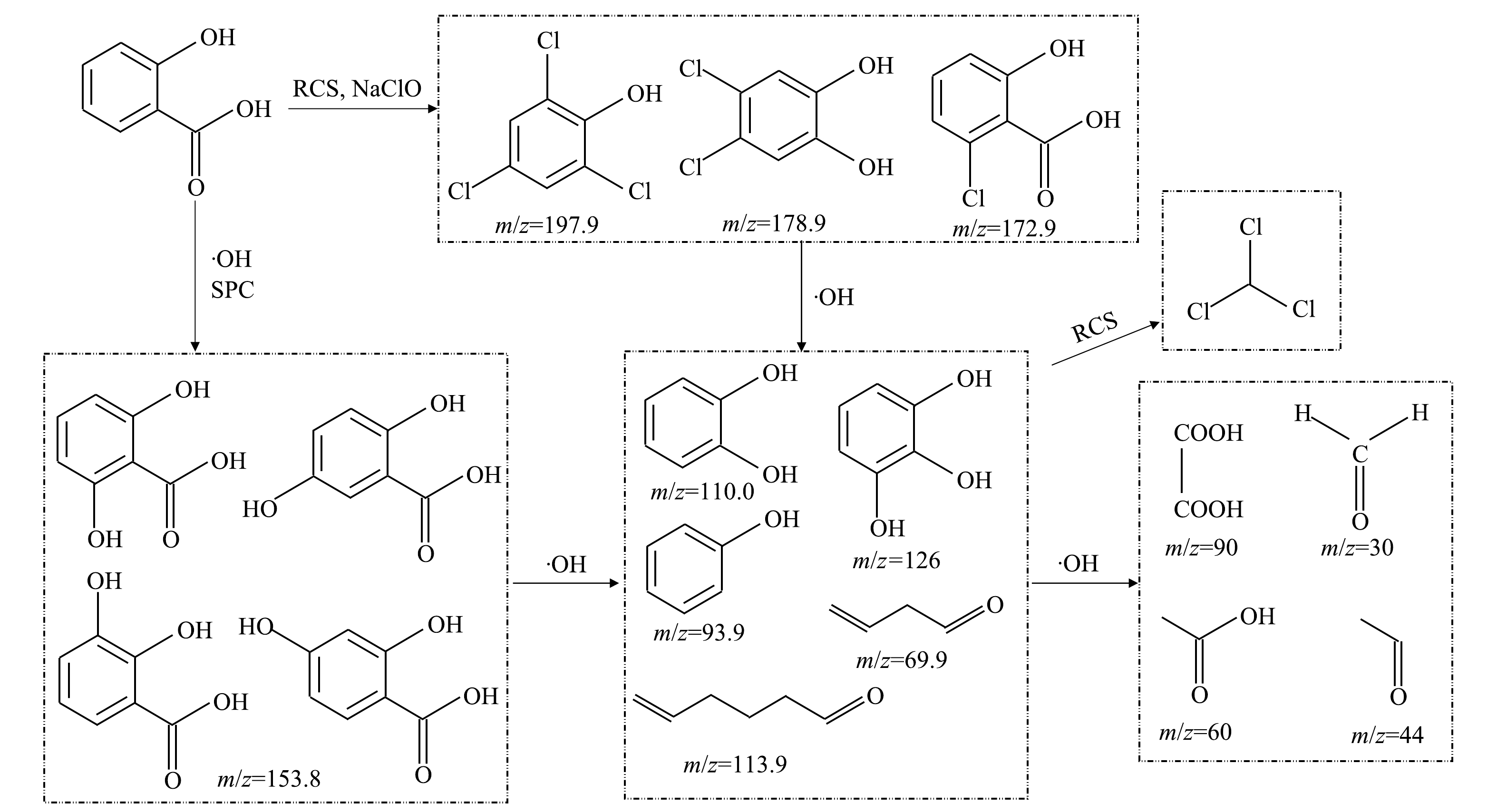
3)降解路径分析。综合GC-MS和LC-MS结果并结合此前DFT的分析结果,推测SA在2种工艺作用下可能的降解路径如图10所示。UV/NaClO工艺中SA主要产物有氯代产物(m/z 172.90、178.98、197.94),其为RCS和NaClO的氧化结果。在2个工艺中均出现酚羟基(-OH)的取代和氧化,主要产物有2,3-二羟甲基苯甲酸(2,3-DHBA,m/z 153.89)、2,4-二羟甲基苯甲酸(2,4-DHBA)、2,5-二羟甲基苯甲酸(2,5-DHBA)、2,6-二羟甲基苯甲酸(2,6-DHBA)、苯酚(m/z 93.9)、邻苯二酚(m/z 110)、连苯三酚(m/z 126)等,此类产物是由于·OH等自由基的氧化产生的。该结果与此前报道的SA与·OH 的反应产物相一致[29]。这类产物在自由基的氧化作用下进一步可以分解为甲醛、乙醛、乙酸、草酸等有机小分子[30]。此外,值得注意的是,在UV/NaClO工艺的降解SA的产物中检测出了三氯甲烷(TCM),其为典型的DBPs,具有三致作用,因此,需引起重视[4]。
4)产物毒性分析。通过ECOSAR软件对已鉴定产物进行了毒性模拟[31],毒性的评估等级分4类:LC50、EC50或ChV > 100 mg·L−1时为无毒;100 mg·L−1≥ LC50、EC50或ChV >10 mg·L−1时为有害;10 mg·L−1 ≥ LC50、EC50或ChV > 1 mg·L−1时为有毒;LC50、EC50或ChV ≤ 1 mg·L−1时为剧毒。其中ChV代表慢性毒性;LC50代表半数致死浓度,即在动物急性毒性实验中,使受试动物半数死亡的毒物浓度;EC50指半数效应浓度,通过测定工业废水和其他化学物质对鱼类等水生生物的急性毒性实验方法,以在一定暴露时间内的平均耐受限(TLm)表示;TLm代表在急性毒性实验中使受试水生动物半数存活或半数死亡的毒物浓度,即TLm同EC50[31]。
SA的鱼、水蚤和绿藻的ChV值分别为12.98、7.06和25.55 mg·L−1,根据评估等级分别判定为有害、有毒和有害。由图11可见,SA的降解产物出现了评估等级为剧毒的物质,其中2,5-DHBA是其同分异构产物中毒性最强的,其鱼类的ChV值为0.10 mg·L−1,为剧毒等级。m/z 69.9对鱼类的LC50,96h和ChV值也达到了剧毒等级。苯酚、m/z 113.9、甲醛和乙醛在水蚤的ChV评估同样为剧毒等级,邻苯二酚、连苯三酚和m/z 197.9对绿藻的ChV评估也达到了剧毒等级。值得注意的是,m/z 197.9在鱼、水蚤和绿藻3个生物毒性评估中均达到了剧毒等级。被认为具有三致作用的TCM在急性毒性评估中毒性小于SA,可能的原因是TCM的毒性表现为遗传或基因毒性,故并未在急性毒性中表现出毒性。在发光细菌急性毒性中,SA初始溶液对发光细菌没有抑制,UV/NaClO工艺中反应溶液的相对抑制率先增加到100%再降至63%,UV/SPC工艺中反应溶液相对抑制率在反应开始同样先增加到50%并逐步开始下降(反应20 min时降至35%)。毒性模拟评估为发光细菌急性毒性实验中SA降解后急性毒性大于SA溶液初始毒性提供了佐证。产物m/z 172.9和甲酸评估结果均为无毒,该结果同样验证了随着降解的进行,产物初步降解为小分子物质,溶液的急性毒性开始逐步下降。在后续的研究与应用中,可以进一步加大对产物的检测与毒性评估,并适当延长降解的时间,可以有效降低溶液的急性毒性。
-
1) UV/NaClO和UV/SPC工艺有效提高了SA的去除效率,2种工艺的R分别达到9.5和15.9。UV/SPC工艺在TOC去除和荧光强度降低方面呈现一定的优势。随着氧化剂投加量的增加2种工艺的降解效率和R均逐步提高,但过量的SPC会抑制SA的去除。
2)初始pH对2种工艺的kobs和R均有较大的影响,随着pH由11下降至3,UV/NaClO工艺中kobs由0.101 7 min−1逐步升至0.287 6 min−1,UV/SPC工艺中kobs和R均在pH为7时为最大,而kobs与R均随着pH的增大或减小而减小;NO3−与HCO3−对UV/NaClO工艺去除SA有促进作用,而对UV/SPC工艺去除SA有明显的抑制作用;HA对2种工艺去除SA均有抑制。
3) SA在2种工艺中的降解机理主要为自由基的取代和氧化,值得注意的是UV/NaClO工艺的降解产物中检测出了典型的DBPs三氯甲烷。
4)软件毒性模拟结合发光细菌毒性实验结果表明部分中间产物会导致急性毒性的上升,这类中间产物进一步分解为小分子无机物后毒性会降低,后续的实验与应用可以延长反应时间以降低溶液毒性。
紫外/次氯酸钠和紫外/过碳酸钠工艺降解水杨酸的影响因素及降解机理
Ultraviolet/sodium hypochlorite and ultraviolet/sodium percarbonate processes for degradation of salicylic acid: Influencing factors and mechanism
-
摘要: 采用紫外/次氯酸钠(UV/NaClO)和紫外/过碳酸钠(UV/SPC)工艺降解水中水杨酸(SA),且利用协同因子(R)作为评价指标,分别考察了氧化剂投加量、pH、阴离子(NO3-、HCO3−)和腐殖酸(HA)等因素对SA去除的影响,结合TOC对比了2种工艺对SA的去除效果,通过鉴定中间降解产物探讨了SA可能的降解路径。结果表明:UV/NaClO和UV/SPC工艺中SA的去除均符合拟一级反应动力学,R与拟一级反应动力学常数(kobs)变化趋势相似。当NaClO和SPC质量浓度分别为 3 mg·L−1和12 mg·L−1时,2种工艺中kobs分别为0.173 2 min−1和0.258 8 min−1,而 RUV/NaClO和RUV/SPC分别为9.5和15.9。kobs和R随氧化剂投加量的增加而升高,因过量的SPC消耗产生的羟基自由基(·OH)会导致kobs降低。初始pH对SA去除有较大影响,酸性环境有利于UV/NaClO工艺去除SA,而UV/SPC工艺则在pH=7具有较好的SA去除效果。NO3−与HCO3−对UV/NaClO工艺去除SA有轻微的促进作用,而显著抑制UV/SPC工艺对SA的去除。HA对2种工艺中SA的去除均有抑制作用。相比UV/NaClO,UV/SPC工艺对TOC去除更为显著。通过分析SA的密度泛函理论(DFT)并结合主要的降解产物推测SA的降解机理主要为自由基的取代和氧化。Abstract: The UV/NaClO and UV/SPC processes were used to degrade salicylic acid (SA) in water. Based on the synergy factor (R) as the evaluation index, the effects of oxidant dosage, pH, anions (NO3−, HCO3−) and humic acid (HA) on SA removal were investigated. Combined with TOC, the SA removal during UV/NaClO process and UV/SPC process was compared, the degradation path of SA and the possible intermediate products were also discussed. The results showed that SA removal in UV/NaClO and UV/SPC processes fitted well with the pseudo- first-order reaction kinetics model, and R and pseudo-first-order reaction kinetical constant (kobs) presented the similar variation trend. When the concentrations of NaClO and SPC were 3 mg·L−1 and 12 mg·L−1, respectively, the kobs values of the two processes were 0.1732 min−1 and 0.2588 min−1, respectively, the RUV/NaClO and RUV/SPC were 9.5 and 15.9, respectively. kobs and R increased with the increase of oxidant dosage, but the excessive SPC would consume the generated hydroxyl radicals (·OH), resulting in the decrease of kobs. The initial pH had a distinctly influence on both processes, the UV/NaClO process was more effective in an acidic environment than in an alkaline one, and the UV/SPC process demonstrated an excellent removal performance in a neutral environment (pH=7). NO3− and HCO3− could slightly promote SA degradation by the UV/NaClO process, but significantly inhibit SA degradation by the UV/SPC process. HA inhibited SA removal by both processes. UV/SPC process was superior to UV/NaClO process in TOC removal. Based on the density functional theory (DFT) analysis of SA and the main intermediate products, the main mechanism of SA degradation was the substitution and oxidation of radicals.
-

-
表 1 SA的自然布局分析(NPA)电荷分布和福井指数
Table 1. Natural population analysis (NPA) charge distribution and Fukui index of SA
原子 q(N) q(N+1) q(N−1) f− f+ f0 1(C) 0.203 8 0.108 0 0.222 4 0.018 6 0.095 8 0.057 2 2(C) −0.03 3 −0.100 8 0.042 1 0.075 1 0.067 8 0.071 4 3(C) 0.090 6 0.039 0 0.178 9 0.088 4 0.051 6 0.070 0 4(O) −0.175 3 −0.216 1 −0.040 0 0.135 3 0.040 8 0.088 0 5(C) −0.069 5 −0.137 9 0.009 5 0.079 1 0.068 4 0.073 7 6(C) −0.026 2 −0.143 5 0.037 4 0.063 6 0.117 2 0.090 4 7(C) −0.052 3 −0.105 9 0.083 9 0.136 2 0.053 6 0.094 9 8(C) −0.021 4 −0.101 2 0.036 1 0.057 5 0.079 9 0.068 7 9(O) −0.291 9 −0.405 3 −0.220 4 0.071 5 0.113 4 0.092 5 10(H) 0.180 7 0.150 9 0.228 3 0.047 5 0.029 9 0.038 7 11(H) 0.040 7 −0.002 5 0.084 5 0.043 8 0.043 3 0.043 5 12(H) 0.048 6 −0.008 4 0.091 9 0.043 2 0.057 0 0.050 1 13(H) 0.045 7 0.005 2 0.100 2 0.054 5 0.040 5 0.047 5 14(H) 0.049 5 0.009 9 0.086 4 0.036 9 0.039 5 0.038 2 15(O) −0.173 5 −0.233 8 −0.152 9 0.020 6 0.060 2 0.040 4 16(H) 0.183 6 0.142 3 0.211 7 0.028 2 0.041 2 0.034 7 -
[1] MA D, YI H, LAI C, et al. Critical review of advanced oxidation processes in organic wastewater treatment[J]. Chemosphere, 2021, 275: 130104. doi: 10.1016/j.chemosphere.2021.130104 [2] LI S, AO X, LI C, et al. Insight into PPCP degradation by UV/NH2Cl and comparison with UV/NaClO: Kinetics, reaction mechanism, and DBP formation[J]. Water Research, 2020, 182: 115967. doi: 10.1016/j.watres.2020.115967 [3] ZHAO X, JIANG J, PANG S, et al. Degradation of iopamidol by three UV-based oxidation processes: Kinetics, pathways, and formation of iodinated disinfection byproducts[J]. Chemosphere, 2019, 221: 270-277. doi: 10.1016/j.chemosphere.2018.12.162 [4] TIAN F X, YE W K, XU B, et al. Comparison of UV-induced AOPs (UV/Cl2, UV/NH2Cl, UV/ClO2 and UV/H2O2 ) in the degradation of iopamidol: Kinetics, energy requirements and DBPs-related toxicity in sequential disinfection processes[J]. Chemical Engineering Journal, 2020, 398: 125570. doi: 10.1016/j.cej.2020.125570 [5] YAN P, SUI Q, LYU S, et al. Elucidation of the oxidation mechanisms and pathways of sulfamethoxazole degradation under Fe(II) activated percarbonate treatment[J]. Science of the Total Environment, 2018, 640-641: 973-980. doi: 10.1016/j.scitotenv.2018.05.315 [6] YUE L, CHENG J, HUA J, et al. A sodium percarbonate/ultraviolet system generated free radicals for degrading capsaicin to alleviate inhibition of methane production during anaerobic digestion of lipids and food waste[J]. Science of the Total Environment, 2021, 761: 143269. doi: 10.1016/j.scitotenv.2020.143269 [7] GUO H, LI D, LI Z, et al. Promoted elimination of antibiotic sulfamethoxazole in water using sodium percarbonate activated by ozone: Mechanism, degradation pathway and toxicity assessment[J]. Separation and Purification Technology, 2021, 266: 118543. doi: 10.1016/j.seppur.2021.118543 [8] PENG X, OU W, WANG C, et al. Occurrence and ecological potential of pharmaceuticals and personal care products in groundwater and reservoirs in the vicinity of municipal landfills in China[J]. Science of the Total Environment, 2014, 490: 889-898. doi: 10.1016/j.scitotenv.2014.05.068 [9] YANG L, ZhANG Z. Degradation of six typical pesticides in water by VUV/UV/chlorine process: Evaluation of the synergistic effect[J]. Water Res, 2019, 161: 439-447. doi: 10.1016/j.watres.2019.06.021 [10] DENG J, WU G, YUAN S, et al. Ciprofloxacin degradation in UV/chlorine advanced oxidation process: Influencing factors, mechanisms and degradation pathways[J]. Journal of Photochemistry and Photobiology A:Chemistry, 2019, 371: 151-158. doi: 10.1016/j.jphotochem.2018.10.043 [11] ESLAMI A, MEHDIPOUR F, LIN K-Y A, et al. Sono-photo activation of percarbonate for the degradation of organic dye: The effect of water matrix and identification of by-products[J]. Journal of Water Process Engineering, 2020, 33: 100998. doi: 10.1016/j.jwpe.2019.100998 [12] GOMES J, COSTA R, QUINTA-FERREIRA R M, et al. Application of ozonation for pharmaceuticals and personal care products removal from water[J]. Science of the Total Environment, 2017, 586: 265-283. doi: 10.1016/j.scitotenv.2017.01.216 [13] CHEN J, QU R, PAN X, et al. Oxidative degradation of triclosan by potassium permanganate: Kinetics, degradation products, reaction mechanism, and toxicity evaluation[J]. Water Research, 2016, 103: 215-223. doi: 10.1016/j.watres.2016.07.041 [14] FENG Y, Smith D W, Bolton J R. Photolysis of aqueous free chlorine species (HOCl and OCl) with 254 nm ultraviolet light[J]. Journal of Environmental Engineering and Science, 2007, 6(3): 277-284. doi: 10.1139/s06-052 [15] CAO F, ZHANG M, Yuan S, et al. Transformation of acetaminophen during water chlorination treatment: kinetics and transformation products identification[J]. Environmental Science and Pollution Research International, 2016, 23(12): 12303-12311. doi: 10.1007/s11356-016-6341-x [16] ZHANG Y, ZHANG J, XIAO Y, et al. Kinetic and mechanistic investigation of azathioprine degradation in water by UV, UV/H2O2 and UV/persulfate[J]. Chemical Engineering Journal, 2016, 302: 526-534. doi: 10.1016/j.cej.2016.05.085 [17] PANDA D, Manickam S. Recent advancements in the sonophotocatalysis (SPC) and doped-sonophotocatalysis (DSPC) for the treatment of recalcitrant hazardous organic water pollutants[J]. Ultrasonics Sonochemistry, 2017, 36: 481-496. doi: 10.1016/j.ultsonch.2016.12.022 [18] HAPESHI E, FOTIOU I, FATTA-KASSINOS D. Sonophotocatalytic treatment of ofloxacin in secondary treated effluent and elucidation of its transformation products[J]. Chemical Engineering Journal, 2013, 224: 96-105. doi: 10.1016/j.cej.2012.11.048 [19] GRAUMANS M H F, HOEBEN W, Van DAEL M F P, et al. Thermal plasma activation and UV/H2O2 oxidative degradation of pharmaceutical residues[J]. Environmental Research, 2021, 195: 110884. doi: 10.1016/j.envres.2021.110884 [20] LI L, GUO R, ZHANG S, et al. Sustainable and effective degradation of aniline by sodium percarbonate activated with UV in aqueous solution: Kinetics, mechanism and identification of reactive species[J]. Environmental Research, 2021: 112176. [21] WOJNAROVITS L, TOTH T, TAKACS E. Rate constants of carbonate radical anion reactions with molecules of environmental interest in aqueous solution: A review[J]. Science of the Total Environment, 2020, 717: 137219. doi: 10.1016/j.scitotenv.2020.137219 [22] ZHU S, TIAN Z, WANG P, et al. The role of carbonate radicals on the kinetics, radical chemistry, and energy requirement of UV/chlorine and UV/H2O2 processes[J]. Chemosphere, 2021, 278: 130499. doi: 10.1016/j.chemosphere.2021.130499 [23] LI Q, LAI C, YU J, et al. Degradation of diclofenac sodium by the UV/chlorine process: Reaction mechanism, influencing factors and toxicity evaluation[J]. Journal of Photochemistry and Photobiology A:Chemistry, 2022, 425: 113667. doi: 10.1016/j.jphotochem.2021.113667 [24] GANIYU S O, ARSLAN M, GAMAL EL-DIN M. Combined solar activated sulfate radical-based advanced oxidation processes (SR-AOPs) and biofiltration for the remediation of dissolved organics in oil sands produced water[J]. Chemical Engineering Journal, 2022, 433: 134579. doi: 10.1016/j.cej.2022.134579 [25] PATIL P B, RAUT-JADHAV S. Intensification of degradation of acetamiprid by the combination of ultrasonic cavitation with other advanced oxidation processes (AOPs)[J]. Journal of the Indian Chemical Society, 2022: 100353. [26] KILIC M Y, ABDELRAHEEM W H, He X, et al. Photochemical treatment of tyrosol, a model phenolic compound present in olive mill wastewater, by hydroxyl and sulfate radical-based advanced oxidation processes (AOPs)[J]. Journal of Hazardous Materials, 2019, 367: 734-742. doi: 10.1016/j.jhazmat.2018.06.062 [27] ELHORRI A M, BELAID K D, ZOUAOUI–RABAH M, et al. Theoretical study of the azo dyes dissociation by advanced oxidation using Fukui indices. DFT calculations[J]. Computational and Theoretical Chemistry, 2018, 1130: 98-106. doi: 10.1016/j.comptc.2018.03.018 [28] 曹婷婷. Co(Ⅱ)-BiOCl@生物炭光催化降解酚类污染物的效能及机制[D]. 哈尔滨工业大学, 2021. [29] ZUPANC M, PETKOVŠEK M, ZEVNIK J, et al. Anomalies detected during hydrodynamic cavitation when using salicylic acid dosimetry to measure radical production[J]. Chemical Engineering Journal, 2020, 396: 125389. doi: 10.1016/j.cej.2020.125389 [30] HU R, ZHANG L, HU J. Study on the kinetics and transformation products of salicylic acid in water via ozonation[J]. Chemosphere, 2016, 153: 394-404. doi: 10.1016/j.chemosphere.2016.03.074 [31] WU Y, DENG L, BU L, et al. Degradation of diethyl phthalate (DEP) by vacuum ultraviolet process: influencing factors, oxidation products, and toxicity assessment[J]. Environmental Science and Pollution Research International, 2019, 26(6): 5435-5444. doi: 10.1007/s11356-018-3914-x -



 下载:
下载: