-
随着江河湖库等自然水体内渔业资源的过度开发及生态环境保护措施的实施,加上人们对鱼类水产需求的快速上升形成的供需矛盾的上升,如何脱离江河湖库等自然水体进行高效率的陆基水产养殖已成为满足发展与保护的最优途径之一[1-2]。其中,高密度集约化的陆基水产养殖因其具有节水节能及占地面积小等优势,已成为当前不断快速推广的一种重要养殖模式[3]。但作为高密度高投入的人工圈养系统,长期大量饵料的使用导致养殖系统内残饵及排泄物污染远高于传统江河湖库等自然水体内的水产养殖,因而残饵及排泄物污染已成为严重制约高密度陆基水产养殖的重要瓶颈问题之一[4]。有研究[5]表明,水产养殖中所投饵料只有不到50%保留在养殖动物体内,其余很大一部分会残留在养殖水体中,使得养殖水体中氮磷含量增加而造成养殖区域环境水质的快速恶化,一方面不仅影响养殖对象的健康生长和产品质量,另一方面,该养殖模式下外排的大量高浓度污染物及由此产生的生态环境破坏问题甚至因远高于传统的塘库养殖而将严重威胁当前这一产业的可持续发展[6-7]。
目前,在物理、化学和物化联合等方法上对水产养殖废水的净化处理已有不少研究,但仍存在投入及运行成本较高、污泥二次污染严重及排水水质难以持续达标等系列问题[8-9]。人工湿地(constructed wetlands, CWs)由于其施工、操作和维护较为简单,可通过植物的吸收、基质的过滤吸附以及系统内微生物的硝化反硝化等作用从养殖废水中有效地去除氮磷等污染物[10]。但如何高效稳定地去除氮磷仍是人工湿地亟需解决的重要问题[11]。基于此,本研究根据高密度陆基水产养殖外排废水的NO3−-N、NO2−-N、NH4+-N、TN、TP等特征污染物组成及浓度,构建了“巨菌草(Pennisetum sinese)生态浮床单元-美人蕉(Canna indica L.)垂直流人工湿地单元-狐尾藻(Myriophyllum verticillatum L.)沉水植物深度净化池单元”三级不同类型湿地单元结合的复合人工湿地系统,研究了不同干湿交替时间下该系统对模拟高密度陆基水产养殖外排废水中氮磷的净化效果及其植物效应,揭示了系统内不同类型湿地单元植物根系和填料中微生物的群落结构特征,并进一步探索该系统污染物去除与微生物群落的关系。相关研究结果旨在为高密度陆基水产养殖水体的生态化净化、循环化使用、周边水体富营养化的预防以及高密度陆基水产养殖业的健康可持续发展提供参考。
-
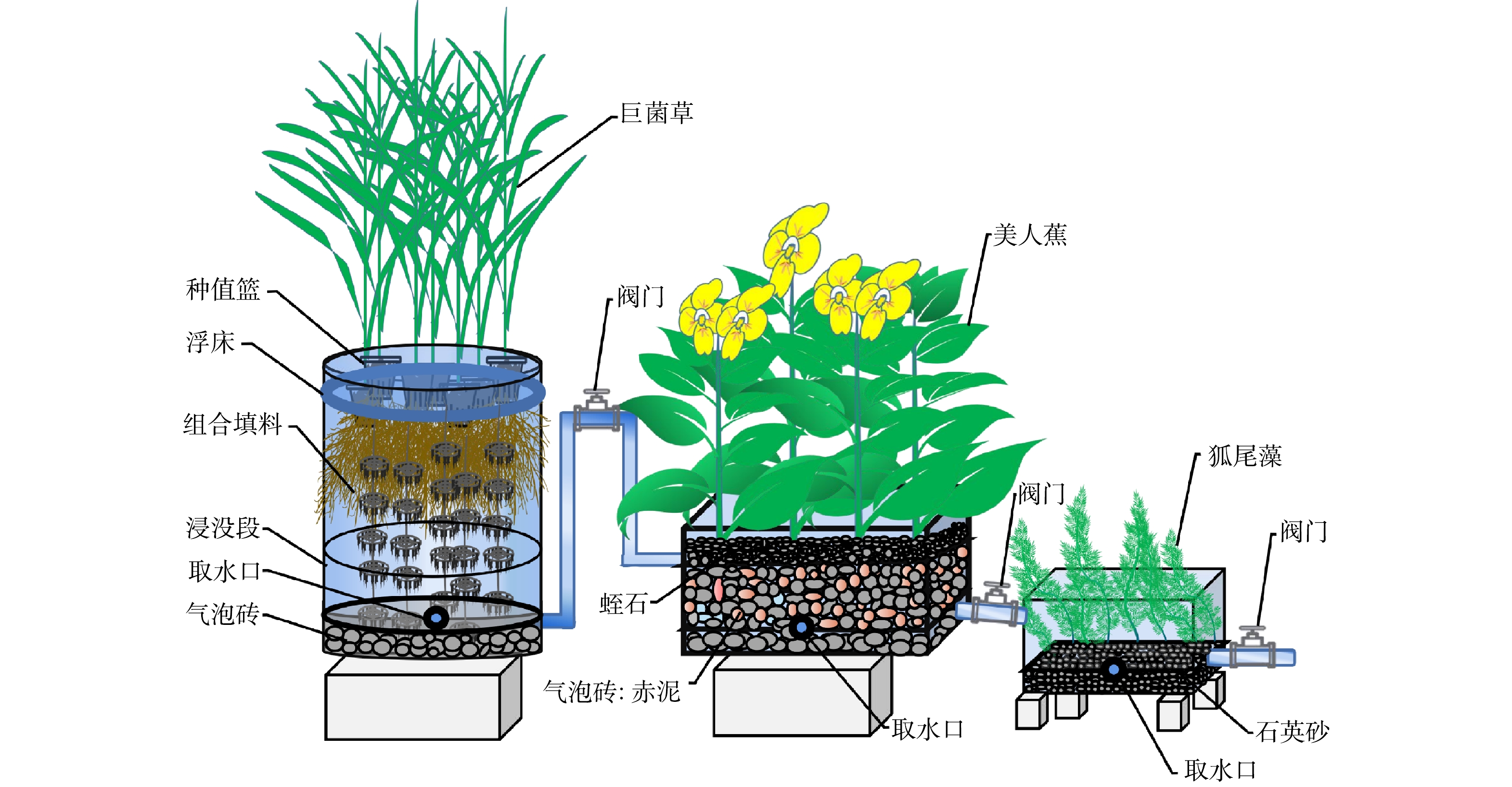
复合人工湿地系统如图1所示,其由三级不同类型湿地单元串联组成并设置3个平行实验。一级单元:巨菌草生态浮床单元,由100 L(下直径:40 cm,上直径:50 cm,桶高:62 cm)的塑料圆柱桶组成,其中填料高度为40 cm(底部Ф为25~50 mm气泡砖10 cm,中部为30 cm组合填料层),有效体积60 L,种植7株形态大小一致株高约为60 cm的巨菌草。一级单元还设置了水位为30 cm V的浸没段,通过PVC虹吸管道和阀门进行控制。二级单元:美人蕉垂直流人工湿地单元,由60 L(外径:长=54 cm,宽=42 cm,高=33 cm)的塑料箱组成,其中填料高度为28 cm(底部Ф为25~50 mm气泡砖8 cm,中部为Ф10~30 mm气泡砖:赤泥(质量比=2:1)15 cm,上部为Ф5~8 mm蛭石5 cm),种植8株形态大小一致株高约为30 cm的美人蕉。三级单元:狐尾藻沉水植物深度净化池单元,由50 L(外径:长=48.7 cm,宽=34 cm,高=26 cm)的塑料箱组成,种植16株形态大小一致株高约为15 cm的狐尾藻;其中填料高度为10 cm(底部Ф为2~4 mm石英砂10 cm)。
-
由于本研究重点为高密度陆基水产养殖外排废水中的氮磷的生态净化效果及其机理,而现实生产中无法长期提供水质和水量非常稳定的大量供试废水,由此将导致实验结果受进水稳定性的影响而波动较大,故根据多次分析高密度陆基水产养殖基地养殖池外排废水中NO3−-N、NO2−-N、NH4+-N、TN、TP等特征污染物组成及浓度的基础上,采用每日现配的人工废水来模拟高密度陆基水产养殖废水。为了尽可能接近养殖废水的水质特点,对贵州省兴义市某水产养殖有限公司高密度陆基水产养殖基地养殖池外排废水多次进行测定后,测得外排废水中特征污染物NO3−-N、NO2−-N、NH4+-N、TN、TP的平均质量浓度分别为6.65、0.76、4.61、12.06、6.01 mg·L−1。依据上述养殖废水中特征污染物的含量配制相应的模拟废水。主要配制成分为KNO3、NH4Cl、NaNO2、KH2PO4、葡萄糖、NaHCO3、混合微量元素0.1 ml·L−1 (0.5 g·L−1 NiCl2、0.5 g·L−1 MnSO4·4H2O、0.1 g·L−1 ZnSO4、0.1 g·L−1 Na2B4O7、0.05 g·L−1 CoCl2·6H2O、0.05 g·L−1 CuSO4·5H2O、0.04 g·L−1 Na2MoO4、7.34 g·L−1 CaCl2·2H2O、25.07 g·L−1 MgCl2·6H2O),污水pH为7.6左右。
-
分别对复合人工湿地系统中一级、二级和三级湿地单元进行挂膜启动,具体步骤为:首先,向一级湿地单元中加入60 L模拟废水,按照有效微生物(effective microorganisms, EM)菌液(江西天意集团)与水体积比为1:1 000的接种量投加EM菌液,充分混合均匀后进行间歇曝气,每天曝气12 h,每隔24 h换掉反应器中50%上清液,再补充投加1:1 000 EM菌液的污水继续曝气,之后重复前述操作。二级湿地单元接种1 L活性污泥(贵州省贵阳市某污水处理厂浓缩池)至反应器中,加模拟污水至反应器的有效体积(30 L),静置使悬浮的微生物与填料充分接触;第2天(即静置24 h后)开始连续进水实验,水力停留时间为24 h,排入三级湿地,静置24 h后排出。连续挂膜14 d至系统挂膜成功后,种植湿地植物,稳定7 d后,开始采样分析等相关实验。复合人工湿地系统实验进水流量为30 L·d−1,具体运行条件见表1。
-
实验期间,复合人工湿地系统中各级湿地单元每2 d取水样250 mL进行分析测定。其中,NO3−-N、NO2−-N、NH4+-N、TN、TP等按照国家环境总局编著的《水和废水监测分析方法》(第四版)进行测定[12]。
-
1)植物生理特性测定。在每个阶段结束末期随机采集系统中复合人工湿地系统中各级单元植物叶片及根系,分别采用愈创木酚比色法和TTC法对叶片POD酶活性和根系活力进行测定[13]。并测定各级单元植株株高,以观察植物长势。
2)植物鲜质量、干质量及氮磷含量测定。植物在每个阶段结束末期随机采集复合人工湿地系统中各级单元植物的地上部分(巨菌草、美人蕉各1株,狐尾藻3株),用滤纸吸干水分,测其鲜质量,于70 ℃下烘至恒重后称其干质量,随后研磨过100目筛。采用H2SO4-H2O2消解后,分别用奈氏试剂比色法、钼锑抗比色法测定植物全氮、全磷含量[14],并进行植物中氮磷含量的计算[15]。植物对氮、磷营养盐的去除负荷(g·m−2)根据式(1)计算[16]。
式中:
$ {{Q}}_{\text{1}} $ 为植物对氮、磷营养盐的去除负荷,g·m−2;$ {{C}}_{\text{1}} $ 和$ {{C}}_{\text{2}} $ 为植物样品在运行初期和末期的氮、磷含量, mg·g−1;$ {{M}}_{\text{1}} $ 和$ {{M}}_{\text{2}} $ 为植物样品在运行初期和末期的干质量,g;A为反应器表面积,m2。 -
填料全氮、全磷测定。收集各阶段运行结束时的湿地填料进行自然风干后研磨、粉碎过筛(100 目)备用,用H2SO4-HClO4消解后,分别用凯氏定氮法、钼锑抗比色法测定填料全氮、全磷含量[14]。填料对氮、磷营养盐的去除负荷根据式 (2)计算 [16]。
式中:
$ {{Q}}_{\text{2}} $ 为填料对氮、磷营养盐的去除负荷,g·m−2;ρ代表基质的密度,g·cm−3;V代表基质的体积,cm3;$ {{C}}_{\text{1}} $ 和$ {{C}}_{\text{2}} $ 代表运行初期和末期基质的氮、磷含量,mg·g−1;A代表反应器表面积,m2。 -
1)植物根系、填料微生物样品的采集。于阶段Ⅳ末期分别采集10 g的复合人工湿地系统中各级湿地单元植物根系和填料样品,将样品混匀,置于灭菌后的锥形瓶中,加入无菌磷酸缓冲盐溶液(PBS),没过样本。180 r·min−1,孵育20 min;倒出PBS溶液,再次加入无菌PBS溶液,180 r·min−1,孵育20 min;再次倒出PBS溶液,加入无菌PBS溶液,超声洗涤10 min,将3次洗涤液汇总,12 000 r·min−1离心10 min,收集沉淀保存于-80 ℃的冰箱中,送至上海美吉生物科技有限公司进行高通量测序。
2)高通量测序。根据E.Z.N.A.® soil DNA kit (Omega Bio-tek,Norcross,GA,美国)说明书进行细菌群落总DNA抽提,使用1%的琼脂糖凝胶电泳检测DNA的提取质量,使用NanoDrop2000测定DNA浓度和纯度,利用ABI GeneAmp® 9700型PCR扩增仪,选用338F (5’-ACTCCTACGGGAGGCAGCAG-3’) 和 806R (5’-GGACTACHVGGGTWTCTAAT-3’)作为引物对16S rRNA基因V3~V4可变区进行PCR扩增,然后用琼脂糖凝胶电泳(2%)检测PCR产物。使用NEXTflexTM Rapid DNA-Seq Kit(Bioo Scientific, 美国)进行建库,利用Illumina公司的Miseq PE300平台测序分析。
-
采用Microsoft Office Excel 2010和IBM SPSS 19.0 软件对常规污染物数据进行分析和处理,并进行单因素方差分析以检验数据间的差异性,且p<0.05具有显著性差异,采用Origin 2021软件进行作图。使用Fastp(version 0.20.0)软件对微生物原始测序序列进行质控,使用FLASH(version 1.2.7)软件进行拼接,过滤reads尾部质量值在20以下的碱基。使用UPARSE软件(version 7.1),根据97%的相似度对序列进行操作分类单元(operational taxonomic units,OTUs)聚类并剔除嵌合体,利用RDP classifier(version 2.2)对每条序列进行物种分类注释,比对SiIva 16S rRNA数据库(version 138),设置比对阈值为70%。使用Origin 2021绘制Bar图,利用R语言包绘制FAPROTAX(functional annotation of prokaryotic taxa,FAPROTAX) 功能热图,用于预测细菌群落的功能。
-
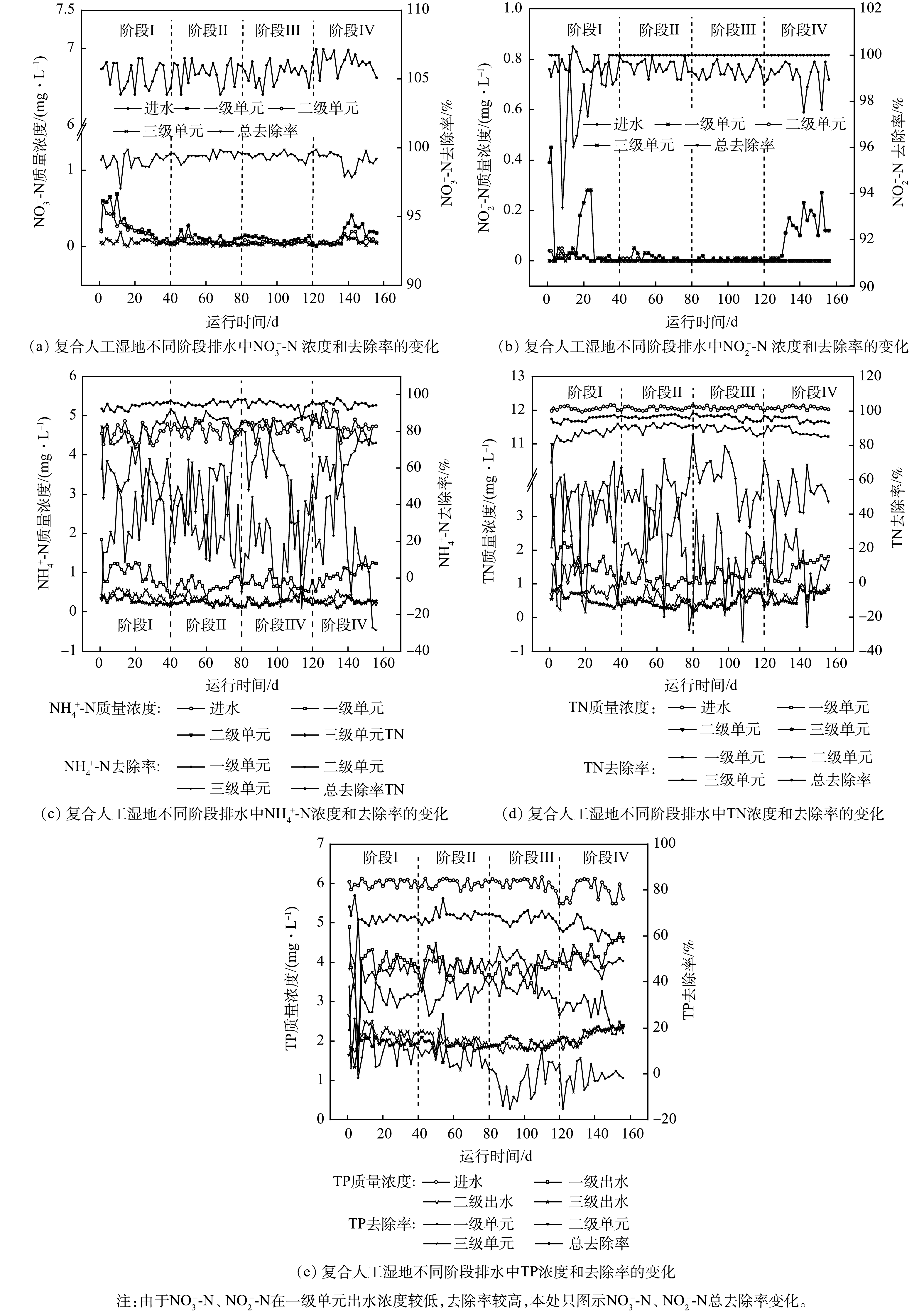
1)不同类型湿地单元对模拟废水中NO3−-N的净化作用。复合人工湿地系统各级单元对模拟废水中NO3−-N的净化效果如图2(a)所示,系统进水NO3−-N平均质量浓度为6.65 mg·L−1,平均出水质量浓度为0.04~0.06 mg·L−1,平均总去除率为99.04%~99.43%,各阶段间平均出水浓度差异不明显,说明随着反应时间的增加,在不同干湿交替时间下系统对NO3−-N具有较好的去除效果。其中,阶段Ⅰ第一、二级湿地单元NO3−-N平均出水浓度明显高于第三级单元(P<0.05)。可能是此时植株较小对硝酸盐吸收过剩,同时植物根系的泌氧能力对反硝化作用有一定的抑制作用,进而导致部分NO3−-N累积[17]。阶段Ⅳ后期出水浓度出现小幅升高,可能与植物生长代谢减慢及植物残体矿化过程会向介质中释放无机氮有关[18]。从各级单元对NO3−-N的去除率来看,NO3−-N的去除主要发生在一级单元,去除率均达到89.87%以上。这可能是一级单元浸没段的设置,使进水时具有充氧作用的体积减小,充水完成后整个反应器内的溶解氧进一步降低,有利于反硝化作用的进行[19]。
2)不同类型湿地单元对模拟废水中NO2−-N的净化作用。复合人工湿地系统各级单元对NO2−-N的净化效果如图2(b)所示,系统进水NO2−-N平均质量浓度为0.76 mg·L−1,经系统处理后的废水中几乎不含NO2−-N,平均总去除率为98.72%~100%。说明本研究中硝化细菌和反硝化细菌对NO2−-N的转化效率较高[17]。从去除率来看,一级单元各阶段对NO2−-N的平均去除率分别为87.99%、98.56%、99.12%、83.65%。由方差分析结果可知阶段Ⅱ、Ⅲ去除率显著高于阶段Ⅰ、Ⅳ(P<0.05),且在一级单元中,NO2−-N在阶段Ⅰ前期及阶段Ⅳ后期均有一定的积累,与NO3−-N的变化趋势相似,这可能与植物的生长状况有关。此外,NO2−-N可反映系统中反硝化反应是否完全进行,系统出水中几乎不含NO2−-N,说明污染水体中大部分TN可得到有效去除[20]。
3)不同类型湿地单元对模拟废水中NH4+-N的净化作用。复合人工湿地系统各级单元对NH4+-N的净化效果如图2(c)所示,系统进水NH4+-N平均质量浓度为4.61 mg·L−1,经系统处理呈现逐级降低的趋势,各阶段平均出水质量浓度为0.22~0.28 mg·L−1。同时,各阶段平均总去除率分别为93.89%、95.26%、94.40%、94.92%,方差分析显示各阶段平均总去除率差异性不明显(P>0.05)。由此可知,系统稳定后,不同干湿交替时间均能够将绝大部分的NH4+-N氧化。从去除率来看,一级单元去除效果最好,其4个阶段平均去除率为79.01%~85.06%,可能是生态浮床结构有利于植物通过根系释放氧气,同时其中组合填料也能够吸附一部分NH4+-N为硝化细菌提供附着生长的空间,从而促进微生物的硝化反应。而第二、三级单元对NH4+-N的去除率较低且相近,可能是氨氮进水负荷较低造成的[21]。另外,第三级单元在实验后期NH4+-N的去除率出现负值,去除效果稍有下降,这可能与沉水植物部分枝叶脱落而使去除作用小于释放作用有关[22]。
4)不同类型湿地单元对模拟废水中TN的净化作用。复合人工湿地系统各级单元对TN的净化效果如图2(d) 所示,系统进水TN平均质量浓度为12.06 mg·L−1。各阶段平均出水质量浓度分别为0.56、0.38、0.48、0.62 mg·L−1,总去除率则在92.23%~98.60%变化,说明系统对污水中TN有较好的去除效果。从去除率来看,系统中TN去除贡献度分别为一级单元(85.90%~91.02%)、二级单元(45.16%~59.07%)、三级单元(10.16%~31.82%),方差分析结果表明,一级单元去除率显著高于二、三级单元,与上述分析中NO3−-N、NO2−-N和NH4+-N主要发生在一级单元一致。研究表明,水体中NO3−-N 、NH4+-N经植物吸收、填料吸附及填料和植物根际附着的微生物(硝化、反硝化细菌)作用等也可促进TN的去除[23]。说明TN在经过3级湿地单元的植物吸收转化、填料吸附固持及微生物降解转化等作用后有明显的去除效果。
5)不同类型湿地单元对模拟废水中TP的净化作用。复合人工湿地系统各级湿地单元对TP的净化效果如图2(e)所示,系统进水TP平均质量浓度为6.04 mg·L−1,经系统处理后各阶段平均出水质量浓度为1.85~2.19 mg·L−1,总去除率在56.85%~77.50%变化。从去除率来看,TP的去除主要发生在二级单元,平均去除率为43.12%~49.95%,这可能与二级单元的填料气泡砖和赤泥中含有铁、铝、钙等离子有关。具有高磷结合能力的过滤介质是使磷去除效果增加的最佳策略,磷酸根可与铁、铝、钙等离子结合形成溶解度较低的磷酸铁、磷酸铝及不溶性的磷酸钙沉淀,且微生物和植物的存在可以促进此过程[24]。而第一级单元中磷的去除效果不佳,可能与进水TP浓度较高,组合填料及植物对TP的去除效果有限有关。第三级单元则可能是NO3−-N、NH4+-N等浓度较低而TP浓度较高,不利于狐尾藻的生长,从而影响了植物对水体中磷的吸收。此外,隗岚琳等[18]研究发现,在好氧情况下人工湿地中微生物对磷的去除率总体较低,且这部分磷会因为微生物的存活与否处于不断吸收和释放的动态过程中。
-
1)不同类型湿地单元内湿地植物的生物学特性及生理特性变化。湿地植物是复合人工湿地系统中影响氮磷生态净化效果的关键因素之一。为探究系统中不同类型湿地单元内特征污染物净化过程中湿地植物的生长特性及生理特性的变化规律,每个阶段实验结束时,对不同类型湿地单元内植物株高、根系活力、叶片POD酶活性进行测定,结果如表2所示。
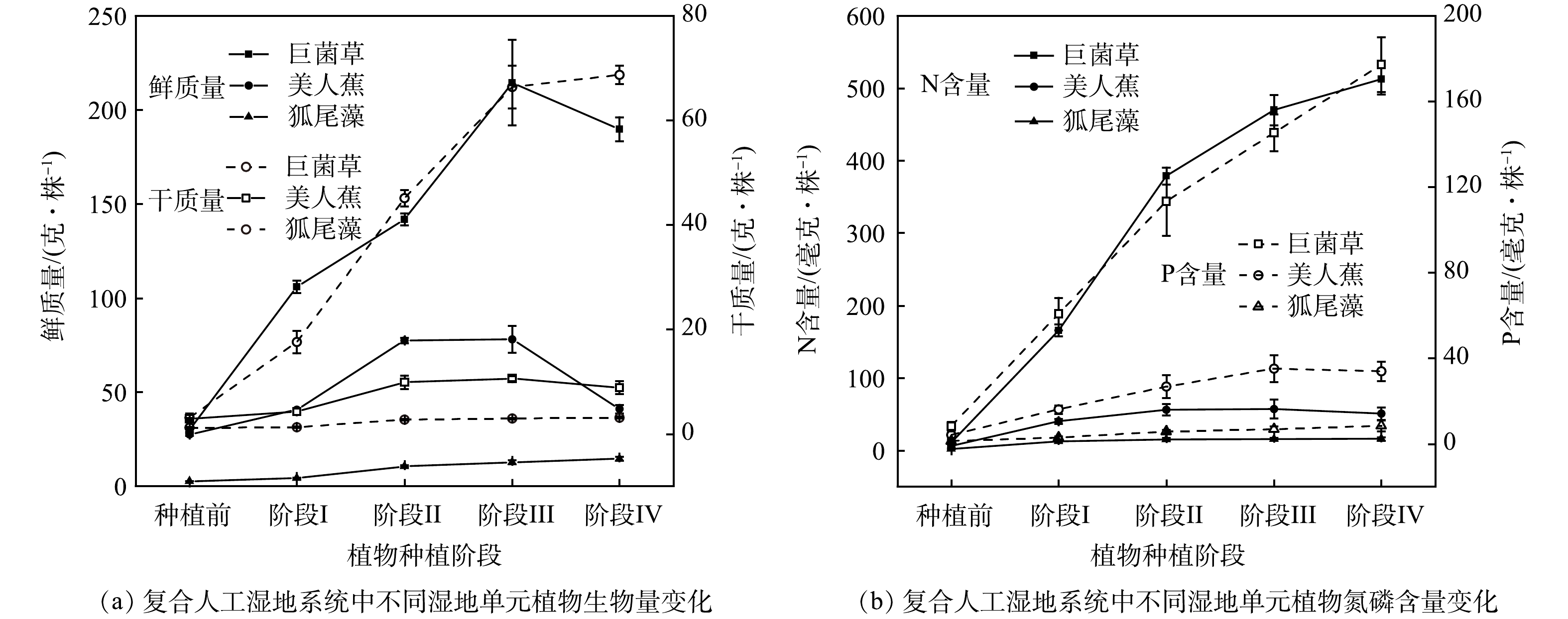
由表2可知,复合人工湿地系统中各级单元3种类型植物株高呈现先快速后缓慢的生长趋势,但狐尾藻在反应后期出现了凋亡现象,株高降低。各植物根系活力均在阶段Ⅳ随季节变化略微降低。其中巨菌草在各阶段的根系活力显著高于美人蕉和狐尾藻(P<0.05),一方面与湿地系统中不同类型植物品种的种间差异以及不同湿地单元间污染物浓度的递减有关,另一方面也可能与植物种植在生态浮床上有利于根系的生长有关[25]。第二、三级单元则是营养盐浓度较低,植物生长受限,根系活力也相应较低。此外,王俊力等[26]发现根系对外界的应激反应表现为根系活力先快速提高加强代谢来减少伤害,但随着胁迫时间的增加,植物本身储存物质消耗加剧,根系活力又呈下降趋势,与本研究结果相似。同时,各植物的叶片POD酶活性呈现逐级降低的趋势,且存在显著差异(P<0.05)。说明随着水质的改善,植物受逆境伤害的程度逐级降低,植物净化能力表现为巨菌草>美人蕉>狐尾藻,这与系统各级湿地单元水中污染物的浓度变化规律一致,也与陈永华等[27]发现植物POD酶活性随污染物浓度逐渐降低而减小的结果相似。
2)不同类型湿地单元内植物生物量及植物体内氮、磷含量的变化。复合人工湿地系统运行过程中不同阶段各级单元植物的地上部分生物量及植物体内氮磷含量变化如图3所示,总体上,不同阶段各级单元植物氮磷含量随着植物的生长而累积,且植物中氮磷含量随污染物浓度变化逐级减少。其中,一级湿地单元中巨菌草生物量和氮磷含量显著高于二级湿地单元中的美人蕉和三级湿地单元中的狐尾藻(P<0.05),一方面与湿地系统中不同类型植物的品种、吸肥特性的种间差异以及不同湿地单元间污染物浓度的递减有关,另一方面也可能是生态浮床结构及干湿交替的运行方式促进植物根部细胞的有氧呼吸,使得植株生长健壮且迅速,表现出较高的植物生物量,从而具有较高的植物氮磷吸收量[15]。ZHU等[28]研究认为湿地植物氮、磷吸收量与其生物量呈极显著正相关,这可能也是巨菌草氮磷含量较高的原因之一。美人蕉和狐尾藻则因为污染物浓度逐渐降低且生物量较低,故吸收的氮磷较少。
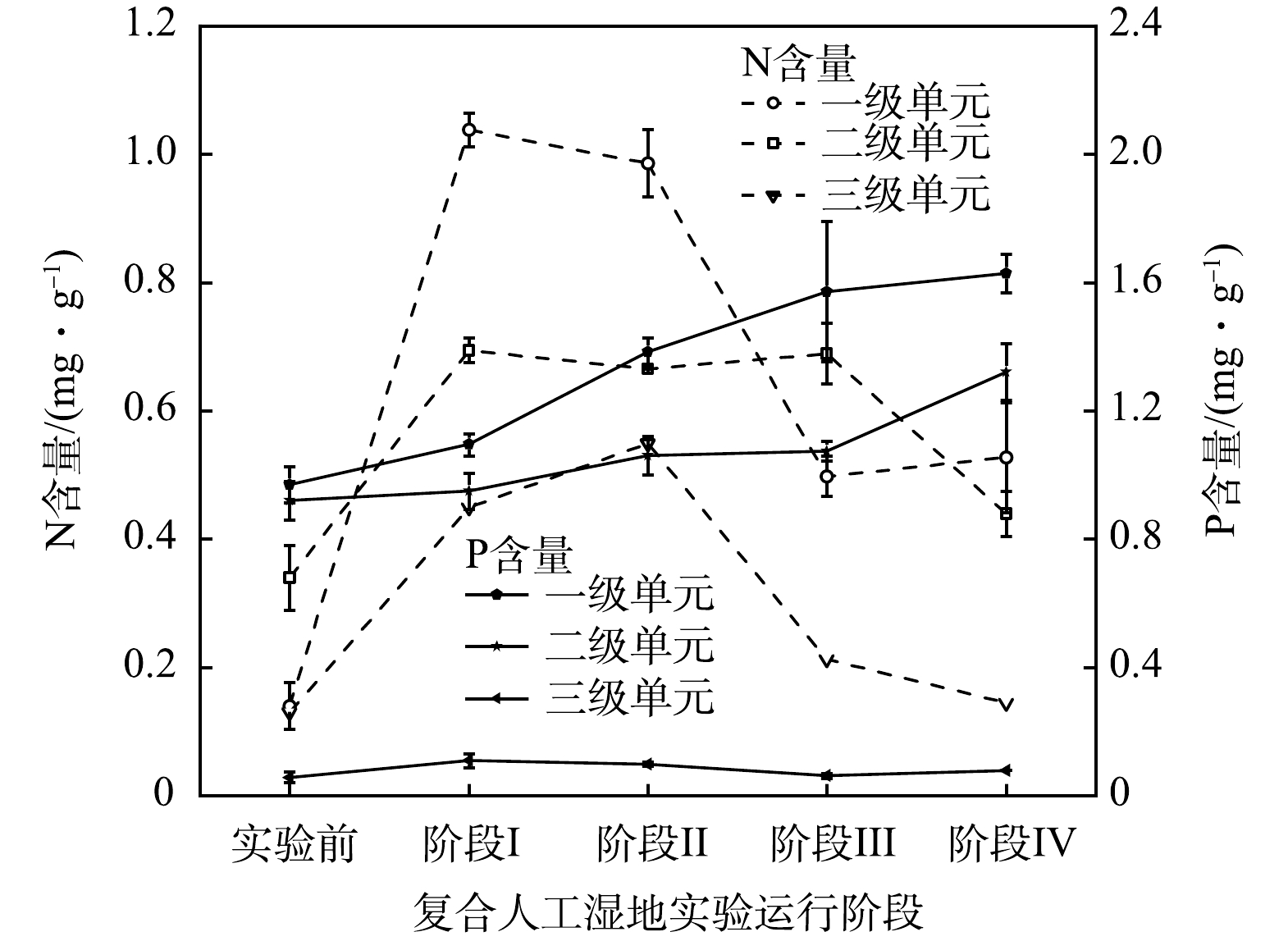
3)不同类型湿地单元内填料氮磷含量的变化。为量化基质对系统不同湿地单元营养盐去除的贡献,各阶段末期分别采集一级湿地组合填料和底部气泡砖、二级湿地填料、三级湿地石英砂,检测其氮磷含量的变化。如图4所示,除阶段Ⅲ外,各级湿地单元填料中全氮、全磷含量均沿流向逐级降低。这可能是因为进水负荷逐级减少及植物的生长代谢能力逐渐降低造成的。DU等[29]也发现基质吸附对TN去除的贡献随着运行时间的推移而逐渐降低,与本研究结果相似。此外,一、二级湿地单元填料种类较多,对磷的吸附作用更强。同时随着反应时间增加,微生物量增加及植物生长,在其协同作用下对磷的吸附转化逐渐加强。而三级单元填料为单一的石英砂,其主要物成分为SiO2,缺少铁、铝等游离金属阳离子对PO43-的化学沉淀作用,且基质会通过影响微生物、植物、环境理化性质等间接影响人工湿地水质净化的效果[30]。
-
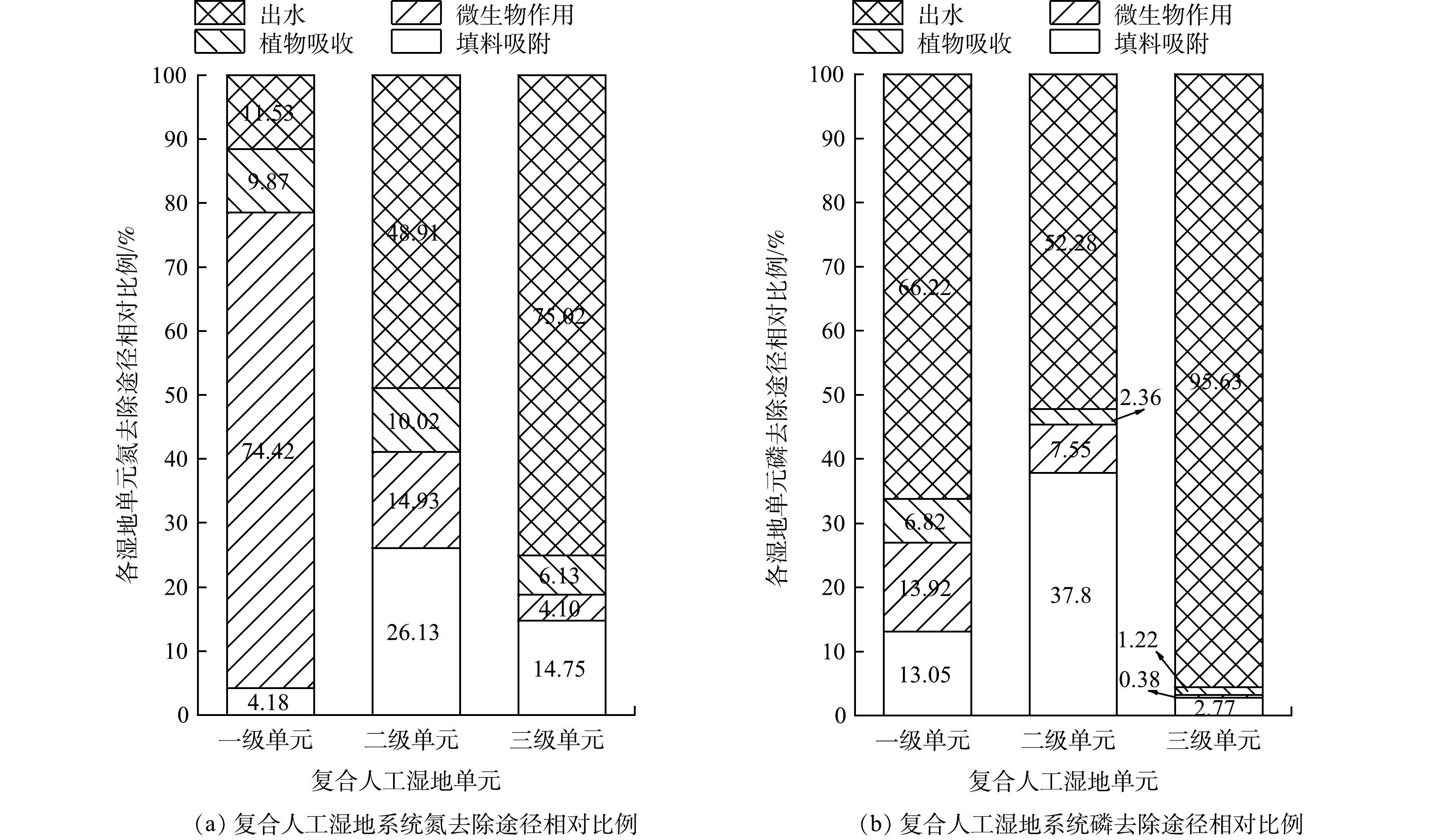
人工湿地去除污水或废水中氮磷的途径包括填料的吸附作用、植物的吸收和利用、微生物作用、排水等[31-32]。运行结束阶段湿地系统中各单元的填料吸附、微生物作用、植物吸收和出水的氮磷去除占比如图5所示。如图5(a)所示,在湿地系统的一级单元中,微生物作用占该单元氮含量总负荷最高约74.42%,填料吸附氮最低约占4.18%。这可能是一级单元的组合填料及巨菌草发达的根系有利于微生物的附着,而微生物作用是氮去除主要的贡献者[33],因此,微生物作用对总氮去除负荷占比较大。同时,一级单元为浮床单元,浮床系统中的植物能够直接从水体中吸收氮元素,降低系统中的氮浓度,从而减少了底部基质需要承受的氮负荷[25]。出水中的氮含量只占总负荷的11.53%,说明氮的去除主要发生在一级单元。在二级单元中 ,氮含量总负荷分别为出水(48.91%)>填料吸附(26.13%)>微生物作用(14.93%)>植物吸收(10.02%)。在三级单元中,氮含量总负荷分别为出水(75.02%)>填料吸附(14.75%)>植物吸收(6.13%)>微生物作用(4.10%)。三级单元去除氮的作用较弱的原因可能是,三级单元中氮元素含量较低,且其填料基质为粒径较小的石英砂,导致该单元内部系统孔隙率小,系统局部可能会形成堵塞,从而影响了湿地的运行[30],弱化了填料、植物及微生物各自独立及协同作用对氮的去除效果。
如图5(b)所示,在湿地系统的各级单元中,出水中的磷含量占总负荷均最高且比列大于其他几种作用之和。其次为填料的吸附,说明在湿地中磷的去除主要依靠填料的吸附作用[34-37]。一级、二级和三级单元中微生物作用去除磷分别占各单元总负荷的13.92%、7.55%和0.38%,一级、二级和三级单元中植物吸收去除磷仅分别占各单元总负荷的6.82%、2.36%和1.22%。沈莹等[38]研究了不同尺度潜流人工湿地对污染河水的净化机制,结果表明植物在湿地氮磷去除中的贡献率仅占8.80%,崔理华等[39]研究了人工湿地系统对污水磷的净化效果,结果表明植物摄取作用仅占去除率的1%~3%,说明植物不是去除磷的最主要因素[40],与本文研究结果相似。以上研究说明,磷的去除是填料吸附、植物吸收和微生物协同作用的结果,大多数情况下,磷的去除主要靠基质的沉淀和吸附作用[41]。
-
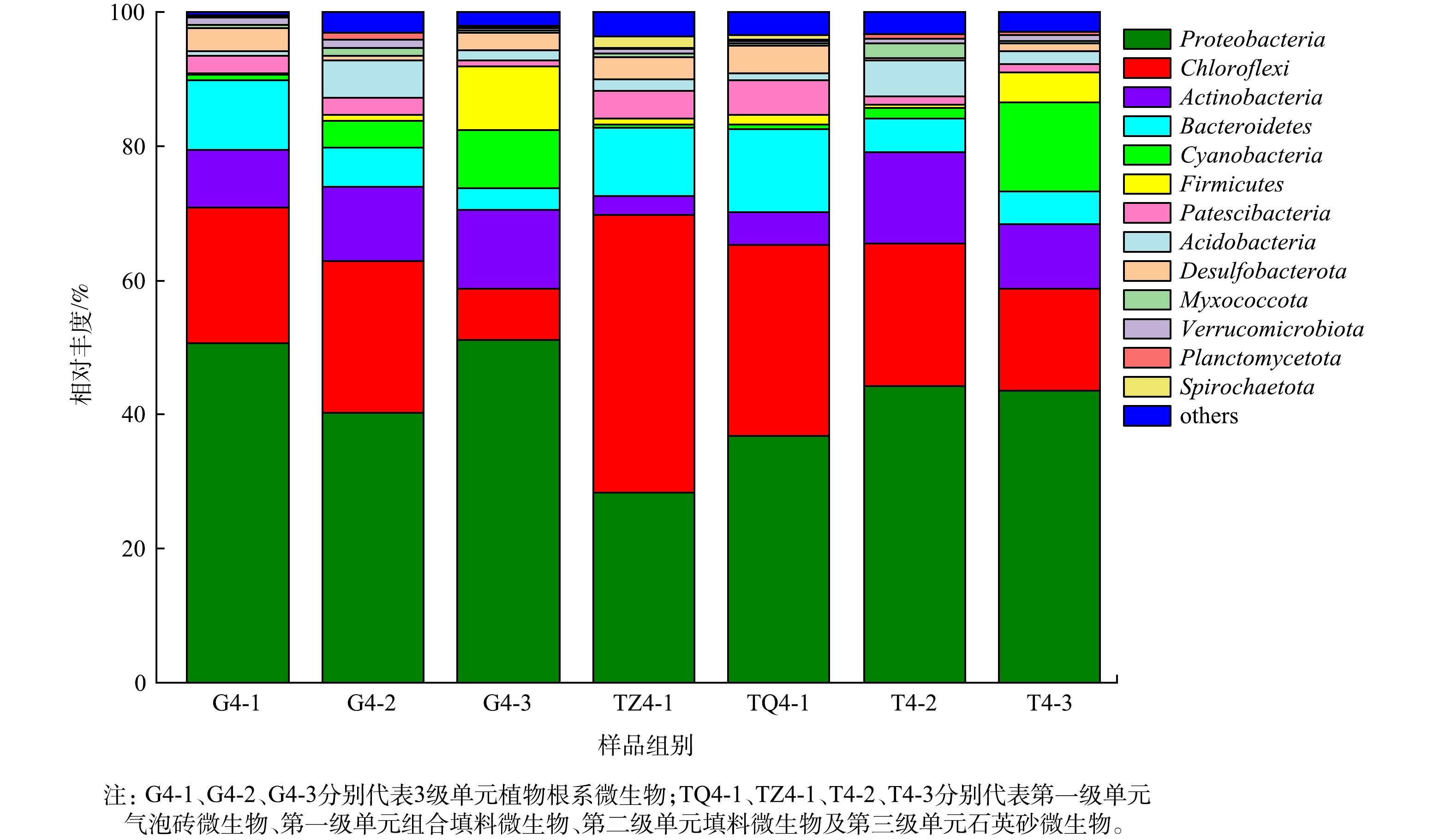
1)不同类型湿地单元微生物群落结构分析。微生物作为人工湿地中的重要组成部分,对污染物的去除和生物地球化学循环起着关键作用。为考察复合人工湿地系统中微生物的群落结构特征,对阶段Ⅳ末期各级湿地单元的植物根系及填料微生物按照最小样本序列数进行抽平后,共得到43 173条有效序列。将获取的序列在门、属水平上进行分类分析。如图6所示,将门水平丰度小于 0.01% 的细菌合并为others,各级单元植物根系和填料微生物优势菌门相似,共同优势菌门主要有Proteobacteria、Chloroflexi、Actinobacteria、Bacteroidetes,占全部序列的73.14%~89.84%。此外,第三级单元还存在Cyanobacteria、Firmicutes等优势菌门。其中,Proteobacteria作为各级单元的第一优势菌门,其在生态浮床和沉水植物单元中植物根系的相对丰度高于填料,分别为G4-1(50.64%)、TQ4-1(36.72%)、TZ4-1(28.30%)和G4-3(51.18%)、T4-3(43.48%),在垂直流湿地单元中植物根系G4-2 (40.30%)和填料T4-2 (44.13%)丰度相似。
有研究表明,Proteobacteria中包括很多能够脱氮除磷的细菌,且大多数反硝化菌属于该菌门[42],为系统中氮磷去除起着重要作用。各湿地单元中还聚集了大量Chloroflexi菌门,在植物根系和填料中相对丰度分别为7.60%~22.62%、15.22%~41.24%,在废水营养盐的去除过程中发挥着重要作用[43]。Actinobacteria和Bacteroidetes也占有一定的比例,据报道,Bacteroidetes可与Actinobacteria共同担负污染物的有效去除[44]。此外,Bacteroidetes与有机质的降解和氮矿化密切相关,其中大多数菌属都具有反硝化能力,这为湿地系统中较高的硝酸盐去除提供了微生物依据[45]。
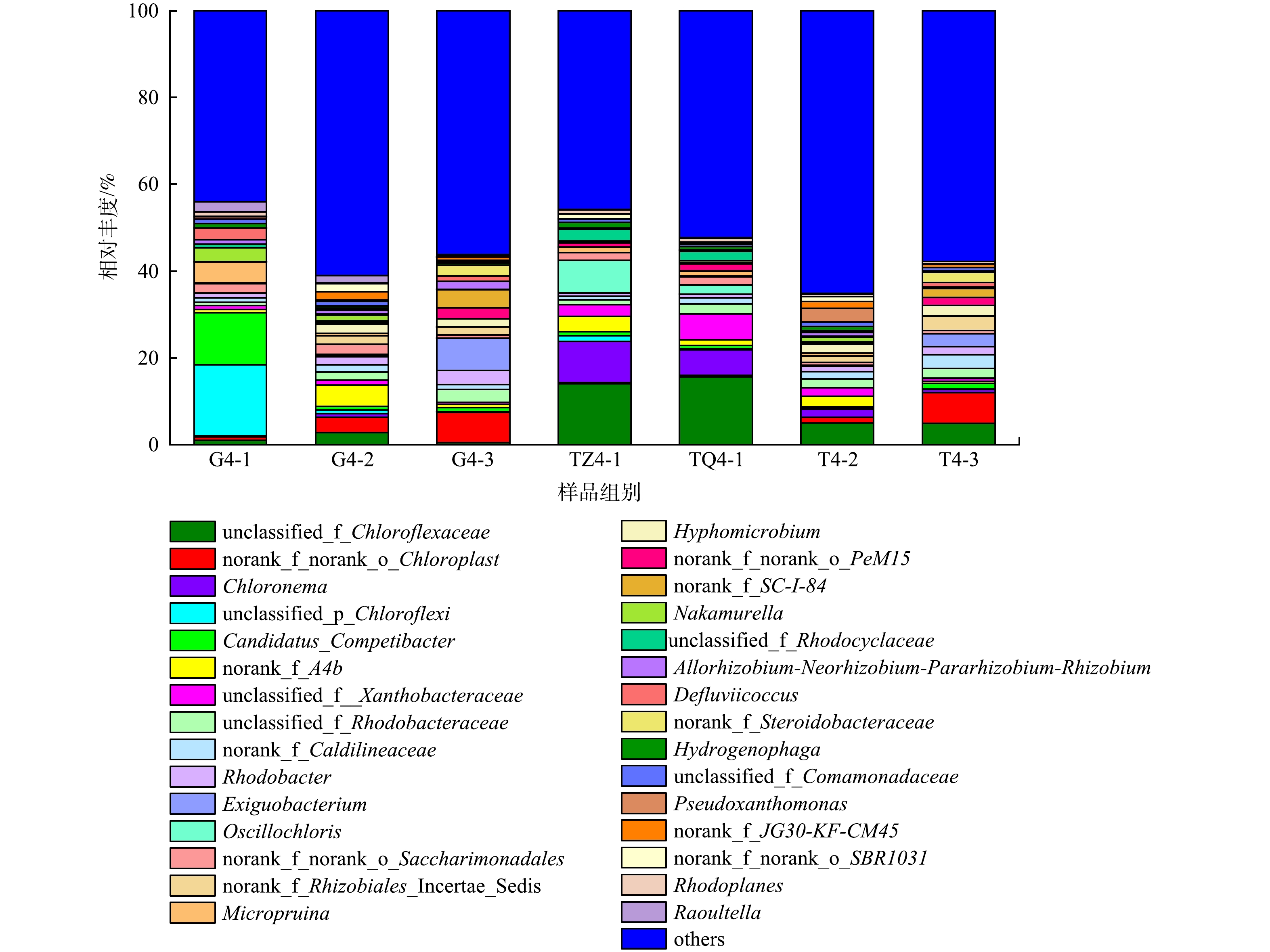
在属水平上,对相对丰度前30名的细菌组成进行分析,结果如图7所示。可见,一级单元优势菌属明显多于二、三级单元,且二、三级单元细菌属结构相似。其中,unclassified_f__Chloroflexaceae、Chloronema在填料中占据绝对优势,特别是一级单元,相对丰度最高达15.51%、9.53%,可能与根系和填料的物理化学环境不同有关;unclassified_p__Chloroflexi、Candidatus_Competibacter主要存在于一级单元根系,相对丰度分别高达16.34%、12.00%,且Candidatus_Competibacter属是反硝化聚糖菌属,缺氧/好氧交替运行可能是该菌属积累并成为优势菌的关键因素,对脱氮有一定作用[46]。
另外,该复合人工湿地系统中存在大量具有脱氮除磷功能的优势菌属。其中,一级单元含有脱氮除磷菌Micropruina(1.20%~4.90%)、反硝化菌Defluviicoccus(0.09%~2.61%)和Hydrogenophaga (1.01%~1.38%)等,其促进了系统内污染物的去除[16,47]。二级单元存在Hyphomicrobium(2.06%)、Pseudoxanthomonas(0.47%~3.20%)和Rhodobacter(1.82%~3.33%)等[48-49] 反硝化菌,三级单元存在Exiguobacterium(2.92%~7.41%)、Hyphomicrobium(1.77%~2.52%)等反硝化细菌[50],对NO3−-N、NO2−-N、NH4+-N、TN去除起主要作用。这也是第二、三级单元氮素得到进一步去除的原因。因此,通过该湿地系统中各级单元优势菌群的协同作用,系统对模拟高密度陆基水产养殖外排废水中特征污染物有较好的净化效果。
2)复合人工湿地系统细菌群落功能。揭示复合人工湿地系统细菌群落的生态功能,有助于加深对人工湿地处理养殖废水中细菌群落生化过程的认识。FAPROTAX数据库是基于可培养菌的文献证据整理的原核生物功能注释数据库,将原核生物分类群(如属或种)映射到代谢或其他生态相关功能(如硝化、反硝化),其包含了4 600多个原核微生物的80多个功能分组7 600多条功能注释信息,可较好地预测环境样本中的原核生物的生物化学循环过程[51]。
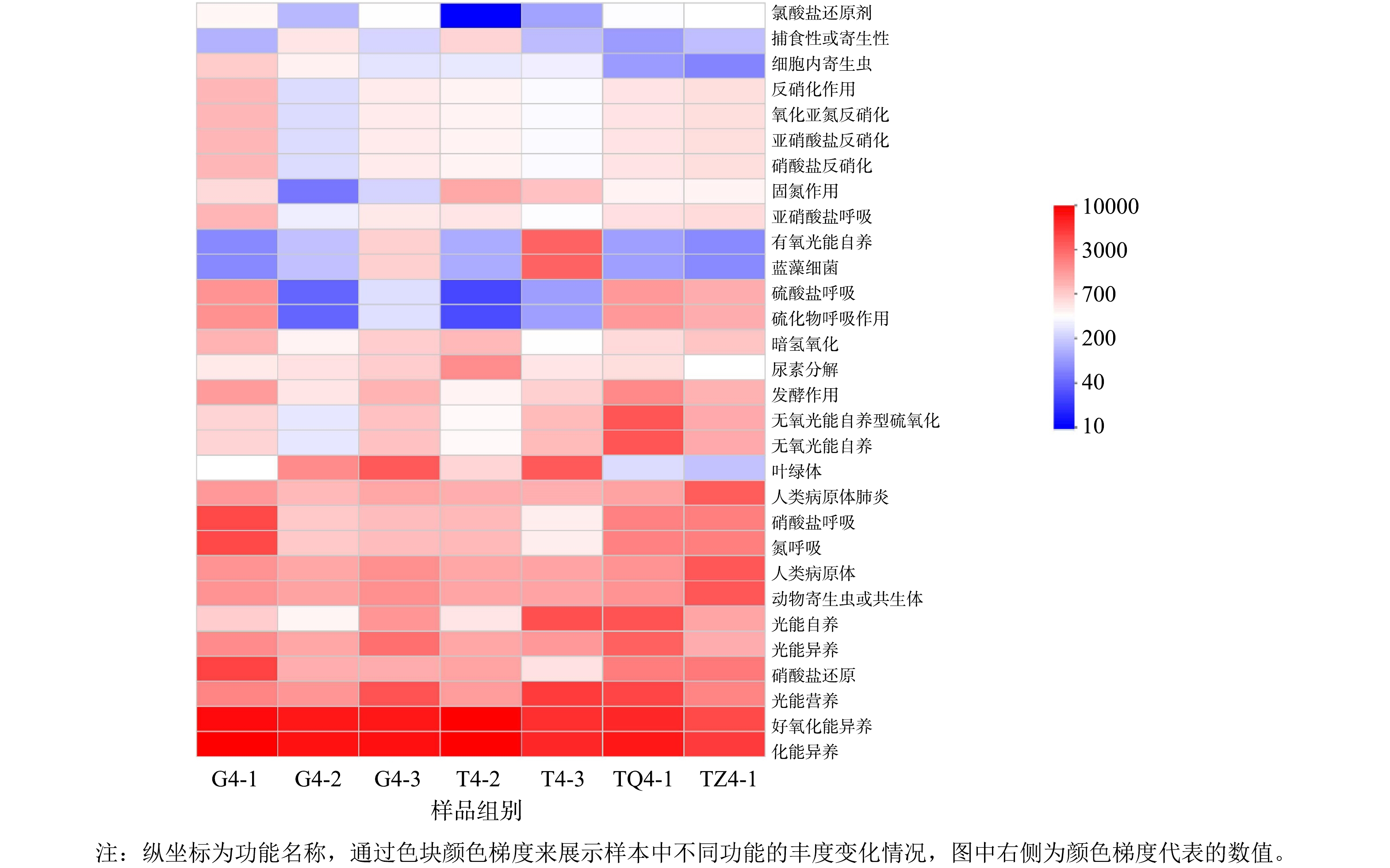
基于FAPROTAX数据库功能注释,本研究在不同类型湿地单元的细菌群落中共检测到54个功能群组,其中前30种功能热图如图8所示。结果表明,化能异养型(12.43%~27.19%)和好氧化能异养型(10.11%~26.46%)细菌功能占比较高,可消化分解养殖废水中的有机物[52]。与氮循环相关的功能如:硝酸盐还原、固氮作用、硝酸盐呼吸、亚硝酸盐呼吸、亚硝酸盐反硝化、氧化亚氮反硝化和硝酸盐反硝化功能等总相对丰度较高(0.09%~29.04%),表明在该复合人工湿地污水处理系统中氮循环相关的细菌类群参与了NO3−-N、NO2−-N、NH4+-N、TN的去除[52],特别是一级单元与氮循环相关的功能丰度占比较大(G4-1:29.04%、TZ4-1:23.06%、TQ4-1:16.66%)。这与前述一级单元是污染物的主要贡献者一致。此外,干湿交替形成的好氧-缺氧环境有利于反硝化作用的进行,如亚硝酸盐呼吸、亚硝酸盐反硝化、氧化亚氮反硝化和硝酸盐反硝化等功能的存在,与图7中反硝化菌属较多结果一致。
-
1)高密度陆基水产养殖外排废水中特征污染物组成为NO3−-N、NO2−-N、NH4+-N、TN、TP,其质量浓度分别为6.65、0.76、 4.61、12.06、6.01 mg·L−1。复合人工湿地系统在不同干湿交替时间下,三级不同类型湿地单元对模拟高密度陆基水产养殖外排废水的污染物进行转化和降解,取得了较好的生态净化效果。系统中NO3−-N、NO2−-N、NH4+-N、TN、TP的平均总去除率分别为99.04%~99.43%、98.72%~100%、93.89%~95.26%、92.23%~98.60%、56.85%~77.50%。其中氮的去除主要发生在巨菌草生态浮床单元,磷的去除主要发生在美人蕉垂直流湿地单元。
2)复合人工湿地系统中不同类型湿地单元内植物特征表现出较大差异。其中,巨菌草(生态浮床单元)的根系活力、POD酶活性、生物量均明显优于美人蕉(垂直流湿地单元)和狐尾藻(沉水植物池单元),且各植物中N、P含量均逐级减少,与系统各级单元排水中污染物浓度的变化规律一致。复合人工湿地系统中氮的去除主要发生在一级单元,微生物作用(74.42%)是氮去除主要的归趋途径;磷的去除主要发生在一级和二级单元,填料吸附(13.05%,38.70%)是磷去除的主要归趋途径。
3)复合人工湿地系统中各湿地单元植物根系及填料微生物优势菌门结构相似,但相对丰度存在差异,共同优势菌门有Proteobacteria、Chloroflexi、Actinobacteria、Bacteroidetes。属水平上各级单元中主要优势菌属存在差异,且在生态浮床单元中相对丰度较高,主要有unclassified_f__Chloroflexaceae、Chloronema、unclassified_p__Chloroflexi、Candidatus_Competibacter等。此外,复合系统中优势功能菌Micropruina、Rhodobacter、Exiguobacterium等的协同作用,对废水中特征污染物有较好的生态净化效果。FAPROTAX数据库功能注释发现,样本中化能异养型和好氧化能异养型细菌功能占比较高,同时存在大量与氮循环相关的功能类群,解释了该复合人工湿地系统对包括NO3−-N、NO2−-N、NH4+-N及TN的平均去除率一直维持非常高水平的原因。
复合人工湿地对陆基水产养殖废水中氮磷的净化及其微生物群落特征
Nitrogen and phosphorus purification from land-based aquaculture wastewater and microbial community characteristics of the combined constructed wetland
-
摘要: 高密度陆基水产养殖外排废水中的氮(N)、磷(P)浓度往往远高于传统的塘库养殖而对周边环境带来更大的压力。为探究复合人工湿地系统对陆基水产养殖外排废水中N、P的净化效果及其微生物群落特征,本文以“高效生态浮床单元-垂直流人工湿地单元-沉水植物池单元”三级不同类型湿地单元构成的复合人工湿地系统为研究对象,研究不同干湿交替时间下该系统对模拟高密度陆基水产养殖外排废水中N、P的净化效果,并揭示系统内各湿地单元植物根系和填料中微生物群落的结构特征。结果表明,复合人工湿地系统在不同干湿交替时间下对NO3−-N、NO2−-N、NH4+-N、TN、TP的平均去除率分别为99.04%~99.43%、98.72%~100%、93.89%~95.26%、92.23%~98.60%、56.85%~77.50%。各湿地单元植物中不同类型植物分析结果表明,高效生态浮床单元中巨菌草的根系活力、POD酶活性、生物量均明显优于垂直流人工湿地单元中的美人蕉和沉水植物池单元中的狐尾藻(P<0.05),且植物中N、P含量呈现沿流向逐级减少的趋势,与各湿地单元排水中的污染物浓度所呈现的逐级降低的规律相一致。各湿地单元N、P去除途径的分析结果表明,一级单元微生物作用(74.42%)和一级、二级单元填料吸附 (13.05%和38.70%) 分别是N和P元素的主要归趋途径。各湿地单元植物根系和填料中微生物群落分析结果表明,植物根系及填料微生物的共同优势菌门主要有Proteobacteria、Chloroflexi、Actinobacteria、Bacteroidetes。属水平上各级湿地单元存在的优势菌属存在明显差异,其中生态浮床单元优势菌属相对丰度最高,主要有Chloronema、unclassified_p__Chloroflexi、Candidatus_Competibacter等。基于FAPROTAX数据库功能预测结果表明,各湿地单元植物根系和填料中化能异养型(12.43%~27.19%)和好氧化能异养型(10.11%~26.46%)细菌功能群占优势,且氮循环相关功能的发现表明细菌在复合人工湿地系统除氮过程中起着关键作用。以上结果说明,经不同类型湿地单元功能菌群与湿地植物的协同作用,可使该系统对高密度陆基水产养殖外排废水中的特征污染物N、P具有较好的生态净化效果。Abstract: Compared with traditional pond aquaculture, the concentrations of nitrogen (N) and phosphorus (P) in the effluent of high-density land-based aquaculture are higher, which brings serious challenges to the surrounding environment. To explore the purification effect of N and P from land-based aquaculture wastewater and microbial community characteristics of combined constructed wetland, which was composed of high-efficient ecological floating bed unit - vertical flow constructed wetland unit - submerged plant pond unit, the purification effect of N and P in simulated high-density land-based aquaculture effluent at different dry-wet alternation times and the characteristics of microbial community structures in roots and fillers of each wetland unit were revealed. The results showed that the average removal rates of NO3−-N, NO2−-N, NH4+-N, TN and TP were 99.04%~99.43%, 98.72%~100%, 93.89%~95.26%, 92.23%~98.60% and 56.85%~77.50% by combined constructed wetland system at different dry and wet alternation times, respecively. Through the analysis of different types of plants in each wetland unit, the root activity, POD enzyme activity and biomass of Pennisetum sinese in the high-efficient ecological floating bed unit were significantly better than those of Canna indica L. in vertical flow constructed wetland and Myriophyllum verticillatum L. in submerged plants pond unit (p <0.05), respectively. In addition, the contents of N and P in plants gradually decreased along the flow direction, which was consistent with the law of pollutant concentrations in the drainage of each wetland unit. Through the analysis of the N and P removal pathways of each wetland unit, the microbial action (74.42%) of the primary unit was the main purification pathway of N, and the filler adsorption (13.05% and 38.70%) of the primary and secondary unit was the main N and P removal pathways. Through the analysis of microbial communities in plant roots and fillers of each wetland unit, the dominant bacterial at phylum level, such as Proteobacteria, Chloroflexi, Actinobacteria and Bacteroidetes, were concurrently discovered in plants root and filler microorganisms. However, the dominant bacteria at genus level in wetland units existed obvious differences, among them, the relative abundance of dominant bacteria genera (mainly Chloronema, unclassified_p__Chloroflexi, Candidatus_Competibacter etc.) in ecological floating bed units was the highest. Based on the FAPROTAX database function prediction, heterotrophic types (12.43%-27.19%) of chemical energy in roots and fillers of each wetland unit plant and aerobic chemoheterotrophy (10.11%-26.46%) were predominant, and the discovery of nitrogen cycle-related functions indicated that the bacteria played a key role in the nitrogen removal process of the combined constructed wetland system. Above all, the results indicated that under the synergistic interaction between the functional bacterial groups and wetland plants in different wetland units, the system had a good ecological purification effect on the characteristic pollutants of N and P in the external drainage of high-density land-based aquaculture.
-

-
表 1 实验运行方式
Table 1. Operation mode of experiment
阶段
(运行时间)处理单元 一级单元 二级单元 三级单元 阶段Ⅰ
(40 d)干/湿时间比8 h:16 h
第0~8 h控制水位30 cm,然后瞬时进水至水位50 cm停留至第24 h,瞬时出水至水位30 cm停留至第32 h,瞬时进水至水位
50 cm停留至第48 h,瞬时出水至水位30 cm(如此循环进出水)干/湿时间比16 h:8 h
第0~16 h排空水量,然后瞬时进水停留至第24 h,瞬时出水停留至第40 h,瞬时进水停留至第48 h,瞬时出水(如此循环进出水)淹没1 d 阶段Ⅱ
(40 d)干/湿时间比16 h:8 h
第0~16 h控制水位30 cm,然后瞬时进水至水位50 cm停留至第24 h,瞬时出水至水位30 cm停留至第40 h ,瞬时进水至水位50 cm停留至第48 h,瞬时出水至水位30 cm(如此循环进出水)干/湿时间比8 h:16 h
第0~8 h排空水量,然后瞬时进水停留至第
24 h,瞬时出水停留至第32 h,瞬时进水停留至第48 h,瞬时出水(如此循环进出水)淹没1 d 阶段Ⅲ
(40 d)干/湿时间比12 h:12 h
第0~12 h控制水为30 cm,然后瞬时进水至水位50 cm停留至第24 h,瞬时出水至水位30 cm停留至第36 h,瞬时进水至水位
50 cm停留至第48 h,瞬时出水至水位30 cm(如此循环进出水)干/湿时间比12 h:12 h
第0~12 h排空水量,然后瞬时进水停留至第24 h,瞬时出水停留至第36 h,瞬时进水停留至第48 h,瞬时出水(如此循环进出水)淹没1 d 阶段Ⅳ
(40 d)同阶段Ⅲ 同阶段Ⅲ 同阶段Ⅲ 表 2 不同类型湿地单元内湿地植物生物学特性及生理特性变化
Table 2. Variations of wetland plant biological characteristics and physiological characteristics in different types of wetland units
实验阶段 株高/cm 根系活力/(mg·(g·h)−1) POD酶活性/(U·g−1) 巨菌草 美人蕉 狐尾藻 巨菌草 美人蕉 狐尾藻 巨菌草 美人蕉 狐尾藻 阶段Ⅰ 130.67±3.06 50.09±3.49 27.00±4.08 8.94±1.12 1.59±0.29 4.6±0.63 472.53±5.00 285.71±34.97 5.99±0.63 阶段Ⅱ 149.00±5.04 71.20±7.05 40.10±3.30 27.79±5.45 1.33±0.20 3.03±0.64 446.33±15.02 351.75±28.12 11.99±0.64 阶段Ⅲ 156.67±4.66 85.00±4.92 40.98±4.02 40.98±4.02 0.76±0.10 0.9±0.04 447.1±14.37 327.47±21.88 46.43±7.46 阶段Ⅳ 164.00±6.70 89.00±8.97 33.00±2.69 35.55±4.91 1.33±0.24 0.88±0.12 420.03±17.23 159.23±20.34 37.93±5.96 -
[1] AGUILAR-ALARCON P, GONZALEZ S V, SIMONSEN M A, et al. Characterizing changes of dissolved organic matter composition with the use of distinct feeds in recirculating aquaculture systems via high-resolution mass spectrometry[J]. Science of the Total Environment, 2020, 749: 142326. doi: 10.1016/j.scitotenv.2020.142326 [2] 马东海. 浅谈陆基水产养殖技术[J]. 农业与技术, 2012, 32(6): 105. doi: 10.3969/j.issn.1671-962X.2012.06.079 [3] 陈斌. 陆基圆池循环水养殖模式的优势[J]. 当代水产, 2022, 47(1): 80-81. doi: 10.3969/j.issn.1674-9049.2022.01.024 [4] WANG X X, OLSEN L M, REITAN K I, et al. Discharge of nutrient wastes from salmon farms: environmental effects, and potential for integrated multi-trophic aquaculture[J]. Aquaculture Environment Interaction, 2012, 2(3): 267-283. doi: 10.3354/aei00044 [5] DAUDA A B, AJAD A, TOLA-FABUNMI A S, et al. Waste production in aquaculture: Sources, components and managements in different culture systems[J]. Aquaculture and Fisheries, 2019, 4(3): 81-88. doi: 10.1016/j.aaf.2018.10.002 [6] YANG P, ZHAO G H, TONG C, et al. Assessing nutrient budgets and environmental impacts of coastal land-based aquaculture system in southeastern China[J]. Agriculture, Ecosystems & Environment, 2021, 322: 107662. [7] NIMPTSCH J, WOELFL S, OSORIO S, et al. Tracing dissolved organic matter (DOM) from land-based aquaculture systems in North Patagonian streams[J]. Science of the Total Environment, 2015, 537: 129-138. doi: 10.1016/j.scitotenv.2015.07.160 [8] ABDUL L A, JING Y C, MOHD H Z M H, et al. Environmental impacts and imperative technologies towards sustainable treatment of aquaculture wastewater: A review[J]. Journal of Water Process Engineering, 2022, 46: 102553. doi: 10.1016/j.jwpe.2021.102553 [9] GOMES J M, SILVA J M, DUARRTE J L S, et al. Ecotoxicological evaluation of a fish farming effluent treated by Fenton oxidation and coagulation process[J]. Separation Science and Technology, 2020, 55(16): 2967-2976. doi: 10.1080/01496395.2019.1662808 [10] LOPARDO C R, ZHANG L, WILIAM J, et al. Comparison of nutrient retention efficiency between vertical-flow and floating treatment wetland mesocosms with and without biodegradable Plastic[J]. Ecological Engineering, 2019, 131: 120-130. doi: 10.1016/j.ecoleng.2019.01.024 [11] BAKHSHOODEH R, ALAVI N, OLDHAM C, et al. Constructed wetlands for landfill leachate treatment: A review[J]. Ecological Engineering, 2020, 146: 105725. doi: 10.1016/j.ecoleng.2020.105725 [12] 国家环境保护总局. 水和废水监测分析方法[M]. 第4版. 北京: 中国环境出版社, 2002. [13] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000. [14] 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000. [15] 郭鹤方, 甄志磊, 赵林婷, 等. 潮汐流-潜流人工湿地对城市污染水体中氮的去除[J]. 环境化学, 2021, 40(12): 3887-3897. doi: 10.7524/j.issn.0254-6108.2021053002 [16] 张晓一. 表面流人工湿地与复合型生态浮床对低污染水体氮磷的去除特性研究[D]. 上海: 上海交通大学, 2019. [17] GU X S, CHEN D Y, WU F, et al. Function of aquatic plants on nitrogen removal and greenhouse gas emission in enhanced denitrification constructed wetlands: Iris pseudacorus for example[J]. Journal of Cleaner Production, 2022, 330: 129842. doi: 10.1016/j.jclepro.2021.129842 [18] 隗岚琳, 刘东升, 廖雪珂, 等. 垂直潜流人工湿地低温净化效果及其与微生物作用关系[J]. 环境科学学报, 2021, 41(10): 4039-4048. doi: 10.13671/j.hjkxxb.2021.0115 [19] 胡沅胜, 赵亚乾, 赵晓红, 等. 实现高效自养脱氮的单级上流式多潮汐人工湿地[J]. 中国给水排水, 2015, 31(15): 127-132. doi: 10.19853/j.zgjsps.1000-4602.2015.15.032 [20] LIU W R, CHEN W J, YANG D H, et al. Functional and compositional characteristics of nitrifiers reveal the failure of achieving mainstream nitritation under limited oxygen or ammonia conditions[J]. Bioresource Technology, 2019, 275: 272-279. doi: 10.1016/j.biortech.2018.12.065 [21] 刘国华, 庞毓敏, 范强, 等. 进水氨氮负荷对污水生物脱氮过程中N2O释放的影响[J]. 环境污染与防治, 2015, 37(7): 18-22. [22] 林运通, 崔理华, 范远红, 等. 5种湿地沉水植物对模拟污水厂尾水的深度处理[J]. 环境工程学报, 2016, 10(12): 6914-6922. [23] PAVLINERI N, SKOULIKIDIS N T, TSIHRINTZIS V A, et al. Constructed floating wetlands: A review of research, design, operation and management aspects, and data meta-analysis[J]. Chemical Engineering Journal, 2017, 308: 1120-1132. doi: 10.1016/j.cej.2016.09.140 [24] 李丹, 吕锡武, 巩佳佳, 等. 冷季型禾草人工湿地处理生活污水的应用[J]. 净水技术, 2020, 39(8): 72-79. doi: 10.15890/j.cnki.jsjs.2020.08.014 [25] KUNDAN S, SOHAM K, SHIVANSHI T, et al. Ecological floating bed (EFB) for decontamination of polluted water bodies: Design, mechanism and performance[J]. Journal of Environmental Management, 2019, 251: 109550. doi: 10.1016/j.jenvman.2019.109550 [26] 王俊力, 付子轼, 乔红霞, 等. 枯萎期芦苇收割时间对湿地脱氮效果及根系呼吸代谢的影响[J]. 环境科学研究, 2021, 34(8): 1909-1917. doi: 10.13198/j.issn.1001-6929.2021.02.10 [27] 陈永华, 吴晓芙, 何钢, 等. 人工湿地污水处理系统中的植物效应与基质酶活性[J]. 生态学报, 2009, 29(11): 6051-6057. doi: 10.3321/j.issn:1000-0933.2009.11.037 [28] ZHU L D, LI Z H, KETOLA T. Biomass accumulations and nutrient uptake of plants cultivated on artificial floating beds in China's rural area[J]. Ecological Engineering, 2011, 37(10): 1460-1466. doi: 10.1016/j.ecoleng.2011.03.010 [29] DU L, TRINH X T, CHEN Q R, et al. Enhancement of microbial nitrogen removal pathway by vegetation in Integrated Vertical-Flow Constructed Wetlands (IVCWs) for treating reclaimed water[J]. Bioresource Technology, 2018, 249: 644-651. doi: 10.1016/j.biortech.2017.10.074 [30] 赵倩, 庄林岚, 盛芹, 等. 潜流人工湿地中基质在污水净化中的作用机制与选择原理[J]. 环境工程, 2021, 39(9): 14-22. doi: 10.13205/j.hjgc.202109003 [31] 潘傲, 张智, 孙磊, 等. 种植不同植物的表面流人工湿地净化效果和微生物群落差异分析[J]. 环境工程学报, 2019, 13(8): 1918-1929. [32] 张馨文, 冯成业, 张文智, 等. 人工湿地碳调控研究进展[J]. 湿地科学, 2022, 20(3): 413-420. doi: 10.13248/j.cnki.wetlandsci.2022.03.015 [33] 张军, 周琪, 何蓉. 表面流人工湿地中氮磷的去除机理[J]. 生态环境, 2004(1): 98-101. [34] 黄翔峰, 王珅, 陈国鑫, 等. 人工湿地对水产养殖废水典型污染物的去除[J]. 环境工程学报, 2016, 10(1): 12-20. [35] 张彩莹, 王岩, 王妍艳. 潜流人工湿地对畜禽养殖废水的净化效果[J]. 农业工程学报, 2013(17): 160-168. [36] 姚燃, 刘锋, 吴露, 等. 三级绿狐尾藻表面流人工湿地对养殖废水处理效应研究[J]. 地球与环境, 2018, 46(5): 475-481. [37] 赵伟, 范增增, 杨新萍. 水平潜流人工湿地对畜禽养殖废水中特征污染物的去除[J]. 环境科学, 2021, 42(12): 5865-5875. [38] 沈莹, 郑于聪, 王晓昌, 等. 不同尺度潜流人工湿地对污染河水的净化机制[J]. 环境工程学报, 2018, 12(6): 1667-1675. [39] 崔理华, 朱夕珍, 骆世明, 等. 垂直流人工湿地系统对污水磷的净化效果[J]. 环境污染治理技术与设备, 2002, 3(7): 13-17. [40] 李飞翔, 岳琛, 张超月, 等. 人工湿地去除水产养殖尾水中氮磷的影响因素识别[J]. 生态与农村环境学报, 2022, 38(7): 925-932. [41] 周新伟, 沈明星, 金梅娟, 等. 多级串联表面流人工湿地对河蟹养殖尾水的净化效果研究[J]. 湿地科学, 2017, 15(6): 774-780. [42] YOUNGGY K, BRUCE E L. Simultaneous removal of organic matterand salt ions from saline wastewater in bioelectrochemical systems[J]. Desalination, 2013, 308(21): 115-121. [43] MA Q, QU Y Y, ZHANG X W, et al. Identification of the microbial community composition and structure of coal-mine wastewater treatmentplants[J]. Microbiological Research, 2015, 175: 1-5. doi: 10.1016/j.micres.2014.12.013 [44] MENG P P, PEI H Y, HU W R, et al. How to increasemicrobial degradation in constructed wetlands: influencing factorsand improvement measures[J]. Bioresource Technology, 2014, 157: 316-326. doi: 10.1016/j.biortech.2014.01.095 [45] CHI Z F, HOU L N, LI H. Effects of pollution load and salinity shock on nitrogen removal and bacterial community in two-stage vertical flow constructed wetlands[J]. Bioresource Technology, 2021, 342: 126031. doi: 10.1016/j.biortech.2021.126031 [46] 韩亚琳, 王福浩, 王 群, 等. HSBBR运行模式对同步短程硝化反硝化脱氮及微生物群落特征的影响[J]. 环境工程, 2021, 9(1): 51-57. [47] 刘琴, 信欣, 周希, 等. 磁性纳米 Fe3O4@C 对 SBR 脱氮除磷性能及其微生物种群组成的影响[J]. 环境科学学报, 2021, 41(7): 2664-2672. [48] 余俊霞, 陈双荣, 刘凌言, 等. 复合人工湿地系统对低污染水总氮的净化效果及其微生物群落结构特征[J]. 环境工程, 2022, 40(1): 13-20. [49] FANG Y K, WANG H C, HAN J L, et al. Enhanced nitrogen removal of constructed wetlands by coupling with the bioelectrochemical system under low temperature: Performance and mechanism[J]. Journal of Cleaner Production, 2022, 350: 131365. doi: 10.1016/j.jclepro.2022.131365 [50] WANG T, NI Z L, KUANG B, et al. Two-stage hybrid microalgal electroactive wetland-coupled anaerobic digestion for swine wastewater treatment in South China: Full-scale verification[J]. Science of the Total Environment, 2022, 820: 153312. doi: 10.1016/j.scitotenv.2022.153312 [51] LOUCA S, PARFREY LW, DOEBELI M. Decoupling function and taxonomy in the global ocean microbiome[J]. Science, 2016, 353(6305): 1272-1277. doi: 10.1126/science.aaf4507 [52] 王飞鹏, 黄亚玲, 张瑞瑞, 等. 不同曝气方式对人工湿地细菌多样性、代谢活性及功能的影响[J]. 环境科学, 2022, 43(4): 2007-2016. -



 下载:
下载: