-
镉 (cadmium,Cd) 是自然界毒性最强的痕量重金属元素之一,不仅会对大气、水资源及农业生产等方面造成不同程度的污染,还会通过食物链迁移、富集,给人类健康和动植物生长带来不可逆的危害[1-2]。国土资源部公布最新数据显示,我国镉污染物点位超标率达到7%,远超其它同类别污染物,如今集中治理后的土壤镉污染虽已基本得到控制,但镉仍是农田土壤的首要污染物之一[3],土壤镉污染问题为当前环境治理领域的一大研究热点。
在众多土壤镉污染解决办法中,钝化修复法由于钝化材料的种类多、成本低、效率高而被广泛研究。钝化材料修复镉污染土壤的原理是通过改变镉的赋存状态从而达到减少农作物的吸收富集以及降低污染地下水的风险的目的[4]。但钝化修复法本身不能彻底去除土壤中的重金属,甚至可能导致二次污染的发生。因此选择钝化材料时,在保证修复效果的同时应该综合考虑其环境友好性能,减少二次污染的风险。磁性纳米复合材料除具有一般纳米材料的优良特性如小粒径、高比表面积外,并拥有独特的磁学性能[5],能够在重金属被固定到材料上后实现与水或土壤分离,实现重金属的移除[6]。此外,磁性材料还适合枝接各类官能团,在增大吸附容量的同时减弱磁性团聚现象[7],目前已有大量经有机改性的磁性材料被用作水溶液中Cd(Ⅱ)等重金属离子的吸附剂,如RAHMI等[8]采用甘氨酸接枝、聚乙二醇交联、Fe3O4磁性填料包埋等方法复合而成的磁性壳聚糖微球 (Fe3O4/Ch-G-P) 可去除水溶液中98%以上的Cd(Ⅱ);LIU等[7]在Fe3O4表面包覆二氧化硅,并对其进行了氨基和羧基改性,得到比表面积为67.80 m2·g−1的Fe3O4@SiO2(-NH2/-COOH)磁性纳米材料,对Cd(Ⅱ)的最大吸附量可达到84.03 mg·g−1。土壤重金属修复领域中有机改性磁性材料的应用虽然相对较少,但其应用潜力也逐渐得到了学者的关注。有学者运用由核壳结构的Fe3O4@SiO2磁性颗粒与螯合官能团结合制备的磁性固体螯合材料修复土壤重金属污染,如方丹丹等[9]制备的超顺磁性纳米Fe3O4-磷酸盐功能化材料(MFH)对土壤镉总镉的去除率可达38.90%;范力仁、聂新星等[10]利用亚氨基二乙酸改性的Fe3O4@SiO2磁性颗粒修复土壤,镉含量由(10.91±2.06) mg·kg−1,下降至1.64 mg·kg−1,去除率达到84.90%[11],材料磁选回收后可有效移除15.91%~18.55%的土壤总镉,其中有效态镉移除量达33.33%~50.26%。总的来说,磁性固体螯合材料修复镉污染土壤的效果较显著,研究钝化材料在钝化过程中Cd(Ⅱ)的释放行为规律有助于提升钝化修复效率,但土壤重金属修复过程中相关研究较少被报道。
本研究运用简单水热法制备了由L-半胱氨酸改性的磁性纳米铁酸盐材料S-ZnFe2O4,在掺杂金属离子的同时枝接多种官能团。该材料在之前的研究中对溶液中的Cd(Ⅱ)表现出良好的吸附效果。为了探究其对镉污染土壤镉滞固的能力,本研究以其作为吸附钝化剂,采用土柱淋溶的实验方法,在改变淋溶液pH、材料用量以及共存金属离子的条件下,分析了镉的淋溶、土壤镉的赋存形态变化以及金属阳离子的竞争吸附行为,探究了钝化吸附的机理,以期为镉污染土壤的钝化修复提供参考借鉴。
-
实验主要试剂均购自中国成都市科隆化学品有限公司,HNO3、HF及HClO4为优级纯,L-半胱氨酸为生物试剂,ZnCl2、CuCl2·2H2O、NiCl2·6H2O、CrCl3·6H2O、PbCl2、FeCl2·4H2O及FeCl3·6H2O均为分析纯。
供试原始土壤为采自四川省乐山市某农田的偏碱性紫色土,经自然风干、均匀混合、去除石砾及肉眼可见杂物后研磨过100目筛备用。土壤pH值为7.78,阳离子交换容量为7.41 cmol·kg−1,土壤有机质含量为43.72 g·kg−1,总镉含量为5.69 mg·kg−1。
根据农用地土壤污染风险管控标准 (GB 15618-2018) ,采用人工添加外源重金属氯盐溶液的方式配制含不同共存金属的土样,配制过程中保证重金属与土壤充分混匀,待自然风干后磨细过100目筛保存,最终得到的共存金属污染土样的浓度分别为Zn:360.96 mg·kg−1;Ni:184.73 mg·kg−1;Cu(Ⅱ):160.79 mg·kg−1;Cr(Ⅲ):270.38 mg·kg−1;Pb:272.48 mg·kg−1。
-
取一定量ZnCl2和FeCl3·6H2O按照1:2的摩尔比充分溶解于超纯水中,调pH至11,70 ℃水浴回流4 h。所得沉淀用超纯水和无水乙醇清洗3遍,60 ℃真空干燥24 h,研磨得到的ZnFe2O4与一定量L-半胱氨酸 (摩尔比为1:1) 充分溶解于适量超纯水,HCl溶液调节pH约为4~5,放入反应釜于160 ℃下反应6 h,冷却所得沉淀并用超纯水及无水乙醇清洗,60 ℃下真空干燥10 h,研磨即得S-ZnFe2O4。
经XRD、FESEM/EDS、BET及VSM分析,所制备材料为尖晶石型S-ZnFe2O4磁性纳米颗粒,平均粒径约为28 nm,比表面积为85.92 m2·g−1,比饱和磁化强度为39.90 emu·g−1,具有比表面积高、吸附位点丰富、可磁选分离等优点。
-
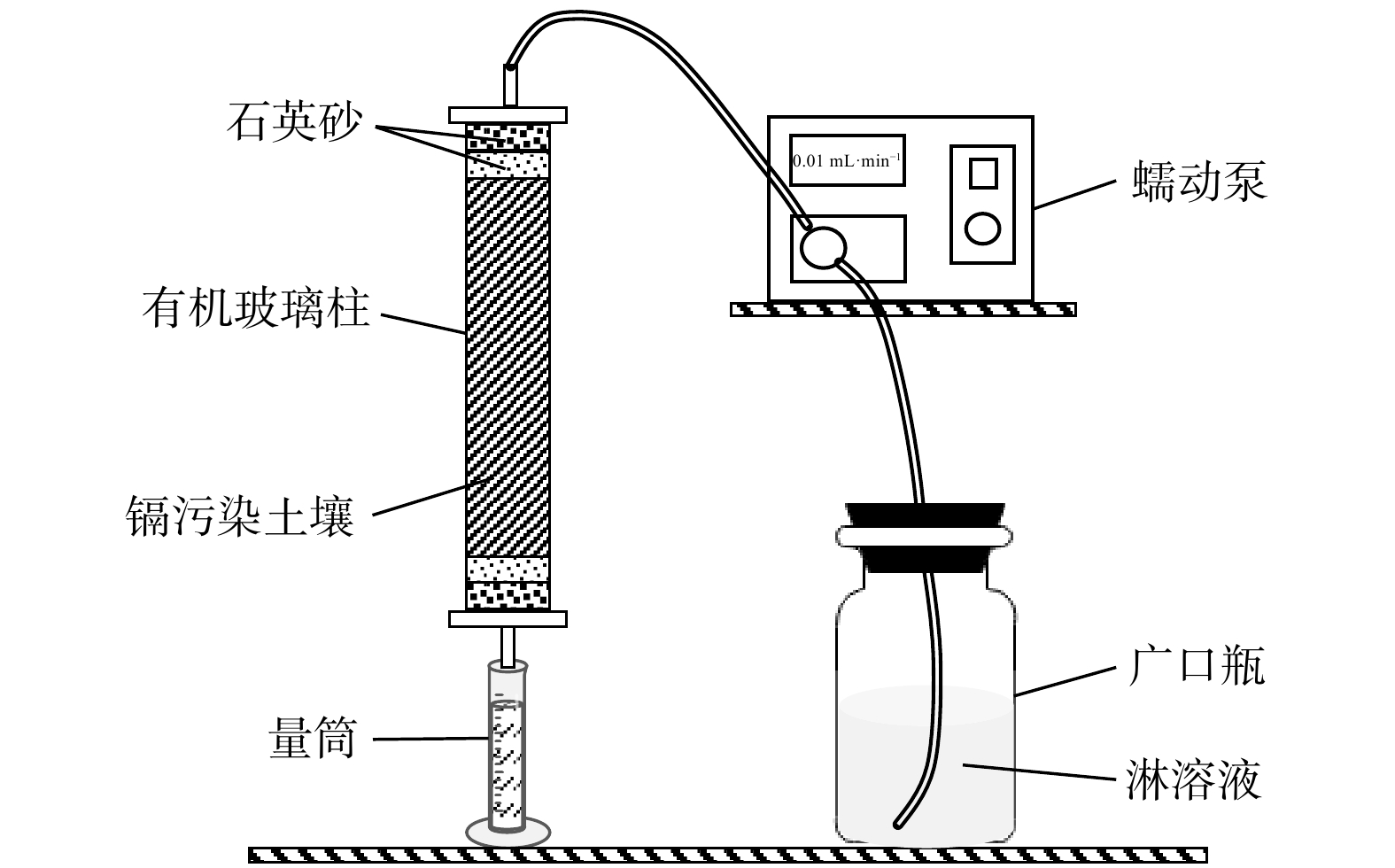
利用直径40 mm、长300 mm的有机玻璃柱作淋溶柱开展实验。实验前用粗砂纸对柱内壁进行打磨以保证边壁粗糙,避免淋溶实验时产生边壁优势;柱的两端分别设有4 cm高的石英砂反滤层,以达到防止土体塌陷和实现均匀布水的目的。使用蠕动泵和装有超纯水的烧瓶作供水装置,土柱上端入水,下端通过量筒收集淋溶液,实验装置示意图如图1。
向土样中加入一定比例的S-ZnFe2O4材料,与石英砂按2∶1的比例混匀填装成柱。设置S-ZnFe2O4投加剂量梯度分别为0、0.50%(wt)、1.00%(wt)、1.50%(wt)、2.00%(wt)、3.00%(wt),使用0.10 mol·L−1HCl、NaOH溶液调节超纯水的pH值至3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0作为淋溶液,根据常见的重金属复合污染类型选定共存重金属Zn(Ⅱ)、Pb(Ⅱ)、Ni(Ⅱ)、Cu(Ⅱ)、Cr(Ⅲ),分别探究材料投加量、淋溶液pH值及共存重金属离子对土壤Cd(Ⅱ)淋溶释放及镉的赋存形态的影响。为了尽可能减小实验误差,填装土柱时分两次压实相同质量的土壤成柱,平行组每收集相同体积淋溶液进行一次取样,所收集淋溶液经0.45 μm滤膜过滤后测定Cd(Ⅱ)浓度。淋溶完成后,受试土壤经自然风干及研磨后测定镉的赋存形态变化,用磁吸的方法吸出S-ZnFe2O4材料进行表征分析。
-
采用电位法 (HJ 962-2018) 在水土比为2.5:1的条件下测pH值,乙酸铵交换法 (NY/T 295-1995) 测阳离子交换容量,重铬酸钾氧化-外加热法 (NY/T 85-1988) 测土壤有机质含量,微波消解法 (HJ 832-2017) 测土壤总镉浓度,Tessier五步提取法[12]提取土壤镉的不同形态,电感耦合等离子体质谱法(ICP-MS)测定淋溶液及提取液中Cd(Ⅱ)的浓度。使用傅里叶变换红外光谱仪 (FTIR,NICOLET51,Thermo) 分析材料表面官能团,X射线光电子能谱仪 (XPS,Thermo ScientificK-Alpha) 分析材料表面元素的价态。
-
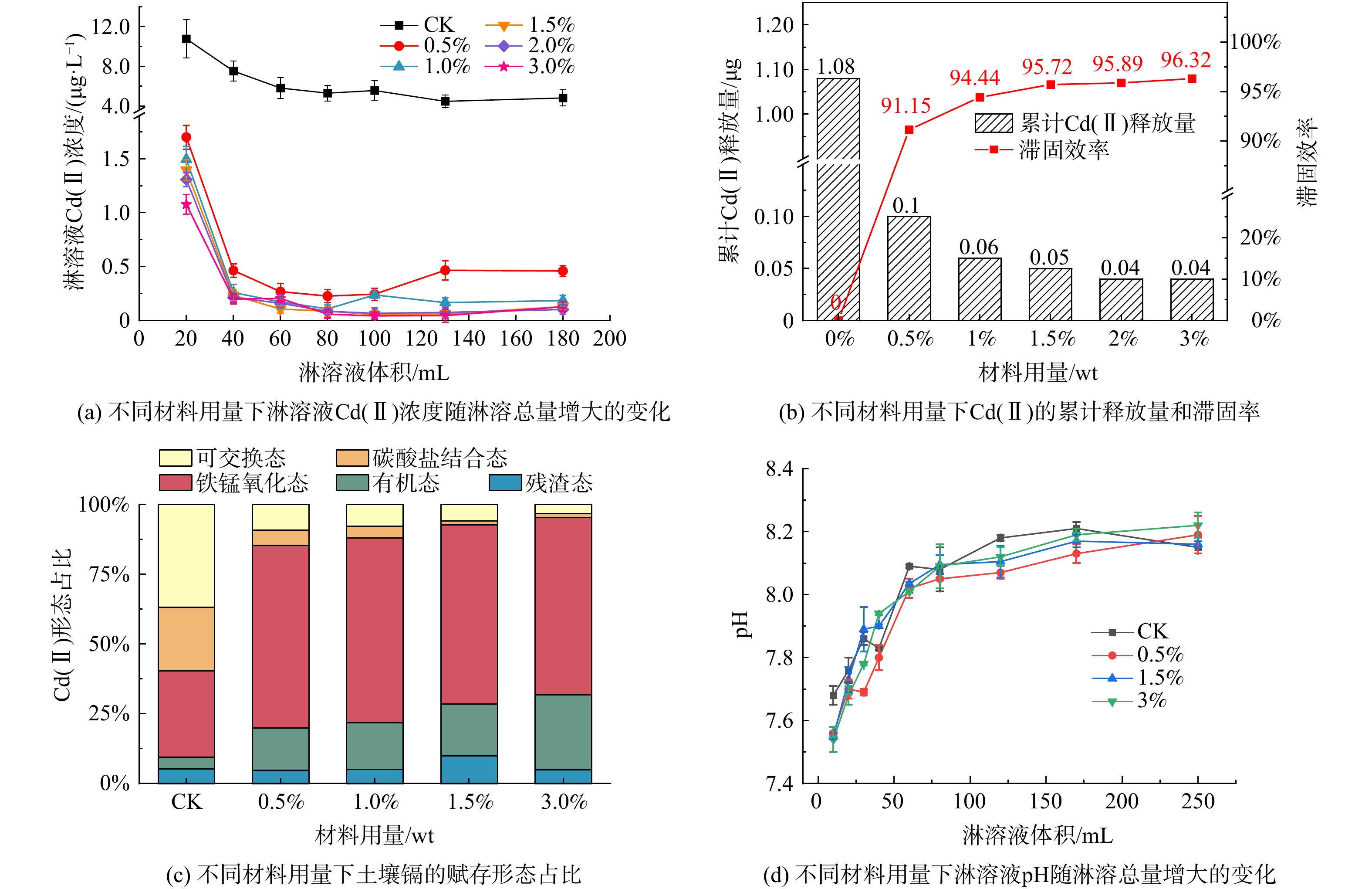
材料投加量对Cd(Ⅱ)释放的影响如图2所示。图2(a)为淋溶液Cd(Ⅱ)的浓度变化,土壤中的可溶Cd(Ⅱ)随淋溶液在土柱中纵向迁移,期间不断被土壤胶体及S-ZnFe2O4材料吸附固定,呈现出淋溶液Cd(Ⅱ)的浓度随时间不断降低至保持稳定。其中,空白组(CK)淋溶液的Cd(Ⅱ)浓度及累计淋溶量图2(b)远高于添加S-ZnFe2O4材料土柱的,并且S-ZnFe2O4用量越大Cd(Ⅱ)的淋溶释放越少,滞固效率越高。S-ZnFe2O4用量<1.50%(wt)的土柱淋溶液Cd(Ⅱ)浓度随淋溶的进行呈先降低后略微反弹的趋势。材料用量为0.50%(wt)及1.00%(wt)时,土柱淋溶Cd(Ⅱ)浓度分别在淋溶量达130 mL和100 mL时出现反弹,前者从0.22 μg·L−1上升至0.47 μg·L−1,后者从0.11 μg·L−1升至0.24 μg·L−1。S-ZnFe2O4用量≥1.50%(wt)时,土壤淋溶液Cd(Ⅱ)浓度波动较小,基本维持在0.20 μg·L−1以下。添加S-ZnFe2O4后土柱Cd(Ⅱ)的淋溶量远少于空白处理,说明S-ZnFe2O4材料的加入对土壤Cd(Ⅱ)有明显的滞固效果,在材料用量为1.50% (wt)时Cd(Ⅱ)的滞固率可达95.72%,再增大用量滞固率的提升不明显 (图2(b)) ,且所有土柱的Cd(Ⅱ)淋出浓度均远低于GB
3838 -2002《地表水环境质量标准》规定的1.00 μg·L−1。不同形态的Cd(Ⅱ)活性不同,迁移性和生物毒性也不同[13]。钝化材料使用的目的是降低可交换态和碳酸盐结合态镉这两种活动性高、毒性强的形态占比。采用Tessier连续提取法对淋溶后土壤中镉的赋存形态占比进行分析,结果如图2(c)所示。空白土壤淋溶后镉的形态占比表现为可交换态(37%)>铁锰结合态(31%)>碳酸盐结合态(23%)>残渣态(5%)>有机结合态(4%)。添加S-ZnFe2O4材料的土壤中铁锰结合态和有机结合态镉的占比均显著增加,可交换态和碳酸盐结合态镉占比则大大降低,残渣态镉占比无明显变化,以上趋势随材料添加量的增大越明显。当材料用量为3%(wt)时,可交换态和碳酸盐结合态镉占比分别降低33.48%和21.57%,有机结合态及铁锰结合态占比分别增加22.45%和32.81%。与空白组相比,在相同淋溶条件下,S-ZnFe2O4材料的作用使可交换态及铁锰结合态镉大量转化为铁锰结合态及有机结合态。在探究材料用量对Cd(Ⅱ)释放的影响实验中,淋溶液为未经调节pH的超纯水,其pH值在5.5~7.0范围内。图2(d)为不同材料用量的土柱淋溶液pH值的动态变化图,可以看出,添加S-ZnFe2O4前后的淋溶液pH值的变化不大,随淋溶的进行pH值以先较快后缓慢的速率持续增大并逐渐稳定,这是土壤中碱性可溶物质溶于水造成的,说明S-ZnFe2O4的添加并不会影响土壤pH值。
-
不同pH条件下土壤和S-ZnFe2O4材料表面性质不同,因而pH值是决定钝化材料及土壤吸附重金属能力大小的重要参数[14]。不同pH下材料及土壤的Zeta电位,如图3(a)所示。土壤颗粒在pH为2.0~11.0范围内均带负电,其电负性总体随pH值的增大而增强。S-ZnFe2O4材料的等电点在pH为2.8附近,其电负性在pH为2.0~7.0范围内随pH增大而增强,随后表面电荷在pH为8.0时趋于0,而后负电荷显著增加。
当S-ZnFe2O4材料用量为1.50%(wt),淋溶液pH分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0时,土壤Cd(Ⅱ)的释放情况如图3(b)所示。淋溶过程中的前60 mL为土壤Cd(Ⅱ)的快速淋出阶段,其淋溶浓度随淋溶的进行逐渐减小。在此阶段,Cd(Ⅱ)的淋溶在pH为8.0时明显高于其他组,其最大淋溶浓度与pH为6.0时的最大淋溶浓度相差2.51 μg·L−1。淋溶超60 mL后,Cd(Ⅱ)淋溶浓度在不同pH下基本上趋于稳定,最高不超过0.26 μg·L−1,其中pH为5.0时浓度最低,均低于0.06 μg·L−1。淋溶180 mL后,不同pH条件下累计淋溶的Cd(Ⅱ)总量随pH增大呈先减少后增加再减少的趋势,在pH为5.0时最少,为0.04 μg·L−1,而在pH为8时累计淋溶量高出pH为5.0时淋溶量的两倍,达116 μg·L−1 (图3(c)) 。
图3(d)为相同材料用量下,经不同pH淋溶液作用后的土壤镉的赋存形态占比情况。由图可以看出,经过不同pH淋溶液作用后,土壤中的镉均以铁锰结合态镉为主要存在形态 (约65%) ,其次是有机结合态镉 (17%) ,不同pH下该占比略有波动;其余形态的镉占比较少,碳酸盐结合态镉占比最低 (约为0%) ,其次是可交换态镉及残渣态镉,这与前面实验的结果一致。
一般来说,pH≤8.0时Cd(Ⅱ)在水溶液中主要以Cd2+存在,而后随pH增大逐渐生成Cd(OH)+,当pH≥10.0后则主要以Cd(OH)2沉淀的形式存在。然而土壤中镉的存在环境更为复杂,各种因素如有机质含量、阳离子交换容量、氧化还原电位等都会影响镉的存在形态,因此评估S-ZnFe2O4材料在土壤中吸附镉的效果时应考虑加上土壤本身起到的作用。就土壤而言,当淋溶液酸性越强,H+与土壤胶体结合产生质子化的现象就越强,这会使土壤对金属阳离子的静电斥力增大,不利于Cd(Ⅱ)的吸附。此外,酸性条件可能导致土壤中大量活性铝元素占据高能吸附位,使土壤对Cd(Ⅱ)的滞固量下降[15]。对于S-ZnFe2O4材料来说,在环境pH改变时,其吸附性能较大程度取决于其电负性的绝对值大小。在pH低于7.0时,土壤和S-ZnFe2O4表面带负电荷,对Cd(Ⅱ)的吸附效果均随pH增大而增强,但pH处于7.0~9.5范围时,S-ZnFe2O4相较于土壤颗粒表面电荷偏正,二者之间的静电吸引作用增强,使得材料对Cd(II)的吸附能力减弱,随着pH继续增大其吸附效果也再次提高。在淋溶前期,土柱的pH值几乎仅取决于淋溶液pH值,高活性的Cd(Ⅱ)由于没有材料的吸附直接随淋溶液排出土柱,这是淋溶液pH=8.0时Cd(Ⅱ)淋溶浓度远高于其他组的主要原因。此时,由于淋失量较大造成土壤中的总镉含量减小,铁锰结合态及有机态镉的总量不变,所以残渣态镉的占比略微升高。随着淋溶液pH继续增大,材料电负性再次增强,对Cd(Ⅱ)的吸附性能也随之转高,Cd(Ⅱ)的释放自然减少。在以上pH范围内,镉的存在形态由于S-ZnFe2O4的缘故依然为铁锰结合态及有机结合态为主,因而残渣态镉占比并无太大变化。
-
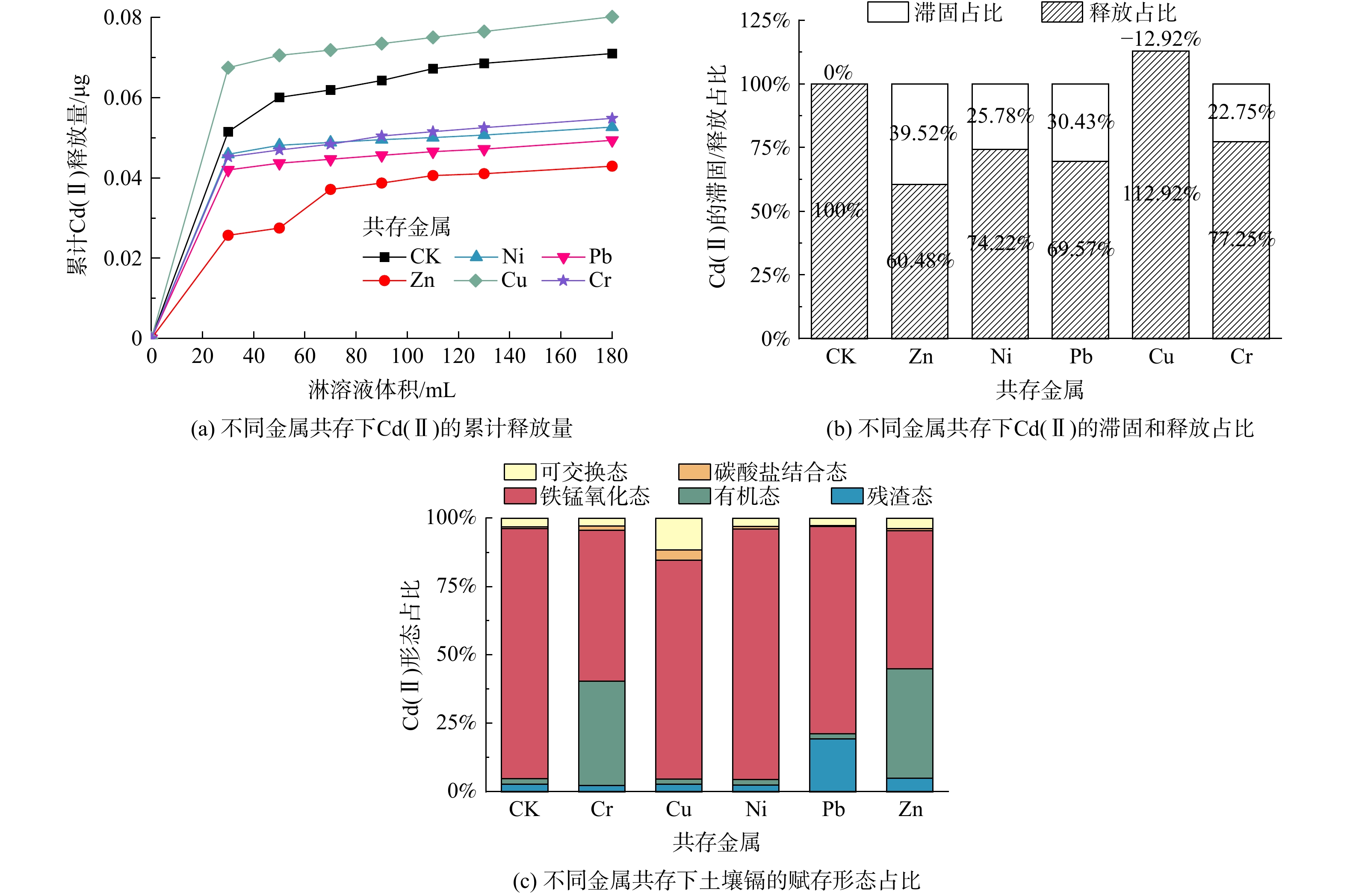
Cd(Ⅱ)、Pb(Ⅱ)、Zn(Ⅱ)、Cu(Ⅱ)、Cr(Ⅲ)、Ni(Ⅱ)是土壤污染中最为常见的几种重金属离子,它们具有不同的金属活性,常常复合存在于土壤之中。本实验通过向土壤添加外源共存金属离子的方法配得了复合污染土壤,并将其与1.50%(wt)的S-ZnFe2O4材料充分混匀,调节淋溶液pH至5.5,在室温条件下进行了土柱淋溶实验,探索共存金属离子对材料吸附土壤镉效果的影响。
如图4(a)所示,与CK相比,5种重金属的添加对S-ZnFe2O4材料吸附镉的能力存在差异,同上文,土壤Cd(Ⅱ)的释放在淋溶量为70 mL后就达相对稳定的状态。除Cu(Ⅱ)、Cd(Ⅱ)复合土柱中Cd(Ⅱ)的释放速度较CK更快且释放总量增加了12.92%外,其余重金属一样均表现出一定减少Cd(Ⅱ)释放的能力,其中Zn(Ⅱ)、Cd(Ⅱ)复合土柱中Cd(Ⅱ)的释放总量减少最明显,达39.52% (图4(b)) 。从土壤中Cd(Ⅱ)各赋存形态的占比变化来看,如图4(c),铁锰氧化态镉依然为主要存在形态。Zn(Ⅱ)及Cr(Ⅲ)的添加可明显增大有机结合态镉占比,各增高38%和36%;Pb(Ⅱ)的添加导致残渣态镉的占比增大16%;而Cu(Ⅱ)的添加增高了可交换态镉的占比,这与该土柱Cd(Ⅱ)淋溶量更高的结果相一致。
共存金属的加入影响土壤Cd(Ⅱ)淋溶释放行为的原因一方面可能是材料或土壤本身对不同金属离子的吸附力不同,而另一方面则是金属之间发生竞争吸附。根据2.1中超纯水淋溶下土壤pH的变化可推断,在淋溶液pH为5.5左右的淋溶条件下,土柱的pH值应该在5.5~8.5之间。在此条件下土壤共存金属离子中只有Cu(Ⅱ)与Cr(Ⅲ) (沉淀溶解常数pKsp分别为19.6和30.2) 可能产生少量沉淀,其余均为离子形态。相同环境下土壤及材料对共存金属离子的吸附性能主要与金属的基本物理化学性质有关[16],当金属阳离子价态相同时,则与该离子的一级水解常数、电负性及离子半径等因素密切联系[17]。SAHA等[18]认为金属离子的一级水解常数可以用来预测铁氧化物和土壤胶体对重金属离子竞争吸附能力的大小,吸附亲和力的大小随一级水解常数负对数pKi的增大而减小:Zn(II)(8.2)>Pb(Ⅱ)(8.8)>Cd(Ⅱ)(9.7),这一结论与一些Fe3O4材料吸附水溶液中多金属实验的结果相似[19]。由于易与吸附位点形成共价键的离子会更优先被吸附,土壤对Cd(Ⅱ)的吸附主要是靠静电吸引,而对Pb(Ⅱ)的吸附大多数是通过共价键作用,因此Pb(Ⅱ)比Cd(Ⅱ)更容易被土壤吸附[20]。本研究中添加Pb(Ⅱ)却增加了Cd(Ⅱ)的滞固量,说明与土壤相比,S-ZnFe2O4材料的吸附作用才是Cd(Ⅱ)被滞固的主要原因。有研究表明,L-半胱氨酸的存在可使对Cd(Ⅱ)的吸附快于Pb(Ⅱ)[21],用Lewis酸碱理论来解释就是Cd(II)是比Pb(II)、Ni(II)、Zn(II)更软的酸[22],L-半胱氨酸的-NH2和-COOH是软碱,而软碱会优先与软酸结合为稳定的络合物[23],因此Cd(Ⅱ)会比共存金属更优先被固定。Pb(II)的添加增大了残渣态镉的占比,可能是由于Pb(II)在被土壤吸附过程中使得大量Cd(II)也被土壤晶格所吸附固定。添加Cr(Ⅲ)或Zn(II)引起的有机结合态镉占比增加可能是因为这两种金属离子更多被吸附到了铁锰氧化物上,形成大量Fe-O-Cr及Fe-O-Zn金属配合物,使得大部分Cd(Ⅱ)只能更多地与材料表面的-NH2及-COOH络合而被固定。添加Cu(Ⅱ)却增加了Cd(Ⅱ)释放的主要原因可能是由于Cu(Ⅱ)与Cd(Ⅱ)之间产生了竞争吸附,会占据部分材料上的吸附位点导致可交换态镉的占比升高,因此增大了Cd(Ⅱ)的淋溶,这与BENETTAYEB等[20]及何恬叶[24]的研究结果一致。
-
本研究中S-ZnFe2O4材料是ZnFe2O4铁氧体经L-半胱氨酸改性而成,FTIR结果 (图5) 表明改性后羧基及氨基官能团被成功接枝到ZnFe2O4表面:在1 042 cm−1、1 623 cm−1处依次检测到由C-N键伸缩振动、N-H键面内弯曲振动引起的氨基特征峰,羧基特征峰分布在1 099 cm−1、1 393 cm−1、1 428 cm−1 、1 737 cm−1、2 854 cm−1及2 922 cm−1处,分别归属于C-O键伸缩振动、O-H键的面内弯曲振动、C=O键的伸缩振动及O-H键伸缩振动;3 430 cm−1附近的较宽大的特征峰可能归属于N-H键的伸缩振动和分子间氢键。大量研究报道,氨基和羧基官能团螯合固定Cd(Ⅱ)的能力突出[25-26],且根据硬软酸碱理论(HSAB),软酸(Cd(Ⅱ))对氨基配体具有高亲和力[20, 27],因此可推断在吸附过程中氨基的存在是Cd(Ⅱ)被络合固定的一个重要原因。此外,FTIR结果中并未检测到L-半胱氨酸的巯基特征峰,是因为巯基与ZnFe2O4结合形成了S-Fe-O或S-Zn-O键,这与KALWAR等[22]的研究结果一致。
反应前后S-ZnFe2O4在580 cm−1附近的Zn-O、Fe-O键的特征峰位置有所偏移,由于铁氧体中的氧原子很容易与Cd(Ⅱ)形成稳定的配合物[28-29],因此此处可能是材料与Cd(Ⅱ)反应生成了配合物Fe-O-Cd或Zn-O-Cd。在2 854 cm−1、2 922 cm−1处的羧羟基峰强以及3 430 cm−1处特征峰强都相对减弱,说明了两处对应基团均参与了钝化反应;除此之外,在600~1 800 cm−1之间存在的-C-N、-C-S、-S=O、-R等基团特征峰在反应前后发生了多处谱带变化,其中包括峰强的变化及新峰的产生,可能为土壤中Cd(Ⅱ)与相关基团发生了络合反应所致[30]。
图6为S-ZnFe2O4吸附前后的XPS分析结果。由图6(a)总谱图中可以看出,反应后新增了Cd 3d特征峰,说明Cd(Ⅱ)被成功吸附在材料表面。Fe 2p精细谱图6(b)中710.51 eV、711.92 eV、713.69 eV处的峰和724.86 eV的峰分别归属于Fe 2p3/2和Fe 2p1/2,其中710.51和718.32处的特征峰意味着有Fe(Ⅱ)的存在,713.69 eV和732.27 eV处的峰意味着Fe(Ⅲ)存在[31]。图6(e)的Cd 3d精细谱中,位于405.27 eV、412.04 eV的峰分别对应Cd 3d5/2和Cd 3d3/2,可见钝化吸附反应后Cd(Ⅱ)的价态未发生改变。图6(d)的S 2p精细谱中161.59 eV、162.74 eV和169.13 eV分别为金属硫化物和SO42-的特征峰[32],反应后Fe(Ⅱ)的峰强有所减弱,而162.74 eV处对应的CdS峰相对加强,说明Cd(Ⅱ)替换了部分Fe(Ⅱ)与S2-结合。
-
淋溶结束后的土壤经烘干研磨后过1 mm筛保存。使用磁铁在土壤中反复搅拌磁吸出S-ZnFe2O4粉体,将其置于超纯水中去除其表面附有的少量土壤微粒,然后在磁吸作用下撇去水溶液,烘干后得到纯净的的磁性颗粒,对其称重并计算得出平均磁选回收率:材料用量为1.50%(wt)时,S-ZnFe2O4磁性材料的平均回收率为77.94%,材料用量为3%(wt)时的平均回收率达到94.50%,增大用量磁选回收率升高的原因主要是增大用量可减小磁吸、烘干、清洗这一过程中损耗量的相对占比。可见S-ZnFe2O4材料磁选回收的效果较高。
-
本研究通过土柱淋溶实验探究了不同条件下S-ZnFe2O4材料对土壤镉含量为5.89 mg·kg−1的污染土壤中Cd(Ⅱ)淋溶释放行为,结果如下:
1)该材料可实现对土壤镉的有效滞固。当S-ZnFe2O4材料用量为1.50%(wt)、淋溶液pH=5时,土壤Cd(Ⅱ)的释放量最少,与空白相比减少了96.02%,此时土壤中可交换态及碳酸盐结合态镉的占比可分别减少34.13%和22.65%,大大降低了Cd(Ⅱ)的活性。
2)多数共存金属对S-ZnFe2O4材料吸附土壤镉的有促进作用。在相同金属浓度条件下,Cu(II)会增加12.92%Cd(Ⅱ)的释放,而Pb(Ⅱ)、Ni(Ⅱ)、Zn(Ⅱ)和Cr(Ⅲ)均有利于Cd(Ⅱ)的滞固,Cd(Ⅱ)的释放量分别减少了30.43%、25.78%、39.52%及22.75%。
3) S-ZnFe2O4材料通过以表面络合为主,离子交换及静电吸引等的共同作用使土壤中可交换态镉和碳酸盐结合态镉被大量转换为铁锰氧化态镉及有机结合态镉,从而实现土壤中Cd(Ⅱ)的滞固。
磁性纳米S-ZnFe2O4作用下土壤Cd(Ⅱ)的淋溶释放
Leaching release behavior of soil Cd(II) under the magnetic nano-S-ZnFe2O4
-
摘要: 通过土柱淋溶实验探究了S-ZnFe2O4磁性纳米材料作用下,镉污染土壤中Cd(Ⅱ)的转化及淋溶释放行为。结果表明:S-ZnFe2O4对土壤镉有较好的钝化效果;在淋溶液pH为5,S-ZnFe2O4用量为1.5% (wt) 的条件下,镉含量为5.69 mg·kg−1的污染土壤中Cd(Ⅱ)的淋溶释放量较空白组减少96.02%,S-ZnFe2O4的平均磁选回收率可达77.94%;S-ZnFe2O4主要通过表面络合、离子交换及静电吸引等作用实现土壤Cd(Ⅱ)的吸附,土壤中大量高活性镉转变为铁锰氧化态及有机结合态,可交换态和碳酸盐结合态镉占比分别降低34.13%和22.65%。共存Pb(Ⅱ)、Zn(Ⅱ)、Cr(Ⅲ)、Ni(Ⅱ)离子促进材料对Cd(Ⅱ)的滞固作用,而Cu(Ⅱ)使Cd(Ⅱ)的淋溶量增加了12.92%。所制备的S-ZnFe2O4磁性纳米材料具有高吸附性、可磁选回收性及制备方法简单的优点,可大大降低土壤Cd(Ⅱ)的活性,降低土壤镉释放污染地下水的风险,研究可为镉污染土壤的修复提供参考。Abstract: A soil column leaching test was carried out to study the leaching release behavior of Cd(Ⅱ) in cadmium-contaminated soil under the S-ZnFe2O4 magnetic nanomaterials. The results showed that S-ZnFe2O4 had a superior passivation effect on soil Cd. Cd(Ⅱ) leaching release from contaminated soil with Cd content of 5.69 mg·kg−1 was reduced by 96.02% compared with that of the blank group, when the leaching solution pH was 5, and the dosage of S-ZnFe2O4 was 1.5%(wt), and the average effective recovery with magnetic separation recovery of S-ZnFe2O4 could reach 77.94%. The adsorption of soil Cd(Ⅱ) by S-ZnFe2O4 was mainly through surface complexation, ion exchange, and electrostatic attraction, a large amount of cadmium with high activity in the soil was transformed into Fe-Mn oxides-bound forms and organic matter-bound forms, and the proportion of cadmium in exchangeable forms and carbonate-bound forms decreased by 34.13% and 22.65%, respectively. The coexistence of Pb(Ⅱ), Zn(Ⅱ), Cr(Ⅲ), and Ni(Ⅱ) ions promoted the immobilization of Cd(Ⅱ) of the material, while Cu(Ⅱ) increased the leaching of Cd(Ⅱ) by 12.92%. The as-prepared S-ZnFe2O4 magnetic nanomaterials have the advantages of being highly adsorptive, recoverable by magnetic separation and simple preparation method, which can greatly reduce soil Cd(Ⅱ) activity and lower the risk of groundwater contamination by soil Cd release. This study provides valuable insights for the remediation of cadmium-contaminated soil.
-
Key words:
- soil column leaching /
- cadmium-contaminated soil /
- S-ZnFe2O4 /
- immobilization
-

-
-
[1] BATAILLARD P, CAMBIER P, PICOT C. Short-term transformations of lead and cadmium compounds in soil after contamination[J]. European Journal of Soil Science, 2010, 54(2): 365-376. [2] 左丹丹, 黄金文, 闻高志, 等. 庐江废弃明矾石矿土壤重金属形态特征及生态危害评价[J]. 生态科学, 2019, 38(5): 86-91. [3] 环境保护部, 国土资源部. 全国土壤污染状况调查公报[EB/OL]. https://www.mee.gov.cn/gkml/sthjbgw/qt/201404/t20140417_270670.htm. [4] DERAKHSHAN N Z, JUNG M C, KIM K H. Remediation of soils contaminated with heavy metals with an emphasis on immobilization technology[J]. Environmental Geochemistry and Health, 2018, 40(3): 927-953. doi: 10.1007/s10653-017-9964-z [5] ABDOLLAHI H, MALEKI S, SAYAHI H, et al. Superadsorbent Fe3O4-coated carbon black nanocomposite for separation of light rare earth elements from aqueous solution: GMDH-based Neural Network and sensitivity analysis[J]. Journal of Hazardous Materials. 2021, 416, 125655. [6] 吴潜. 磁性纳米材料研究进展及展望[J]. 化学工业, 2017, 35(6): 19-22. doi: 10.3969/j.issn.1673-9647.2017.06.005 [7] LIU Z G, LEI M, ZENG W, et al. Synthesis of magnetic Fe3O4@SiO2-(-NH2/-COOH) nanoparticles and their application for the removal of heavy metals from wastewater[J]. Ceramics International, 2023, 49(12): 20470-20479. doi: 10.1016/j.ceramint.2023.03.177 [8] RAHMI, JULINAWATI, MARLIA N, et al. Preparation and characterization of new magnetic chitosan-glycine-PEGDE (Fe3O4/Ch-G-P) beads for aqueous Cd(II) removal[J], Journal of Water Process Engineering, 2022, 45: 102493. [9] 方丹丹, 张立志, 王强. 超顺磁性纳米材料对镉污染稻田土壤微生物和酶的影响[J]. 环境科学, 2021, 42(3): 1523-1534. [10] 聂新星, 刘骏龙, 欧阳光明, 等. 一种磁性固体螯合材料对农田土壤Cd的移除修复效果研究[J]. 农业资源与环境学报, 2017, 34(6): 25-530. [11] 范力仁, 宋吉青, 周洋, 等. 磁性固体螯合剂(MSC-IDA)对土壤镉污染的移除净化[J]. 环境化学, 2017, 36(6): 1204-1212. doi: 10.7524/j.issn.0254-6108.2017.06.2016122202 [12] 尹带霞. 生物炭对稻田土壤重金属生物有效性的影响与作用机制[D]. 长沙: 湖南师范大学, 2016. [13] TESSIER A, CAMPBELL P G, BISSON M. Sequential extraction procedure for speciation of particulate trace metals[J]. Analytical Chemistry. 1979, 51: 844-851. [14] DU C, ZHANG Z, YU G, et al. A review of metal organic framework (MOFs)-based materials for antibiotics removal via adsorption and photocatalysis[J]. Chemosphere, 2021, 272: 129501. doi: 10.1016/j.chemosphere.2020.129501 [15] MULDER J, STEIN A. The solubility of aluminum in acidic forest soils: long-term changes due to acid deposition[J]. Geochimica Et Cosmochimica Acta, 1994, 58(1): 85-94. doi: 10.1016/0016-7037(94)90448-0 [16] 林青, 徐绍辉. 土壤中重金属离子竞争吸附的研究进展[J]. 土壤, 2008, 40(5): 706-711. doi: 10.3321/j.issn:0253-9829.2008.05.005 [17] 王玉军, 周东美, 孙瑞娟, 等. 土壤中铜、铅离子的竞争吸附动力学[J]. 中国环境科学, 2006, 26(5): 555-559. doi: 10.3321/j.issn:1000-6923.2006.05.011 [18] SAHA U K, TANIGUCHI S, SAKURAI K. Simultaneous adsorption of cadmium, zinc, and lead on hydroxyalumium-and hydroxyaluminosilicate-montmorillonite complexes[J]. Soil Science Society of America Journal, 2002, 66: 117-128. [19] LIU G L, LIANG D, ZHONG M Q, et al. Organic adsorbents modified with citric acid and Fe3O4 enhance the removal of Cd and Pb in contaminated solutions[J]. Chemical engineering journal, 2020, 395(1): 125108. [20] BENETTAYEB A, GUIBAL E, MORSLI A, et al. Chemical modification of alginate for enhanced sorption of Cd(II), Cu(II) and Pb(II)[J]. Chemical Engineering Journal, 2017, 316: 704-714. doi: 10.1016/j.cej.2017.01.131 [21] WANG D Y, EVELIINA R, HE F S, et al. Dual functional sites strategies toward enhanced heavy metal remediation: Interlayer expanded Mg-Al layered double hydroxide by intercalation with L-cysteine[J]. Journal of Hazardous Materials, 2022, 439: 129693. doi: 10.1016/j.jhazmat.2022.129693 [22] KALWAR, NAFADY, SOOMRO, et al. Microwave-assisted synthesis of L-cysteine-capped nickel nanoparticles for catalytic reduction of 4-nitrophenol[J], Rare Metals, 2015, 34: 683-691. [23] JAWAD A, WANG H B, JEROSHA I, et al. Efficient, stable and selective adsorption of heavy metals by thio-functionalized layered double hydroxide in diverse types of water[J]. Chemical Engineering Journal, 2018, 332: 387-397. doi: 10.1016/j.cej.2017.09.080 [24] 何恬叶. 稳定化纳米零价铁生物炭对水中重金属的吸附[D]. 成都: 成都理工大学, 2023. [25] GAO Y S, QI G S, YAN W C, et al. Preparation of L-cysteine modified MnFe2O4 nanoparticles based on high-gravity technology and application for the removal of lead[J]. Journal of Environmental Chemical Engineering, 2022, 10(2): 2213-3437. [26] ZHAO M, HUANG Z, WANG S, et al. Design of l-cysteine functionalized UiO-66 MOFs for selective adsorption of Hg(II) in aqueous medium[J]. ACS applied materials & interfaces, 2019, 11(50): 46973-46983. [27] LI J, XIE L, GUO R, et al. Facile preparation of Fe3O4/MoS4 for ultra fast and highly selective uptake towards Hg2+, Pb2+ and Ag+[J]. Journal of Alloys and Compounds, 2020, 823: 153819. doi: 10.1016/j.jallcom.2020.153819 [28] LEI T, LI S J, JIANG F, et al. Adsorption of cadmium ions from an aqueous solution on a highly stable dopamine-modified magnetic nano-adsorbent[J]. Nanoscale Research Letters, 2019, 14(1): 352. doi: 10.1186/s11671-019-3154-0 [29] CHOWDHURY S R, YANFUL E K, PRATT A R. Chemical states in XPS and Raman analysis during removal of Cr(VI) from contaminated water by mixed maghemite-magnetite nanoparticles[J]. Journal of Hazardous Materials, 2012, 235-236: 246-256. doi: 10.1016/j.jhazmat.2012.07.054 [30] 刘孟清. 蒙脱石/高岭土负载硫修饰铁磁纳米复合材料的制备及其对镉的吸附研究[D]. 绵阳: 西南科技大学, 2022. [31] YUAN G Q, LI K Z, ZHANG J Z, et al. A novel insight into the microwave induced catalytic reduction mechanism in aqueous Cr(VI) removal over ZnFe2O4 catalyst[J]. Journal of Hazardous Materials, 2023, 443: 130211. doi: 10.1016/j.jhazmat.2022.130211 [32] SUN Y, LOU Z M, YU J B, et al. Immobilization of mercury(Ⅱ) from aqueous solution using Al2O3-supported nanoscale FeS[J]. Chemical Engineering Journal, 2017, 323: 438-491. -



 下载:
下载: