-
在全球倡导高效、低耗、可持续脱氮要求的背景下,针对含氨氮(NH4+-N)、硝酸盐(NO3−-N)工业废水(光伏、化肥废水)的脱氮处理受到人们的关注。目前,含氮废水普遍采用传统硝化反硝化技术[1],但其具有高能耗和温室气体排放等问题,背离了可持续发展的目标[2]。厌氧氨氧化(anaerobic ammonium oxidation,Anammox)技术因其低能耗、高效率的特点被视为目前最具潜力的生物脱氮技术[3-4]。Anammox以NH4+-N和亚硝酸盐(NO2−-N)作为底物,在厌氧条件下生成N2和少量NO3−-N。然而,将Anammox应用于处理含NH4+-N和NO3−-N工业废水时仍受到限制。一方面,在自然条件下NO2−-N含量较低,而NO2−-N作为Anammox的必要底物之一,通常需要通过其他方式提供足够的NO2−-N以保证Anammox转化的需求。另一方面,由于Anammox会产生一部分NO3−-N,总氮去除率最高为89%,且废水中NH4+-N浓度越高,Anammox中出水NO3−-N浓度也随之升高[5]。
目前,普遍采用部分反硝化(partial denitrification, PD)与Anammox耦合处理含NH4+-N和NO3−-N的废水[6-8]。WANG等[9]研究表明,硫自养反硝化(sulfur autotrophic denitrification,SADN)过程具有与Anammox耦合应用的优势。相较于其他形态的硫(S2−和SO32−),单质硫(S0)作为SADN电子供体,具有对微生物没有毒性、价格低廉、易于获取等优势。SUN等[10]研究表明,在NO3−-N和NO2−-N共存环境中,S0倾向于选择NO3−-N作为电子受体,极易发生NO2−-N积累,为Anammox提供充足的底物,有利于SADN和Anammox耦合。CHEN等[11]以序批模式运行S0ADN-Anammox厌氧发酵罐,总氮去除率高达97%~98%。HUO等[12]以UASB反应器运行S0ADN-Anammox耦合系统,总氮去除率维持在90%。S0ADN前半程、S0ADN后半程、S0ADN全程反应过程如式(1)~(3)所示[13]。
由于S0溶解性较差,目前以S0为电子供体的研究中均采用较大的S0与进水硝态氮的质量比(S/N)运行,例如CHEN等[11]以S/N=2.1投加S0, HUO等[12]和ZHANG等[14]的研究中采用S/N=8~10。而在S0ADN-Anammox耦合系统中,理论上S/N仅需0.762(式(1)),即可实现S0ADN前半程的发生,可为Anammox提供充足的NO2−-N底物,远小于现有研究[11]中的S/N。由此可见,现有研究均以较高S/N投加S0,造成严重的S0浪费。另一方面,CUI等[15]和CHEN等[16]在研究以S0作为电子供体的S0ADN过程中发现,S0对NO3−-N的亲和力大于NO2−-N,NO2−-N转化仅在NO3−-N不存在的情况下发生。由于S0ADN前半程反应速率较快,NO3−-N全部转化为NO2−-N,导致NH4+-N和NO2−-N共存,此时是否会存在S0ADN后半程与Anammox对底物NO2−-N的竞争关系,若存在,对耦合系统具有何种影响尚不明确。因此适宜的S/N对于S0ADN-Anammox耦合系统的稳定运行至关重要,目前针对此方向的研究很少。
本研究通过批次实验,首先探讨了S/N对S0ADN-Anammox耦合系统脱氮性能的影响,优化了S0ADN-Anammox耦合系统适宜的S/N;其次,模拟了在NO3−-N完全转化为NO2−-N以及不同S0投加量的条件下,S0ADN后半程与Anammox对NO2−-N的竞争能力。
-
将污泥和进水放置于封口瓶中,封口瓶选择液面高度与瓶口距离为3 cm型号,尽可能减少测样时空气进入,避免对实验造成影响,并置于恒温振荡器(THZ320-JINGHONG-CHN)保温振荡,控制内部完全混合状态。
-
本实验采用批次实验方法。接种污泥取自实验室长期培养一步式连续流S0ADN-Anammox反应器不同运行阶段的污泥,控制封口瓶内污泥质量浓度(mixed liquor suspended solids,MLSS)。其中含有活性良好厌氧氨氧化菌(anaerobic ammonia oxidation bacteria,AnAOB)和硫自养反硝化菌(sulfure oxidizing bacteria,SOB),视实验情况采取清水清洗污泥5遍的预处理方式,批次实验接种污泥情况和连续流反应器中对应的进出水水质如表1和表2所示。进水中投加不同底物及质量浓度,同时添加营养物质和微量元素以维持微生物生长,控制不同S/N,控制温度为35 ℃及初始pH为8.5±0.2。定时取样检测,观察S0ADN和Anammox反应情况。
-
本实验共设置4次批次实验,采用1 000 mL规格封口瓶。设置摇床仓内温度为35 ℃、转速180 r·min−1。营养液包括27 mg·L−1 KH2PO4 、10 mg·L−1 MgCl2 、10 mg·L−1 CaCl2 、250 mg·L−1 NaHCO3,225 mg·L−1 微量元素A、337.5 mg·L−1 微量元素B。以5 mol·L−1 NaOH和1 mol·L−1 HCl调节初始pH为8.5±0.2,每组批次实验设置3组平行样,各批次实验具体条件如表3所示。底物中NH4+-N、NO2−-N、NO3−-N分别采用NH3Cl、NaNO2、NaNO3配制,底物质量浓度均为实际测量值,微量元素配方[17]包括微量元素A和微量元素B,微量元素A包括5 g·L−1 EDTA·2Na,5 g·L−1 FeSO4·7H2O;微量元素B包括15 g·L−1 EDTA·2Na、0.43 g·L−1 ZnSO4·7H2O、0.24 g·L−1 CoCl2·6H2O、0.99 g·L−1 MnCl2·4H2O、0.25 g·L−1 CuSO4·5H2O、0.22 g·L−1 Na2MoO4·2H2O、0.19 g·L−1 NiCl2·6H2O、0.014 g·L−1 H3BO3。
-
常规分析项目。每隔12 h将封口瓶静置2 min,用胶头滴管吸取上清液5 mL,经过中速定性滤纸过滤后检测NH4+-N、NO3−-N、NO2−-N、SO42−等指标。NH4+-N、NO2−-N、NO3−-N均采用标准方法[18]测定;SO42-经过0.22 μm聚醚砜注射器过滤头(Therom ScientificTM)过滤,采用电导检测器(IC-900,DIONEX,USA)离子色谱法测定;pH采用pH计(PHS-3E,SINCE,CHN)监测;MLSS采用污泥浓度计(TSS-PORTABLE,HACH,USA)监测,并用标准方法[18]辅助校准。
-
NO3−-N、NO2−-N、NH4+-N去除速率根据式(4)进行计算;Anammox在NO2−-N去除过程中贡献比根据式(5)进行计算;SADN后半程在NO2−-N去除过程中贡献比根据式(6)计算;S0ADN前半程SO42−产生浓度根据式(7)计算;S0ADN后半程SO42−产生浓度根据式(8)计算;S0ADN全程SO42−产生浓度根据式 (9) 计算;Anammox去除NH4+-N需要的NO2−-N浓度根据式(10)计算。
式中:R为污染物去除速率,kg·(m³·d)−1;∆C表示氮素转化量,mg·L−1;∆T表示反应时间,d。
式中:PA表示Anammox在NO2−-N去除过程中贡献比,%;∆
$ {C}_{\mathrm{N}{\mathrm{H}}_{4}^{+}-\mathrm{N}} $ 表示NH4+-N转化量,mg·L−1;∆$ {C}_{\mathrm{N}{\mathrm{O}}_{2}^{-}-\mathrm{N}} $ 表示NO2−-N转化量,mg·L−1;∆$ {C}_{\mathrm{N}{\mathrm{O}}_{3}^{-}-\mathrm{N}} $ 表示NO3−-N转化量,mg·L−1。式中:PS2表示SADN后半程在NO2−-N去除过程中贡献比,%。
式中:CS1表示S0ADN前半程SO42−产生浓度,mg·L−1。
式中:CS2表示S0ADN后半程SO42−产生浓度,mg·L−1。
式中:CS表示S0ADN全程SO42−产生浓度,mg·L−1。
式中:
$ {C}_{\mathrm{N}{\mathrm{O}}_{2}^{-}-\mathrm{N}} $ 表示Anammox去除NH4+-N需要的NO2−-N浓度,mg·L−1。 -
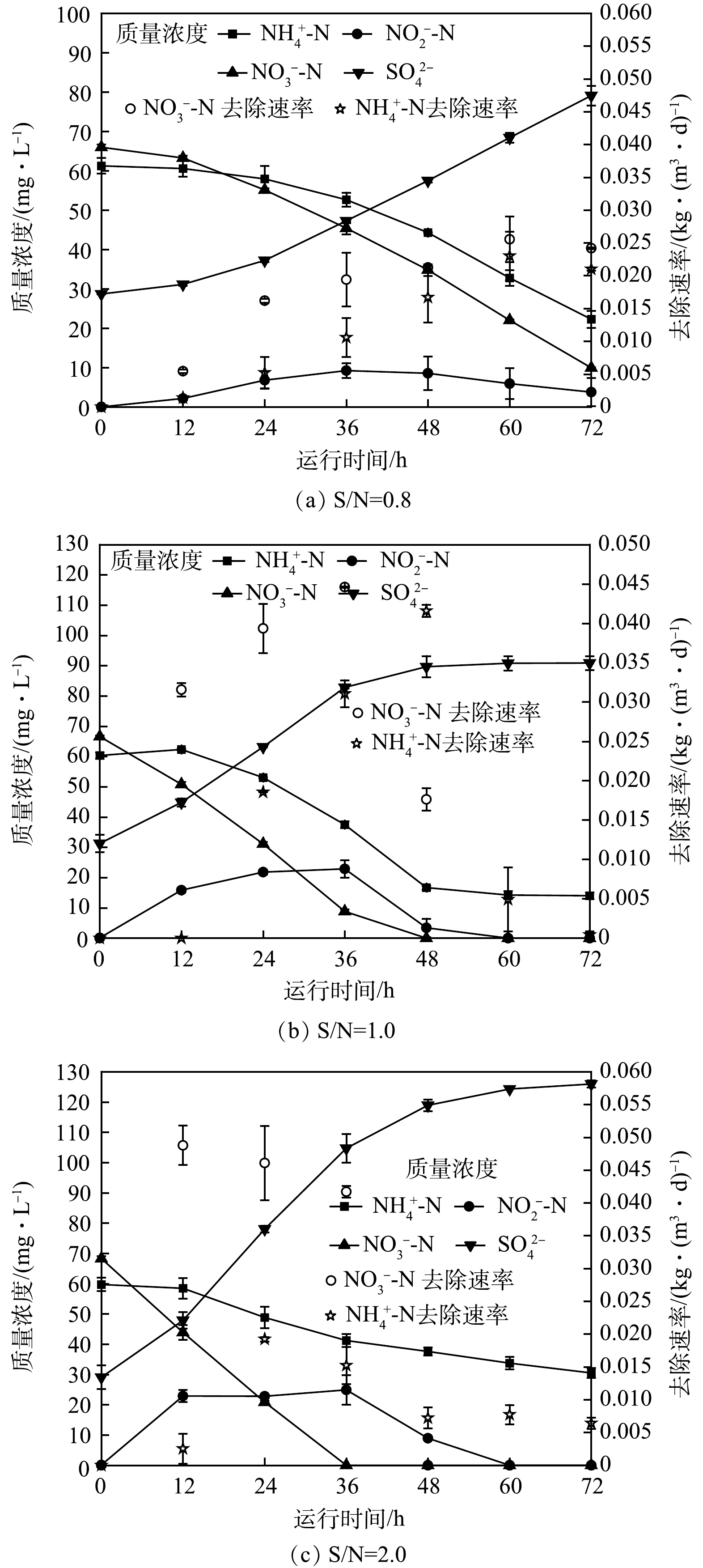
NH4+-N、NO3−-N去除和NO2−-N与SO42−的生成情况如图1所示。在S0ADN-Anammox系统中,NH4+-N并未被快速去除,随着NO2−-N的逐渐累积,NH4+-N去除率显著提升;而在运行初期,NO3−-N发生了明显转化。当S/N=0.8时(图1(a)),NH4+-N和NO3−-N质量浓度均呈下降趋势,72 h后分别剩余22 mg·L−1和10 mg·L−1,NH4+-N和NO3−-N最高去除速率分别为0.023 kg·(m³·d)−1和0.026 kg·(m³·d)−1,在此过程中NO2−-N累积最高达9 mg·L−1,SO42−增加至50 mg·L−1。当S/N=1时(图1(b)),NH4+-N和NO3−-N均被显著去除,72 h后NH4+-N剩余14 mg·L−1,而NO3−-N在48 h后被完全去除,NH4+-N和NO3−-N去除速率最高达0.042 kg·(m³·d)−1和0.045 kg·(m³·d)−1,NO2−-N累积最高达22 mg·L−1,SO42−共增加60 mg·L−1。当S/N=2时(图1(c)),NO3−-N明显去除,而NH4+-N去除效果不佳,72 h后NH4+-N仍剩余31 mg·L−1,NO3−-N则在36 h完全去除,NO3−-N去除速率最高达0.049 kg·(m³·d)−1,NH4+-N去除速率最高仅为0.019 kg·(m³·d)−1,NO2−-N累积情况与S/N=1时类似,最高为24 mg·L−1,SO42−共增加约97 mg·L−1。
上述实验结果表明,当S/N为1时,Anammox充分反应,耦合系统脱氮性能较好;而在S/N不足时,S0ADN前半程无法提供充足NO2−-N底物,导致Anammox无法充分反应;S/N过高,S0ADN前半程快速将NO3−-N转化为NO2−-N,但Anammox反应受到抑制。
批次实验1以NH4+-N和NO3−-N作为底物,在S0ADN-Anammox条件下探究适宜的S/N。当S/N充足时,S0ADN前半程会快速提供足量的NO2−-N底物,S0ADN前半程没有完成时,Anammox反应仍具备一定NO2−-N竞争能力。这与ZHOU等[19]研究结果一致,他们发现,当存在NO3−-N时,S0往往优先与NO3−-N反应生成NO2−-N,S0ADN后半程速率很低。故S0ADN-Anammox系统耦合情况可以根据S0ADN前半程产生的NO2−-N分别通过Anammox和S0ADN后半程去除的占比情况进行判断,根据式(5)和式(6)计算可得,系统中通过Anammox 和S0ADN后半程去除的NO2−-N占比情况如图2所示。
由图2可以看出,当S/N由0.8增加至2,PS2由1%升至44%,而PA由99%下降至56%,总氮去除率在S/N=1时最高,可达89%,而S/N为0.8和2时,总氮去除率仅为72%和76%。根据式(7)~(9)计算可得,批次实验1 中在S/N分别为0.8、1.0、2.0的实验组中,理论上用于将Anammox产生的NO3−-N转化为NO2−-N所需的SO42−和通过S0ADN后半程去除NO2−-N所产生的SO42−质量浓度总和分别为50、56和86 mg·L−1,与实际测量值近似,这可验证上述结果的准确性。数据分析结果表明,当S/N=1时,Anammox反应充分,系统总氮去除率较高,当S/N较低时,S0溶解产生可被微生物利用的多硫化物速率较慢,限制S0ADN前半程反应速率,即NO2−-N生成速率降低,故Anammox虽然可以获得系统中大部分NO2−-N进行反应,但NO2−-N质量浓度不足以将NH4+-N完全去除,NO3−-N和NH4+-N均未完全去除,导致系统总氮去除率较低。S/N过高则会导致大量NO2−-N通过SADN后半程去除,Anammox反应占比下降,最终导致系统总氮去除率降低。
综上所述,在批次实验中,S/N=1更有利于S0ADN-Anammox系统的高效运行,由于S0参与反应需要溶解的过程,系统中需要保存一定量固态S0以确保具有生物有效性的多硫化物供微生物进行S0ADN前半程反应[20-21],因此,该S/N控制值略高于理论值;而S/N过高则会导致Anammox反应受到抑制,进而不利于NH4+-N的去除。
在HUO等[12]的研究中,UASB反应器内部完全依靠水流作用进行泥水混合,系统内会因重力不均出现分层现象,较重的S0颗粒大部分沉在反应器底部形成沉淀,无法与微生物充分接触并参与反应。LI等[22]在连续流厌氧发酵罐中以S/N为2.1启动S0ADN-Anammox系统,当NO3−-N完全转化后,仍剩余S/N约为1.34,由于实验装置没有泥水分离装置,发酵罐内污泥携带S0随出水持续排出,经外接沉淀池沉淀后,再用蠕动泵将污泥送回发酵罐,此时部分S0以溶解态存在于上清液或小颗粒态漂浮在表面没有被抽入发酵罐,因此实际重返发酵罐的S0远低于1.34。这些研究中虽然投入大量S0,但实际只有小部分参与反应,因此没有表现出S/N过高对Anammox反应的抑制现象。
-
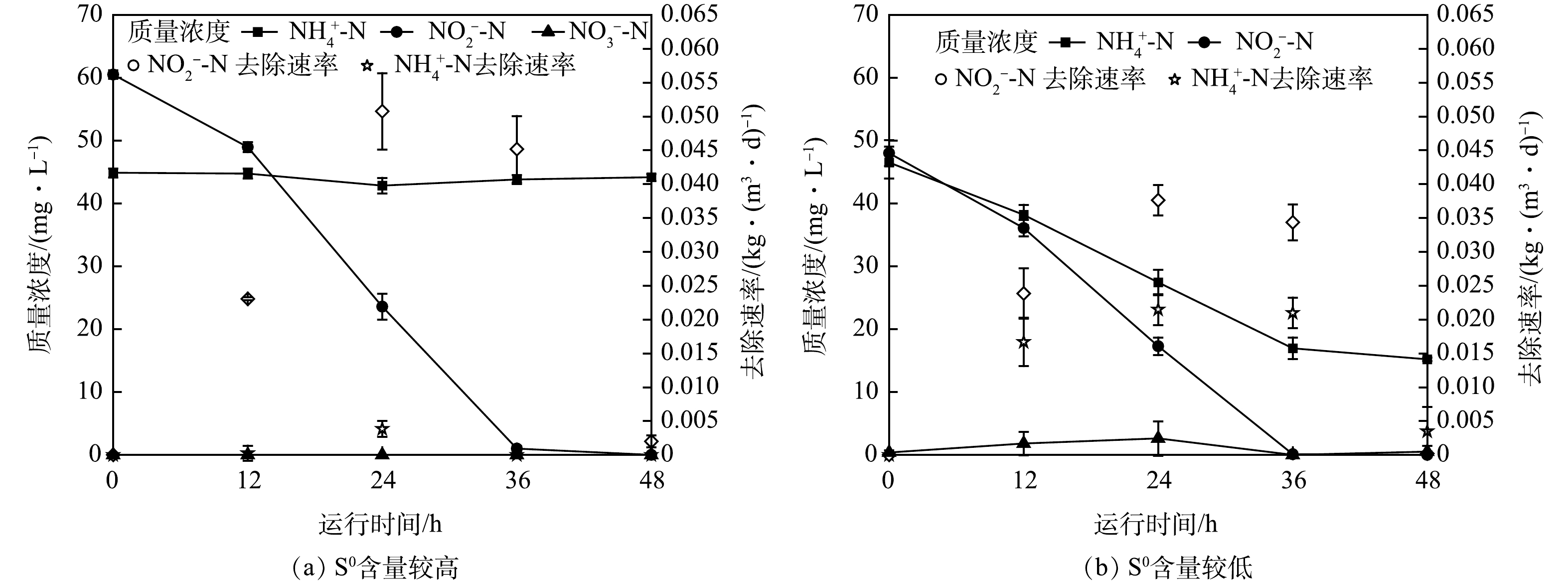
在S0ADN-Anammox耦合系统中,当系统中NO3−-N被S0ADN前半程转化后,Anammox反应与S0ADN后半程竞争共同底物NO2−-N。为考察S0的含量对这一竞争过程的影响,进行了3次批次实验。批次实验2和3的进水中仅含NH4+-N和NO2−-N,接种污泥分别取自同一连续流S0ADN-Anammox反应器的不同运行阶段,中间间隔9 d,批次实验2的污泥中S0含量远高于批次实验3。2次实验中NH4+-N、NO2−-N和NO3−-N的转化情况如图3所示。
当S0含量较高时(图3(a)),反应初期,NO2−-N质量浓度显著下降,48 h 后NO2−-N被完全去除;NO2−-N去除速率在前24 h升至0.050 kg·(m³·d)−1,之后开始逐渐下降,至48 h仅为0.002 kg·(m³·d)−1。而NH4+-N质量浓度始终保持在45 mg·L−1左右,几乎没有发生转化,NH4+-N去除速率始终处于0.004 kg·(m³·d)−1以下。在这过程中始终未检测到NO3−-N。
当S0含量较低时(图3(b)),在反应48 h后,NH4+-N下降至15 mg·L−1,其去除速率上升至0.021 kg·(m³·d)−1,而后逐渐下降至0.003 kg·(m³·d)−1。NO2−-N经过36 h后被完全去除,其转化速率在24 h升高至0.038 kg·(m³·d)−1。随着反应进行,NO3−-N质量浓度在前24 h逐渐升高至2.7 mg·L−1,36 h后又降为0 mg·L−1。在整个实验过程中,NO2−-N、NH4+-N分别去除了48 mg·L−1和32 mg·L−1。
上述实验结果表明,在高S0含量的条件下,仅有S0ADN后半程反应发生,而无Anammox反应发生;而在低S0含量条件下,Anammox反应在NO2−-N、NH4+-N的去除过程中表现明显的主导作用。这可能是S0对S0ADN后半程和Anammox的底物竞争产生了明显的影响。
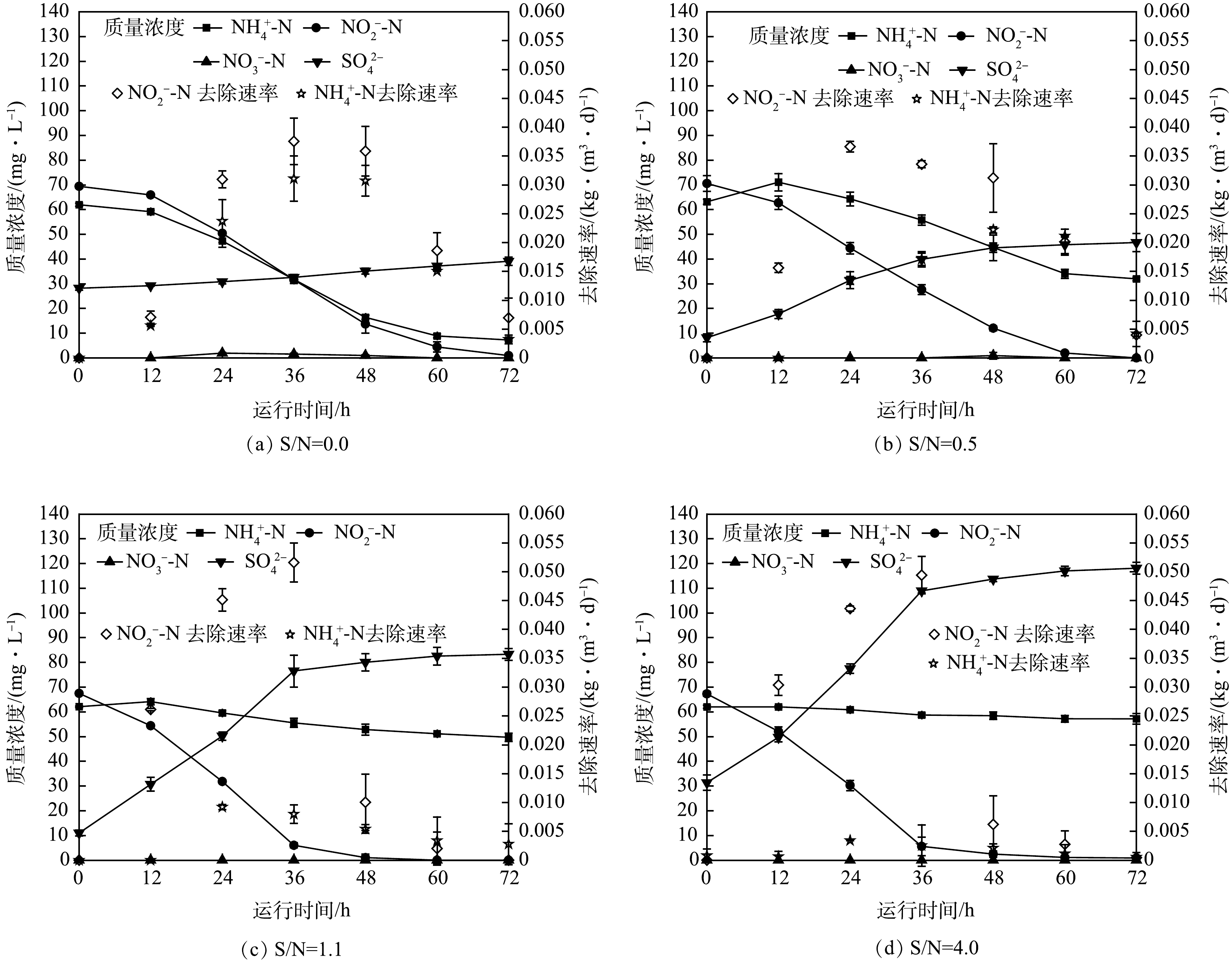
为进一步明确不同S0含量对上述2个反应过程的影响程度,进行了批次实验4。将连续流反应器中取出的污泥用清水清洗5遍,以去除污泥中存留的S0。将等量的污泥加入4个封口瓶中,并投加不同的S0(S/N分别为0、0.5、1.1和4),NH4+-N和NO2−-N的初始质量浓度均分别控制在60 mg·L−1和66 mg·L−1左右。实验中NO2−-N、NH4+-N去除和NO3−-N与SO42−的生成转化情况如图4所示。如图4(a)所示,当S/N=0时,NH4+-N和NO2−-N被明显去除,在反应的前36 h,NH4+-N和NO2−-N去除速率持续上升至0.031 kg·(m³·d)−1和0.037 kg·(m³·d)−1,反应过程中发现NO3−-N生成,24~48 h NO3−-N质量浓度维持在1~2 mg·L−1,SO42−在整个过程增加了11 mg·L−1,NH4+-N和NO2−-N分别去除了55 mg·L−1和68 mg·L−1。如图4(b)所示,当S/N增至0.5时,NO2−-N去除情况不变,NH4+-N在72 h后仍剩余32 mg·L−1,NH4+-N去除速率略微下降至0.022 kg·(m³·d)−1。过程中并未检测出NO3−-N,SO42−在整个批次实验中增加了39 mg·L−1,NH4+-N、NO2−-N分别去除了31 mg·L−1和70 mg·L−1。如图4(c)所示,继续增加S/N至1.1时,NO2−-N去除效果良好,而NH4+-N质量浓度下降缓慢,72 h后仍剩余50 mg·L−1,NH4+-N去除速率低于0.008 kg·(m³·d)−1,过程中并未检测出NO3−-N。SO42−在反应过程中增加了72 mg·L−1,NH4+-N和NO2−-N分别去除12 mg·L−1和67 mg·L−1。如图4(d)所示,当S/N继续增加至4时,72 h后NH4+仅去除了5 mg·L−1,NO2−-N被完全去除且去除速率最高达0.049 kg·(m³·d)−1。过程中同样未检测出NO3−-N,SO42−共增加了87 mg·L−1。
批次实验4结果表明,当耦合系统中S0ADN前半程将NO3−-N转化后,S/N极低情况下,Anammox可以在NO2−-N和NH4+-N的去除中占据主导地位,随着S/N增加,Anammox反应情况逐渐恶化,当S/N为0.5、1.1时,NH4+-N去除量分别减少了24 mg·L−1和43 mg·L−1,当S/N为4时,主要发生S0ADN后半程反应,Anammox已无法正常进行。
批次实验2和3中的底物转化情况表明,实验中NH4+-N和NO2−-N不同的转化情况,不是由于2次实验接种污泥中Anammox数量不同所致,而是由于不同S0含量对Anammox的转化作用所致。
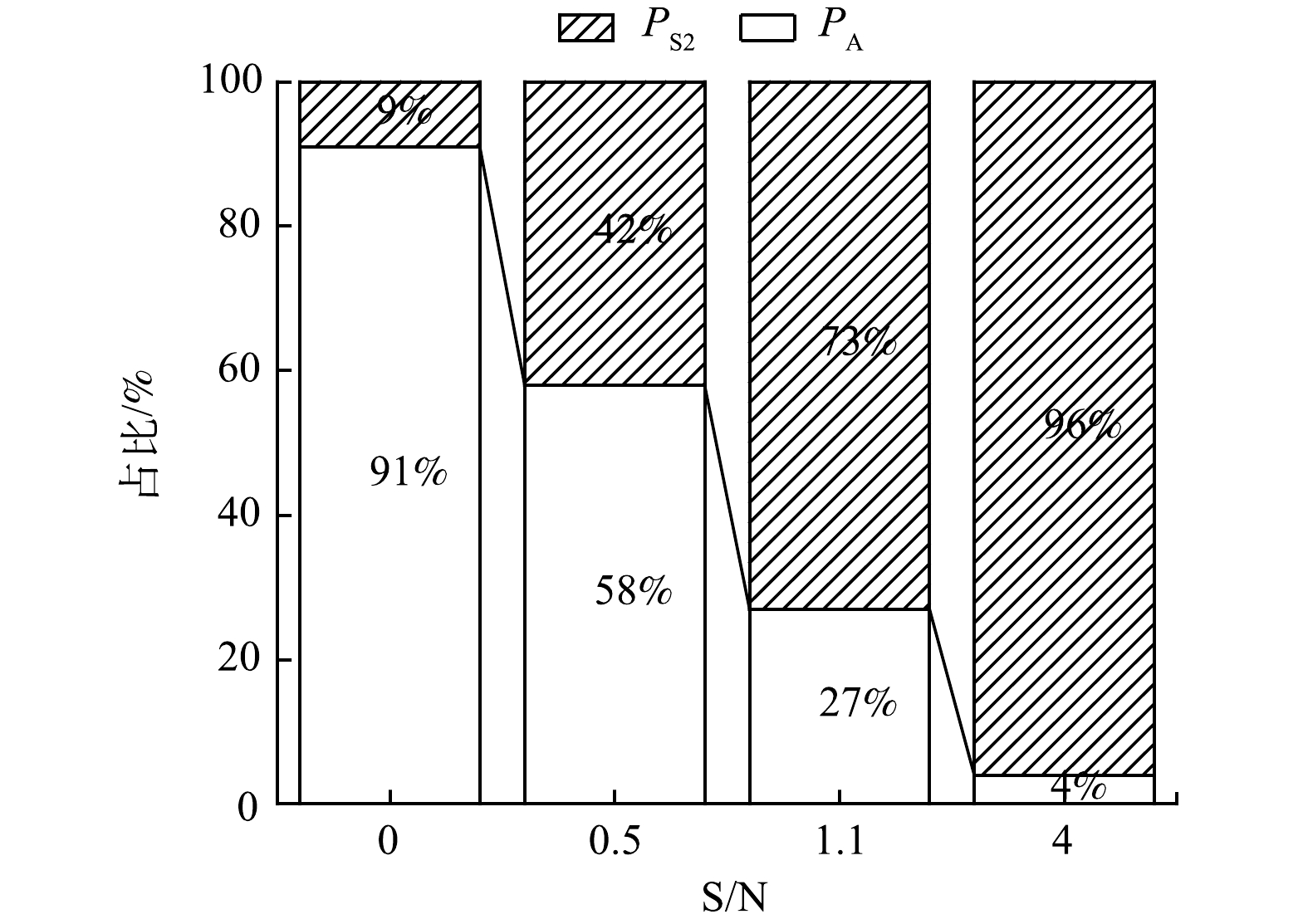
通过批次实验4,探究不同S0含量对S0ADN后半程与Anammox竞争的影响。结果表明,当耦合系统中S0ADN前半程将NO3−-N转化完成,随着S/N增加,更多NO2−-N会通过S0ADN后半程去除,而并没有通过Anammox途径去除,导致NH4+-N去除效果恶化。根据式(5)和式(6)计算可得批次实验4中PS2和PA的分布情况,结果如图5所示。
由图5可以看出,随着系统中S/N由0增加至4,PS2逐渐由9%升至96%,而PA从91%下降至4%,根据式(7)~(9)计算可得,在批次实验4中,当 S/N分别为0.0、0.5、1.1、4.0的实验组中,理论上产生的SO42−质量浓度总和分别为26、37、62和77 mg·L−1,与实际测量值近乎一致,可验证上述结果的准确性。
结果表明,当S0ADN-Anammox系统中NO3−-N通过S0ADN前半程快速转化后,仅存在NO2−-N和NH4+-N时,S0的存在会加快S0ADN后半程对NO2−-N的利用速率,从而对Anammox过程产生抑制作用,且S/N越高,S0ADN后半程获得的NO2−-N越多,Anammox越难发挥作用。FU等[23]在USAB反应器中启动S0ADN-Anammox系统,将进水中NO3−-N换为NO2−-N,过量投加S0,NO2−-N去除率为100%,NH4+-N去除率仅为50%,将近50% NO2−-N通过S0ADN后半程去除,说明当S0存在时,确实会导致SADN后半程竞争更多的NO2−-N底物。
-
1)采用略高于理论值的S/N,使系统中固态S0存量满足多硫化物溶解的需求,即可保证S0ADN-Anammox耦合系统有良好的性能。批次实验的结果表明,S/N为1时,系统的总氮去除率可达89%,其中NH4+-N去除率为77%,NO3−-N去除率为100%。
2)在进水含NO2−-N和NH4+-N的实验结果表明,S0含量会明显增强S0ADN后半程对NO2−的竞争能力。因而S/N过高会抑制S0ADN-Anammox耦合系统中Anammox过程对底物的竞争能力,降低NH4+-N去除效果。
S/N对硫自养反硝化耦合厌氧氨氧化反应氮素转化的影响
Effect of S/N on nitrogen transformation in sulfur autotrophic denitrification coupled anaerobic ammonium oxidation reaction
-
摘要: S0基硫自养反硝化耦合厌氧氨氧化(sulfur autotrophic denitrification anammox, S0ADN-Anammox)工艺中普遍存在S/N较高问题,从而造成S0的浪费。为此,通过批次实验,在不考虑S0流失条件下,优化了以S0为电子供体的系统中适宜的S/N,并通过底物控制策略,模拟S0ADN前半程完全反应,仅存在后半程与Anammox的系统环境,讨论在不同S0存在的情况下S0ADN后半程和Anammox对NO2−-N的竞争能力。结果表明,在不同的S0投加量条件下,S0ADN-Anammox系统会表现出不同的脱氮性能,当S/N=1,S0ADN-Anammox系统总氮去除率较高,达89%,其中NH4+-N和NO3−-N的去除率分别为77%和100%;当只存在NO2−-N和NH4+-N时,S0质量浓度越高,Anammox可获得的NO2−-N越少,S0ADN后半程对NO2−-N的竞争能力要强于Anammox,过高的S/N会影响NH4+-N去除效果。
-
关键词:
- 硫自养反硝化耦合厌氧氨氧化 /
- S/N的影响 /
- 底物竞争关系
Abstract: There is a common problem of high S/N in the S0-based sulfur autotrophic denitrification coupled anaerobic ammonium oxidation (sulfur autotrophic denitrification anammox, S0ADN-Anammox) process, resulting in the waste of S0. Thus, batch experiments were conducted to optimize the appropriate S/N in the sulfur autotrophic denitrification coupled anaerobic ammonium oxidation system when S0 was taken as the electron donor without considering the loss of S0. And the first half stage of the complete reaction of S0ADN was simulated through the substrate control strategy, then in the system environment of the second half stage of S0ADN and Anammox, their competitive ability for NO2−-N in the presence of different S0 was discussed. The results showed that the S0ADN-Anammox system had a different denitrification performance at different S0 dosage. When S/N=1, the total nitrogen removal rate of the S0ADN-Anammox system was high and reached 89%, of which the removal rates of NH4+-N and NO3−-N were 77% and 100%, respectively; when only NO2−-N and NH4+-N existed, the higher the S0 mass concentration, the less NO2−-N available to Anammox, and the competitive ability for NO2−-N in the second half of S0ADN was stronger than Anammox, and too high S/N could affect the NH4+-N removal effect.-
Key words:
- S0ADN-Anammox /
- the impact of S/N /
- substrate competition relationship
-

-
表 1 批次实验接种污泥理化性质
Table 1. Physical and chemical properties of inoculated sludge in batch experiments
批次实验 连续流反应器运行时间/d MLSS/ (mg·L−1) 污泥性状 预处理 1 149 2 500 S0ADN及Anammox反应均良好 有 2 93 1 320 污泥中S0含量较高 无 3 102 1 350 污泥中S0含量较少 无 4 116 2 100 S0ADN及Anammox反应均良好 有 表 2 连续流反应器进出水水质
Table 2. Inlet and outlet water quality of the continuous flow reactor
连续流反应器
运行时间/dNH4+-N/(mg·L−1) NO3−-N/(mg·L−1) NO2−-N/(mg·L−1) SO42−/(mg·L−1) S/N 进水 出水 进水 出水 进水 出水 进水 出水 149 50 7 63 10 7 1 27 95 1.5 93 50 45 60 0 2 0 20 139 3.0 102 55 25 60 0 3 0 19 128 0.0 116 55 4 60 0 4 0 17 93 2.0 表 3 批次实验条件
Table 3. Batch experimental conditions
批次实验 配水水质 底物质量浓度/(mg·L−1) S/N 运行时间/h NH4+-N/(mg·L−1) NO3−-N/(mg·L−1) NO2−-N/(mg·L−1) 1 自来水 60 66 0 0.8 72 60 66 0 1.0 72 60 66 0 2.0 72 2 连续流反应器出水 45 0 60 较高 48 3 连续流反应器出水 47 0 48 较低 48 4 自来水 60 0 66 0.0 72 60 0 66 0.5 72 60 0 66 1.1 72 60 0 66 4.0 72 -
[1] ZHANG M, WANG S Y, JI B, et al. Towards mainstream deammonification of municipal wastewater: Partial nitrification-anammox versus partial denitrification-anammox[J]. Science of the Total Environment, 2019, 692: 393-401. doi: 10.1016/j.scitotenv.2019.07.293 [2] TOMASZEWSKI M, CEMA G, ZIEMBIŃSKA-BUCZYŃSKA A. Influence of temperature and pH on the anammox process: A review and meta-analysis[J]. Chemosphere, 2017, 182: 203-214. doi: 10.1016/j.chemosphere.2017.05.003 [3] WETT B, OMARI A A, PODMIRSEG S M, et al. Going for mainstream deammonification from bench to full scale for maximized resource efficiency[J]. Water Science and Technology, 2013, 68(2): 283-289. doi: 10.2166/wst.2013.150 [4] GRAAF. A A V D, BRUIJN. P D, ROBERTSON. L A, et al. Autotrophic growth of anaerobic ammonium-oxidizing micro-organisms in a fluidized bed reactor.[J]. Microbiology, 1996, 142(8): 2187-2196. doi: 10.1099/13500872-142-8-2187 [5] XU D D, YING S Y, WANG Y H, et al. A novel SAD process: Match of anammox and denitrification[J]. Water Research, 2021, 193: 116874-116874. doi: 10.1016/j.watres.2021.116874 [6] CUI B, YANG Q, LIU X H, et al. Achieving partial denitrification-anammox in biofilter for advanced wastewater treatment[J]. Environment International, 2020, 138: 105612-105612. doi: 10.1016/j.envint.2020.105612 [7] LIU H G, DONG W Y, ZHAO Z Z, et al. Anammox-based technologies for municipal sewage nitrogen removal: Advances in implementation strategies and existing obstacles[J]. Journal of Water Process Engineering, 2023, 55: 104090-104090. doi: 10.1016/j.jwpe.2023.104090 [8] Li Y, Chen B H, Zhang X L, et al. Elemental sulfur autotrophic partial denitrification (S0-PDN) with high pH and free ammonia control strategy for low-carbon wastewater: From performance to microbial mechanism. Chemical Engineering Journal. 2023; 474: 145419-145419. [9] WANG T, LI X, WANG H, et al. Sulfur autotrophic denitrification as an efficient nitrogen removals method for wastewater treatment towards lower organic requirement: A review[J]. Water Research, 2023, 245: 120569-120569. doi: 10.1016/j.watres.2023.120569 [10] SUN Y M, NEMATI M. Evaluation of sulfur-based autotrophic denitrification and denitritation for biological removal of nitrate and nitrite from contaminated waters[J]. Bioresource Technology, 2012, 114: 207-216. doi: 10.1016/j.biortech.2012.03.061 [11] CHEN F M, LI X, YUAN Y, et al. An efficient way to enhance the total nitrogen removal efficiency of the Anammox process by S0-based short-cut autotrophic denitrification[J]. Journal of Environmental Sciences, 2019, 81: 214-224. doi: 10.1016/j.jes.2019.01.010 [12] HUO D, DANG Y, SUN D Z, et al. Efficient nitrogen removal from leachate by coupling Anammox and sulfur-siderite-driven denitrification[J]. Science of The Total Environment, 2022, 829: 154683-154683. doi: 10.1016/j.scitotenv.2022.154683 [13] POKORNA D, ZABRANSKA J. Sulfur-oxidizing bacteria in environmental technology[J]. Biotechnology Advances, 2015, 33(6): 1246-1259. doi: 10.1016/j.biotechadv.2015.02.007 [14] ZHANG K, KANG T L, YAO S, et al. A novel coupling process with partial nitritation-anammox and short-cut sulfur autotrophic denitrification in a single reactor for the treatment of high ammonium-containing wastewater[J]. Water Research, 2020, 180: 115813. doi: 10.1016/j.watres.2020.115813 [15] CUI Y X, GUO G, EKAMA G A, et al. Elucidating the biofilm properties and biokinetics of a sulfur-oxidizing moving-bed biofilm for mainstream nitrogen removal[J]. Water Research, 2019, 162: 246-257. doi: 10.1016/j.watres.2019.02.061 [16] CHEN F M, LI X, GU C D, et al. Selectivity control of nitrite and nitrate with the reaction of S0 and achieved nitrite accumulation in the sulfur autotrophic denitrification process[J]. Bioresource Technology, 2018, 266: 211-219. doi: 10.1016/j.biortech.2018.06.062 [17] WANG T, GUO J B, SONG Y Y, et al. Efficient nitrogen removal in separate coupled-system of anammox and sulfur autotrophic denitrification with a nitrification side-branch under substrate fluctuation[J]. Science of the Total Environment, 2019, 696: 133929-133929. doi: 10.1016/j.scitotenv.2019.133929 [18] AMERICAN PUBLIC HEALTH ASSOCIATION (APHA) A W W A A, WATER ENVIRONMENT FEDERATION (AEF). Standard methods for the examination of water and wastewater. [J]. Washington, DC, USA, 2005. [19] ZHOU W L, SUN Y J, WU B T, et al. Autotrophic denitrification for nitrate and nitrite removal using sulfur-limestone[J]. Journal of Environmental Sciences, 2011, 23(11): 1761-1769. doi: 10.1016/S1001-0742(10)60635-3 [20] HUILINIR C, ACOSTA L, YANEZ D, et al. Elemental sulfur-based autotrophic denitrification in stoichiometric S(0)/N ratio: Calibration and validation of a kinetic model[J]. Bioresource Technology, 2020, 307: 123229-123229. doi: 10.1016/j.biortech.2020.123229 [21] WANG Y, BOTT C, NERENBERG R. Sulfur-based denitrification: Effect of biofilm development on denitrification fluxes[J]. Water Research, 2016, 100: 184-193. doi: 10.1016/j.watres.2016.05.020 [22] LI X, YUAN Y, HUANG Y, et al. Simultaneous removal of ammonia and nitrate by coupled S0-driven autotrophic denitrification and Anammox process in fluorine-containing semiconductor wastewater[J]. Science of the Total Environment, 2019, 661: 235-242. doi: 10.1016/j.scitotenv.2019.01.164 [23] FU K M, ZENG Z X, HUANG S W. Effect of sulfur autotrophic denitrification sludge on the start-up characteristics of anaerobic ammonia oxidation[J]. Water, 2023, 15(7): 1275-1275. doi: 10.3390/w15071275 -



 下载:
下载: