-
近年来,全球环境恶化,土壤环境受到严重影响。土地荒漠化、盐碱化、重金属污染等不利因素会导致土壤肥力急剧下滑,引起农作物减产[1-2]。在土壤科学的研究中,学者们发现土壤中有机质含量是影响土壤肥效的主要因素,肥沃的土壤通常有机质含量较高。而土壤有机质的一种主要成分是腐植质,占据其总量的75%以上[3]。腐植质广泛存在于天然水体和土壤中,是动植物残体在经历漫长的生物和物理化学过程后形成的有机聚合物[4]。腐殖酸 (humic acid,HA) 是一类典型且高活性的腐植质。根据分子量大小和溶解度的不同,腐殖酸分为黄腐酸 (又称富里酸 (fulvic acid,FA) ) 、棕腐酸与黑腐酸。不同种类的腐殖酸具有相似的官能团结构,主要包含苯环、稠苯环和各种杂环,这些苯环通过桥键相连,上面带有羧基、酚羟基、甲氧基、酮基等多种官能团[5]。自然界的腐殖酸主要源自于动植物残骸,通过微生物分解、物化作用以及地球化学过程逐渐形成和积累[6]。它广泛分布于自然界,包括土壤、低级煤炭、生物质和水体等。由于腐殖酸独特的物理和化学特性,使其得到广泛应用。特别是在农业领域,腐殖酸被广泛用于土壤改良和肥料处理。
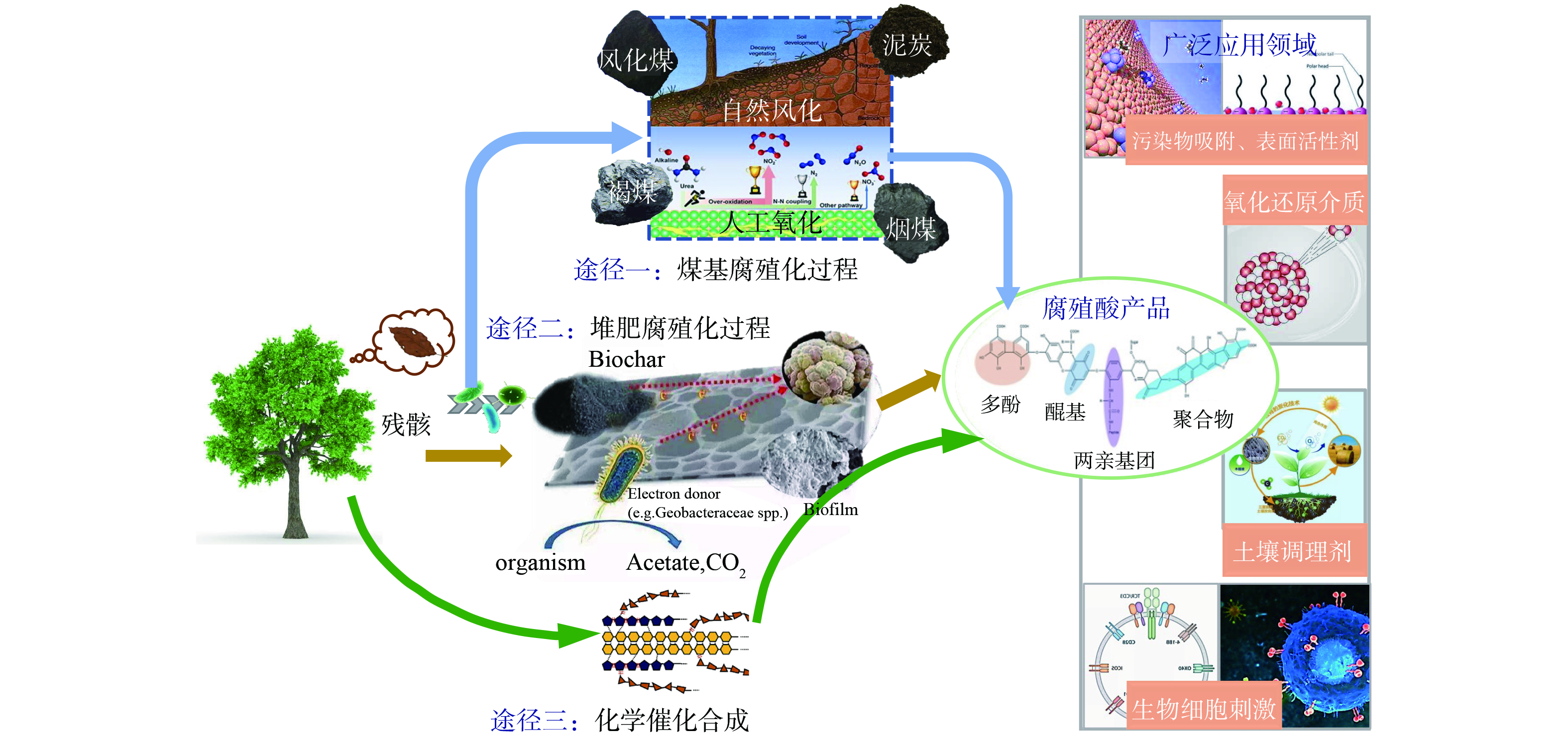
目前,工业大规模应用的腐殖酸主要通过两种途径生产 (如图1所示) 。一种是从化石原料中提取,利用泥炭、褐煤、风化煤等矿物,通过化学氧化形成腐殖酸,进而通过酸处理去除部分矿物质。随后,采用稀碱溶液进行萃取,再将萃取液酸化,得到腐殖酸沉淀[6]。天然腐殖酸的生产受到泥炭等化石原料来源的限制。传统的氧化过程中采用的HNO3、H2O2、KMnO4等氧化剂具有不良的环境影响,这对其未来的发展构成一定的限制。
腐殖酸的另外一种生产途径是人工合成腐殖酸。人工合成腐殖酸是人为模拟并加速自然界中的腐殖化过程,将生物质等有机废物转化为腐殖酸类物质。相较而言,人工合成腐殖酸可以通过调整合成工艺条件,确定腐殖酸产品的化学性质和表面官能团组成[7],以满足后续多种利用的需求。另一方面,人工合成腐殖酸是利用工农业生产活动的附属物或废弃物等有机废物为原料,成本低廉且易于获取。随着生物质化工的发展,人工合成腐殖酸作为一种高效且绿色低碳的腐殖酸合成工艺,在近年逐渐兴起并成为研究热点。
-
在土壤中,天然腐殖酸的形成过程中微生物发挥着关键作用。生物法合成腐殖酸就是借鉴了天然腐殖酸的形成原理,将微生物反应视为腐殖酸形成的主要过程。如图2所示,堆肥过程主要包含两个途径:矿化和腐殖化。组成复杂的有机废物在微生物胞外酶的作用下降解为有机酸、短链糖等小分子产物,进而通过微生物胞内代谢转化为羧酸等代谢中间产物。一方面,小分子产物和代谢中间产物可以被微生物完全矿化产生CO2,即矿化过程;同时也可以作为重要前体,通过特定途径聚合形成腐植质,即腐殖化过程。ZHOU等[8]以食物垃圾和锯末为原料通过生物强化好氧堆肥生产腐殖酸,结果显示,经过堆肥后的产物中,腐殖酸含量显著增加。生物菌剂的加入不仅促进了原料中蛋白质和碳水化合物的腐殖化程度,还增强了美拉德反应,促进了芳香族结构的形成,提高了腐殖酸的分子量。
好氧生物堆肥是一种常用的腐殖酸生物合成方法。传统的好氧堆肥所需的反应时间较长 (可参见表1数据) ,且得到的腐殖酸产物中的化合物种类较单一[9]。QI等[10]通过加入MnO2为反应催化剂,以鸡粪和玉米秸秆为原料进行好氧堆肥,最终得到的腐殖酸产物中的化合物种类明显增多。这是因为MnO2能够重塑好氧堆肥反应中的微生物生态,增加反应体系中的微生物种类,从而促进多种化合物的生成。在后续的研究中,QI等[11]发现MnO2除了对微生物种类多样性有促进作用之外,还促进某些化学官能团的形成,尤其是具有芳香性的官能团。此外,针对不同的反应原料,MnO2所促进形成的官能团有所差异。这些促进作用使得MnO2这一种无污染的绿色添加剂在腐殖酸的生产中得到了广泛应用。
为了促进好氧堆肥反应,除了利用催化剂之外,还可以接种外源微生物。WAN等[34]以鸡粪和玉米秸秆为堆肥原料,通过外加接种微生物的方式促进好氧堆肥过程中产物的生成。通过接种25种已有的菌株和7种功能性菌株,堆肥过程中有机物的降解更加迅速。此外,接种菌株延长了微生物反应最适温度的存在时间,同时提高了最适温度和反应体系pH。通过种子发芽实验验证了通过接种微生物可以使好氧堆肥的腐殖酸产物具有更强的促进植物生长能力。
-
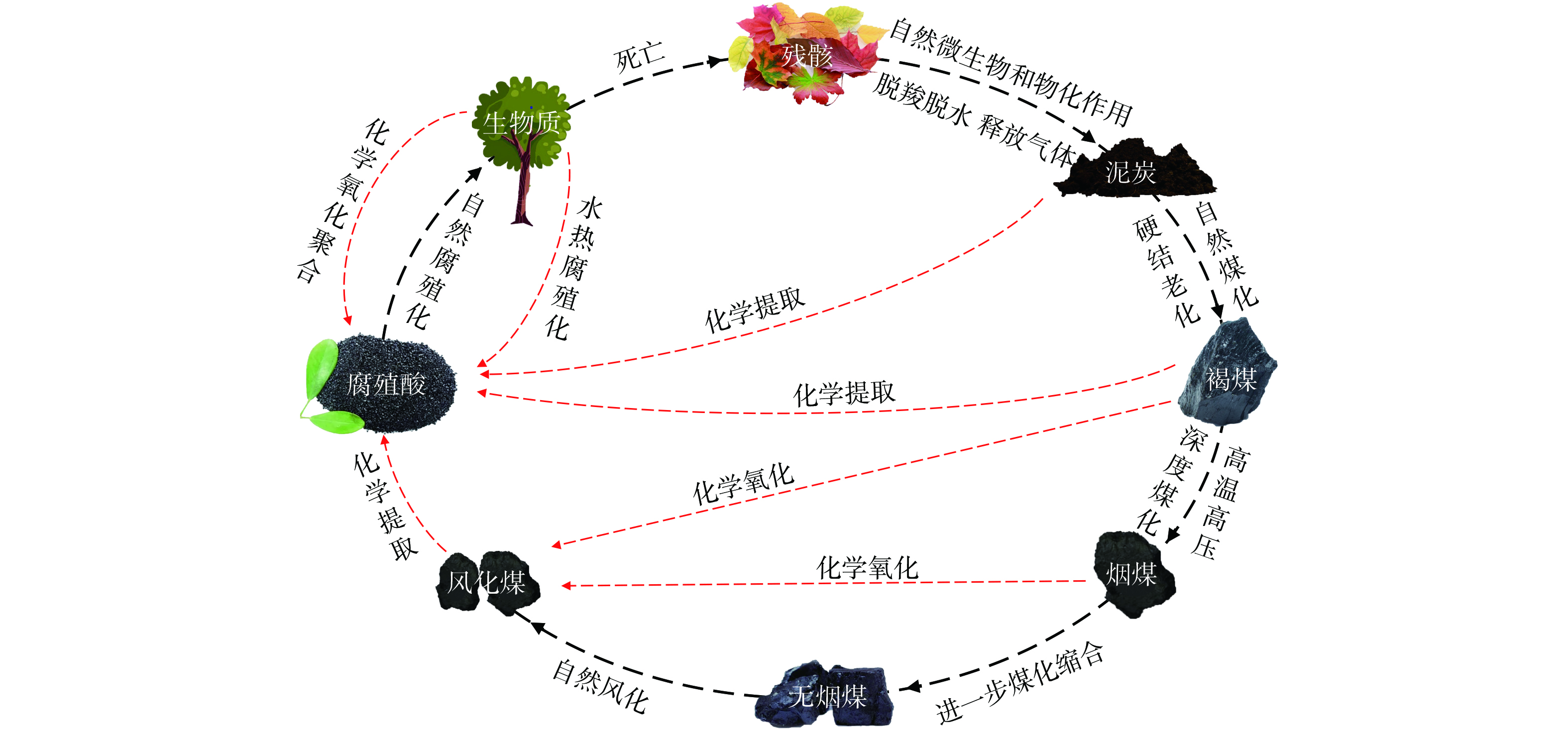
化学方法合成腐殖酸仍然建立在天然腐殖酸形成理论的基础上。我国北方地区土壤温度较低,微生物代谢活动减弱,但却拥有肥沃的黑色土壤。研究表明,黑土壤形成是微生物活动减弱导致化学过程增强的结果。图3展示了黑土壤的自然环境以及其中腐殖酸和富里酸的潜在化学合成途径[29]。这些化学过程可以通过多种方式在实际生产中模拟,本质上都是采用特定手段来缩短天然腐殖酸形成过程所需的化学反应时间。表1总结了近年来采用化学方法合成腐殖酸的相关研究,主要包括氧化聚合反应和水热腐殖化反应。
由表1可以看出,氧化聚合腐殖酸的合成通常需要添加催化剂,常用催化剂包括无机矿物 (如含水锰矿钠、赤铁矿等) 、金属氧化物、天然土壤和沸石等,而氧化剂则主要有H2O2、O2等。其中,无机矿物通常与生物质废弃物共存,它可通过接受腐植质前驱体的电子来促进腐殖化过程。金属氧化物可氧化酚类物质形成半醌自由基,进而促进腐殖化,最终与体系中的氨基酸聚合形成大分子有机化合物。这一过程主要受到所含金属氧化物的性质和含量的影响。在好氧条件下,含有Mn、Al、Fe和Si的氧化物能够增强前驱体小分子的缩合反应,提高大分子有机化合物的产率和腐殖化程度。在这些金属氧化物中,MnO2促进有机物腐殖化的能力最强,这是因为锰氧化物是自然界中催化能力最强的金属氧化物 (金属氧化物的催化能力:Mn(Ⅳ) > Fe(Ⅲ) > Al > Si[35]) ,可用作电子受体参与自然界中许多物质的氧化还原反应。YANG等[21, 36-38]以邻二苯酚、甘氨酸和葡萄糖为原料,使用MnO2作为催化剂进行腐殖酸的合成。研究发现,反应符合多酚学说以及糖-胺缩合学说,MnO2可加速底物的脱水和缩合反应,促进多酚类化合物形成大分子化合物。该合成反应在室温25 °C的下即可进行,但缺点是需要较长的反应时间。合成得到的腐殖酸产物富含羧基、羰基等多种含氧官能团,对污染土壤中重金属离子,尤其是铜、铅以及铬离子,表现出良好的吸附效果。此外,MnO2的化学结构类似于生物酶的活性中心,这也是其腐殖化能力突出的另一个原因。SARLAKI等[39]通过对牛粪进行厌氧消化产生的消化液进行MnO2-KOH-尿素增强的腐殖化反应,在优化条件下,采用7.69 mg·L−1的MnO2、0.57 mol·L−1的KOH和0.63 mol·L−1的尿素,在85 °C下反应106 min,腐殖酸产率达到32.15%,羧酸含量为3.325 mmol·g−1。傅里叶变换红外光谱 (FT-IR) 、X射线光电子能谱 (XPS) 以及热重分析质谱 (TGA-MS) 等分析结果显示,人工合成的腐殖酸与天然腐殖酸在化学结构和功能性官能团上具有相似之处,并且显示出增强的功能性。相比于MnO2,H2O2具有更强的氧化能力,在合成腐殖酸的反应中能够使腐殖酸的生成更加迅速。WANG等[22]利用H2O2作为氧化剂处理了玉米秸秆的碱预处理废液,所得到的腐殖酸产物相较于商业腐殖酸表现出更强的电子传递能力和重金属结合能力。
-
水热腐殖化是一种在密闭容器中进行的化学反应,原材料在高温高压的液体水溶液中发生腐殖化。与氧化聚合合成腐殖酸的方法相比,水热腐殖化无需加入氧化剂或催化剂,通常需要添加酸碱溶剂或有机溶剂,以提高反应体系对腐殖酸产物的溶解度。表2总结并对比了不同合成方法的优缺点,水热腐殖化相对于堆肥过程的周期更短,与化学法相比经济性也更加合理。同时,水热腐殖化与煤制腐殖酸相比,不需要进行氧化、硝化、磺化等多个步骤,操作更加简单。因此,水热腐殖化制备腐殖酸已成为目前生物质腐殖化研究的热点之一。
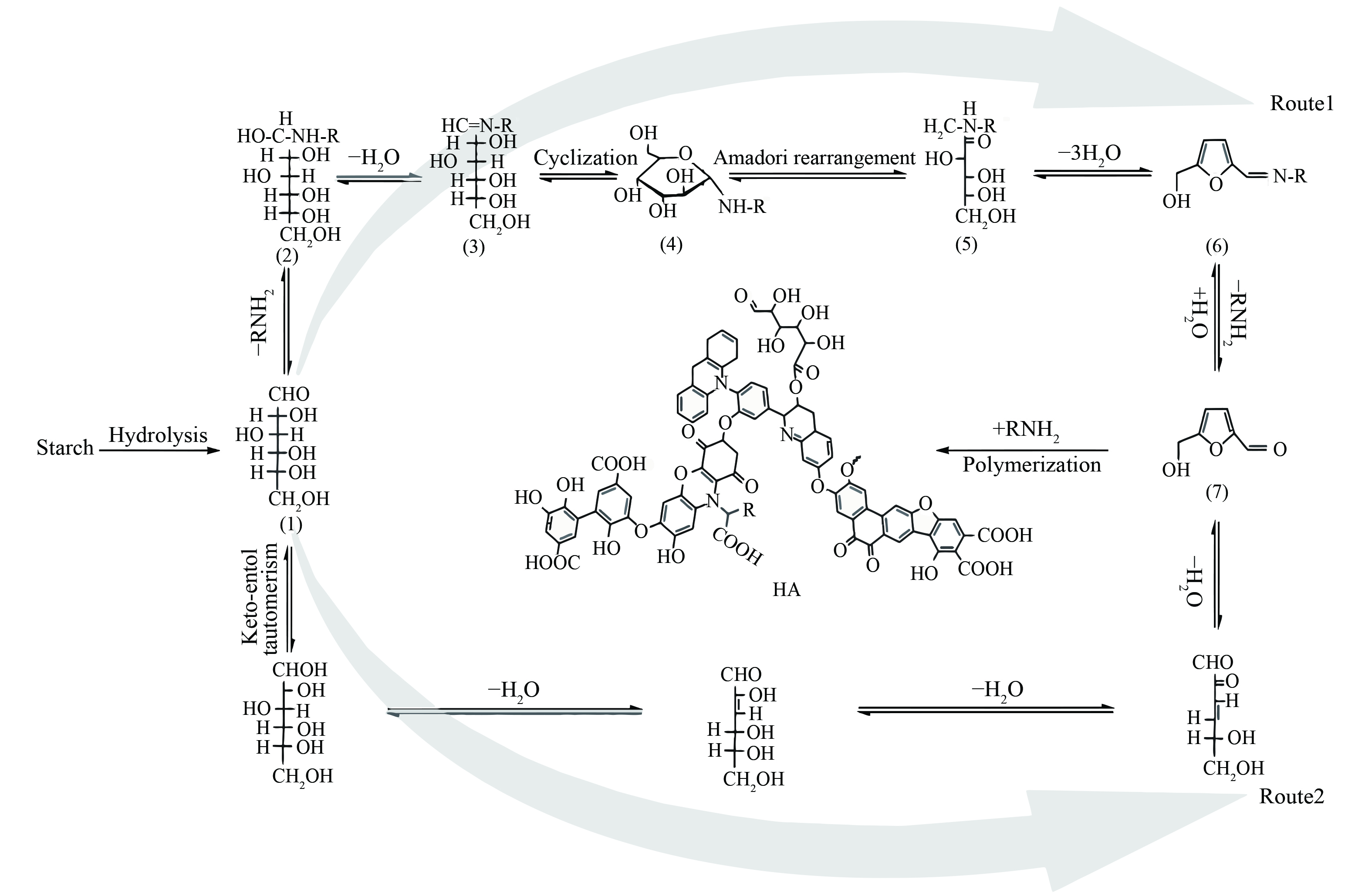
在水热腐殖化过程中,原料不同会导致腐殖化程度和产物的不同。YANG等[29, 40-43]以葡萄糖、木屑和树叶等生物质为原料,在加入KOH作为提取剂的反应体系中进行水热反应的研究。葡萄糖的最终反应产物为黄腐酸,而生物质废物的最终反应产物为腐殖酸。研究表明,最终的腐殖酸产物分子中含有大量的酸性官能团。CHEN等[44]开展了厨余垃圾水热碳化制备腐殖酸的研究,结果表明,在215 °C的条件下,仅需1 h即可成功从食物废弃物中获得43.5%的腐殖酸产率。XPS、FT-IR和核磁共振 (NMR) 等分析表明,所产生的腐殖酸在结构和组成上与从矿物中提取的天然腐殖酸相似。机理研究证明,厨余垃圾中含有的蛋白质可通过氨基酸和葡萄糖的反应显著促进腐殖酸的形成,其中,美拉德反应是关键步骤,具体反应途径可参见图4。
生物质因其来源广泛且成本较低,是水热腐殖化制备腐殖酸的常用原料。在生物质的水热腐殖化反应中,原料和反应条件的差异均会导致腐殖酸产率的不同。王文祥等[45]使用木质纤维素作为原料,发现在碱性水热条件 (0.5 mol·L−1 KOH) 下,腐殖酸的产率最高,可达9.73%。FT-IR、扫描电子显微镜 (SEM) 、三维荧光光谱 (3D-EEM) 以及元素分析结果表明,相比于酸性和中性条件,碱性条件下合成的腐殖酸具有碳含量高 (61.09%) 、酸性官能团含量高 (3.381 mmol·g−1) 、有效成分含量高等优势。WAN等[46]研究发现生物质在酸性条件下会水解生成葡萄糖和木糖,然后降解生成5-羟甲基糠醛 (hydroxymethylfurfural,HMF) 和糠醛等中间产物,进而通过聚合反应转化为腐殖酸分子的主链骨架。SHI等[47]分别以葡萄糖、果糖、木糖和鼠李糖为原料开展水热腐殖化反应,分别获得了60.7%、54.1%、46.4%和35.2%的固体腐植质。其中,葡萄糖和果糖的腐植质产率较高是由于它们水热过程中均产生了HMF,它单独作为原料水热产生腐植质的产率可高达64.6%。而木糖和鼠李糖的水热中间产物分别以糠醛和5-甲基糠醛为主,这两种中间产物向腐植质的转化率相对较低,分别为23.4%和12.1%。
此外,通过单体小分子物质的合成聚合也可能是生成腐殖酸的重要途径。比如,在生物质水热酸催化生产糠醛的过程中,观察到反应器中产生大量的碳化污垢。进一步的分析发现,碳化污垢的形成与水热腐殖化形成的腐殖酸类产物有关。类似的现象也出现在造纸制浆蒸煮过程中大量产生的造纸黑液中。YAO等[31]的研究发现,与天然腐殖酸相比,人工合成腐殖酸具有较少的芳香结构,但含有更高的木质素、碳水化合物和氨基酸。SHEN等[32]在170 °C条件下用HMF合成的腐殖酸分子结构中,可以观察到其分子结构中含有HMF典型的呋喃环结构,以及经过醚化、酯化、醇醛缩合等一系列反应后形成的碳碳双键、羧酸基和羰基。研究表明,在只有木质素的水热反应体系中没有腐殖酸类物质的生成,形成腐殖酸的物质的主体反应物是糖类化合物水解得到的糠醛、HMF等呋喃类化合物。尽管受限于当前对腐殖酸结构的认知,对于形成的聚合物的定义存在一定的分歧,如称为类腐殖酸或假木质素等,但从分子量、功能性官能团、分子结构、生物活性等应用效果方面看,这些合成产物与传统意义上的腐殖酸具有一定的可替代性。
水热腐殖化合成的腐殖酸展现出优异的应用性能。在ZHANG等[48-50]的研究中,利用玉米秸秆和桉树叶在KOH存在的条件下进行水热反应,将生成的腐殖酸负载在磁性生物炭上,用于吸附环境中的重金属离子。经过负载处理后的吸附剂富含多种功能性官能团,在环境中展现出极好的分散性和抗氧化性,其回收率可达96.5%以上。ZHANG等[48]在之前的研究基础上,利用污泥与生物质在碱灰存在的条件下进行水热反应合成了腐殖酸,并将污泥中的磷元素回收到液体产物中,重金属则被富集到固体产物中。最终得到的液体产物富含腐殖酸和营养元素,同时,铬和镉含量降至检出限以下。在植物培养实验中,经过25 d的生长,加入了反应液体产物的玉米种子的株高和根长均高于对照组。将有机废物资源替代水热反应体系中的反应物,并将所产生的腐殖酸产品应用于环保和农业等领域,正在逐渐成为一种腐殖酸合成和应用的新兴发展方向。
-
作为一种自然界广泛存在的物质,腐殖酸具有丰富的氧化还原活性基团,在沉积物和土壤中参与着多种生物和非生物反应。例如,腐殖酸含有疏水芳香基团以及基于氧和氮的功能基团,能够通过氢键、螯合和基于自由基偶联的共价键结合方式,对特定的污染物产生吸附和络合作用;同时,腐殖酸的两性基团可起到表面活性剂的作用,有助于溶解疏水性的石油烃等污染物。图5和表3列出了人工合成腐殖酸在环境污染治理领域的典型应用。作为一种绿色无毒的功能材料,腐殖酸已被广泛应用于重金属和有机污染物的修复研究中[51]。
1) 腐殖酸与重金属的氧化还原反应
环境中毒性较大的重金属和类金属污染物大多是价态变化较多的过渡元素,其毒性因价态而异。腐殖酸的各种活性官能团使其具有离子交换、吸附和络合金属离子的能力,并在此过程中促使金属离子的存在形态发生改变,进而降低金属离子的迁移性和毒性[42]。
腐殖酸可在光照等条件下产生活性氧 (reactive oxygen species,ROS) ,从而还原高价态重金属[59-60]。研究表明,腐殖酸可以作为光化学催化剂,在太阳光或紫外光的照射下产生活性载体物质,催化重金属的光化学反应[61]。例如,HUANG等[52]证实,在土壤表面的太阳辐射下,腐殖酸的酚羟基产生的超氧自由基 (·O2−) 会将Ag+还原为纳米银颗粒,消除银离子的生物毒性。ADEGBOYEGA等[62]进一步研究了不同环境条件 (包括温度、pH和紫外线) 对腐殖酸还原Ag+的影响,结果表明,银离子的反应速率随着反应体系的温度和pH的升高而提高。此外,XU等[63]研究了腐殖酸的官能团对土壤中Cr(Ⅵ)的还原作用机制,发现其中一种途径是腐殖酸的酚羟基作为电子供体可将电子转移给O2,从而产生ROS,ROS进一步与Cr(Ⅵ)反应将其还原为Cr(Ⅲ),该机制对Cr(Ⅵ)还原的贡献约占30%。
腐殖酸还原金属离子的另一种途径是利用酚羟基的强给电子能力,直接将金属离子还原。XU等[63]证实腐殖酸可利用这种机制将Cr(Ⅵ)还原为Cr(Ⅲ)。CHRYSOCHOO等[64]证明腐殖酸作为电子供体,可将Cr(Ⅵ)还原并显著降低其迁移性。ZHANG等[65]进一步证明了腐殖酸还原并稳定Cr(Ⅵ)的4步机制:①Cr(Ⅵ)静电吸附到腐殖酸表面;②羧基和锟基络合物吸附Cr(Ⅵ);③酚羟基将络合的Cr(Ⅵ)还原为Cr(Ⅲ);④还原的Cr(Ⅲ)被羧基络合稳定。
此外,醌类作为腐殖酸的重要基团,可以通过氧化还原过程在半醌自由基和氢醌之间循环,从而在金属离子的氧化还原过程中发挥电子传递作用[59, 66]。WANG等[67]发现醌类或半醌类是促进Hg(Ⅱ)向Hg(0)转化的主要基团。他们还对Hg(Ⅱ)还原的影响因素开展了研究,发现Hg(Ⅱ)的还原百分比与Hg/HA含量比值密切相关,当Hg/HA比值为1 134 ng·mg−1时,腐殖酸对Hg(Ⅱ)的还原百分比最大。JIANG等[68]发现腐殖酸作为氧化还原活性物质可将As(Ⅲ)氧化为As(Ⅴ),用于修复砷污染的土壤和水体。实验结果表明,腐殖酸在微生物或化学还原过程中产生的半醌自由基是强氧化剂,可以将As(Ⅲ)氧化为As(Ⅴ),从而降低As的毒性和迁移性。
2) 腐殖酸与有机污染物的氧化还原反应
光降解是土壤环境中有机污染物转化和减少的主要途径之一[53,69]。腐殖酸的结构复杂多变,具有一定的光催化特性,可以提供了大量的光活性反应位点,也可作为电子传递介体,参与有机污染物的氧化还原反应。研究证实腐殖酸在光的作用下可产生大量ROS催化降解污染物,如·OH、·O2−和单线态氧 (1O2) 等。SHI等[70-71]发现,腐殖酸催化产生ROS主要通过3个过程:①腐殖酸在光照下吸收电子生成单线激发态物质 (1HA*) ;②1HA*转化形成能量较低的三重激发态物质 (3HA*) ;③3HA*能量传递给H2O2和O2生成·OH、·O2−和1O2,这些ROS与有机污染物反应并加速其降解。腐殖酸除了参与有机污染物的光催化降解之外,还能影响有机污染物的直接光降解。例如,在模拟阳光照射下,从自然环境中提取的黄腐酸会促使某些有机污染物发生直接光降解[54]。然而,另一些研究发现,腐殖酸可能通过竞争光吸收和遮光来抑制有机污染物的直接光降解。此外,光照后的腐殖酸也可促进过氧单硫酸盐的光敏转化,从而加速向SO4·−的转化,并加速高级氧化法 (advanced oxidation process,AOPs) 对有机污染物的降解[72]。ZHOU等[55]研究发现,在基于过硫酸盐的AOPs体系中添加不同浓度的腐殖酸,硝基咪唑的氧化降解率提高了2.05~4.77倍。
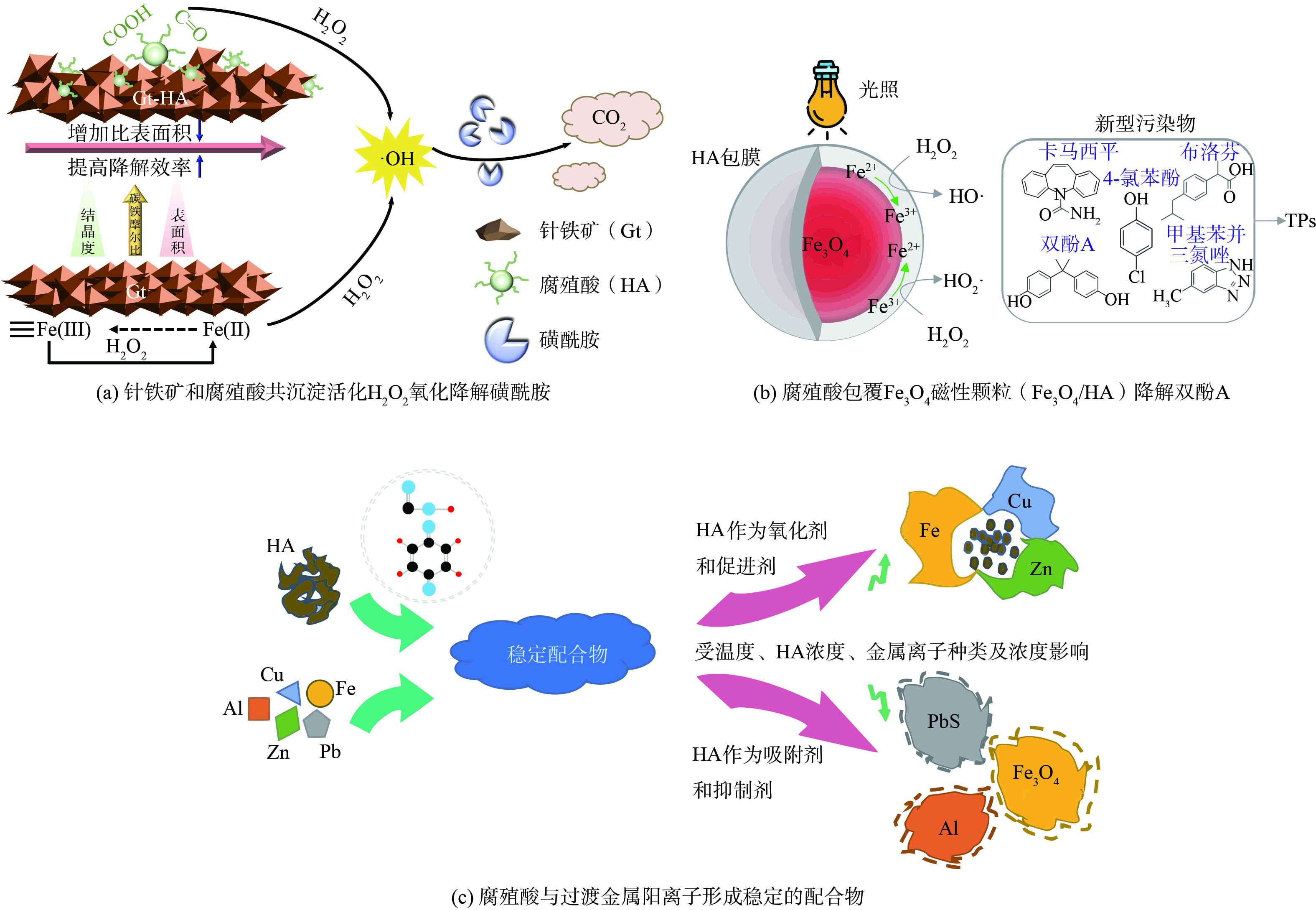
基于芬顿法 (Fenton) 的AOPs在有机污染的处理中也得到广泛研究,研究人员已经证明,常见形式的氧化铁均可以催化H2O2产生自由基并降解pH为3~7范围内的有机污染物[73-74]。然而,由于Fe(Ⅲ)与H2O2的反应速度远慢于Fe(Ⅱ)与H2O2的反应速度,所以Fenton氧化效率受到限制[75-76]。因此,提高Fe(Ⅲ)/Fe(Ⅱ)的循环速率可以有效提高Fenton反应的效率。研究表明,腐殖酸与铁结合可以加速Fe(Ⅲ)还原为Fe(Ⅱ)或促进Fe(Ⅳ)自由基的氧化,从而提高·OH的生成速率[77]。如图6(a),YU等[56]研究了针铁矿和腐殖酸的共沉淀 (Gt-HA) 活化H2O2产生·OH降解磺酰胺的能力,发现共沉淀的腐殖酸可利用羧基与Fe(Ⅲ)形成配合物和电子传递介体,促进Fe(Ⅲ)/Fe(Ⅱ)的转化,与单独的针铁矿相比,Gt-HA体系显著提高了磺酰胺的降解效率。此外,将腐殖酸的光催化性能与Fenton技术相结合,构建光Fenton催化体系,可以进一步增强·OH的产生,更有利于降解有机化合物。LIU等[78]构建了HA-Fe(Ⅲ)光Fenton催化体系,发现Fe(Ⅲ)-Fe(Ⅱ)-Fe(Ⅲ)循环可以激活HA-Fe(Ⅲ)络合物连续生成·OH用于降解草甘膦。GONCALVES等[79]发现光照下的腐殖酸包覆的Fe3O4催化剂显著提高了催化剂对卡马西平、布洛芬等新型污染物的降解效率 (如图6(b)) 。
-
腐殖酸最重要的特性之一是它能够与外源性物质相互作用并形成具有不同溶解度的复合物[80]。由于腐殖酸具有酚类、羧基、醌类以及胺类官能团,容易与有毒金属络合,降低其流动性、生物利用度和环境毒性,实现环境修复[81]。如图6(c),腐殖酸可以与过渡金属阳离子,特别是铜和铁形成稳定的络合物,羧基和醌基可作为金属阳离子的结合位点[82]。这个过程很容易受到温度、腐殖酸浓度、金属离子种类及浓度的影响,这使得腐殖酸在金属络合中的作用不同。首先,腐殖酸可以作为金属离子的载体,调节重金属离子的环境毒性。例如,腐殖酸与铜和砷等无机物的络合,能够增强其溶解度和迁移能力[83]。ANTILEN等[84]制备了腐殖酸涂覆的电化学吸附材料,对Cu(Ⅱ)进行了电化学萃取,去除率高达72%以上。AHMED等[85]发现,腐殖酸的存在增强了Pb2+在土壤中的吸附,降低其毒性。其次,腐殖酸与金属离子的络合可以减缓金属的腐蚀进程。早期的研究表明腐殖酸显著降低了黄铁矿的腐蚀电流,表明腐殖酸与黄铁矿的络合抑制了黄铁矿的腐蚀[86]。UMOREN等[87]也发现了类似的规律,腐殖酸在不同条件下都能抑制黄铁矿的腐蚀,达到保护金属的目的。LIU等[88]研究了不同pH和腐殖酸浓度下方铅矿的风化过程,发现在相同pH下,腐殖酸浓度越高,腐蚀密度越低;当pH为2.5时,高腐殖酸浓度 (1 000 mg·L−1) 能有效抑制方铅矿的腐蚀。
-
腐殖酸可以作为电子转移介体加速有机污染物的生物降解或重金属的生物还原[57]。研究发现,在腐殖酸存在的情况下,氯乙烯和二氯乙烷可以在无氧条件下被有效地生物矿化而不积累还原中间体,这表明腐殖酸可以作为微生物降解污染物的电子受体[89]。YAN等[57]也发现溶解态腐殖酸可以加速PAHs等有机物的生物降解。GU和CHEN[90]报道了包括腐殖酸在内的天然有机质可以作为电子转移介体参与微生物对重金属的还原。在中性或弱碱性条件下,腐殖酸在Cr(Ⅵ)和U(Ⅵ)的生物还原中起重要作用。CERVANTES等[91]发现腐殖酸中的醌基可以作为终端电子受体在有机污染物的厌氧降解中发挥作用。FINNERAN和LOVLEY[92]通过向水体沉积物中添加腐植质和Fe(Ⅲ)来加速甲基叔丁基醚的厌氧降解,他们认为腐殖酸中的醌基可以作为微生物和Fe(Ⅲ)之间的电子载体,从而刺激铁还原菌的活动。腐殖酸还可提高微生物活性,增加污染物的生物可利用性,从而有效促进污染物的生物降解。KE等[93]研究了腐殖酸对水和底泥中PAHs的生物降解性和溶解度的影响,发现腐殖酸 (0~1.6%,w/v) 的加入提高了PAHs的溶解度和生物可利用度,PAHs的生物降解率显著提高。
此外,腐殖酸对污染物的植物修复也有促进作用[94]。它可以通过改变根系构型和生长动态,增加根际微生物活性,进而提高植物修复效率。ZANDONADI等[95]研究发现,腐殖酸能够激活根须质膜和液泡中的相关生物酶来增加有丝分裂点位,进而促进植物侧根的显著增殖,改善根系生长。DENG等[96]通过沼液浸渍对玉米秸秆酸水解残渣进行水热腐殖化生产人工腐殖酸。盆栽实验证实制备的腐殖酸增强了养分缓释特性和保水能力。BOYSAN等[58]研究证明腐殖酸在Pb、Cr、Cd、Zn污染土壤中施用,可通过降低油菜作物中重金属含量和氧化应激,对植物发育有一定的补救作用。ZHANG等[97]通过盆栽试验,研究了添加腐殖酸后薄荷、香蒲等4种水生植物对重金属污染沉积物的修复效果,结果表明,适量的腐殖酸作为改良剂可有效改善金属污染沉积物的植物修复作用。
-
腐殖酸以其独特的物理化学特性在石油污染土壤修复中发挥着关键角色,通过物理、化学以及生物协调作用显著促进石油烃的降解过程 (如表4所示) 。首先,由于腐殖酸具备丰富的官能团,它展现出优异的吸附和富集有机污染物的能力[98],同时具备表面活性剂的性质,能够加速土壤中原油的乳化,有效提高石油类污染物的脱附和溶解效率[99]。任煊静[100]的研究结果显示,添加2%的腐殖酸显著改善了石油污染土壤的团聚状态,增加了土壤团聚体的水稳定性,进而改善了土壤修复过程中的传质限制。同时,将腐殖酸应用于石油污染土壤的化学修复中,可与化学药剂协同作用,显著提高污染物去除效果。HU等[101]的研究结果表明,腐殖酸与二价铁的联合使用能够生成羟基自由基等高效的活性基团,有效促使石油类有机污染物的降解。YUAN等[77]的研究发现,腐殖酸中的酚羟基是活化产生羟基自由基的主要媒介。此外,腐殖酸与H2O2以及Fenton试剂的联合使用能够推动高浓度石油污染土壤的修复进程。在总石油烃 (total petroleum hydrocarbon,TPH) 浓度达到20 000 mg·kg−1的土壤中,采用H2O2+生化黄腐酸 (BFA) 和Fenton+BFA修复,5d后TPH的降解率分别达到28.4%和36.0%,均明显高于未添加BFA的对照组[100]。XU等[102]在石油污染土壤的芬顿氧化体系中引入腐殖酸后发现,腐殖酸能够调节土壤有机污染物的亲水性,从而对芬顿反应产生正向作用,而且该正向作用会随着腐殖酸用量的增加而逐渐增强[106]。
此外,腐殖酸在生物修复过程中的应用可提高土壤中的生物活性,增加石油烃的生物可利用性,从而有效促进污染物的生物降解。张秀霞等[107]对腐殖酸对石油污染土壤特性和生物修复效果的研究表明,腐殖酸的添加在一定程度上提高了土壤酶活性、调节了C/N比例,并增加了土壤速效磷含量。AKHANOVA等[108]通过利用腐殖酸等制备有机矿物生物肥,进而开展石油污染土壤的植物修复实验。结果表明,腐殖酸加入后生物活性显著增加,植物根系更加发达,石油类污染物降解率提高了12%~22%。PARK等[105]在桔梗等植物修复石油污染土壤的研究中发现,添加腐殖酸后,土壤中的石油烃降解效率从30%增加到45%。该结果归因于植物与腐殖酸的联合作用导致了土壤中微生物活性和生物可利用石油烃的增加。FASHINA等[109]在研究腐殖酸对石油污染土壤中石油烃生物降解的影响过程中也发现,腐殖酸能够促进石油烃的生物降解,并刺激土壤中细菌的增殖。此外,腐殖酸还可以应用于微生物固定化技术,增加微生物的生长空间,为其繁殖提供更多的营养。通过腐殖酸改性生物燃料灰的固定化处理,接种微生物对土壤中石油烃的降解率在60d内达到47.8%,相较于游离微生物修复的效果提高了2倍[110]。
-
腐殖酸在农、林、牧、石油、化工、建材、医药、卫生和环保等多个领域均呈现出广泛的应用前景。在农业领域,腐殖酸通过改善土壤的物理和化学特性,促进了植物的生长和提高了作物的品质。其通过物理化学吸附、沉淀和氧化还原等过程,对土壤中的污染物起到了一定程度的缓解作用。在环境修复方面,腐殖酸能有效地除去废水中的重金属和有机污染物,并促进这些污染物的转化和降解。在工业应用方面,作为可替代石油基功能性聚合物的廉价、可持续和环境友好的替代品,腐殖酸被广泛用于农药、医药、工业水处理剂等领域。相较于传统的煤基提取工艺,其存在着原料不可再生和严重污染等问题,从生物质等可再生有机废物人工合成腐殖酸是一种更为高效、绿色和低碳的合成途径。随着对堆肥过程中合成腐殖酸机理的深入研究和关键因素的识别,结合氧化预处理以提高前驱体供给,以及生物活性增强和矿物催化的协同等手段,可以升级传统堆肥处理工艺,进一步提高腐殖化效率。而以氧化聚合和水热腐殖化为代表的新兴化学合成途径,更具有优势,可以提高有机物的腐殖化效率,并生产功能化的腐殖酸产品,适用于大规模、集约化处理有机废物,从而节省场地空间,降低环境污染的风险。腐殖酸在环境污染修复应用中也展现了显著的优势,既可作为电子转移介质,促进污染物的氧化还原反应,有助于有害物质的去除,又能作为生物刺激剂,促进土壤中微生物的活动,推动生物修复过程。
虽然当前的研究进展已经充分证明了人工合成腐殖酸在较短时间内制备官能团丰富的腐殖酸的优势,但不论采用何种合成方法,其在规模化工业生产中仍然面临一些挑战。腐殖酸的生产成本主要受制于原料采集、生产工艺和环境治理等多个因素,其中包括原料采集和预处理的资源消耗、生产工艺的复杂性以及废水和废气排放对环境造成的污染等。此外,市场因素如原材料价格波动和市场竞争压力也会影响腐殖酸的生产和销售。因此,在腐殖酸的开发利用过程中,需要注重降低生产成本、加强环境保护和安全管理,并寻求高值应用以提高收益率和抗风险能力。未来的研究需要重点关注生物质原料的挖掘、因地制宜的多源人工腐殖酸合成路径以及多领域的应用开发,以实现生物质的低碳转化和环境生态循环利用。当前亟待解决的问题主要包括以下五个方面:
1) 精细化定量表征腐殖酸分子结构:腐殖酸作为大分子有机物,其分子量和结构具有一定的不确定性。进一步界定和定义其分子结构,实现标准化,建立分子结构与效能的关系对于工业化和产品化至关重要;
2) 明晰腐殖酸合成反应过程机制:加强化学合成腐殖化过程中两类基本反应的研究,小分子有机物的脱水、缩合、芳构化以及木质纤维素类物质部分降解生成多官能团化的芳环结构腐殖酸,通过控制缩合度和矿化度,提高腐殖酸的产率和品质;
3) 拓宽腐殖酸合成原料来源:拓展原料的来源,如污泥、生物质、畜禽粪便等,通过共水热联合作用制备官能团和营养元素更丰富的腐殖酸产品;
4) 定性合成功能性腐殖酸及其高端应用:通过氧化剂和碱性物质等的添加,降低水热反应的温度和压力,达到定向合成腐殖酸的目的,同时开发具有高纯度和更强功能性的腐殖酸,在医药、精细化工等高端领域拓展其应用和附加值,是人工合成腐殖酸未来的重要方向;
5) 追踪评估环境修复体系中的生态效应:人工合成腐殖酸虽然性能优异,但作为生态系统的外源物质,其对生态系统结构和功能的影响仍需深入研究,例如腐殖酸对水体、沉积物以及土壤环境中原著生物群落的影响,修复过程产出的二次污染和环境风险等是腐殖酸在环境修复领域推广应用前亟需探索的关键问题。
腐殖酸的人工合成及其在环境污染修复中的研究进展
Research advance on artificial synthesis of humic acid and its application in environmental pollution remediation
-
摘要: 腐殖酸 (HA) 作为广泛存在于自然环境中的有机物,在生物和非生物地球化学过程中发挥着至关重要的作用,特别是在碳循环、土壤肥力和环境污染修复等方面。由于其独特的功能性和环境重要性,腐殖酸市场需求迅速增长,人工合成腐殖酸因其原料易得、产品功能性强等优势而备受关注。系统归纳了生物堆肥、化学氧化聚合、水热腐殖化等有机废物人工合成腐殖酸的方法与特点,探讨了腐殖酸分别作为电子转移介质参与污染物的氧化还原反应、作为吸附络合剂稳定重金属、作为生物刺激剂加速生物修复作用,以及在石油烃污染土壤修复等方面的应用和效果,并对人工合成腐殖酸的未来发展方向和在环境污染修复中的应用前景进行了展望。Abstract: Humic acid (HA), as a widely occurring organic substance in the natural environment, plays a crucial role in both biotic and abiotic geochemical processes, particularly in carbon cycling, soil fertility, and environmental pollution remediation. Due to its unique functionality and environmental importance, the demand for humic acid in the market is rapidly increasing. Artificial synthesis of humic acid has attracted considerable attention due to its advantages of readily available raw materials and enhanced product functionalities. The methods and characteristics of artificial synthesis of humic acid from organic waste, such as biological composting, chemical oxidation polymerization, and hydrothermal humification, were reviewed. Then, the applications and effects of humic acid as an electron transfer medium in the redox reaction of pollutants, as an adsorption complexing agent to stabilize heavy metals, as a biostimulant to accelerate bioremediation, and its application in the remediation of petroleum hydrocarbon-contaminated soils, were discussed. Finally, an outlook on the future development direction of artificially synthesized humic acid and its application prospects in environmental pollution remediation was given.
-

-
图 3 黑土壤形成的自然环境以及其中腐殖酸和富里酸的潜在合成途径[12]
Figure 3. The pictures of natural environment of black soil formation and the possible routes for the synthesis of fulvic acids and humic acids
图 4 蛋白质促进糖类物质水热合成腐殖酸的反应机理[44]
Figure 4. The reaction mechanism of protein promoting the hydrothermal synthesis of humic acid from glucose substances
表 1 人工合成腐殖酸的典型方法技术参数对比
Table 1. Comparison of technical parameters of typical artificial humic acid synthesis methods
方法 原料 合成温度/°C 反应时间/h 氧化剂/添加剂 H/C O/C E4/E6 参考文献 生物法 葡萄枝、废蘑菇基质和生物炭 25~65 1 080 (NH4)2SO4、Ca(H2PO4)2和K2SO4 0.06 0.08 — [12] 鸡粪、中药渣 — 960~1 440 无 0.09 0.7 — [13] 餐厨垃圾 70~80 10 无 0.10 0.80 — [14] 城市固体废物 — — 无 1.14 — 6.84 [15] 甘蔗渣、牛粪、污泥、蚯蚓 — 1 440 无 — — — [16] 皮革厂废物、牛粪、锯末 11~29 3 240 无 — — — [17] 稻草、蚯蚓 — 2 160 真菌 — — — [18] 木屑、植物残渣 — 1 080 无 — — — [19] 牛粪、玉米秸秆、杨树枝 — 2 400 木质纤维素 — — [20] 化学氧化聚合 沥青质 180~210 1~2 O2和NaOH 1.22 — — [7] 邻二苯酚+甘氨酸+葡萄糖 25 240 MnO2 0.74 0.70 3.20 [21] 玉米秸秆预处理液 30~70 2.5 H2O2 — 1.13 1.80 [22] 褐煤 室温 3 H2O2 1.11 0.62 — [23] 没食子酸 26 12 O2 — — — [24] 植物残渣、牛粪、蚯蚓 45 1 KMnO4 — — — [25] 芒草、芦苇 50 12 H2O2 — — — [26] 儿茶酚 36 24 无 — — — [27] 芦苇 50 12 无 — — — [28] 水热腐殖化 葡萄糖、木屑、树叶 200 24 KOH 0.89 0.36 — [29] 甘蔗渣+酒糟 230 13 H3PO4 1.21 0.57 5.71 [30] 小麦秸秆 240 6.7 (NH4)3PO4 0.83 0.63 4.04 [31] 5-羟甲基糠醛 (HMF) 170 3.3 H2SO4 — — — [32] 果糖 120 24 H2SO4 — — — [33] 注:H/C和O/C表示产物中元素含量比值,H/C越低代表产物的芳香化程度越高,O/C越高代表产物的腐殖化程度越高;E4/E6表示产物在465 nm和665 nm波长处吸光度的比值,比值越低代表产物的芳香化程度越高。 表 2 人工合成腐殖酸的典型方法优缺点对比
Table 2. Comparison of advantages and disadvantages of typical methods for artificially synthesizing humic acid
方法 技术分类 适用场景 优点 缺点 生物法 堆肥 场地空间较大、通风条件较好的乡村等场景 可以模拟自然腐殖酸的合成过程,能耗较低 合成时间长,产率低;分离过程复杂,排放温室气体 蚯蚓堆肥 潮湿、松散、肥沃的土壤和温度光照适宜的农业应用场景 无需添加化学试剂,合成过程绿色无污染 合成时间长;产率低;分离过程复杂,动物受环境影响大 特定微生物发酵 发酵菌种来源广泛且具有特定发酵场所的场景 具备堆肥的优点,同时比堆肥更快速,可以在制备腐殖酸过程中进行改性 需培养特定菌种,需添加额外的碳源,与化学法相比周期依然较长 化学氧化/
还原聚合催化氧化聚合 需要对产物定向改造,对周期要求较高且经济条件较好的场景 可以去除有毒物质单体酚,可引入类脂长烷基链和氮基官能团 催化剂的投入成本较高,催化剂和缓冲溶液的合理使用存在困难 碱性氧化水解 环保配套设施齐全,对周期要求较高但经济条件一般的场景 合成速度较快,可使用廉价的化学药剂 反应残渣易污染环境,产物分离过程复杂,可溶性木质素的含量较低 芬顿氧化聚合 环保配套设施齐全,对周期要求较高但经济条件一般的场景 合成速度较快,可使用廉价的化学药剂,技术相对成熟 反应残渣易污染环境,产物分离过程复杂,可溶性木质素的含量较低 臭氧氧化聚合 无需对产物进行改造,对周期要求较高且经济条件较好的场景 合成腐殖酸速度较快,反应清洁,产生活性氧效率较高,技术相对成熟 臭氧投入成本较高,产物分离过程复杂,可溶性木质素的含量较低 硼氢化钠还原聚合 对产物和合成周期要求较高且经济条件允许的场景 通过还原途径引入官能团,可以增加腐殖酸的疏水性 硼氢化钠的成本较高,分离腐殖酸过程复杂 水热腐殖化 水热腐殖化 热源充足,环保配套设施齐全,产物不以农田应用为目的的场景 相对堆肥过程周期短,碳可以被固定在固体产品中,添加的原料 (如生物质) 可以完全降解 产生有毒物质单体酚,腐殖酸的产量低,加热过程能耗较高,技术不够成熟 表 3 腐殖酸在降解环境污染物中的应用
Table 3. Application of humic acid in the degradation of environmental pollutants
表 4 腐殖酸在石油烃污染土壤修复中的应用
Table 4. Application of humic acid in soil remediation of petroleum hydrocarbon pollution
污染物 修复技术 腐殖酸的协同作用 修复效果 文献来源 柴油 化学氧化 黄腐酸可为芬顿氧化提供弱酸性环境,还可以和Fe2+形成络合物,保持Fe2+的浓度,从而持续催化H2O2产生高级氧化作用 H2O2+BFA和Fenton+BFA实验组均比对照组有更好的降解效果,总石油烃 (TPH) 解率最高分别达到35.2%和36.6% [100] 石油烃 化学氧化 由于土壤原生有机质的亲水官能团更容易捕获自由基,降低污染物的降解效率。腐殖酸的加入可以调节土壤原生有机质中亲水官能团数量,进而减少自由基的非目标消耗,提高Fenton反应对土壤中TPH的降解效率 添加腐殖酸的实验组,被羟基自由基氧化的TPH和土壤原生有机质的总量之比为1.29,是对照组的2~3倍 [102] 硝基苯 化学还原 堆肥衍生的腐殖酸能够充当电子穿梭体,促进硝基苯还原为苯胺。腐殖酸中的酚类物质是促进硝基苯降解的主要因素 硝基苯的降解率随腐殖酸中酚羟基、醌类和芳香性结构的增加而增加。腐殖酸在应用于硝基苯污染的土壤后,具有增强硝基苯还原为苯胺的巨大潜力 [77] 石油烃 微生物修复 腐殖酸改性生物质电厂灰的孔状结构增多且表面粗糙,有利于微生物的附着。改性结构使石油烃降解菌得到保护和支撑,提高了土壤基础呼吸速率和土壤酶活性 60 d后固定化菌剂对污染土壤中TPH的降解效率达到51.9%,比游离菌提高25.0% [103] 十六烷烃 微生物修复 腐殖酸作为一种重要的环保化工原料和污染修复助剂。腐殖酸利用表面活性,提高污染物溶解度;腐殖酸作为聚合物基质对微生物具有粘附作用,提供微生物的附着力 红球菌属和腐殖酸联合作用情况下,十六烷的最终去除率达91% [104] 柴油 植物修复 植物和腐殖酸的共同作用导致土壤中微生物活性和生物可利用TPH的增加 在添加腐殖酸的实验组中,土壤中TPH的降解率对照组增加15% [105] -
[1] ZHANG W, LIU M, LI C. Soil heavy metal contamination assessment in the Hun-Taizi Rivewatershed, China[J]. Scientific Reports, 2020, 10(1): 8730. doi: 10.1038/s41598-020-65809-0 [2] KHAN S, NAUSHAD M, LIMA E C, et al. Global soil pollution by toxic elements: Current status and future perspectives on the risk assessment and remediation strategies–A review[J]. Journal of Hazardous Materials, 2021, 417: 126039. doi: 10.1016/j.jhazmat.2021.126039 [3] PETROV D, TUNEGA D, GERZABEK M H, et al. Molecular dynamics simulations of the standard Leonardite humic acid: Microscopic analysis of the structure and dynamics[J]. Environmental Science & Technology, 2017, 51(10): 5414-5124. [4] FEDOTOV G N, SHOBA S A. On the nature of humic substances[J]. Eurasian Soil Science, 2015, 48: 1292-1299. doi: 10.1134/S1064229315120066 [5] 杨会国, 马丽萍, 张彦彬, 等. 腐殖酸接枝共聚物的研究进展及应用前景[J/OL]. 应用化工, [2024-03-28]. https://doi.org/10.16581/j.cnki.issn1671-3206.20240227.005. [6] GUO X, LIU H, WU S. Humic substances developed during organic waste composting: Formation mechanisms, structural properties, and agronomic functions[J]. Science of the Total Environment, 2019, 662: 501-510. doi: 10.1016/j.scitotenv.2019.01.137 [7] SHAO Y, LI Z, LONG Y, et al. Direct humification of biowaste with hydrothermal technology: A review[J]. Science of the Total Environment, 2023: 168232. [8] ZHOU X, LI J, ZHANG J, et al. Bioaugmentation mechanism on humic acid formation during composting of food waste[J]. Science of the Total Environment, 2022, 830: 154783. doi: 10.1016/j.scitotenv.2022.154783 [9] ZHANG Z, ZHAO Y, YANG T, et al. Effects of exogenous protein-like precursors on humification process during lignocellulose-like biomass composting: Amino acids as the key linker to promote humification process[J]. Bioresource Technology, 2019, 291: 121882. doi: 10.1016/j.biortech.2019.121882 [10] QI H, WEI Z, ZHANG J, et al. Effect of MnO2 on biotic and abiotic pathways of humic-like substance formation during composting of different raw materials[J]. Waste Management, 2019, 87: 326-334. doi: 10.1016/j.wasman.2019.02.022 [11] QI H, ZHAO Y, ZHAO X, et al. Effect of manganese dioxide on the formation of humin during different agricultural organic wastes compostable environments: It is meaningful carbon sequestration[J]. Bioresource Technology, 2020, 299: 122596. doi: 10.1016/j.biortech.2019.122596 [12] YU H, LI P, BO G, et al. Studies on the humic acid structure and microbial nutrient restriction mechanism during organic-inorganic co-composting[J]. Journal of Environmental Management, 2024, 353: 120186. doi: 10.1016/j.jenvman.2024.120186 [13] 陈丹, 程澳, 余旭芳, 等. 不同类型堆肥中腐殖酸与富里酸的光谱特性和分子量分布[J]. 生态与农村环境学报, 2024(2): 276-284. [14] ZHAO P, HUANG Z, MA Q, et al. Artificial humic acid synthesized from food wastes: An efficient and recyclable adsorbent of Pb (Ⅱ) and Cd (Ⅱ) from aqueous solution[J]. Environmental Technology & Innovation, 2022, 27: 102399. [15] CAMPITELLI P A, VELASCO M I, CEPPI S B. Chemical and physicochemical characteristics of humic acids extracted from compost, soil and amended soil[J]. Talanta, 2006, 69(5): 1234-1239. doi: 10.1016/j.talanta.2005.12.048 [16] SEN B, CHANDRA T S. Chemolytic and solid-state spectroscopic evaluation of organic matter transformation during vermicomposting of sugar industry wastes[J]. Bioresource Technology, 2007, 98(8): 1680-1683. doi: 10.1016/j.biortech.2006.06.007 [17] SCAGLIA B, NUNES R R, REZENDE M O O, et al. Investigating organic molecules responsible of auxin-like activity of humic acid fraction extracted from vermicompost[J]. Science of the Total Environment, 2016, 562: 289-295. doi: 10.1016/j.scitotenv.2016.03.212 [18] MAJI D, MISRA P, SINGH S, et al. Humic acid rich vermicompost promotes plant growth by improving microbial community structure of soil as well as root nodulation and mycorrhizal colonization in the roots of Pisum sativum[J]. Applied Soil Ecology, 2017, 110: 97-108. doi: 10.1016/j.apsoil.2016.10.008 [19] MONDA H, COZZOLINO V, VINCI G, et al. Molecular characteristics of water-extractable organic matter from different composted biomasses and their effects on seed germination and early growth of maize[J]. Science of the Total Environment, 2017, 590-591: 40-49. doi: 10.1016/j.scitotenv.2017.03.026 [20] SPACCINI R, COZZOLINO V, DI MEO V, et al. Bioactivity of humic substances and water extracts from compost made by ligno-cellulose wastes from biorefinery[J]. Science of the Total Environment, 2019, 646: 792-800. doi: 10.1016/j.scitotenv.2018.07.334 [21] YANG T, HODSON M E. Investigating the use of synthetic humic-like acid as a soil washing treatment for metal contaminated soil[J]. Science of the Total Environment, 2019, 647: 290-300. doi: 10.1016/j.scitotenv.2018.07.457 [22] WANG X, MUHMOOD A, DONG R, et al. Synthesis of humic-like acid from biomass pretreatment liquor: Quantitative appraisal of electron transferring capacity and metal-binding potential[J]. Journal of Cleaner Production, 2020, 255: 120243. doi: 10.1016/j.jclepro.2020.120243 [23] WANG M, LI Y, ZHANG Y, et al. Exploration of the H2O2 oxidation process and characteristic evaluation of humic acids from two typical lignites[J]. ACS Omega, 2021, 6(37): 24051-24061. doi: 10.1021/acsomega.1c03257 [24] GIANNAKOPOULOS E, DROSOS M, DELIGIANNAKIS Y. A humic-acid-like polycondensate produced with no use of catalyst[J]. Journal of Colloid and Interface Science, 2009, 336(1): 59-66. doi: 10.1016/j.jcis.2009.03.037 [25] DOBBSS L B, PASQUALOTO CANELLAS L, LOPES OLIVARES F, et al. Bioactivity of chemically transformed humic matter from vermicompost on plant root growth[J]. Journal of Agricultural and Food Chemistry, 2010, 58(6): 3681-3688. doi: 10.1021/jf904385c [26] SAVY D, COZZOLINO V, NEBBIOSO A, et al. Humic-like bioactivity on emergence and early growth of maize (Zea mays L. ) of water-soluble lignins isolated from biomass for energy[J]. Plant and Soil, 2016, 402(1): 221-233. [27] CHA J Y, KIM T W, CHOI J H, et al. Fungal laccase-catalyzed oxidation of naturally occurring phenols for enhanced germination and salt tolerance of arabidopsis thaliana: a green route for synthesizing humic-like fertilizers[J]. Journal of Agricultural and Food Chemistry, 2017, 65(6): 1167-1177. doi: 10.1021/acs.jafc.6b04700 [28] SAVY D, CANELLAS L, VINCI G, et al. Humic-like water-soluble lignins from giant reed (Arundo donax L.) display hormone-like activity on plant growth[J]. Journal of Plant Growth Regulation, 2017, 36(4): 995-1001. [29] YANG F, ZHANG S, CHENG K, et al. A hydrothermal process to turn waste biomass into artificial fulvic and humic acids for soil remediation[J]. Science of the Total Environment, 2019, 686: 1140-1151. doi: 10.1016/j.scitotenv.2019.06.045 [30] GUILAYN F, BENBRAHIM M, ROUEZ M, et al. Humic-like substances extracted from different digestates: First trials of lettuce biostimulation in hydroponic culture[J]. Waste Management, 2020, 104: 239-245. doi: 10.1016/j.wasman.2020.01.025 [31] YAO Y, WANG X, YANG Y, et al. Molecular composition of size-fractionated fulvic acid-like substances extracted from spent cooking liquor and its relationship with biological activity[J]. Environmental Science & Technology, 2019, 53(24): 14752-14760. [32] SHEN H, SHAN H, LIU L. Evolution process and controlled synthesis of humins with 5-hydroxymethylfurfural (HMF) as model molecule[J]. ChemSusChem, 2020, 13(3): 513-519. doi: 10.1002/cssc.201902799 [33] CHENG Z, EVERHART J L, TSILOMELEKIS G, et al. Structural analysis of humins formed in the Brønsted acid catalyzed dehydration of fructose[J]. Green Chemistry, 2018, 20(5): 997-1006. doi: 10.1039/C7GC03054A [34] WAN L, WANG X, CONG C, et al. Effect of inoculating microorganisms in chicken manure composting with maize straw[J]. Bioresource Technology, 2020, 301: 122730. doi: 10.1016/j.biortech.2019.122730 [35] SHINDO H, HUANG P M. Catalytic effects of manganese (Ⅳ), iron (Ⅲ), aluminum, and silicon-oxides on the formation of phenolic polymers[J]. Soil Science Society of America Journal, 1984, 48(4): 927-934. doi: 10.2136/sssaj1984.03615995004800040045x [36] YANG T, HODSON M E. The copper complexation ability of a synthetic humic-like acid formed by an abiotic humification process and the effect of experimental factors on its copper complexation ability[J]. Environmental Science and Pollution Research, 2018, 25(16): 15873-15884. doi: 10.1007/s11356-018-1836-2 [37] YANG T, HODSON M E. The impact of varying abiotic humification conditions and the resultant structural characteristics on the copper complexation ability of synthetic humic-like acids in aquatic environments[J]. Ecotoxicology and Environmental Safety, 2018, 165: 603-610. doi: 10.1016/j.ecoenv.2018.09.057 [38] YANG T, HODSON M E. Investigating the potential of synthetic humic-like acid to remove metal ions from contaminated water[J]. Science of the Total Environment, 2018, 635: 1036-1046. doi: 10.1016/j.scitotenv.2018.04.176 [39] SARLAKI E, GHOFRANI-ISFAHANI P, GHORBANI M, et al. Oxidation-alkaline-enhanced abiotic humification valorizes lignin-rich biogas digestate into artificial humic acids[J]. Journal of Cleaner Production, 2024, 435: 140409. doi: 10.1016/j.jclepro.2023.140409 [40] YANG F, ANTONIETTI M. The sleeping giant: A polymer View on humic matter in synthesis and applications[J]. Progress in Polymer Science, 2020, 100: 101182. doi: 10.1016/j.progpolymsci.2019.101182 [41] YANG F, ZHANG S, SONG J, et al. Synthetic humic acids solubilize otherwise insoluble phosphates to improve soil fertility[J]. Angewandte Chemie International Edition, 2019, 58(52): 18813-18816. doi: 10.1002/anie.201911060 [42] YANG F, ANTONIETTI M. Artificial humic acids: sustainable materials against climate change[J]. Advanced Science, 2020, 7(5): 1902992. doi: 10.1002/advs.201902992 [43] YANG F, ZHANG S, FU Q, et al. Conjugation of artificial humic acids with inorganic soil matter to restore land for improved conservation of water and nutrients[J]. Land Degradation & Development, 2020, 31(7): 884-893. [44] CHEN P, YANG R, PEI Y, et al. Hydrothermal synthesis of similar mineral-sourced humic acid from food waste and the role of protein[J]. Science of the Total Environment, 2022, 828: 154440. doi: 10.1016/j.scitotenv.2022.154440 [45] 王文祥, 张雷, 李爱民. 废弃生物质水热腐殖化产物与介质酸碱性响应关系[J]. 大连理工大学学报, 2022, 62(1): 9-17. doi: 10.7511/dllgxb202201002 [46] WAN G, ZHANG Q, LI M, et al. How pseudo-lignin is generated during dilute sulfuric acid pretreatment[J]. Journal of Agricultural and Food Chemistry, 2019, 67(36): 10116-10125. doi: 10.1021/acs.jafc.9b02851 [47] SHI N, LIU Q, JU R, et al. Condensation of α-carbonyl aldehydes leads to the formation of solid humins during the hydrothermal degradation of carbohydrates[J]. Acs Omega, 2019, 4(4): 7330-7343. doi: 10.1021/acsomega.9b00508 [48] ZHANG S, DU Q, CHENG K, et al. Efficient phosphorus recycling and heavy metal removal from wastewater sludge by a novel hydrothermal humification-technique[J]. Chemical Engineering Journal, 2020, 394: 124832. doi: 10.1016/j.cej.2020.124832 [49] ZHANG S, SONG J, DU Q, et al. Analog synthesis of artificial humic substances for efficient removal of mercury[J]. Chemosphere, 2020, 250: 126606. doi: 10.1016/j.chemosphere.2020.126606 [50] DU Q, LI G, ZHANG S, et al. High-dispersion zero-valent iron particles stabilized by artificial humic acid for lead ion removal[J]. Journal of Hazardous Materials, 2020, 383: 121170. doi: 10.1016/j.jhazmat.2019.121170 [51] ZINGARETTI D, LOMINCHAR M A, VERGINELLI I, et al. Humic acids extracted from compost as amendments for Fenton treatment of diesel-contaminated soil[J]. Environmental Science and Pollution Research, 2020, 27: 22225-22234. doi: 10.1007/s11356-020-08221-5 [52] HUANG Y N, QIAN T T, DANG F, et al. Significant contribution of metastable particulate organic matter to natural formation of silver nanoparticles in soils[J]. Nature Communications, 2019, 10(1): 3775. doi: 10.1038/s41467-019-11643-6 [53] REN Z, ZHANG H, WANG Y, et al. Multiple roles of dissolved organic matter released from decomposing rice straw at different times in organic pollutant photodegradation[J]. Journal of Hazardous Materials, 2021, 401: 123434. doi: 10.1016/j.jhazmat.2020.123434 [54] FILIPE O M, SANTOS E B, OTERO M, et al. Photodegradation of metoprolol in the presence of aquatic fulvic acids. Kinetic studies, degradation pathways and role of singlet oxygen, OH radicals and fulvic acids triplet states[J]. Journal of Hazardous Materials, 2020, 385: 121523. doi: 10.1016/j.jhazmat.2019.121523 [55] ZHOU Y, WU Y, LEI Y, et al. Redox-active moieties in dissolved organic matter accelerate the degradation of nitroimidazoles in SO4·–-based oxidation[J]. Environmental Science & Technology, 2021, 55(21): 14844-14853. [56] YU H, LIU G, JIN R, et al. Goethite-humic acid coprecipitate mediated Fenton-like degradation of sulfanilamide: The role of coprecipitated humic acid in accelerating Fe (Ⅲ)/Fe (Ⅱ) cycle and degradation efficiency[J]. Journal of Hazardous Materials, 2021, 403: 124026. doi: 10.1016/j.jhazmat.2020.124026 [57] YAN Z, HE Y, CAI H, et al. Interconnection of key microbial functional genes for enhanced benzo [a] pyrene biodegradation in sediments by microbial electrochemistry[J]. Environmental Science & Technology, 2017, 51(15): 8519-85129. [58] BOYSAN CANAL S, BOZKURT M, YıLMAZ H. The effect of humic acid on plant growth, phytoremediation and oxidative stress in rapeseed (Brassica napus L. ) grown under heavy metal stress[J]. Yüzüncü Yıl Üniversitesi Ziraat Fakültesi Tarım Bilimleri Dergisi, 2022, 32(2): 237-248. [59] PENG X X, GAI S, CHENG K, et al. Roles of humic substances redox activity on environmental remediation[J]. Journal of Hazardous Materials, 2022, 435: 129070. doi: 10.1016/j.jhazmat.2022.129070 [60] JIA H, ZHAO S, SHI Y, et al. Transformation of polycyclic aromatic hydrocarbons and formation of environmentally persistent free radicals on modified montmorillonite: the role of surface metal ions and polycyclic aromatic hydrocarbon molecular properties[J]. Environmental Science & Technology, 2018, 52(10): 5725-5733. [61] SHARPLESS C M, BLOUGH N V. The importance of charge-transfer interactions in determining chromophoric dissolved organic matter (CDOM) optical and photochemical properties[J]. Environmental Science: Processes & Impacts, 2014, 16(4): 654-671. [62] ADEGBOYEGA N F, SHARMA V K, SISKOVA K, et al. Interactions of aqueous Ag+ with fulvic acids: Mechanisms of silver nanoparticle formation and investigation of stability[J]. Environmental Science & Technology, 2013, 47(2): 757-764. [63] XU J, DAI Y, SHI Y, et al. Mechanism of Cr (Ⅵ) reduction by humin: Role of environmentally persistent free radicals and reactive oxygen species[J]. Science of the Total Environment, 2020, 725: 138413. doi: 10.1016/j.scitotenv.2020.138413 [64] CHRYSOCHOOU M, THEOLOGOU E, BOMPOTI N, et al. Occurrence, origin and transformation processes of geogenic chromium in soils and sediments[J]. Current Pollution Reports, 2016, 2: 224-235. doi: 10.1007/s40726-016-0044-2 [65] ZHANG J, CHEN L, YIN H, et al. Mechanism study of humic acid functional groups for Cr (Ⅵ) retention: two-dimensional FTIR and 13C CP/MAS NMR correlation spectroscopic analysis[J]. Environmental Pollution, 2017, 225: 86-92. doi: 10.1016/j.envpol.2017.03.047 [66] QIAO J, LI X, LI F, et al. Humic substances facilitate arsenic reduction and release in flooded paddy soil[J]. Environmental Science & Technology, 2019, 53(9): 5034-5042. [67] WANG J, WANG K, GUO Y, et al. Photochemical degradation of nebivolol in different natural organic matter solutions under simulated sunlight irradiation: Kinetics, mechanism and degradation pathway[J]. Water Research, 2020, 173: 115524. doi: 10.1016/j.watres.2020.115524 [68] JIANG J, BAUER I, PAUL A, et al. Arsenic redox changes by microbially and chemically formed semiquinone radicals and hydroquinones in a humic substance model quinone[J]. Environmental Science & Technology, 2009, 43(10): 3639-3645. [69] GUSAIN R, GUPTA K, JOSHI P, et al. Adsorptive removal and photocatalytic degradation of organic pollutants using metal oxides and their composites: A comprehensive review[J]. Advances in Colloid and Interface Science, 2019, 272: 102009. doi: 10.1016/j.cis.2019.102009 [70] SHI Y, DAI Y, LIU Z, et al. Light-induced variation in environmentally persistent free radicals and the generation of reactive radical species in humic substances[J]. Frontiers of Environmental Science & Engineering, 2020, 14: 1-10. [71] SHI Y, ZHANG C, LIU J, et al. Distribution of persistent free radicals in different molecular weight fractions from peat humic acids and their impact in reducing goethite[J]. Science of the Total Environment, 2021, 797: 149173. doi: 10.1016/j.scitotenv.2021.149173 [72] NIE J, ZOU J, YAN S, et al. Photosensitized transformation of peroxymonosulfate in dissolved organic matter solutions under simulated solar irradiation[J]. Environmental Science & Technology, 2022, 56(3): 1963-1972. [73] ZHAO L, LIN Z R, MA X H, et al. Catalytic activity of different iron oxides: Insight from pollutant degradation and hydroxyl radical formation in heterogeneous Fenton-like systems[J]. Chemical Engineering Journal, 2018, 352: 343-351. doi: 10.1016/j.cej.2018.07.035 [74] HUANG Y, YANG J. Degradation of sulfamethoxazole by the heterogeneous Fenton-like reaction between gallic acid and ferrihydrite[J]. Ecotoxicology and Environmental Safety, 2021, 226: 112847. doi: 10.1016/j.ecoenv.2021.112847 [75] QIAN X, REN M, FANG M, et al. Hydrophilic mesoporous carbon as iron (Ⅲ)/(Ⅱ) electron shuttle for visible light enhanced Fenton-like degradation of organic pollutants[J]. Applied Catalysis B: Environmental, 2018, 231: 108-114. doi: 10.1016/j.apcatb.2018.03.016 [76] YU H, LIU G, DONG B, et al. Synergistic catalytic Fenton-like degradation of sulfanilamide by biosynthesized goethite-reduced graphene oxide composite[J]. Journal of Hazardous Materials, 2021, 415: 125704. doi: 10.1016/j.jhazmat.2021.125704 [77] YUAN Y, XI B, HE X, et al. Compost-derived humic acids as regulators for reductive degradation of nitrobenzene[J]. Journal of Hazardous Materials, 2017, 339: 378-384. doi: 10.1016/j.jhazmat.2017.06.047 [78] LIU J, FAN J, HE T, et al. The mechanism of aquatic photodegradation of organophosphorus sensitized by humic acid-Fe3+ complexes[J]. Journal of Hazardous Materials, 2020, 384: 121466. doi: 10.1016/j.jhazmat.2019.121466 [79] GONçALVES N P, MINELLA M, FABBRI D, et al. Humic acid coated magnetic particles as highly efficient heterogeneous photo-Fenton materials for wastewater treatments[J]. Chemical Engineering Journal, 2020, 390: 124619. doi: 10.1016/j.cej.2020.124619 [80] LEITA L, MARGON A, PASTRELLO A, et al. Soil humic acids may favour the persistence of hexavalent chromium in soil[J]. Environmental Pollution, 2009, 157(6): 1862-1866. doi: 10.1016/j.envpol.2009.01.020 [81] VOLKOV I, POLYAKOV E. Interaction of humic acids with microelements/radionuclides in sorption systems[J]. Radiochemistry, 2020, 62: 141-160. doi: 10.1134/S1066362220020010 [82] EL-GHENYMY A, ALSHEYAB M, KHODARY A, et al. Corrosion behavior of pure titanium anodes in saline medium and their performance for humic acid removal by electrocoagulation[J]. Chemosphere, 2020, 246: 125674. doi: 10.1016/j.chemosphere.2019.125674 [83] SOLER-ROVIRA P, MADEJóN E, MADEJóN P, et al. In situ remediation of metal-contaminated soils with organic amendments: Role of humic acids in copper bioavailability[J]. Chemosphere, 2010, 79(8): 844-849. doi: 10.1016/j.chemosphere.2010.02.054 [84] ANTILEN M, GUZMAN D, DEL VALLE M A, et al. Application of polypyrrole/humic acid composite electrode for copper ion extraction from drinking water[J]. International Journal of Electrochemical Science, 2012, 7(7): 5939-5950. doi: 10.1016/S1452-3981(23)19452-1 [85] AHMED I, HELAL A A, EL AZIZ N A, et al. Influence of some organic ligands on the adsorption of lead by agricultural soil[J]. Arabian Journal of Chemistry, 2019, 12(8): 2540-2547. doi: 10.1016/j.arabjc.2015.03.012 [86] LALVANI S, DENEVE B, WESTON A. Prevention of pyrite dissolution in acidic media[J]. Corrosion, 1991, 47(1): 55-61. doi: 10.5006/1.3585220 [87] UMOREN S A, INAM E I, UDOIDIONG A A, et al. Humic acid from livestock dung: Ecofriendly corrosion inhibitor for 3SR aluminum alloy in alkaline medium[J]. Chemical Engineering Communications, 2015, 202(2): 206-216. doi: 10.1080/00986445.2013.836635 [88] LIU Q, LI H, JIN G, et al. Assessing the influence of humic acids on the weathering of galena and its environmental implications[J]. Ecotoxicology and Environmental Safety, 2018, 158: 230-238. doi: 10.1016/j.ecoenv.2018.04.030 [89] BRADLEY P M, CHAPELLE F H, LOVLEY D R. Humic acids as electron acceptors for anaerobic microbial oxidation of vinyl chloride and dichloroethene[J]. Applied and Environmental Microbiology, 1998, 64(8): 3102-3105. doi: 10.1128/AEM.64.8.3102-3105.1998 [90] GU B, CHEN J. Enhanced microbial reduction of Cr (Ⅵ) and U (Ⅵ) by different natural organic matter fractions[J]. Geochimica et Cosmochimica Acta, 2003, 67(19): 3575-3582. doi: 10.1016/S0016-7037(03)00162-5 [91] CERVANTES F J, DIJKSMA W, DUONG-DAC T, et al. Anaerobic mineralization of toluene by enriched sediments with quinones and humus as terminal electron acceptors[J]. Applied and Environmental Microbiology, 2001, 67(10): 4471-4478. doi: 10.1128/AEM.67.10.4471-4478.2001 [92] FINNERAN K T, LOVLEY D R. Anaerobic degradation of methyl tert-butyl ether (MTBE) and tert-butyl alcohol (TBA)[J]. Environmental Science & Technology, 2001, 35(9): 1785-1790. [93] KE L, BAO W, CHEN L, et al. Effects of humic acid on solubility and biodegradation of polycyclic aromatic hydrocarbons in liquid media and mangrove sediment slurries[J]. Chemosphere, 2009, 76(8): 1102-1108. doi: 10.1016/j.chemosphere.2009.04.022 [94] GERKE J. The central role of soil organic matter in soil fertility and carbon storage[J]. Soil Systems, 2022, 6(2): 33. doi: 10.3390/soilsystems6020033 [95] ZANDONADI D B, CANELLAS L P, FAçANHA A R. Indolacetic and humic acids induce lateral root development through a concerted plasmalemma and tonoplast H+pumps activation[J]. Planta, 2007, 225: 1583-1595. doi: 10.1007/s00425-006-0454-2 [96] DENG F, CAO Z, LUO Y, et al. Production of artificial humic acid from corn straw acid hydrolysis residue with biogas slurry impregnation for fertilizer application[J]. Journal of Environmental Management, 2023, 345: 118845. doi: 10.1016/j.jenvman.2023.118845 [97] ZHANG Y, LIU G, GAO S, et al. Effect of humic acid on phytoremediation of heavy metal contaminated sediment[J]. Journal of Hazardous Materials Advances, 2023, 9: 100235. doi: 10.1016/j.hazadv.2023.100235 [98] ZHAO J, LIANG G, ZHANG X, et al. Coating magnetic biochar with humic acid for high efficient removal of fluoroquinolone antibiotics in water[J]. Science of the Total Environment, 2019, 688: 1205-1215. doi: 10.1016/j.scitotenv.2019.06.287 [99] CONTE P, AGRETTO A, SPACCINI R, et al. Soil remediation: Humic acids as natural surfactants in the washings of highly contaminated soils[J]. Environmental Pollution, 2005, 135(3): 515-522. doi: 10.1016/j.envpol.2004.10.006 [100] 任煊静. 生化黄腐酸在石油烃污染土壤修复中的应用研究[D]. 上海: 华东师范大学, 2018. [101] HU D, ZENG Q, ZHU J, et al. Promotion of humic acid transformation by abiotic and biotic fe redox cycling in nontronite[J]. Environmental Science & Technology, 2023, 57(48): 19760-19771. [102] XU J, RONG Y, LIU L, et al. Efficient Fenton oriented oxidation of petroleum hydrocarbons in soil by regulating hydrophilic functional groups in soil organic matter[J]. Journal of Environmental Chemical Engineering, 2024, 12(1): 111772. doi: 10.1016/j.jece.2023.111772 [103] 郑瑾, 王馨妤, 李杰, 等. 腐殖酸改性生物质电厂灰固定化微生物修复石油烃污染土壤[J]. 环境工程, 2020, 38(8): 34-40. [104] DMITRIEVA E D, GRINEVICH V I, GERTSEN M M. Degradation of oil and petroleum products by biocompositions based on humic acids of peats and oil-degrading microorganisms[J]. Russian Journal of General Chemistry, 2022, 92: 2920-2930. doi: 10.1134/S1070363222120453 [105] PARK S, KIM K S, KIM J T, et al. Effects of humic acid on phytodegradation of petroleum hydrocarbons in soil simultaneously contaminated with heavy metals[J]. Journal of Environmental Sciences, 2011, 23(12): 2034-2041. doi: 10.1016/S1001-0742(10)60670-5 [106] AHMADKALAEI S P J, GAN S, NG H K, et al. The role of humic acid in Fenton reaction for the removal of aliphatic fraction of total petroleum hydrocarbons (diesel range) in soil[J]. Environmental Science and Ecotechnology, 2021, 7: 100109. doi: 10.1016/j.ese.2021.100109 [107] 张秀霞, 韩雨彤, 张涵, 等. 腐殖酸对石油污染土壤特性和生物修复效果的影响[J]. 腐殖酸, 2017(2): 45. [108] AKHANOVA T R, LYUBCHENKO N P, SARMURZINA R G, et al. Complex restoration of oil-contaminated soils with new organomineral reagents[J]. Water, Air, & Soil Pollution, 2023, 234(11): 686. [109] FASHINA T, ADESANWO O, ADEBIYI F. Influence of humic acid on biodegradation of petroleum hydrocarbons in oil-contaminated soils[J]. Energy Sources, Part A: Recovery, Utilization, and Environmental Effects, 2016, 38(17): 2624-2632. doi: 10.1080/15567036.2015.1079571 [110] WANG X, ZHENG J, HAN Z, et al. Bioremediation of crude oil‐contaminated soil by hydrocarbon‐degrading microorganisms immobilized on humic acid‐modified biofuel ash[J]. Journal of Chemical Technology & Biotechnology, 2019, 94(6): 1904-1912. -



 下载:
下载: