-
河岸带作为水陆交接地带,既是水体天然的保护屏障,又是陆源营养物质输入水体的重要通道,被认为是生物地球化学循环的热点区域[1]。河岸带沉积物通过一系列的物理沉淀、化学吸附、生物降解等复杂作用,可吸附容纳来自陆源的污染物[2-3],同时河岸带沉积物与季节性的上覆水水体间的交换成为污染物向水体迁移的重要途径[4]。
目前国内外学者在河岸带氮磷阻隔、重金属钝化等沉积物污染控制与修复方面取得了一些重要进展[5-6]。其中,原位覆盖技术因其工程造价低,覆盖材料种类多,掩蔽效果好等优点成为沉积物修复的较好选择[7],该技术是指利用物理、化学或生物的方法形成屏障,将污染物留在沉积物中阻止其从沉积物中释放出来,从而实现沉积物中内源污染物的固定、改善水体环境的目的[8]。覆盖材料是原位覆盖技术研究的重点,而研究环境毒性低、修复持续性高、去除范围广的新型覆盖材料成为研究热点。李扬等[9]研究发现生物炭可有效抑制沉积物氨氮的释放且具有应用到污染水体中沉积物修复的潜力。于翔霏等[10]证明建筑回填土作为覆盖材料对沉积物中氨氮和全磷有很好的控释效果。GU等[11]证明膨润土、伊利石和沸石作为覆盖材料具备阻断和固定污染沉积物中碳、氮和磷释放的可行性。
覆盖材料发展至今,其种类日益丰富,大致可分3大类[12]:无机覆盖材料(砂、砾石、混凝土渣等)、活性覆盖材料(沸石、活性炭等)、生物覆盖材料(生物活性剂、苦草等)。传统的砂、砾石等无机覆盖材料因覆盖厚度大而存在影响河流流速、抬高河床等缺陷[13],而混凝土渣的覆盖厚度小,还可实现废物再资源化及污染沉积物原位修复双赢效果,故被选为本研究备选覆盖材料之一。沸石、活性炭作为活性覆盖材料通常可满足来源丰富、环境污染小、去除范围广等需求,且均被认为是高效的覆盖材料[8],故沸石、活性炭也被选为本研究备选的两种覆盖材料。由于生物覆盖材料的应用尚处实验室研究阶段[12],故本研究未选生物覆盖材料。目前关于沸石、活性炭及混凝土渣作为黄河上游兰州段河岸带原位覆盖备选材料可行性的研究不足,关于这三种材料对河岸带沉积物中氨氮吸附-解吸的影响机制的认知也不足。
本研究选取天然斜发沸石、建筑废料混凝土渣和木质活性炭,基于热力学实验、动力学实验、混合实验及原位覆盖实验,研究三种类型材料对氨氮吸附效果,并结合BET、SEM-EDS、FTIR、XRD表征手段对比选取最适用于黄河兰州段河岸带沉积物的原位覆盖材料,从而为提升河岸带沉积物吸附固定上覆水氨氮的效果及沉积物中氨氮控释效果提供理论和技术支撑。
-
研究采用的普通天然斜发沸石、建筑废料混凝土渣和木质活性炭,分别来自河南同德环保科技有限公司、兰州市某建筑工地、平顶山市绿之原活性炭有限公司。将材料清洗烘干后进行破碎研磨,处理后过100目筛,待用。实验采用的沉积物为黄河兰州段河岸带表层沉积物,其采样点如图1所示,采样过程中利用高度为150 mm,内径为70 mm的沉积物采样器采集,取河岸带表层0~100 mm深度的表层沉积物样品,沿河道方向共取8组沉积物样品,利用四分法取样后充分混合装入自封袋运输至实验室,剔除杂质并研磨,过100目筛后装入自封袋在室温下保存备用。
-
原位覆盖实验采用壁厚5 mm,高400 mm,内径110 mm的有机玻璃圆柱体作为实验容器。将4个实验装置分别标记为1#、2#、3#和4#,其中1#和2#为无原位覆盖材料添加的对照组,3#和4#为有原位覆盖材料添加的实验组。装置自下向上结构为:1)沉积物层,60 mm;2)覆盖材料层(对照组1#和2#不含此层),40 mm;3)上覆水层,150 mm。装置示意图如图2所示。
-
1)吸附/释放实验。材料吸附动力学实验是称取(0.5±0.010) g材料于250 mL锥形瓶中,加入50 mL 20 mg·L−1氨氮溶液(由NH4Cl配制),利用恒温振荡器在(25±1) ℃ 150 r·min−1扰动频率下吸附固定,在时间梯度为0~1 440 min 内取出锥形瓶,取上清液3 000 r·min−1离心5 min,过0.45 μm滤膜,采用纳氏试剂分光光度法测定NH4+-N质量浓度,每组实验均测定3份平行样。材料吸附热力学实验中材料添加量、恒温振荡器的设定及取测样方法同材料吸附动力学实验所述,不同之处在于将材料分别加至质量浓度梯度为5~100 mg·L−1 的50 mL 氨氮溶液中,在(15±1)、(20±1)和(25±1) ℃下反应至吸附释放平衡后取样。材料添至沉积物的氨氮吸附实验除额外添加(0.5±0.010) g经处理的沉积物混合后并振荡12 h外,其他实验条件同材料吸附动力学实验,其中对照组为仅添加沉积物不添加材料的实验组。材料添至沉积物的氨氮控释实验除实验配水为去离子水外,其他实验条件同材料添至沉积物的氨氮吸附实验。
2)原位覆盖模拟实验。将预处理后的沉积物均匀铺设60 mm于有机玻璃圆柱底部,在沉积物上方铺设吸附材料40 mm,然后注入上覆水达设计水位高度150 mm即可,实验装置上覆水模拟劣五类水,配置5 mg·L−1氨氮溶液作为上覆水沿柱壁缓慢注入柱内(最大限度地降低上覆水对沉积物的扰动),连续观测14 d。
-
实验涉及指标采用国标法进行测定,其中用纳氏试剂分光光度法测定氨氮质量浓度;用比表面及孔隙度分析仪(BET)计算材料比表面积和孔径;用扫描电子显微镜(SEM-EDS)分析材料表面的形貌特征;用X 射线衍射仪(XRD)分析材料晶体结构;用傅立叶红外-拉曼光谱仪(FTIR)研究材料官能团种类。
实验仪器采用恒温振荡器,IS-R DD3 型,美国精骐公司;固体样品粉碎机,FS200型,方科仪器(常州)有限公司;比表面及孔隙度分析仪,ASAP2020C+M型,美国麦克仪器公司;紫外可见分光光度计,UV-3 600 Plus型,日本岛津公司;扫描电子显微镜,ZEISS GeminiSEM 500型,德国卡尔蔡司公司;傅立叶红外-拉曼光谱仪,VERTEX 70型,德国布鲁克公司;X 射线衍射仪,MiniFlex 600型,日本理学有限公司。
-
在实验数据分析过程中,吸附量和释放量分别按式(1)和式(2)采用差减法计算。吸附率、释放率、控释率计算采用比值法,分别按式(3)、式(4)、式(5)计算。选用准一级动力学模型(式(6))、准二级动力学模型(式(7))拟合氨氮吸附过程[14]。热力学分析选用Langmuir吸附模型(式(8))、Freundlich吸附模型(式 (9) )、吸附热方程(式(10)~(12))拟合氨氮等温吸附过程[15]。
式中:
$ {q}_{\mathrm{a}} $ 为吸附质在吸附剂上的平衡吸附量,mg·g−1;$ {q}_{\mathrm{r}} $ 为吸附剂在溶液的平衡释放量,mg·g−1;$ {c}_{\mathrm{e}} $ 为吸附释放平衡质量浓度,mg·L−1;$ {c}_{0} $ 为吸附前质量浓度,mg·L−1;$ {c}_{1} $ 为对照组吸附释放平衡质量浓度,mg·L−1;$ m $ 为材料的质量,g;$ V $ 为溶液体积,mL;$ {\mu }_{\mathrm{a}} $ 为吸附剂的吸附率,%;$ {\mu }_{\mathrm{r}} $ 为吸附剂的释放率,%;$ {\mu }_{\mathrm{c}} $ 为实验组的控释率,%;$ {\mu }_{\mathrm{r}1} $ 为实验组的释放率,%;$ {\mu }_{\mathrm{r}2} $ 为对照组的释放率,%;。式中:
$ {q}_{\mathrm{e}} $ 为吸附质在吸附剂上的平衡吸附量,mg·g−1;t为反应时间,min;$ {q}_{t} $ 为t时刻吸附质在吸附剂上的吸附量,mg·g−1;$ {K}_{1} $ 为准一级速率常数,min−1;$ {K}_{2} $ 为准二级速率常数,g·(mg·min)−1。式中:
$ {q}_{\mathrm{m}} $ 为饱和吸附容量,mg·g−1;$ {K}_{\mathrm{L}} $ 为与吸附能量相关的特征常数,L·mg−1;$ {q}_{\mathrm{e}} $ 为吸附质在吸附剂上的平衡吸附量,mg·g−1;$ {c}_{\mathrm{e}} $ 为吸附释放平衡质量浓度,mg·L−1;$ {K}_{\mathrm{F}} $ 为非均向吸附剂的特征常数,(mg·g−1)(L·mg−1)1/n;1/n与吸附动力大小和吸附位的能量分布有关。式中:
$ \Delta {G}^{\mathrm{\theta }} $ 为吉布斯自由能变,kJ·mol−1;$ \Delta {H}^{\mathrm{\theta }} $ 为吸附焓变,kJ·mol−1;$ \Delta {S}^{\mathrm{\theta }} $ 为吸附熵变,J·(mol·K)−1;$ T $ 为热力学温度,K;$ R $ 为气体常数,8.314 J·(mol·K)−1;$ K $ 为吸附平衡常数。 -
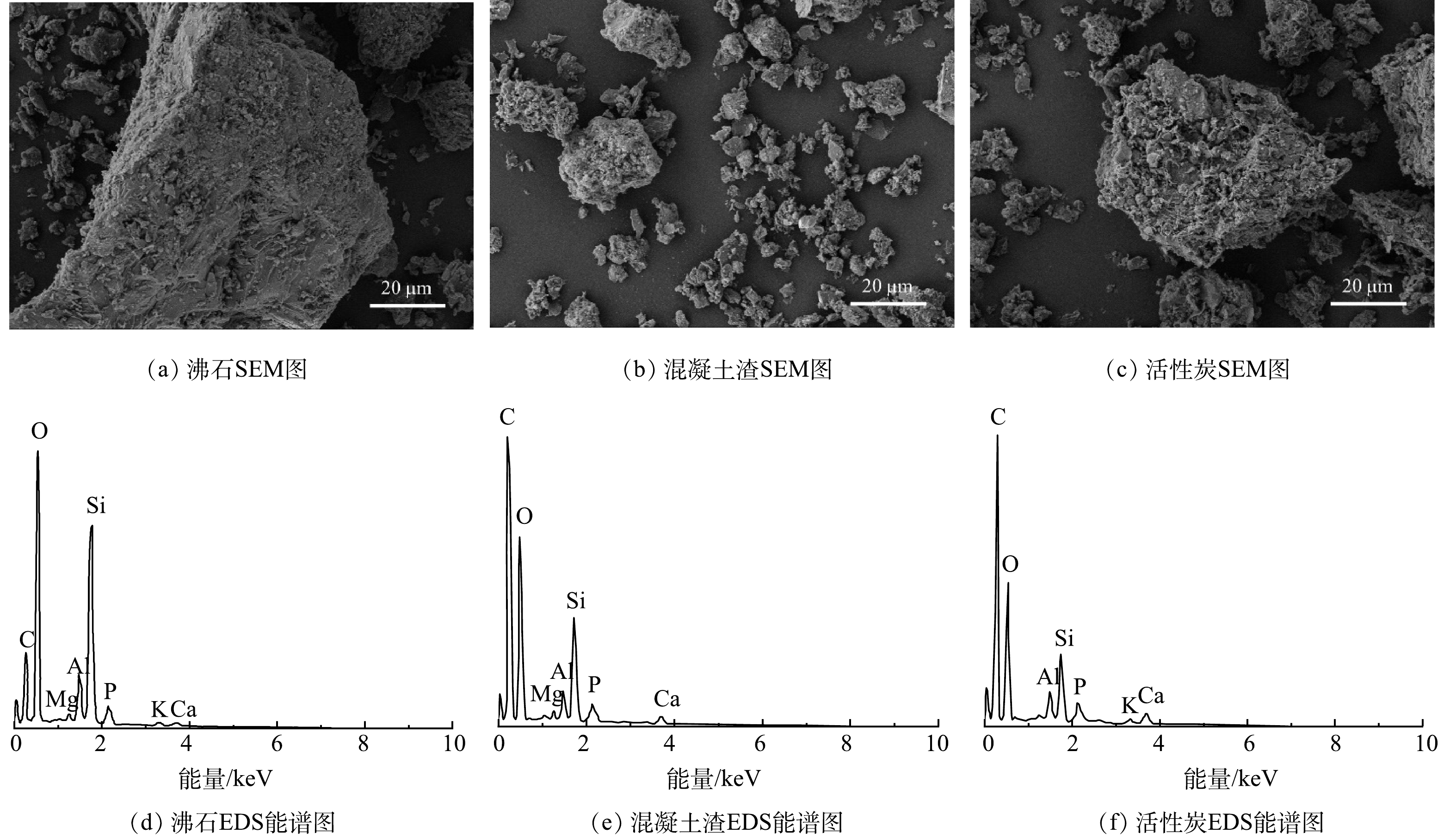
通过SEM(图3)对比分析沸石、混凝土渣和活性炭的材料特征。可以看出沸石表面呈现出鳞片状和颗粒状的结构特点,粗糙度较大,孔隙大小和形状不规则。混凝土渣表面覆盖着不规则形状的颗粒,颗粒大小各异,有些呈现块状,有些则呈现细小的颗粒状。活性炭颗粒表面粗糙度大于沸石,呈现高度发达的孔隙结构。
通过EDS(图3)分析可知,沸石的主要组成元素为O、C、Si、Al、Ca、K等,这些元素是沸石形成的基本成分,其在地壳中广泛存在,并在沸石的形成过程中被吸附或结晶。混凝土渣的主要组成元素为C、O、Si、Al、Ca等,混凝土渣中含有硅酸盐,如硅酸钙(CaSiO3)、硅酸铝钙(Ca2Al2SiO7)等,这些化合物是混凝土渣中骨料(石子、沙子)的成分。活性炭的主要组成元素为C、O等,这些元素是由于活性炭是通过碳素含量很高的木质材料经过高温热解或氧化处理而成的,因此,其主要成分为碳和氧。
-
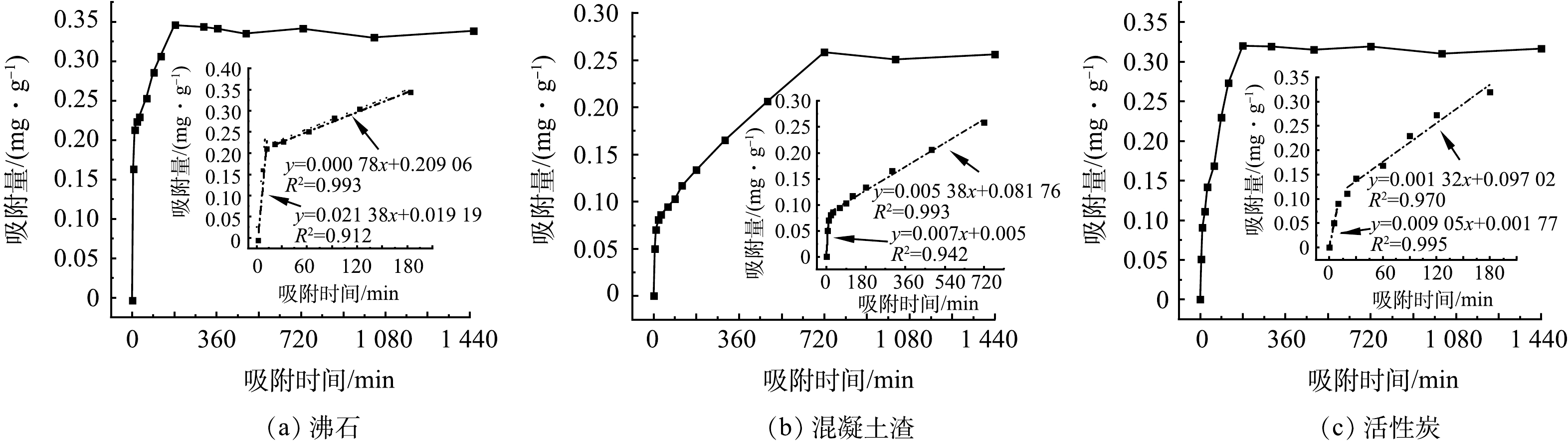
对3种材料进行动力学吸附实验,得到三者动力学吸附曲线(图4)。沸石和混凝土渣对氨氮的吸附均呈现出明显的快速吸附、慢速吸附及吸附释放平衡3个阶段的吸附特征,活性炭对氨氮的吸附呈现出明显的快速吸附和吸附释放平衡两个阶段的吸附特征。沸石及活性炭达到吸附释放平衡历时较短,均为180 min达到吸附释放平衡。其中沸石吸附氨氮过程中的最大吸附量的61.88%集中在前10 min完成,180 min后达吸附释放平衡,最大吸附量为0.346 mg·g−1。活性炭吸附氨氮过程中,前10 min完成最大吸附量的28.30%,180 min后达到吸附释放平衡,最大吸附量为0.320 mg·g−1。混凝土渣达吸附释放平衡的历时较长,0~30 min为快速吸附阶段,该阶段可完成最大吸附量的33.34%,30~720 min为慢吸附阶段,720 min后达吸附释放平衡,最大吸附量为0.258 mg·g−1。通过对比可以看出,沸石的快速吸附时间短,吸附效率高,原因是沸石与活性炭相比,沸石对氨氮表现出更高的亲和力和吸附稳定性[16];沸石与混凝土渣相比,沸石粒径更小、比表面积更大、表面具有更多的氨氮吸附位点[17]。
由表1知,对3种材料吸附动力学曲线进行模型拟合后,沸石、混凝土渣和活性炭的准一级动力学模型的拟合可决定系数R2分别为0.838、0.809和0.808。准二级动力学模型的R2分别为0.926、0.863和0.558。对比可知,沸石及混凝土渣吸附动力学曲线与准二级动力学模型有更高的拟合度,活性炭吸附动力学曲线与准一级动力学模型有更高的拟合度,说明沸石及混凝土渣对氨氮的吸附行为是多种吸附作用共同实现的[18],活性炭对氨氮的吸附是通过表面吸附或者孔隙吸附来实现的,而不是通过化学吸附[19]。
-
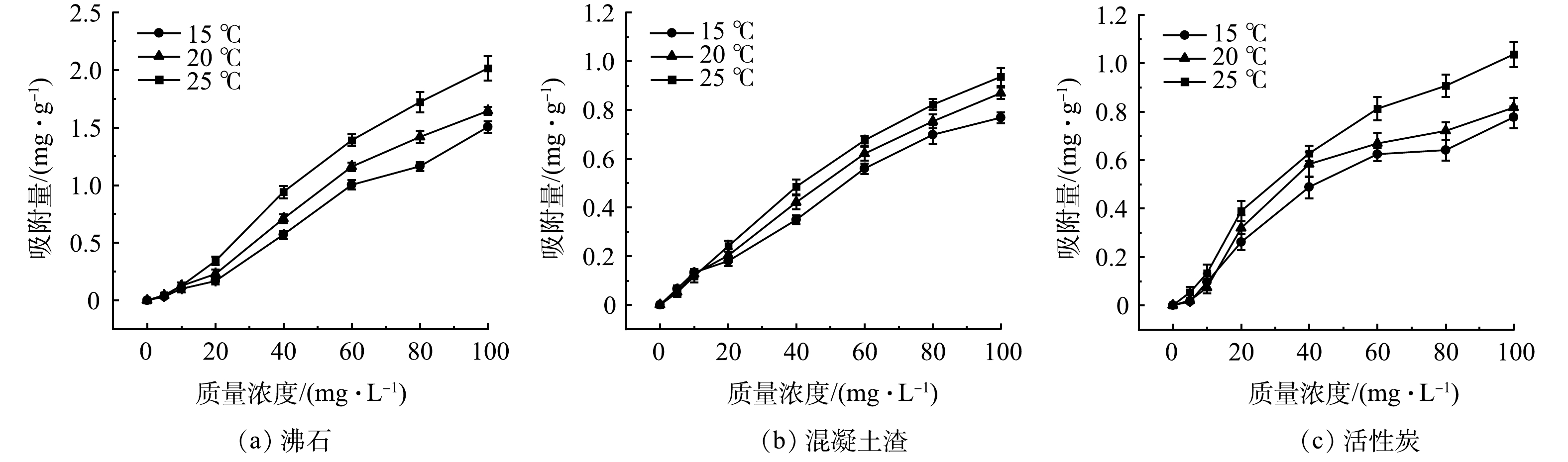
由图5知,在质量浓度梯度为0、20、40、60、80、100 mg·L−1的氨氮胁迫下,随着污染物质量浓度的升高,3种材料对氨氮的吸附量均呈现增加趋势。且三者对氨氮吸附量随温度升高均呈现明显的增长趋势,不同温度实验条件下的最大氨氮吸附量均表现为:沸石>活性炭>混凝土渣。
由表2知,3种材料吸附氨氮的热力学曲线拟合Langmuir和Freundlich模型均表现出Freundlich模型的拟合程度更高,说明3种材料的吸附过程均属于多分子层吸附,这与HUANG等[20]在沸石去除水溶液氨氮研究中的拟合结果、LI等[21]在建筑垃圾再生骨料(沥青、混凝土渣等)作为人工湿地填料的净化效果研究中的拟合结果以及WANG等[22]在沸石-活性炭复合材料作为吸附剂去除水溶液氨氮研究中的拟合结果相似。同时,3种材料Freundlich拟合模型的参数均表现为0<1/n<1,表明沸石、混凝土渣和活性炭都属于易吸附的材料[23]。沸石、混凝土渣和活性炭的吸附系数KF随着温度的升高而增大,进一步说明温度升高提升了三者对氨氮的吸附能力[24]。在不同温度实验条件下的理论最大吸附量均表现为:沸石>活性炭>混凝土渣,表明沸石吸附效果最好,如在常温(25±1) ℃条件下,沸石、混凝土渣和活性炭的理论最大吸附量分别达3.809、1.132和1.416 mg·g−1。结合前文分析,可推测温度的提升有效的促进了沸石对氨氮的吸附,这是由于温度会增加固液界面之间的离子交换,使氨氮分子与沸石的吸附位点接触机会更多,从而提升了沸石的吸附效果,这与宋珩等[25]在沸石处高温废水环境的氨氮吸附特性研究结果相似。
-
由表3知,沸石、混凝土渣及活性炭体系
$ \Delta {H}^{\mathrm{\theta }} $ 均大于0,说明沸石、混凝土渣及活性炭吸附氨氮为吸热反应。一般来说,物理吸附过程中产生的热量与冷凝热的数量级相同,$ \Delta {H}^{\mathrm{\theta }} $ 值约在2.1~20.9 kJ·mol−1,而化学吸附的热量一般在80~200 kJ·mol−1 [26]。活性炭体系$ \Delta {H}^{\mathrm{\theta }} $ 值为4.458 kJ·mol−1,在2.1~20.9 kJ·mol−1,再次说明活性炭对氨氮的吸附是吸热且以物理吸附为主。而沸石和混凝土渣体系$ \Delta {H}^{\mathrm{\theta }} $ 值分别为28.572 kJ·mol−1和25.996 kJ·mol−1,说明沸石和混凝土渣对氨氮的吸附可能是吸热伴有物理化学吸附过程,而非单纯的吸热伴有物理或化学吸附过程。3个材料反应体系$ \Delta {S}^{\mathrm{\theta }} $ 值均为正值,说明沸石、混凝土渣及活性炭对氨氮的吸附过程是熵增的过程,吸附过程中固溶体界面随机性的增加,即体系混乱度增加。热力学参数$ \Delta {G}^{\mathrm{\theta }} $ 均小于0,且随着温度的升高$ \Delta {G}^{\mathrm{\theta }} $ 均减小,再次说明三者对氨氮的吸附过程均为自发进行,且在较高温度下对氨氮的吸附效果更好[27]。 -
1) BET分析。通过BET分析对比可知(表4),活性炭具有最大的比表面积、总孔体积、微孔体积和平均孔径,沸石次之,混凝土渣最小。吸附氨氮后,沸石和活性炭的比表面积、总孔体积和微孔体积均呈现出变小趋势,比表面积的减少率分别为7.96%和36.87%,总孔体积的减小率分别为7.00%和15.41%,微孔体积的减小率分别为20.92%和50.71%。混凝土渣与前两者不同,其比表面积呈增加趋势,总孔体积和微孔体积均呈现出变小趋势,比表面积增长率为24.42%,总孔体积及微孔体积的减小率分别为20.59%和22.22%。沸石在吸附过程中,氨氮分子会与其表面发生化学反应,形成氨基盐等化合物从而填充沸石的孔隙和空隙,从而使其孔隙率不断下降[28]。活性炭本身具有多微孔和介孔结构的特点,这些孔隙可以通过物理作用吸附氨氮分子,以上作用导致孔隙结构的部分堵塞,孔体积减小,有效表面积减少[29]。混凝土渣表面具有丰富的羟基和硅铝盐等吸附位点,依靠这些位点能够与氨氮形成氢键和静电作用等吸附力,进而实现对氨氮分子的吸附,形成的化合物可进一步增加混凝土渣的表面积,相关研究也表明,混凝土渣表面没有像沸石和活性炭那样丰富的微孔和介孔结构,部分氨氮分子填充混凝土渣的孔隙会直接导致总孔体积和微孔体积变小[30]。三种材料吸附氨氮后,平均孔径均增加,沸石、混凝土渣和活性炭的平均孔径增长率分别为26.33%、11.16%和28.71%,原因是氨氮分子被吸附到材料的表面形成吸附层后,三者均表现出微孔体积减小率高于总孔体积减小率,即微孔体积变小是总孔体积变小的主要影响因素,部分微孔孔隙空间的减小或消失使得平均孔径增大[31]。
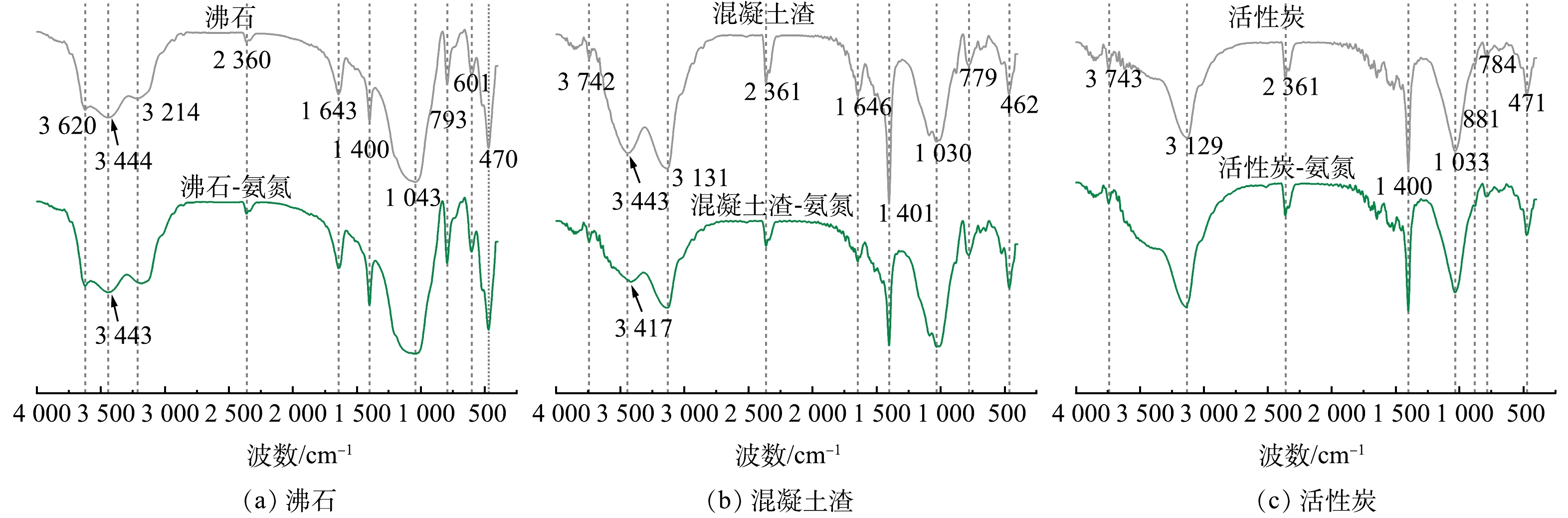
2) FTIR分析。基于FTIR分析,材料表面的结构可以通过其骨架振动光谱和羟基吸收峰来表征,且这些官能团对材料的吸附性能影响较大[32]。由图6(a)可知,3 620、3 444和3 214 cm−1处出现的峰为沸石表面O—H伸缩振动峰,其中3 444 cm−1为中心的宽带水合信号是羟基的特征[33],O—H伸缩振动峰由3 444 cm−1偏移至3 443 cm−1,说明氨氮与沸石之间存在氢键作用或静电引力。沸石吸附氨氮前后的吸收峰的位置大致相同,但峰强度不同,说明沸石吸附氨氮前后官能团类型没有变化,但数量发生了变化,侧面反映沸石中的羟基官能团有利于氨氮的吸附[34]。由图6(b)知,混凝土渣吸附氨氮前后无新峰形成,且吸收峰的位置大致相同,O—H伸缩振动峰由3 443 cm−1偏移3 417 cm−1,说明混凝土渣中的羟基官能团可能与氨氮形成氢键或存在静电引力,从而导致氨氮的红外光谱吸收峰发生偏移。1 030、1 401和2 361 cm−1处的吸收峰未发生偏移但是强度发生明显变化,说明混凝土渣中的Si/Al—O基团也可能参与氨氮的吸附作用[35]。由图6(c)知,活性炭吸附氨氮前后无新峰形成,且吸收峰的位置相同无偏移,原因是活性炭是以物理吸附的方式为主,而非化学吸附[36]。三种材料吸附氨氮前后均表现出吸收峰的位置大致相同,但峰强度不同,三者比较后可发现混凝土渣和沸石的红外光谱图表现出相似的吸收峰和强度,这反映了沸石和混凝土渣的化学结构和表面性质可能相同,进而导致两者吸附氨氮的机理可能相同。
3) XRD分析。由图7知,三种填料吸附氨氮后的特征峰数量和位置均无特别明显变化。由图7(a)可知,2
$ \theta $ 为19.85°、22.16°、24.75°、26.36°、29.78°、31.70°是沸石的特征峰,吸附氨氮后沸石的特征峰数量和位置无明显变化。仅2$ \theta $ 为27.47°处可能出现了C6N2的衍射峰,该处与X射线衍射标准卡(09-0544)的图谱特征峰相似,说明沸石发生吸附后其晶体结构基本未发生改变,这与刘思远等[37]的研究结论一致。由图7(b)可知,混凝土渣的主要成份为SiO2和硅酸盐(CaSiO3、Ca2Al2SiO7等),混凝土渣吸附氨氮后在2$ \theta $ 为20.58°、26.26°、29.16°和36.31°处的峰强度较吸附前减弱明显,说明混凝土渣吸附氨氮后影响了混凝土渣的表面结构[18]。由图7(c)可知,虽然活性炭是非晶态材料,没有明确的晶体结构,但是可能存在弱碳元素的衍射峰,图中显示其吸附氨氮前后各衍射峰无明显变化,说明活性炭吸附氨氮后无新型晶体结构生成[38]。 -
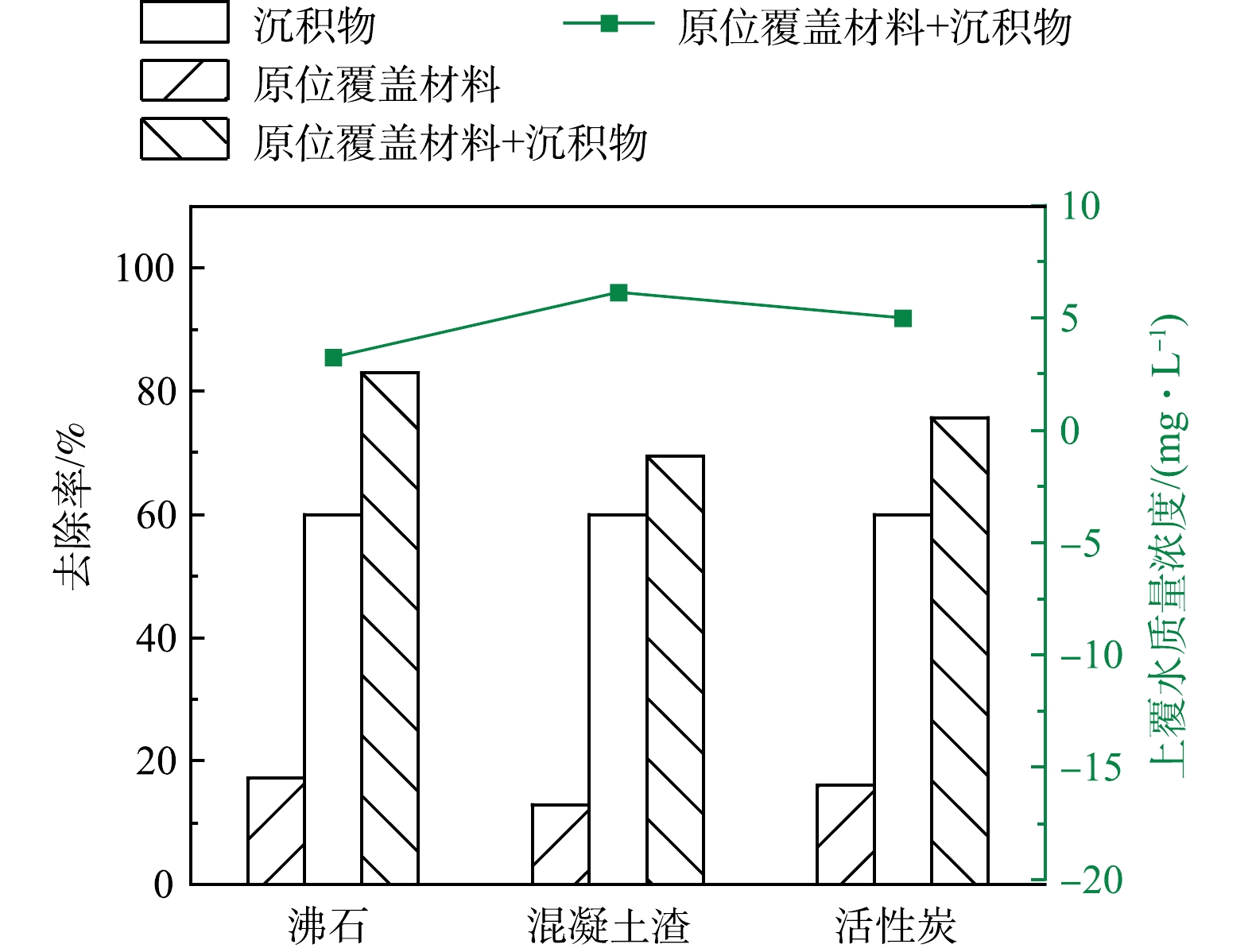
1)沉积物添加材料后对氨氮吸附效果对比分析。通过材料混合沉积物实验对比分析材料对河岸带沉积物吸附上覆水中氨氮效果的提升作用。由图8知,未添加材料的对照组对氨氮的吸附率为60.00%,单位吸附量为1.20 mg·g−1。材料混合沉积物的实验组对氨氮的吸附率较对照组得到明显提升,沸石、混凝土渣和活性炭添至沉积物后对氨氮的吸附率分别为83.04%、69.41%和75.72%,较对照实验组分别提高了23.04%、9.41%和15.72%,混合体系单位吸附量分别为1.546、1.282和1.387 mg·g−1。达到吸附平衡后,上覆水环境中的氨氮质量浓度由20 mg·L−1分别降至3.26、6.12和4.99 mg·L−1,进一步说明添加覆盖材料可以有效提升沉积物对氨氮的吸附容量,降低上覆水体的氨氮质量浓度。沸石、混凝土渣和活性炭添加组对氨氮的吸附效果表现为:添加沸石组>添加活性炭组>添加混凝土渣组。
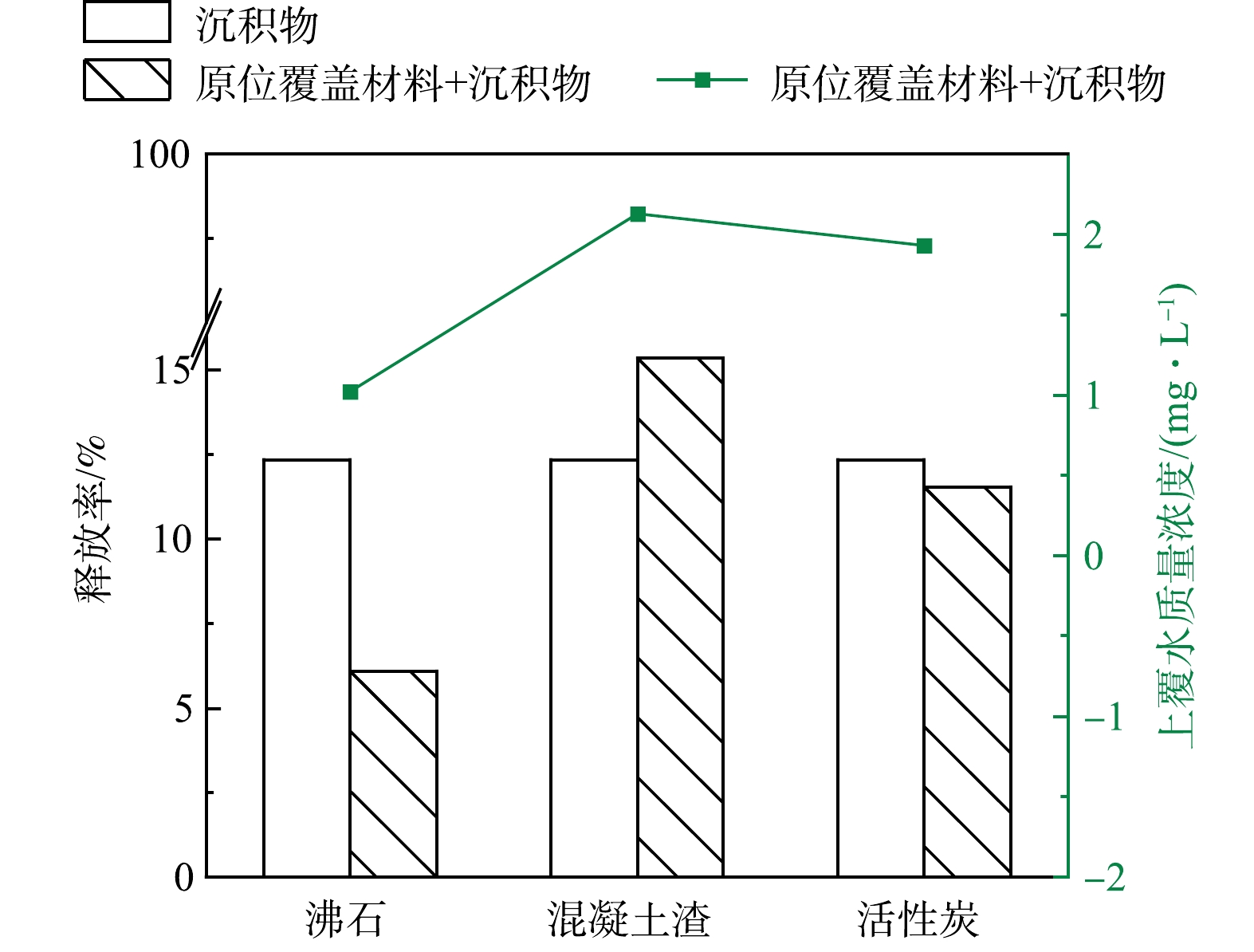
2)沉积物添加材料后对氨氮解吸效果对比分析。为模拟季节性上覆水诱使沉积物发生内源污染物氨氮再次释放,通过解吸实验对比3种材料对沉积物中氨氮的控释效果。由图9可知,随着去离子水的加入,12 h后,各组均出现氨氮从沉积物中释放至上覆水环境的现象,且不同实验组上覆水中的氨氮质量浓度存在明显差异,对照组上覆水氨氮质量浓度为2.07 mg·L−1,添加沸石、混凝土渣和活性炭的实验组上覆水中氨氮质量浓度分别为1.02、2.57和1.93 mg·L−1,对照组沉积物的单位释放量为0.207 mg·g−1,沉积物分别添加沸石、混凝土渣和活性炭的混合体系的单位释放量分别为0.051、0.126和0.097 mg·g−1。可以看出,添加沸石组抑制沉积物中氨氮释放效果最为显著,添加活性炭组次之,但添加混凝土渣组的上覆水中氨氮质量浓度超过了对照组,表现出对沉积物中氨氮释放的促进作用。添加沸石、活性炭对沉积物中氨氮的控释率分别为50.72%和6.76%,推测原因主要是:一方面沉积物中的氨氮释放到水体环境中,沸石表面发生物理吸附及表面阳离子与NH4+交换从而起到了阻隔作用;另一方面沉积物与沸石或活性炭的接触可能诱发沉积物吸附活性位数量增加从而提升沉积物对氨氮的吸附容量,起到了控制沉积物中的氨氮向水体释放的效果[39]。而混凝土渣组的上覆水中氨氮质量浓度超过了对照组的,说明混凝土渣促进了沉积物中氨氮的释放,可能的原因有:沉积物向水体释放转移NH4+的同时,混凝土渣向水体释放转移Ca2+和Fe3+等活性比NH4+弱的离子,等达到临界点,沉积物中的NH4+与水体中Ca2+和Fe3+等进行强烈的离子交换,诱发沉积物释放更多的NH4+,水体中氨氮质量浓度增加且超过了对照组的[40]。
由上述对比可知,沸石、混凝土渣和活性炭作为原位覆盖材料有效提高沉积物的吸附容量和对上覆水中氨氮的吸附能力,表现为添加沸石组>添加活性炭组>添加混凝土渣组。3种材料对沉积物中氨氮控释情况表现为:添加沸石组>添加活性炭组>添加混凝土渣组。其中混凝土渣作为原位覆盖材料添至沉积物后反而会引发沉积物内源氨氮释放。进一步对比沉积物添加沸石和活性炭体系的单位吸附量及释放量可知,沸石和活性炭添加组体系单位吸附量分别为1.546 mg·g−1和1.387 mg·g−1,单位释放量分别为0.051 mg·g−1和0.097 mg·g−1,添加沸石组和添加活性炭组均表现出混合体系的单位吸附量远远大于单位释放量,可考虑作为原位覆盖材料来提升黄河河岸带沉积物对陆源氨氮的吸附效果。此外,沸石添加组的单位吸附量要优于活性炭,在对沉积物中氨氮控释方面也要优于活性炭,且沸石在我国储量大、分布广,成本不高,物理和化学性能稳定[41],选择沸石作为性质优良的原位覆盖材料,用于进一步验证其上覆黄河兰州段河岸带沉积物的应用效果。
-
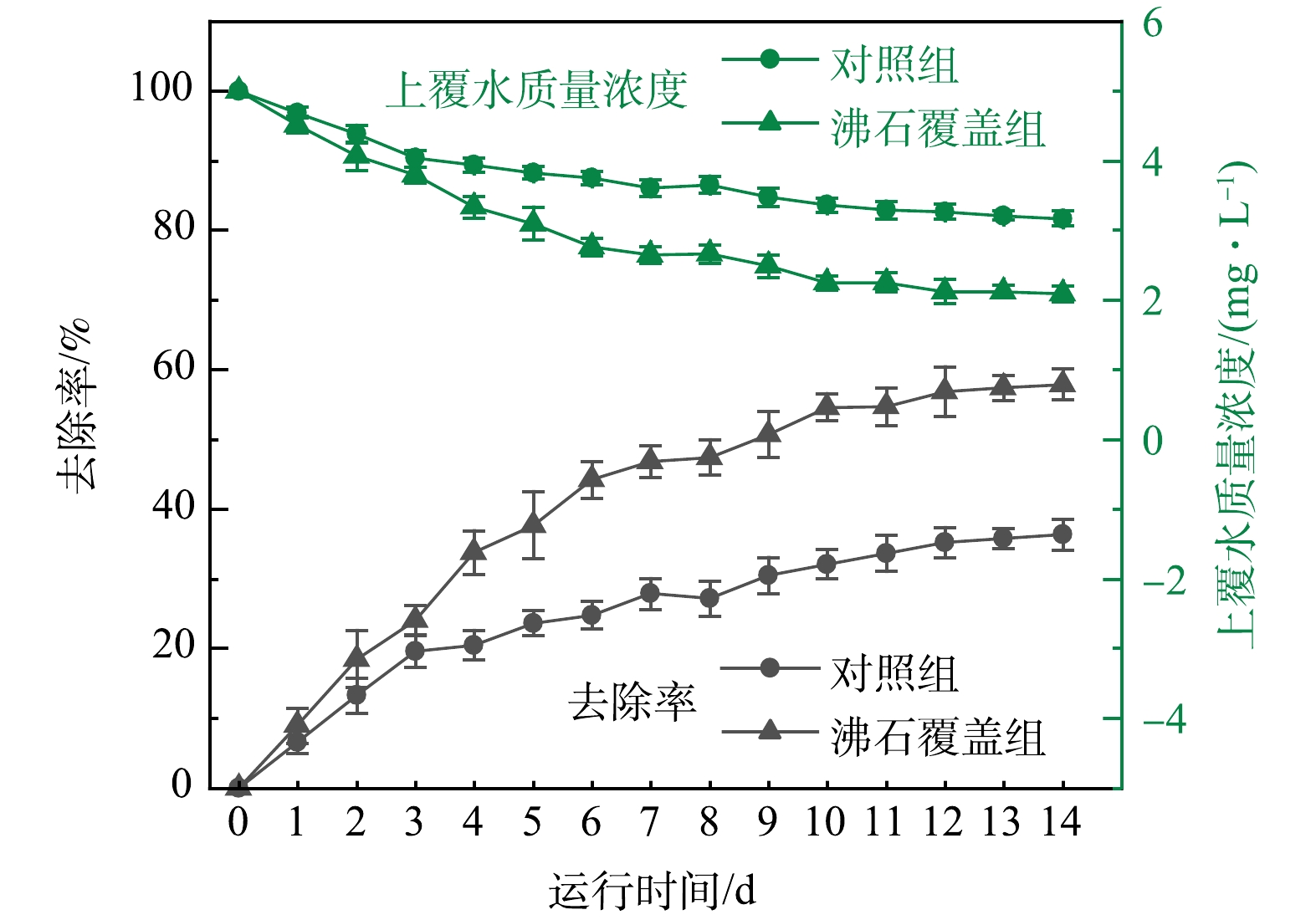
通过“沸石+河岸带沉积物”的覆盖实验组与无沸石覆盖沉积物的对照组对比研究添加沸石后对上覆水中氨氮的吸附及沉积物中氨氮的阻隔效应。由图10知,经过对覆盖实验装置14 d的连续观测,发现沸石覆盖后的沉积物对上覆水中氨氮的吸附能力大幅度提升。装置运行到第14天时,沸石覆盖沉积物的实验装置上覆水水体氨氮质量浓度由5 mg·L−1降至约2.11 mg·L−1,对照组的上覆水中氨氮质量浓度由5 mg·L−1降至约3.18 mg·L−1,两者对上覆水中氨氮的吸附率分别为57.89%和36.32%,由此可见,在相同质量浓度外源氨氮污染的胁迫下,相较于未上覆原位覆盖材料的普通河岸带,利用沸石作为原位覆盖材料的河岸带的上覆水水体氨氮质量浓度更低。沸石上覆沉积物后,使沉积物对外源氨氮的吸附率提升约21.58%。这说明沸石原位覆盖技术的应用可有效提升黄河兰州段河岸带沉积物对氨氮的环境容量及吸附能力,减小黄河上游水体中的的陆源氨氮负荷,降低沉积物内源氨氮释放风险。因此,沸石原位覆盖技术可作为适用黄河兰州段河岸带的一种经济而有效的氨氮污染控制方法。
-
1)常温条件下,沸石及活性炭达到吸附释放平衡历时较短,均为180 min,混凝土渣则为720 min。通过材料吸附氨氮的热力学分析发现,温度对三种材料的氨氮吸附效果具有明显的提升作用,且不同温度下,各材料对氨氮的最大吸附量均表现为:沸石>活性炭>混凝土渣。
2)沸石及混凝土渣对氨氮的吸附行为是多种吸附作用共同实现的,而活性炭对氨氮的吸附是通过表面吸附或者孔隙的物理吸附来实现的。吸附机理分析表明沸石和混凝土渣的羟基官能团通过与氨氮形成氢键或存在静电引力有利于两者对氨氮的吸附,而混凝土渣的硅氧键及铝氧键官能团也参与了氨氮的吸附。
3)通过混合吸附/释放实验发现,沸石、混凝土渣、活性炭分别添至沉积物的混合体系的单位吸附量表现为:沸石组>活性炭组>混凝土渣组。混合体系单位释放量的表现效果与单位吸附量的相反,除添加混凝土渣组表现为诱发沉积物氨氮释放外,添加沸石组和添加活性炭组对沉积物中氨氮均有较好控释效果。
4)相较于混凝土渣及活性炭,沸石具有成本低、吸附速度快、吸附容量大、控释效果明显等特点。通过沸石覆盖黄河兰州段河岸带沉积物实验,运行14 d后发现实验装置上覆水中氨氮质量浓度由5 mg·L−1降至约2.11 mg·L−1,对照组的降至约3.18 mg·L−1,采用沸石覆盖沉积物,无诱发沉积物氨氮释放风险的前提下,对上覆水中氨氮的吸附率可提升约21.58%。沸石可有效的提升河岸带沉积物对外源氨氮的吸附作用及阻控沉积物中氨氮向水体再次释放,可作为良好的原位覆盖材料应用于黄河兰州段河岸带的氨氮污染控制当中。
吸附材料对黄河兰州段河岸带沉积物中氨氮吸附-解吸的影响
Effect of adsorption materials on adsorption-desorption of ammonia-nitrogen in riparian sediments in Lanzhou section of the Yellow River
-
摘要: 采用原位覆盖技术可有效提升河岸带沉积物对陆源污染物的吸附作用,且有效控制沉积物内源污染物释放。本研究以沸石、混凝土渣和活性炭作为覆盖材料的代表,结合BET、SEM-EDS、FTIR、XRD等表征手段,通过吸附动力学实验、吸附热力学实验、混合实验及原位覆盖实验对覆盖材料的氨氮吸附效果及机理进行对比分析,同时研究材料对河岸带沉积物中氨氮吸附及解吸的影响。结果表明,3种材料对20 mg·L−1氨氮溶液中氨氮的吸附动力学表现为:沸石和生物炭在180 min可达到吸附释放平衡,混凝土渣则需720 min。随着环境温度的升高,材料的吸附量不断增加,沸石的理论吸附量值最大。三种材料对氨氮的吸附均属于可自发进行的吸热过程,活性炭吸附主要以物理吸附为主,而沸石、混凝土渣还伴有化学吸附。表征分析结果表明,沸石、混凝土渣在吸附氨氮过程中,两者的羟基官能团与氨氮形成氢键或存在静电引力,这有利于两者对氨氮的吸附,其中混凝土渣的硅氧键及铝氧键官能团也参与了氨氮的吸附。吸附后,沸石的晶体结构未发生改变,但混凝土渣的表面结构受到一定的影响。混合吸附/释放实验结果表明,与无材料添加的对照实验组比较,沸石、混凝土渣和活性炭分别添至沉积物并吸附12 h后,对氨氮质量浓度为20 mg·L−1上覆水中氨氮的吸附率分别提升了23.04%、9.41%和15.72%。但3种材料添至沉积物后对沉积物内源氨氮的控释效果存在差异,添加沸石和活性炭组对沉积物中氨氮的控释率分别提高了6.24%和0.80%,添加混凝土渣组促进了沉积物中氨氮的释放。通过综合对比,沸石吸附氨氮效果最佳,活性炭次之,混凝土渣最差。通过进一步的原位覆盖实验,连续观察14 d后,发现沸石作为原位覆盖材料对上覆水中氨氮吸附率可提升约21.58%,且无诱发沉积物中氨氮释放风险,可成为黄河兰州段河岸带面源污染控制的原位覆盖材料。Abstract: The use of in-situ cover technology can effectively enhance the adsorption of land-based pollutants by riparian sediment and effectively control the release of endogenous pollutants in sediments. In this study, zeolite, concrete slag, and activated carbon were used as representatives of cover materials (inorganic/activated), combined with BET, SEM-EDS, FTIR, XRD, and other characterization means, to comparatively analyze the ammonia nitrogen adsorption effect and mechanism of the cover materials through adsorption kinetic and thermodynamic experiments, mixed experiments and in-situ covering experiments, the effect of the materials on the adsorption and desorption of ammonia nitrogen in the sediment of the riparian zone was also studied. The results showed that the adsorption kinetics of ammonia nitrogen in 20 mg·L−1 ammonia nitrogen solution on the three materials were following: zeolite and biochar could reach the adsorption-desorption equilibrium in 180 min, while concrete slag took 720 min. With the increase of the ambient temperature, the adsorption capacity of the material increased, and the theoretical adsorption value of zeolite was the largest. The adsorption of ammonia nitrogen on the three materials was a spontaneous endothermic process, and the physical adsorption mainly occurred on activated carbon, while the chemical adsorption adsorption also accompanied on zeolite and concrete slag. The results of characterization analysis showed that the hydroxyl functional groups of zeolite and concrete slag could form hydrogen bonds with ammonia nitrogen or produce electrostatic attraction during the adsorption of ammonia nitrogen, which was conducive to the adsorption of ammonia nitrogen, of which the silica-oxygen and aluminum-oxygen bonding functional groups of concrete slag also took part in the adsorption of ammonia nitrogen. After adsorption, no changes happened in the crystal structure of zeolite, but some changes appeared on the surface structure of concrete slag. The results of the mixed adsorption/release experiments showed that with comparison to the control experimental group with no material addition, the adsorption efficiencies of ammonia nitrogen in overlying water with an initial concentration of 20 mg·L−1 increased by 23.04%, 9.41%, and 15.72% after the addition of zeolite, concrete slag, and activated carbon to the sediment and 12 h absorption, respectively. However, there were differences in the release control of endogenous ammonia nitrogen from the sediments after the three materials were added to the sediments, the release control effects of ammonia nitrogen from the overlying water were 6.24% and 0.80% for the addition of zeolite and activated carbon groups, respectively, while the addition of concrete slag group increased the release of ammonia nitrogen from the sediments. Through comprehensive comparison, the best effect of adsorption ammonia nitrogen was zeolite, then was activated carbon, and the worst effect was concrete slag. Further in-situ covering experiments were carried out, and the results showed that zeolite as in-situ covering material could increase the adsorption efficiency of ammonia nitrogen by about 21.58%, and the risk of induced release of ammonia nitrogen from sediment was low, it can be used as in-situ covering material for non-point source pollution control in the riparian zone of Lanzhou section of the Yellow River.
-

-
表 1 原位覆盖材料吸附氨氮动力学模型参数
Table 1. Adsorption kinetic model parameters of in-situ covering material to ammonia nitrogen
原位覆盖材料 准一级动力学模型 准二级动力学模型 k1/(min−1) qe/(mg·g−1) R2 k2/(g·mg−1·min−1) qe/(mg·g−1) R2 沸石 0.079 0.322 0.838 0.155 0.350 0.926 混凝土渣 0.006 0.240 0.809 0.029 0.266 0.863 活性炭 0.026 0.321 0.808 0.088 0.309 0.558 表 2 原位覆盖材料吸附氨氮的Langmuir和Freundlich模型参数
Table 2. Langmuir and Freundlich model parameters for ammonia nitrogen adsorption on in-situ covering materials
原位覆盖材料 温度/ ℃ Langmuir模型 Freundlich模型 Qm/(mg·g−1) kL/(L·mg−1) R2 n kF/((mg·g−1)(L·mg−1)1/n) R2 沸石 15 2.871 0.047 0.932 1.694 0.024 0.973 20 3.156 0.049 0.940 1.732 0.038 0.972 25 3.809 0.053 0.953 1.820 0.089 0.970 混凝土渣 15 0.972 0.027 0.978 1.867 0.014 0.988 20 1.016 0.041 0.984 1.850 0.016 0.993 25 1.132 0.052 0.987 1.888 0.025 0.993 活性炭 15 1.228 0.014 0.907 1.733 0.017 0.932 20 1.346 0.021 0.804 1.506 0.021 0.946 25 1.416 0.026 0.906 1.949 0.023 0.910 表 3 原位覆盖材料吸附氨氮热力学参数
Table 3. Adsorption thermodynamic parameters of ammonia nitrogen on in-situ covering material
原位覆盖材料 温度/ ℃ ∆Gθ/(kJ·mol−1) ∆Hθ/(kJ·mol−1) ∆Sθ/(kJ·mol−1) 沸石 15 −3.423 28.572 0.111 20 −4.159 25 −4.455 混凝土渣 15 −3.356 25.996 0.101 20 −3.429 25 −4.380 活性炭 15 −0.072 4.458 0.016 20 −0.024 25 −2.267 表 4 原位覆盖材料吸附氨氮前后比表面积及孔径结构参数
Table 4. The specific surface area and pore size structure parameters of the in-situ coated material before and after adsorption of ammonia nitrogen
原位覆盖材料 吸附前/后 比表面积
/(m2·g−1)总孔体积
/(cm3·g−1)微孔体积
/(cm3·g−1)平均孔径
/nm沸石 吸附前 457.815 0.486 0.325 2.252 吸附后 421.376 0.452 0.257 2.845 混凝土渣 吸附前 76.645 0.034 0.018 8.435 吸附后 95.359 0.027 0.014 9.376 活性炭 吸附前 1 052.241 0.915 0.635 13.217 吸附后 664.317 0.774 0.313 17.011 -
[1] BERTOLET B L, CORMAN J R, CASSON N J, et al. Influence of soil temperature and moisture on the dissolved carbon, nitrogen, and phosphorus in organic matter entering lake ecosystems[J]. Biogeochemistry, 2018, 139(3): 293-305. doi: 10.1007/s10533-018-0469-3 [2] 范成新, 刘敏, 王圣瑞, 等. 近20年来我国沉积物环境与污染控制研究进展与展望[J]. 地球科学进展, 2021, 36(4): 346-374. [3] 杨颖, 刘吉宝, 魏源送, 等. 北运河沉积物中氮磷营养盐及荧光溶解性有机物的污染特征研究[J]. 环境科学学报, 2022, 42(3): 40-50. [4] 孟晓东. 炭质吸附剂原位治理污染底泥技术研究[D]. 北京: 北京交通大学, 2016. [5] JABŁOŃSKA-CZAPLA M, ZERZUCHA P, GRYGOYĆ K. Impact of river water and bottom sediment pollution on accumulation of metal(loid)s and arsenic species in the coastal plants stuckenia pectinata l. , galium aparine l. , and urtica dioica l. : A chemometric and environmental study[J]. Archives of Environmental Contamination and Toxicology, 2020, 79(1): 60-79. [6] 吴闪闪, 刘付文晓, 许志国, 等. 硝酸钙缓释颗粒原位修复黑臭底泥的作用机制及其应用[J]. 环境工程学报, 2022, 16(7): 2198-2207. doi: 10.12030/j.cjee.202109158 [7] PATIL M P, JEONG I, WOO H E, et al. Effect of bacillus subtilis zeolite used for sediment remediation on sulfide, phosphate, and nitrogen control in a microcosm[J]. International Journal of Environmental Research and Public Health, 2022, 19(7): 4163. doi: 10.3390/ijerph19074163 [8] ABEL S, AKKANEN J. Novel, Activated carbon-based material for in-situ remediation of contaminated sediments[J]. Environmental Science & Technology, 2019, 53(6): 3217-3224. [9] 李扬, 李锋民, 张修稳, 等. 生物炭覆盖对底泥污染物释放的影响[J]. 环境科学, 2013, 34(8): 3071-3078. [10] 于翔霏, 程宪伟, 祝惠, 等. 长春西湖沉积物氮、磷营养盐释放通量及原位覆盖控释效果模拟研究[J]. 湿地科学, 2017, 15(4): 595-600. [11] GU B-W, HONG S-H, LEE C-G, et al. The feasibility of using bentonite, illite, and zeolite as capping materials to stabilize nutrients and interrupt their release from contaminated lake sediments[J]. Chemosphere, 2019, 219: 217-226. doi: 10.1016/j.chemosphere.2018.12.021 [12] 申粤, 聂煜东, 张贤明, 等. 底泥原位覆盖材料选择及应用研究进展[J]. 环境污染与防治, 2021, 43(7): 898-903. [13] 贺艳, 邓月华. 原位薄层覆盖修复重金属污染沉积物的研究现状与展望[J]. 环境污染与防治, 2023, 45(10): 1456-1461. [14] SCHER Y, BONOMO O L, PAL A, et al. Microscopic theory of adsorption kinetics[J]. The Journal of Chemical Physics, 2023, 158(9): 094107. doi: 10.1063/5.0121359 [15] GUPTA H, SINGH S. Kinetics and thermodynamics of phenanthrene adsorption from water on orange rind activated carbon[J]. Environmental Technology & Innovation, 2018, 10: 208-214. [16] MATITO-MARTOS I, MARTIN-CALVO A, ANIA C O, et al. Role of hydrogen bonding in the capture and storage of ammonia in zeolites[J]. Chemical Engineering Journal, 2020, 387: 124062. doi: 10.1016/j.cej.2020.124062 [17] DEHGHAN R, ANBIA M. Zeolites for adsorptive desulfurization from fuels: A review[J]. Fuel Processing Technology, 2017, 167: 99-116. doi: 10.1016/j.fuproc.2017.06.015 [18] WANG M Q, XU D F, MA H, et al. Synthesis of NaA zeolite from foundry dust and its adsorption capacity of ammonia[J]. Journal of Environmental Management, 2023, 331: 117297. doi: 10.1016/j.jenvman.2023.117297 [19] HUBBE M A, AZIZIAN S, DOUVEN S. Implications of apparent pseudo-second-order adsorption kinetics onto cellulosic materials: A Review[J]. BioResources, 2019, 14: 7582-7626. doi: 10.15376/biores.14.3.Hubbe [20] HUANG H M, XIAO X M, YAN B, et al. Ammonium removal from aqueous solutions by using natural Chinese (chende) zeolite as adsorbent[J]. Journal of Hazardous Materials, 2010, 175(1-3): 247-252. doi: 10.1016/j.jhazmat.2009.09.156 [21] LI Y J, WANG J P, LIN X C, et al. Purification effects of recycled aggregates from construction waste as constructed wetland filler[J]. Journal of Water Process Engineering, 2022, 50: 103335. doi: 10.1016/j.jwpe.2022.103335 [22] WANG M, XIE R Z, CHEN Y, et al. A novel mesoporous zeolite-activated carbon composite as an effective adsorbent for removal of ammonia-nitrogen and methylene blue from aqueous solution[J]. Bioresource Technology, 2018, 268: 726-732. doi: 10.1016/j.biortech.2018.08.037 [23] 张芙蓉, 雷行, 常冰, 等. 铝锰复合氧化物负载沸石对氨氮和磷的同步吸附特性[J]. 环境工程学报, 2017, 11(4): 2163-2169. doi: 10.12030/j.cjee.201601038 [24] ASHFAQ M H, SHAHID S, JAVED M, et al. Controlled growth of TiO2/Zeolite nanocomposites for simultaneous removal of ammonium and phosphate ions to prevent eutrophication[J]. Frontiers in Materials, 2022, 9: 1007485. doi: 10.3389/fmats.2022.1007485 [25] 宋珩, 魏刚, 樊保民, 等. 天然沸石在高温氨氮废水中的吸附特性研究[J]. 北京化工大学学报(自然科学版), 2013, 40(6): 62-66. [26] LIU Y, LIU Y J. Biosorption isotherms, kinetics and thermodynamics[J]. Separation and Purification Technology, 2008, 61(3): 229-242. doi: 10.1016/j.seppur.2007.10.002 [27] REN Z J, JIA B, ZHANG G M, et al. Study on adsorption of ammonia nitrogen by iron-loaded activated carbon from low temperature wastewater[J]. Chemosphere, 2021, 262: 127895. doi: 10.1016/j.chemosphere.2020.127895 [28] FAN J W, WU H X, LIU R Y, et al. Non-thermal plasma combined with zeolites to remove ammonia nitrogen from wastewater[J]. Journal of Hazardous Materials, 2021, 401: 123627. doi: 10.1016/j.jhazmat.2020.123627 [29] ZHU F, WANG Z Q, HUANG J C, et al. Efficient adsorption of ammonia on activated carbon from hydrochar of pomelo peel at room temperature: Role of chemical components in feedstock[J]. Journal of Cleaner Production, 2023, 406: 137076. doi: 10.1016/j.jclepro.2023.137076 [30] LUAN X Z, LI J H, YANG Z W. Effects of attapulgite addition on the mechanical behavior and porosity of cement-based porous materials and its adsorption capacity[J]. Materials Chemistry and Physics, 2020, 239: 121962. doi: 10.1016/j.matchemphys.2019.121962 [31] LAWAL A A, HASSAN M A, ZAKARIA M R, et al. Effect of oil palm biomass cellulosic content on nanopore structure and adsorption capacity of biochar[J]. Bioresource Technology, 2021, 332: 125070. doi: 10.1016/j.biortech.2021.125070 [32] XIA M, ZHENG X M, DU M Y, et al. The adsorption of Cs+ from wastewater using lithium-modified montmorillonite caged in calcium alginate beads[J]. Chemosphere, 2018, 203: 271-280. doi: 10.1016/j.chemosphere.2018.03.129 [33] ZHANG H G, LYU T, LIU L X, et al. Exploring a multifunctional geoengineering material for eutrophication remediation: Simultaneously control internal nutrient load and tackle hypoxia[J]. Chemical Engineering Journal, 2021, 406: 127206. doi: 10.1016/j.cej.2020.127206 [34] LI Z J, ZHANG X P, DONG H F, et al. Efficient absorption of ammonia with hydroxyl-functionalized ionic liquids[J]. Royal Society of Chemistry Advances, 2015, 5(99): 81362-81370. [35] 范春辉, 马宏瑞, 花莉. XRD和FTIR对沸石合成机制的光谱学解析[J]. 光谱学与光谱分析, 2012, 32(4): 1118-1122. doi: 10.3964/j.issn.1000-0593(2012)04-1118-05 [36] ZHU K R, FU H, ZHANG J H, et al. Studies on removal of NH4+-N from aqueous solution by using the activated carbons derived from rice husk[J]. Biomass and Bioenergy, 2012, 43: 18-25. doi: 10.1016/j.biombioe.2012.04.005 [37] 刘思远, 郝瑞霞, 刘航, 等. 硅铝比对分子筛吸附氨氮性能的影响[J]. 中国环境科学, 2019, 39(3): 1026-1033. doi: 10.3969/j.issn.1000-6923.2019.03.016 [38] YUAN J J, ZHU Y, WANG J Z, et al. Agricultural bamboo leaf waste as carbon precursor for the preparation of Cu-Al/biomass fiber adsorption and its application in the removal of ammonia nitrogen pollutants from domestic wastewater[J]. Journal of Wood Chemistry and Technology, 2021, 41(4): 137-149. doi: 10.1080/02773813.2021.1914110 [39] NGUYEN T D, NGUYEN T M P, VAN H T, et al. Adsorption removal of ammonium from aqueous solution using Mg/Al layered double hydroxides-zeolite composite[J]. Environmental Technology & Innovation, 2022, 25: 102244. [40] LAI J T, CHENG M S, HUANG R, et al. Mechanism of ammonium sharp increase during sediments odor control by calcium nitrate addition and an alternative control approach by subsurface injection[J]. Environmental Research, 2020, 190: 109979. doi: 10.1016/j.envres.2020.109979 [41] KUKOBAT R, ŠKRBIĆ R, MASSIANI P, et al. Thermal and structural stability of microporous natural clinoptilolite zeolite[J]. Microporous and Mesoporous Materials, 2022, 341: 112101. doi: 10.1016/j.micromeso.2022.112101 -




 下载:
下载: