-
中国是世界最大的煤炭消费国,煤炭消费量占全球的50%。中国全年能源消费总量为57.2×109 t标准煤[1],煤炭消费量占能源消费总量为55.3%。煤炭被广泛应用于热电领域,以及作为能源与原料应用于钢铁冶炼等行业,然而煤炭所含硫分对热电领域与钢铁冶炼等行业的健康发展会产生不利影响[2]。例如,在热电领域,高硫煤燃烧产生二氧化硫所诱发产生的酸雨会导致动植物死亡、石灰岩建筑破坏等环境问题[3]。此外,二氧化硫亦可诱发支气管炎、肺气肿和结膜炎症等多种人类疾病[4]。在炼铁过程中,煤炭中硫含量增加0.1%,生铁产量下降2.0%~2.5%[5]。因此,煤炭脱硫对减少大气污染、保护人体健康、维持相关行业健康发展具有重要意义。
煤炭中硫分主要以有机硫与无机硫形态赋存。其中无机硫多以硫铁矿为主,高硫煤中70%~80%的硫以硫铁矿形态存在[6-8],因此高硫煤中硫分去除需重点关注煤系硫铁矿的去除。依据脱硫原理,煤系硫铁矿的去除方法可分为物理脱硫法,化学脱硫法和生物脱硫法。物理脱硫法是通过煤系硫铁矿与煤基质物理性质或物理化学性质的差异来分离煤炭与硫铁矿的方法,主要有重选法、磁选法和浮选法[9-12]。其中重选法对粒度较小的煤炭脱硫效果较差,而磁选法由于较高的成本都未能实现工业化应用。浮选法尽管实现了工业化应用,然而浮选效率低,较难脱除煤中嵌布粒度较细的硫铁矿也制约了其进一步的推广与发展。而化学脱硫法是通过强酸或者强碱等化学试剂将煤中的硫铁矿进行氧化溶解的方法,其主要有碱处理法、氧化法、热解法、溶剂萃取法等[10]。化学法尽管可以有效的去除煤中的硫铁矿,却需要高温高压等反应条件,并产生二次污染,同时也会导致煤部分可燃物 (腐殖酸等) 的损失,未能实现规模化应用[13-14]。近年来,以硫杆菌为主要微生物介导的煤炭生物浸出脱硫技术因其反应温和、投资少、成本较低、环境污染小而受到业内研究者的关注[15-20],然而浸出时间较长却成为煤炭生物浸出脱硫难以应用的关键问题。ISABEL等采用氧化亚铁硫杆菌和氧化硫硫杆菌开展煤炭脱硫研究,反应30 d后,煤系硫铁矿去除率可达到85%~95%[21]。此外,微生物浸出脱硫需将煤炭粒度研磨至小于0.150 mm[21-24]确保硫铁矿与微生物的充分接触,可见煤炭粒度对生物浸出脱硫可能将产生较大影响。有研究表明,氧化亚铁硫杆菌被引入煤炭体系后,其常在菌胞外聚合物(蛋白质、多糖等)介导下选择性地吸附于煤系硫铁矿表面,可增强硫铁矿的亲水性,降低硫铁矿的可浮性,进而提高煤炭浮选的脱硫效率[25]。煤炭生物浸出脱硫后,煤系硫铁矿表面常吸附一定量的氧化亚铁硫杆菌,若将生物浸出后的煤炭再进行浮选脱硫是否有望进一步提高煤炭脱硫效率尚待被进一步研究。
鉴于以上研究背景,本研究以不同粒度煤炭为研究对象,将煤炭生物浸出脱硫与煤炭浮选脱硫工艺相结合,探讨了煤炭粒度对煤炭生物脱硫的影响,相关研究结果可为煤炭生物脱硫技术的应用提供数据参考。
-
本研究所用煤炭样品采自山西省汾西县某选煤厂。对煤样进行研磨筛分,制备成粒度为0.075~0.150、0.280~0.400与0.500~1.000 mm的煤炭样品。其中0.075~0.150 mm粒度的煤炭样品中全硫、硫铁矿硫、硫酸盐硫含量分别为3.18%、2.45%、0.136%;0.280~0.400 mm和0.500~1.000 mm粒度的煤炭样品中全硫、硫铁矿硫、硫酸盐硫含量分别为2.96%、2.41%、0.121%和2.73%、2.17%、0.062%。
-
将15 mL氧化亚铁硫杆菌休止细胞液与135 mL的9K液体培养基置于一系列250 mL玻璃三角瓶中,于温度28 °C,转速180 r·min−1的恒温振荡器中培养。待体系Fe2+完全氧化后将培养液抽滤,取15 mL滤液重新接种于135 mL的9K液体培养基中在前期相同条件下继续培养。该过程重复2次后将细菌培养液于4 ℃、12 000 r·min−1的条件下离心15 min,弃去上清液,利用pH=2.50硫酸溶液悬浮离心管底部沉淀的菌体,硫酸与离心菌液的体积比设置1﹕30[23],制备出浓缩30倍的氧化亚铁硫杆菌休止细胞液。
-
分别将10 g粒度为0.075~0.150、0.280~0.400、0.500~1.000 mm的煤炭样品置于容积为250 mL的玻璃三角瓶中,加入148 mL去离子水、1 mL浓缩10倍的无铁改性型9K培养基 (培养基包含35 g·L−1 (NH4)2SO4、5.83 g·L−1 MgSO4·7H2O、0.58 g·L−1 K2HPO4、1.198 g·L−1 KCl、0.168 g·L−1 Ca(NO3)2) ,每12 h用3 mol·L−1 H2SO4调节体系pH,72 h后各处理体系pH稳定至2.0后加入1 mL浓缩30倍的休止细胞液后,测定各体系初始pH、总Fe、Fe3+、Fe2+与SO42-的浓度。然后,将三角瓶用消毒的八层纱布封口后放置于28 ℃,180 r·min−1的恒温振荡器中开展煤炭生物浸出脱硫实验,每隔24 h测定体系pH,每72 h从各处理体系收集1 mL样品,通过0.22 μm硝酸纤维素膜过滤,用于测定总Fe、Fe3+、Fe2+与SO42-的浓度。实验过程中各体系挥发的水分通过蒸馏水补充。每个处理初始设置6个重复,并于168 h、360 h各取3个重复混合均匀后,分析体系微生物产生胞外聚合物的化学组成。同时对体系生物浸出后的煤炭在XFD-12型浮选机中进行进一步的浮选脱硫研究。具体为将生物浸出完成时刻的体系溶液放入浮选槽中,加入30 μL煤油以及100 μL仲辛醇并加水至1 L刻度线,置于浮选机中,调节页轮转速至1 736 r·min−1,浮选15 min,刮泡5 min。收集精煤与尾煤,并将煤样于50 ℃下烘干至恒重,测定精煤与尾煤的干重以及硫铁矿的含量。
-
根据Bhattacharyya与马蓉等[26-27]描述的方法测量煤中硫铁矿含量。浸出脱硫与浮选脱硫的效率使用总脱硫率(式(1))、浸出脱硫率(式(2))、浮选降硫率(式(3))、精煤产率(式(4))4个指标进行评价。
式中:
$ {R}_{\mathrm{z}} $ 代表总脱硫率,%;$ {R}_{\mathrm{j}\mathrm{c}} $ 代表浸出脱硫率,%;$ {R}_{\mathrm{f}\mathrm{x}} $ 代表浮选降硫率,%;$ {R}_{\mathrm{j}\mathrm{m}} $ 代表精煤产率,%;Sv为原煤的硫铁矿硫含量,%;Sc为浸出后煤炭的硫铁矿硫含量,%;Sj为浮选后精煤的硫铁矿硫含量,%;Nj为精煤干质量,g;Nc为尾煤干质量,g。溶液pH和氧化还原电位(ORP)采用pH-3C型测定(上海佑科),测定精度分别为0.01与1。采用1,10-邻菲罗啉法测定溶液中总Fe和Fe2+浓度,总Fe浓度与Fe2+浓度差值即为Fe3+浓度[23]。采用离子色谱 (IC6200,皖仪科技) 测定溶液中SO42-含量。采用EDTA法提取体系微生物分泌的胞外聚合物。具体为,将15 mL煤炭浸出脱硫体系混合溶液与等体积质量百分比为2%的EDTA·2Na溶液混合并反应3 h,随后于4 ℃、12 000 r·min−1离心20 min后取上清液,即为粗提细胞胞外聚合物(EPS)溶液,EPS溶液装入截留分子质量为3 500 kD的透析袋后置于4 °C恒温蒸馏水中透析2 d去除溶液杂质,测定EPS溶液中的主要组分蛋白质与多糖含量。蛋白质与多糖含量分别采用考马斯亮蓝G-250法与蒽酮法测定[28-29]。采用CuKαx射线源,利用热场发射扫描电镜(SEM,JSM-7001F,日本东京)与X射线衍射仪(XRD,MiniFlex II,日本东京)对煤的形貌和矿相进行分析。 -
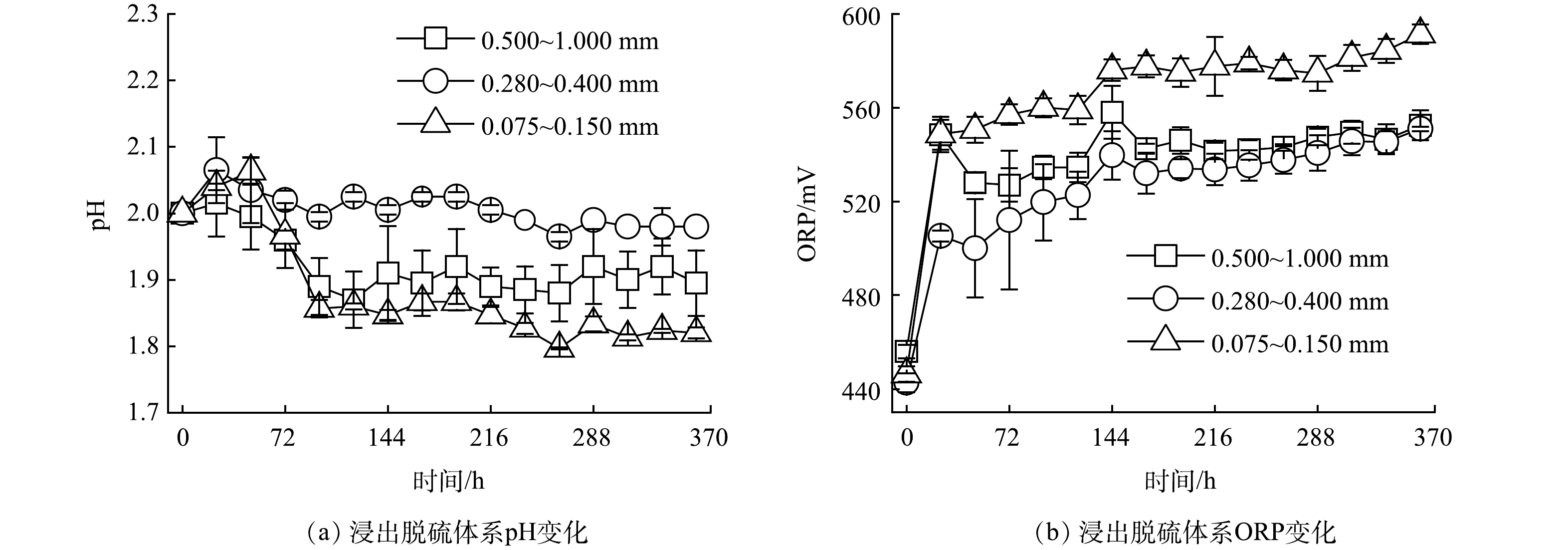
煤炭生物浸出脱硫体系pH与氧化还原电位(ORP)可用来评价煤炭生物浸出脱硫的情况[30-32]。由于氧化亚铁硫杆菌生物氧化煤系硫铁矿可产生H+、SO42-和铁离子,因此,各粒度煤炭生物浸出脱硫体系pH随着反应时间的延长在48 h后呈现逐渐降低的趋势(图1),而造成各处理体系在初始时pH在0~48 h内呈现小幅上升趋势的原因是体系Fe2+被氧化亚铁硫杆菌氧化至Fe3+是一个消耗H+的过程[33]。随着氧化亚铁硫杆菌的加入体系内ORP值在24 h内显著增加,这一现象与叶俊培等[34]的研究结果类似。然后体系内ORP值上升趋势放缓,煤炭生物浸出脱硫过程在360 h时,0.075~0.150 mm粒度的煤炭生物浸出脱硫体系pH值最低为1.82,ORP值最高为591 mV。可见煤炭粒度为0.075~0.150 mm的生物浸出脱硫体系反应更为快速。
-
煤系硫铁矿在O2和氧化亚铁硫杆菌同时存在下发生生物氧化行为[23],化学反应方程如式(5)~(7)所示。这些反应反映了煤系硫铁矿生物氧化过程中固相FeS2与液相中Fe2+、Fe3+、SO42-之间的反应关系,可见液相Fe2+、Fe3+、SO42-浓度可间接评价煤炭生物浸出脱硫效率。
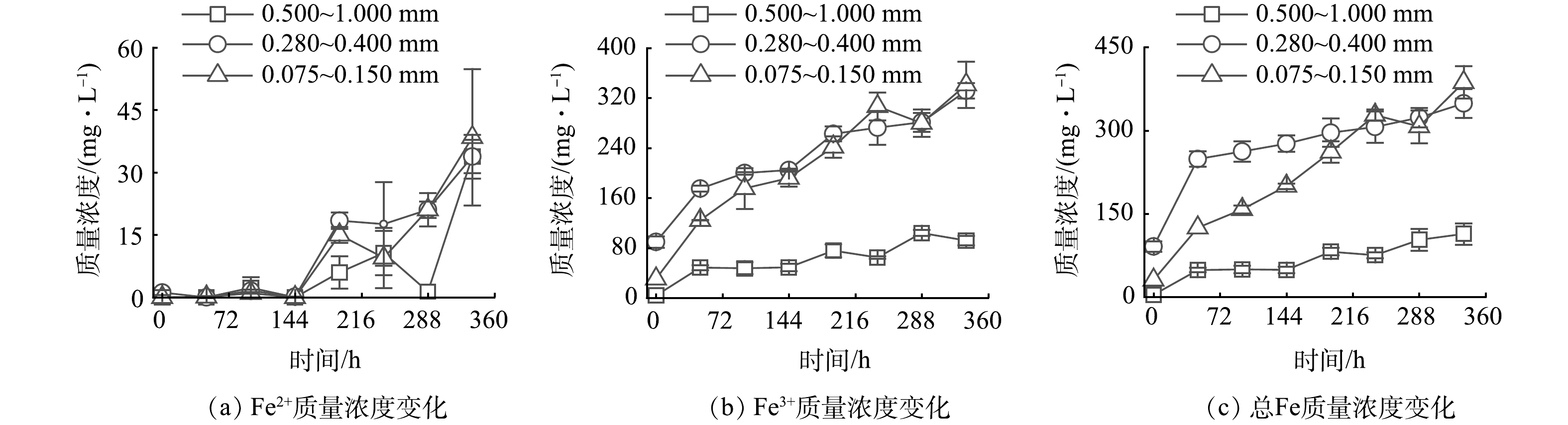
1)各煤炭生物浸出脱硫处理体系Fe2+、Fe3+、总Fe浓度的变化。图2为各煤炭生物浸出脱硫体系反应至360 h时Fe2+、Fe3+和总Fe含量的变化情况。在尚未加入氧化亚铁硫杆菌的初始时刻,各体系含有一定量的Fe3+,其可能是由于前期用硫酸调节pH后,硫酸溶解煤中的含铁矿物(Fe2O3)导致溶出的Fe3+进入液相所致。与各处理液相Fe3+含量相比较,尽管在煤炭生物浸出脱硫过程中Fe2+浓度呈现小幅升高趋势(图2(a)),在浸出脱硫结束后各处理体系Fe2+含量仍低于40 mg·L−1,各处理体系Fe2+对全Fe的占比相对较低。图2(b)~(c)分别为各煤炭浸出脱硫体系Fe3+含量与总Fe含量的变化,在0~48 h内体系的Fe3+与全Fe显著增加,后增长放缓。0.075~0.150 mm粒度的煤炭生物浸出脱硫体系中总Fe的溶出率显著高于其他两个体系,在生物浸出360 h时,该体系Fe3+浓度净增加值分别是0.500~1.000 mm和0.280~0.400 mm粒度煤炭浸出脱硫体系的3.52倍和1.28倍,全Fe浓度净增加值分别是0.500~1.000 mm与0.280~0.400 mm煤炭浸出脱硫体系的3.18倍与1.36倍。
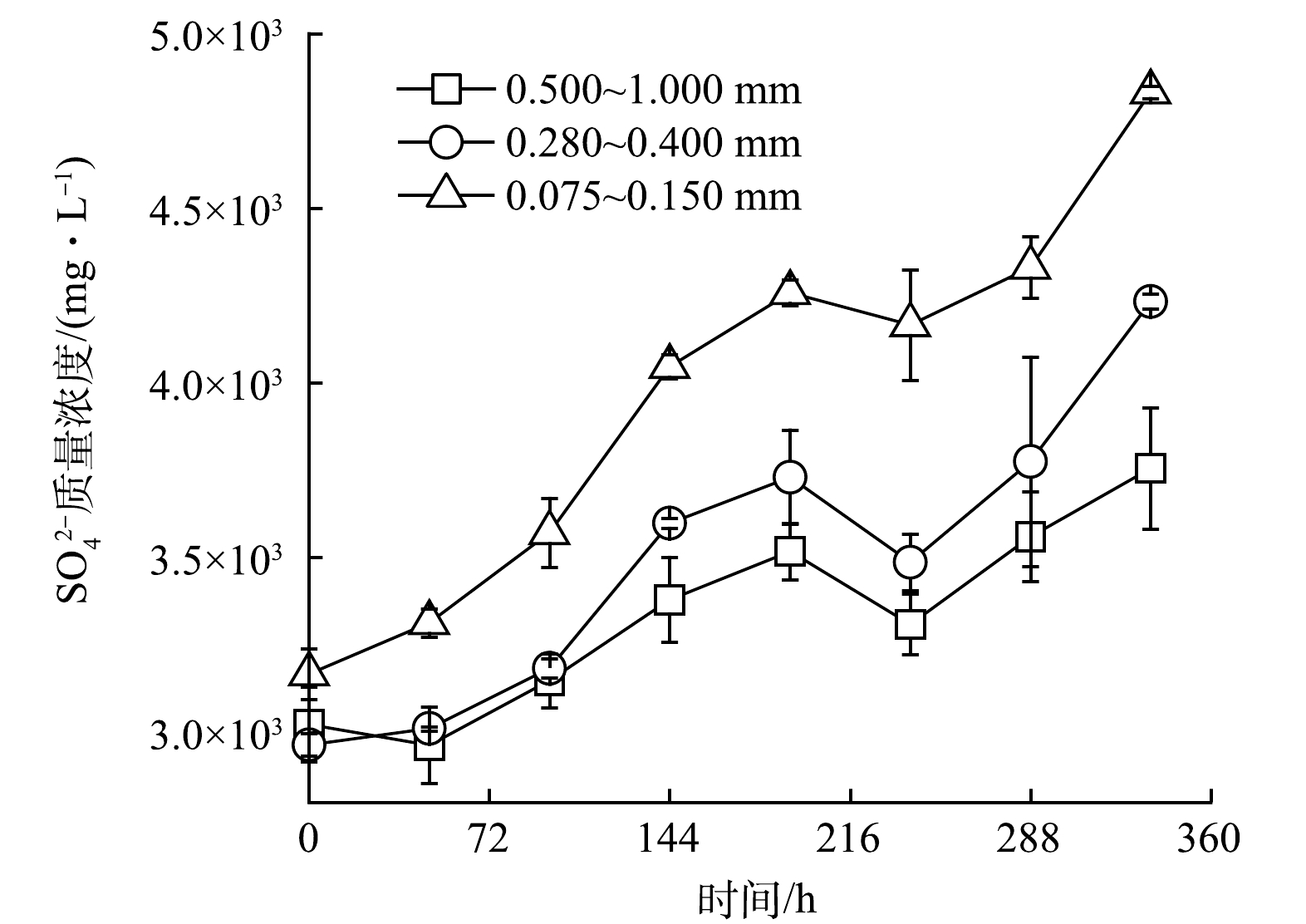
2)煤炭生物浸出脱硫过程中SO42-含量变化。煤炭生物浸出脱硫使得煤系硫铁矿中硫以SO42-的形式进入液相。图3为各煤炭生物脱硫体系SO42-浓度的变化情况。各体系初始时刻有一定量的硫酸根,这是由于前期调节pH使得体系引入SO42-所致。各处理体系在整个生物浸出脱硫期间,SO42-浓度呈上升趋势。煤炭研磨越充分,粒度越小,体系硫铁矿单体解离度越高,致使硫铁矿与氧化亚铁硫杆菌接触更充分进而加速了其生物氧化进程[35]。如图3,在生物浸出至360 h时,0.075~0.150 mm粒度组成的煤炭浸出脱硫体系SO42-浓度净增加值最高为1 665.04 mg·L−1,分别为粒度0.500~1.000 mm与0.280~0.400 mm的煤炭生物浸出脱硫体系SO42-浓度净增加值的2.27倍与1.30倍。而总铁浓度由式(5)~(7)可知其总铁的浓度变化与硫酸根的浓度变换应呈正比关系,因此呈现相似的变化趋势(图3(c)),即随粒度的减小其总铁的净溶出量也随之升高。此外,在部分反应时刻(240 h)煤炭生物浸出脱硫体系中的SO42-浓度呈现小幅下降趋势,这可能是由于液相中的SO42-与煤炭中的钙结合生成硫酸钙吸附于煤炭颗粒表面或进入煤炭孔道所致。
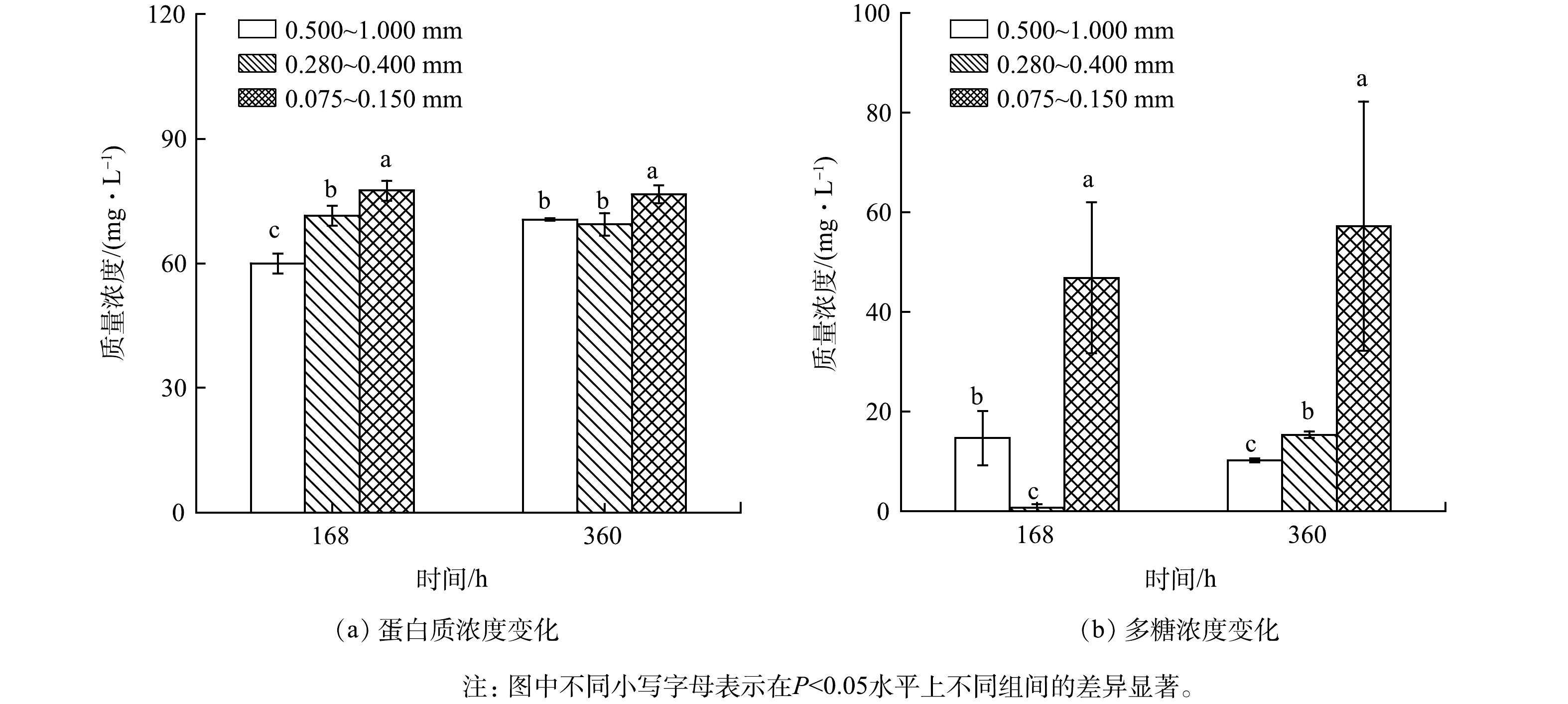
3)煤炭生物浸出脱硫体系EPS含量的变化。图4为不同粒度煤炭生物浸出脱硫体系微生物分泌EPS中蛋白质和多糖浓度的变化。由图4(a)可以得出,当各煤炭浸出体系反应至168 h,随着煤炭粒度变大,生物浸出体系EPS中蛋白质含量逐渐降低。当煤炭生物浸出脱硫体系反应至360 h,除粒度为0.500~1.000 mm的煤炭生物浸出脱硫体系外,其余2个处理体系在360 h时的多糖含量均高于168 h。粒度为0.500~1.000 mm的煤炭生物浸出脱硫体系多糖质量浓度由168 h 的14.68 mg·L−1降至360 h的10.22 mg·L−1,而0.280~0.400 mm与 0.075~0.150mm粒度的煤炭生物浸出脱硫体系分泌的多糖质量浓度分别由168 h的0.76 mg·L−1和46.84 mg·L−1上升至360 h的15.35 mg·L−1和57.24 mg·L−1。煤炭生物浸出过程中,微生物吸附于煤系硫铁矿表面,其通过分泌EPS会降低含硫煤炭的接触角,进而降低含硫煤炭的可浮性。事实上,笔者在开展后续相关研究中发现,粒度为0.075~0.150 mm的原始煤炭接触角为111.4°,生物浸出至360 h时,煤炭接触角降至60.2°。
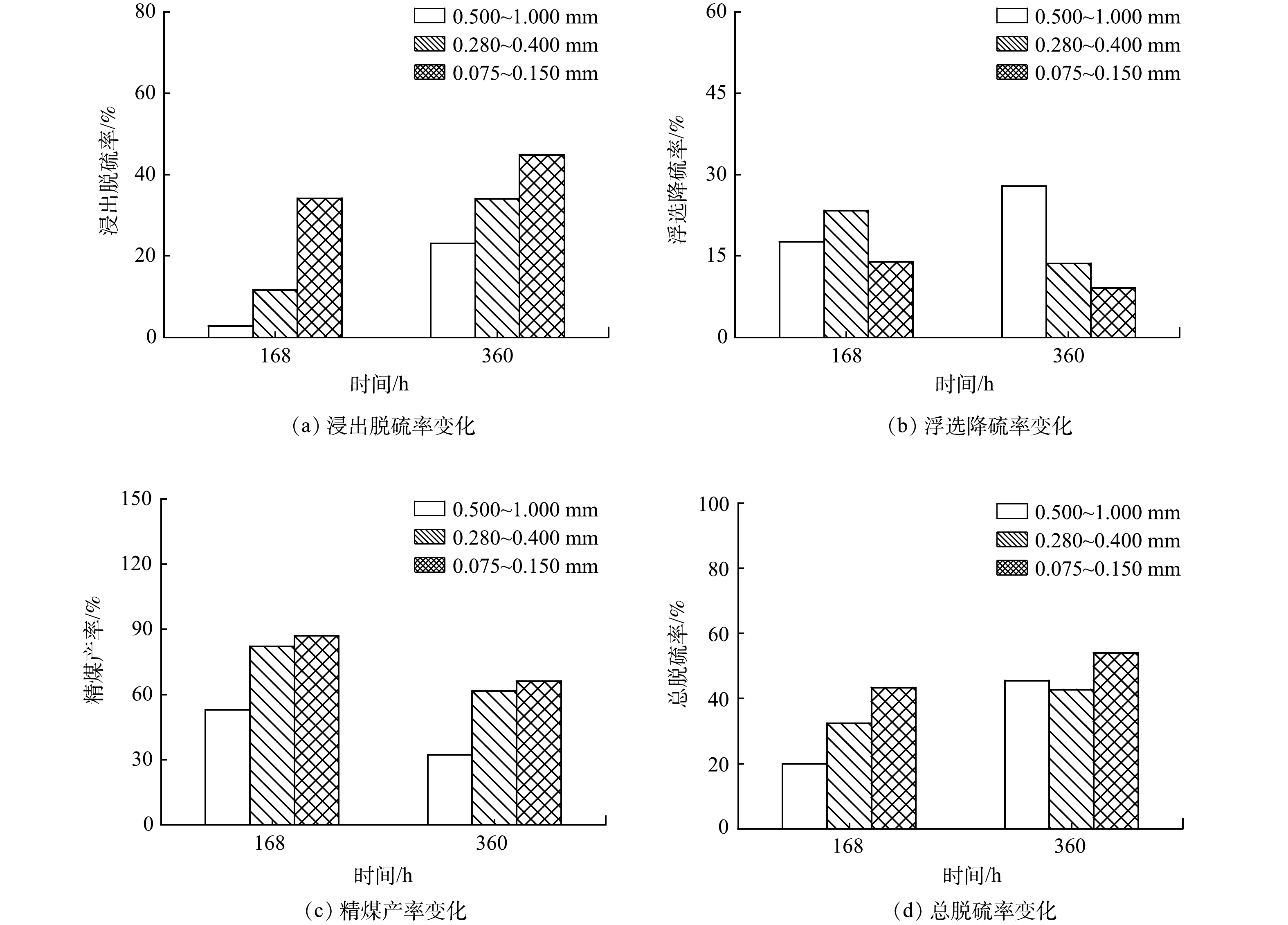
4)生物浸出脱硫时间对浮选脱硫的影响。由图2(c)与图3可以得知随着生物浸出时间的推移煤系硫铁矿以硫酸根与铁离子的形式进入液相,因而煤中的硫铁矿含量逐渐降低,各处理体系浸出脱硫率随浸出时间的增长而提高。由于粒度越小的煤炭其铁离子与硫酸根离子的溶出量越高,因而粒度为0.075~0.150 mm的煤炭浸出脱硫率相对最高,在第168 h与360 h分别达到34.3%与44.8%,而该体系微生物分泌蛋白质和多糖的含量也相对最高(图4)。这可能是由于煤炭粒度较小,促进了硫铁矿与氧化亚铁硫杆菌的接触,使得菌生长更加旺盛从而促进了EPS的分泌[36]。由图5(b)可以得出,粒度为0.500~1.000 mm的煤炭生物浸出后的浮选降硫率随生物浸出反应时间的增长而增加,而粒度为0.280~0.400 mm与0.075~0.150 mm的煤炭生物浸出后的浮选降硫率随着生物浸出反应时间的增长而有所降低,换言之,在粒度为0.075~1.000 mm时,生物浸出后煤炭的浮选降硫率并没有随着体系微生物分泌蛋白质或多糖含量的增加而有所升高。TANG 等研究证实煤系硫铁矿含量与生物浮选降硫效率呈正相关[19],本研究中粒度为0.280~0.400 mm和0.075~0.150 mm的煤炭生物浸出脱硫效率相对较高,残留在煤炭中的硫铁矿相对较少,可能是导致其后续浮选降硫率较低的原因之一。由图5(c)可知,各粒度煤炭在168 h的精煤产率均高于同粒度360 h的精煤产率。可见,煤炭粒度较小,浮选精煤产率较高,生物浸出时间较短时(168 h)的煤炭浮选精煤产率高于较长(360 h)时间的浮选精煤产率。笔者认为,随着反应时间的延长,煤炭的接触角逐渐降低,致使煤炭上浮进入精煤的含量下降,进而降低了浮选精煤的产率。由图5d可以得出,煤炭生物浸出耦合浮选工艺总脱硫率随着时间的延长逐渐上升,其中粒度为0.075~0.150 mm煤炭的总脱硫率最高,从168 h的43.2%提高至360 h的54.0%。
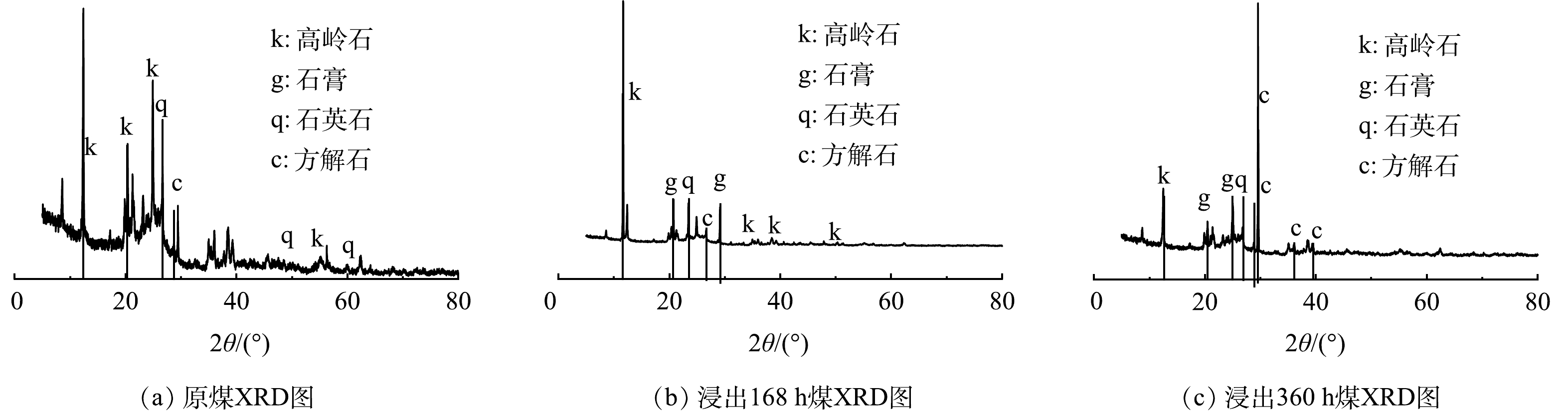
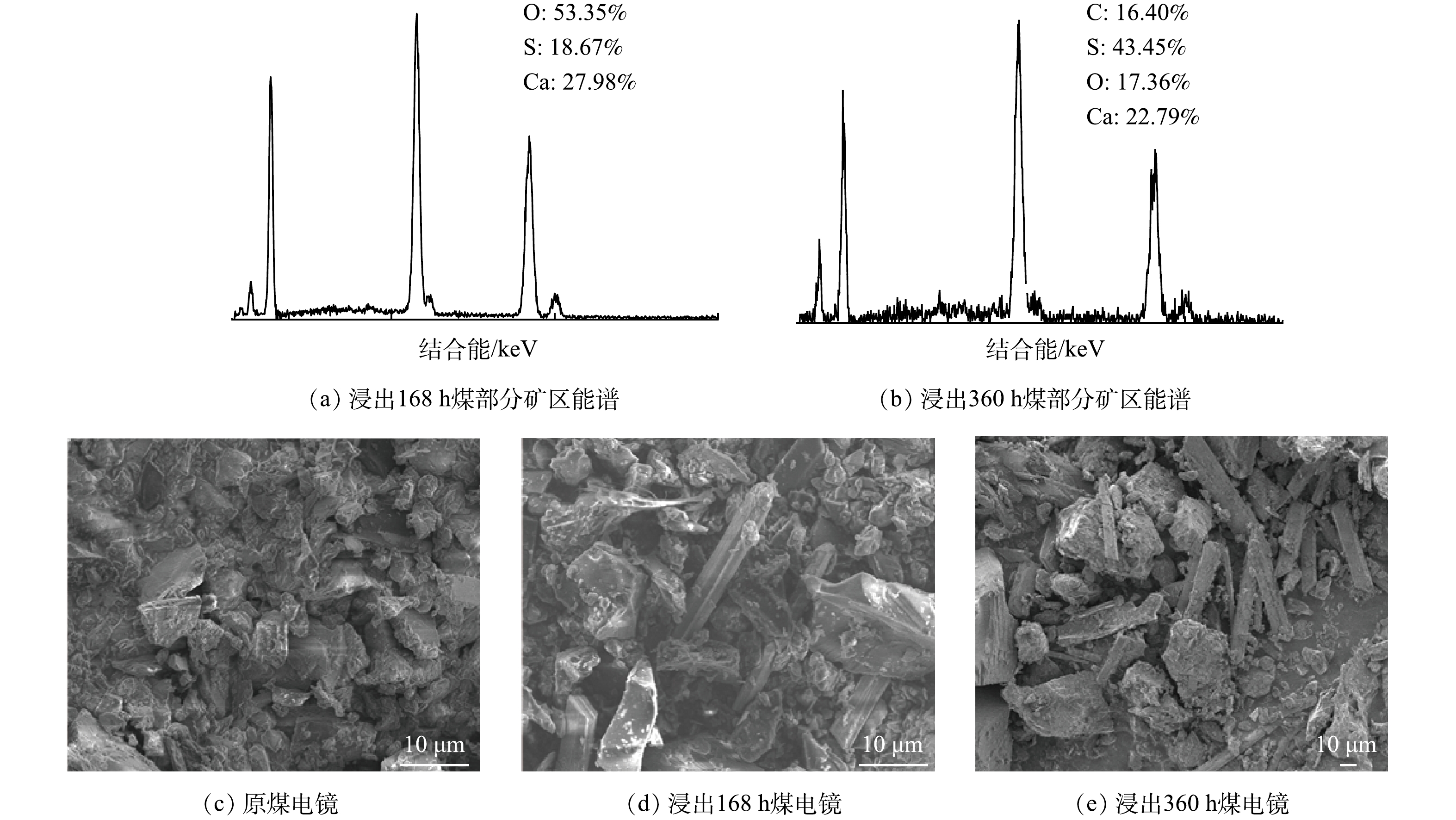
5)生物浸出脱硫煤矿相分析。图6为粒度为“0.075~0.150 mm”煤炭样品生物浸出前后的XRD表征图。在原煤与生物浸出脱硫煤中均有高岭石[Al2Si2O5(OH)4]、石英(SiO2)、方解石(CaCO3),在生物浸出第168 h与第360 h的煤炭样品中有CaSO4·2H2O产生,这可能证明图3中液相硫酸根浓度降低的原因。LIU等[23]研究发现,高硫煤炭生物浸出脱硫27 d后,煤炭表面有次生铁矿物黄铁矾生成。本研究中相关体系未观察到次生铁矿物黄铁矾的生成,这可能是由于煤炭生物浸出时间相对较短且培养基供给相对较少所导致。
对0.075~0.150 mm粒度的原始煤炭与生物浸出脱硫后的煤炭进行形貌分析,在浸出脱硫体系观测到CaSO4·2H2O矿物的存在(图7(b)~(c)),CaSO4·2H2O的杆状形貌与前人研究结果一致[37-38]。可见,煤炭生物浸出脱硫至168 h与360 h,生物脱硫煤炭表面确实均有CaSO4·2H2O的分布(图7(b)~(c))。在本研究中,粒度为0.075~0.150 mm的煤炭生物氧化进程最快。这一过程势必会促使煤炭中铁离子与硫酸根离子等更容易从固相中溶解进入液相,进而促进CaSO4·2H2O的生成。综上所述,高硫煤在生物浸出过程中硫酸根的变化至少呈现2个阶段:一个阶段是通过微生物生物氧化煤系硫铁矿促进SO42−从固相向液相释放的过程;另一个阶段则是随着体系的酸化,释放进入液相的SO42−与煤炭中钙结合生成CaSO4·2H2O吸附在煤炭颗粒表面或孔道中。换言之,煤炭生物浸出脱硫体系在某一时刻液相中SO42−变化规律应该是上述2个过程共同作用后的结果,当然这取决于煤炭中硫铁矿、碳酸钙等物质的含量。
-
1)煤炭粒度对其生物浸出与浮选耦合脱硫具有一定影响。煤炭生物浸出脱硫效率随煤炭粒度的减小而提高,煤炭生物浸出脱硫体系中有CaSO4·2H2O矿物产生。
2)利用氧化亚铁硫杆菌对粒度组成为0.075~0.150 mm的煤炭进行168~360 h的生物浸出脱硫时,煤炭脱硫率为34.3%~44.8%,耦合后续浮选工艺,煤炭总脱硫率可提高至43.2%~54.0%。相关参数可为改进煤炭生物脱硫工艺提供一定数据参考。
煤炭粒度对生物浸出-浮选联合工艺脱硫效果的影响
Effect of coal particle size on desulphurization effect of bioleaching-flotation combined process
-
摘要: 煤炭脱硫对减少大气污染及保护人体健康具有重要意义。本研究利用氧化亚铁硫杆菌对3种粒度分别为0.075~0.150、 0.280~0.400、 0.500~1.000 mm的煤炭进行生物浸出脱硫研究,并探究了生物浸出后煤炭的浮选脱硫效果。结果表明,煤炭生物浸出脱硫效率随煤炭粒度的减小而提高。其中,粒度为0.150~0.075 mm煤炭浸出脱硫效率最高,在第7天和第15天浸出脱硫率分别为34.3%和44.8%。在结合浮选工艺后,煤炭总脱硫率分别提高至43.2%和54.0%。粒度为0.075~0.150 mm与 0.280~0.400 mm煤炭的浮选降硫率随着前期浸出脱硫时间的增加而降低,而粒度为0.500~1.000 mm煤炭的浮选降硫率随着前期浸出脱硫时间的增加而提高。此外,浮选脱硫的精煤产率随着煤炭粒度的减小而提高。以上研究结果可为改进煤炭生物脱硫工艺提供数据参考。Abstract: The coal desulfurization is of great significance to reduce air pollution and protect human health. In this study. In this study, A. ferrooxidans was used to bioleach coals with the particle size distribution of 0.075~0.150, 0.280~400 and 0.500~1.000 mm, and the flotation desulfurization effect of coal after bioleaching was also explored. The results showed that the smaller the coal particle size, the higher the desulfurization efficiency of coal bioleaching, of which, the highest bioleaching desulfurization efficiency occurred for 0.075~0.150 mm coal, and the desulfurization efficiencies were 34.3% and 44.8% on day 7 and day 15, respectively. Combined with the flotation process, the total desulfurization efficiencies increased to 43.2% and 54.0%, respectively. The flotation desulfurization efficiency of coal with particle size distribution of 0.075~0.150 mm and 0.280~0.400 decreased with the increase of the pre-phase bioleaching desulfurization time, while the flotation desulfurization efficiency of coal with particle sizes distribution of 0.500~1.000 mm increased with the increase of the pre-phase bioleaching desulfurization time. In addition, the yield of clean coal for flotation desulfurization increased with the decrease of coal particle size. The research results can provide data support for improving the coal biological desulfurization process
-

-
-
[1] 攻坚克难回升向好夯基蓄能向新而行——解读《中华人民共和国2023年国民经济和社会发展统计公报》[J]. 记者观察. 2024, 7: 20-21. [2] 涂佩玥, 杨欢, 陈兰洲, 等. 中国重点城市大气污染与健康风险的时空分布特征[J]. 环境科学. 2023, 44(11): 5954-5963. [3] ARSLAN V. The application of combined lignite cleaning processes, bacterial leaching and flotation, for reducing higher ash and sulfur contents[J]. International Journal of Coal Preparation and Utilization, 2020, 42: 2114-2126. [4] MOHAJAN H. Acid Rain is a Local Environment Pollution but Global Concern[J]. Journal Of Analytical Chemistry, 2018, 3: 47-55. [5] 王纵横. 华能国际营口电厂脱硫项目进度计划与控制研究[D]. 长春: 吉林大学. 2013. [6] LIU F, QIAO X, ZHOU L, et al. Migration and Fate of Acid Mine Drainage Pollutants in Calcareous Soil[J]. International Journal of Environmental Research and Public Health, 2018, 15: 1759-1773. doi: 10.3390/ijerph15081759 [7] TAO X, XU N, XIE M, TANG L. Progress of the technique of coal microwave desulfurization[J], International Journal of Coal Science & Technology, 2014, 1: 113-128. [8] 唐跃刚, 贺鑫, 程爱国, 等. 中国煤中硫含量分布特征及其沉积控制[J]. 煤炭学报, 2015, 40: 1977-1988. [9] 张杰芳, 桑树勋, 王文峰. 贵州高硫煤的微生物浮选脱硫实验研究[J]. 科学技术与工程, 2015, 15: 16-23. doi: 10.3969/j.issn.1671-1815.2015.06.004 [10] 陈俊. 煤浮选脱硫降灰工艺的研究[D]. 合肥: 合肥工业大学. 2022. [11] 陈文辉, 刘佳, 袁宇东, 等. 采用摇床分级重选复杂高硫煤的试验研究[J]. 煤炭加工与综合利用, 2018, 3: 10-13. [12] 王建英, 宋晋阳, 吴旭, 等. 细粒煤超导磁选脱硫降灰的试验研究[J]. 中国煤炭, 2018, 44(6): 96-100. doi: 10.3969/j.issn.1006-530X.2018.06.021 [13] PRAYUENYONG P. Coal biodesulphurization processes[J]. Journal of Science Technology, 2002, 24(3): 493-507. [14] 刘松, 张明旭, 卢旭东. 高硫煤微波辅助脱除有机硫试验研究[J]. 煤炭技术, 2015, 34(5): 308-310. [15] XU J, LIU X, SONG C, et al. Biodesulfurization of high sulfur coal from Shanxi: Optimization of the desulfurization parameters of three kinds of bacteria[J]. Energy Sources Part A Recovery Utilization and Environmental Effects, 2019, 42: 1-19. [16] EHSANI M. Desulfurization of Tabas Coals Using Chemical Reagents[J]. Iranian Journal of Chemistry & Chemical Engineering, 2006, 25(2): 59-66. [17] VARGAS M, MORAN A, GOMEZ E, et al. Biodesulphurization of a coal by packed-column leaching. Simultaneous thermogravimetric and mass spectrometric analyses[J]. Fuel, 2006, 85(12-13): 1756-1762. doi: 10.1016/j.fuel.2006.02.014 [18] KOTELNIKOV V, CHYSYMA C. Microorganisms in Coal Desulfurization (Review)[J]. Applied Biochemistry and Microbiology, 2020, 56: 5. [19] TANG Y, XUE L, GOU M, et al. Study on influencing factors of coal microbial flotation desulfurization[J]. Fuel, 2024, 358: 130115. doi: 10.1016/j.fuel.2023.130115 [20] 刘金艳. 氧化亚铁硫杆菌优化培养及其煤炭生物脱硫的界面作用研究[D]. 徐州: 中国矿业大学. 2010. [21] CARDONA I, MARQUEZ M. Biodesulfurization of two Colombian coals with native microorganisms[J]. Fuel Processing Technology, 2009, 90: 1099-1106. doi: 10.1016/j.fuproc.2009.04.022 [22] 易欣, 张少航, 葛龙, 等. 好氧微生物抑制煤自燃机理研究现状及展望[J]. 洁净煤技术. 2023, 29: 198-205. [23] LIU F, LEI Y, SHI J, et al. Effect of microbial nutrients supply on coal bio-desulfurization[J]. Journal of Hazardous Materials, 2020, 384: 121324. doi: 10.1016/j.jhazmat.2019.121324 [24] LIU T, HOU J, PENG Y. Biodesulfurization from the high sulfur coal with a newly isolated native bacterium, Aspergillussp. DP06[J]. Environmental Progress & Sustainable Energy, 2017, 36: 595-599. [25] LIU H, GU G, XU Y. Surface properties of pyrite in the course of bioleaching by pure culture of Acidithiobacillus ferrooxidans and a mixed culture of Acidithiobacillus ferrooxidans and Acidithiobacillus thiooxidans[J]. Hydrometallurgy, 2011, 108: 143-148. doi: 10.1016/j.hydromet.2011.03.010 [26] BHATTACHARYYA D, HSIEH M, FRANCIS H, et al. Biological desulfurization of coal by mesophilic and thermophilic microorganisms[J]. Resources Conservation & Recycling, 1990, 3: 81-96. [27] 马蓉, 卢小海, 陈仕陆. 煤中各种形态硫的测定的注意事项[J]. 科技传播, 2014, 6: 87-88. [28] DONG B, JIA Y, ZHAO H, et al. Evidence of weak interaction between ferric iron and extracellular polymeric substances of Acidithiobacillus ferrooxidans[J]. Hydrometallurgy, 2022, 209: 105817. doi: 10.1016/j.hydromet.2022.105817 [29] YE M, LIANG J, LIAO X, et al. Bioleaching for detoxification of waste flotation tailings: Relationship between EPS substances and bioleaching behavior[J]. Journal of Environmental Management, 2021, 279: 111795. doi: 10.1016/j.jenvman.2020.111795 [30] HIMEL K, MELISSA C, JOSHUA R, et al. Complete genome sequence of Acidihalobacter prosperus strain F5, an extremely acidophilic, iron- and sulfur-oxidizing halophile with potential industrial applicability in saline water bioleaching of chalcopyrite - ScienceDirect[J]. Journal of Biotechnology, 2017, 262: 56-59. doi: 10.1016/j.jbiotec.2017.10.001 [31] BOXALL N, REA S, LI J, et al. Effect of high sulfate concentrations on chalcopyrite bioleaching and molecular characterisation of the bioleaching microbial community[J]. Hydrometallurgy, 2017, 168: S0304386X16304364. [32] LI X, LIU Y, ZENG G, et al. Direct current stimulation of Thiobacillus ferrooxidans bacterial metabolism in a bioelectrical reactor without cation-specific membrane[J]. Bioresource Technology, 2010, 101: 6035-6038. doi: 10.1016/j.biortech.2010.02.094 [33] 刘奋武, 高诗颖, 王敏, 等. 镁离子对氧化亚铁硫杆菌生物合成次生铁矿物的影响[J]. 中国环境科学, 2014, 34(3): 713-719. [34] YE J, ZHANG P, ZHANG G, et al. Biodesulfurization of high sulfur fat coal with indigenous and exotic microorganisms[J]. Journal of Cleaner Production, 2018, 197: 562-570. doi: 10.1016/j.jclepro.2018.06.223 [35] 俞宏军, 刘兆瑞, 于保强. 巴基斯坦某铜矿选矿工艺研究[J]. 中国矿山工程, 2023, 52(3): 74-79. [36] 虞艳云. 胞外聚合物在含铁矿物同微生物界面过程中的作用研究[J]. 合肥: 合肥工业大学. 2014. [37] LIU F, ZHOU J, ZHOU L, et al. Effect of neutralized solid waste generated in lime neutralization on the ferrous ion bio-oxidation process during acid mine drainage treatment[J]. Journal of Hazardous Materials, 2015, 299: 404-411. doi: 10.1016/j.jhazmat.2015.06.035 [38] PAN Z, LOU Y, YANG G, et al. Preparation of calcium sulfate dihydrate and calcium sulfate hemihydrate with controllable crystal morphology by using ethanol additive[J]. Ceramics International, 2013, 39: 5495-5502. doi: 10.1016/j.ceramint.2012.12.061 -



 下载:
下载: