-
随着社会经济的进步和工业化的加速,中国面临着日益严峻的水污染和水资源短缺问题。工业和生活废水排放量的增加,以及更加严格的排放标准,突显了水污染治理的复杂性。在碳中和目标的背景下,开发低碳的水处理工艺是未来的发展方向[1]。废水处理工艺包括化学处理法、物理处理法、生物处理法。化学和物理处理工艺存在能耗高,处理流程长、出水水质无法稳定达标等问题。传统的活性污泥法会消耗大量能源和电力,而且会产生包括二氧化碳(CO2)、甲烷(CH4)和氧化亚氮(N2O)在内的温室气体并进一步加剧温室效应[2]。在生物处理法中,微藻处理技术因其能够直接利用废水中的无机碳源和营养物质并合成微藻生物质,以实现废水的资源化利用而备受关注[3]。微藻具有同化废水中多种无机氮和有机氮的能力,在高浓度的氨氮(NH4+-N)环境下仍能显著生长,并且在NH4+-N浓度达到14 mmol·L−1时,其生物量可达到78.9 mg·(L·d)−1[4]。此外,微藻还能有效利用废水中的磷酸二氢盐(H2PO4−)和磷酸氢盐(HPO4−),通过磷酸化过程转化为有机化合物[5]。在处理废水过程中加入蓝藻(Arthrospira platensis)可达到总氮和总磷分别为81.51%和80.52%的去除率[6]。有研究表明,小球藻在处理废水的过程中可以积累淀粉,并且在相对较低的氮浓度下效果更好[7]。此外,有研究[8]表明标志链带藻在废水培养下,微藻生物质质量浓度达9.75 g·L−1,淀粉单位体积含量和产量分别达到4.75 g·L−1 和 230 mg·L−1。因此,微藻处理废水技术是一种经济可持续的方法,然而微藻处理废水的效率容易受温度和光照强度等环境因素影响,这些因素的不同组合在各类废水处理中对微藻处理能力有着直接影响。
同时,在水环境中的菌藻共生系统中发现了细胞之间的交流机制,细菌和真菌的信号分子是介导微藻和微生物之间的主要通讯方式[9]。细菌信号分子通过下调DNA复制过程中的关键酶,进一步调节了微藻的生物量,微藻还表现出了针对细菌信号分子调控的各种反馈特性[10]。此外,细菌信号分子有助于调节微藻的生长和代谢过程,同时可通过菌藻共生系统从废水处理厂回收氮和磷营养物[11]。因此,微藻不仅能有效进行废水处理,还能生产具有高附加值的生物质产品。金合欢醇(farnesol),作为一种主要的真菌信号分子[12],可以调节废水处理过程中的膜生物反应器(membrane bioreactor, MBR)内的生物膜形成,特别是通过调控AI-2型群体感应系统,减少膜生物污染[13]。在我们的前期研究中发现,金合欢醇可以促进集胞藻PCC6803的生长速率和光合作用。因此,通过金合欢醇调控微藻的代谢路径,有潜力可以调控其在废水处理过程中生物质的产量。
本研究采用响应面分析方法(RSM)以及运用Box-Behnken设计(BBD)策略,以集胞藻PCC6803构建微藻处理废水的系统,设置温度、光照强度和微藻添加量为影响因素,分析其对COD、NH4+-N、总磷、总氮去除率和微藻生长速率的影响,并通过优化确定最佳运行参数。随后,在最佳运行参数下,向集胞藻PCC6803处理废水的系统中添加金合欢醇信号分子,通过淀粉含量检测以及相应的分子机制来探究其对集胞藻PCC6803处理废水的调控作用,为微藻在环境治理和废水资源化领域提供了新策略。
-
实验所用生活污水取自北京昌平某污水处理厂进水。该水样经0.45 μm水系聚醚砜滤膜过滤。进水水质为 COD为 465 mg·L−1,NH4+-N为36.2 mg·L−1,pH=9.22,总氮和总磷的质量浓度分别为93 mg·L−1和 8.8 mg·L−1。实验中所使用的集胞藻PCC6803菌株来自中国科学院水生生物研究所淡水藻类培养库(FACHB-898)。集胞藻PCC6803在BG11培养基中培养,并放置于人工气候培养箱中。培养一定周期后,取集胞藻PCC6803菌液用于后续的实验,OD680为0.4。
-
本研究采用响应面法中 Box-Behnken 中心组合设计响应面实验,探讨温度、光照强度和微藻添加量3个环境因素对集胞藻PCC6803处理废水效能的影响,响应值为COD去除率、NH4+-N去除率、总磷去除率、总氮去除率及微藻的生长速率,以此建立3因素3水平的中心组合实验(表1)。
-
将生活污水通过0.45 μm的水系聚醚砜滤膜进行过滤,并调整其pH至7.0。随后,使用高压灭菌锅进行高温蒸汽灭菌处理,并将灭菌后的污水在20 ℃下保存以备后用。灭菌完成的生活污水随后被准确分装入500 mL的三角瓶中,每瓶装入200 mL。在超净工作台中,根据表2所示的微藻添加量,向每个三角瓶中加入相应的微藻培养液(OD680=0.4)。为确保实验结果的准确性,每组实验设立3个重复。
用乙醇作为溶剂,配制1 000 nmol·L−1的金合欢醇。在最佳工艺参数下,基于1.4微藻处理废水的实验方法,在实验组加入1 000 nmol·L−1的金合欢醇,对照组加入1 000 nmol·L−1的乙醇以排除实验组乙醇的干扰,每组实验设立3个重复。
-
在微藻处理周期结束后,从各实验组中取样进行水质测定。NH4+-N采用纳氏试剂分光光度法测定,在640 nm的波长下进行吸光度测量。COD通过重铬酸钾分光光度法来测定,在加热和酸性条件下用重铬酸钾氧化样品中的有机物质,并在600 nm测定溶液中剩余重铬酸钾的吸光度来计算COD值。总氮的浓度通过硫酸盐氧化法测定,使用过硫酸盐氧化样品中的所有氮形态至硝酸盐,在410 nm波长处使用紫外分光光度法测定硝酸盐浓度来计算总氮含量。总磷浓度的测定采用钼酸铵分光光度法,在酸性条件下总磷与钼酸铵反应生成的磷钼蓝复合物的吸光度,在700 nm波长处进行测量。
采用索莱宝总淀粉试剂盒(Solarbio Science & Technology Co. Ltd.)测试微藻中的淀粉积累量。试剂盒基于酶解法,能够有效分解样品中的总淀粉为葡萄糖,并通过葡萄糖在特定条件下与试剂反应产生的颜色变化,通过分光光度计进行定量分析,进而计算得到淀粉含量。
-
微藻生长速率的测定采用了可见分光光度法。为确保实验数据的准确性,实验前首先将微藻培养液进行充分摇匀,以保证样品之间的一致性。随后,利用BG11培养基作为实验的空白对照,对紫外分光光度计进行零点校准,确保仪器的准确性,并测定680 nm波长处的吸光度。
-
在1 000 nmol·L−1的金合欢醇作用于微藻处理废水系统的一定周期后,离心收集该处理组的藻细胞, 对照组则添加了相同浓度的乙醇。向其中加入 1 mL Trizol 裂解液, 液氮速冻 15 min 后80 ℃储存备用。每组的样品均选取3个平行样(共计 6 个样品)进行后续文库构建和 Illumina Novaseq 6000 双端测序(北京奥维森基因科技有限公司)。
转录组学数据分析:原始测序数据经过处理,去除适配器序列和过滤低质量读数,生成高质量的干净数据。清洁数据使用 Bowtie2 工具对 P. denitrificans PD1 222 基因组参考序列 进行比对。转录量根据|log2(FoldChange)|>0.2 和经过校正的 P<0.05 确定差异基因表达 。通过 Gene Ontology(GO)和 Kyoto Encyclopedia of Genes and Genomes(KEGG)分析富集的代谢途径,识别关键的代谢途径。
-
响应面数据分析:利用Design expert 13软件分析。首先设计Box-Behnken中心组合实验设计表,将每组实验的响应值输入,然后依次进行 Transform 分析、Tit Sumary分析、Model分析、ANOVA(方差分析)、 Diagnostics 分析、Model Graphs 分析,通过 ANOVA 分析可得到二次回归拟合方程与显著性,通过 Model Graphs分析可得到3D与平面响应面。
-
本实验采用Box-Behnken 响应面方法优化微藻处理废水的实验,分别在低(−1)、中(0)、高(1)3个水平上进行中心复合设计,3个变量在3个水平的响应值(COD去除率、NH4+-N去除率、TN去除率、TP去除率以及微藻生长速率)如表2所示。随后,使用 Design expert13软件对数据进行二次回归分析与方差分析(ANOVA)[14]。
通过方差分析对模型进行评估,并对模型系数进行显著性检验,方差分析结果表明示,COD去除率、NH4+-N去除率、总氮去除率、总磷去除率以及微藻生长速率均小于 0.05,因而模型显著,同时这些模型的R2值均接近 1,表明实验数据与数学模型拟合性较好,能够使用上述模型准确分析因素之间的交互作用。
根据表2的实验结果使用 Design-Expert软件进行方差分析,得到COD去除率(式(1))、NH4+-N去除率(式(2)),TP去除率(式(3)),TN去除率(式(4)),微藻的生长情况(式(5))的二次响应回归方程。
注:Y1为COD去除率;Y2为NH4+ -N去除率;Y3为TP去除率;Y4为TN去除率;Y5为微藻的生长速度。
-
不同处理组中的COD去除率、TP去除率以及微藻生长变化如所示。对所有响应值的模型拟合分析结果表明,在温度25.73 ℃、光照强度1 722.39 Lux及微藻添加量10%的条件下,集胞藻PCC6803处理污水的效能得到了最大提升,具体响应面数值为COD去除率达到59.57%,NH4+-N去除率高达87.01%,总磷与总氮去除率分别达到50.99%和55.79%,同时集胞藻PCC6803的OD680=0.448。
1)各因素交互作用对污水的COD去除率的响应面分析。各因素之间的交互作用对COD去除率影响的结果如图1所示。在响应面图分析中,曲面颜色深浅的变化用于指示响应值的大小,颜色越深意味着响应值的降低;曲面的陡峭度代表环境变量对响应值影响的显著性,曲面陡峭程度越高,其对响应值的影越大[15-16]。通过分析表2各因素对COD去除率发现,当温度偏离一定阈值后,光照强度对COD去除率的作用逐渐减弱。这一现象可能归因于温度对微藻活性和代谢能力的直接影响,进而影响到有机污染物的去除效率[17]。此外,当微藻添加量超过一定阈值后,光照强度的增加对COD的去除效果下降。这可能是由于过高的微藻密度导致光照无法有效穿透培养体系中的每个微藻细胞[18]。
2)各因素交互作用对污水的NH4+-N去除率的响应面分析。有研究[19]表明,微藻能异养同化有机碳并通过光合作用代谢营养成分,同时有效提高NH4+-N去除效率。本研究优化了3个因素对废水中NH4+-N去除率的影响,根据NH4+-N去除率的质量分数回归方程绘制图2。由表2分析发现,温度20 ℃、光照强度2 000 Lux和微藻添加量20%的最佳环境条件下,NH4+-N去除率可达98.8%。在温度和微藻添加量不变的条件下,提高光照强度能显著升高NH4+-N去除率,这可能是因为光照对微藻光合作用能力的增强,进而提升NH4+-N的吸收和转化效率[20]。此外,在较低温度条件下,微藻处理废水系统中的NH4+-N去除效率得到显著提升,这可能是因为低温下微藻代谢速率降低[21],造成微藻将更多能量用于NH4+-N的吸收和转化。
3)各因素交互作用对污水的总磷去除率的响应面分析。通过研究各因素交互作用对集胞藻PCC6803的总磷去除率的影响发现,如图3所示,3个因素两两之间交互作用显著。由表2分析发现,在温度20 ℃、光照强度1 500 Lux和微藻添加量10%的特定条件组合下,总磷去除率可达52.11%。但在本实验中总磷去除率在不同的实验条件下变化不大,这可能是因为总磷的去除不只依赖于生物吸收,还可能受到其他物理化学过程的影响,如沉降和吸附等[22]。
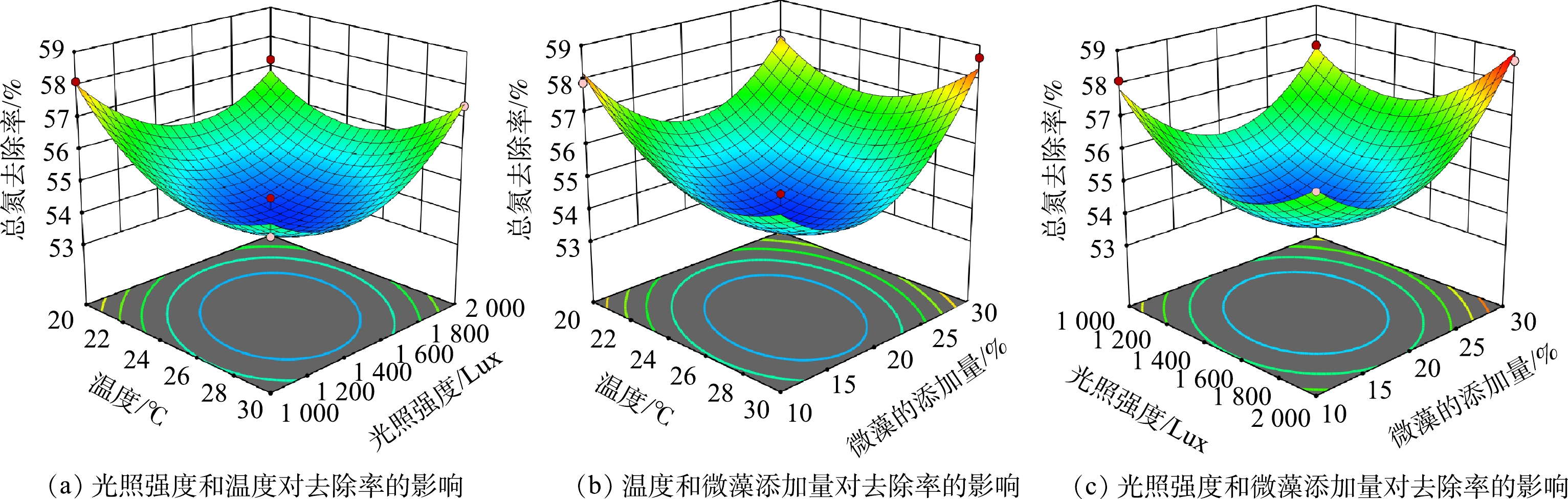
4)各因素交互作用对污水的总氮去除率的响应面分析。通过表2的实验数据分析,在温度25 ℃、光照强度2 000 Lux以及微藻添加量30%的条件组合下,总氮去除率可达58.69%的最高值。通过对因素间交互作用的分析,在图4中发现温度、光照强度以及微藻添加量之间的交互作用都较为显著。由图4可知,在温度不变下,增加光照强度能够提高微藻的光合作用,并提高其对总氮的吸收和转化。此外,温度过高,会影响微藻处理废水中总氮的效率。有研究[23]表明,过高的总氮水平可能对微藻造成不利影响,如藻类褪色、生长抑制或毒性反应,进而影响污水处理效果。
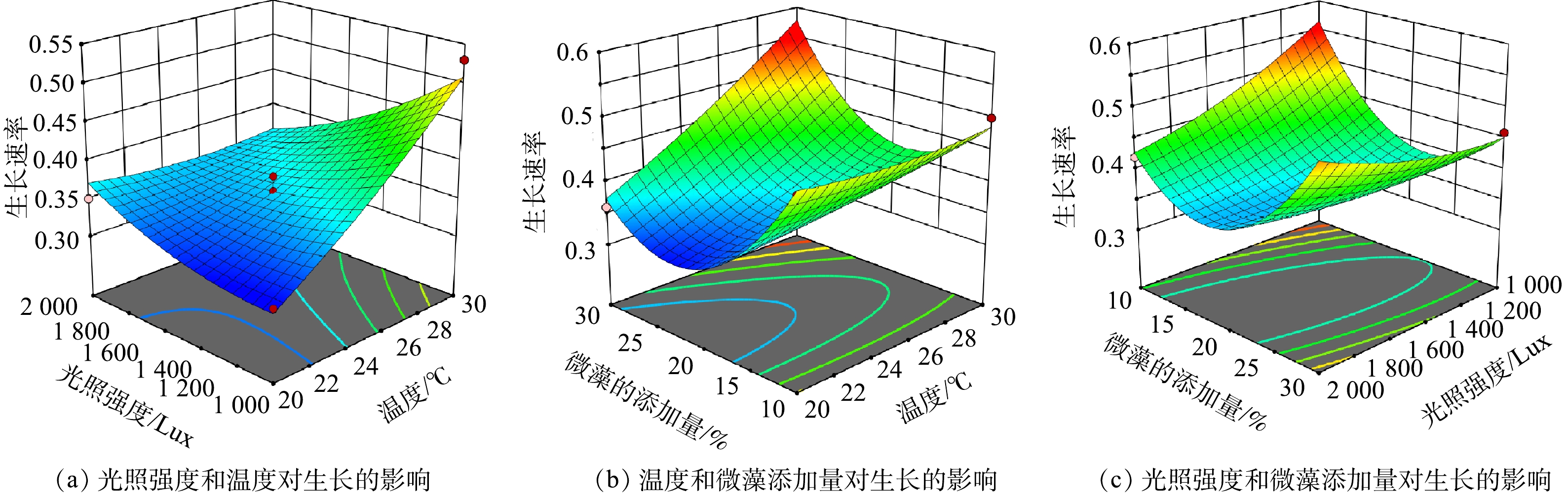
5)各因素交互作用对微藻生长速率的响应面分析。各因素交互作用对集胞藻PCC6803的生长速率的影响见图5。从图5中可以看出,在光照强度保持不变时,随着温度的升高,微藻生长速率升高,但超过25 ℃后微藻的生长速率会受到抑制。温度对微藻的生长和代谢活动有着显著的影响,直接影响到微藻的碳固定能力[24]。在合适的温度区间内,微藻的增长速度会随温度升高而提高[25]。然而,过高的温度可能会加速微藻的生理代谢过程[26]。在温度保持不变时,光照强度越高,微藻的生长速率越低。有研究表明,光照是影响微藻生长和微藻处理污水的关键因素[27]。通过调控光照强度,不仅可以优化光合作用的效率,还能确保光能的有效利用,从而促进微藻生物量的增加。
为了检验模型预测的准确性,用确定的最优工艺参数进行3次重复实验。工艺参数优化条件为:在温度25.73 ℃、光照强度1 722.84 Lux及微藻添加量10%的条件下。选择与最优参数最接近的整数值进行实验:温度设定为26 ℃,光照强度设定为1 723 Lux,微藻添加量保持为10%。结果取3 次平行实验平均值,得到COD去除率达到60.09%,NH4+-N去除率高达88.01%,总磷去除率与总氮去除率分别为51.12%和54.94%,同时集胞藻PCC6803的生长速率OD680为0.453。该结果与模型预测值接近,证明使用响应面法优化参数的可靠性。
-
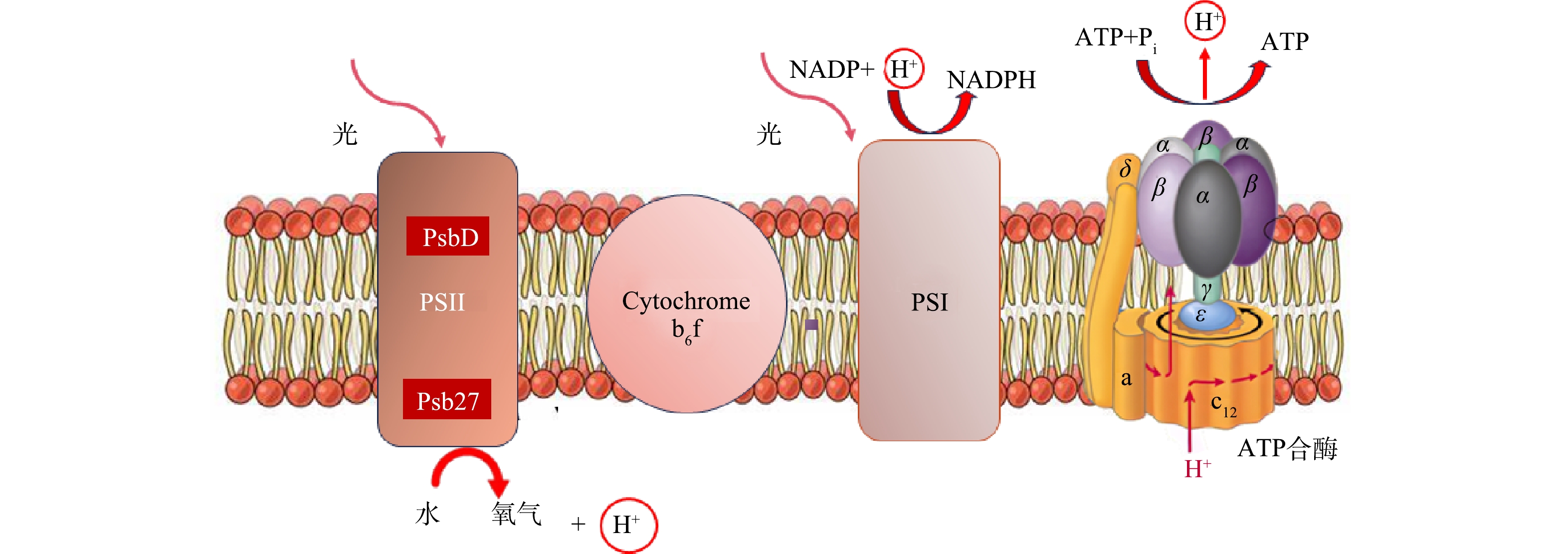
集胞藻通过光物理、光化学和生物化学反应过程能将光能转化为有机化合物中的化学能。在集胞藻类囊体膜上有2个光系统负责捕获和转化光能,分别为光系统Ⅱ (photosystem Ⅱ,PSⅡ)和光系统Ⅰ(photosystem Ⅰ,PSⅠ)。这2个光系统通过反应中心的电荷分离实现能量的转换,并在电子传递的过程中产生跨膜质子浓度梯度和还原力NADPH。PSⅡ中的放氧复合物(oxygen evolving complex,OEC)将水分子裂解并释放出氧气和质子,从水分子中抽提出的电子经由PSⅡ、质体醌库(plastoquinone pool,PQ pool)、细胞色素b6f、质体蓝素(plastocyanin,PC),并最终由PSI传递给铁氧化还原蛋白(ferredoxin,Fd)。在铁氧还原蛋白-NADPH氧化还原酶(ferredoxin-NADPH oxidoreductase,FNR)的作用下,NADP+被还原为NADPH。在光合作用电子传递过程中,质子在类囊体腔侧累积,形成跨膜质子浓度梯度,驱动ATP合成酶合成ATP。光反应过程中所产生的NADPH和ATP为暗反应过程提供还原力和能源,将二氧化碳固定并转化为可利用的生物质[28-29]。本研究中,在金合欢醇的作用下,发现光系统II中PsbD和Psb27这2个基因上调(图6)。这表明金合欢醇可能通过影响光合作用中的关键蛋白质的表达来调节微藻的生长和代谢,从而增强光合作用效率和碳固定能力,促进微藻生长并进一步调控化合物的合成能力。研究表明,信号分子会对微藻的生长和代谢产生显著影响,微藻能够通过调节光合作用的核心组分如PSII和PSI,来影响光合效率和碳固定能力,进而调控微藻生长和代谢[30-31]。
-
微藻在处理废水时不仅能消减水体污染物,而且有能力将废水中溶解的营养物转化为有价值的生物质。淀粉作为微藻体内主要的能量储存形式,其积累量能直接反映微藻对废水资源化的利用效率。考虑到外源信号分子对微藻生理功能的潜在调控作用,本研究分析了添加外源信号分子金合欢醇对微藻淀粉积累的影响。对照组中集胞藻PCC6803淀粉含量为7.66 mg·g−1,而在金合欢醇处理组中,淀粉含量显著增加至8.524 mg·g−1。这一结果表明,金合欢醇能够促进集胞藻PCC6803中的淀粉积累。微藻淀粉的合成受到多种酶的共同作用,外源信号分子的添加使集胞藻PCC6803淀粉含量增加,可能与多种酶的表达变化有关[32]。
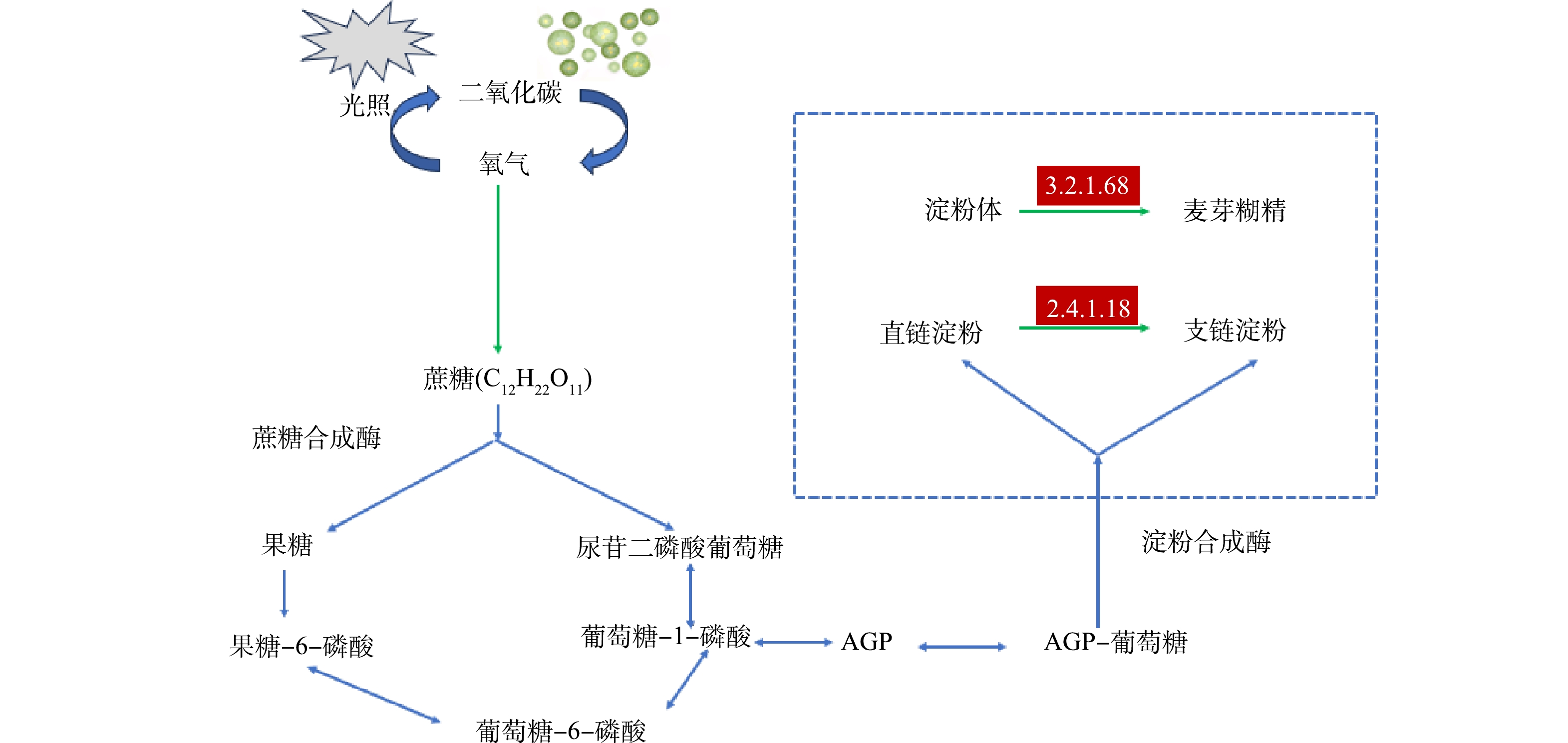
通过分析淀粉合成的代谢通路(图7)发现,在金合欢醇的调控作用下,基因3.2.1.68和2.4.1.18的表达上调,促进了直链淀粉(Amylose)向支链淀粉(Amylopectin)以及淀粉体到麦芽糊精的转化过程。有研究发现莱茵衣藻中的关键酶(AGPase)失活导致淀粉合成受阻,同时脂类的含量增加10倍[33]。基因2.4.1.18为14-α-葡聚糖支链酶,其上调意味着更多的直链淀粉分子被转化为支链淀粉或糖原,增加了淀粉分子之间的交联和支链结构,从而提高了淀粉的稳定性和积累量。与支链淀粉相比,直链淀粉的降解速度更快[34]。因此,将直链淀粉转化为支链淀粉,可能在一定程度上提高淀粉的总积累量。基因3.2.1.68是糖原操纵子蛋白GlgX同源物,该基因的上调增加了淀粉到麦芽糊精的转化过程,使得更多的淀粉分子被分解成较小的、更易于积累的分子,从而增加了可积累的淀粉总量。这两个基因的上调增加了ADP-葡萄糖到淀粉总积累量合成之间的中间产物,这些中间产物有可能会直接影响到淀粉合成的酶活性。淀粉合成中的酶主要有GBA、SBE、GBE。GBA主要作用于直链淀粉分子的合成,SBE主要作用于支链淀粉的形成,GBE作为合成高支化淀粉的关键酶,能够特异性催化淀粉α-1.4糖苷键连接的直链分子形成新的分支,从而增加淀粉中α-1.6糖苷键含量[35]。这两个基因的上调,可能促进了淀粉合成途径中的关键酶活性增强,进而增加了直链(Amylose)和支链(Amylopectin)淀粉的合成,提高了淀粉的总积累量。当前关于信号分子在调控淀粉合成方面的研究相对较少。但已有研究揭示了信号分子对微生物淀粉代谢过程的显著影响。TRAMICE [36]研究发现信号分子抑制剂(trans-cinnamaldehyde)能够降低微生物淀粉酶的活性,而外源性信号分子(C4-HSL)的添加则能增强微生物淀粉酶的活性,从而直接影响淀粉的积累。同样,ZHANG [37]的研究也的得出了同样的结论,信号分子通过调节α-淀粉酶活性,对微生物淀粉的代谢过程产生显著影响,进而影响淀粉的积累量。
-
1)集胞藻PCC6803处理生活废水的最优处理工艺参数为:温度为25.73 ℃、光照强度为1 722.39 Lux、微藻添加量为10%。在此条件下,COD去除率达到59.57%,NH4+-N去除率达到87.01%,总磷去除率和总氮去除率分别为50.99%和55.79%,同时集胞藻PCC6803仍能维持较高的生长。
2)在最优处理工艺参数下,向微藻处理废水体系中加入金合欢醇,发现集胞藻PCC6803光系统II中的关键基因上调,金合欢醇显著提高了集胞藻PCC6803的光合作用效率和碳固定能力。
3)经金合欢醇调控的集胞藻PCC6803淀粉产量显著提高,这表明该信号分子能够增强集胞藻PCC6803生物质转换潜力。代谢通路分析结果表明,金合欢醇通过调控集胞藻PCC6803的基因2.4.1.18和基因3.2.1.68,影响ADP-葡萄糖到淀粉合成之间的14-α-葡聚糖支链酶和糖原操纵子蛋白GlgX同源物,这些中间产物有可能会影响到淀粉合成酶活性,从而增加淀粉的积累量。
工艺参数及外源信号分子对集胞藻处理废水的调控作用
Regulation of wastewater treatment by synechococcus under the influence of process parameters and exogenous signals
-
摘要: 污水资源化高效回收利用是实现碳中和的关键一环。采用微藻处理废水不仅可以促进水体中污染物的降解,还能将废水内的有机物转换为生物质原料,进一步推动碳中和进程。此外,外加细菌类信号物质对微藻的生长和代谢产生了显著影响,但目前还缺乏外源信号物质调控微藻合成高附加值产物的研究。为了研究微藻在废水污染物消减方面的潜力及外源微生物信号分子对其处理效率的调控作用,本研究通过响应面法(RSM)优化集胞藻PCC6803处理污水的关键条件,包括温度、光照强度和微藻添加量。结果表明:在最佳工艺参数(温度为25.73 ℃、光照为1 722.39 Lux、集胞藻PCC6803添加量为10%)条件下,COD去除率可达59.57%,氨氮、总磷和总氮去除率分别高达87.01%、50.99%和55.79%,集胞藻PCC6803仍能维持较高的生长率(OD680=0.448)。进一步通过添加1 000 nmol·L−1金合欢醇作为外源信号分子,研究其对废水资源化的调控作用,发现金合欢醇的添加进一步促进了集胞藻的淀粉积累。通过转录组测序,揭示了金合欢醇通过调节集胞藻淀粉代谢途径(上调基因2.4.1.18和基因3.2.1.68),影响ADP-葡萄糖到淀粉合成之间的14-α-葡聚糖支链酶和糖原操纵子蛋白GlgX同源物进而影响淀粉的合成。本研究优化了微藻处理生活废水的工艺参数,建立了利用外源微生物信号分子调控微藻的碳代谢并有效促进废水污染物向高附加值产物(淀粉)的转化过程,为微藻在环境治理和可再生能源开发领域的应用提供了新策略。Abstract: Efficient recycling and utilization of wastewater resources are key components in achieving carbon neutrality. The use of microalgae for wastewater treatment not only promotes the degradation of pollutants in wastewater but also converts organic matter in wastewater into biomass raw materials, further push the process of carbon neutrality. In addition, exogenously added bacterial signaling substances have shown significant effects on the growth and metabolic production of microalgae, yet there is a lack of research on the regulation of high-value product synthesis in microalgae by exogenous signaling substances. To investigate the potential of microalgae in the reduction of wastewater pollutants and the regulatory effects of exogenous microbial signaling molecules on its treatment efficiency, this study optimized the key conditions for wastewater treatment by Synechocystis sp. PCC 6 803 using Response Surface Methodology (RSM), including temperature, light intensity, and the addition of microalgae. The results showed that under optimal process parameters (temperature of 25.73°C, light intensity of 1 722.39 Lux, and Synechocystis sp. PCC 6 803 addition of 10%), the removal rates of COD (Chemical Oxygen Demand), ammonia nitrogen, total phosphorus, and total nitrogen could reach 59.57%, 87.01%, 50.99%, and 55.79%, respectively, and Synechocystis sp. PCC 6 803 still maintained high growth (OD680=0.448). Further, the regulatory role on wastewater resource recovery was studied by adding exogenous signaling molecules (1 000 nmol·L−1 of homoserine lactone), and it was found that the addition of homoserine lactone further promoted starch accumulation in Synechocystis sp. PCC 6 803. Through transcriptome sequencing, it was revealed that homoserine lactone regulates the starch metabolism pathway of Synechocystis sp. PCC 6 803 (upregulating genes 2.4.1.18 and 3.2.1.68), affecting the synthesis of starch from ADP-glucose by influencing the 14-α-glucan branching enzyme and the glycogen operator protein GlgX homolog. This study optimized the process parameters for microalgae treatment of domestic wastewater and established the use of exogenous microbial signaling molecules to regulate microalgal carbon metabolism and effectively promote the conversion of wastewater pollutants to high-value products (starch), providing new strategies for the application of microalgae in environmental governance and renewable energy development.
-
Key words:
- response surface methodology /
- wastewater treatment /
- signaling molecule /
- farnesol
-

-
表 1 Box-Behnken设计实验表
Table 1. Table of Box-Behnken design experiment
水平 因素 (A)温度/ ℃ (B)光照强度/Lux (C)接种量/% −1 20 1 000 10 0 25 1 500 20 1 30 2 000 30 表 2 响应面实验结果
Table 2. Experiment results of response surface
运行 A B C COD去除率/% NH4+-N去除率/% 总磷去除率/% 总氮去除率/% 生长速度(OD680) 1 30 2 000 20 58.6 85.07 50.22 57.37 0.36 2 20 1 500 30 55.72 86.02 50.22 57.67 0.36 3 25 1 000 30 61.71 60.88 49.08 57.68 0.46 4 30 1 000 20 51.5 52.27 50.23 55.55 0.53 5 30 1 500 10 47.5 74.1 50.2 56.19 0.5 6 20 1 500 10 51.5 90.15 52.11 57.89 0.52 7 20 1 000 20 54.61 70.91 51.56 58.1 0.31 8 25 2 000 30 58.16 92.74 49.87 58.69 0.55 9 25 2 000 10 62.58 93.76 50.29 56.81 0.42 10 30 1 500 30 57.27 73.7 49.65 58.64 0.55 11 25 1 000 10 48.17 65.84 51.37 58.1 0.53 12 25 1 500 20 65.71 80.1 51.75 54.5 0.38 13 25 1 500 20 64.3 79.6 51.75 53.89 0.34 14 25 1 500 20 65.26 79.76 51.56 53.98 0.36 15 20 2 000 20 56.83 98.8 50.42 57.25 0.35 -
[1] HABIB R Z, THIEMANN T, AL KENDI R J J O W R, et al. Microplastics and wastewater treatment plants—a review[J]. Journal of Water Resource and Protection, 2020, 12(1): 1-35. doi: 10.4236/jwarp.2020.121001 [2] MARINELLI E, RADINI S, FOGLIA A, et al. Validation of an evidence-based methodology to support regional carbon footprint assessment and decarbonisation of wastewater treatment service in Italy [J]. Water Research, 2021, 207: 117 831. [3] WOLLMANN F, DIETZE S, ACKERMANN J U, et al. Microalgae wastewater treatment: Biological and Technological approaches[J]. Engineering in Life Sciences, 2019, 19(12): 860-871. doi: 10.1002/elsc.201900071 [4] LIN Y, SONG G, LING H, et al. Isolation of a high-ammonium-tolerant Monoraphidium sp. and evaluation of its potential for biodiesel production[J]. Process Biochemistry, 2021, 111: 297-304. doi: 10.1016/j.procbio.2021.11.010 [5] 王美琦, 平文祥, 葛菁萍, 等. 微藻在废水处理和生物质回收再利用方面的研究进展 [J]. 微生物学报, 2022, 62(12): 4 756-4 768. [6] ZHAI J, LI X, LI W, et al. Optimization of biomass production and nutrients removal by Spirulina platensis from municipal wastewater[J]. Ecological Engineering, 2017, 108: 83-92. doi: 10.1016/j.ecoleng.2017.07.023 [7] NOGUCHI M, AIZAWA R, NAKAZAWA D, et al. Application of real treated wastewater to starch production by microalgae: Potential effect of nutrients and microbial contamination [J]. Biochemical Engineering Journal, 2021, 169: 107 973. [8] 周芷薇, 沈丹丹, 高保燕, 等. 一株高产淀粉绿藻——标志链带藻在废水中的培养及对氮磷的去除[J]. 植物科学学报, 2016, 34(3): 446-459. doi: 10.11913/PSJ.2095-0837.2016.30446 [9] ZHANG B, LI W, GUO Y, et al. Microalgal-bacterial consortia: From interspecies interactions to biotechnological applications [J]. Renewable and Sustainable Energy Reviews, 2020, 118: 109 563. [10] ZHANG C, LI Q, LIANG F, et al. Quorum sensing molecules in activated sludge could trigger microalgae lipid synthesis[J]. Bioresource Technology, 2018, 263: 576-582. doi: 10.1016/j.biortech.2018.05.045 [11] TANG C C, YU T, HE Z W, et al. Performance and mechanism of a novel algal-bacterial symbiosis system based on sequencing batch suspended biofilm reactor treating domestic wastewater[J]. Bioresource Technology, 2018, 265: 422-431. doi: 10.1016/j.biortech.2018.06.033 [12] ALBUQUERQUE P, CASADEVALL A J M M. Quorum sensing in fungi–a review[J]. Medical Mycology, 2012, 50(4): 337-345. doi: 10.3109/13693786.2011.652201 [13] LEE K, LEE S, LEE S H, et al. Fungal quorum quenching: a paradigm shift for energy savings in membrane bioreactor (MBR) for wastewater treatment [J]. Environmental science & technology, 2016, 50(20): 10 914-10 922. [14] JIANG Y, WANG H, ZHAO C, et al. Establishment of stable microalgal-bacterial consortium in liquiddigestate for nutrient removal and biomass accumulation[J]. Bioresource Technology, 2018, 268: 300-307. doi: 10.1016/j.biortech.2018.07.142 [15] SHEN N, WANG Q, QIN Y, et al. Optimization of succinic acid production from cane molasses by Actinobacillus succinogenes GXAS137 using response surface methodology (RSM) [J]. Food Science and Biotechnology, 2014, 23: 1 911-1 919. [16] 张圆圆, 孟永斌, 张琳, 等. 响应面法优化微波辅助水蒸气蒸馏法提取油樟精油工艺[J]. 化工进展, 2020, 39(S2): 291. [17] 薛银浩, 刘卓苗, 王昊, 等. 海洋酸化对微藻关键生理过程的调控机制及环境因素的影响 [J]. 应用生态学报, 2020, 31 (11): 3 969-3 978. [18] 许波, 王长海. 微藻的平板式光生物反应器高密度培养[J]. 食品与发酵工业, 2003, 29(1): 36-40. doi: 10.3321/j.issn:0253-990X.2003.01.009 [19] 商洪国, 吴楠, 韩飞, 等. 微藻对海水养殖循环水高效碳氮磷一体化去除的研究[J]. 环境科学学报, 2021, 41(9): 3 408-3 417. [20] 张瀚艺, 张玉蕾, 李长玲, 等. 环境因子对波吉卵囊藻-沼泽红假单胞菌藻菌体系氨氮吸收的影响[J]. 广东海洋大学学报, 2021, 41(6): 1-8. doi: 10.3969/j.issn.1673-9159.2021.06.001 [21] 谭啸, 孙玉童, 段志鹏, 等. 不同超声强度下微囊藻群体沉降及其上浮过程对光照和温度的响应[J]. 湖泊科学, 2017, 29(5): 1 168-1 176. [22] 王立立, 张娜, 胡勇有. 生活污水化学强化混凝除磷试验研究[J]. 工业水处理, 2006, 26(3): 26-30. doi: 10.3969/j.issn.1005-829X.2006.03.008 [23] CAI T, PARK S Y, LI Y J R, et al. Nutrient recovery from wastewater streams by microalgae: status and prospects[J]. Renewable and Sustainable Energy Reviews, 2013, 19: 360-369. doi: 10.1016/j.rser.2012.11.030 [24] 刘加慧, 杨洪帅, 王辉. 温度、盐度和 pH 对小球藻生长率的联合效应[J]. 水生生物学报, 2014, 38(3): 446-453. doi: 10.7541/2014.63 [25] 晁建颖, 颜润润, 张毅敏. 不同温度下铜绿微囊藻和斜生栅藻的最佳生长率及竞争作用[J]. 生态与农村环境学报, 2011, 27(2): 53-57. doi: 10.3969/j.issn.1673-4831.2011.02.010 [26] 王卓, 李晓莉, 陶玲, 等. 温度和初始密度比对 2 种微藻生长竞争的影响研究[J]. 西北植物学报, 2019, 39(9): 1670-1 677. [27] LEE K, LEE C-G J B, ENGINEERING B. Effect of light/dark cycles on wastewater treatments by microalgae[J]. Biotechnology and Bioprocess Engineering, 2001, 6: 194-199. doi: 10.1007/BF02932550 [28] WATANABE M, IWAI M, NARIKAWA R, et al. Is the photosystem II complex a monomer or a dimer? [J]. Plant and cell physiology, 2009, 50(9): 1 674-1 680. [29] ROCHAIX J-D J A R O P B. Regulation and dynamics of the light-harvesting system[J]. Annual Review of Plant Biology, 2014, 65: 287-309. doi: 10.1146/annurev-arplant-050213-040226 [30] DOW L, STOCK F, PELTEKIS A, et al. The multifaceted inhibitory effects of an alkylquinolone on the diatom Phaeodactylum tricornutum [J]. ChemBioChem, 2020, 21(8): 1 206-1 216. [31] STOCK F, BILCKE G, DE DECKER S, et al. Distinctive growth and transcriptional changes of the diatom Seminavis robusta in response to quorum sensing related compounds [J]. Frontiers in Microbiology, 2020, 11: 511 653. [32] RAN W, WANG H, LIU Y, et al. Storage of starch and lipids in microalgae: Biosynthesis and manipulation by nutrients [J]. Bioresource technology, 2019, 291: 121 894. [33] LI Y, HAN D, HU G, et al. Chlamydomonas starchless mutant defective in ADP-glucose pyrophosphorylase hyper- accumulates triacylglycerol[J]. Metabolic Engineering, 2010, 12(4): 387-391. doi: 10.1016/j.ymben.2010.02.002 [34] MAGEIN H, LEURQUIN D. Changes in amylose, amylopectin and total starch content in jonagold apple fruit during growth and maturation[C]. XXV International Horticultural Congress, Part 7: Quality of Horticultural Products 517, 1998: 487-494. [35] HAN H, YANG C, ZHU J, et al. Competition between granule bound starch synthase and starch branching enzyme in starch biosynthesis[J]. Rice, 2019, 12: 1-9. [36] TRAMICE A, CUTIGNANO A, IODICE A, et al. Involvement of a quorum sensing signal molecule in the extracellular amylase activity of the thermophilic anoxybacillus amylolyticus[J]. Microorganisms, 2021, 9(4): 819. doi: 10.3390/microorganisms9040819 [37] ZHANG Z, WANG L, JI Y, et al. Understanding the N-acylated homoserine lactones (AHLs)-based quorum sensing for the stability of aerobic granular sludge in the aspect of substrate hydrolysis enhancement[J]. Science of the Total Environment, 2023, 858: 159581. doi: 10.1016/j.scitotenv.2022.159581 -




 下载:
下载: