-
抗生素在医疗、农业以及水产养殖等领域发挥至关重要的作用。然而,近年来抗生素的过度使用和滥用导致大量抗生素残留排入水体,促进抗性细菌(antibiotic resistance bacteria, ARB)和抗性基因(antibiotic resistance genes, ARGs)的传播和扩散[1-2],目前已在我国污水处理厂、医院污水中普遍检出[3-4]。水中的ARB可能导致人类感染抗生素耐药疾病,传统的抗生素无法有效对其治疗[5]。ARGs可通过整合子等可移动遗传元件在细菌群落内进行水平基因转移,进一步加剧新型ARB的产生[6-7]。抗生素耐药性问题已被世界卫生组织列为21世纪人类健康面临的重要挑战之一,抗生素耐药性去除已迫在眉睫[8]。
传统的水消毒技术,如氯消毒、紫外消毒和臭氧消毒等,虽然能够有效灭活水环境中的ARB,但对ARGs的去除效果有限,甚至存在消毒后会出现ARGs被富集的现象[9–11]。因此,开发新型消毒方式去除ARB和ARGs并协同去除水中的抗生素具有重要意义。电化学消毒技术因其操作简单、环境友好、安全性高、不受浊度影响且占地面积小等优势备受关注。目前常用的电氯化消毒技术成本较低且具有较强的消毒能力,但产生的含氯消毒副产物严重威胁人类健康[12];电芬顿消毒技术存在易产生含铁污泥且反应需在酸性条件下进行的局限性[13];纳米电穿孔消毒技术可依靠电穿孔原理实现高效消毒且不产生消毒副产物,但其高能耗和设备复杂性限制其广泛应用[14]。
电活化高锰酸钾(PM)技术是近年来新兴的电化学氧化技术,PM经电场活化后可产生活性中间价态锰(RMnS),目前已被应用于去除水中多种有机污染物[15]。与其他电化学消毒技术相比,电活化PM技术具有氧化能力强、不产生卤代副产物和pH适用性更广的优势[16],但其用于去除ARB和ARGs的相关研究还十分有限。此外,虽然该技术已被证明对去除多种有机污染物有效,但其氧化效率受所用平板式电极反应器较厚扩散层的限制[17-18]。相比之下,阴极穿透式反应器具有更优的液体流态和传质效率,能够实现更高效的消毒效能[19-20]。基于此,我们合理推测阴极穿透式反应器耦合电活化高锰酸钾体系可能可以通过高效产生RMnS并提高其氧化效率,以有效去除水中ARB和ARGs。
综上所述,本研究构建了阴极穿透式反应器耦合电活化高锰酸钾体系(电阴极-高锰酸钾体系),考察了其对目标微生物多重耐药大肠杆菌(AR E. coli)的灭活效果,并对体系同时去除抗生素、ARB及ARGs的效能和抗水质干扰能力进行评估,探究了AR E. coli的灭活机理以及PM浓度、电流密度和溶液初始pH对AR E. coli灭活的影响,以期为基于高锰酸钾的电化学消毒技术应用于水体抗生素耐药性污染防控提供理论基础和技术支持。
-
实验菌种:大肠杆菌BL21(DE3)由北京百欧博伟生物技术有限公司购得通用菌株。通过抗生素平板筛选实验,发现该菌株对多种抗生素具有抗性。通过全基因组测序,获得了该菌株抗性基因相关的序列。本文使用的抗生素抗性基因和整合酶基因在NCBI中的序列编号信息如表1所示。
实验菌液:将–80 ℃超低温冷冻冰箱保存的冰冻菌种融化后接种于LB琼脂培养基,37 ℃恒温培养36 h后保存于–4 ℃冰箱内。将菌株接种于100 mL的LB肉汤培养基中,于37 ℃、220 r·min–1下振荡培养18 h,再以5 000 r·min–1离心10 min,将沉淀重新悬浮于无菌水中,重复3次以去除培养基,将最终的沉淀溶于12 mL无菌水中得到菌悬液。根据实验要求配制初始浓度为107 CFU·mL–1的无菌水菌液作为实验菌液。
-
主要材料:高锰酸钾(KMnO4)、硫代硫酸钠(Na2S2O3)、硫酸钠(NaSO4)、氢氧化钠(NaOH)、硫酸(H2SO4)、焦磷酸钠(Na4P2O7)均为分析纯;碘化丙啶(PI)购自上海麦克林生化科技股份有限公司;SYTO9购自赛默飞世尔科技公司;碳纤维毡(直径4 cm,厚度2 mm)购自内蒙古万兴碳素有限公司;LB肉汤培养基(氯化钠10 g·L–1,蛋白胨10 g·L–1,酵母浸粉5 g·L–1)、LB琼脂培养基(氯化钠10 g·L–1,蛋白胨10 g·L–1,酵母浸粉5 g·L–1,琼脂30 g·L–1)由实验室制备。
主要实验仪器:高速离心机(TG16-WS,湖南湘仪实验室仪器开发有限公司);洁净工作台(SW-CJ-1FD,苏州安泰空气技术有限公司);高压灭菌锅(DSX-280B,上海申安医疗器械厂);恒温培养箱(SPX-250B-G,上海迅博实业有限公司医疗设备厂);振荡培养箱(ZWY-103D,上海智城分析仪器制造有限公司);涡旋混合仪(CY-30S,上海楚悦机电科技有限公司);直流电源(PS-303DM,深圳市龙威电源有限公司);蠕动泵(FZI-101K,重庆杰恒蠕动泵有限公司)。
-
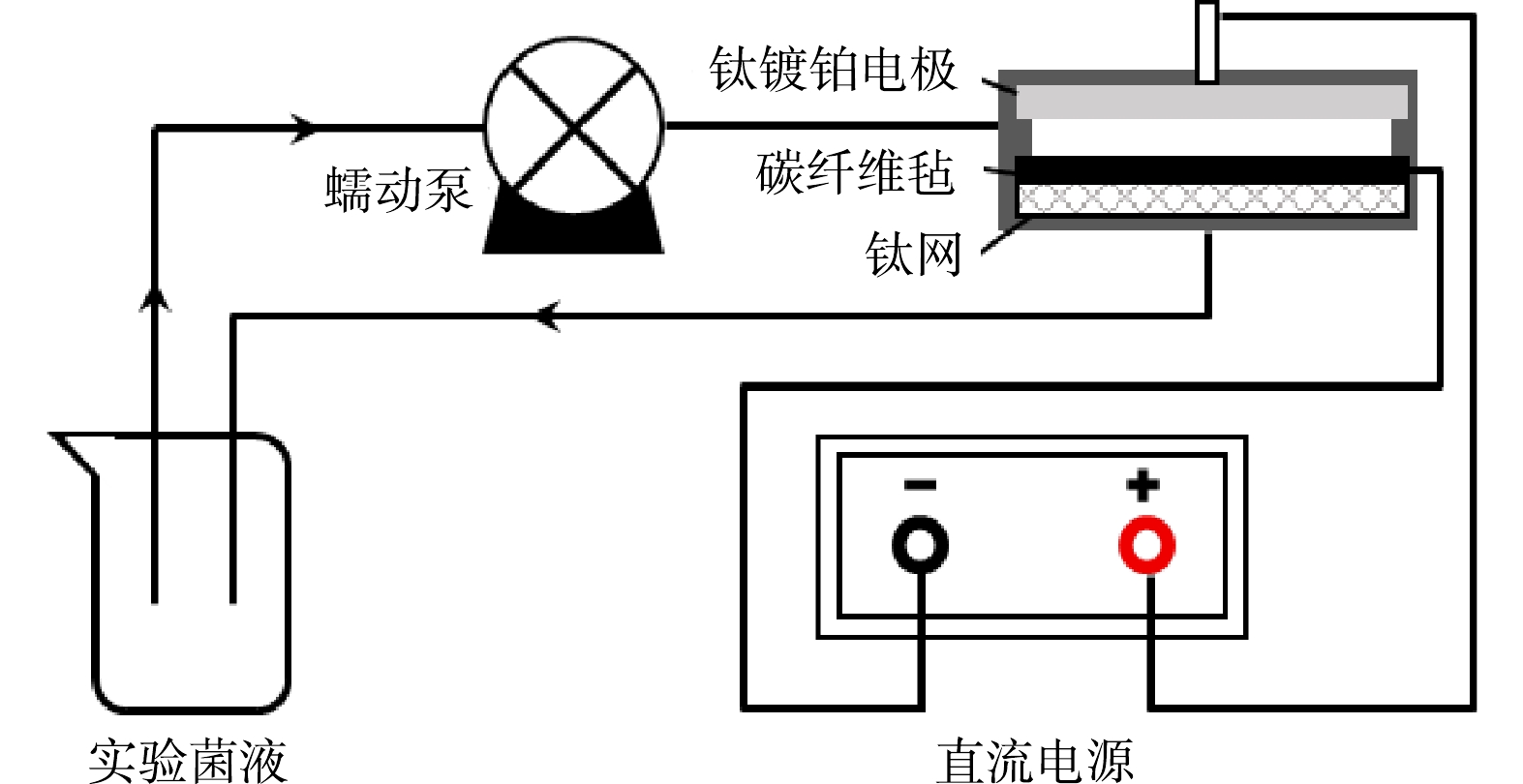
电阴极-高锰酸钾体系灭活多重耐药大肠杆菌的实验装置如图1所示。采用钛镀铂电极为阳极,钛网支撑碳纤维毡为阴极,电极间距为2 cm。配制500 mL实验菌液至无菌玻璃烧杯中,添加50 mmol·L–1无水硫酸钠电解质(本研究已验证该电解质浓度下细菌活性未降低),使用磁力搅拌器充分混合。反应时,先将实验菌液均匀流过反应装置,再打开直流电源,然后投加PM,使实验水样从阳极端流过,阴极端流出。实验中,AR E. coli初始浓度约为107 CFU·mL–1,PM浓度为7 μmol·L–1,电流密度为12.55 mA·cm–2,菌液初始pH为5,取样时间为0、3、5、8、10、15 min,从反应装置的阴极端取1 mL菌液加入30 μL质量浓度为4%的硫代硫酸钠溶液淬灭后进行分析。
-
1)细菌计数方法。将取样淬灭后的1 mL菌液用50 mmol·L–1的硫酸钠溶液以10倍浓度梯度连续稀释至适当浓度,取100 μL后用无菌涂布棒均匀涂布在LB琼脂培养基(含16 μg·L–1四环素)上,于37 ℃恒温培养箱中培养24 h后计数。大肠杆菌对数去除率根据式(1)计算。
式中:n为对数去除率,log;N0和N为反应前和反应后的菌液大肠杆菌的浓度,CFU·mL–1。
2) qPCR分析。使用Bacteria Genomic DNA Kit试剂盒(CWBIO, China)提取样品中的DNA并测定基因序列,通过荧光定量PCR对该株多重耐药大肠杆菌所携带的5种抗性基因CpxA、Kpne_OmpK37、EmrA、PmrF、YojI和整合子intⅠ3进行定量检测。qPCR反应体系为20 μL,其中2×SYBR qPCR Mix(ABclonal, China)10 μL,引物FIR各1 μL,DNA模版1 μL,ddH2O 7 μL,各基因引物序列见表2;qPCR扩增条件为95 ℃预变性1 min后,95 ℃变性20 s,55 ℃退火20 s,72 ℃延伸35 s,共40个循环。荧光定量PCR反应在QuantStudio 1实时荧光定量pCR系统(Thermo Fisher Scientific, USA)中进行。
3)有机物浓度测定。使用高效液相色谱仪(Waters
2695 )测定有机污染物盐酸四环素(TCH)的浓度。仪器色谱柱型号为COSMOSIL 3C18-MS-II,紫外检测器型号为Waters2487 ,检测条件为:柱温为25 ℃,流动相为20%的乙腈和80%的0.5%冰乙酸,波长为356 nm。将菌液样品用0.22 μm的膜过滤器过滤至棕色小瓶中待测。4)活性锰测定。采用紫外-可见光光度计(T6 新世纪,北京普析通用仪器有限公司)测定反应中产生的活性锰物种。在实验水样中添加适量焦磷酸钠(PP)捕获产生的三价锰,然后用紫外-可见光光度计在200~700 nm进行全波长扫描,并检测258 nm下的Mn(III)-PP的特征吸收峰。
5)细菌表征方法。细胞形态观察:采用扫描电子显微镜(Quattro S,美国赛默飞世尔公司)观察处理前后大肠杆菌的表面形态。细胞膜通透性:采用SYTO9和PI 2种染料对大肠杆菌染色,在倒置荧光显微镜(IX71-12FL/PH-DP70,日本奥林巴斯公司)下观察大肠杆菌细胞膜通透性变化。将菌液样品离心后弃上清液,加入50 μL SYTO9或PI染料,在室温下避光染色30 min,用倒置荧光显微镜观察绿色和红色荧光。细胞膜脂质过氧化:将收集的菌液样品在超声波破碎仪(JY96-IIN,宁波新芝生物科技公司)中以60%的功率破碎1 min,按照《微量丙二醛测定试剂盒》(南京建成生物工程研究所)说明书测定反应过程中丙二醛浓度变化。细胞蛋白质降解:采用福林酚法测定反应过程中总蛋白质含量变化。细胞ATP浓度:采用多功能酶标仪(SpetraMax i3x,美国 Molecular Devices)测定全体系处理过程中总ATP、胞外ATP、胞内ATP的浓度,其中测定胞外ATP时需用0.22 μm的膜过滤器过滤,按照BacTiter-GloTM生物发光法试剂盒(普洛麦格生物技术有限公司)说明书进行测定。
-
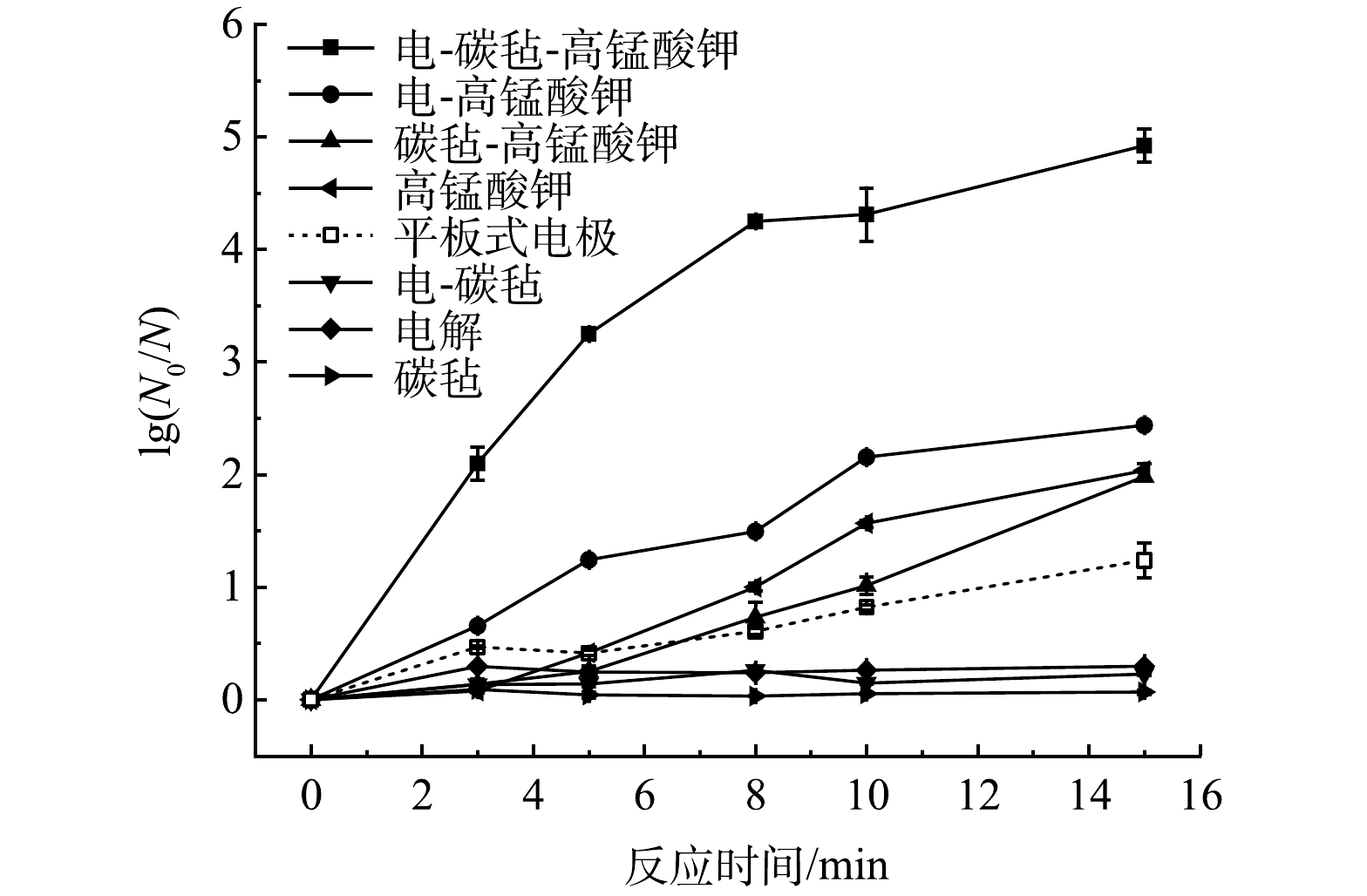
在AR E. coli浓度约为107 CFU·mL–1,PM投加量为7 μmol·L–1,电流密度为12.55 mA·cm–2,初始pH为5,反应时间15 min的条件下,研究了电解、碳毡、电-碳毡、高锰酸钾、电-高锰酸钾、碳毡-高锰酸钾以及电-碳毡-高锰酸钾体系对AR E. coli的灭活效果,其中在非碳毡体系中阴极为钛网。如图2所示,电解、碳毡和电-碳毡体系对AR E. coli几乎无去除效果,表明碳毡对AR E. coli的吸附去除以及电解杀菌效果均较弱;高锰酸钾、电-高锰酸钾和电-碳毡-高锰酸钾对AR E. coli的对数去除率分别为2.03、2.44和4.92 log,电-碳毡-高锰酸钾相较于单独高锰酸钾提高了2.89 log,表明当碳毡作为阴极时,电活化PM能够有效提升消毒效果。这一方面可能是由于电活化PM产生具有较高氧化还原电位的活性中间价态锰[15],能够迅速灭活AR E. coli;另一方面,碳毡阴极具有丰富的孔隙结构和较大的比表面积[21],可增加与AR E. coli的接触面积,从而缩短传质距离,进而提高了体系的传质效率。
此外,对比了平板式电极反应器与阴极穿透式反应器对AR E. coli的灭活效果。其中平板式电极反应器的电极材料、极板间距与阴极穿透式反应器完全相同,电极浸没至菌液中。由图2可知,阴极穿透式反应器(电-碳毡-高锰酸钾)对AR E. coli的对数去除率比平板式电极高出1.24 log。这可能是由于阴极穿透式反应器内菌液的连续流动提高了PM向阴极电化学活性位点的传质效率,从而更有效促进RMnS的生成,并增强其与AR E. coli的接触。此外,有研究[22]表明,穿透式电极孔隙的边界层厚度小于平均孔半径,因此,阴极穿透式反应器能够通过压缩边界层厚度提高电化学反应过程的传质效率。
-
进一步探究了电阴极-高锰酸钾体系在最优工况时,同时去除不同浓度盐酸四环素(TCH)、AR E. coli及其携带ARGs的效能。如图3(a)所示,TCH投加浓度为1 μmol·L–1时,反应5 min时,TCH去除率迅速达到86.2%,反应15 min时提高至96.4%,且对AR E. coli的对数去除率仍可维持4.61 log左右,达到99.99%的去除率。当TCH投加浓度为5 μmol·L–1时,电阴极-高锰酸钾体系对TCH仍能达到89.5%的去除率。这表明电阴极-高锰酸钾体系对TCH和AR E. coli具有良好的同时去除效果。
采用qPCR技术评估了该体系削减ARGs的效能。由于DNA损伤速度比ARB灭活速度慢且更困难,以往研究者在进行ARGs削减分析时,通常会提高氧化剂浓度并延长反应时间[23-24]。因此,本研究将PM投加量由7 μmol·L–1提高至140 μmol·L–1,反应时间延长至90 min,对该株AR E. coli携带的5个抗性基因多重耐药基因Kpne_OmpK37、CpxA,氟喹诺酮类抗生素EmrA,肽类抗生素PmrF、YojI和整合子基因intⅠ3的去除情况进行分析。如图3(b)所示,该体系在短时间内即可实现显著的ARGs去除效果,反应5 min时,即对ARGs达到2.56~2.89 log的显著削减效果,反应时间90 min时对数去除率进一步提高至3.39~3.89 log,表明该体系中产生的RMnS对ARGs损伤有重要贡献。整合子是一类重要的可移动基因元件,其中Ⅰ、Ⅱ、Ⅲ型整合子介导的ARGs水平转移已被证实是环境中抗生素耐药性传播的重要途径[25]。由图3(b)可知,该体系对intⅠ3可高达3.87 log的高效削减,达到99.99%的去除率,这说明RMnS对ARGs的水平转移有显著抑制效果。
该体系对ARGs削减的机理可能解释为:电活化PM产生的RMnS诱导细胞发生氧化应激反应,进而生成胞内活性氧(ROS),如超氧阴离子、过氧化氢等[26]。随着细胞活性的降低,RMnS得以进入细胞内部,与胞内ROS共同氧化攻击ARGs碱基对之间的氢键或破坏含ARGs的DNA片段[27],从而有效去除ARGs。以上结果表明,该体系对ARGs具有显著的去除效果,有效抑制ARGs的水平转移和抗生素耐药性的传播风险。综上所述,电阴极-高锰酸钾体系能够同时处理水中抗生素、ARB和ARGs,并实现显著的去除效果。
-
1)主要活性物种检测。研究表明,在电活化PM体系中,Mn(Ⅲ)aq是最主要的活性物种,羟基自由基(·OH)和硫酸根自由基(SO4·−)几乎不发挥作用[15,28]。叔丁醇常作为·OH的淬灭剂(反应速率常数为6×108 mol–1 s–1)[29],甲醇常作为·OH和SO4·−的淬灭剂(反应速率常数为9.7×108 mol–1 s–1和2.5×107 mol–1 s–1)[30]。控制实验条件不变,向体系中投加0.1、1 mmol·L–1的叔丁醇和甲醇检测·OH和SO4·−是否存在。结果如图4(a)所示,投加淬灭剂对体系中AR E. coli的灭活无影响,表明该体系中,·OH和SO4·−并未参与AR E. coli的灭活。因此,电阴极-高锰酸钾体系灭活AR E. coli的反应中起主要作用的是活性Mn(Ⅲ)aq,而非·OH和SO4·−[15,28]。
为证明该体系中起主要作用的是活性Mn(Ⅲ)aq,进行Mn(Ⅲ)aq络合实验。焦磷酸钠(PP)与Mn(Ⅲ)aq的稳定络合物Mn(Ⅲ)aq-PP在波长258 nm处会显示特征吸收峰[31]。虽然本实验投加的PM浓度较低,全扫描时检测到特征吸收峰,但由于吸光度较低可能存在误差,因此在全扫描检测Mn(Ⅲ)aq-PP时,所投加PM浓度为100 μmol·L–1。扫描结果如图4(c)和图4(d)所示,溶液流经阴极后,在258 nm处立即出现特征吸收峰,且随着反应时间增加,烧杯内的特征吸收峰不断增强,这表明电阴极-高锰酸钾体系中确实产生了Mn(Ⅲ)aq且Mn(Ⅲ)aq是由PM在阴极还原产生。为进一步验证Mn(Ⅲ)aq的氧化作用,向体系中投加不同浓度的PP。从图4(b)可以看出,随着加入的PP浓度从7 μmol·L–1到700 μmol·L–1,AR E. coli的灭活效果显著降低。这表明Mn(Ⅲ)aq为AR E. coli灭活的主要活性物种。综上所述,电阴极-高锰酸钾体系生成Mn(Ⅲ)aq的途径如式(2)~(4)所示。
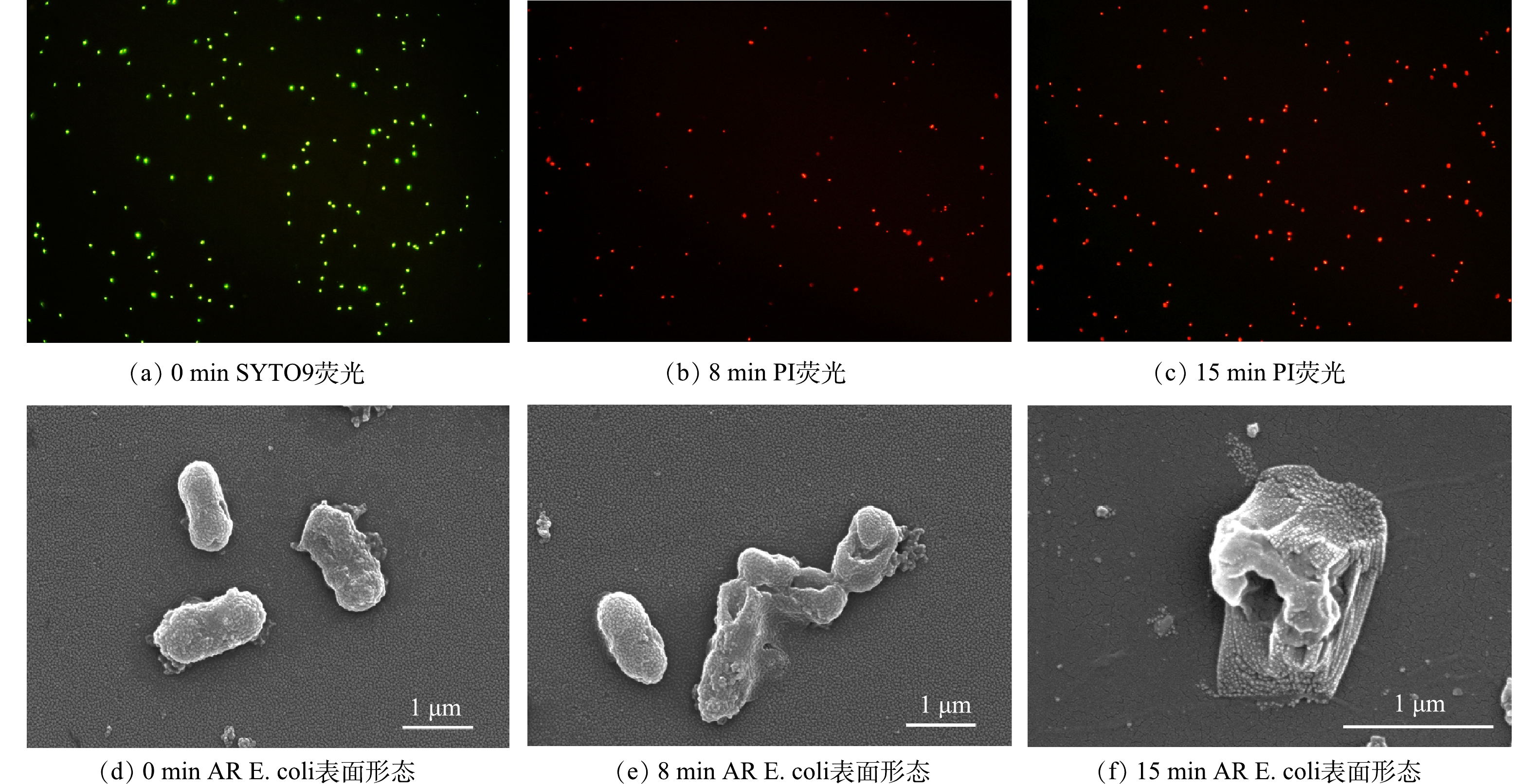
2) AR E. coli灭活过程探究。为探究反应过程中AR E. coli细胞膜的通透性变化,采用SYTO9和PI染料对反应前后AR E. coli染色后在荧光显微镜下观察。SYTO9是一种可以穿透细胞的绿色荧光核酸染料,能同时标记活细菌和死细菌,PI是一种可以穿透破损细胞的红色荧光核酸染料,只能标记死细菌[32]。因此,红色荧光代表细胞膜通透性改变后的大肠杆菌,而绿色荧光代表具有完整细胞膜的大肠杆菌。如图5(a)~(c)所示,反应前,由于细胞结构完整,绿色荧光非常强烈;反应8 min后,红色荧光逐渐增多;反应15 min后,几乎全部细胞都呈现出红色荧光。表明电阴极-高锰酸钾体系能够有效增加细胞膜的通透性,从而使染料对细胞进行染色。
为进一步探究反应过程中AR E. coli形态变化,采用扫描电镜观察反应前后AR E. coli的表面形态。如图5(d)~(f)所示,反应前,大肠杆菌结构完整、表面光滑且呈杆状;反应8 min后,部分大肠杆菌结构遭到破坏,表面开始出现褶皱、收缩,且有部分菌体破碎交联;反应15 min后,大肠杆菌表面出现严重塌陷、萎缩,菌体破碎,细胞内物质流出。说明电阴极-高锰酸钾体系产生的Mn(Ⅲ)aq可以有效破坏AR E. coli的结构形态,使胞内物质流出,从而逐渐失去活性,这与荧光显微镜表征结论一致。
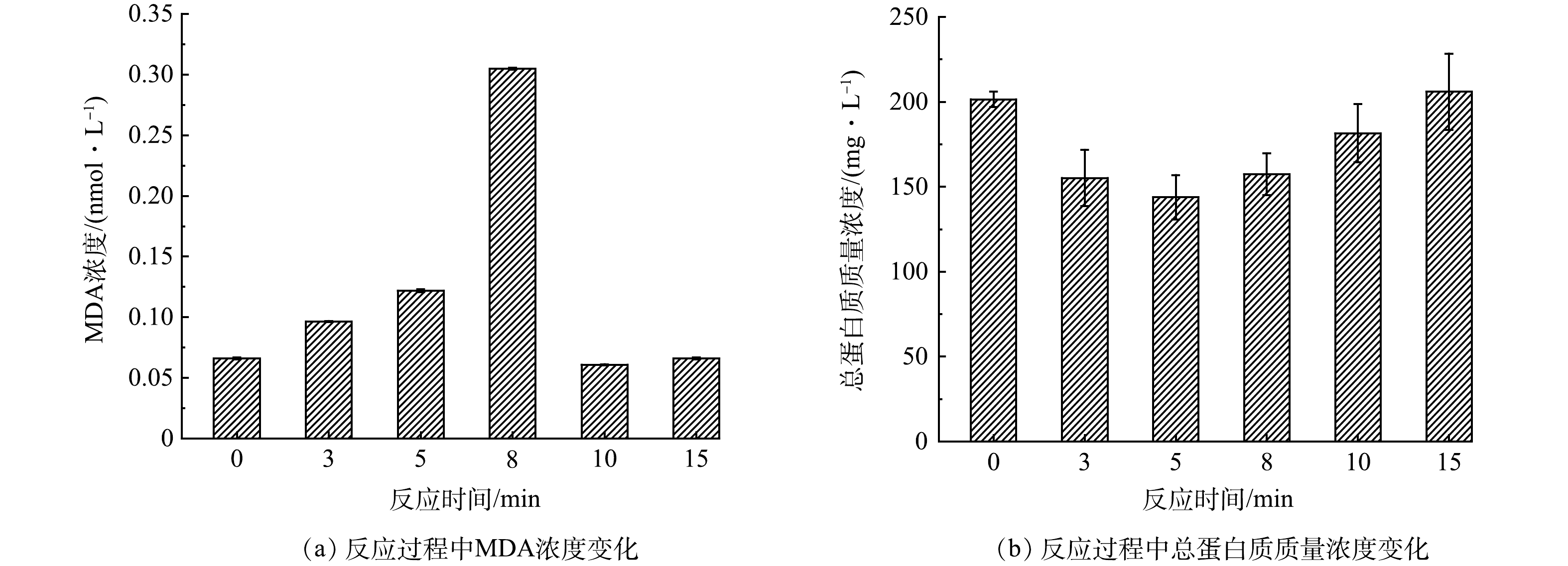
当细胞膜的脂质分子被活性物种氧化时,会发生脂质过氧化[33],丙二醛(MDA)是脂质过氧化的重要产物[32],因此,测定了反应过程中MDA的浓度变化。如图6(a)所示,MDA的浓度先上升后降低。MDA浓度升高一方面是由于反应过程中产生的Mn(Ⅲ)aq从外部破坏细胞膜脂质双分子层;另一方面,Mn(Ⅲ)aq诱发细胞内氧化应激,导致胞内ROS异常升高,从内部氧化细胞膜中的脂质成分[34]。反应8 min后,由于MDA被活性物种氧化,浓度逐渐降低。
此外,测定了反应过程中总蛋白质质量浓度变化,如图6(b)所示,总蛋白质质量浓度先降低后上升,原因可能是反应前期蛋白质释放速度较慢,且小于蛋白质降解速度,因此,总蛋白质质量浓度逐渐降低,然而反应5 min后,由于蛋白质持续大量释放,降解速度小于释放速度,总蛋白质质量浓度逐渐升高。以上结果进一步说明电阴极-高锰酸钾体系产生的Mn(Ⅲ)aq导致大肠杆菌细胞膜完整性受损,通透性改变。
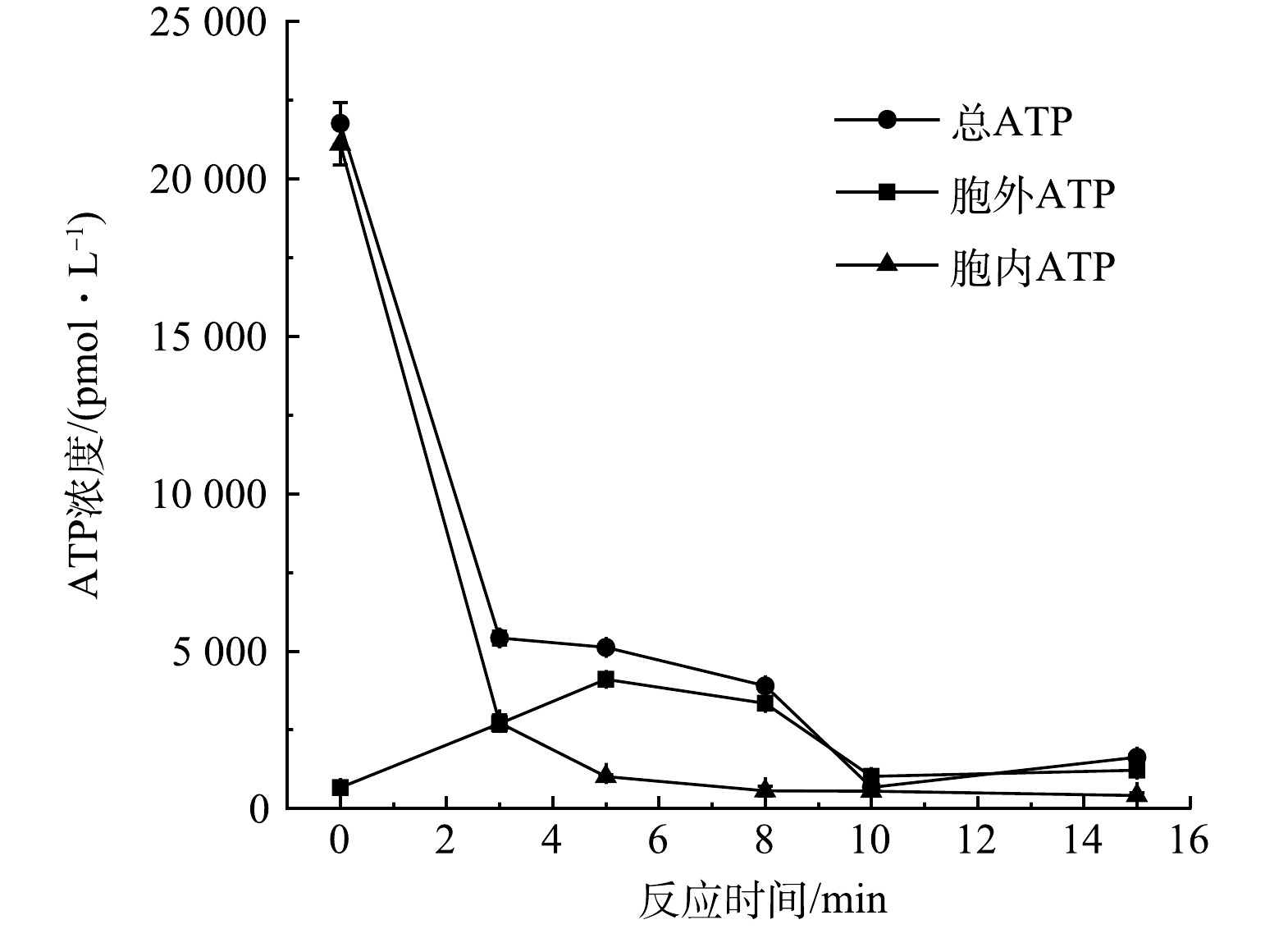
ATP是衡量细胞活性的指标[35],采用酶标仪进一步测定反应过程中ATP浓度变化。总ATP是胞内ATP和胞外ATP的总和,如图7所示,反应开始至反应5 min时,总ATP浓度和胞内ATP浓度含量迅速下降,胞外ATP浓度上升,这表明反应前期,在Mn(Ⅲ)aq的刺激下,ATP合成受到间接或直接抑制[34],细胞活力显著下降,同时,由于细胞完整性受损,胞内ATP释放,反应8 min后,总ATP和胞外ATP浓度几乎相等且持续下降,表明反应过程中细胞逐渐死亡,无法合成新的ATP并且胞外ATP不断被氧化降解[36]。
根据上述实验结果,通过图8归纳了电阴极-高锰酸钾体系去除AR E. coli及其ARGs的机理和过程。在电场作用下,PM在碳纤维毡阴极还原生成活性Mn(Ⅲ)aq,PM与Mn(III)aq共同破坏细胞膜,导致细胞内蛋白质等胞内物质逐渐泄露。同时,细胞内ATP合成受阻,细胞活力下降,Mn(III)aq得以侵入细胞破坏ARGs。随着反应持续进行,细胞内容物逐渐被氧化,细胞结构破损,大肠杆菌完全失活。
-
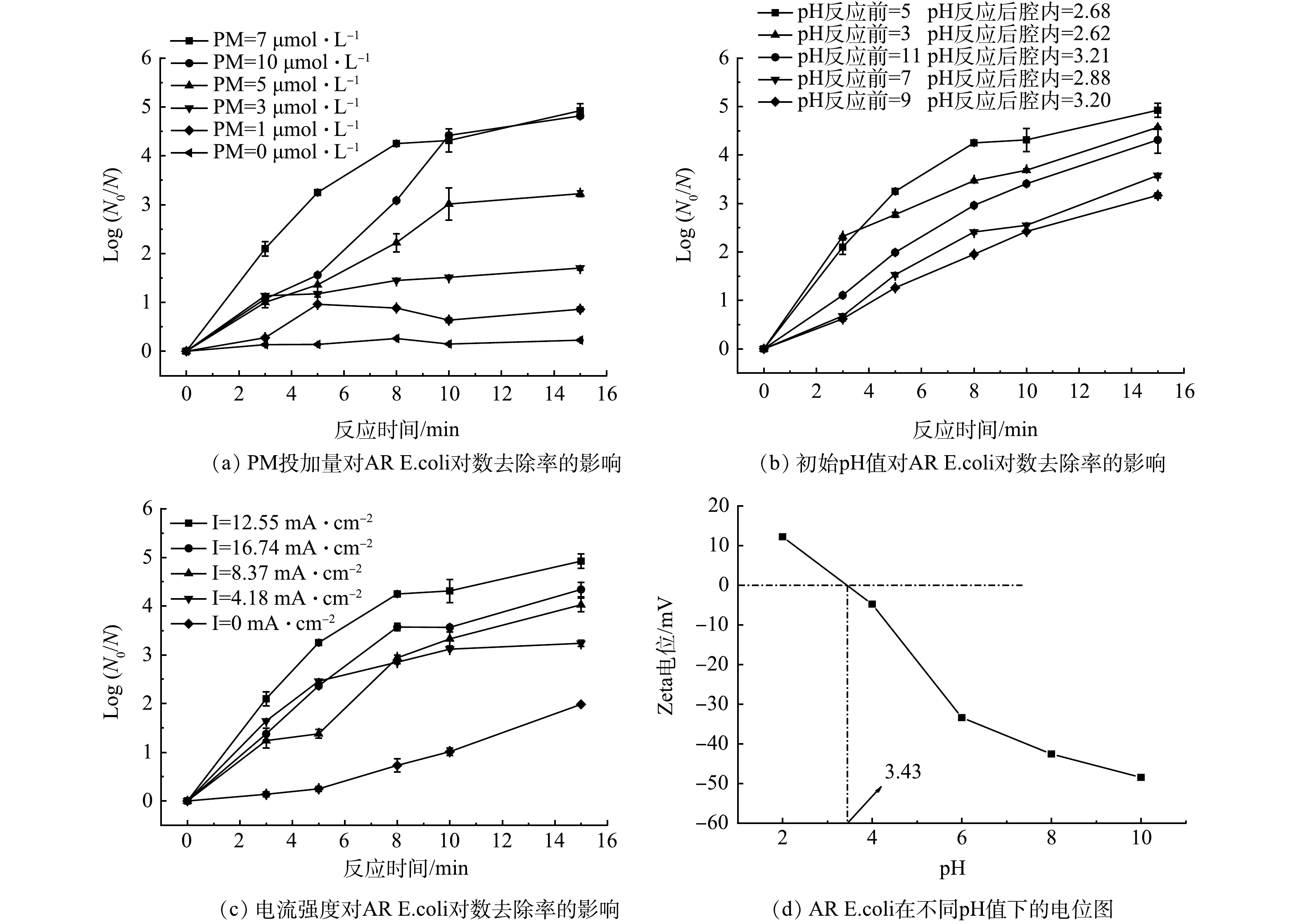
在室温条件下,保持其他实验条件不变,分别考察PM投加量、初始pH和电流密度对AR E. coli灭活的影响。如图9(a)所示,随着PM投加量由1 μmol·L–1增加到7 μmol·L–1,AR E. coli的对数去除率由0.86 log增加到4.92 log,这是由于PM浓度的提高增加了其在阴极得电子的几率,促使更多活性物种产生,从而更有效地灭活AR E. coli。但当PM浓度由7 μmol·L–1增加到10 μmol·L–1时,AR E. coli的对数去除率几乎不变,可能因为部分PM不能被充分利用,从而无法提高体系对AR E. coli的灭活效果。
由图9(b)可知,酸性条件更有利于电阴极-高锰酸钾体系对AR E. coli的去除,且pH为5时大肠杆菌对数去除率最高,这可能是由于PM在酸性条件下的氧化还原电位高于碱性条件,且更容易被活化[37]。同时,Mn(III)aq在碱性条件下易发生歧化反应[38],导致AR E. coli的灭活效能降低。如图9(d)所示,该大肠杆菌的等电点在3.4左右,当环境pH小于3.4时其表面呈正电性。检测了反应过程中反应腔内pH变化,发现菌液在流经阳极时,因阳极表面发生析氧反应,菌液pH值降低至3.4以内,推测细菌表面可能带正电,更容易被阴极电吸附[19]。因此,该体系在较广pH条件下仍有良好的AR E. coli去除效果。
由图9(c)可以看出,当电流密度由4.18 mA·cm–2增加到12.55 mA·cm–2时,AR E. coli的对数去除率由3.24 log增加到4.92 log,但当电流密度增加到16.74 mA·cm–2时,其对数去除率降低至4.34 log。这主要是由于随着电流密度增加,反应中的电子数量增加,电场对PM的活化效率提高。但当电流密度增加到一定程度,体系中氧化剂含量有限,过高的电流密度不能被有效利用,此外,过高的电流会增强电极表面析氢(式(5))和析氧(式(6))反应,与电活化PM竞争,从而导致电流效率降低[39-40]。综合考虑,确定最佳PM投加量为7 μmol·L–1,溶液初始pH=5,电流密度为12.55 mA·cm–2。
-
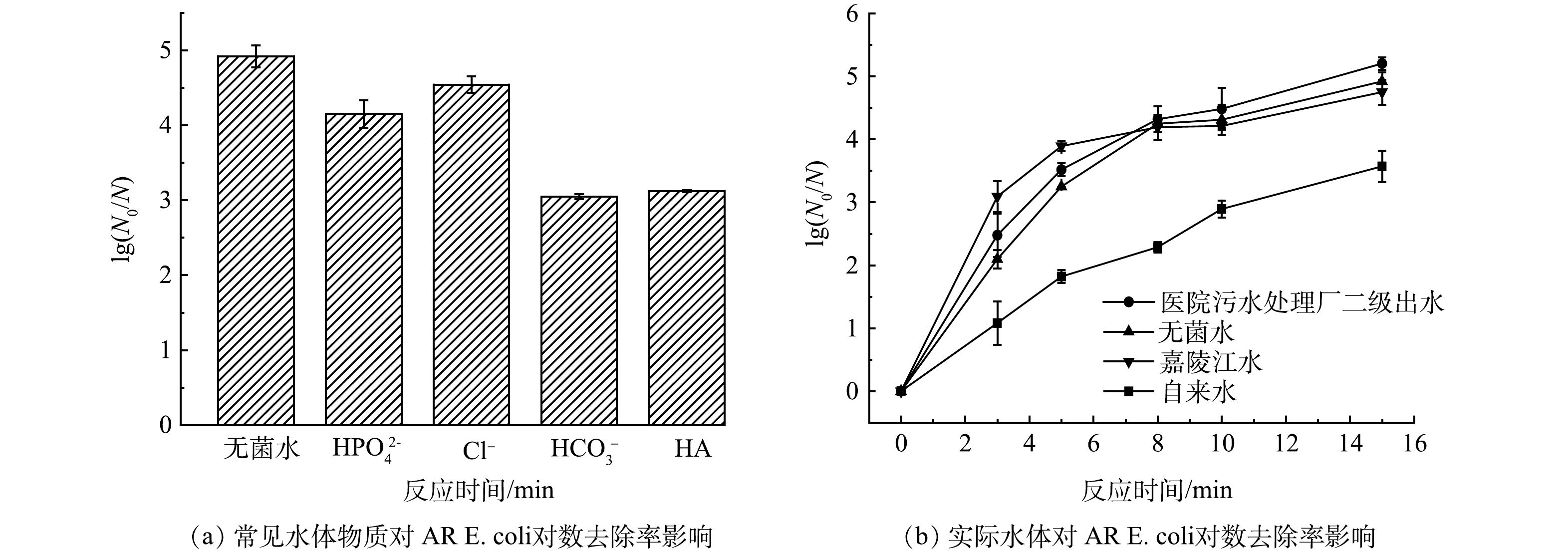
实际水体中可能含有无机阴离子(Cl–、HPO42–、HCO3–)和天然有机物(以HA为代表),这些物质可能影响体系的消毒效果,因此,分析了几种水体中常见物质对AR E. coli灭活的影响。如图10(a)所示,当体系中存在5 mmol·L–1的Cl–时,AR E. coli的对数去除率由4.92 log降低至4.54 log,说明添加一定浓度的Cl–对体系灭活AR E. coli的影响较小。当体系中分别存在1 mmol·L–1的HPO42–、HCO3–和1 mg·L–1的HA,其对数去除率分别降低至4.15、3.05和3.12 log,说明HPO42–、HCO3–和HA抑制了AR E. coli的灭活,这可能是因为HPO42–能够捕获体系产生的活性锰物种[37,41],并且HPO42–和HCO3–是常见的缓冲盐,能够通过影响溶液的pH条件抑制AR E. coli的灭活。高剂量的HA会竞争还原PM,导致AR E. coli去除率降低[42]。
为探究反应体系在实际水体中去除AR E. coli的适用性,测试了该体系在3种实际水体,重庆市肿瘤医院污水处理厂二级出水、嘉陵江水和自来水中的灭活效果。如图10(b)所示,与无菌水相比,反应15 min后医院污水处理厂二级出水中AR E. coli的对数去除率增加至5.20 log,而在嘉陵江水和自来水中,其对数去除率降低至4.75 log和3.57 log。自来水和嘉陵江水中存在更多无机阴离子和天然有机质,可能会消耗或影响体系中的氧化剂[43],而医院污水处理厂二级出水中可能存在共离子和共氧化剂[36],从而促进体系对AR E. coli的灭活。即便如此,该体系仍然能够达到99.9%的AR E. coli去除率。并且,该体系反应后的总锰残留浓度为1.11 mg·L–1,低于国家要求排放标准[44]。综上所述,该体系具有较强的抗水质干扰能力,且不存在锰超标风险,有良好的消毒应用前景。
采用现今消毒技术普遍使用的每阶电能消耗(electrical energy per order, EEO)计算该体系的能耗,公式见式(7)[36],去除每log大肠杆菌能耗仅为0.122 KWh·m–3。通过对比目前常用消毒技术所需能耗(表3),发现电阴极-高锰酸钾体系具有低耗节能的优势,有望成为高效、低耗去除水中抗生素耐药性的消毒技术。
式中:EEO为单位log大肠杆菌的电能消耗量,
$ \text{kWh·}{\text{m}}^{-3} $ ;Ucell为消毒电压,V;V消毒水量体积,L;N0和Nt分别为初始和时刻t的大肠杆菌浓度,CFU·mL–1。 -
1)阴极穿透式反应器耦合电活化高锰酸钾体系在PM浓度仅为7 μmol·L–1,初始pH为5,电流密度为12.55 mA·cm–2时具有明显的协同消毒效果,反应15 min时对AR E. coli可达4.92 log的去除率,比平板式反应器的去除率提高了3.68 log。
2)阴极穿透式反应器耦合电活化高锰酸钾体系产生的Mn(Ⅲ)aq是ARB灭活和ARGs削减的主要活性物种。Mn(Ⅲ)aq首先攻击细胞表面,细胞膜发生脂质过氧化,细胞膜完整性受损,使细胞内蛋白质、ATP逐渐释放并被降解,导致细胞活力显著下降;随着细胞膜通透性上升,Mn(Ⅲ)aq逐渐进入细胞内部破坏细胞质和DNA,细胞正常生长代谢过程受阻,大肠杆菌完全失活。
3)阴极穿透式反应器耦合电活化高锰酸钾体系能够同时高效去除水中四环素(96.5%)、AR E. coli(4.61 log),并且对ARGs具有显著的削减效果,反应5 min时即可高达2.93 log的去除率,90 min可提高至3.89 log,达到99.99%的去除率,因此,该体系在同时降解抗生素、灭活ARB和削减ARGs方面具有较强的潜能。
4)阴极穿透式反应器耦合电活化高锰酸钾体系在实际水体中仍具有高效的AR E. coli去除率,HPO42–、HCO3–、HA对该体系灭活AR E. coli具有一定抑制作用,Cl–对该体系灭活AR E. coli几乎没有影响,体现出良好的消毒应用前景。
阴极穿透式反应器耦合电活化高锰酸钾体系同步去除多重耐药细菌及抗性基因
Simultaneous removal of ARB and ARGs by cathode flow-through reactor coupled with electro-activated permanganate process
-
摘要: 抗生素耐药性的问题已在全球范围内引起广泛关注,特别是在水环境中的传播。为了应对这一挑战,本研究建立了阴极穿透式反应器,探究了电活化高锰酸钾(PM)对抗生素去除、多重耐药大肠杆菌灭活以及抗性基因削减的效果和作用机制。探究了PM投加量、电流密度、初始pH及实际水体和水体中常见物质(HA、Cl–、HCO3–、HPO42–)对多重耐药大肠杆菌灭活的影响。结果表明,当PM浓度仅为7 μmol·L–1、电流密度为12.55 mA·cm–2、初始pH为5时,电阴极-高锰酸钾体系具有明显的协同消毒效果,反应15 min时大肠杆菌去除率可达4.92 log。同时对该细菌携带的抗性基因具有显著的去除效果,对5种抗性基因实现高达3.89 log的对数去除率(99.99%),并且可同时高效去除水中抗生素,可达96.4%的盐酸四环素去除率。利用扫描电镜可观察到处理后的细菌受到严重损伤,细胞膜完整性受到破坏。通过细胞表征进一步发现细胞膜上的脂质被氧化,同时胞内物质逐渐释放并被降解,大肠杆菌完全失活。通过活性锰物种检测和掩蔽实验分析该体系中起主要消毒作用的活性物种为Mn(Ⅲ)aq。该体系在实际水体中表现出优异的多重耐药大肠杆菌去除能力。Cl–对多重耐药大肠杆菌的灭活几乎没有影响,HA、HCO3–、HPO42–对其灭活存在抑制作用。以上研究结果可对遏制抗生素耐药性在水环境中的传播提供参考。Abstract: The issue of antibiotic resistance has received worldwide attention, especially its spread in water environment. To address this challenge, a cathode flow-through reactor was established in this study, then the effects and mechanisms of electro-activated permanganate on antibiotic removal, inactivation of antibiotic resistant Escherichia coli (AR E. coli), and reduction of resistance genes (ARGs) were investigated. The effects of permanganate dosage, current density, initial pH value, actual water bodies and water matrices, including humic acid (HA), chloride ion (Cl–), bicarbonate (HCO3–), hydrogen phosphate (HPO42–), on the inactivation of AR E. coli were investigated. The results showed electric cathode-permanganate process had significant synergistic disinfection effects at the permanganate concentration of only 7 μmol·L–1, the current density of 12.55 mA·cm–2, and the initial pH 5, achieving 4.92 log removal rate after 15 minutes. Meanwhile, the process exhibited a significant removal effect on the ARGs carried by the bacteria, resulting in a 3.89 log reduction (99.99%) in five ARGs. In addition, this process can also efficiently remove antibiotics, and could remove 96.4% tetracycline. Scanning electron microscopy images revealed that the treated bacteria were severely damaged and their cell membrane integrity was disrupted. Through further confirmation, it was found that lipid on the cell membrane were oxidized, while intracellular substances were gradually released and degraded, resulting in complete inactivation of AR E. coli. Detection of reactive manganese species and masking experiments identified Mn(III)aq as the primary disinfecting active species. In actual water, the process showed an excellent removal ability of AR E. coli. The presence of Cl– had no effect on the inactivation of AR E. coli, while HA, HCO3– and HPO42– all inhibited the inactivation process. The above result provides a reference for inhibit the spread of antibiotic resistance in aquatic environments.
-
Key words:
- AR E. coli /
- disinfection /
- ARGs /
- permanganate /
- electrochemistry
-

-
表 1 各基因在NCBI中的序列编号
Table 1. Sequences ID of each gene in NCBI
基因 序列编号 intI3 GBIAPNBH_00602 CpxA GBIAPNBH_01930 Kpne_OmpK37 GBIAPNBH_03022 EmrA GBIAPNBH_02504 PmrF GBIAPNBH_03040 YojI GBIAPNBH_04059 表 2 各基因引物序列
Table 2. Primer sequence of each gene
基因 引物 序列 扩增片段/bp R2(P<0.05) 扩增率/% intⅠ3 intⅠ3-F TGAACAGAGTAAAGCACGAA 455 0.9962 98.48 intⅠ3-R GCTCACTGGACCGAATAA CpxA CpxA-F GTGGTGGCGGCGTCTATT 425 0.9993 100.67 CpxA-R GGCGGTCGGCGTGGATAAAG Kpne_OmpK37 Kpne_OmpK37-F ATTCCAGGATGTGGGTTC 393 0.9991 89.95 Kpne_OmpK37-R CGTTGTGGTAAGGCAGGT EmrA EmrA-F AGCGTCTGCTCCTCCTTCTCAC 382 0.9885 91.46 EmrA-R GGCACACGGCGTTGTAGTC PmrF PmrF-F ATTATGGCGGGATTCAGT 444 0.9857 106.14 PmrF-R ATGTAAGCAGCGGTGTTC YojⅠ YojⅠ-F CCTGTCAGCGGCGAACAACC 400 0.9975 105.18 YojⅠ-R GCTGGCGTAAGTTTCCCT 表 3 不同消毒技术的效果和能耗比较
Table 3. Comparison of effects and energy consumption of different disinfection technologies
消毒技术 目标污染物 反应条件 去除效果 能耗/KWh·m–3 参考文献 Ti/Sb-SnO2/PbO2
电阳极氧化大肠杆菌 电流密度=30 mA·cm–2 3.5 log (12 min) 4.978 [36] 电芬顿 大肠杆菌 电流= 1A; [Fe]= 10 mg· L−1 7 log (60 min) 3.8~4.0 [45] UV/H2O2 总大肠菌群 UV=4×8 W; [H2O2]= 5 mg·L−1 4 log(全部灭活所需时间) 6.95 [46] 电阴极-高锰酸钾 抗生素、ARB和ARGs 电流密度=12.55 mA·cm–2 96.4% TCH、4.92 log ARB和
3.89 log ARGs (15 min)0.122 本研究 -
[1] LI S, ONDON B S, HO S H, et al. Antibiotic resistant bacteria and genes in wastewater treatment plants: From occurrence to treatment strategies[J]. Science of the Total Environment, 2022, 838: 156544. doi: 10.1016/j.scitotenv.2022.156544 [2] PEI M, ZHANG B, HE Y, et al. State of the art of tertiary treatment technologies for controlling antibiotic resistance in wastewater treatment plants[J]. Environment International, 2019, 131: 105026. doi: 10.1016/j.envint.2019.105026 [3] LAMBA M, GRAHAM D W, AHAMMAD S Z. Hospital wastewater releases of carbapenem-resistance pathogens and genes in urban India[J]. Environmental Science & Technology, 2017, 51(23): 13906-13912. [4] MANAIA C M, ROCHA J, SCACCIA N, et al. Antibiotic resistance in wastewater treatment plants: tackling the black box[J]. Environment International, 2018, 115: 312-324. doi: 10.1016/j.envint.2018.03.044 [5] CASSINI A, HÖGBERG L D, PLACHOURAS D, et al. Attributable deaths and disability-adjusted life-years caused by infections with antibiotic-resistant bacteria in the EU and the European Economic Area in 2015: A population-level modelling analysis[J]. The Lancet Infectious Diseases, 2019, 19(1): 56-66. doi: 10.1016/S1473-3099(18)30605-4 [6] ALLEN H, DONATO J, WANG H, et al. Call of the wild: antibiotic resistance genes in natural environments[J]. Nature reviews. Microbiology, 2010, 8: 251-259. doi: 10.1038/nrmicro2312 [7] YU W, ZHAN S, SHEN Z, et al. Efficient removal mechanism for antibiotic resistance genes from aquatic environments by graphene oxide nanosheet[J]. Chemical Engineering Journal, 2017, 313: 836-846. doi: 10.1016/j.cej.2016.10.107 [8] MANOHARAN R K, ISHAQUE F, AHN Y H. Fate of antibiotic resistant genes in wastewater environments and treatment strategies: A review[J]. Chemosphere, 2022, 298: 134671. doi: 10.1016/j.chemosphere.2022.134671 [9] JIA S, SHI P, HU Q, et al. Bacterial community shift drives antibiotic resistance promotion during drinking water chlorination[J]. Environmental Science & Technology, 2015, 49(20): 12271-12279. [10] ALEXANDER J, KNOPP G, DÖTSCH A, et al. Ozone treatment of conditioned wastewater selects antibiotic resistance genes, opportunistic bacteria, and induce strong population shifts[J]. Science of the Total Environment, 2016, 559: 103-112. doi: 10.1016/j.scitotenv.2016.03.154 [11] HILLER C X, HÜBNER U, FAJNOROVA S, et al. Antibiotic microbial resistance (AMR) removal efficiencies by conventional and advanced wastewater treatment processes: A review[J]. Science of the Total Environment, 2019, 685: 596-608. doi: 10.1016/j.scitotenv.2019.05.315 [12] ALEX T. CHOW, ANTHONY T. O'GEEN, RANDY A, et al. Reactivity of litter leachates from California oak woodlands in the formation of disinfection by-products[J] Journal of Environmental Quality, 2011, 40(5): 1607-1616. [13] WANG K, ZHAO K, QIN X, et al. Treatment of organic wastewater by a synergic electrocatalysis process with Ti3+self-doped TiO2 nanotube arrays electrode as both cathode and anode[J]. Journal of Hazardous Materials, 2022, 424: 127747. doi: 10.1016/j.jhazmat.2021.127747 [14] WANG T, CHEN H, YU C, et al. Rapid determination of the electroporation threshold for bacteria inactivation using a lab-on-a-chip platform[J]. Environment International, 2019, 132: 105040. doi: 10.1016/j.envint.2019.105040 [15] ZHU Y, ZHAO C, LIANG J, et al. Rapid removal of diclofenac in aqueous solution by soluble Mn(III) (aq) generated in a novel Electro-activated carbon fiber-permanganate (E-ACF-PM) process[J]. Water Research, 2019, 165: 114975. doi: 10.1016/j.watres.2019.114975 [16] XU Q, FU Q, LIU X, et al. Mechanisms of potassium permanganate pretreatment improving anaerobic fermentation performance of waste activated sludge[J]. Chemical Engineering Journal, 2021, 406: 126797. doi: 10.1016/j.cej.2020.126797 [17] CHEN M, LEI Q, REN L, et al. Efficacy of electrochemical membrane bioreactor for virus removal from wastewater: Performance and mechanisms[J]. Bioresource Technology, 2021, 330: 124946. doi: 10.1016/j.biortech.2021.124946 [18] LIU Y, LEE J H D, XIA Q, et al. A graphene-based electrochemical filter for water purification[J]. Journal of Materials Chemistry A, 2014, 2(39): 16554-16562. doi: 10.1039/C4TA04006F [19] LIU H, NI X Y, HUO Z Y, et al. Carbon fiber-based flow-through electrode system (FES) for water disinfection via direct oxidation mechanism with a sequential reduction–oxidation process[J]. Environmental Science & Technology, 2019, 53(6): 3238-3249. [20] YANG C, WEN L, LI Y, et al. Fabrication of SnO2-Sb reactive membrane electrodes for high-efficiency electrochemical inactivation of bacteria and viruses in water[J]. Chemical Engineering Journal, 2022, 446: 137327. doi: 10.1016/j.cej.2022.137327 [21] 辛蕾, 霍正洋, 倪欣业等. 过滤式碳纤维电极消毒效果比较与机理研究[J]. 环境科学学报, 2018, 38(3): 940-946. [22] GUO L, JING Y, CHAPLIN B P. Development and characterization of ultrafiltration TiO2 Magnéli phase reactive electrochemical membranes[J]. Environmental Science & Technology, 2016, 50(3): 1428-1436. [23] HU Y, ZHANG T, JIANG L, et al. Removal of sulfonamide antibiotic resistant bacterial and intracellular antibiotic resistance genes by UVC-activated peroxymonosulfate[J]. Chemical Engineering Journal, 2019, 368: 888-895. doi: 10.1016/j.cej.2019.02.207 [24] YAO S, HU Y, YE J, et al. Disinfection and mechanism of super-resistant Acinetobacter sp. and the plasmid-encoded antibiotic resistance gene blaNDM-1 by UV/peroxymonosulfate[J]. Chemical Engineering Journal, 2022, 433: 133565. doi: 10.1016/j.cej.2021.133565 [25] HERRAIZ-CARBONÉ M, COTILLAS S, LACASA E, et al. A review on disinfection technologies for controlling the antibiotic resistance spread[J]. Science of the Total Environment, 2021, 797: 149150. doi: 10.1016/j.scitotenv.2021.149150 [26] WANG W, WANG H, LI G, et al. Catalyst-free activation of persulfate by visible light for water disinfection: Efficiency and mechanisms[J]. Water Research, 2019, 157: 106-118. doi: 10.1016/j.watres.2019.03.071 [27] YAO M C, ZHANG X, HUANG Q, et al. Chlorine oxide radical (ClO ) enables the enhanced degradation of antibiotic resistance genes during UV/chlorine treatment by selectively inducing base damage[J]. Environment International, 2023, 178: 108121. doi: 10.1016/j.envint.2023.108121 [28] ZHU Y, WANG X, ZHANG J, et al. Generation of Active Mn(III) aq by a novel heterogeneous electro-permanganate process with manganese(II) as promoter and stabilizer[J]. Environmental Science & Technology, 2019, 53(15): 9063-9072. [29] SONG H, YAN L, MA J, et al. Nonradical oxidation from electrochemical activation of peroxydisulfate at Ti/Pt anode: Efficiency, mechanism and influencing factors[J]. Water Research, 2017, 116: 182-193. doi: 10.1016/j.watres.2017.03.035 [30] LIU Z, ZHAO C, WANG P, et al. Removal of carbamazepine in water by electro-activated carbon fiber-peroxydisulfate: Comparison, optimization, recycle, and mechanism study[J]. Chemical Engineering Journal, 2018, 343: 28-36. doi: 10.1016/j.cej.2018.02.114 [31] WANG Z, XIONG W, TEBO B M, et al. Oxidative UO2 dissolution induced by soluble Mn(III)[J]. Environmental Science & Technology, 2014, 48(1): 289-298. [32] ZHANG L, JIN H, MA H, et al. Oxidative damage of antibiotic resistant E. coli and gene in a novel sulfidated micron zero-valent activated persulfate system[J]. Chemical Engineering Journal, 2020, 381: 122787. doi: 10.1016/j.cej.2019.122787 [33] PIGEOT-RÉMY S, SIMONET F, ATLAN D, et al. Bactericidal efficiency and mode of action: A comparative study of photochemistry and photocatalysis[J]. Water Research, 2012, 46(10): 3208-3218. doi: 10.1016/j.watres.2012.03.019 [34] YAN Y, ZHOU X, YU P, et al. Characteristics, mechanisms and bacteria behavior of photocatalysis with a solid Z-scheme Ag/AgBr/g-C3N4 nanosheet in water disinfection[J]. Applied Catalysis A: General, 2020, 590: 117282. doi: 10.1016/j.apcata.2019.117282 [35] OSIMANI A, GAROFALO C, CLEMENTI F, et al. Bioluminescence ATP monitoring for the routine assessment of food contact surface cleanliness in a university canteen[J]. International Journal of Environmental Research and Public Health, 2014, 11(10): 10824-10837. doi: 10.3390/ijerph111010824 [36] RATHINAVELU S, DIVYAPRIYA G, JOSEPH A, et al. Inactivation behavior and intracellular changes in Escherichia coli during electro-oxidation process using Ti/Sb–SnO2/PbO2 anode: Elucidation of the disinfection mechanism[J]. Environmental Research, 2022, 210: 112749. doi: 10.1016/j.envres.2022.112749 [37] SONG Y, ZHAO C, WANG T, et al. Simultaneously promoted reactive manganese species and hydroxyl radical generation by electro-permanganate with low additive ozone[J]. Water Research, 2021, 189: 116623. doi: 10.1016/j.watres.2020.116623 [38] KLEWICKI J K, MORGAN J J. Kinetic behavior of Mn(III) complexes of pyrophosphate, EDTA, and citrate[J]. Environmental Science & Technology, 1998, 32(19): 2916-2922. [39] PANIZZA M, CERISOLA G. Removal of organic pollutants from industrial wastewater by electrogenerated Fenton’s reagent[J]. Water Research, 2001, 35(16): 3987-3992. doi: 10.1016/S0043-1354(01)00135-X [40] 张妮, 任松宇, 张燕羽, 等. 缓释铁源耦合气体扩散电极强化电芬顿降解环丙沙星[J]. 环境工程学报, 2022, 16(11): 3596-3605. doi: 10.12030/j.cjee.202208056 [41] JIANG J, PANG S Y, MA J. Role of Ligands in permanganate oxidation of organics[J]. Environmental Science & Technology, 2010, 44(11): 4270-4275. [42] ZHANG C, TIAN S, QIN F, et al. Catalyst-free activation of permanganate under visible light irradiation for sulfamethazine degradation: Experiments and theoretical calculation[J]. Water Research, 2021, 194: 116915. doi: 10.1016/j.watres.2021.116915 [43] YUAN Y, WANG W, NIE M, et al. Visible light-mediated activation of periodate for bisphenol A degradation in the presence of Fe3+ and gallic acid at neutral pH[J]. Chemical Engineering Journal, 2024, 479: 147541. doi: 10.1016/j.cej.2023.147541 [44] 国家环境保护总局, 国家质量监督检验检疫总局, 中国国家标准化管理委员会. 中华人民共和国国家标准: 城镇污水处理厂污染物排放标: GB 18918-2002[S] 北京: 中国环境科学出版社, 2002. [45] KOURDALI S, BADIS A, BOUCHERIT A, et al. Electrochemical disinfection of bacterial contamination: Effectiveness and modeling study of E. coli inactivation by electro-Fenton, electro-peroxi-coagulation and electrocoagulation[J]. Journal of Environmental Management, 2018, 226: 106-119. [46] RUBIO-CLEMENTE A, CHICA E, PEÑUELA G. Total coliform inactivation in natural water by UV/H2O2, UV/US, and UV/US/H2O2 systems[J]. Environmental Science and Pollution Research, 2019, 26(5): 4462-4473. doi: 10.1007/s11356-018-3297-z -



 下载:
下载: