-
抗生素是一种新污染物,其主要来源于抗生素生产企业、养殖业和畜牧业及医院等。废水中的抗生素可通过多种途径进入环境,这不仅会诱发抗生素抗性基因,还会与其他污染物结合,进而产生毒性更大的复合污染物[1]。去除废水中的抗生素方法有高级氧化法[2]、光催化降解法[3]、生物降解法等[4]。其中,生物法因操作条件温和且运行成本低,已得到广泛研究和应用。已有研究[5-6]将微生物燃料电池(microbial fuel cell,MFC)用于处理抗生素废水中。影响MFC性能的因素较多,接种污泥微生物是重要的影响因素之一[7]。厌氧污泥作为MFC接种污泥是最常用的方法,已有研究[8]将厌氧颗粒污泥(anaerobic granular sludge,AGS)用于MFC中;活性污泥(activated sludge,AS)也可作为接种微生物用于MFC中,但2种接种污泥用于MFCs降解抗生素的性能对比并未研究。为此,本研究以AGS-MFC与AS-MFC处理废水中常见的磺胺嘧啶(sulfadiazine,SDZ),对比分析了2组MFC对SDZ的去除性能,可为MFC产电、有机物去除及降解抗生素提供数据参考。
-
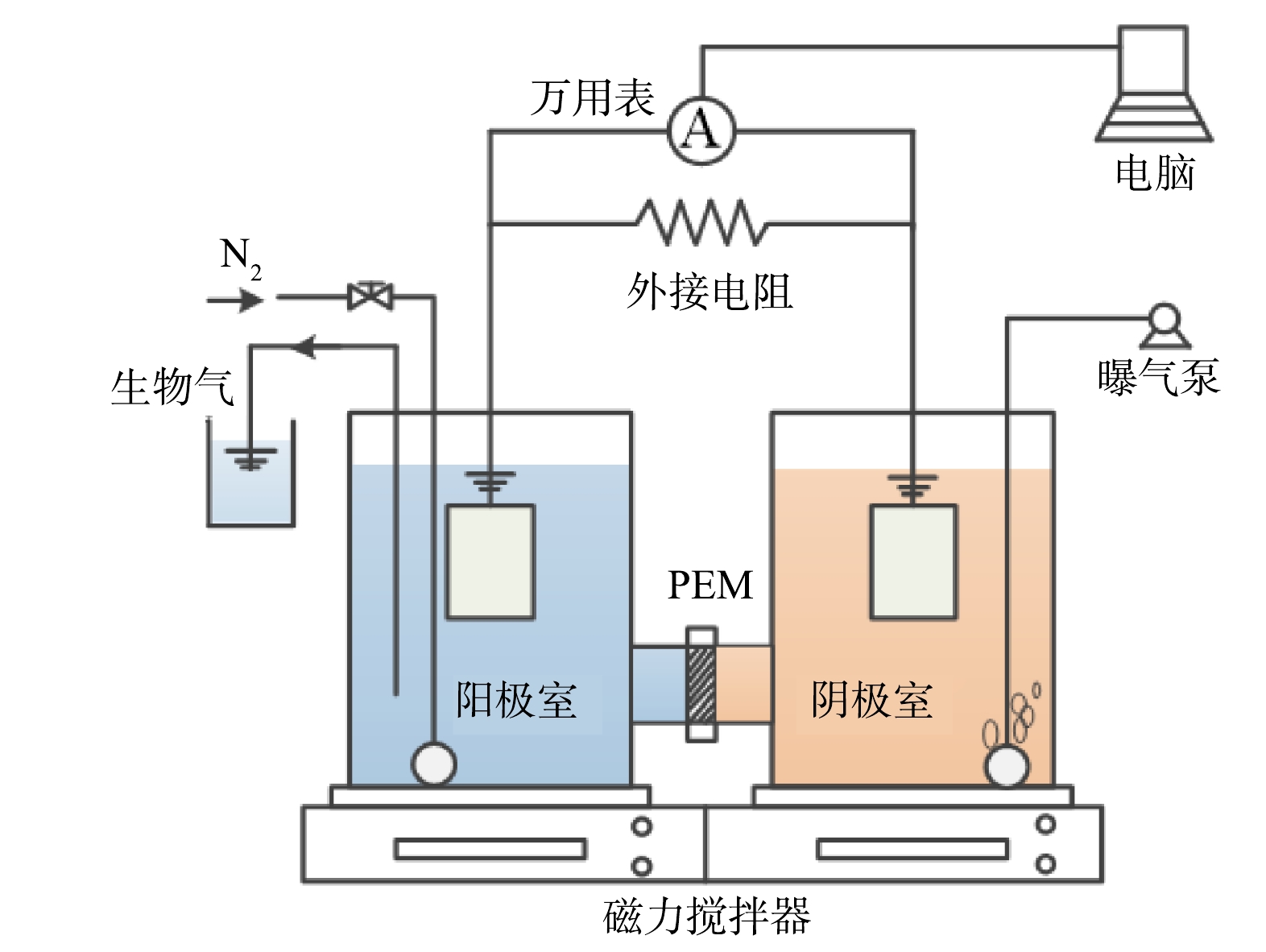
构建2组相同的双室H型MFC装置。单个MFC装置的阳极、阴极室均为圆柱形,阳极室与阴极室的容积均为750 mL,采用Nafion117 PEM(杜邦质子交换膜)将阴极室、阳极室分隔。阳极电极与阴极电极的电极材料均采用4 cm×5 cm HCP030碳纸,碳纸参数为:厚度0.3 mm,密度0.78 g·cm−3,气孔率75%,电阻率3 mΩ·cm−1,弯曲半径10 cm。MFC装置图见图1。在阴极室中加入0.1 mol·L−1铁氰化钾溶液至完全浸没阴极;通过空气泵进行曝气,控制曝气量在2~4 L·min−1。阳极利用磁力搅拌器确保污泥与配水充分混合。2组MFC通过电磁恒温加热器将温度在(30±2) ℃,阴极与阳极间连接的外接电阻为1 000 Ω,进水为间歇式。当MFC产电明显下降时,同时更换阴极液与阳极液,并在更换阳极液后立刻通入10~15 min氮气以去除阳极液中的残留氧气。用导线将MFC的阳极与阴极相连接,并在阴阳极间并联入ZX21型多盘十进电阻箱与UT61B型专业电子万用表;万用表通过USB连接插座将产电数据输出至电脑自动记录。实验以20 min为间隔记录2组MFC的电压输出。
-
AS取自成都市某污水处理厂二沉池,AGS取自实验室原有厌氧反应器,颗粒直径为2~3 mm。接种时保持两种MFC混合液悬浮固体(mixed liquor suspended solids,MLSS)浓度一致;阳极接种量均为300 mL。阳极液的组成为,1 000 mg·L−1葡萄糖,74 mg·L−1 NH4Cl,3 000 mg·L−1 NaHCO3,22 mg·L−1 KH2PO4,54 mg·L−1 MgSO4·7H2O,6.2 mg·L−1 CaCl2。微量元素(营养液)少量加入EDTA、ZnSO4·7H2O、CuCl2·2H2O、NiSO4·6H2O。SDZ添加量按0、1、3、5、10、15、25 mg·L−1递增。
-
废水常规指标COD、MLSS、MLVSS、pH等采用国家标准方法[9]检测;抗生素采用LC-MS进行定量分析,色谱柱为Acquity UPLC® BEH C18色谱柱(1.7 μm,2.1 mm×10 mm),保护柱为Acquity UPLC® BEH C18 保护柱(1.7 μm,2.1 mm×5 mm),流动相A为含0.1%甲酸的水溶液;流动相B为含0.1%甲酸的甲醇溶液;质谱为正负电离切换多反应监测模式,利用数据处理软件进行数据提取与处理。
-
MFC的产电性能表征的输出电压、功率密度、电池内阻与持续产电时间,电流密度、极化曲线与功率密度曲线、库伦效率的测量及计算与文献[9-10]相同。
-
送上海生工生物股份有限公司提供微生物测序。步骤如下。1)样品预处理:取样5 mL,4 500 r·min−1离心15 min后,留取沉淀待提取DNA。2)DNA提取:根据说明使用E.Z.N.ATM Mag-Bind Soil DNA试剂盒(Omega Bio-tek,Inc,Norcross,GA,USA),从5 mL细菌培养物中提取总DNA,用琼脂糖凝胶测试DNA完整性。3)PCR扩增:利以确定PCR反应需加入的DNA量。对于细菌样品,使用通用细菌引物341F和805R扩增提取的DNA的16SrRNA基因的V1~V3区,并且在第2轮扩增中引入Illumina桥PCR相容性引物。对于古菌样品,用Qubit3.0 DNA检测试剂盒对基因组DNA精确定量,古菌引用的PCR扩增一共3轮,第1轮使用M-340F,GU1ST-1000R引物扩增,第2轮使用上一轮的PCR产物进行扩增,PCR所用的引物已经融合了Miseq测序平台的V3~V4通用引物。第3轮扩增,引入Illumina桥式PCR兼容引物。4)DNA纯化回收:对于细菌扩增的PCR产物和正常扩增片段在400 bp以上的PCR产物,选用0.6倍的磁珠(Agencourt AMPure XP)处理。5)定量混合:利用Qubit2.0 DNA检测试剂盒对回收的DNA精确定量,按照1﹕1的比例等量混合后准备上机测序。6)上机测序。测序使用的软件:Prinseq、FLASH、Mothur、Uclust、Cytoscape、Oiime、Muscle、MEGAN、RDP、Fasttree以及R包:scatterplot3D、vegan、gplots、ape、VennDiagram、pheatmap。测序使用数据库:RDP classifier 数据库、Silva数据库以及Unite数据库。
-
成功启动后的AGS-MFC、AS-MFC以葡萄糖为碳源,COD (1 000±20) mg·L−1下进行去除SDZ与产电的性能及差异性研究。在不同SDZ浓度下,对比AGS-MFC、AS-MFC中的SDZ以及COD去除率;由液相色谱-质谱联用仪(LC-MS)检测出中间产物的质荷比推导SDZ降解的中间产物,分析SDZ在MFC系统中的降解途径。通过微生物测序来解析两种体系功能微生物群落。
-
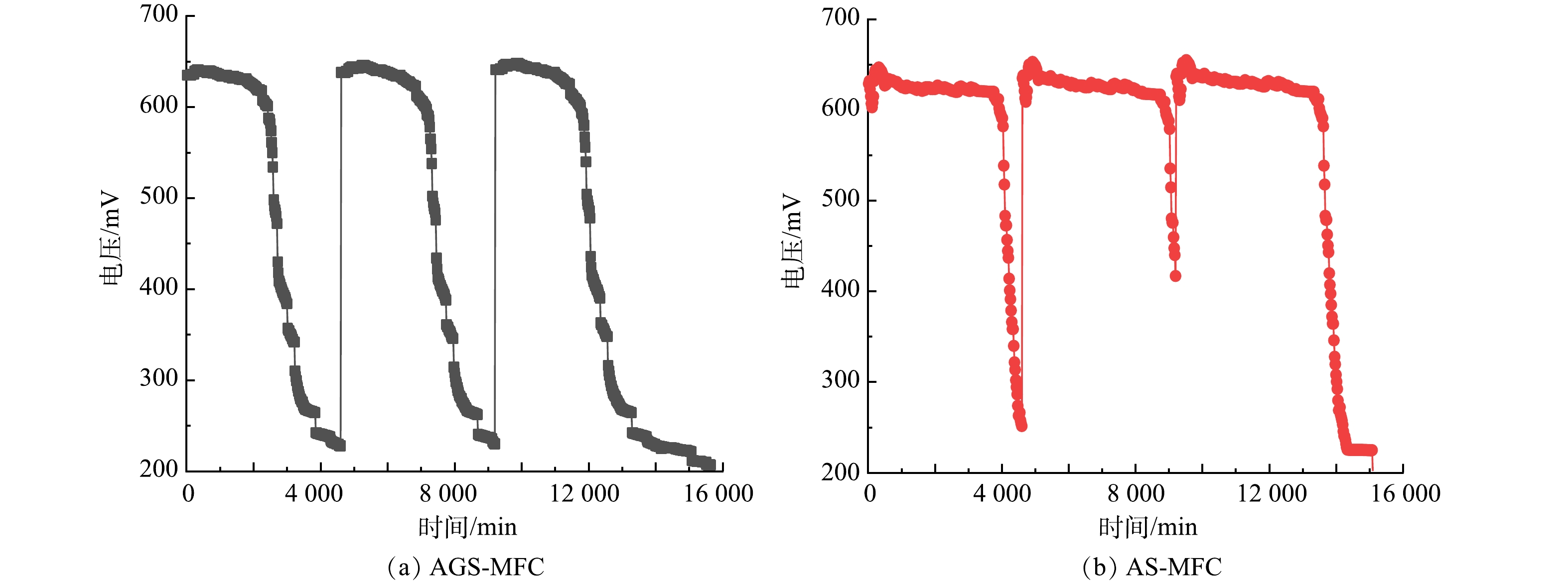
1)输出电压和持续产电时间。图2是在SDZ为0 mg·L−1、以葡萄糖为唯一底物时AGS-MFC、AS-MFC的输出电压图。AGS-MFC和AS-MFC的最高输出电压分别为648 mV和655 mV;维持在200 mV以上的产电时间分别为97.8 h和98.8 h。
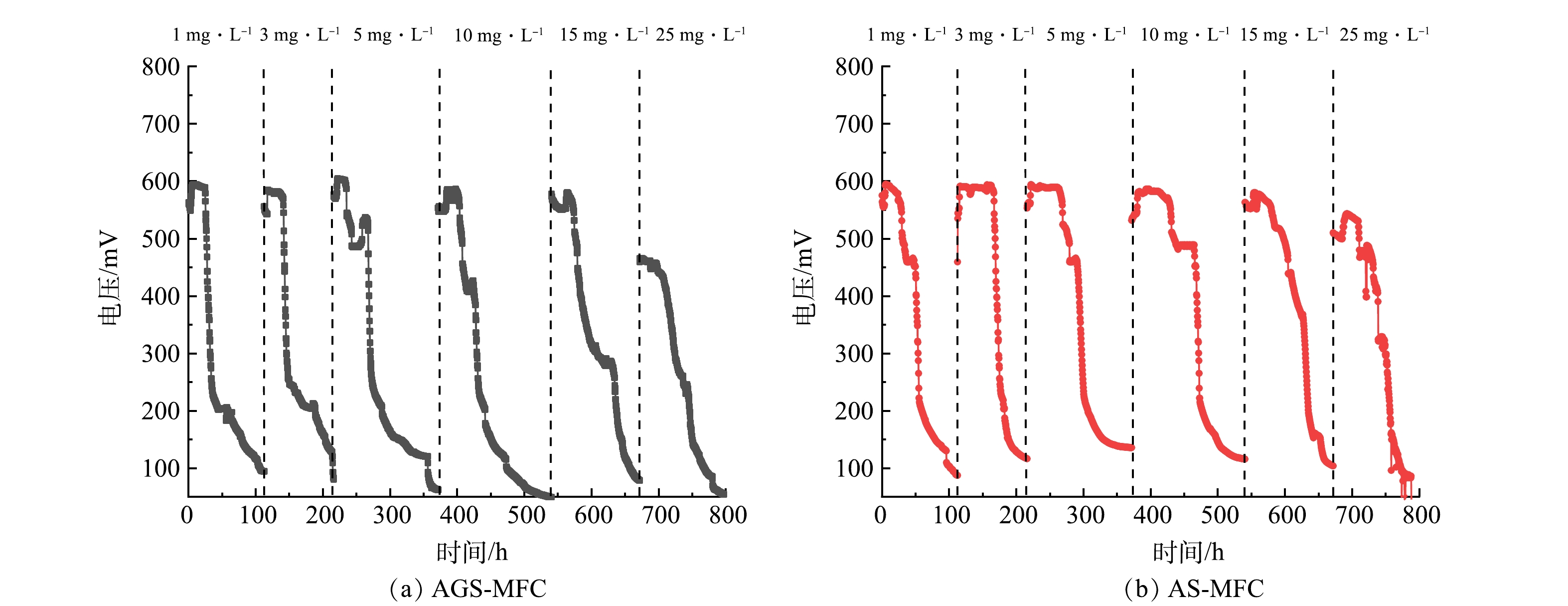
随SDZ浓度的增加,AGS-MFC、AS-MFC的输出电压的变化如图3所示。总体来看,当加入1 mg·L−1抗生素时,AGS-MFC与AS-MFC的输出电压的变化趋势一致,与不添加SDZ相比均略有下降;当SDZ添加量为1、3、5、10、15 mg·L−1时2组MFC的产电没有明显变化,但当SDZ加入量为25 mg·L−1时,可以观察到2组体系输出电压的明显下降。当加入1 mg·L−1 SDZ时,AGS-MFC的最高输出电压594 mV,维持在200 mV以上的产电时间为58.7 h,AS-MFC的最高输出电压为595 mV,维持在200 mV以上的产电时间为59.3 h。输出电压值与产电时间的降低说明SDZ可能对2组MFCs中的产电微生物均产生了抑制作用。
当SDZ添加量继续增加为3、5、10、15 mg·L−1时AGS-MFC的最高输出电压分别为585、605、586和580 mV,AS-MFC的最高输出电压分别为591、594、586和580 mV;AGS-MFC保持在200 mV以上的产电时间分别为76.0、71.7、69.0和96.3 h,AS-MFC保持在200 mV以上的产电时间分别为70.0、90.4、105.0和94.3 h。输出电压值与产电时长的提升表明,MFC中的微生物一定程度上可以适应有SDZ的环境,这与HARNISCH等[11]的研究结果一致。SDZ的加入导致竞争种群减少,SDZ降解的中间产物可以作为中介体,促进电子从细菌到电极的传递从而弥补了抗生素本身的抑制作用[12-13]。但当加入25 mg·L−1 SDZ时,由于高浓度SDZ对产电菌的影响,AGS-MFC与AS-MFC的产电均明显下降;AGS-MFC最高输出电压下降为465 mV,AS-MFC的产电均明显下降为543 mV;保持在200 mV以上的产电时间AGS-MFC为74.0 h、AS-MFC为84.0 h。
2)输出功率。以稳态放电法测试不同阻值外接电阻下的稳定输出电压值,结果如图4所示。AGS-MFC、AS-MFC电压随外电阻的变化趋势一致。在外接电阻R小于1 000 Ω时,输出电压均随着R的增大而迅速增大;当外接电阻R大于1 000 Ω后,AGS-MFC、AS-MFC的输出电压均随R的增大缓慢增加,并趋于稳定。
在外接电阻R为1 000 Ω时,当SDZ添加量为0、1、3、5、10、15、25 mg·L−1时AGS-MFC的输出电压值分别为614、582、623、592、587、578和511 mV,AS-MFC的输出电压值分别为603、586、625、591、584、571和467 mV。当R为9 000 Ω时,在SDZ添加量为0、1、3、5、10、15、25 mg·L−1时,AGS-MFC的输出电压分别为711、676、725、689、679、671和630 mV,AS-MFC的输出电压分别为698、671、727、680、674、664和621 mV。结果表明,2组MFC体系都在SDZ浓度为3 mg·L−1时有最高电压,在SDZ浓度为25 mg·L−1时输出电压值最低,产电效果最差。
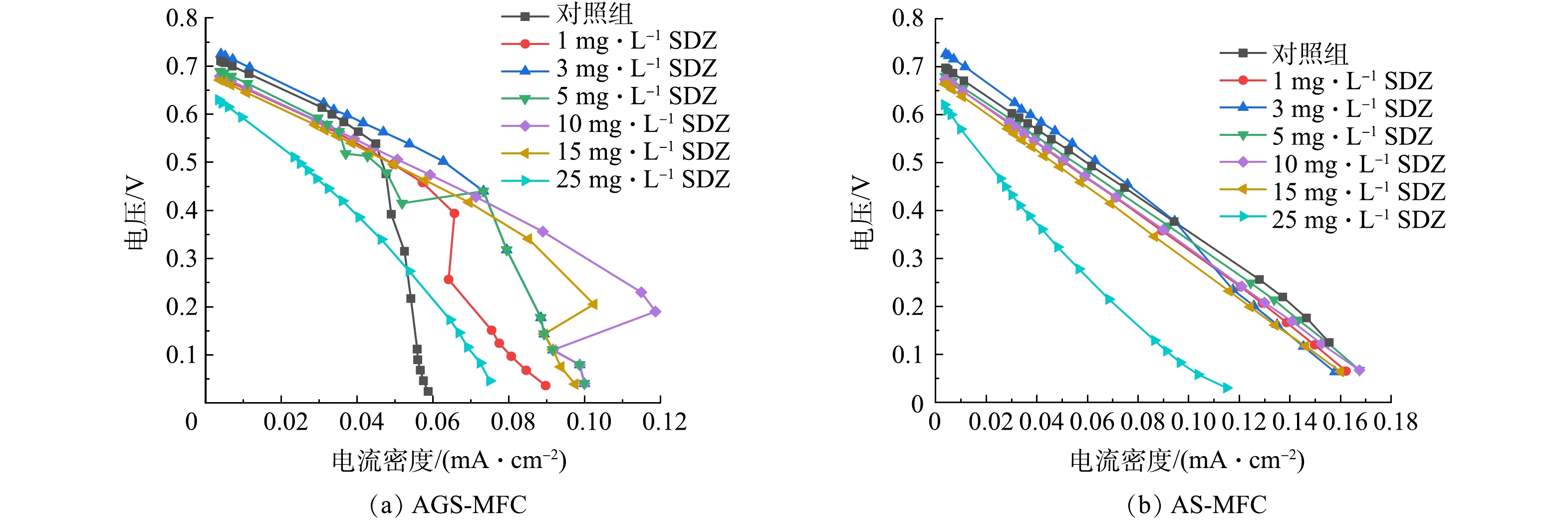
根据不同外电阻时测定的输出电压,计算出各点的电流密度、功率密度,绘制出图5极化曲线和图6功率密度曲线。如图5所示,AGS-MFC在1、10、15 mg·L−1时出现电流密度先增大后回折的现象,而AS-MFC在SDZ任何浓度的添加量时均呈现出电流密度随电压增大而减小的趋势。当SDZ添加量为0、1、3、5、10、15、25 mg·L−1时通过Origin拟合出AGS-MFC的Vmax(最高输出电压)分别为727、691、741、706、694、686和652 mV;AS-MFC的Vmax分别为712、687、743、694、689、678和641 mV。2组MFC体系均在SDZ浓度为3 mg·L−1时取得最高输出电压。
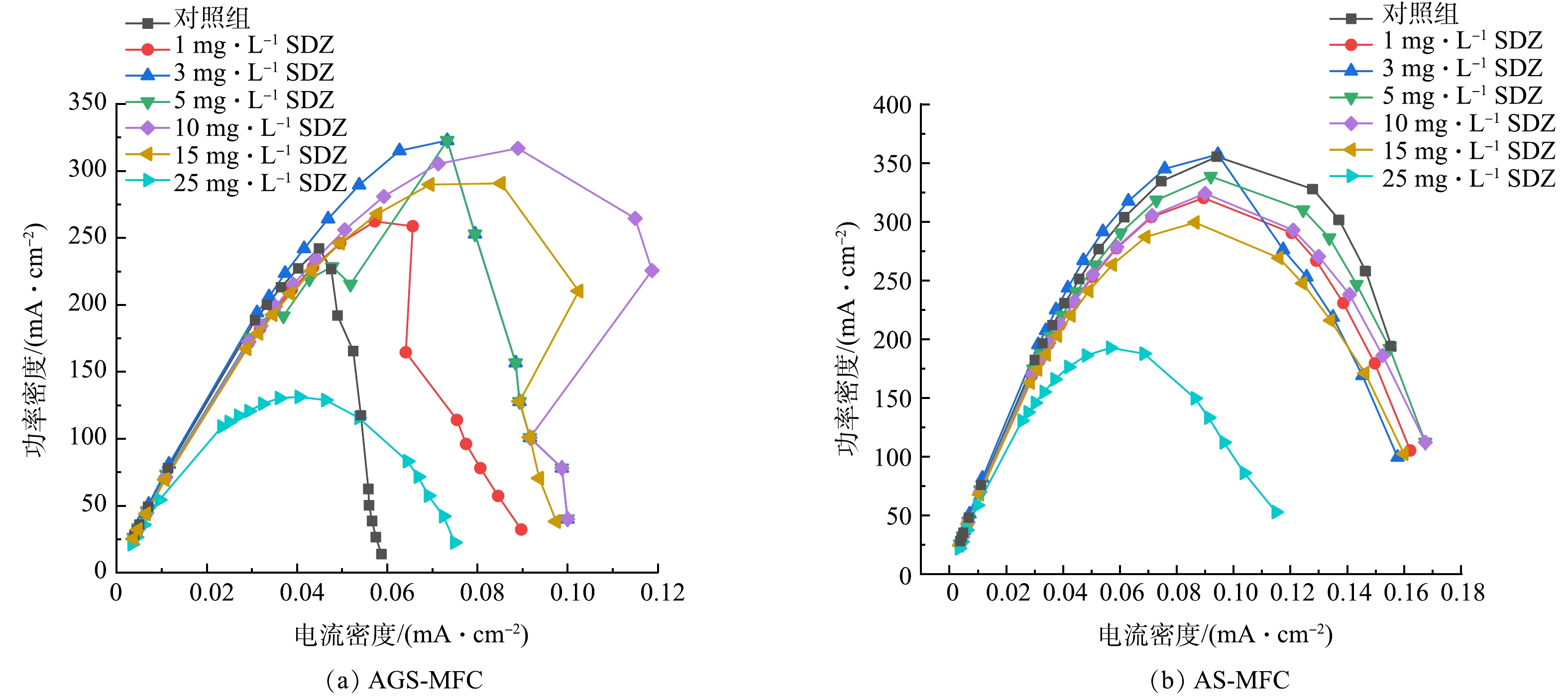
AGS-MFC与AS-MFC在不同SDZ浓度下的功率密度曲线如图6。功率密度曲线变化与极化曲线相同,在AGS-MFC体系中,同样在1、10、15 mg·L−1时随输出电压的降低电流密度先增大后发生回折,这是微生物燃料电池研究中常出现的一种现象。研究表明,功率密度曲线回折现象出现的主要原因可分为生物因素与非生物因素的影响[14];回折现象的出现限制了MFC的最大功率。
SDZ添加量为0、1、3、5、10、15、25 mg·L−1时,A(责任编辑 曲娜)GS-MFC的最大功率密度分别为242、262、323、229、317、291和131 mW·m−2;AS-MFC最大功率密度分别为355、320、357、339、324、299和193 mW·m−2。AGS-MFC由于功率密度回折限制了最大功率,但2组MFC体系均在SDZ浓度为3 mg·L−1时取得最大功率323 mW·m−2、357 mW·m−2,这说明一定浓度的SDZ对阳极微生物的产电具有一定的促进作用。
-
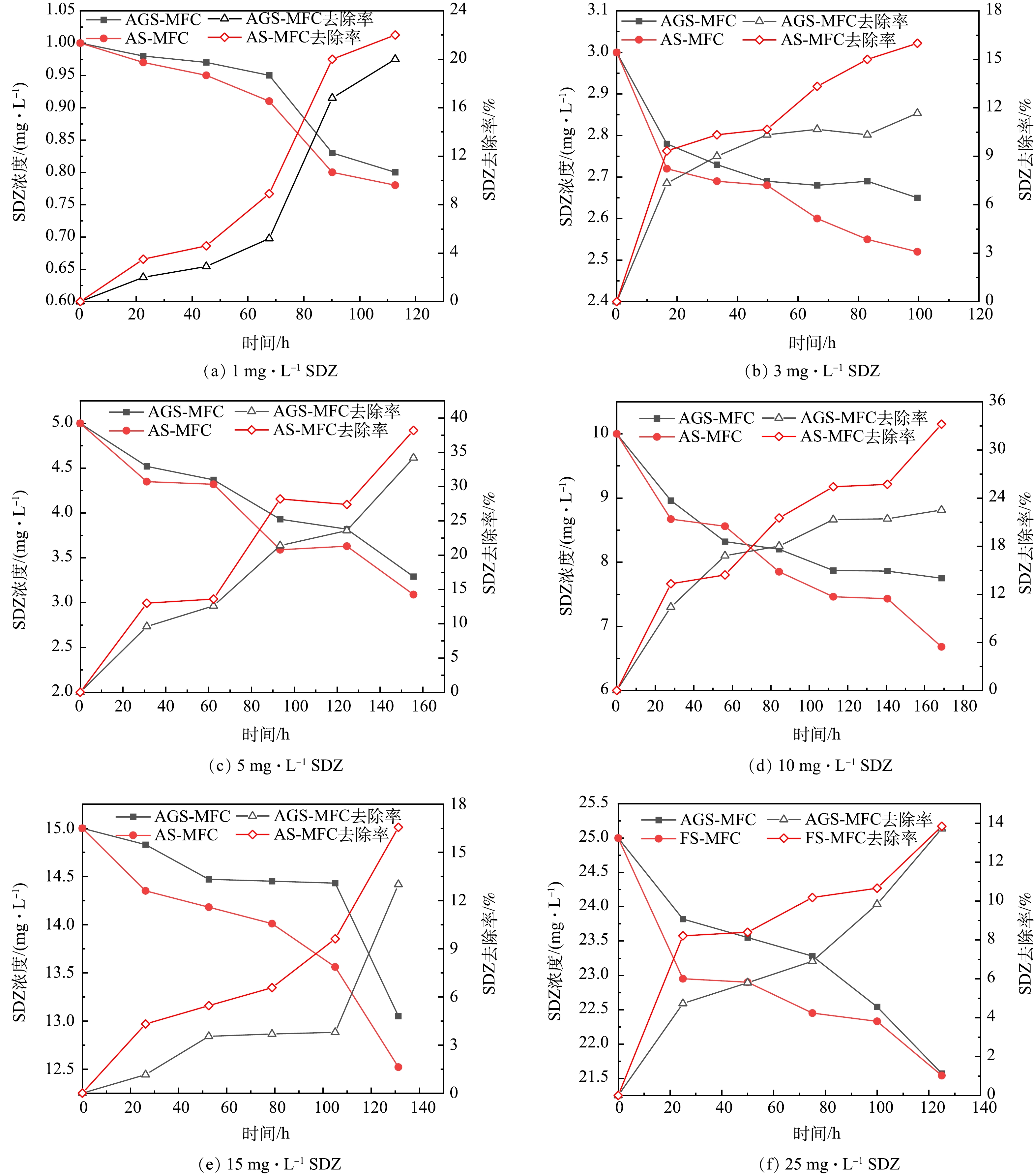
1)磺胺嘧啶的去除。由LC-MS检测出的响应值,根据标准曲线推算浓度再计算得到SDZ去除率。图7为SDZ在2组MFC体系中的SDZ变化曲线与去除率曲线图。SDZ在2组MFC体系中均可有效降解,AS-MFC的去除率均高于AGS-MFC。当加入不同浓度的SDZ时,在产电周期内,SDZ的降解分别为:当加入1 mg·L−1 SDZ时,AGS-MFC、AS-MFC的去除率分别为20.00%、22.12%;当加入3 mg·L−1 SDZ时,AGS-MFC、AS-MFC的去除率分别为11.67%、16.01%;当加入5 mg·L−1 SDZ时,AGS-MFC、AS-MFC的去除率分别为34.20%、38.20%;当加入10 mg·L−1 SDZ时,AGS-MFC、AS-MFC的去除率分别为22.51%、33.20%;当加入15 mg·L−1 SDZ时,AGS-MFC、AS-MFC的去除率分别为13.02%、16.56%;当加入25 mg·L−1 SDZ时,AGS-MFC、AS-MFC的去除率分别为13.72%、13.84%。
结果表明,在SDZ添加量为1~25 mg·L−1内,AS-MFC的去除率均高于AGS-MFC。推测原因有两方面,一方面结合AS-MFC的产电在各个添加量情况下均高于AGS-MFC,较高的电子转移量强化了阳极细菌的繁殖,加速了阳极室中微生物对有机底物的分解过程,从而产生了更多电子,进一步促进抗生素的降解[15];也有研究表明产电微生物活性越好,对污染物的降解效率越高[16-17]。另一方面,当在阳极室加入SDZ时,一部分SDZ会被吸附在微生物与电极上,这种吸附也会降低LC-MS对SDZ的响应值,实际SDZ并没有被真正降解,而是在后续的脱落过程中得到缓慢降解。数据分析发现,AS-MFC、AGS-MFC均在5 mg·L−1时达到最高去除率,这说明在AS-MFC、AGS-MFC中的微生物对SDZ产生了一定程度的适应性,但当加入25 mg·L−1 SDZ时,AGS-MFC、AS-MFC的去除率都显著下降,仅为13.72%、13.84%,产电也出现了明显下降,这说明过高的SDZ浓度抑制了2组MFC中产电菌与非产电菌的活性。
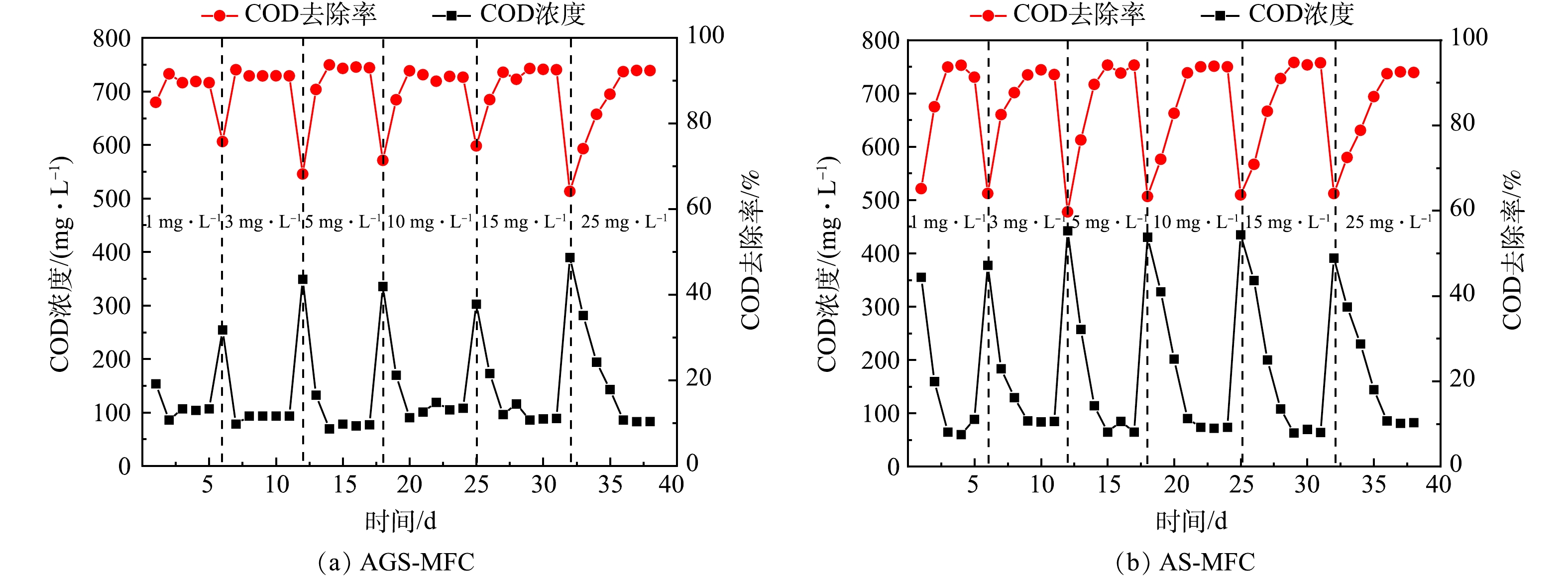
2) COD的去除。不同浓度SDZ添加情况下2组MFC稳定运行12 h后的COD的去除率如图8所示。在各浓度下AGS-MFC的COD去除率均大于AS-MFC,但在较高SDZ浓度下两者COD去除率均明显下降。从图8可以看到,12 h时,当SDZ添加量为1、3、5、10、15、25 mg·L−1时AGS-MFC的COD去除率分别为84.95%、75.78%、68.21%、71.40%、74.76%和64.15%,AS-MFC的COD去除率分别为65.18%、64.03%、59.71%、63.32%、63.71%和64.01%;在各浓度下AGS-MFC的去除率均大于AS-MFC,这是由于AGS具有更强的耐冲击负荷能力,但在高浓度SDZ的冲击下,AGS的活性也受到影响;SDZ的添加量为25 mg·L−1时,AGS-MFC、AS-MFC的COD去除率均明显下降。
在产电周期结束后,2组MFC中COD的最终去除率均能维持在90%以上。SDZ添加量为1、3、5、10、15、25 mg·L−1时,AGS-MFC的COD去除率分别为89.53%、91.12%、93.00%、90.79%、92.57%和92.36%,AS-MFC的COD去除率分别为91.30%、91.90%、94.11%、93.71%、94.66%和92.39%。考虑到2组体系对SDZ的去除率,可以发现去除的COD主要来自于葡萄糖的贡献;产电微生物通过降解葡萄糖与SDZ实现自身代谢、增殖与电流输出。
-
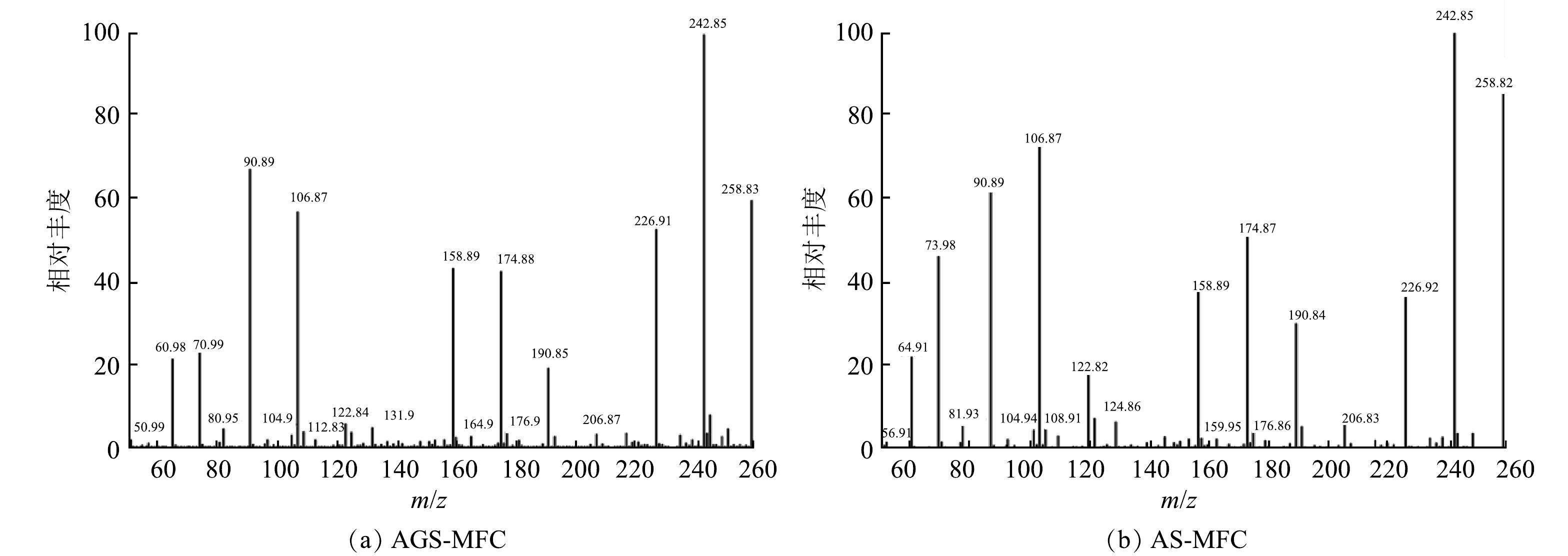
在SDZ浓度为25 mg·L−1的产电周期结束后,取AGS-MFC、AS-MFC的上清液对中间产物进行测定,得到的液质分析结果如图9。结合图9的质谱图分析,SDZ的m/z为250,在降解过程中产生了9种可能的中间产物,其m/z分别为73.98、90.89、106.87、158.89、174.87、190.84、226.92、242.85、258.82。基于m/z推测出中间产物并对SDZ在MFC体系中的降解途径进行了推导,路径图如图10所示。推测SDZ可通过4种途径进行降解:1)SDZ的S-N键不稳定,容易发生断裂,断裂后生成对氨基苯磺酸(P2)和2-氨基嘧啶(2AP)[18]。对氨基苯磺酸(P2)可进行脱硫并伴随着电子的释放生成2-羟基-2,4-己二烯二酸(P3),并进一步降解生成1,2,4-BUTANETRIOL(P4)与一缩丁二醇(P5)。2)S-N键断裂后由SDZ生成的对氨基苯磺酸(P2)氨基官能团上的H原子被羟基取代生成P6,再进一步降解为小分子物质。3)在微生物菌群的代谢下2AP开环裂解生成链状化合物(P7),最终矿化生成CO2和H2O。4)SDZ中的S-N键断裂后,由于生成的2AP中嘧啶环的化学特征与苯环相似,且苯环上容易发生羟基化反应[19],因此,2AP可以形成偶氮化合物,进一步羟基化生成P8、P9、P10,再在体系中得到进一步降解。
-
通过SEM观察2组MFC投加SDZ前后阳极微生物的形态,结果见图11。在投加SDZ前,AGS-MFC与AS-MFC阳极的优势微生物均为单一形态微生物;微生物以杆状菌为主,AS-MFC球菌为优势微生物。投加SDZ后,AGS-MFC中AGS颗粒直径仍为2~3 mm,无变化,AGS-MFC中出现了球菌,阳极上同时附着有短杆菌、长丝菌、球菌。AS-MFC中球菌不再是优势微生物,能明显观察到长丝菌、短杆菌与球菌共存。两类MFC阳极均同时生长有短杆菌、长丝菌、球菌,微生物种群丰富。致密的生物膜覆盖了整个阳极表面,形成复杂结构;这些细胞相互粘连,对电子转移等物理化学性质具有良好的传导效果[15,20]。KIM等[21]认为,这些细菌能够将复杂的底物分解为更小分子质量的物质,小分子质量物质可以作为生物膜内电化学活性细菌的底物。
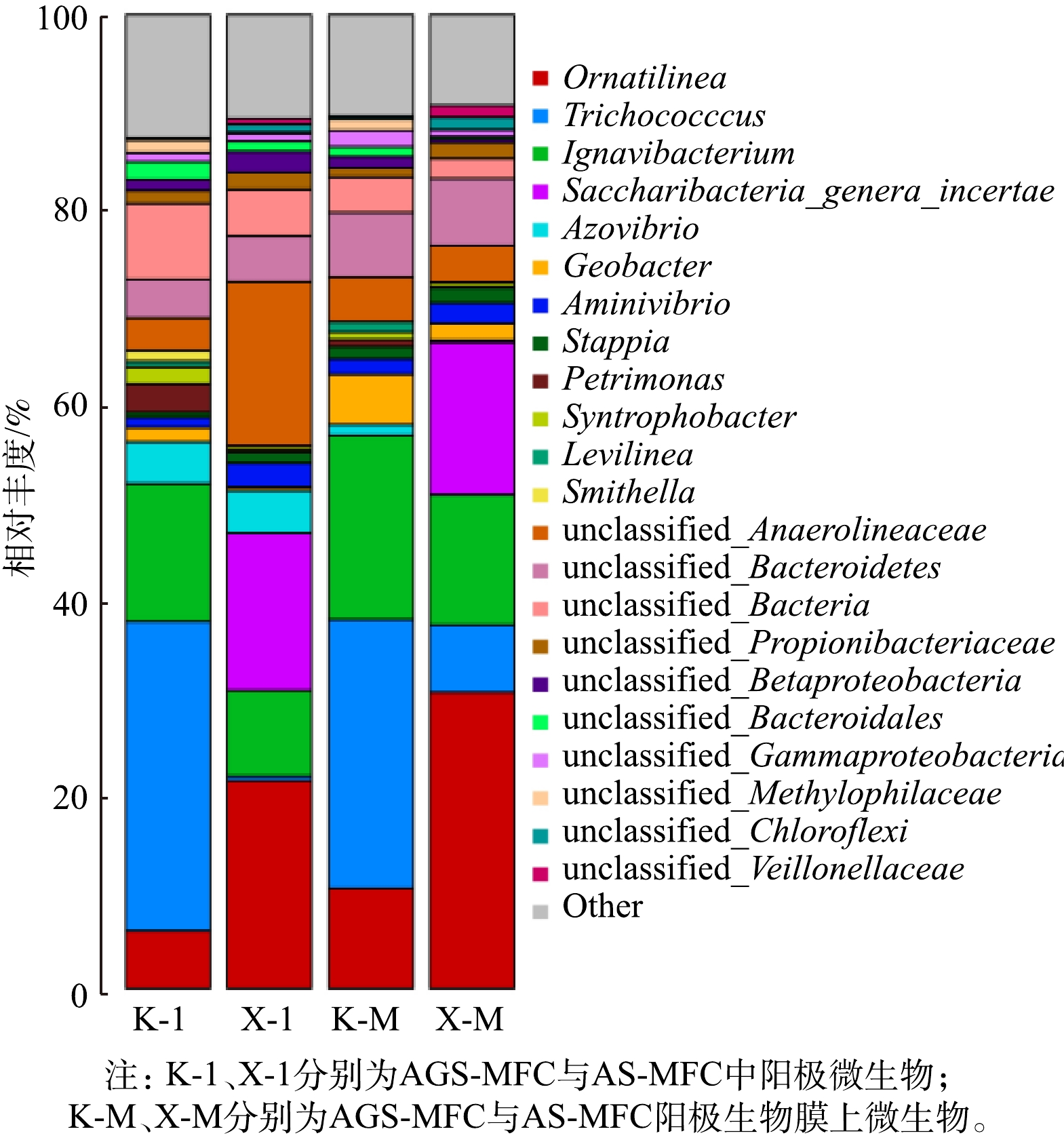
有机底物的变化会显著影响MFC阳极微生物群落结构。对AGS-MFC、AS-MFC处理SDZ后的阳极生物膜(分别为K-M和X-M)与阳极微生物(分别为K-1和X-1)进行了微生物测序,结果如图12和图13所示。2组污泥与阳极生物膜上的细菌种类与丰度基本一致,但AGS-MFC、AS-MFC的微生物群落有明显差异。在纲水平上,AGS的优势菌种是Bacilli (32%)、Ignavibacteria (14.13%)和Anaerolineae (10.07%)以及Betaproteobacteria (8.02%);AS中主要的菌种为Anaerolineae (39.29%)、Candidatus (16.16%)、Ignavibacteria (8.77%)以及Betaproteobacteria (8.59%)。
在属水平上,AGS优势种群为Trichococcus (31.76%)、Ignavibacterium (14.13%)、Ornatilinea (5.94%)、Azovibrio (4.27%)、Geobacter (1.49%)、Aminivibrio (1.03%);AS的优势种群为Ornatilinea (21.35%)、Saccharibacteria (16.16%)、Ignavibacterium (8.77%)、Azovibrio (4.39%)、Aminivibrio(2.46%)。微生物主要为反硝化菌、脱氮菌和脱硫菌等。Trichococcus为革兰氏阳性兼性厌氧菌,它具备反硝化脱氮能力的同时对复杂大分子有机物和胞外多糖也具有很强的分解能力[22-23]。Ignavibacterium属Uncultured Ignavibacterium sp.是一种鞭毛状兼性厌氧菌[24],能以含硫化合物作为电子供体去除体系中的难降解污染物,这种微生物可以通过硫的代谢同时将苯环降解开环来降解反应体系中的SDZ[25]。同时,Ignavibacterium是电化学活性菌,在生物电化学系统中,可以促进Ignavibacterium的生长,并起到强化污染物去除效果[26]。Ornatilinea属于Anaerolineaceae,可以将有机物转化为乙酸和其他挥发性脂肪酸[27];Ornatilinea对喹啉的降解起重要作用[28],SDZ的结构与喹啉相似,推测其对SDZ有一定降解作用。有研究[29]表明,在长期运行的廊道推流式生物电化学系统中,阳极生物膜也以Ornatilinea菌为主。固氮弧菌属Azovibria是革兰氏阴性曲状杆菌,多种有机物如葡萄糖、果糖、蔗糖、乙酸、延胡索酸和乙醇等均可被利用作碳源,氮源来源也十分广泛,如硝酸盐、氨和氨基酸等用于自身生长繁殖[30];Azovibria极有可能直接或间接影响阳极生物膜的胞外电子传递能力[31]。Aminivibrio是产氢产乙酸菌,是一种严格厌氧的弧菌[32],Aminivibrio可为电化学系统的产电提供良好的产电基质[33]。Geobacter是目前公认的产电菌,其传输电子效率高、产电能力强,Geobacter的电子传递不依赖于介体,是直接电子传递[34-35];Geobacter对难降解有机物,如氧氟沙星也有降解能力[36]。Saccharibacteria是污水处理厂常见的丝状菌,其具有代谢高分子有机物和难降解污染物的能力。因此,不同微生物处于不同生态位,在他们的协同作用下污染物去除率和能量输出效率更高。
-
1) MFC中的微生物在一定程度上可以适应有SDZ的环境,低浓度的SDZ对阳极微生物的产电具有一定的促进作用;2组体系中的功率密度曲线与极化曲线、产电趋势一致;但当SDZ浓度为25 mg·L−1时会影响微生物的活性及产电。当加入25 mg·L−1 SDZ时,AGS-MFC、AS-MFC的产电均明显下降,最高输出电压下降为465 mV和543 mV,保持在200 mV以上的产电时间分别为74 h和84 h。
2) SDZ在2组MFC体系中均可以降解。在1~25 mg·L−1内,AS-MFC中的SDZ去除率均高于AGS-MFC。当SDZ添加量为1、3、5、10、15、25 mg·L−1时,AGS-MFC对SDZ的去除率分别为20.00%、11.67%、34.20%、22.50%、13.00%和13.72%。AS-MFC对SDZ的去除率分别为22.12%、16.00%、38.20%、33.20%、16.56%和13.84%。
3)在加入SDZ后,AGS-MFC、AS-MFC中微生物为多种形态的微生物共存;微生物的协同作用实现了有机物降解与电能输出;AGS-MFC、AS-MFC中微生物种类基本一致,但优势菌有所不同。在属水平上,AGS优势种群为Trichococcus (31.76%)、Ignavibacterium (14.13%)、Ornatilinea (5.94%)、Azovibrio (4.27%)、Geobacter (1.49%)、Aminivibrio (1.03%);AS中优势种群为Ornatilinea (21.35%)、Saccharibacteria (16.16%)、Ignavibacterium (8.77%)、Azovibrio (4.39%)、Aminivibrio (2.46%)。
厌氧颗粒污泥与活性污泥微生物燃料电池对磺胺嘧啶的去除性能比较
Comparative performance of sulphadiazine removal between anaerobic granular sludge and activated sludge microbial fuel cell
-
摘要: 比较研究厌氧颗粒污泥微生物燃料电池(AGS-MFC)与活性污泥微生物燃料电池(AS-MFC)处理废水时的产电、有机物及抗生素去除性能可拓展MFC可能的应用场景。为此,该研究对比考察了2组相同的双室H型MFC(COD为(1 000±20) mg·L−1)对含不同浓度磺胺嘧啶(sulfadiazine,SDZ)废水的产电性能、有机物、SDZ的去除性能以及加入SDZ后微生物种群的变化。结果表明:低浓度SDZ对2组MFC阳极微生物的产电均具有一定的促进作用;但当SDZ浓度为25 mg·L−1时会影响产电微生物活性及产电性能,AGS-MFC、AS-MFC的产电量均明显下降。SDZ在2组MFC体系中均可降解,SDZ在1~25 mg·L−1内,AS-MFC对SDZ去除率均高于AGS-MFC,但COD去除率略低;在较高SDZ浓度下2组COD去除率均下降;产电周期结束后,2组MFC中COD的最终去除率均稳定维持在90%左右。在SDZ添加量为1、3、5、10、15、25 mg·L−1时,AGS-MFC对COD去除率分别为89.53%、91.12%、93.00%、90.79%、92.57%和92.36%,AS-MFC对COD去除率分别为91.30%、91.90%、94.11%、93.71%、94.66%和92.39%。加入SDZ后,AGS-MFC、AS-MFC中的微生物由单一形态微生物变为多种形态微生物共存;AGS-MFC、AS-MFC中的微生物优势种群不同;在纲水平上,AGS-MFC的优势菌为Bacilli (32.00%)、Ignavibacteria (14.13%)和Anaerolineae (10.07%)、Betaproteobacteria (8.02%);AS-MFC优势菌为Anaerolineae (39.29%)、Candidatus (16.16%)、Ignavibacteria (8.77%)、Betaproteobacteria (8.59%)。在属水平上,AGS-MFC优势种群为Trichococcus (31.76%)、Ignavibacterium (14.13%)、Ornatilinea (5.94%)、Azovibrio (4.27%)、Geobacter (1.49%)、Aminivibrio (1.03%);AS-MFC优势种群为Ornatilinea (21.35%)、Saccharibacteria (16.16%)、Ignavibacterium (8.77%)、Azovibrio (4.39%)、Aminivibrio (2.46%)。以上研究结果表明AGS-MFC和AS-MFC均可用于处理含SDZ的有机废水并产电。Abstract: The comparative study of electricity production, organic matter and antibiotic removal performance between anaerobic granular sludge microbial fuel cell (AGS-MFC) and activated sludge microbial fuel cell (AS-MFC) can expand the possible application of MFC. Two identical sets of double-chamber H-type MFC comparison experiments were used to study the power generation from wastewater with COD value of (1 000±20) mg·L−1 and different content of sulfadiazine (SDZ), organic matter and SDZ removal, and the change in microbial population structure after SDZ addition. The results showed that SDZ with low concentration could promote the power production of anode microorganisms in two MFCs; but SDZ with the antibiotic concentration of 25 mg·L−1 could affect the activity and power producing performance of microorganisms, an obvious decrease occurred in the power production of AGS-MFC and AS-MFC. SDZ could be degraded in both MFC systems. For SDZ at 1~25 mg·L−1 concentrations, its removal rate by AS-MFC was higher than AGS-MFC, but the COD removal rates were slight low; at the higher SDZ concentration, the COD removal rates of both MCFs decreased; after power production cycle, the final removal rates of COD in both MFCs were stable at about 90 %. The COD removal rates of AGS-MFC and AS-MFC at SDZ addition of 1, 3, 5, 10, 15 and 25 mg·L−1 were 89.53%, 91.30%; 91.12%, 91.90%; 93.00%, 94.11%; 90.79%, 93.71%; 92.57%, 94.66%; 92.36% and 92.39%, respectively. After SDZ addition, the microorganisms in AGS-MFC and AS-MFC all changed from a single morphological one to multiple morphological ones coexisting. At the class level, the predominant species of AGS-MFC were mainly Bacilli (32.00%), Ignavibacteria (14.13%), Anaerolineae (10.07%), and Betaproteobacteria (8.02%); the predominant species in AS-MFC were Anaerolineae (39.29%), Candidatus (16.16%), Ignavibacteria (8.77%), and Betaproteobacteria (8.59%). At the genus level, the main dominant populations of AGS-MFC were Trichococcus (31.76%), Ignavibacterium (14.13%), Ornatilinea (5.94%), Azovibrio (4.27%), Geobacter (1.49%), and Aminivibrio (1.03%). The main predominant populations in the AS-MFC were Ornatilinea (21.35%), Saccharibacteria (16.16%), Ignavibacterium (8.77%), Azovibrio (4.39%), and Aminivibrio (2.46%). Both AGS-MFC and AS-MFC can be used to treat organic wastewater containing SDZ and produce electricity.
-
Key words:
- anaerobic granular sludge /
- activated sludge /
- microbial fuel cell /
- sulfadiazine /
- wastewater treatment
-

-
-
[1] AMARASIRI M, SANO D, SUZUKI S. Understanding human health risks caused by antibiotic resistant bacteria (ARB) and antibiotic resistance genes (ARG) in water environments: Current knowledge and questions to be answered[J]. Critical Reviews in Environmental Science and Technology, 2020, 50(19): 2016-2059. doi: 10.1080/10643389.2019.1692611 [2] WANG C F, LI Y Y, LI A H, et al. Degradation of COD in antibiotic wastewater by a combination process of electrochemistry, hydroxyl-functionalized ball-milled zero-valent iron/Fe3O4 and oxone[J]. Environmental Technology, 2022, 20: 1-12. [3] NIU J, MA Z, ZHANG Y, et al. Optimization of microwave process parameters in preparation of Ni-Fe hydrotalcite by response surface methodology and evaluation of photocatalytic degradation of antibiotic wastewater[J]. Integrated Ferroelectrics, 2022, 228(1): 192-201. doi: 10.1080/10584587.2022.2072134 [4] YANG Y, OK Y S, KIM K, et al. Occurrences and removal of pharmaceuticals and personal care products (PPCPs) in drinking water and water/sewage treatment plants: A review[J]. Science of the Total Environment, 2017, 596-597: 303-320. doi: 10.1016/j.scitotenv.2017.04.102 [5] WANG L, LIU Y, MA J, et al. Rapid degradation of sulphamethoxazole and the further transformation of 3-amino-5-methylisoxazole in a microbial fuel cell[J]. Water Research, 2016, 88: 322-328. doi: 10.1016/j.watres.2015.10.030 [6] WANG L, YOU L, ZHANG J, et al. Biodegradation of sulfadiazine in microbial fuel cells: reaction mechanism, biotoxicity removal and the correlation with reactor microbes[J]. Journal of Hazardous Materials, 2018, 360: 402-411. doi: 10.1016/j.jhazmat.2018.08.021 [7] AGHABABAIE M, FARHADIAN M, JEIHANIPOUR A, et al. Effective factors on the performance of microbial fuel cells in wastewater treatment–a review[J]. Environmental Technology Reviews, 2015, 4(1): 71-89. doi: 10.1080/09593330.2015.1077896 [8] ZHAO N, TREU L, ANGELIDAKI I, et al. Exoelectrogenic anaerobic granular sludge for simultaneous electricity generation and wastewater treatment[J]. Environmental Science & Technology, 2019, 53: 12130-12140. [9] HUANG J, YANG P, GUO Y, et al. Electricity generation during wastewater treatment: An approach using an AFB-MFC for alcohol distillery wastewater[J]. Desalination, 2011, 276(1-3): 373-378. doi: 10.1016/j.desal.2011.03.077 [10] LIU S, LI L, LI H, et al. Study on ammonium and organics removal combined with electricity generation in continuous flow microbial fuel cell[J]. Bioresource Technology, 2017, 243: 1087-1096. doi: 10.1016/j.biortech.2017.07.071 [11] HAMISCH F, GIMKIEWICZ C, BOGUNOVIC B, et al. On the removal of sulfonamides using microbial bioelectrochemical systems[J]. Electrochemistry Communications, 2013, 26: 77-80. doi: 10.1016/j.elecom.2012.10.015 [12] DAN W, FSA B, FENG J, et al. Enhanced power generation in microbial fuel cell by an agonist of electroactive biofilm Sulfamethoxazole ScienceDirect[J]. Chemical Engineering Journal, 2019, 384. [13] JIAN S, XU W, PING Y, et al. Enhanced oxytetracycline removal coupling with increased power generation using a self-sustained photo-bioelectrochemical fuel cell[J]. Chemosphere, 2019, 221: 21-29. doi: 10.1016/j.chemosphere.2018.12.152 [14] WATSON V J, LOGAN B E. Analysis of polarization methods for elimination of power overshoot in microbial fuel cells[J]. Electrochemistry Communications, 2011, 13(1): 54-56. doi: 10.1016/j.elecom.2010.11.011 [15] KHAJEH R T, ABER S, NOFOUZI K, et al. Treatment of mixed dairy and dye wastewater in anode of microbial fuel cell with simultaneous electricity generation[J]. Environmental Science and Pollution Research, 2020, 27: 43711-43723. doi: 10.1007/s11356-020-10232-1 [16] HARTL M, BEDOYA-RIOS D, FEMANDEZ-GATELL M, et al. Contaminants removal and bacterial activity enhancement along the flow path of constructed wetland microbial fuel cells[J]. Science of the Total Environment, 2018, 652: 1195-1208. [17] IDRIS M O, KIM H C, YAQOOB A A, et al. Exploring the effectiveness of microbial fuel cell for the degradation of organic pollutants coupled with bio-energy generation[J]. Sustainable Energy Technologies and Assessments, 2022, 52: 102183. doi: 10.1016/j.seta.2022.102183 [18] TAO R, YING G G, SU H C, et al. Detection of antibiotic resistance and tetracycline resistance genes in Enterobacteriaceae isolated from the Pearl rivers in South China[J]. Environmental Pollution, 2010, 158(6): 2101-2109. doi: 10.1016/j.envpol.2010.03.004 [19] ZHANG Y, HU S, ZHANG H, et al. Degradation kinetics and mechanism of sulfadiazine and sulfamethoxazole in an agricultural soil system with manure application[J]. Science of the Total Environment, 2017, 607-608: 1348-1356. doi: 10.1016/j.scitotenv.2017.07.083 [20] 丁予涵, 胡 翔. 微生物燃料电池去除水中低含量头孢他啶研究[J]. 水处理技术, 2021, 47(4): 40-44. [21] KIM B H, PARK H S, KIM H J, et al. Enrichment of microbial community generating electricity using a fuel-cell-type electrochemical cell[J]. Applied Microbiology & Biotechnology, 2004, 63(6): 672-681. [22] 林惟实, 何春华, 王传亚, 等. 餐厨发酵液强化喹啉降解和反硝化脱氮[J]. 工业水处理, 2021, 41(7): 94-99. [23] HAN F, ZHANG M, SHANG H, et al. Microbial community succession, species interactions and metabolic pathways of sulfur-based autotrophic denitrification system in organic-limited nitrate wastewater[J]. Bioresource Technology, 2020, 315: 123-126. [24] LIU Z, NIRLS-ULRIK F, KAJETAN V, et al. Complete genome of Ignavibacterium album, a metabolically versatile, flagellated, facultative anaerobe from the Phylum Chlorobi[J]. Frontiers in Microbiology, 2012, 185(3): 1-19. [25] 郑杰蓉, 汪素芳, 赵晓婵, 等. 厌氧反硝化体系对磺胺嘧啶的共代谢降解特性[J]. 科学技术与工程, 2020, 20(35): 14760-14766. doi: 10.3969/j.issn.1671-1815.2020.35.060 [26] 万 辉, 易筱筠, 刘小平, 等. 施加不同电压对河涌底泥中多氯联苯还原脱氯的影响[J]. 环境工程学报, 2018, 12(2): 581-589. doi: 10.12030/j.cjee.201707180 [27] CARVALHO J, AMARAL F M, FLORENCIO L, et al. Microaerated UASB reactor treating textile wastewater: The core microbiome and removal of azo dye Direct Black 22[J]. Chemosphere, 2020, 242: 125157.1-125157.8. [28] WANG S, ZHAO Q, JIANG J, et al. Insight into the organic matter degradation enhancement in the bioelectrochemically-assisted sludge treatment wetland: Transformation of the organic matter and microbial community evolution[J]. Chemosphere, 2022, 290: 133259. doi: 10.1016/j.chemosphere.2021.133259 [29] 孙 茜. 廊道推流式生物电化学系统还原偶氮染料效能和机制研究[D]. 哈尔滨: 哈尔滨工业大学, 2017. [30] 丁飞杨. 潜流式生物滤池脱氮效能及微生物群落结构解析[D]. 西安: 西安建筑科技大学, 2018. [31] 梅晓雪. 温度与接种物对微生物燃料电池电极生物膜群落结构的影响[D]. 哈尔滨: 哈尔滨师范大学, 2015. [32] HONGDA T, FUJITA T, TONOUCHI A. Aminivibrio pyruvatiphilus gen. nov. , sp. nov. , an anaerobic, amino-acid-degrading bacterium from soil of a Japanese rice field[J]. International journal of systematic and evolutionary microbiology, 2013, 63(Pt_10): 3679-3686. [33] 于瑞娟. BES处理尿液的影响因素及能源回收资源化研究[D]. 西安: 陕西科技大学, 2019. [34] LOVLEY D R, UEKI T, TIAN Z, et al. Geobacter: the microbe electric's physiology, ecology, and practical applications[J]. Advances in Microbial Physiology, 2011, 59: 1-100. [35] 曹效鑫, 范明志, 梁 鹏, 等. 阳极电势对Geobacter sulfurreducens产电性能的影响[J]. 高等学校化学学报, 2009, 30(5): 983-987. doi: 10.3321/j.issn:0251-0790.2009.05.028 [36] 陶虎春, 马 骉, 丁凌云, 等. 两种喹诺酮类抗生素对Geobacter sulphurreducens PCA菌的影响研究[J]. 北京大学学报(自然科学版), 2018, 54(5): 1039-1045. -



 下载:
下载: