-
磺胺甲恶唑(sulfamethoxazole,SMX)是一种典型的磺胺类抗生素,由于其广谱抗菌性而被广泛用于治疗人类、畜牧业和水产养殖业的细菌感染[1-2]。 然而,由于SMX的大量使用及其低生物降解性, SMX在环境中被广泛检出[3],在不同水环境中的检出质量浓度从ng·L−1到µg·L−1不等[4-5]。 即使在痕量质量浓度下,SMX仍可诱导抗生素耐药细菌及抗性基因的产生,从而通过食物链对人类健康和生态系统造成潜在威胁[6]。因此,高效去除水环境中的SMX具有重要研究意义。
针对水环境中SMX的去除,传统水处理方法(生物法和吸附法)面临重大挑战。因SMX生物降解性差,现有生物处理工艺对其去除率低[7];同时,SMX的亲水性使其不易被活性炭吸附[8]。因此,近年来越来越多的研究集中于高级氧化技术(advanced oxidation process,AOPs)对水中SMX等有机微污染物的去除。在AOPs中,有机微污染物可通过强氧化剂高碘酸盐(periodate,PI)、过氧化氢(hydrogen peroxide,H2O2)、过氧乙酸(peroxyacetic acid,PAA)、次氯酸(hypochlorous acid,HClO)、过硫酸盐(persulfate,PS)等生成的高活性自由基降解[9–11]。PI作为固态氧化剂,因其良好的热稳定性及便于运输和储存而备受关注[12-13]。单独使用PI(E0=+1.6 V)氧化有机污染物的反应性有限,因此需要通过分子间或分子内电子转移活化PI,产生高活性物质[14],如碘酸根自由基(IO3·),羟基(·OH),单线态氧(1O2)等[15-16]。近年来,研究者致力于开发多种活化PI的方法,包括紫外(UV)[17–20]、太阳光[21]、低温等离子体[22]、过渡金属[13,23–26]和碳基材料[9,27-28]等。过渡金属活化PI因无需额外能量输入、操作简单等优点为PI活化提供了一种有效的途径[29]。
本研究探究了20种金属离子对PI的活化,发现Ru(Ⅲ)活化高碘酸盐对SMX的降解效果最佳。采用单因素变量法,初步探讨了Ru(Ⅲ)/PI体系中Ru(Ⅲ)浓度、PI浓度、初始pH以及水基质对SMX降解的影响,并考察了Ru(Ⅲ)/PI体系对于卡马西平(carbamazepine,CBZ)、环丙沙星(ciprofloxacin,CIP)、甲硝唑(metronidazole,MNZ)和甲氧苄啶(trimethoprim,TMP)的降解效能。考察了Ru(Ⅲ)/PI在不同实际水体中对SMX的去除效果。通过淬灭实验、探针实验和电子顺磁共振(electron paramagnetic resonance,EPR),研究Ru(Ⅲ)/PI体系中的活性物质及其反应机理,并探究了PI在Ru(Ⅲ)/PI体系中的转化。
-
实验中所使用的物质均为分析纯。高碘酸钠(NaIO4,99%)、三氯化钌(Ⅲ)水合物(RuCl3·2H2O,≥99.9%)、七水合硫酸亚铁(FeSO4·7H2O,≥99%)、氯化镉(CdCl2,99.9%)、二水氯化钡(BaCl2·2H2O,≥99%)、五水硫酸铜(CuSO4·5H2O,99%)、硫酸铬(Ⅲ)水合物(Cr2(SO4)3 · xH2O,99%)、氧化铝(Al2O3,99.99%)、硫酸银(Ag2SO4,99.9%)、九水硝酸铁(Fe(NO3)3·9H2O,99.9%)、七水硫酸钴(CoSO4·7H2O,≥99%)、六水硫酸镍(NiSO4·6H2O,99.9%)、氯化钇(YCl3,99.95%)、氯化镧(LaCl3,≥99.9%)、氯化锆(ZrCl4,98%)、钼酸铵((NH4)2MoO4,99.98%)、一水硫酸锰(MnSO4·H2O,99.9%)、氯化镁(MgCl2,≥98%)、二水氯化钙(CaCl2·2H2O,99%)、七水硫酸锌(ZnSO4·7H2O,≥99.95%)、氯化钯(PaCl2,99%)、磺胺甲恶唑(SMX,>99%)、卡马西平(CBZ,>99%)、环丙沙星(CIP,>99%)、甲硝唑(MNZ,>99%)、甲氧苄啶(TMP,>99%)、硝基苯(NB,>99%)、氯化钠(NaCl,99%)、碳酸氢钠(NaHCO3,99.7%)、腐殖酸(humic acid,HA,99%)、甲基苯基亚砜(methyl phenyl sulfoxide,PMSO,99%)、甲基苯基砜(methyl phenyl sulfone,PMSO2,99%)、叔丁醇(tert-butyl alcohol,TBA,99%)、糠醇(furfuryl alcohol,FFA,99%)、L-组氨酸(L-Histidine,L-his,99%)、2,2,6,6-四甲基-4-哌啶醇(TEMP,99.9%)。以上试剂均购至阿拉丁生化科技股份有限公司和Sigma Aldrich上海有限公司。使用磷酸二氢钠(NaH2PO4,99%)和磷酸氢二钠(Na2HPO4,99%)在超纯水中配制10.0 mmol·L−1 磷酸盐缓冲液(PB)。
地表水取自上海青浦区的淀山湖,二沉池出水取自上海某污水处理厂,在使用前,将收集到的水用0.22 μm滤膜过滤,然后添加初始浓度为10 μmol·L−1的SMX储备液。水质组分如表1所示。
-
高效液相色谱仪 (
1260 型,美国安捷伦), Zorbax SB-C18色谱柱(4.6 mm×250 mm,5μm)、pH测试仪(FE28K型,瑞士梅特勒托利多)、磁力搅拌器(84-1A型,上海司乐仪器有限公司)、电子天平(AW120型,日本岛津)、电子顺磁共振波谱仪(A300型,德国布鲁克)。 -
所有实验操作均在室温(25±2) ℃下进行,使用超纯水制备反应溶液。SMX降解动力学实验均在150 mL烧杯内进行,反应溶液体积均为100 mL,将烧杯置于200 r·min−1的恒温磁力搅拌器上,以确保反应溶液充分混合。在超纯水中加入0.01 mmol·L−1的目标污染物以及三氯化钌储备液,用10 mmol·L−1磷酸盐(PB)缓冲液调节反应pH,加入PI溶液即刻引发反应。于一定的时间点取样1 mL并经过0.45 μmol·L−1滤膜过滤于液相棕色进样瓶,立即加入0.1 mL浓度为100 mmol·L−1的Na2S2O3进行猝灭,样品于12 h内放置于高效液相色谱仪(HPLC)中进行定量分析。通过控制实验中的变量关系分别研究了Ru(Ⅲ)浓度、PI浓度、pH和水基质(Cl−、HCO3−和HA)等对反应降解效果的影响。
淀粉比色法:制备淀粉原液,将3g可溶性淀粉与10 mL超纯水混合,然后将混合物倒入90 mL沸水中大力搅拌。搅拌3 min后,将混合物冷却至室温备用。将等分的Ru(Ⅲ)/PI体系或I2溶液与新制备的淀粉原液混合,观察颜色。
-
在电子顺磁共振光谱仪(低温空位+配备牛津仪器液氦低温恒温器)上记录。使用1~20 mW的微波功率和100 kHz的场调制,振幅设置为1 G,获得了电子顺磁共振谱,每个EPR谱的g值是从使用EasySpin(v5.2.23)进行的模拟中提取的。
采用高效液相色谱法对目标污染物进行定量分析,目标污染物的测试参数如表2所示。
-
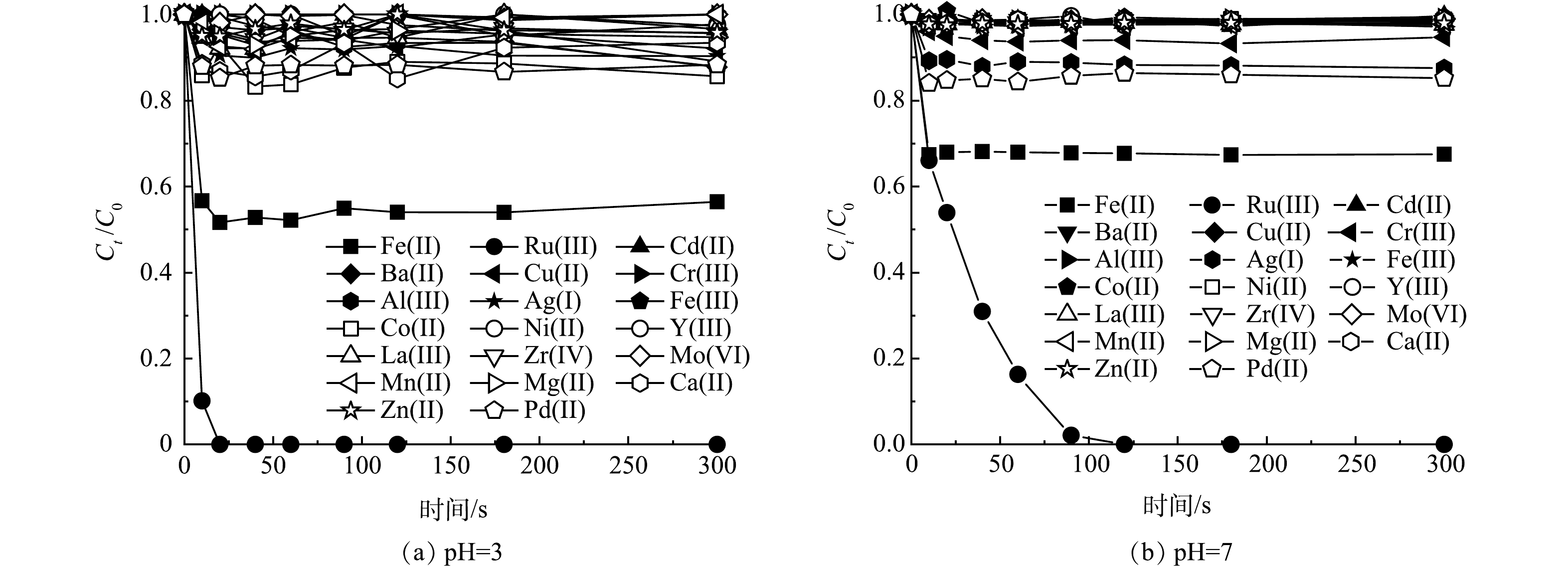
首先,研究了20种金属离子活化高碘酸盐来评估SMX的降解情况。实验设计采用了0.1 mmol·L−1金属离子和0.1 mmol·L−1 PI组合,SMX的浓度为0.01 mmol·L−1,在pH分别为3和7的条件下观察SMX的降解效果,结果如图1所示。
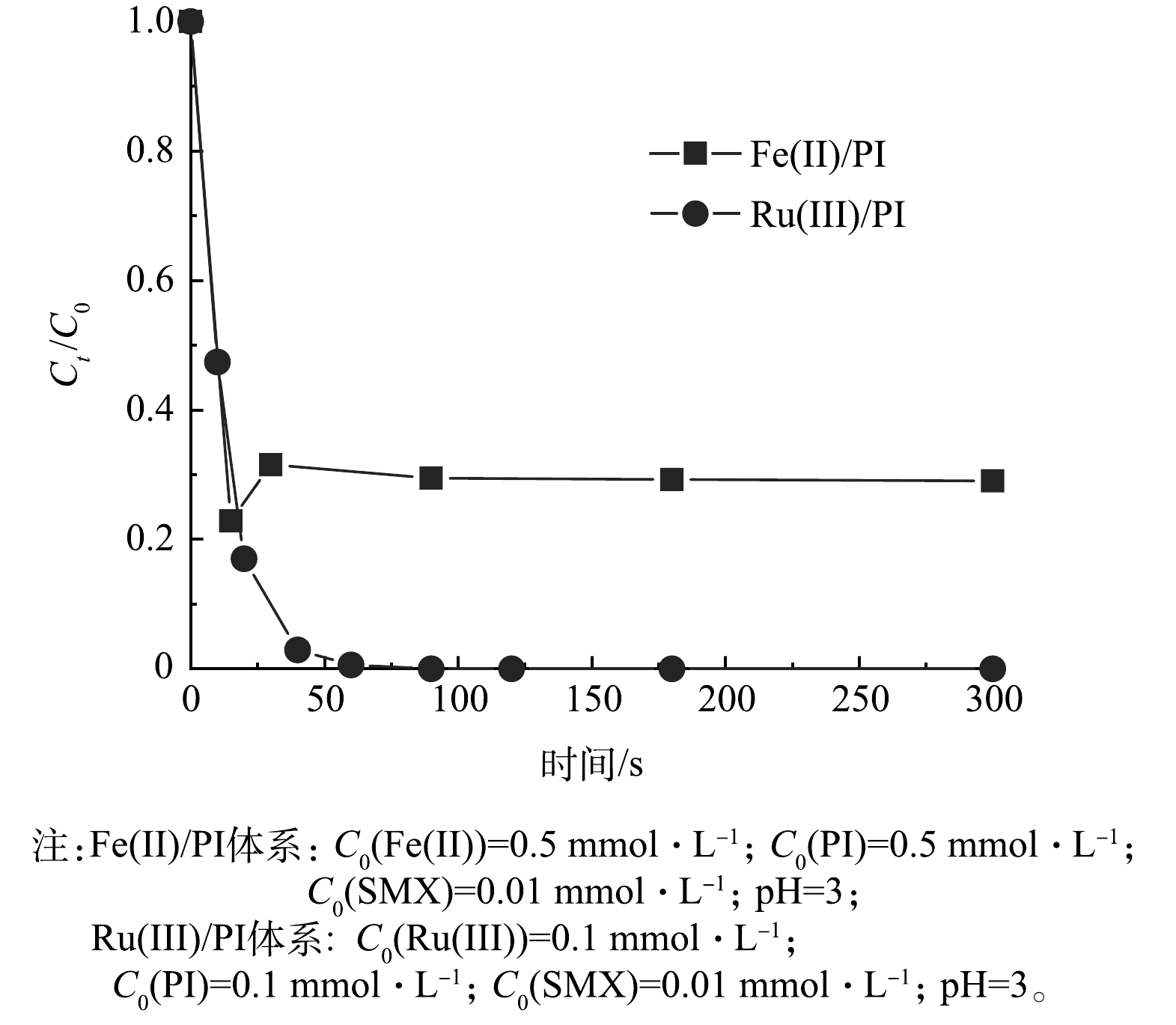
由图1(a)可知,在pH=3时,Cu(Ⅱ)、Cr(Ⅲ)、Ag(I)、Fe(Ⅲ)、Ni(Ⅱ)、Y(Ⅲ)、La(Ⅲ)、Zr(IV)、Mo(VI)、Mn(Ⅱ)、Zn(Ⅱ)、Mg(Ⅱ)和Ca(Ⅱ)活化PI对SMX的降解效率可忽略不计(5 min内<10.0%),尽管Cd(Ⅱ)、Ba(Ⅱ)、Al(Ⅲ)、Co(Ⅱ)和Pd(Ⅱ)活化PI在30 s内观察到约大于10.0%的SMX降解,但在更长时间(5 min)内并未见进一步去除,Fe(Ⅱ)与PI结合可部分去除SMX,降解率为43.2%。
由图1(b)可知, 在pH=7时, Cd(Ⅱ)、Ba(Ⅱ)、Cu(Ⅱ)、Cr(Ⅲ)、Al(Ⅲ)、Fe(Ⅲ)、Co(Ⅱ)、Ni(Ⅱ)、Y(Ⅲ)、La(Ⅲ)、Zr(IV)、Mo(VI)、Mn(Ⅱ)、Mg(Ⅱ)、Ca(Ⅱ)和Zn(Ⅱ)活化PI降解SMX的效果可忽略(5 min内<5.0%)。Ag(I)和Pd(Ⅱ)活化PI在30 s内降解SMX超过10.0%,但未见进一步降解SMX。同样,Fe(Ⅱ)可以活化PI部分降解 SMX,降解率为32.5%。
在pH为3和7的条件下, Ru(Ⅲ)/PI对SMX的降解在2 min内可达100%。这表明20种金属离子中,Ru(Ⅲ)对PI具有最高的催化活性。有研究表明,金属离子可与PI相互作用形成配合物,再经过电子转移生成活性物质(高价金属-氧或活性氧)[25,30-31]。根据配位化学原理,金属离子的配位能力与其电子结构之间存在密切关系,金属离子半径越小,金属带的电荷越多。如表3所示,Ru(Ⅲ)半径相对较小,这意味着其电荷更加集中,电荷密度较高,因此与PI的配位作用越强。
Fe(Ⅱ)和Ru(Ⅲ)均可以活化PI降解SMX,然而Fe(Ⅱ)在成本上更具优势。因此,探究了过量Fe(Ⅱ) (0.5 mmol·L−1)活化PI降解SMX的实验,结果如图2所示。尽管Fe(Ⅱ)浓度增加,SMX的降解效果仍未超过低浓度Ru(Ⅲ) (0.1 mmol·L−1)活化PI体系的降解效果。过量的Fe(Ⅱ)可能导致Fe(Ⅱ)与SMX发生不利的竞争反应[33], 从而影响SMX的降解效率。Ru(Ⅲ)具有较强的电子转移能力和稳定的催化特性[30],在催化降解过程中能高效地活化PI。此外,Ru(Ⅲ)的催化效率较高,也可能是由于其能够在较低浓度下保持较高的催化活性,而Fe(Ⅱ)则可能需要较高的浓度才能达到类似的效果。因此,尽管Fe(Ⅱ)的成本较低,但从催化效率和降解效果的角度来看,Ru(Ⅲ)在高碘酸盐活化降解SMX的过程中依然表现出了明显的优势。
-
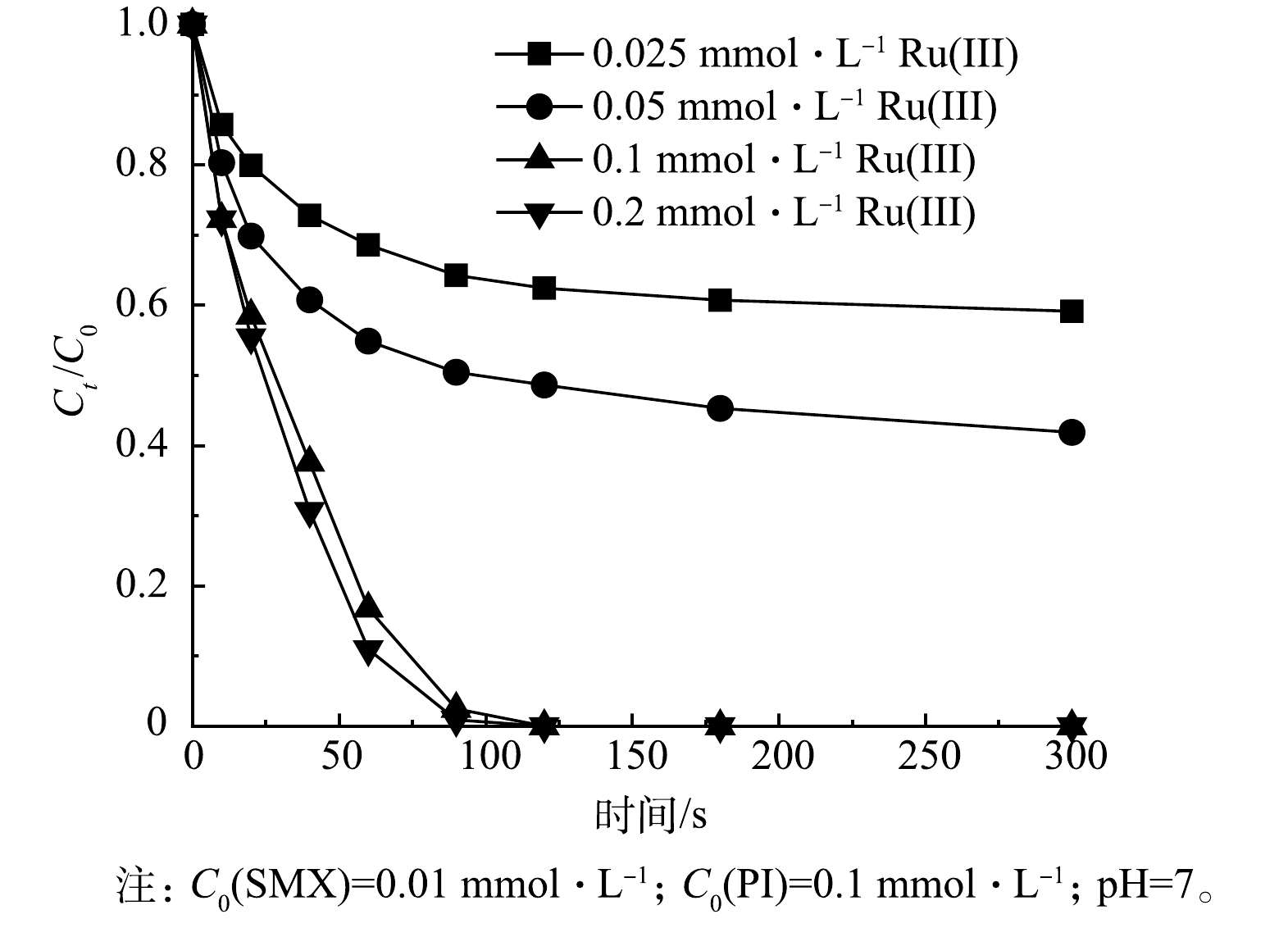
1) Ru(Ⅲ)浓度的影响。考察了不同Ru(Ⅲ)浓度(0.025、0.05、0.1、0.2 mmol·L−1)对Ru(Ⅲ)/PI体系降解SMX的影响,结果如图3所示。当Ru(Ⅲ)浓度由0.025 mmol·L−1增加到0.1 mmol·L−1时,在5 min内SMX的降解率由41.8%升至100%。这是由于当Ru(Ⅲ)的浓度增加时,在活化PI过程中会产生更多活性物种Ru(V)=O。然而,当Ru(Ⅲ)浓度继续增加至0.2 mmol·L−1时,Ru(Ⅲ)对SMX降解的促进作用有限,这可能是因为过量的Ru(Ⅲ)消耗了活性金属中间体[34],从而限制了体系中活性物质的生成。
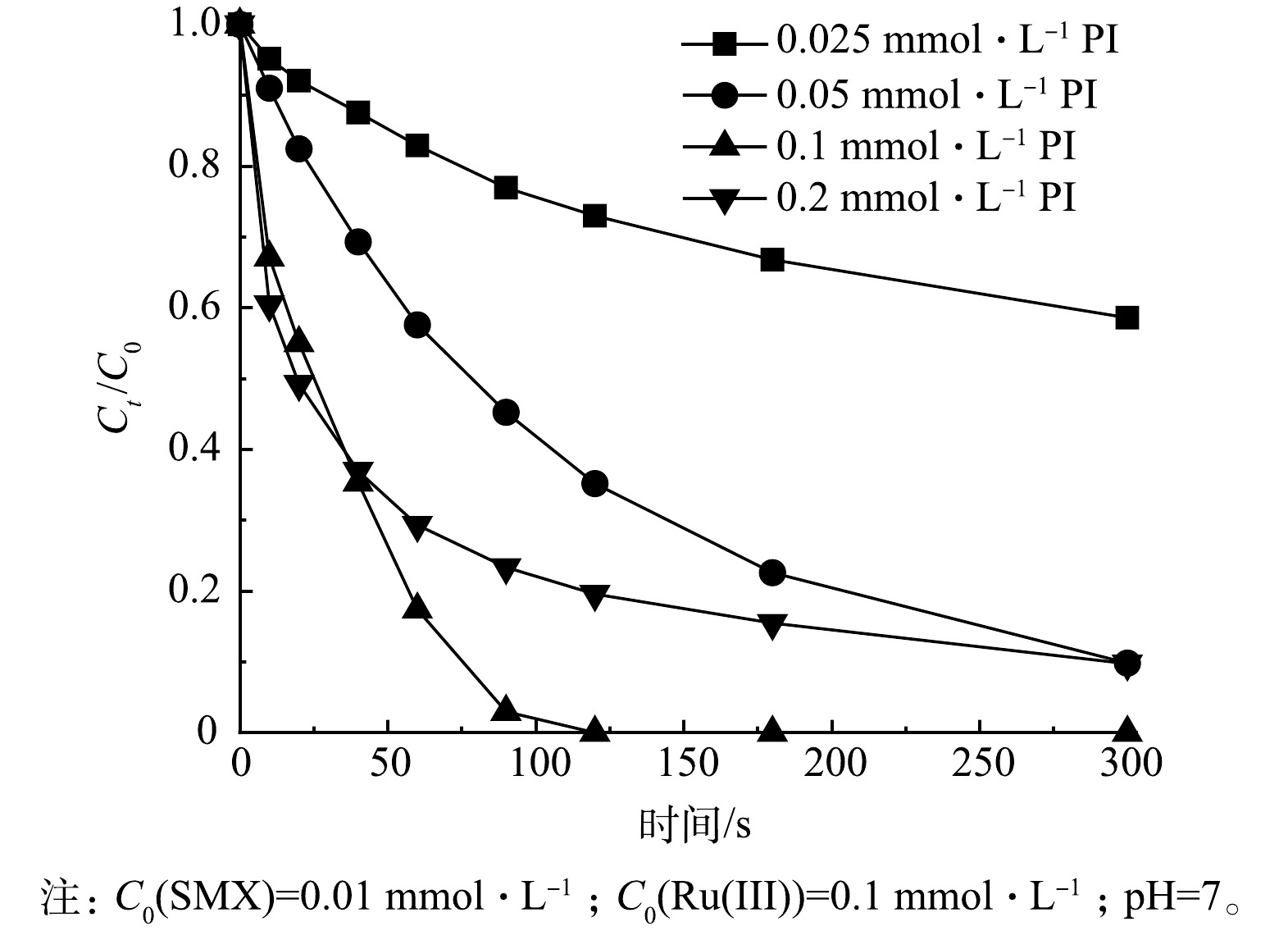
2) PI浓度的影响。探讨了不同PI浓度(0.025、0.05、0.1、0.2 mmol·L−1)对Ru(Ⅲ)/PI体系对SMX降解的影响,结果如图4所示。可见,当PI浓度从0.025 mmol·L−1增加至0.1 mmol·L−1时,SMX的降解率从42.3%提升至100%。这是因为PI浓度增加,体系中的活性物质也相应增加。然而,当PI浓度提高至0.2 mmol·L−1时,SMX的降解率反而降低,从100%降至91.4%。这可能是由于过量的PI消耗了反应过程中的活性物质[35],从而导致SMX的降解率下降。
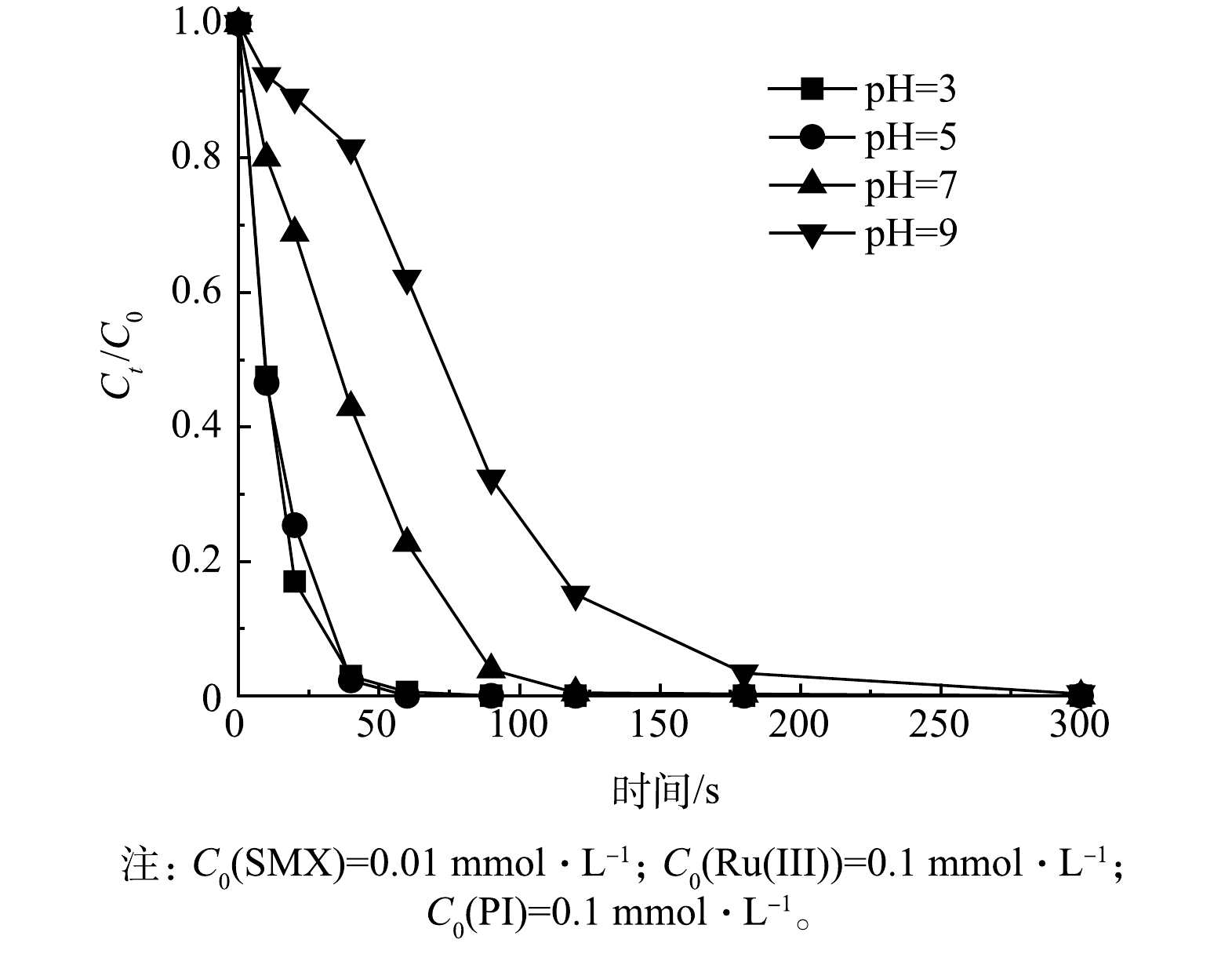
3)不同pH的影响。为了探讨Ru(Ⅲ)/PI体系在不同pH条件下SMX的降解情况,使用pH分别为3、5、7、9的10 mmol·L−1磷酸缓冲液来调节反应溶液的pH,考察Ru(Ⅲ)/PI体系对SMX降解的影响,结果如图5所示。在不同pH条件下,反应5 min内SMX均被有效降解,SMX的去除率在较宽的pH范围内保持稳定,但在碱性(pH=9)条件下SMX降解速率有所减慢,这主要与PI中碘的形态以及Ru的存在形态有关。PI中碘的形态会随着pH的变化而变化,当pH<8时,IO4−占主导,而当pH>8时二聚化的H2I2O104−占主导。PI中碘的形态变化与其氧化电位密切相关,pH从酸性升至碱性时,氧化还原电位会随之增加[36-37]。但pH的增加可生成沉淀形式的Ru(OH)3[38],从而降低SMX降解速率。考虑在中性条件下降解污染物更具实际应用意义,最终研究主要在pH=7的条件下进行。
-
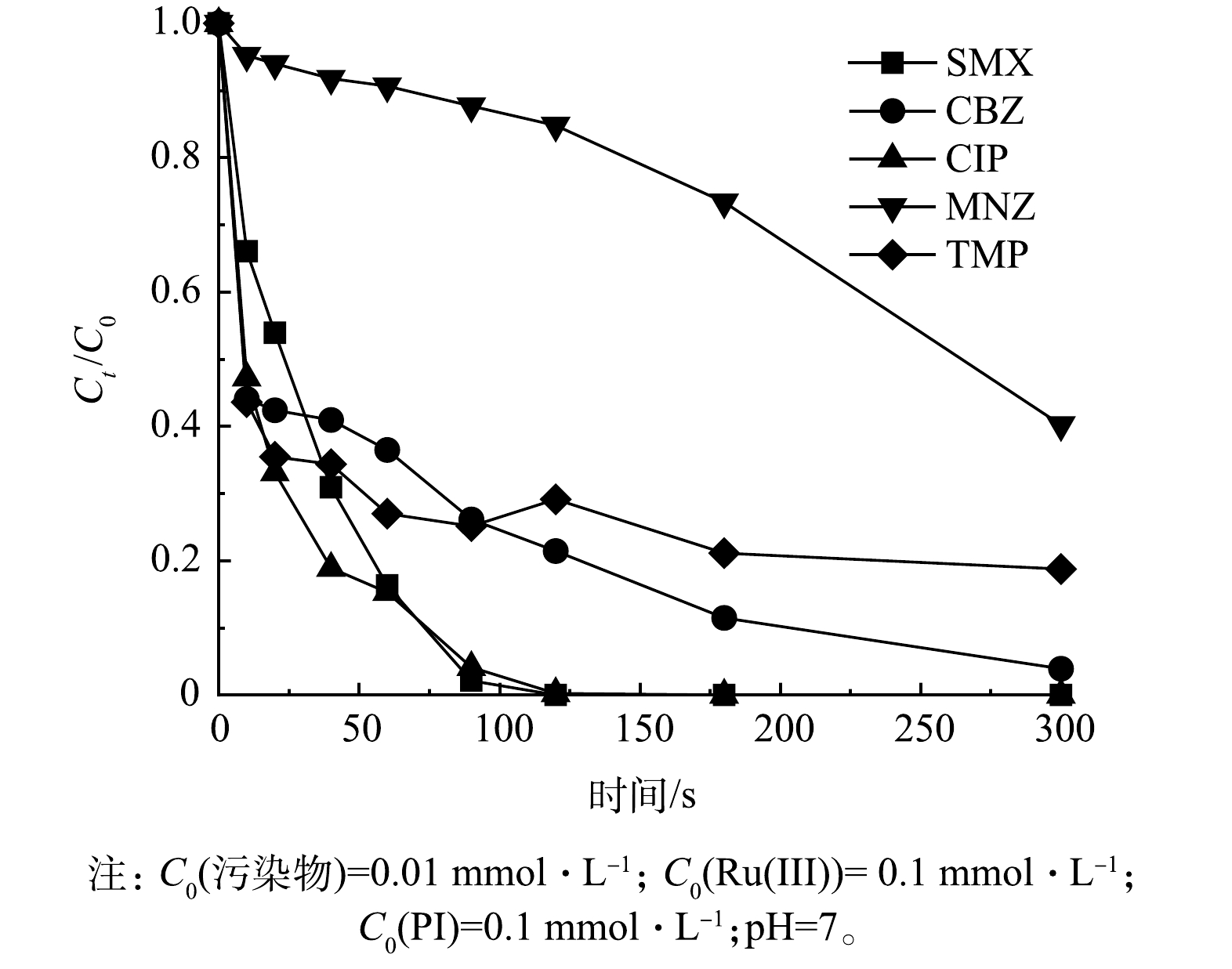
为了评估Ru(Ⅲ)/PI体系对不同污染物的降解效果,选取了磺胺甲恶唑(SMX)、卡马西平(CBZ)、环丙沙星(CIP)、甲硝唑(MNZ)和甲氧苄啶(TMP)作为目标污染物进行降解实验。结果如图6所示,在5 min内,SMX和CIP完全降解,而CBZ、MNZ和TMP的降解率也分别达到了97.4%、60.8%和82.6%。这些结果表明,Ru(Ⅲ)/PI体系对不同有机污染物均具有较强的降解效能。
-
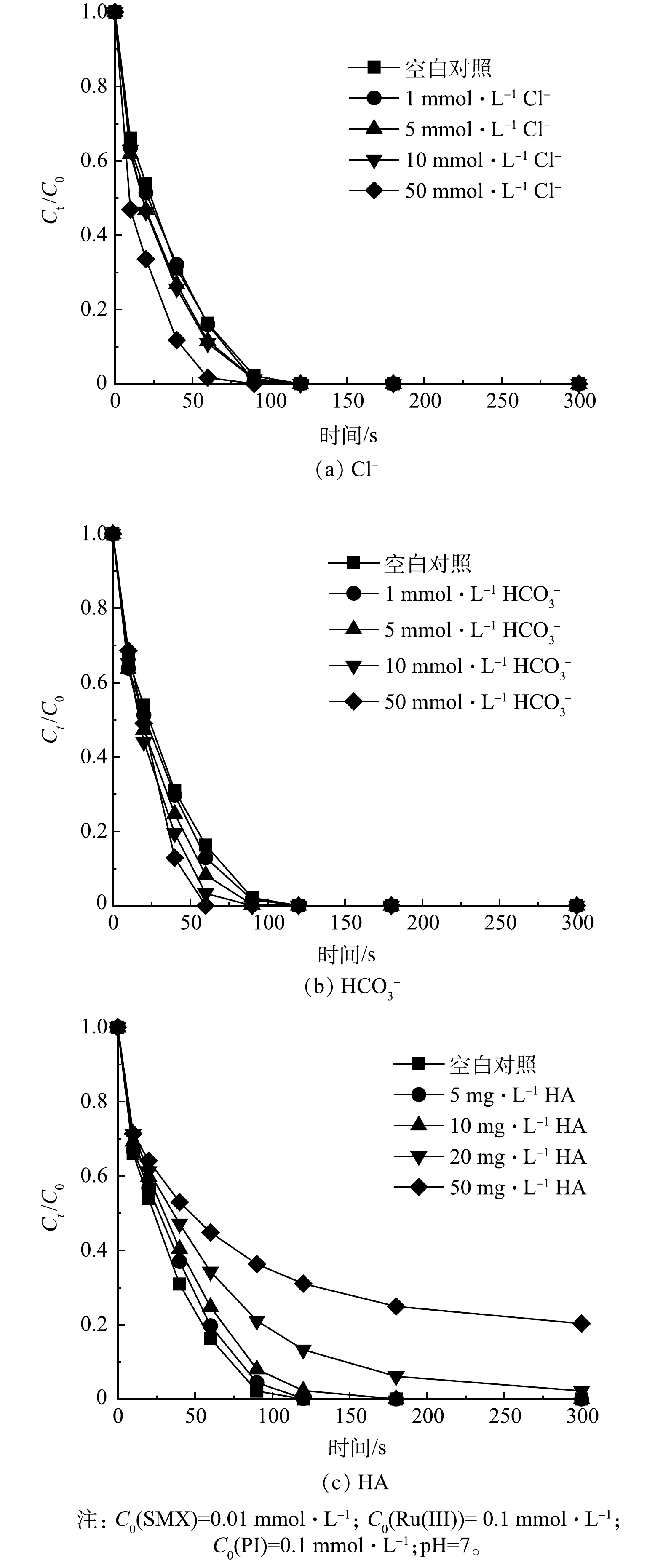
在实际水体中,存在许多无机阴离子和天然有机物,这可能干扰PI的活化性能,进而影响着有机污染物的降解效果[39]。实验研究了Cl−、HCO3−和腐殖酸(HA)对Ru(Ⅲ)/PI体系降解SMX的影响,结果如图7所示。
由图7(a)可知,随着Cl−的浓度从1 mmol·L−1增加至50 mmol·L−1,SMX的降解无明显变化,表明Cl−对SMX降解效率的影响可忽略不计。Cl−对于以自由基(·OH和SO4·−)为主要作用的体系有明显抑制作用[40],对非自由基1O2为主要氧化作用的过程没有影响[41]。研究表明,Cl−与高价金属Ru(V)=O的氧化还原反应活性低[42],因此对Ru(Ⅲ)/PI体系降解SMX没有影响。
由图7(b)可知,在1~50 mmol·L−1 HCO3−的浓度下,SMX在2 min内均完全降解。加入高浓度的HCO3−后,体系pH升至碱性,并且HCO3−的加入对SMX的降解有轻微促进作用。众所周知,HCO3−是一种自由基清除剂,但是在一定浓度下,它们可促进污染物的降解,这是因为HCO3−会参与1O2的形成(式(1)~式(8))[43-44]。
由图7(c)可知,当腐殖酸质量浓度从5 mg·L−1提高至50 mg·L−1时,SMX的降解率从100%下降至80.5%,表明腐殖酸的存在抑制了SMX的降解。这是因为腐殖酸由许多大分子有机物组成,这些大分子有机物与SMX竞争反应中的活性物质Ru(V)=O[22],从而导致SMX降解率下降。
-
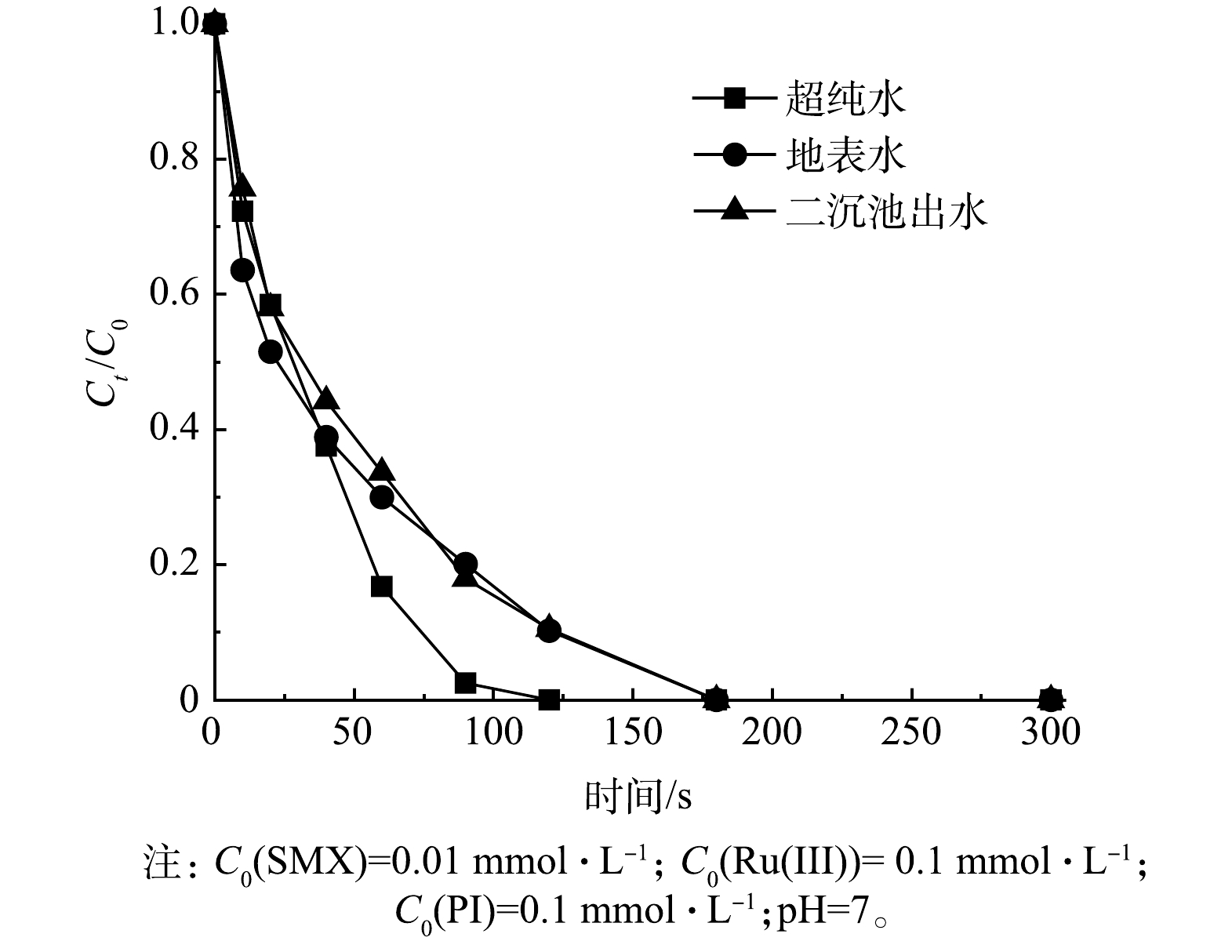
实际水体中复杂的背景基质在不同程度上会影响SMX的降解效果,本研究选择了地表水和实际二沉池出水为背景水样,其水质组分如表1所示。考察了Ru(Ⅲ)/PI在不同实际水体中对SMX的去除效果,结果如图8所示。相比于超纯水,在地表水和二沉池出水中Ru(Ⅲ)/PI对SMX的降解受到轻微的抑制,然而,在5 min内SMX的降解率均达到100%。实验结果表明,Ru(Ⅲ)/PI体系在实际水体中也能够对SMX起到较好的去除作用。
-
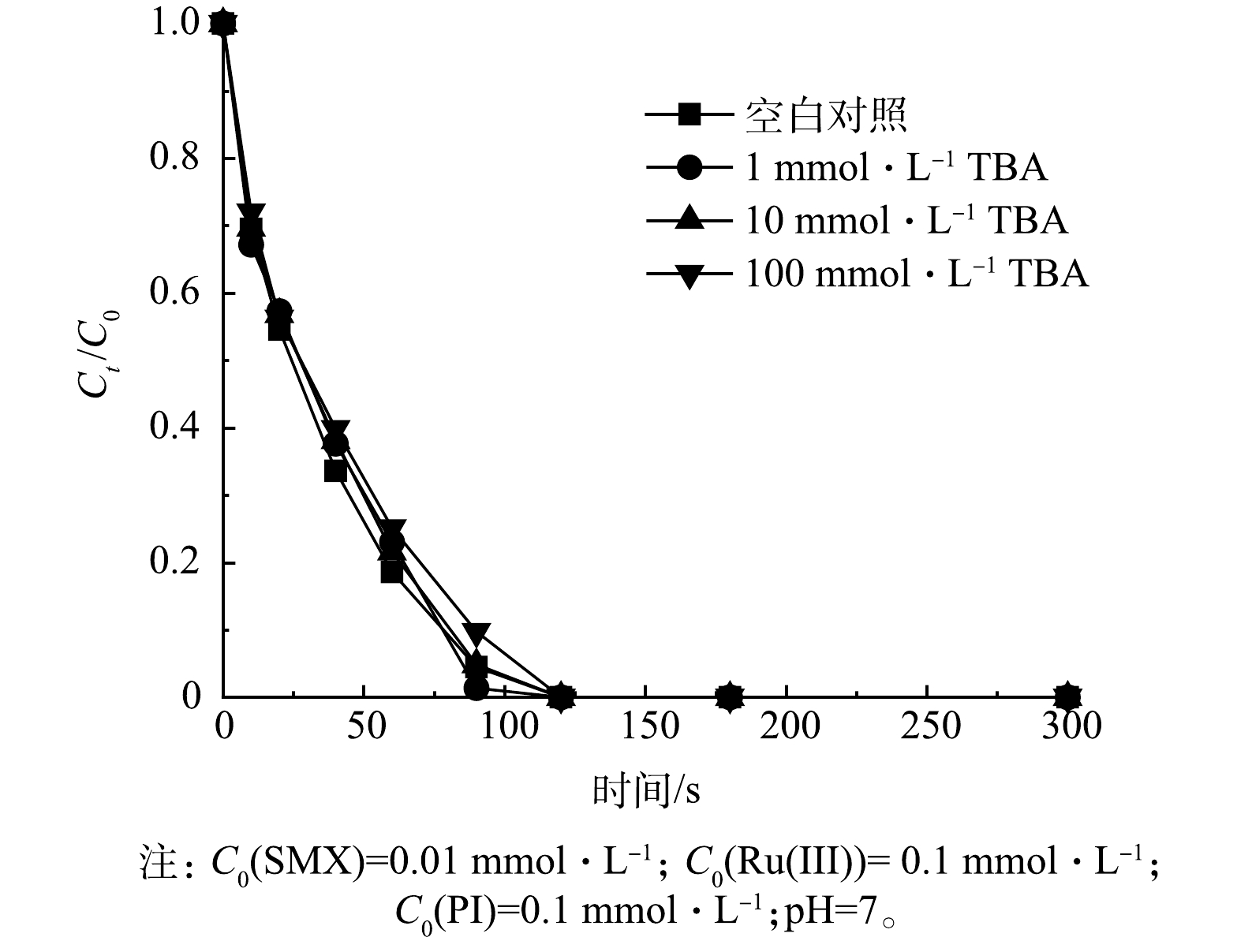
1)自由基的作用。为了探究在Ru(Ⅲ)/PI体系中羟基自由基(·OH)和碘酸根自由基(IO3·)的作用,分别采用淬灭实验和探针实验进行了验证。叔丁醇作为·OH的淬灭剂,与·OH反应的速率常数为3.8×108~7.6×108 L·(mol·s)−1[45],通过淬灭实验考察了叔丁醇对SMX降解效果的影响。如图9所示,当叔丁醇浓度从1 mmol·L−1提高至100 mmol·L−1,SMX降解的抑制作用可忽略不计。因此,·OH不是Ru(Ⅲ)/PI体系降解SMX过程中主要的活性物质。
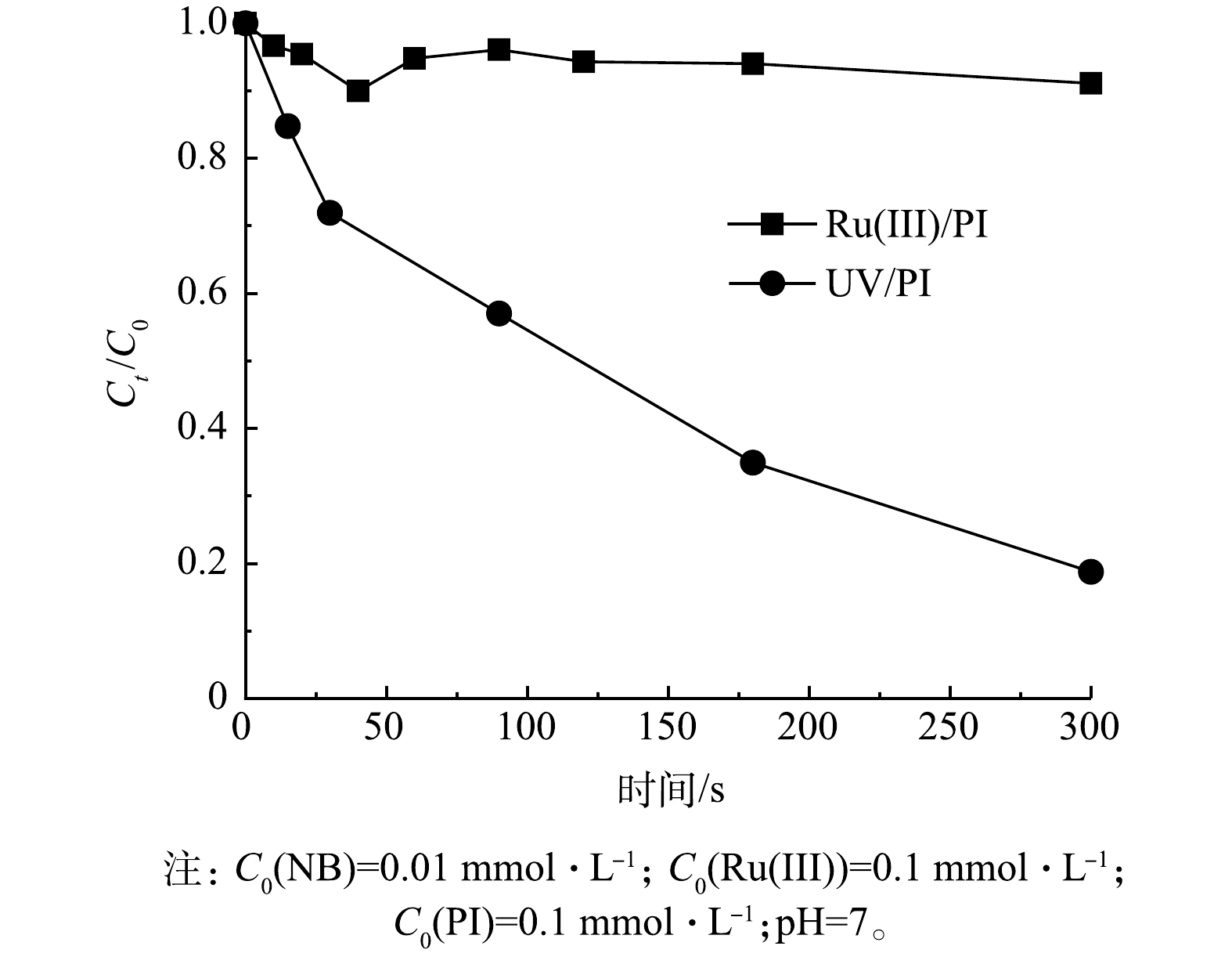
LEE等[24] 研究表明硝基苯(nitrobenzene,NB)可以被IO3·有效去除,此外,有研究表明,在紫外光照射下,活化PI产生的主要活性物质是·OH和 IO3·[17–19,46]。因此,对Ru(Ⅲ)/PI体系与UV/PI体系进行对比研究,将NB作为探针来识别Ru(Ⅲ)/PI体系中IO3·的作用。如图10所示,在UV/PI体系中NB在5 min内降解率为82.8%,而Ru(Ⅲ)/PI体系中NB的降解可忽略不计,因此, IO3·不是Ru(Ⅲ)/PI体系降解SMX的主要活性物质。
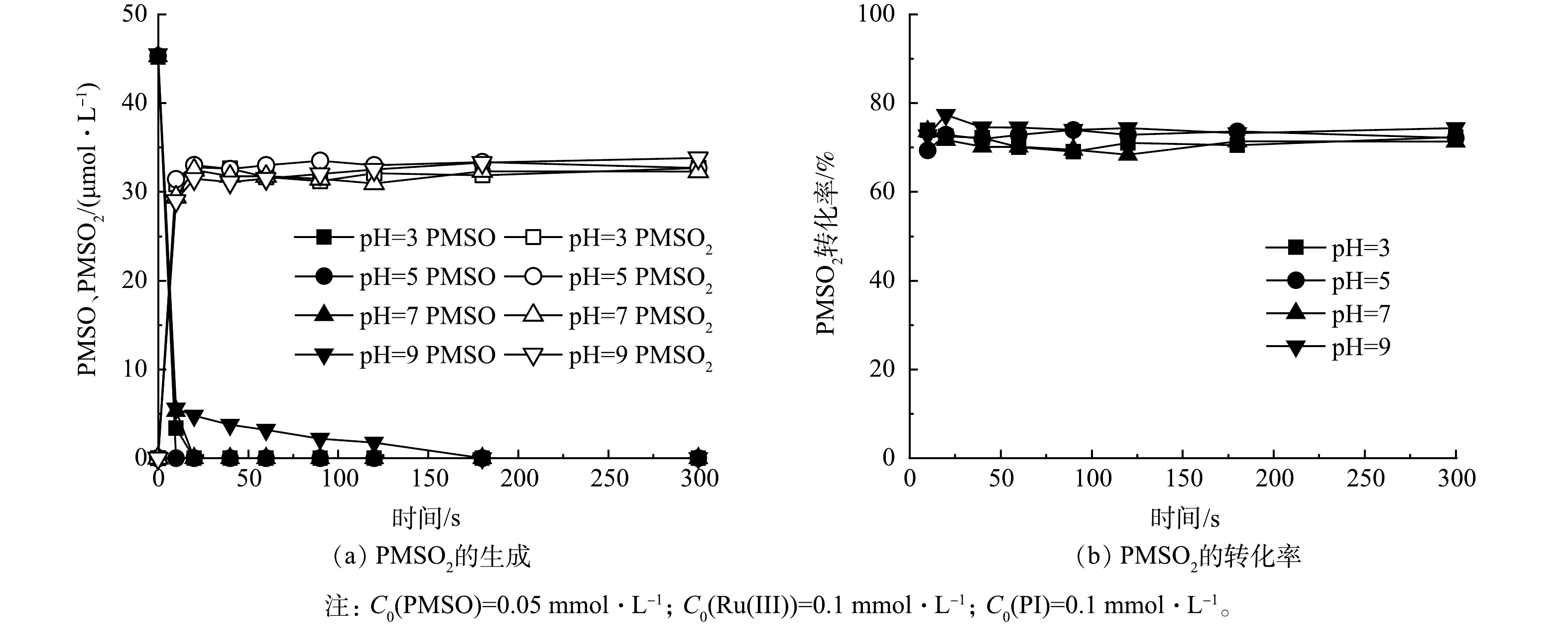
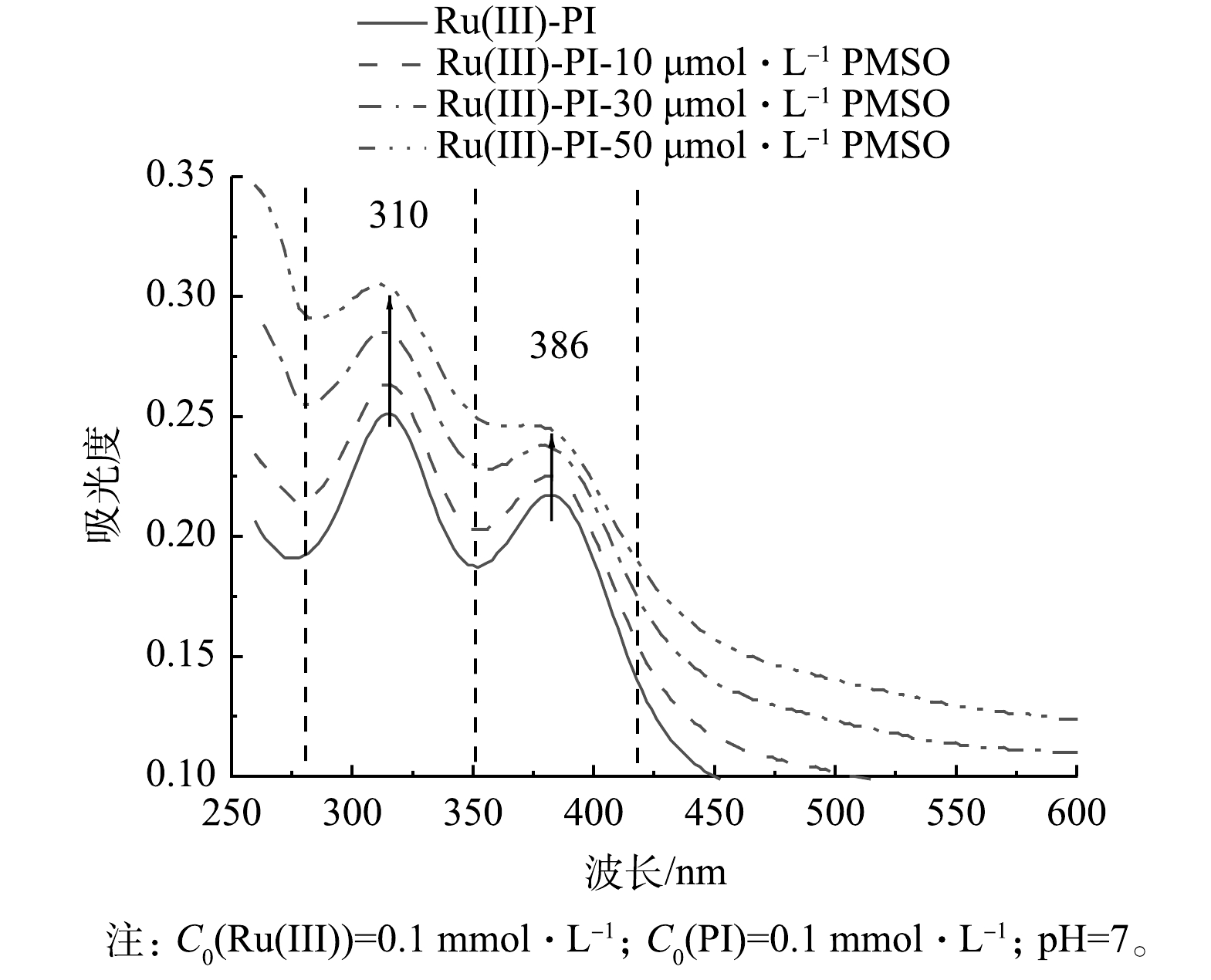
2)非自由基作用。近来,基于高价金属氧物种的非自由基氧化被广泛提出是作为多种过氧化物高级氧化体系中的活性物质,通过双电子途径和氧原子转移步骤生成[47]。高价金属氧物种的一个显著特征是与水中的氧原子交换[13]。已有研究表明,甲基苯基亚砜(PMSO)可以被高价金属氧物种氧化,形成相应的砜产物(甲基苯基砜,PMSO2),并遵循化学计量关系,即PMSO2的转化率[26],因此,选用PMSO为探针物质,研究了体系内高价金属氧物种的生成。如图11(a)所示,在pH为3~9内,PMSO迅速转化成PMSO2,表明在Ru(Ⅲ)/PI过程中生成了Ru(V)=O。为了进一步证实Ru(V)=O的生成,对Ru(Ⅲ)/PI体系进行了紫外-可见光谱检测。已有研究[25]表明,波长为310 nm和386 nm的2个吸收峰对应PI氧化Ru(Ⅲ)的产物Ru(V)=O。如图12所示,在Ru(Ⅲ)/PI的紫外-可见光谱图中在310 nm和386 nm处分别有2个吸收峰,PMSO通过氧原子转移与Ru(V)=O反应(式(9)),从而消耗Ru(V)=O,在加入PMSO后,2个吸收峰呈下降趋势,且随着PMSO浓度的增加,吸收峰的下降幅度也显著增强。综上所述,证实了Ru(Ⅲ)/PI体系中Ru(V)=O的生成。图11(b)显示,PMSO2转化率为70.0%,其余30.0%的PMSO是由其他活性物质氧化,这表明Ru(Ⅲ)/PI体系中存在多种活性物质共同氧化有机污染物。
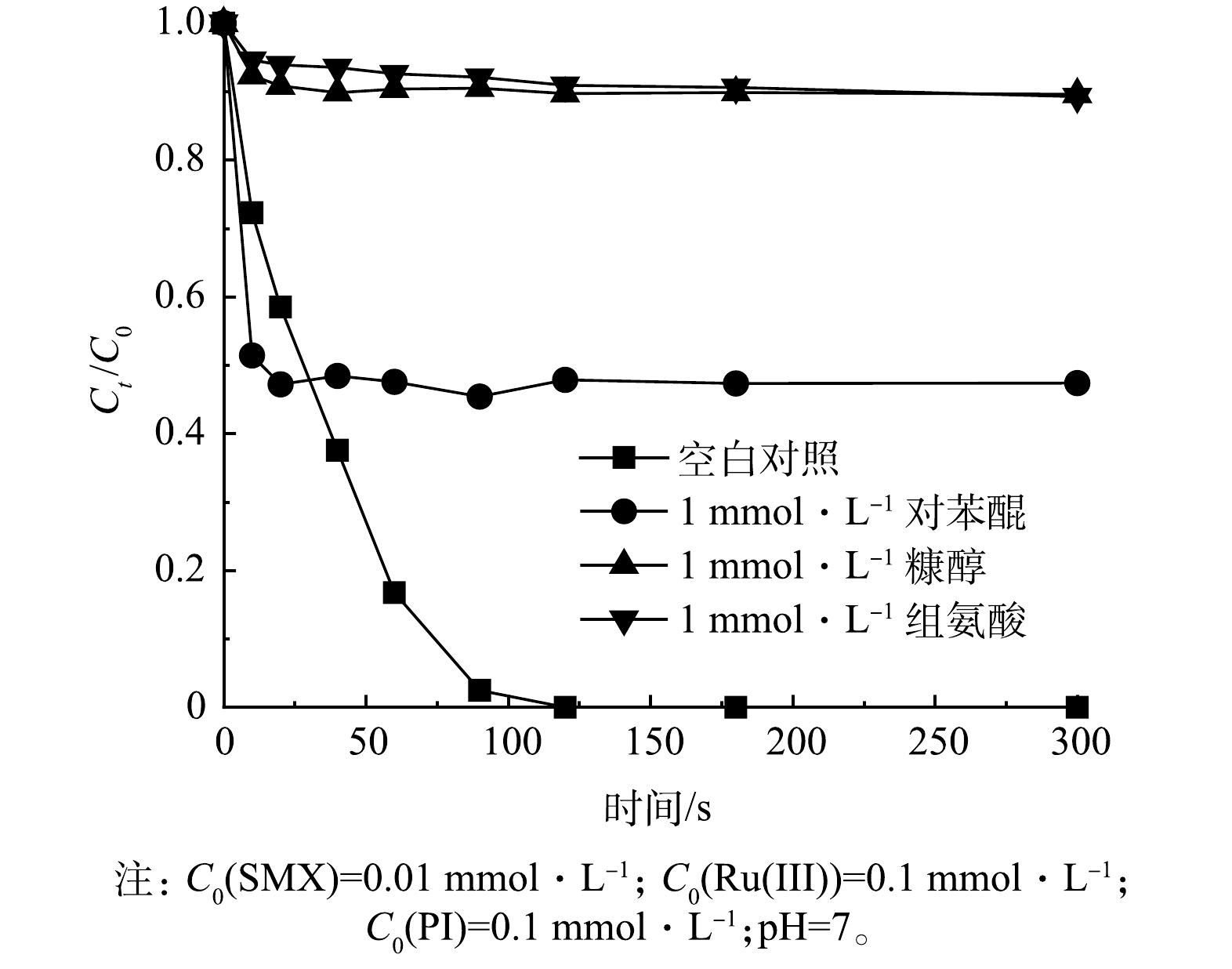
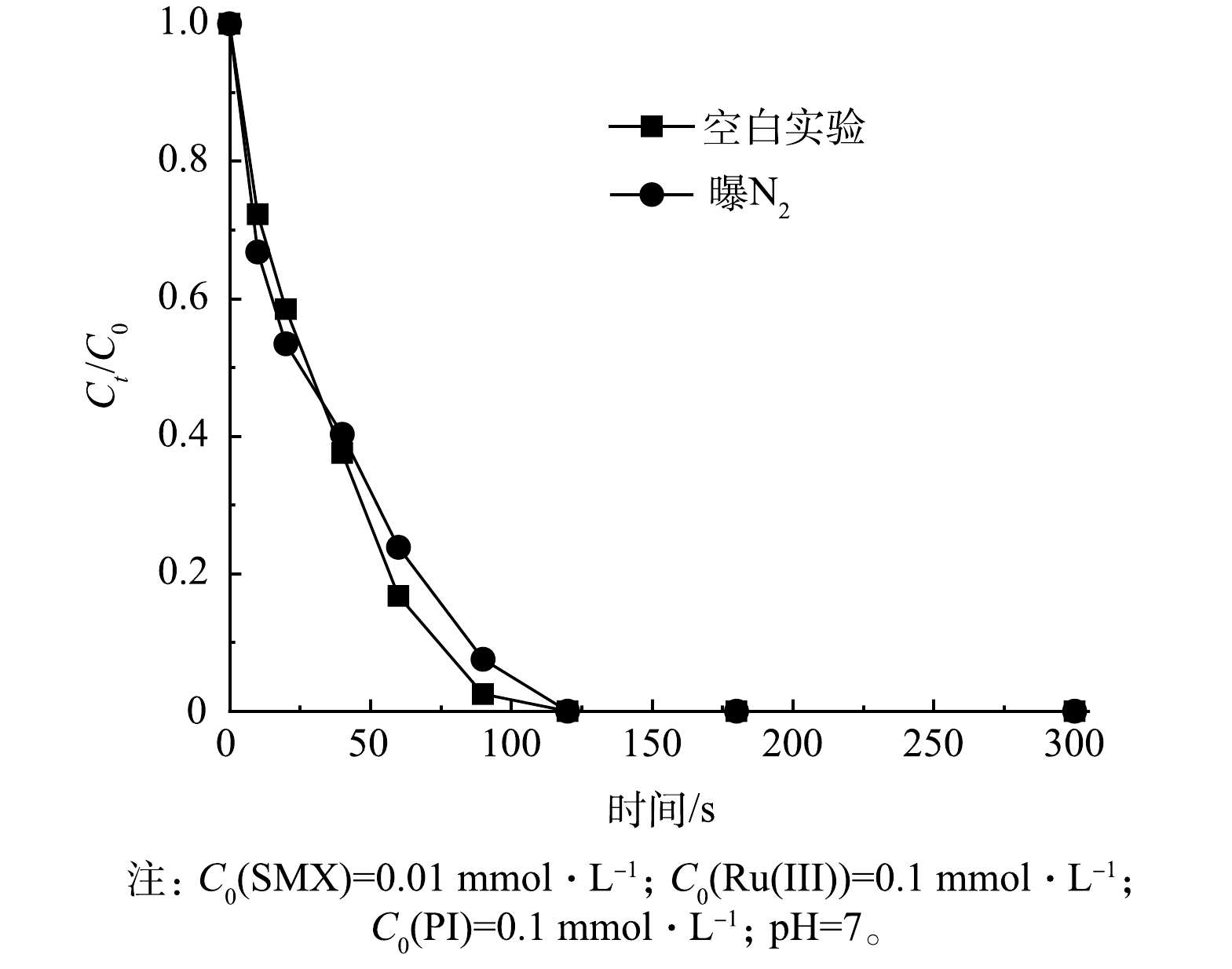
为了探究Ru(Ⅲ)/PI体系反应过程中的其他活性物质,通过投加相同浓度(1 mmol·L−1)的对苯醌(p-BQ)、糠醇(FFA)和L-组氨酸(L-his),以研究其对Ru(Ⅲ)/PI体系中SMX降解效果的影响。对苯醌是O2·−的淬灭剂,速率常数为1.2×108 L·(mol·s)−1,糠醇和L-组氨酸都是1O2典型的淬灭剂,速率常数分别为0.9×109~1.0×109 L·(mol·s)−1和4.0×107 L·(mol·s)−1 [16,48]。如图13所示,添加对苯醌后,SMX的降解率降至53.6%,表明O2·−对于SMX的降解有部分贡献,但原位生成的O2·−可以重新组合形成1O2(式(10)~式(11))[49]。相比之下,糠醇和L-组氨酸对SMX降解的抑制作用更为显著,SMX降解率由100%分别降至10.4%和10.7%,表明1O2对Ru(Ⅲ)/PI体系中SMX的降解起作用。有研究[25]表明,1O2也可以由PI和Ru(V)=O的反应所产生(式(12)~式(13))。通过曝N2实验也表明1O2并非源于溶解氧(图14),而主要来源于原位生成的O2·−和Ru(V)=O。
通过电子顺磁共振(EPR)进一步鉴定反应体系中的1O2,采用TEMP作为自由基捕获剂。如图15所示,在单独PI体系中未检测到TEMP-1O2加合物的信号,而加入Ru(Ⅲ)后,检测出了强度比为1∶1∶1的TEMP-1O2加合物信号,并且随着时间推移,TEMP-1O2加合物信号逐渐增强,证明Ru(Ⅲ)/PI中产生了1O2。此外,在Ru(Ⅲ)/PI体系中加入SMX时,TEMP-1O2加合物的信号明显降低,表明了SMX降解过程中消耗了1O2。综上所述,Ru(Ⅲ)/PI体系降解SMX过程中产生的主要活性物种为非自由基Ru(V)=O和1O2。
-
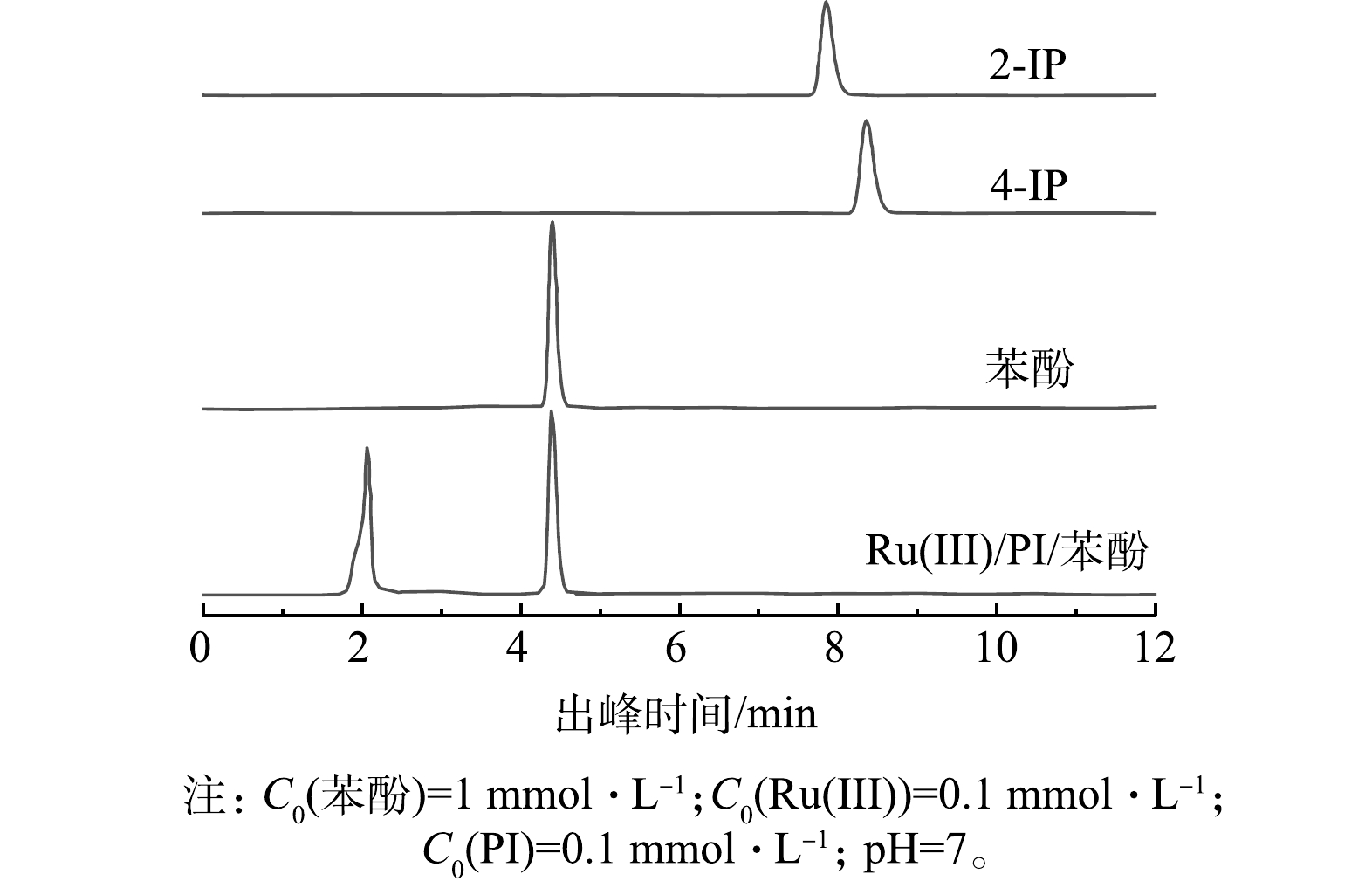
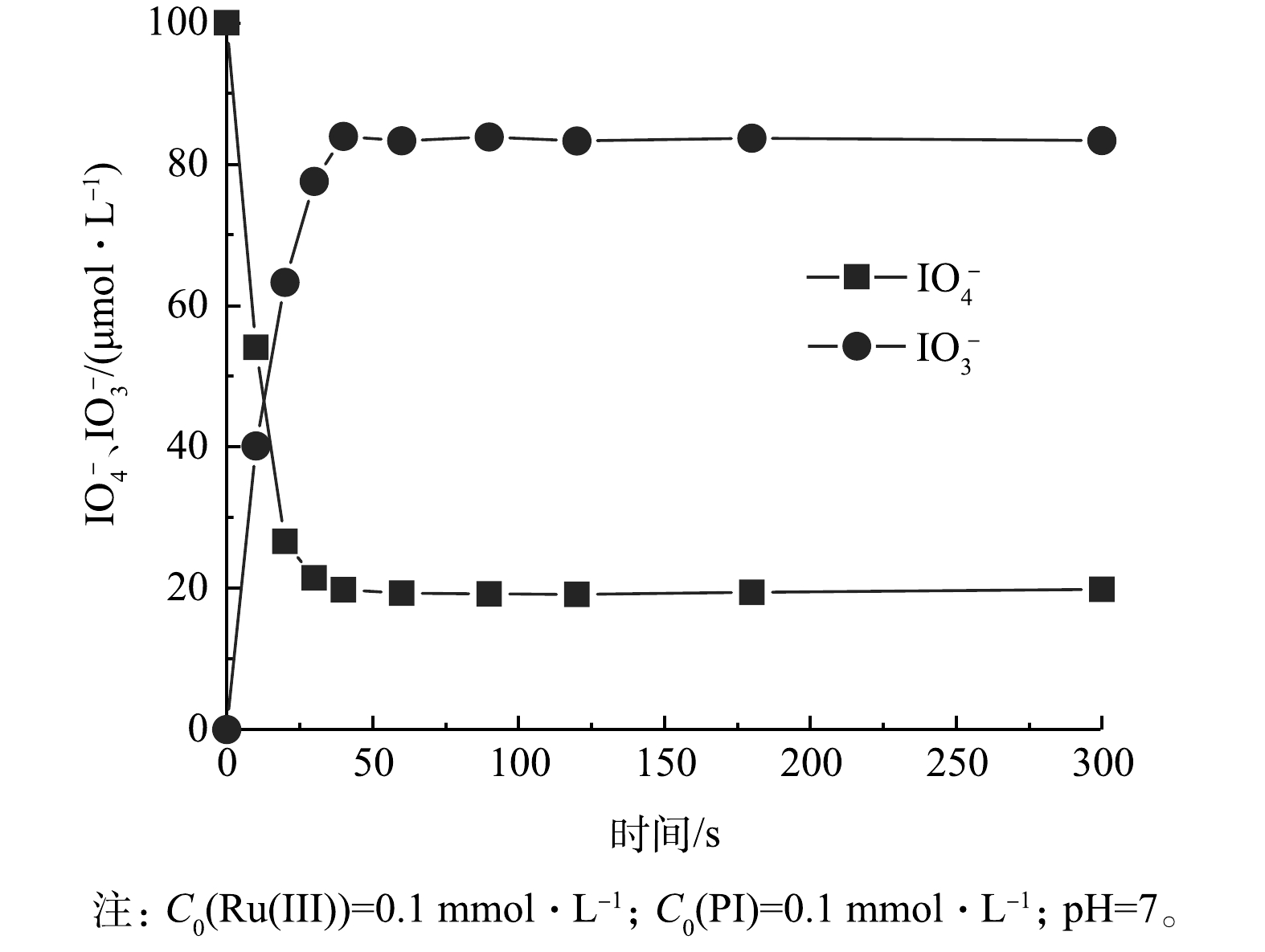
虽然PI本身没有毒性,但基于PI的AOPs可能产生有毒的碘代消毒副产物(I-DBPs),如I2、I3−和HOI[13,48],具有潜在的环境风险。由于HOI与苯酚易生成碘化苯酚[21],包括2-碘酚(2-IP)和4-碘酚(4-IP),因此,使用苯酚作为探针检测Ru(Ⅲ)/PI体系中是否有HOI。如图16所示,在Ru(Ⅲ)/PI体系中没有检测到2-IP和4-PI,表明Ru(Ⅲ)/PI体系中没有HOI的生成。I2和I3−则可以采用淀粉比色法进行分析[45]。如图17所示,I2遇淀粉溶液出现明显的蓝色,而Ru(Ⅲ)/PI分别反应了1、3和5 min的溶液与淀粉溶液混合时没有观察到蓝色,表明Ru(Ⅲ)/PI体系中没有生成I2和I3−。由图18可见,PI可以化学计量的转化为IO3−,而IO3−是无毒的,更安全的碘物种[45]。综上所述,Ru(Ⅲ)/PI体系中的PI化学计量的转化为了IO3−,不会形成碘代消毒副产物。
-
1)在20种金属离子活化PI中,Ru(Ⅲ)/PI体系对SMX的降解效果最佳。SMX的降解率随着Ru(Ⅲ)浓度的增加而提高,这是由于体系中活性物质Ru(V)=O增多,从而促进对SMX的降解。尽管SMX的降解率随着PI浓度的增加而提高,但过量的PI浓度反而会消耗活性物质,从而导致SMX降解受到抑制。
2) Ru(Ⅲ)/PI体系能在较宽的pH范围内完全降解SMX,并且对于不同有机污染物均能达到较好的降解效果,表明Ru(Ⅲ)/PI是一种强效的污染物降解工艺。
3) Cl−和HCO3−对SMX降解影响较小,当HCO3−投加到一定浓度时,会对SMX降解有轻微促进作用,而腐殖酸会抑制SMX的降解。此外,Ru(Ⅲ)/PI体系在实际水体中也能够对SMX起到较好的去除作用。
4) Ru(Ⅲ)/PI体系中的活性物质不是·OH和IO3·自由基,而是高价金属Ru(V)=O和1O2起主要的氧化作用。
5)通过苯酚作为探针以及淀粉比色法表明Ru(Ⅲ)/PI体系中的PI化学计量的转化为了无毒的IO3−,不会形成I2、I3−和HOI。
过渡金属Ru(Ⅲ)催化活化高碘酸盐降解磺胺甲恶唑的性能
The degradation performance of sulfamethoxazole by Ru(Ⅲ) activated periodate of periodate
-
摘要: 高碘酸盐作为一种新型过氧化物在水处理中的应用已引起越来越多的重视,本研究探究了20种金属离子催化活化高碘酸盐(PI)降解水中磺胺甲恶唑(SMX)。结果表明,Ru(Ⅲ)对PI的活化效果最佳。在Ru(Ⅲ)/PI体系中,当Ru(Ⅲ)和PI的浓度分别为0.1、0.1 mmol·L−1时,反应2 min内SMX的降解率可达100%。pH对Ru(Ⅲ)/PI体系的影响较小,在pH 3~9内,反应5 min内可完全降解SMX。Ru(Ⅲ)/PI体系对不同有机污染物(卡马西平、环丙沙星、甲硝唑和甲氧苄啶)均表现出良好的去除效果。水基质的影响研究表明,氯离子(Cl−)和碳酸氢根离子(HCO3−)对SMX降解影响较小,而腐殖酸(HA)会抑制SMX的降解。Ru(Ⅲ)/PI体系在实际水体中对SMX的降解起到较好的效果。淬灭实验、探针实验和电子顺磁共振检测(EPR)结果表明,该体系中的主要活性物质为高价金属Ru(V)=O和单线态氧(1O2)。Ru(Ⅲ)/PI体系中的PI可化学计量的转化为了IO3−。Abstract: This study investigated the homogeneous activation of periodate (PI) by 20 metal ions for the degradation of sulfamethoxazole (SMX) in water. Ru(Ⅲ) exhibited the optimal activation efficiency. In the Ru(Ⅲ)/PI system, with both Ru(Ⅲ) and PI concentrations at 0.1 mmol·L−1, the degradation rate of SMX reached to 100% within 2 min. Experimental results indicated that the Ru(Ⅲ)/PI system could completely degrade SMX within 5 min across a wide pH range from 3 to 9. The Ru(Ⅲ)/PI system showed well efficiency in removing various organic pollutants, including carbamazepine, ciprofloxacin, metronidazole, and methapyrilene. In aqueous matrix, chloride ions (Cl−) and bicarbonate ions (HCO3−) had minimal impact on SMX degradation, while humic acid (HA) inhibited SMX degradation. The Ru(Ⅲ)/PI system showed better effect on the degradation of SMX in actual water samples. Quenching experiment, probe test combined with electron paramagnetic resonance (EPR) detection indicated that the dominant reactive species in this system were the high-valent metal-oxo Ru(V)=O and singlet oxygen (1O2). PI in the Ru(Ⅲ)/PI system was stoichiometrically converted to IO3−.
-
Key words:
- sulfamethoxazole /
- periodate /
- Ru(Ⅲ) /
- advanced oxidation
-

-
表 1 实际水样水质组分
Table 1. Actual water quality components
水样 pH TOC /(mg·L−1) Cl− /(mmol·L−1) NO3− /(mmol·L−1) 地表水 7.76 6.95 1.41 0.059 二沉池出水 7.53 9.52 2.43 1.40 表 2 各目标污染物测试参数
Table 2. Test parameters for each target pollutant
目标污染物 流动相比例 流量/(mL·min−1) 紫外波长/nm 进样量/μL 柱温/ ℃ SMX 40(乙腈)餐饮区、商办区和住宅区60(0.1%乙酸) 1 265 20 35 CBZ 30(甲醇)∶70(超纯水) 1 285 20 35 CIP 20(乙腈)∶80(0.1%甲酸) 1 277 20 35 MNZ 80(甲醇)∶20(超纯水) 1 316 10 35 TMP 30(乙腈)∶70(0.1%甲酸) 1 270 20 35 NB 30(甲醇)∶70(超纯水) 1 268 20 35 PMSO 70(乙腈)∶30(超纯水) 1 225 30 35 PMSO2 70(乙腈)∶30(超纯水) 1 225 30 35 苯酚 44(乙腈)∶56(超纯水) 1 285 30 35 IO4−/IO3− 10(乙腈)∶90(0.1%磷酸) 1 228 50 35 2-IP/4-IP 44(乙腈)∶56(超纯水) 1 285 30 35 表 3 金属离子的氧化态及离子半径
Table 3. Oxidation states and ionic radii of metal ions
金属离子 氧化态 离子半径/pm[32] Fe(Ⅱ) +2 61 LS, 78 HS Ru(Ⅲ) +3 68 Cd(Ⅱ) +2 95 Ba(Ⅱ) +2 136 Cu(Ⅱ) +2 73 Cr(Ⅲ) +3 61.5 Al(Ⅲ) +3 53.5 Ag(I) +1 115 Fe(Ⅲ) +3 55 LS, 64.5 HS Co(Ⅱ) +2 55 LS, 64.5 HS Ni(Ⅱ) +2 69 Y(Ⅲ) +3 90 La(Ⅲ) +3 103.2 Zr(IV) +4 72 Mo(IV) +4 59 Mn(Ⅱ) +2 67LS Mg(Ⅱ) +2 72 Ca(Ⅱ) +2 100 Zn(Ⅱ) +2 74 Pd(Ⅱ) +2 86 注:LS表示低旋;HS表示高旋。 -
[1] ZHAN H, LIU X, HUANG J, et al. Iron electrocoagulation activated peracetic acid for efficient degradation of sulfamethoxazole[J]. Chemical Engineering Research and Design, 2023, 200: 244-255. doi: 10.1016/j.cherd.2023.10.042 [2] ZHANG J, LV S, YU Q, et al. Degradation of sulfamethoxazole in microbubble ozonation process: Performance, reaction mechanism and toxicity assessment[J]. Separation and Purification Technology, 2023, 311: 123262. doi: 10.1016/j.seppur.2023.123262 [3] WANG J, WANG S. Microbial degradation of sulfamethoxazole in the environment[J]. Applied Microbiology and Biotechnology, 2018, 102(8): 3573-3582. doi: 10.1007/s00253-018-8845-4 [4] GAO H, ZHAO F, LI R, et al. Occurrence and distribution of antibiotics and antibiotic resistance genes in water of Liaohe River Basin, China[J]. Journal of Environmental Chemical Engineering, 2022, 10(5): 108297. doi: 10.1016/j.jece.2022.108297 [5] Occurrence of quinotone antibiotics and their impacts on aquatic environment in typical river-estuary system of Jiaozhou Bay, China[J]. Ecotoxicology and Environmental Safety, 2020, 190: 109993. [6] BONVIN F, OMLIN J, RUTLER R, et al. Direct photolysis of human metabolites of the antibiotic sulfamethoxazole: Evidence for abiotic back-transformation[J]. Environmental Science & Technology, 2013, 47(13): 6746-6755. [7] JIANG B, LI A, CUI D, et al. Biodegradation and metabolic pathway of sulfamethoxazole by Pseudomonas psychrophila HA-4, a newly isolated cold-adapted sulfamethoxazole-degrading bacterium[J]. Applied Microbiology and Biotechnology, 2014, 98(10): 4671-4681. doi: 10.1007/s00253-013-5488-3 [8] AO X, LIU W. Degradation of sulfamethoxazole by medium pressure UV and oxidants: Peroxymonosulfate, persulfate, and hydrogen peroxide[J]. Chemical Engineering Journal, 2017, 313: 629-637. doi: 10.1016/j.cej.2016.12.089 [9] DAI J, CAI T, LI X, et al. Revisit the selectivity of metal-free biochar activated periodate for the oxidation of emerging contaminants[J]. Chemical Engineering Journal, 2023, 476: 146795. doi: 10.1016/j.cej.2023.146795 [10] LI Y, WANG J, WEI Z, et al. Effective periodate activation by peculiar Cu2O nanocrystal for antibiotics degradation: The critical role of structure and underlying mechanism study[J]. Applied Catalysis B: Environmental, 2024, 341: 123351. doi: 10.1016/j.apcatb.2023.123351 [11] YANG L, YANG F, ZHANG H, et al. Insight into the electron transfer regime of periodate activation on MnO2: The critical role of surface Mn(IV)[J]. Journal of Hazardous Materials, 2023, 454: 131479. doi: 10.1016/j.jhazmat.2023.131479 [12] YANG T, AN L, ZENG G, et al. Enhanced hydroxyl radical generation for micropollutant degradation in the In2O3/Vis-LED process through the addition of periodate[J]. Water Research, 2023, 243: 120401. doi: 10.1016/j.watres.2023.120401 [13] ZONG Y, SHAO Y, ZENG Y, et al. Enhanced oxidation of organic contaminants by iron(Ⅱ)-activated periodate: The significance of high-valent iron–oxo species[J]. Environmental Science & Technology, 2021, 55(11): 7634-7642. [14] WANG Q, ZENG H, LIANG Y, et al. Degradation of bisphenol AF in water by periodate activation with FeS (mackinawite) and the role of sulfur species in the generation of sulfate radicals[J]. Chemical Engineering Journal, 2021, 407: 126738. doi: 10.1016/j.cej.2020.126738 [15] ZOU R, YANG W, REZAEI B, et al. Sustainable bioelectric activation of periodate for highly efficient micropollutant abatement[J]. Water Research, 2024, 254: 121388. doi: 10.1016/j.watres.2024.121388 [16] GUO D, YAO Y, YOU S, et al. Ultrafast degradation of micropollutants in water via electro-periodate activation catalyzed by nanoconfined Fe2O3[J]. Applied Catalysis B: Environmental, 2022, 309: 121289. doi: 10.1016/j.apcatb.2022.121289 [17] CAO M H, WANG B B, YU H S, et al. Photochemical decomposition of perfluorooctanoic acid in aqueous periodate with VUV and UV light irradiation[J]. Journal of Hazardous Materials, 2010, 179(1): 1143-1146. [18] CHIA L H, TANG X, WEAVERS L K. Kinetics and mechanism of photoactivated periodate reaction with 4-chlorophenol in acidic solution[J]. Environmental Science & Technology, 2004, 38(24): 6875-6880. [19] LEE C, YOON J. Application of photoactivated periodate to the decolorization of reactive dye: reaction parameters and mechanism[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2004, 165(1/2/3): 35-41. [20] WEAVERS L K, HUA I, HOFFMANN M R. Degradation of triethanolamine and chemical oxygen demand reduction in wastewater by photoactivated periodate[J]. Water Environment Research, 1997, 69(6): 1112-1119. doi: 10.2175/106143097X125849 [21] LIU F, LI Z, DONG Q, et al. Catalyst-free periodate activation by solar irradiation for bacterial disinfection: Performance and mechanisms[J]. Environmental Science & Technology, 2022, 56(7): 4413-4424. [22] PUYANG C, HAN J, GUO H. Degradation of emerging contaminants in water by a novel non-thermal plasma/periodate advanced oxidation process: Performance and mechanisms[J]. Chemical Engineering Journal, 2024, 483: 149194. doi: 10.1016/j.cej.2024.149194 [23] DU J, TANG S, FAHEEM, et al. Insights into periodate oxidation of bisphenol A mediated by manganese[J]. Chemical Engineering Journal, 2019, 369: 1034-1039. doi: 10.1016/j.cej.2019.03.158 [24] LEE H, YOO H Y, CHOI J, et al. Oxidizing capacity of periodate activated with iron-based bimetallic nanoparticles[J]. Environmental Science & Technology, 2014, 48(14): 8086-8093. [25] LI D, PAN C, ZONG Y, et al. Ru(Ⅲ)-periodate for high performance and selective degradation of aqueous organic pollutants: Important role of Ru(V) and Ru(IV)[J]. Environmental Science & Technology, 2023, 57(32): 12094-12104. [26] NIU L, LIN J, CHEN W, et al. Ferrate(VI)/periodate system: Synergistic and rapid oxidation of micropollutants via periodate/iodate-modulated Fe(IV)/Fe(V) intermediates[J]. Environmental Science & Technology, 2023, 57(17): 7051-7062. [27] SUN Y J, FANG Z Y, HUANG X T, et al. Efficient photo-switchable activation of periodate by nitrogen-vacancy-rich carbon nitride for organic contaminant removal: Theoretical predictions and experimental validations[J]. Applied Catalysis B: Environmental, 2023, 337: 122994. doi: 10.1016/j.apcatb.2023.122994 [28] PENG J, ZHOU P, ZHOU H, et al. Removal of phenols by highly active periodate on carbon nanotubes: A mechanistic investigation[J]. Environmental Science & Technology, 2023, 57(29): 10804-10815. [29] LI R, WANG J, WU H, et al. Periodate activation for degradation of organic contaminants: Processes, performance and mechanism[J]. Separation and Purification Technology, 2022, 292: 120928. doi: 10.1016/j.seppur.2022.120928 [30] SATHIYAN K, WANG J, WILLIAMS L M, et al. Revisiting the electron transfer mechanisms in Ru(Ⅲ)-mediated advanced oxidation processes with peroxyacids and ferrate(VI)[J]. Environmental Science & Technology, 2024, 58(26): 11822-11832. [31] ZONG Y, SHAO Y, JI W, et al. Trace Mn(Ⅱ)-catalyzed periodate oxidation of organic contaminants not relying on any transient reactive species: The substrate-dependent dual roles of in-situ formed colloidal MnO2[J]. Chemical Engineering Journal, 2023, 451: 139106. doi: 10.1016/j.cej.2022.139106 [32] SPEIGHT J G, LANGE N A. Lange’s handbook of chemistry[M]. 16t. ed. , 70th anniversary ed. New York: McGraw-Hill, 2005. [33] KIM J, ZHANG T, LIU W, et al. Advanced oxidation process with peracetic acid and Fe(Ⅱ) for contaminant degradation[J]. Environmental Science & Technology, 2019, 53(22): 13312-13322. [34] ZHAO J, ZHANG H, SHI Y, et al. Efficient activation of ferrate by Ru(Ⅲ): Insights into the major reactive species and the multiple roles of Ru(Ⅲ)[J]. Journal of Hazardous Materials, 2023, 458: 131927. doi: 10.1016/j.jhazmat.2023.131927 [35] XIONG Y, TANG X, LIU Y, et al. Activation of periodate by chalcopyrite for efficient degradation of tetracycline hydrochloride[J]. Separation and Purification Technology, 2023: 125813. [36] KIM Y, LEE H, OH H, et al. Revisiting the oxidizing capacity of the periodate–H2O2 mixture: identification of the primary oxidants and their formation mechanisms[J]. Environmental Science & Technology, 2022, 56(9): 5763-5774. [37] CHEN T, SUN Y, DONG H, et al. Understanding the importance of periodate species in the pH-dependent degradation of organic contaminants in the H2O2/periodate process[J]. Environmental Science & Technology, 2022, 56(14): 10372-10380. [38] LI R, MANOLI K, KIM J, et al. Peracetic acid–ruthenium(Ⅲ) oxidation process for the degradation of micropollutants in water[J]. Environmental Science & Technology, 2021, 55(13): 9150-9160. [39] LUO K, SHI Y, HUANG R, et al. Activation of periodate by N-doped iron-based porous carbon for degradation of sulfisoxazole: Significance of catalyst-mediated electron transfer mechanism[J]. Journal of Hazardous Materials, 2023, 457: 131790. doi: 10.1016/j.jhazmat.2023.131790 [40] QIAN Y, HUANG J, LIU X, et al. Rapid oxidation of histamine H2-receptor antagonists by peroxymonosulfate during water treatment: Kinetics, products, and toxicity evaluation[J]. Water Research, 2020, 185: 116278. doi: 10.1016/j.watres.2020.116278 [41] Application of sludge biochar combined with peroxydisulfate to degrade fluoroquinolones: Efficiency, mechanisms and implication for ISCO[J]. Journal of Hazardous Materials, 2022, 426: 128081. [42] ZONG Y, ZHANG H, ZHANG X, et al. Highly selective oxidation of organic contaminants in the RuⅢ-activated peroxymonosulfate process: The dominance of Ru(V)=O species[J]. Chemosphere, 2021, 285: 131544. doi: 10.1016/j.chemosphere.2021.131544 [43] CHEN Y, YUAN X, JIANG L, et al. Insights into periodate oxidation of antibiotics mediated by visible-light-induced polymeric carbon nitride: Performance and mechanism[J]. Chemical Engineering Journal, 2023, 457: 141147. doi: 10.1016/j.cej.2022.141147 [44] ZHOU L, SONG W, CHEN Z, et al. Degradation of organic pollutants in wastewater by bicarbonate-activated hydrogen peroxide with a supported cobalt catalyst[J]. Environmental Science & Technology, 2013, 47(8): 3833-3839. [45] SUN H, HE F, CHOI W. Production of reactive oxygen species by the reaction of periodate and hydroxylamine for rapid removal of organic pollutants and waterborne bacteria[J]. Environmental Science & Technology, 2020, 54(10): 6427-6437. [46] BENDJAMA H, MEROUANI S, HAMDAOUI O, et al. Efficient degradation method of emerging organic pollutants in marine environment using UV/periodate process: Case of chlorazol black[J]. Marine Pollution Bulletin, 2018, 126: 557-564. doi: 10.1016/j.marpolbul.2017.09.059 [47] YANG B, MA Q, HAO J, et al. Periodate-based advanced oxidation processes: A review focusing on the overlooked role of high-valent iron and manganese species[J]. Chemosphere, 2023, 337: 139442. doi: 10.1016/j.chemosphere.2023.139442 [48] ZHANG K, YE C, LOU Y, et al. Promoting selective water decontamination via boosting activation of periodate by nanostructured Ru-supported Co3O4 catalysts[J]. Journal of Hazardous Materials, 2023, 442: 130058. doi: 10.1016/j.jhazmat.2022.130058 [49] BOKARE A D, CHOI W. Singlet-oxygen generation in alkaline periodate solution[J]. Environmental Science & Technology, 2015, 49(24): 14392-14400. -



 下载:
下载: