-
人类社会在快速发展工业和农业的同时也带来了严重的土壤重金属污染问题,土壤重金属污染降低了土地的可持续利用性,并且它也威胁着生态环境和人类的健康[1]。被污染土地中的重金属主要来源于矿产资源的开采和冶炼、工业“三废”的排放、用含重金属废水进行污灌,施用含有重金属农药、以及施用过量的磷肥等[2]。目前我国耕地中的Cd污染问题比较严重,据统计数据显示我国Cd污染耕地面积达1.3 ×104 hm2,涉及11个省市的25个地区,每年生产Cd米(Cd含量≥1.0 mg·kg−1的糙米)5.0 ×107 kg[3]。我国近年来镉污染事故也频繁发生,如发生于2005年的广东北江韶段关Cd严重超标事件,发生于2006年的湘江湖南株洲段镉污染事故和发生于2009年的湖南省浏阳市镉污染事故等[4]。Cd被植物吸收、积累和富集到植物体内,之后通过食物链途径使Cd进入人体从而威胁人体健康[5]。Cd毒性较大,长期生活在Cd污染的环境中会引起慢性中毒,因此需要寻求合理的方法来防治Cd污染,减轻Cd对人体的危害。
水稻是一种在我国具有重要农业生产地位的粮食作物[6]。然而在许多地区水稻遭受比较严重的镉污染胁迫[7]。因此如何去除环境中的镉、降低其对植物和人体健康的危害已成为人们关注的环境问题。已有研究表明,外源添加一些物质,如植物激素、化学改良剂、络合螯合剂和有机物料等[8-11]均可以降低镉对环境的危害。亚精胺(Spd)是多胺的一种,普遍存在的多阳离子脂肪族胺,是细胞正常生长所必需的物质[12]。Spd是植物体内的内源物质,具有环境友好的优点。多胺在细胞生理中起着重要的作用,具有影响细胞大分子结构、基因表达、蛋白质功能、核酸及蛋白质合成,调节离子通道,以及保护细胞免受氧化损伤等功能[13]。杨安中等[14]研究发现,亚精胺浸种可以促进水稻种子的萌发和秧苗的生长,有很好的促根壮苗的效果。Alcázar等[15]研究发现外源添加Spd可以提高植物对盐胁迫、低温和干旱的耐受性。Spd提高植物的抗逆作用主要是通过提高抗氧化酶活性和清除自由基等方式实现的[16-17]。Zhao等[18]研究发现,在Cd胁迫下对平邑甜茶进行叶面喷施Spd可以显著地提高平邑甜茶的内源Spd含量,促进氧化酶活性或直接清除活性氧来保持膜的稳定性,减少活性氧的生成,从而缓解镉对平邑甜茶的胁迫作用。Yang等[19]研究发现,Spd参与了马来眼子菜的保护体系,Spd诱导抗氧化酶和抗氧化剂来阻止活性氧的形成。Spd可以作为潜在的生长调节剂来改善植物在金属胁迫下的生长状况。以上研究结果证明外源施用Spd对缓解植物重金属胁迫的可行性。
目前有关外源添加Spd对Cd胁迫下水稻种子萌发的影响鲜有报道,本文就外源亚精胺对Cd胁迫下水稻种子萌发的影响这一问题开展一系列研究,为Cd胁迫下水稻栽培以及稻田镉污染防治提供科学依据。
全文HTML
-
水稻选用品种为中嘉早17,属籼型常规水稻,是由中选181与D001-2杂交选育而成的水稻品种。在长江中下游作双季早稻种植,全生育期平均109.0 d。株型适中,分蘖力中等,茎秆粗壮,叶片宽挺,熟期转色好,每亩有效穗数20.6万穗,株高88.4 cm,穗长18.0 cm,每穗总粒数122.5粒,结实率82.5%,千粒重26.3 g。
实验药品:氯化镉(CdCl2·2.5H2O),分析纯;亚精胺(Spd),化学名称:N-乙酰基-5-甲氧基色胺,分子式为C7H19N3,优级纯。
-
实验设置3个Cd浓度处理:0、10、30 μmol·L−1和3个Spd浓度处理:0、500、1000 μmol·L-1,组合后总共有9个实验处理。Cd以CdCl2·2.5H2O的形式加入。
选取饱满的水稻种子以供实验,在实验处理前将水稻种子用5%的过氧化氢浸泡15 min消毒,之后用去离子水冲洗5遍,将消毒好的水稻种子平铺在育苗盘中,将其放置于恒温培养箱中(28 ℃)催芽1 d,从育苗盘中选取露白一致的种子,将其放置于的培养皿(Φ 9 cm)中,在每个培养皿下层铺一张滤纸并放置30粒种子,按照上述实验设置加入10 mL配置好的不同浓度的Cd和Spd组合的处理液。将处理好的培养皿放置于28 ℃的恒温培养箱中,避光使其萌发。每个实验处理设置3次重复。每3 d更换1次处理液,在水稻幼苗培养时每天观察和记录种子的发芽生长的情况。
-
生长指标测定:记录培养3 d和7 d后水稻种子有效萌发个数,用于计算水稻的发芽势和发芽率。当水稻种子胚芽长度与种子长度的一半相同,且水稻种子的胚根长和种子的长度相同时记为有效萌发[20].
发芽势=(第3 d有效萌发个数/种子总数)×100%
发芽率=(第7 d有效萌发个数/种子总数)×100%
处理7 d后收取水稻样品,从每个处理中选取长势均匀的水稻样品,测定其芽长,每个处理测定10株,取平均值。将处理后的水稻从每个培养皿中取出,分为芽和根两个部分并用滤纸擦干其表面的水分,之后称量芽和根系的重量,每个处理的重量按照培养皿中所有植株重量的总和计算。
根系扫描分析:从培养皿中选取长势均匀的水稻幼苗,将其根部洗净,然后放入装有水的扫描根盘中,采用台式扫描仪(Epson Expression 1680)扫描水稻根系,之后用图像分析软件Win RHIZO(加拿大Regent Instruments公司)对根系图像进行分析得出总根长、根表面积、根体积、根尖数和根分叉数的数据,每个处理选取10个重复,取其平均值。
生理指标测定:将处理7 d后的种子的芽和根系分开并标记好,用液氮将其速冻,将处理好的样品放入−80 ℃超低温冰箱中,用于测定各个生理指标。生理指标测定采用苏州科铭生物技术公司生产的试剂盒,测定的生理指标包括:丙二醛(MDA)、过氧化氢酶(CAT)、过氧化物酶(POD)和超氧化物歧化酶(SOD)活性。
-
实验所得数据采用origin 9.1进行分析,利用SPSS 21统计分析软件进行差异显著性检验,对同一Spd处理浓度下的不同处理的数据进行单因素方差分析和Duncan多重比较。文中实验数据以平均值±标准差的形式表示。
1.1. 实验材料
1.2. 实验设计
1.3. 测定项目与方法
1.4. 数据处理
-
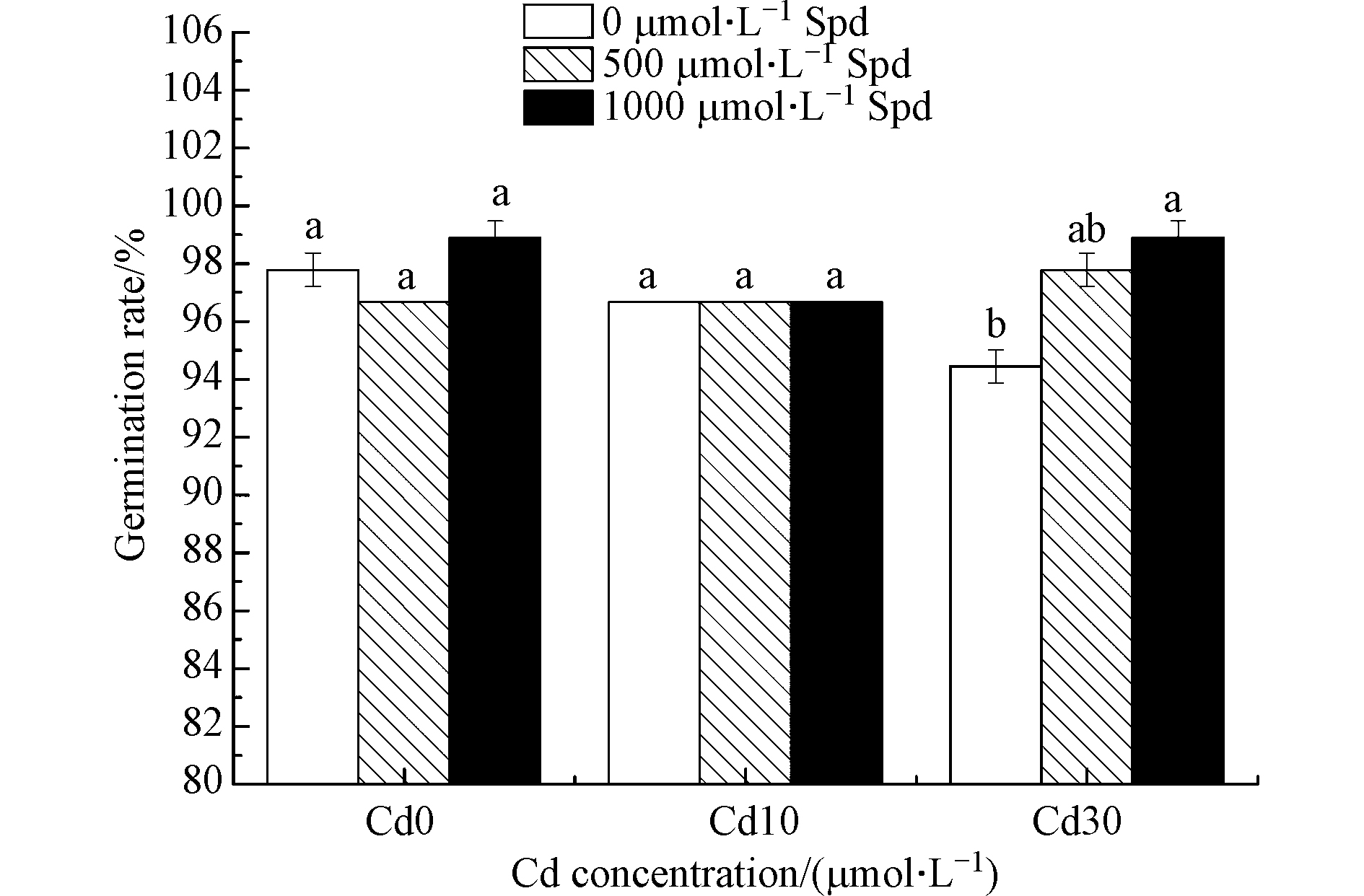
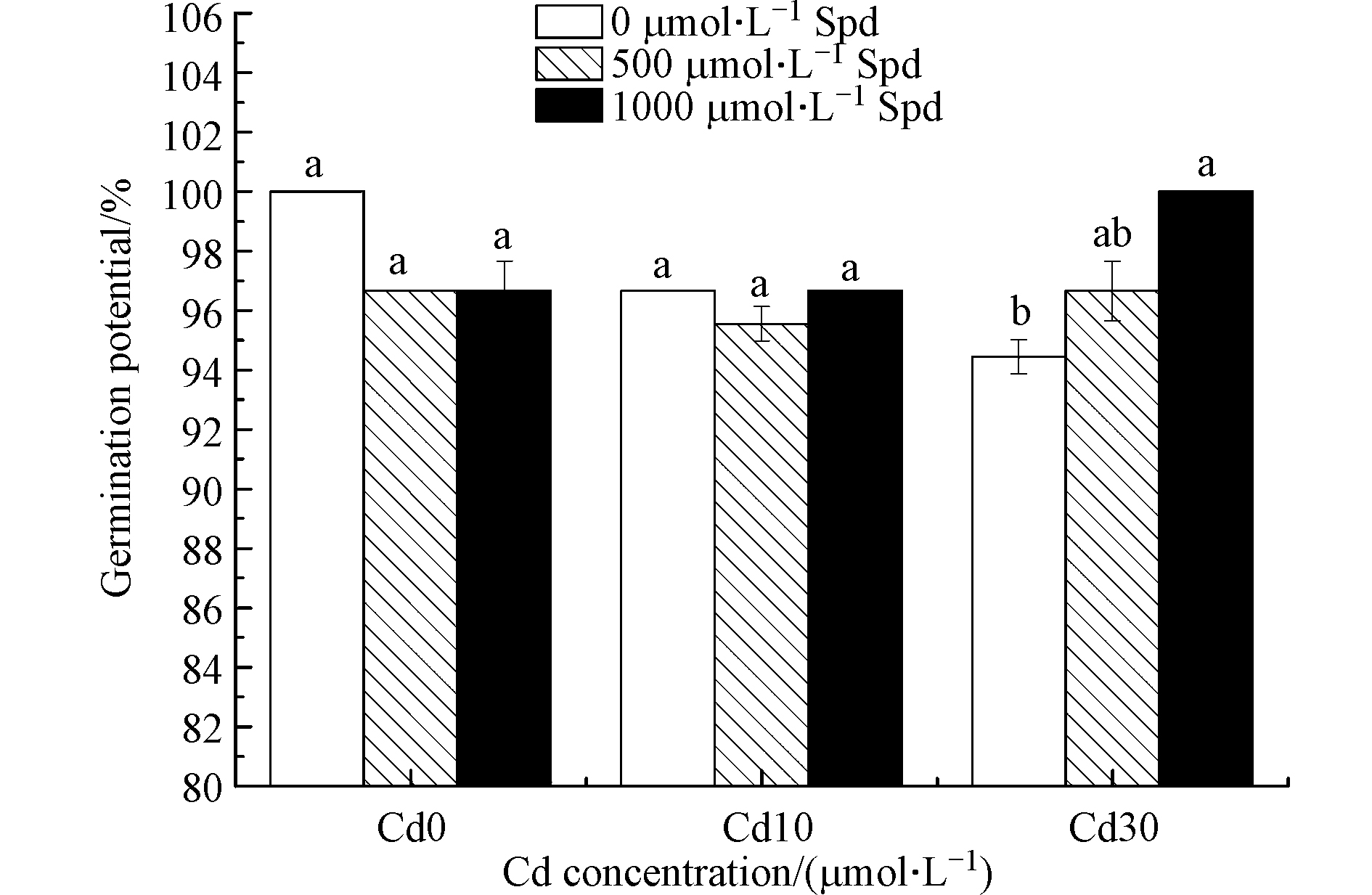
图1和图2为外源添加Spd对不同浓度Cd胁迫下水稻种子发芽势和发芽率的影响。可以看出,在Cd胁迫下,水稻种子的发芽势和发芽率与空白对照相比均有降低的趋势。Cd浓度为10 μmol·L−1时,水稻的发芽势与没有镉胁迫的对照相比显著降低了3.3%(P<0.05),当Cd浓度为30 μmol·L−1时,发芽势比对照处理显著降低了5.6%(P<0.05),发芽率显著降低了3.4%(P<0.05)。
由图1和图2还能看出,外源添加Spd可以影响水稻的发芽势和发芽率。当Cd胁迫的浓度为30 μmol·L−1时,外源添加1000 μmol·L−1的Spd使发芽势比对照处理显著提高5.9%(P<0.05),发芽率显著提高4.7%(P<0.05)。
双因素方差分析结果表明(表1),Cd添加、外源Spd添加对水稻种子发芽势和发芽率的影响差异不显著。Cd和Spd对水稻发芽势的影响有交互作用。
Cd不是植物生长所必须的元素,Cd会干扰植物多种重要的生理功能,影响植物对矿质营养物质的摄取和转运,对植物产生毒害作用,引起植物叶片萎黄坏死[21]。本研究通过实验发现Cd胁迫会抑制水稻种子的萌发过程,导致种子的发芽势和发芽率有明显的下降趋势。合理添加亚精胺以后可以有效提高水稻种子的发芽势和发芽率。Aldesuquy等[22]也通过实验研究发现外源施用Spd可以有效缓解污灌水中重金属对小麦的危害作用。
-
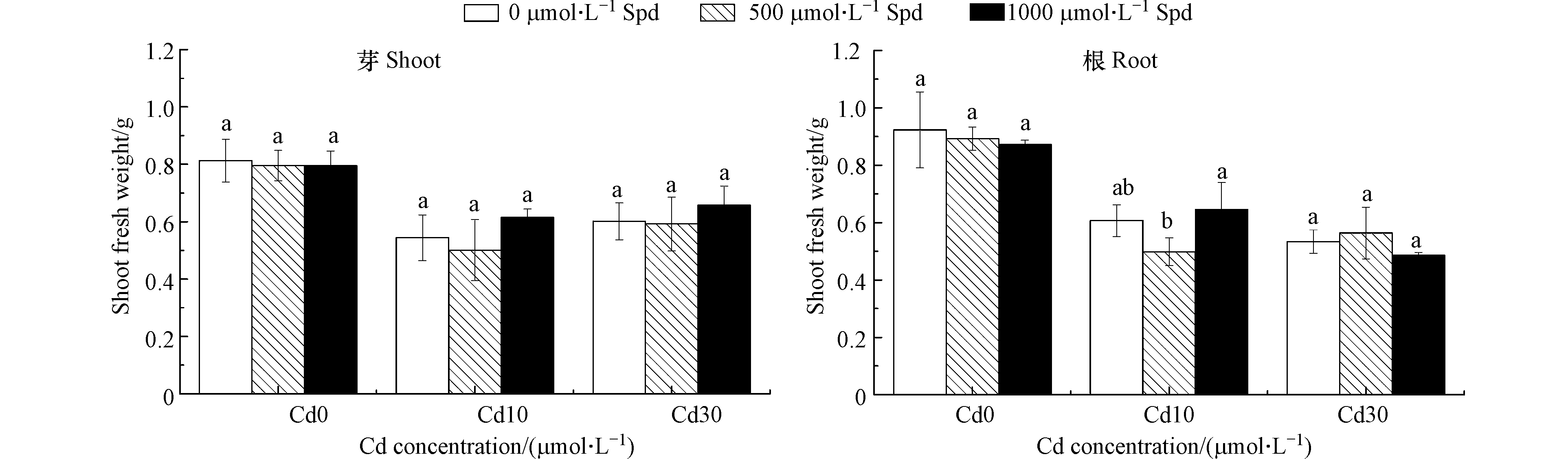
图3是在Cd胁迫下,外源添加不同浓度的Spd对水稻芽鲜重和根鲜重的影响。由图3可以看出,与对照相比Cd胁迫使水稻幼芽和根的鲜重均显著降低,水稻幼芽鲜重在两个镉处理浓度下分别降低33.0%和26.0%(P<0.05),根系鲜重分别降低34.2%和42.2%((P<0.05)。在Cd浓度为10 μmol·L−1和30 μmol·L−1的处理中,外源添加500 μmol·L−1 Spd和1000 μmol·L−1 Spd均没有导致水稻幼芽和根系的鲜重有显著变化。
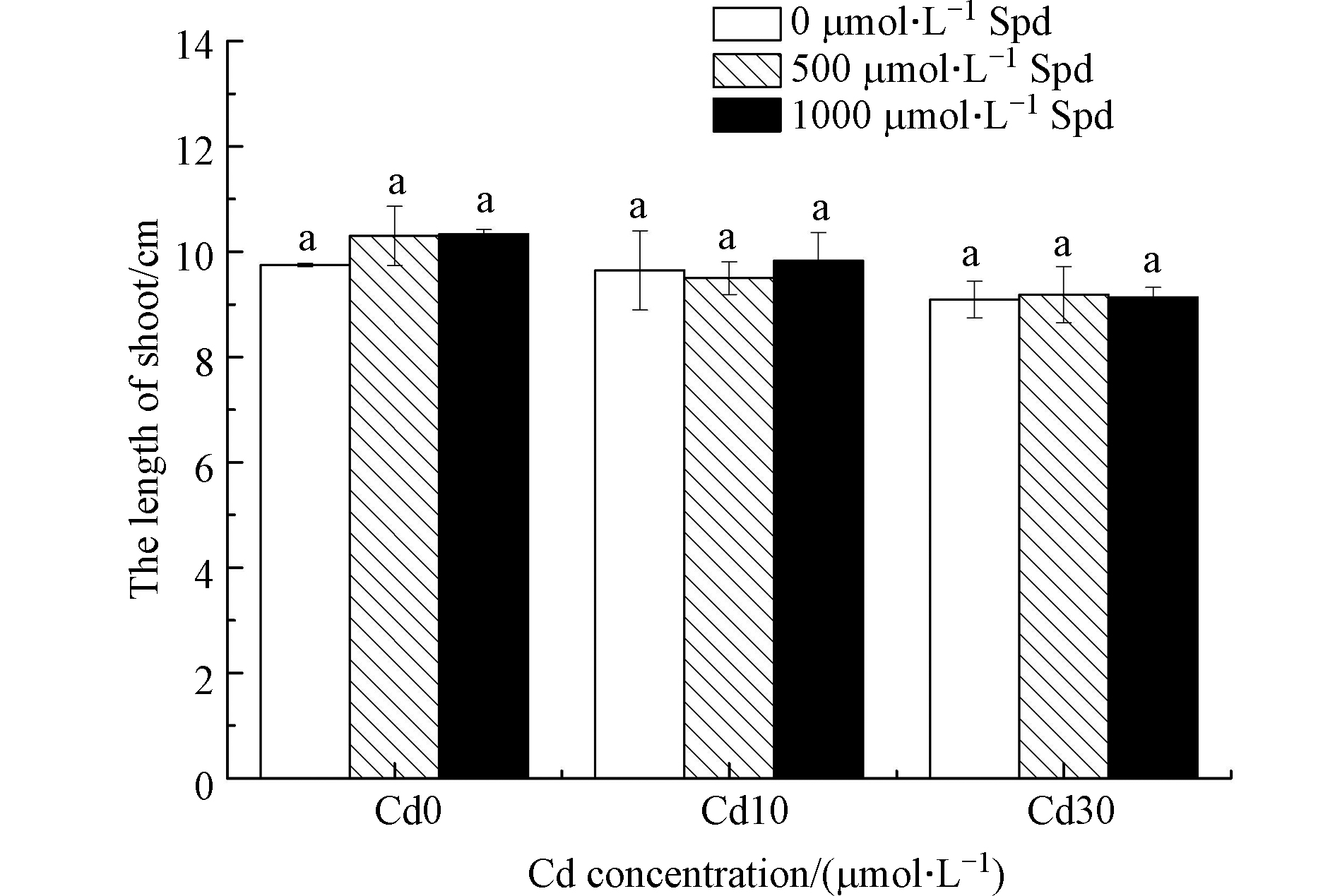
图4是外源添加Spd对水稻芽长的影响.从图4看出,Cd胁迫可导致水稻芽长有所降低,但差异不显著。不管是Cd浓度为10 μmol·L−1还是30 μmol·L−1,外源添加500 μmol·L−1 Spd和1000 μmol·L−1 Spd均没有使水稻芽长发生显著变化。
双因素方差分析结果表明(表1),添加不同Cd浓度对芽鲜重、根鲜重和芽长的影响差异达极显著水平,而添加不同Spd浓度对这几个指标影响差异不显著,Cd和Spd对水稻的芽鲜重、根鲜重和芽长的影响没有交互作用。
实验研究结果表明,Cd胁迫虽然对芽长的影响不明显,但会显著抑制幼芽的生物量影响水稻的萌发过程。
-
表2为水稻根系扫描分析得出包括总根长、根表面积、根体积、根尖数和分叉数。由表2可以看出,在Cd胁迫下,根系形态数据均呈现一定程度的下降趋势,尤其是水稻根尖数和分叉数下降更为明显。在没有Cd胁迫的处理中,外源添加Spd可使水稻总根长显著提高,与对照相比,添加500 μmol·L−1 Spd和1000 μmol·L−1 Spd总根长分别提高13.2%和19.6%,其它指标无显著变化。当Cd浓度为10 μmol·L−1时,添加500 μmol·L−1 Spd和1000 μmol·L−1 Spd与对照相比,水稻根体积分别提高24.1%和23.4%。当Cd浓度为30 μmol·L−1时,外源添加500 μmol·L−1 Spd和1000 μmol·L−1 Spd对水稻的根长、根表面积、根体积、根尖数和分叉数的影响均没有达到显著水平。
实验过程中外源添加Spd使水稻根系变强壮,根长和根体积有所提高,因此Spd可以有效缓解Cd对水稻种子萌发过程中对根系的不利影响。
-
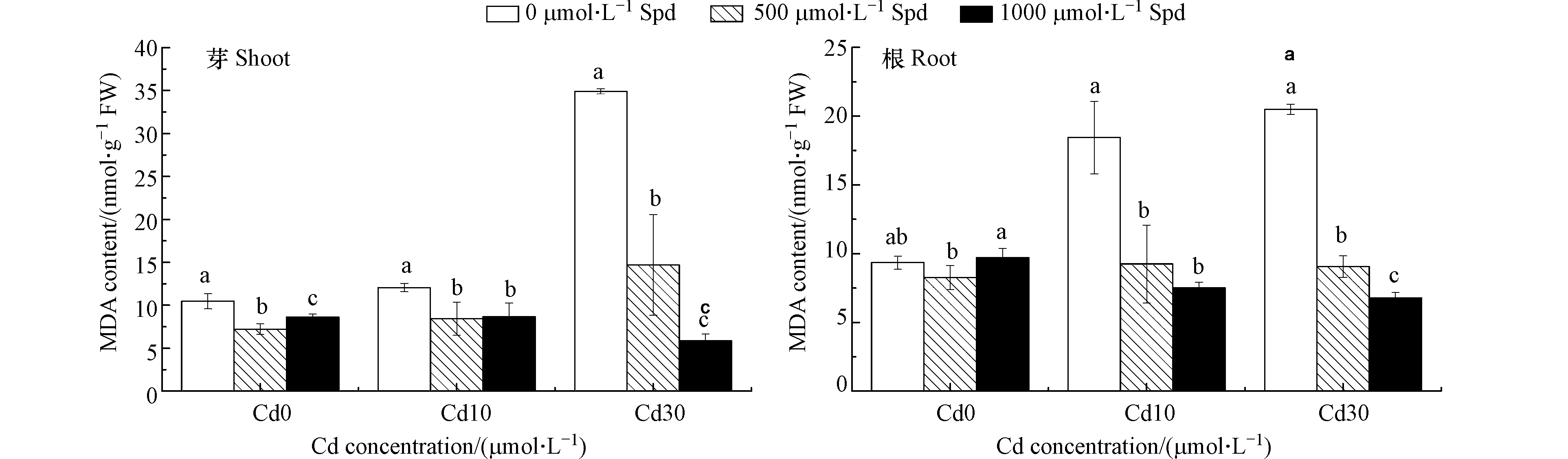
图5为外源添加Spd对Cd胁迫下水稻芽和根系MDA含量的影响,从图5可以看出,在受到Cd的胁迫时,水稻幼芽和根系中的MDA含量均显著提升,10 μmol·L−1的Cd胁迫使水稻芽和根中的MDA含量分别显著提升了15.2%和97.3%(P<0.05);30 μmol·L−1的Cd胁迫使水稻芽和根中的MDA含量分别显著提升了233.3%和119.1%(P<0.05)。当Cd浓度为10 μmol·L−1时,添加500 μmol·L−1和1000 μmol·L−1 Spd导致水稻芽中MDA含量分别比对照降低30.1%和28.2%(P<0.05),水稻根系MDA含量分别降低49.9%和59.3%(P<0.05)。当Cd浓度为30 μmol·L−1时,添加500 μmol·L−1和1000 μmol·L−1 Spd可使水稻芽中的MDA含量分别比对照显著降低57.9%和83.2%(P<0.05),水稻根系MDA含量分别显著降低55.8%和66.9%(P<0.05)。
双因素方差分析结果表明(表3),添加不同Cd、Spd浓度对水稻芽和根系MDA含量的影响均达极显著差异水平,并且Cd和Spd对水稻芽和根系MDA含量的影响有交互作用。
重金属胁迫会引起植物体内的活性氧(ROS)过量积累,这是重金属对植物产生胁迫的反应[23]。ROS是有毒分子,会抑制光合作用、破坏核酸和蛋白质、加速细胞程序性死亡和诱导衰老等[24]。与不饱和烯烃键相邻的氢原子对氧化攻击特别敏感,因此植物膜的不饱和脂质是这种氧化反应的主要目标之一[25]。多数情况下,脂质过氧化反应产生醛类物质,其中最多的就是丙二醛。在体外,丙二醛可以改变蛋白质、DNA、RNA和许多其他生物分子[26],因此MDA含量可以表征植物在受到重金属胁迫时产生大量ROS引起的植物细胞内脂质过氧化的程度。许多研究发现Cd胁迫会使得水稻体内的MDA含量显著上升[27-28]。本研究结果也发现,Cd胁迫会使得水稻幼芽和根系中的MDA含量显著提高,当外源施用Spd时可以使水稻幼芽和根系中的Spd显著降低。这一研究结果说明Spd可以有效缓解Cd胁迫对水稻造成的氧化损伤。Xu等[29]研究发现,外源添加Spd可降低植物体内活性氧水平从而提高空心莲子草对Cu胁迫的耐受性,这与我们的研究结果相类似。
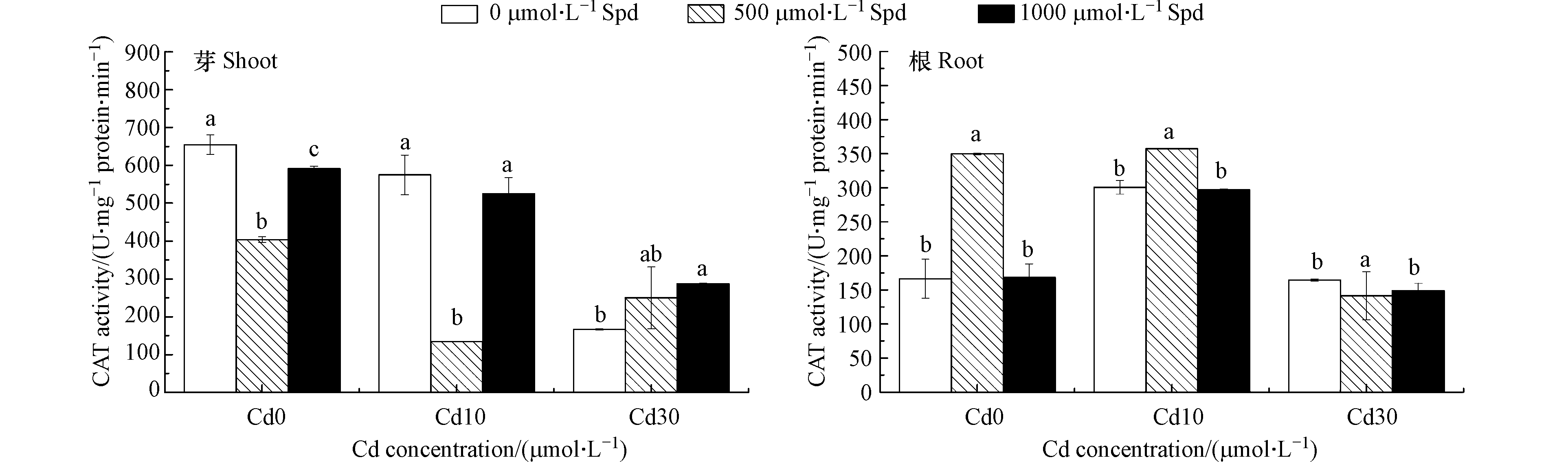
外源添加Spd对水稻幼芽和根中CAT活性的影响见图6.由图6可以看出,Cd胁迫使得水稻幼芽和根系中的CAT活性降低,添加Spd后可以使某些处理水稻幼芽和根中CAT活性提高,从而缓解Cd胁迫。当Cd的浓度为10 μmol·L−1时,外源添500 μmol·L−1 Spd可以使水稻根系CAT活性显著提高18.7%(P<0.05),而当Cd的浓度为30 μmol·L−1时,添加500 μmol·L−1 Spd和1000 μmol·L−1 Spd使水稻幼芽CAT活性分别提高50.1%和72.6%(P<0.05)。
外源添加Spd对水稻幼芽和根系中POD活性的影响见图7。在Cd胁迫作用下水稻幼芽和根系的POD活性有所降低,其中芽中的POD活性降低最为明显。外源添加Spd对水稻根系中POD活性影响不显著,但是对水稻幼芽POD活性有影响。当Cd的浓度为30 μmol·L−1时,与对照相比添加500 μmol·L−1 Spd和1000 μmol·L−1 Spd可以分别显著提高水稻幼芽POD活性175.5%和185.5%(P<0.05)。
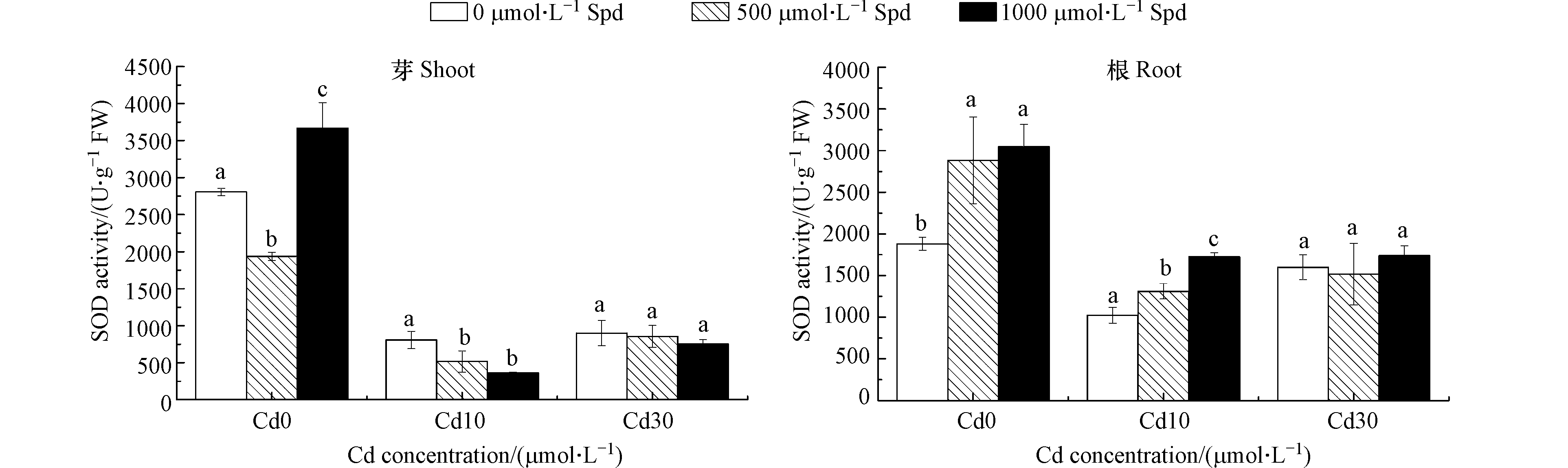
图8为不同浓度Cd胁迫下外源添加Spd对水稻幼芽和根系中SOD活性的影响。由图8可以看出,在没有Cd胁迫的情况下,外源添加Spd可提高水稻幼芽和根系中的SOD活性(除500 μmol·L−1 Spd处理的幼芽以外)。当Cd的浓度为10 μmol·L−1时,外源添加500 μmol·L−1 Spd和1000 μmol·L−1 Spd可使水稻根系中的SOD活性分别显著提升28.1%和68.6%(P<0.05),但使水稻幼芽中的SOD活性分别降低35.9%和54.8%(P<0.05)。当Cd的浓度为30 μmol·L−1时,外源添加Spd对水稻幼芽和根系中的SOD活性均影响不大。
双因素方差分析结果表明(表3),添加不同Cd、Spd浓度对水稻幼芽和根系中CAT、SOD活性的影响均达极显著差异水平,并且Cd和Spd对水稻幼芽和根系中CAT、SOD活性的影响有交互作用。不同Cd浓度对水稻幼芽和根系中POD活性的影响也达极显著差异水平,但是Cd和Spd对水稻幼芽和根系中POD活性的影响没有交互作用。
Cd胁迫对水稻的抗氧化酶系统也产生影响。Talukdar[30]研究发现当扁豆受到Cd胁迫时,植物体内CAT和SOD酶活性将显著降低。Hassan等报道水稻受到Cd胁迫时,其体内的SOD、POD和CAT酶活性普遍降低并且随着Cd胁迫浓度的升高而降低[31]。本文的研究结果与上述研究结果一致,当水稻幼芽受到Cd胁迫时,水稻幼芽中的CAT、POD和SOD酶活性与空白对照相比显著降低,水稻根系除CAT活性外其余酶活性与空白对照相比也显著降低。水稻受到了Cd胁迫,但由于水稻自身防御能力不足,抗氧化酶系统受损使得酶活性降低。外源添加Spd在某些处理中可以缓解Cd对水稻的抗氧化系统的破坏作用,提高CAT、POD和SOD酶活性。在CAT酶的存在下H2O2可迅速转化为氧气和水[32],在H2O2的解毒的过程中,POD酶起着重要的作用。在细胞壁中POD酶以可溶性、离子结合型和共价键结合型的形式存在,除具有作为H2O2清除剂的解毒作用外,还参与许多通过催化作用调节细胞生长的生理过程[33]。SOD酶可以与超氧自由基以扩散受限的速率反应生成H2O2和O2 [34]。施用合适浓度的Spd可以显著提高CAT、POD和SOD酶活性,清除水稻体内的ROS,缓解其对水稻的毒害作用。
多胺(包括Spd)可以与一些信号分子如NO、Ca2+和H2O2相互作用起到信号分子和调节压力的功能,例如在盐度和干旱胁迫下,多胺调节细胞质中的Ca2+水平并诱导NO产生,二者协同作用触发ABA诱导的气孔关闭。多胺还具有如下提高植物抗逆性的功能:减少脂质过氧化和稳定脂质来保持细胞膜完整性;在病原体侵袭和伤口愈合过程中增强细胞壁;保留类囊体膜,光系统的组装,并增加玉米黄质和类胡萝卜素等光保护分子的丰度,从而提高光合作用效率并改善多余能量的耗散;调节离子通道的活性并保持离子平衡;清除活性氧(ROS)和增加抗氧化剂活性保持氧化还原稳态;调节压力反应,例如HR、GABA和其他相容性溶质的积累,并诱导病原相关蛋白(PR)的表达的功能[35],这些可能是亚精胺可以缓解水稻Cd毒害的主要机理。总之,外源施用Spd显著降低了MDA含量,有效清除了ROS防止膜脂过氧化,增强了水稻幼苗的耐Cd性,提高水稻幼苗生长的适应性。在实际应用过程中还应根据不同作物品种和不同逆境条件选择合适的Spd浓度来提高植物的抗逆性。
2.1. Spd对Cd胁迫下水稻种子发芽势和发芽率的影响
2.2. Spd对Cd胁迫下水稻生物量和芽长的影响
2.3. Spd对Cd胁迫下水稻根系形态的影响
2.4. Spd对Cd胁迫下水稻幼芽MDA含量和酶活性的影响
-
(1)Spd和Cd处理对水稻的萌发的发芽势、发芽率和鲜重等一些列指标没有交互影响。
(2)外源添加Spd(1000 μmol·L−1)可分别显著提高30 μmol·L−1 Cd胁迫下水稻种子发芽率和发芽势4.7%和5.9%,外源添加亚精胺可以促进水稻种子的萌发过程。
(3)当Cd浓度为30 μmol·L−1时,与对照处理相比添加500 μmol·L−1和1000 μmol·L−1 Spd可使水稻芽中的MDA含量分别降低57.9%和83.2%,水稻根系MDA含量分别降低55.8%和66.9%,水稻幼芽POD活性分别提高175.5%和185.5%,说明外源添加Spd可以提高水稻体内的抗氧化酶活性,清除活性氧,防止膜脂过氧化,Cd的毒害作用因此被减低。



 下载:
下载: