-
吡啶(pyridine,C5H5N)是一种有毒害的芳香族含氮杂环化合物[1],也是一类重要的化工原料和有机合成中间体,被广泛应用于医药、农药、塑料、染料、合成树脂等领域,此外还可用作溶剂、实验试剂和消毒剂等[2-4]。吡啶结构稳定,代谢过程不易受到破坏,生物降解性差,具有致畸性、致癌性、致突变性,已列入世界卫生组织发布的致癌物2B类清单,由此使得吡啶成为环境领域中备受关注的一类污染物[5]。含吡啶废水毒性大,如果被排放到水体、土壤中会通过食物链在生物体内富集和积累,对生态环境和人体健康造成潜在危害。因此加强对吡啶废水的治理迫在眉睫。
目前针对吡啶废水的治理方法有膜分离法、混凝沉降法、电化学法、微生物降解法和物理吸附法等[6-9]。其中,物理吸附法因处理效果好、操作简单,在工业有机废水处理中备受青睐。其原理是利用吸附剂比表面积、特定官能团的吸附作用去除水中污染物,所以筛选并获得具有良好吸附性能的材料是关键[10]。目前研究的材料集中于活性炭、碳纳米管、石墨烯、无定形碳和一些功能性碳材料等。许多学者对于这些材料进行了深入研究。但人们发现通过复杂过程合成或制备的这些碳材料,不仅消耗了能源、其它化学试剂等,而且成本高,还有可能产生二次污染,因而受到很多专家质疑。因此,因地制宜地探寻更多的新型、经济型材料是吸附材料发展的必由之路。
生物炭作为一种新型低成本环保吸附材料,具有比表面积大、孔隙结构丰富、吸附能力强、环境稳定性好等特点,而被广泛用于去除水体、土壤中的污染物[11-15]。生物炭制备原料来源广泛,应用方法环保高效,适用于去除多类型的有机污染物,大量研究表明,水中有机污染物在介质上的吸附作用包括分配作用和表面吸附作用。生物炭的制备技术成熟,但在生物炭制备原料选材方面没有一致的标准,且有关生物炭吸附有机污染物的吸附机理还有待深入研究。目前对生物炭吸附杂环芳香性有机化合物的研究较多[16-18],基于吡啶本身的性质,许多制备的生物炭吸附效果差,从而少见生物炭吸附吡啶的研究报道[19-21]。
加拿大一枝黄花(Solidago canadensis L.)是一种恶性入侵检疫性杂草,因其广泛蔓延并难以控制,被称为生态杀手,严重威胁我国的农业生产[22-23]。如何防控加拿大一枝黄花已成为棘手的难题。特别是割除后的中晚期加拿大一枝黄花生物量大,难以环保处置。但中晚期加拿大一枝黄花的纤维素、半纤维素、木质素含量高,分别为45.55%、15.86%、11.27%,是制备生物炭的优等级原材料[24]。
本研究从解决加拿大一枝黄花的危害着手,变废为宝,以中晚期加拿大一枝黄花茎秆为材料,开展了生物炭的制备、表征,并将其应用于废水中吡啶污染物的吸附去除,同时采用响应面法优化其吸附工艺,为中晚期加拿大一枝黄花的防控及吡啶废水的有效处理提供新思路。
全文HTML
-
实验材料与试剂:加拿大一枝黄花茎秆来源于长沙县黄花镇郭公渡实验基地。吡啶来源于国家标准物质中心,纯度>96%;甲醇均为色谱纯,购于美国TEDIA公司;超纯水,由实验室超纯水净化系统制得,实验中使用的其它试剂均为分析纯。
实验仪器:RIGOL L-3000高效液相色谱,北京普瑞分析仪器有限公司;UVmin1240紫外可见分光光度计,日本SHIMADZU;Thermo超纯水净化系统(Ultrapure Water System)EASYpure II;SX-5-120箱式电阻炉,天津市泰斯特仪器有限公司;QuadrasorbSI比表面孔隙分析仪,美国康塔公司;S-3400N扫描电子显微镜,日本日立;Tensor 27型傅里叶变换红外光谱仪(FTIR),德国Bruker公司;XRD-6000射线衍射仪,日本岛津。
-
以中晚期加拿大一枝黄花(以下简称SCL)为材料,去除枝叶,洗净、烘干、粉碎、过60目筛后,即得到SCL茎秆粉末,将得到的粉末装入坩埚后置于马弗炉内在100 ℃下保持1 h,再以10 ℃·min−1的升温速度分别升温至400、500、600、650 ℃恒温炭化2 h,冷却至室温后用0.1 mol·L−1的盐酸浸泡6 h,最后用蒸馏水清洗至中性,过滤后烘干即得生物炭。并根据烧结温度的不同,分别命名为SCL-400、SCL-500、SCL-600、SCL-650。
-
利用傅里叶变换红外光谱仪(FTIR)分析生物炭表面官能团,将溴化钾与生物炭于玛瑙研钵中充分研磨后压片,在扫描波数范围为400—4000 cm−1的条件下进行测试;用扫描电子显微镜(SEM)观察生物炭的形貌结构,将生物炭置于胶板上,选取一个观测部位,调节清晰度与放大倍数后进行拍照;利用比表面孔隙分析仪测定生物炭的比表面积,将待测试的生物炭于150 ℃真空下脱气2 h,以氮气为吸附质,在饱和蒸汽压为1.0360×105 Pa,P/P0取点范围为0. 05—0.35的条件下进行检测;用X射线衍射仪观察生物炭的晶体结构,2θ角测量范围为10°—80°,扫描速度为5°·min−1。
-
吸附实验在三角瓶中进行,所有实验重复3次,取平均值。1000 mg·L−1的吡啶储备液由吡啶固体和超纯水配制而成。实验过程中特定浓度的吡啶溶液用超纯水稀释储备液而成。
生物炭对吡啶的吸附量Q(mg·g−1)通过下式计算:
式中,C0和Ce分别表示溶液吸附前后的浓度,mg·L−1;Q为吸附量,mg·g−1;V为溶液的体积,mL;m为吸附剂的质量,mg。
吡啶的吸附率公式如下:
根据实验结果,采用伪一级和伪二级方程对吸附动力学进行拟合,拟合方程式如下:
伪一级模型:
伪二级模型:
式中,Qe(mg·g−1)表示吸附剂达到吸附平衡时的最大吸附量;Qt(mg·g−1)表示t(h)时刻吸附剂的吸附量;k1(h−1)为伪一级动力学的吸附速率常数;k2(g·mg−1·h−1)为伪二级动力学的吸附速率常数。
采用Langmuir方程、Freundlich方程对吸附热力学进行拟合,拟合方程如下:
Langmuir等温线:
Freundlich等温线:
式中,Qe (mg·g−1)是平衡吸附容量,Ce (mg·L−1)是吸附平衡浓度;Qmax (mg·g−1)是最大吸附量,KL(L·mg−1)是一个Langmuir常数,KF(L·mg−1)是Freundlich常数,1/n (无量纲)是吸附的强度。
-
取初始浓度为100 mg·L−1的吡啶溶液50 mL于若干三角锥形瓶中,分别加入0.1 g生物炭,置于恒温振荡器(180 r·min−1,28 ℃)中,振荡不同时间(0.5、1、2、4、6、9 h)后,过滤,滤液采用高效液相色谱测定吡啶浓度。
-
取初始浓度分别为10、50、100、150、200、250、300、350、400 mg·L−1的吡啶溶液50 mL于若干三角锥形瓶中,分别加入0.1 g生物炭,置于恒温振荡器(180 r·min−1,28 ℃)中,吸附反应2 h,过滤,滤液采用高效液相色谱测定吡啶浓度。
-
取初始浓度为100 mg·L−1的吡啶溶液50 mL于若干三角锥形瓶中,添加生物炭,使其投加量分别为0.5、1、2、4、6、10 g·L−1,置于恒温振荡器(180 r·min−1,28 ℃)中,吸附2 h后,过滤,滤液采用高效液相色谱测定吡啶浓度。
-
以单因素实验结果进行Box-Behnken设计,利用JMP软件对实验数据进行分析,并求得最优值。
-
采用高效液相色谱法检测吡啶浓度。HPLC检测条件:Agilent1260高效液相色谱仪,SB-C18反相色谱柱,流动相为甲醇∶水=7∶3,检测波长254 nm,流速1 mL·min−1,进样量10 μL。
1.1. 实验材料与仪器
1.2. 生物炭制备
1.3. 生物炭表征
1.4. 生物炭吸附吡啶实验
1.4.1. 吸附时间对吸附的影响
1.4.2. 吡啶初始浓度的影响
1.4.3. 生物炭投加量的影响
1.5. 响应面优化实验设计
1.6. 吡啶测定方法
-
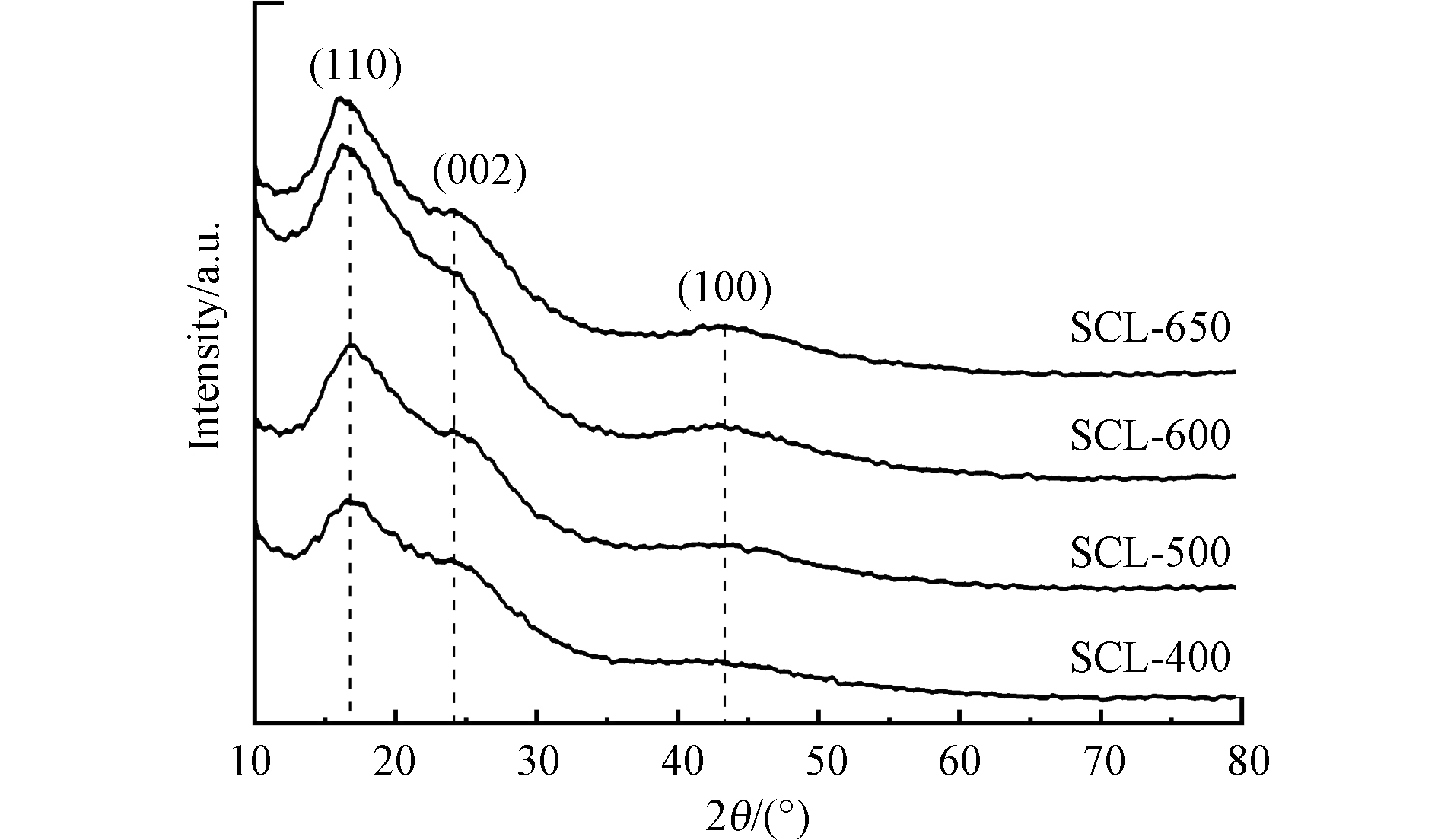
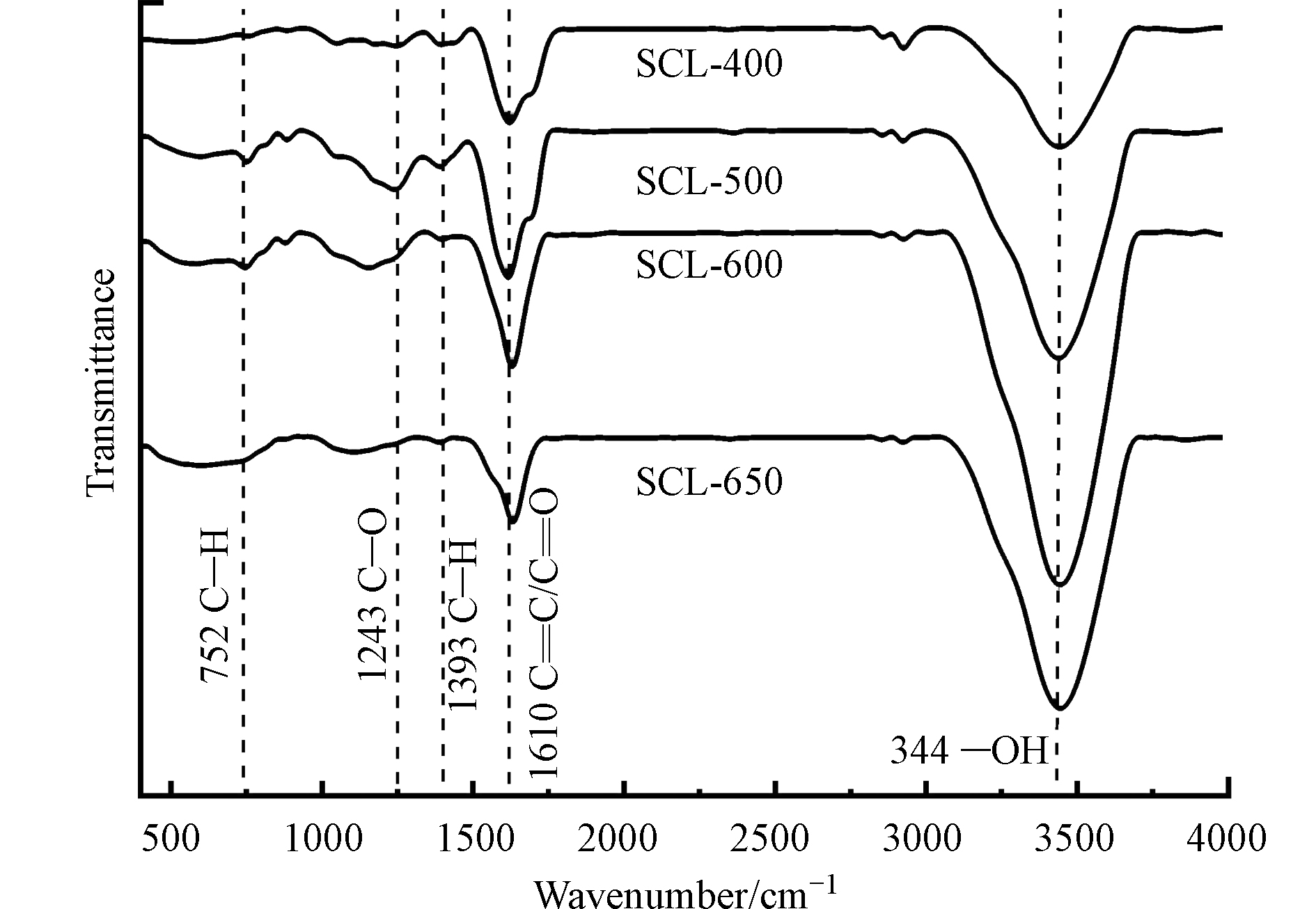
不同炭化温度下制备的生物炭FTIR图谱见图1。由图1可见,炭化温度不同,所制生物炭的红外光谱吸收峰存在明显的差异。
400 ℃热解的生物炭位于3400 cm−1附近的吸收峰为醇类和酚类中的—OH伸缩振动引起,1600 cm−1附近的吸收峰则由羧基的C=O和芳环的C=C伸缩振动引起,1400 cm−1附近的吸收峰为碳水化合物中的甲基/烷烃/醛类的C—H伸缩振动,1250 cm−1附近的吸收峰为纤维素类脂肪族C—O—C官能团的伸缩振动峰[25-26]。碳水化合物和/或纤维素的存在表明生物质尚未分解完全。当炭化温度升高至500 ℃时,醇类和酚类中的O—H峰,以及羧基和芳环的C=O/C=C峰显著增大,表明形成了大量的含氧官能团;当炭化温度为600 ℃和650 ℃时,O—H和C=O/C=C峰不断增强,1400 cm−1的C—H和1250 cm−1C—O—C不断减弱,且752 cm−1处的芳香族C—H谱带增强。芳香体系的存在可增强生物炭的给电子能力,继而增强其对有机污染物的吸附作用。
-
不同炭化温度下制备的生物炭SEM结果见图2。由图2可见,炭化后所制生物炭内部具有丰富的孔隙结构,且炭化温度不同,其微观结构存在明显的差异。在400 ℃和500 ℃下制备的生物炭内部有许多杂乱无章的碎片。原因可能是碳化温度较低,生物质尚未碳化完全,从而残留大量的灰分所致。这可由图1观察到大量碳水化合物和/或纤维素的吸收峰的结果得以证实。当温度升高至600 ℃时,所得生物炭的形貌较为规则,表面有清晰的孔隙结构,表明生物质已经分解完全;随着温度继续升高至650 ℃,生物炭的微观结构被破坏,出现少量的碎片。由此可见,生物质的最佳热解温度为600 ℃。
-
利用N2作为吸附气体测定不同炭化温度下制备的生物炭微孔结构。从表1可知,加拿大一枝黄花茎秆生物炭微孔体积与BET比表面积均随热解温度的升高而增加。这可能是随着热解温度的升高,生物质中的灰分逐渐分解气化,微孔体积显著增加,尤其在400—500 ℃热解过程中,生物炭的BET比表面积从0.80 m2·g−1增加到126.51 m2·g−1。这是因为较高的温度为生物质中挥发性组分的分解释放提供更多的能量,挥发性物质损失更大,反应更加彻底,导致微孔数量增加,比表面积增大[20-21]。
-
不同炭化温度下制备的生物炭XRD图谱见图3。由图可知,在400 ℃、500 ℃、600 ℃与650 ℃下制备的生物炭均在17°左右有明显的纤维素(101)晶面衍射峰,在22°和44°附近出现的宽峰为碳的(002)和(100)衍射峰,表明形成的生物炭为无定型结构[27]。当炭化温度从400 ℃升至600 ℃过程中,生物炭中(002)和(100)晶面衍射峰峰位逐渐向高角度移动,峰强度增强。表明炭化温度升高会使生物炭的石墨层间距收缩,结晶度增加,稳定性增强。结合FTIR和SEM结果推断,可能是因为炭化温度越高,生物质裂解越完全,结晶度越高所致。
-
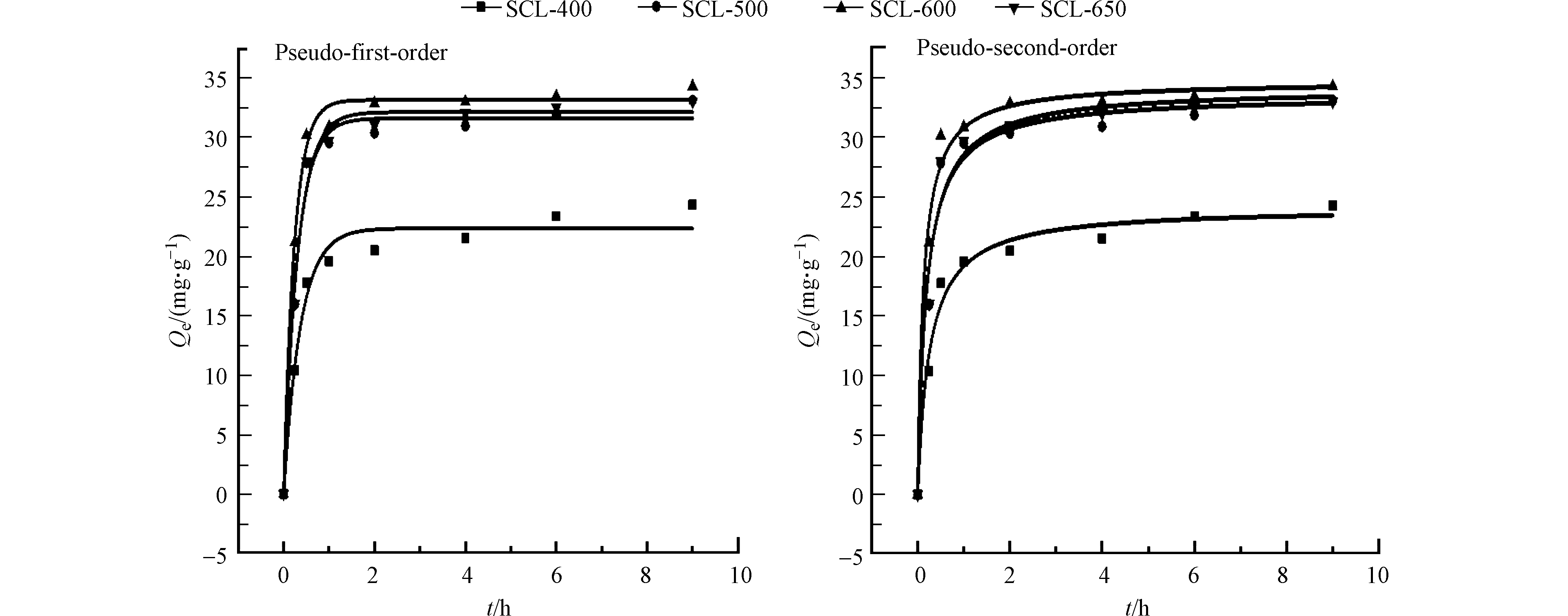
为了进一步探讨生物炭对吡啶的吸附机理,实验研究了吸附时间对生物炭吸附性能的影响,并采用伪一级和伪二级动力学模型对其吸附过程进行拟合,结果见图4和表2所示。由图4可知,当吡啶初始浓度为100 mg·L−1、生物炭用量2 g·L−1,SCL-400、SCL-500、SCL-600和SCL-650等4种材料在反应2 h后达到吸附平衡。平衡时刻SCL-600的吸附量最高,为32.9 mg·g−1;而SCL-400的吸附量最低,仅为20.5 mg·g−1。这主要与生物炭对水中吡啶污染物的吸附机制有关。生物炭对芳香性有机污染物的吸附机制主要为分子尺寸效应引起的孔隙填充作用,吸附过程中存在π-π作用,氢键作用及疏水作用。从上述的FTIR、XRD和BET结果可知,随着烧结温度的升高,生物炭的表面含氧官能团越丰富,芳香化程度和比表面积越大。含氧官能团的存在可增强生物炭的亲水性,有利于其与吡啶污染物的接触;芳香化程度越高,其与吡啶污染物的π-π作用越大;比表面积越大,接触效果越好[28-30]。另外,从SEM图可见,热解温度600 ℃下制备的生物炭结构规则,稳定性最佳,有利于其与目标污染物形成稳定吸附。因此,随着烧结温度的升高,所制生物炭对吡啶的吸附量存在先增大后减小的趋势,当烧结温度为600 ℃所制生物炭的吸附量最大。
由表2的吸附动力学参数可见,4种生物炭的伪一级吸附动力学方程回归系数(R2)均较高,分别为0.974、0.985、0.994和0.988,尤其是后3种生物炭的伪一级动力学方程的R2值均大于伪二级动力学方程的R 2值,说明伪一级动力学方程能更好地反映生物炭对吡啶的吸附动力学机制。伪一级动力学的吸附过程受扩散控制,为物理吸附;而伪二级动力学的吸附过程受结合力控制,属于化学吸附。说明吡啶在4种生物炭上的吸附机理主要是物理吸附。
-
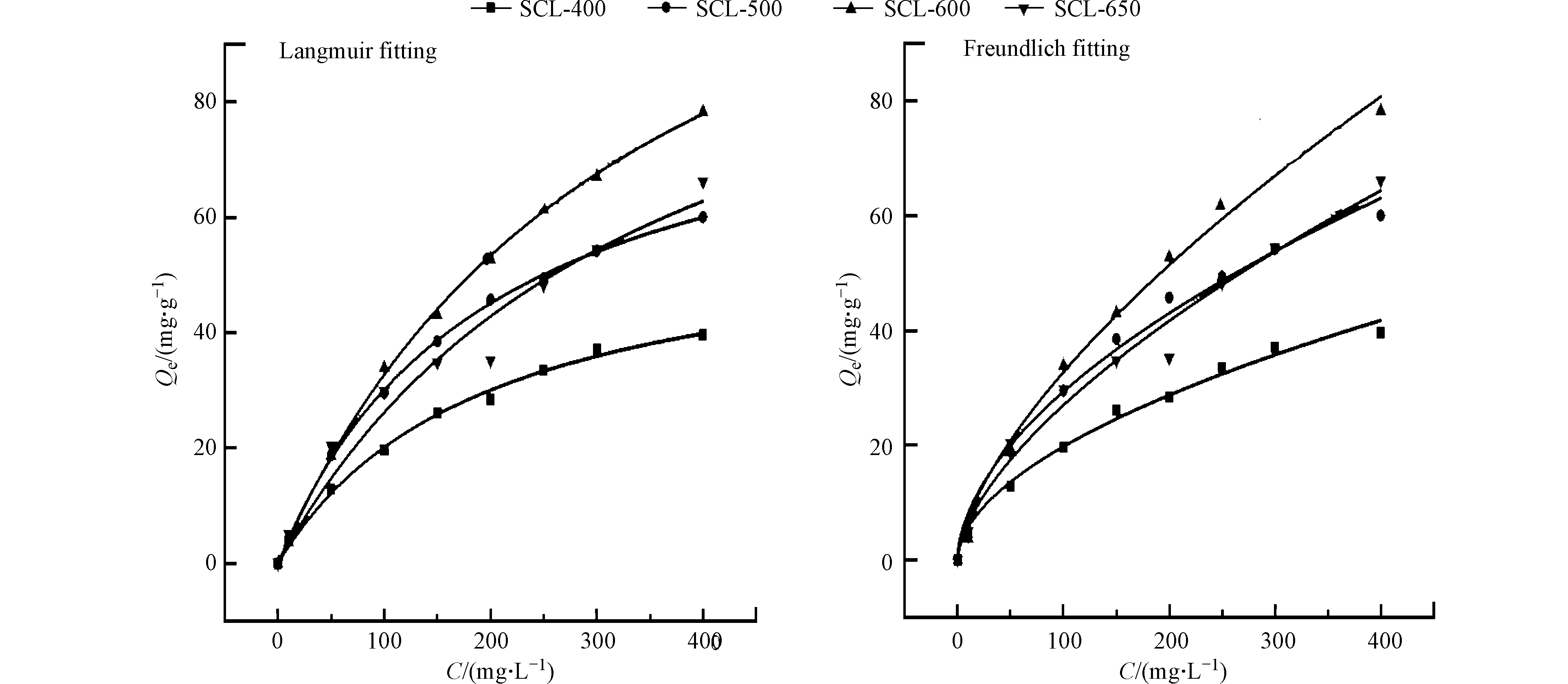
吡啶初始浓度对生物炭吸附性能的影响如图5所示。由图5可知,当吸附时间为2 h,生物炭投加量2 g·L−1时,不同炭化温度下所制生物炭的吸附量均随吡啶初始浓度的升高而呈现上升的趋势,当吡啶初始浓度低于200 mg·L−1时,随着浓度的增大,其吸附量迅速上升;但是当浓度继续增大时,生物炭吸附量的增大趋势变缓。并且,在浓度较低时,SCL-500、SCL-600和SCL-650等3种材料表现出相似的吸附性能;当浓度较大(≥100 mg·L−1)时,SCL-600表现出了优于SCL-500和SCL-650的吸附性能。特别是当吡啶浓度为400 mg·L−1时,SCL-600的吸附容量达77.3 mg·g−1,表现出极高的去除能力。这说明以中晚期的加拿大一枝黄花茎秆为原料,在600 ℃的炭化温度下制备成生物炭对水体中的吡啶污染物有高效的去除作用。
根据实验结果进行Langmuir和Freundlich方程拟合,相关参数如表3所示。由表3可知,Langmuir和Freundlich模型拟合线的R2都大于0.9,两种吸附等温方程都能很好的拟合实验数据,说明吡啶在生物炭上的吸附过程受到多种吸附机制的作用。然而Langmuir吸附模型的R2值大于Freundlich模型中的R2值,说明Langmuir吸附模型可以更好地描述本吸附过程。Freundlich吸附等温模型描述的是多分子层吸附,Freundlich模型中包含KF和n两个经验常数,其中n值与吸附反应的难易程度有关,当1/n的值小于0.5时可判断该吸附过程较为容易,本实验中Freundlich模型中的1/n值在0.5附近,说明该吸附过程较为容易,Langmuir吸附等温模型描述的是单分子层吸附,用Langmuir吸附模型进行拟合,结果显示炭化温度升高,吸附量受生物炭表面吸附位点的影响,生物炭表面吸附位点增多,生物炭对吡啶的吸附量增加,SCL-600对吡啶的最大吸附量为144.44 mg·g−1。
-
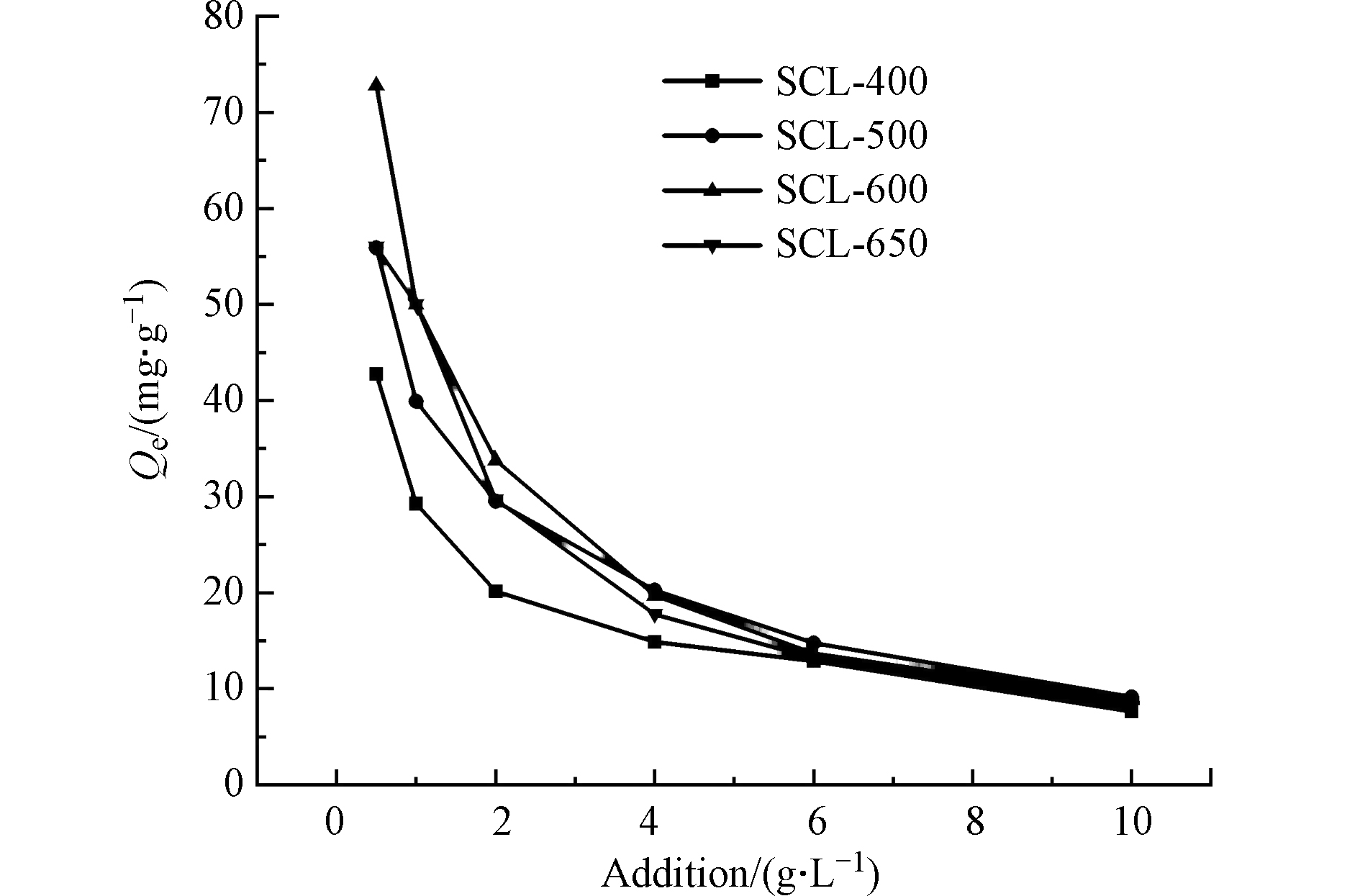
生物炭投加量对吡啶吸附去除的影响如图6所示。由图6可见,当吡啶浓度为100 mg·L−1,吸附时间为2 h时,随着碳用量的增加,4种生物炭均表现出吸附性能减小的趋势。这是因为各种碳用量下反应体系中吡啶的初始浓度(C0)是固定的,从1.4节的计算方程式(1)可以看出,这种减小的趋势属于正常现象。在生物炭投加量较低(0.5 g·L−1)时,SCL-400、SCL-500、SCL-600和SCL-650等4种材料均表现出优异的吸附性能,其中SCL-600的吸附容量高达72.8 mg·g−1,说明加拿大一枝黄花是制备高效吡啶吸附剂的材料。
-
由生物炭的表征及单因素实验结果可知,SCL-600对吡啶的吸附效果最佳,故采用其进行响应面优化实验,根据单因素实验确定3个显著因子的最适范围后,以生物炭投加量5 g·L−1、初始浓度100 mg·L−1、吸附时间3 h为中心点进行响应面实验设计,各因素水平见表4。
由表5可知,3个显著因子对响应值的影响排序为:初始浓度(A)>生物炭投加量(B)>吸附时间(C)。其中,A、B对Y(吸附率)的影响差异极显著,A、B对Y的影响高度显著,而C、AC、BC、A2、B2和C2对Y的影响不显著。以吡啶吸附率为响应值,设计3因素3水平的Box-Behnken实验,实验结果见表6。
运用JMP软件对15组实验结果进行模型拟合,得吸附率实际值与预测值的拟合模型,R2=0.974,说明方程的拟合度较好,可以用该方程进行实验结果预测。通过因子刻画器的最大意愿值预测模型可知生物炭投加量、初始浓度、吸附时间的最佳组合(见图7)。由图7可知,生物炭投加量4 g·L−1、吡啶初始浓度102.10 mg·L−1、吸附时间2.89 h,此时生物炭SCL-600对吡啶的吸附率达到最大值97.92%,表现出优异的吸附性能。
2.1. 生物炭的结构表征
2.1.1. 红外衍射(FTIR)
2.1.2. 电镜扫描(SEM)
2.1.3. 比表面积(BET)
2.1.4. X射线衍射(XRD)
2.2. 吸附实验结果
2.2.1. 吸附时间的影响
2.2.2. 初始浓度的影响
2.2.3. 生物炭投加量的影响
2.3. 响应面优化结果
-
以中晚期加拿大一枝黄花茎秆为原料,在400 ℃、500 ℃、600 ℃和650 ℃烧结制备生物炭。随着烧结温度的升高,含氧官能团、芳香化程度和比表面积逐渐增大,且600 ℃下制得的生物炭材料结构规则,稳定性最高,制得的生物炭材料对吡啶有良好的吸附性能。当吡啶初始浓度100 mg·L−1、生物炭用量2 g·L−1,600 ℃制备的生物炭对吡啶的性能最佳,反应2 h后达到吸附平衡,吸附容量32.9 mg·g−1。吸附动力学符合伪一级动力学模型,为物理吸附,受扩散控制。吸附等温线表示Langmuir模型能更好地拟合生物炭对吡啶的吸附过程,600 ℃制备的生物炭对吡啶的最大吸附量为144.44 mg·g−1。实验结果表明,中晚期加拿大一枝黄花茎秆是优异的生物质原料,可通过热解制成生物炭吸附去除水体中的吡啶污染物。



 下载:
下载: