-
自工业革命以来,随着化石燃料使用、土地利用方式的改变及森林的大量砍伐等人为活动加剧,大气CO2浓度明显升高,由工业革命前的280 μL·L−1快速升高至现在的410 μL·L−1 [1]. 与此同时,碳稳定同位素比值也发生了明显变化,主要原因是,地质历史时期形成的化石燃料相对当前大气CO2富集12C,其燃烧产生的CO2大量进入大气时,会明显降低大气CO2的δ13C值[2]. 有研究显示,大气CO2的δ13C值已由工业革命前的−6.5‰降至现在−8.0‰ [3-4]. 伴随大气CO2的δ13C值的降低,海水溶解无机碳(DIC)因与大气直接发生气体交换,其δ13C也会发生明显改变. 例如,太平洋表层海水的δ13CDIC在1970—1990年间降低了0.4‰[5].
鉴于δ13CDIC在示踪碳的来源和循环过程[6-8]及相关通量估算[5, 9-10]等方面的应用,迄今国际上已在多个海域开展海水δ13CDIC的分布特征及变化规律的研究. 例如,南印度洋海表δ13CDIC呈现夏季高于冬季的分布特征,且最大变化幅度约为0.3‰[11]. 阿拉伯海附近不同季风期海表δ13CDIC值分布范围在0.7‰—1.0‰之间,且主要受生物活动的影响[12]. 我国迄今关于海水δ13CDIC的相关研究开展较少,仅在南海北部和东北部、胶州湾,以及长江口外、黄河口外、珠江口外等海域有数据报道[7, 13-17].
当前,δ13CDIC正在成为研究海洋缺氧酸化形成机制的有效工具. 基于有机碳矿化产生CO2的δ13C值能继承其来源有机物δ13C特征的原理,在长江口、珠江口、墨西哥湾北部等区域,成功解析出缺氧酸化发生过程中耗氧有机物的来源组成,这将在很大程度上指导实施旨在改善水体缺氧酸化现象的管控措施[15, 17-18]. 目前黄渤海同样受到季节性缺氧酸化现象的影响. 据调查,黄海冷水团区域因群落呼吸作用积累起大量CO2,并且在夏、秋季水文条件下无法排放,造成显著的季节性酸化现象[19]. 另外,2011年至2017年间渤海夏季的底层水溶解氧(DO)呈现波动下降趋势,个别海域已经接近2 mg·L−1这一缺氧阈值[20].
黄渤海作为与西太平洋直接和间接连接的陆架边缘海,其生物地球化学特征的变化集中体现了人类活动和全球变化对边缘海的影响. 另外,黄渤海有着丰富的渔业资源和大量的水产养殖基地,是中国重要的海洋经济区. 然而季节性缺氧酸化现象的发生,会对黄渤海底栖生物的群落结构[21]和海水养殖产业产生严重影响,因此对黄渤海海域季节性缺氧酸化现象的产生机理及环境效应的研究势在必行. 开展δ13CDIC的调查研究,有助于深入认识该海域缺氧酸化的形成机制. 迄今在黄渤海区域除了在胶州湾和黄河口曾开展过δ13CDIC示踪水体碳化学过程外[7, 16],尚未见在黄渤海开阔海域报道关于δ13CDIC的结果,更无从探讨δ13CDIC的变化与该海域季节性缺氧酸化的关系.
水体δ13CDIC分析的前处理有沉淀法[22]和气体法[23]两种. 其中沉淀法不适用于海水等含有高浓度硫酸盐的水体[24],所以海水δ13CDIC的分析多基于气体法. 其原理是将水样加磷酸酸化后收集产生的CO2进行测定[25]. δ13CDIC的测定通常采用稳定同位素比质谱仪(IRMS),该法在国内外碳的稳定同位素测定方面应用很广[26-30]. 近年来,随着光腔衰荡光谱技术(CRDS)的发展,也有研究者将其用于CO2的δ13C测定[25, 31-32]. 相比于IRMS来说,CRDS分析技术具有更高的仪器稳定性、便携性,而且成本更低. 已有的研究显示,将基于CRDS技术的CO2同位素分析仪应用于海水δ13CDIC测定,可得到与IRMS相当的准确度和精密度[25].
本研究设计并优化了一种海水中δ13CDIC分析样品的前处理方法,并且与基于CRDS技术的CO2同位素分析仪联用,测试了黄渤海夏季缺氧酸化发生海域典型断面的δ13CDIC,探讨其分布特征及可能的影响因素.
全文HTML
-
在优化δ13CDIC预处理过程的方法实验中,用到的海水样品为青岛鳌山湾近岸海水. 于涨潮时使用25 L水桶(高密度聚乙烯材质)采集,使用前先静置1 d,只取用上清液,以消除水体悬浮颗粒物对δ13CDIC测定的干扰.
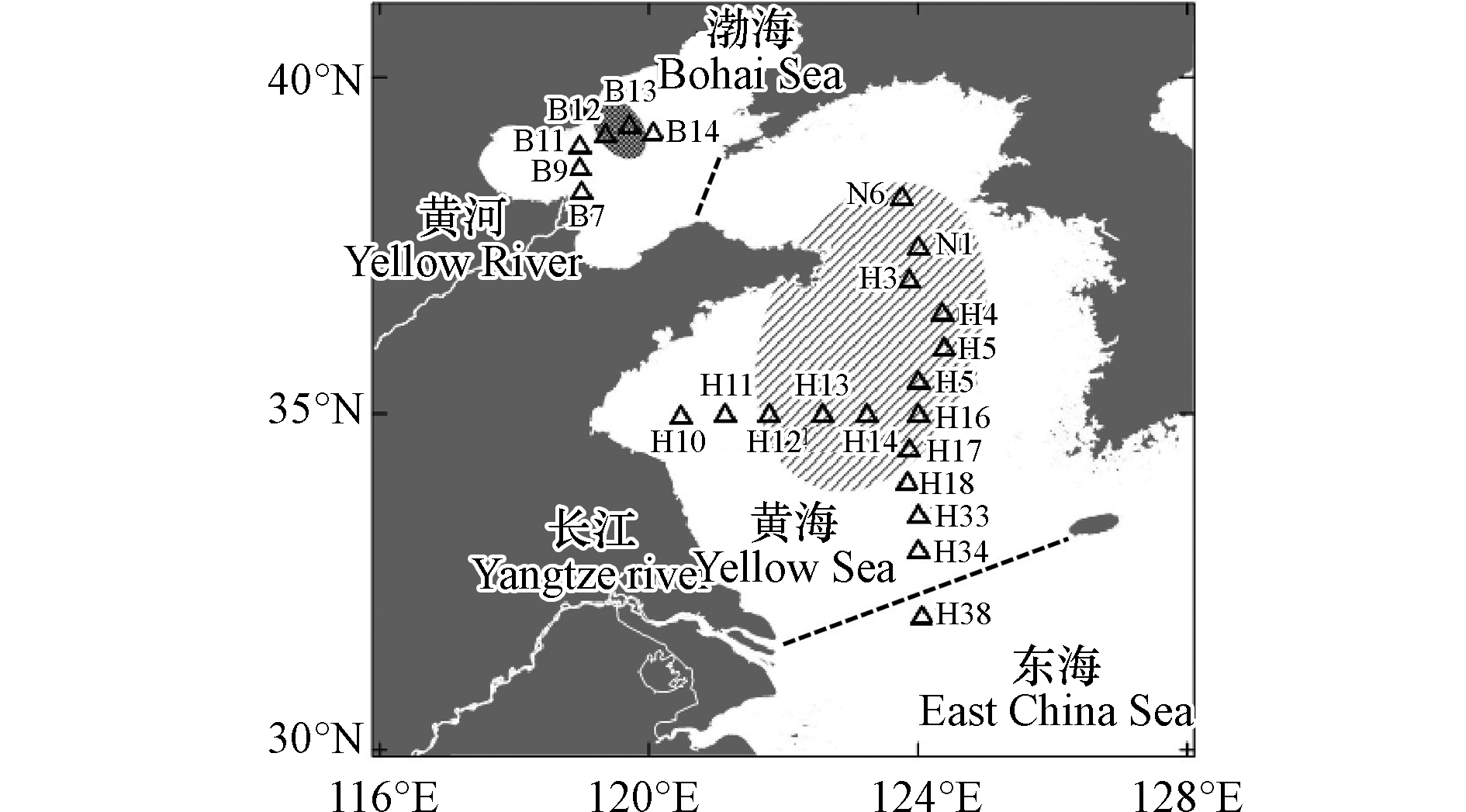
在开展黄渤海夏季δ13CDIC分布及影响因素研究中,水样于2019年7月26日—8月3日期间,利用参加国家自然科学基金委员会渤、黄海共享航次(NORC2019-01)的机会,在“北斗”号和“蓝海101”科学考察船上采集,采样站位见图1. 其中在渤海区域共计6个站位进行了采样,样品数为18,对应于站位编号B7、B9、B11—B14;在黄海35°N断面共计5个站位进行了采样,样品数为19,对应于站位编号H10—H14; 在黄海124°E断面共计12个站位进行了采样,样品数为43,对应于站位编号N6、N1、H3—H5、H15—H18、H33—H34、H38. 另外,在航次调查中,通过当年新购置安装的直读式(SBE911+)或自容式(SBE25)温盐深剖面仪(CTD)获取了水温和盐度数据. DIC、δ13CDIC以及北黄海和渤海的DO使用导管溢流的方法采集水样. 南黄海DO数据通过直读式CTD上的DO传感器(SBE43)获得,此航次为该CTD的首次使用,所配各个传感器都是新近标定过的,DO数据准确度±1 μmol·kg−1.
黄海和渤海的DO采用Winkler流程现场滴定,不确定水平<0.5%[20],相当于准确度±1 μmol·kg−1. 为了指示水体新陈代谢水平,通过大气平衡DO与实测DO的差减计算出表观耗氧量(AOU),AOU>0通常表示以呼吸作用为主,而AOU<0则表示水体以光合作用为主. DIC和δ13CDIC水样盛装在60 mL螺口硼硅酸盐玻璃瓶中,都添加50 μL饱和HgCl2溶液,随后密封保存直到带回实验室进行分析. DIC浓度使用美国Apollo公司出品的AS-C3型仪器进行测定[19].
-
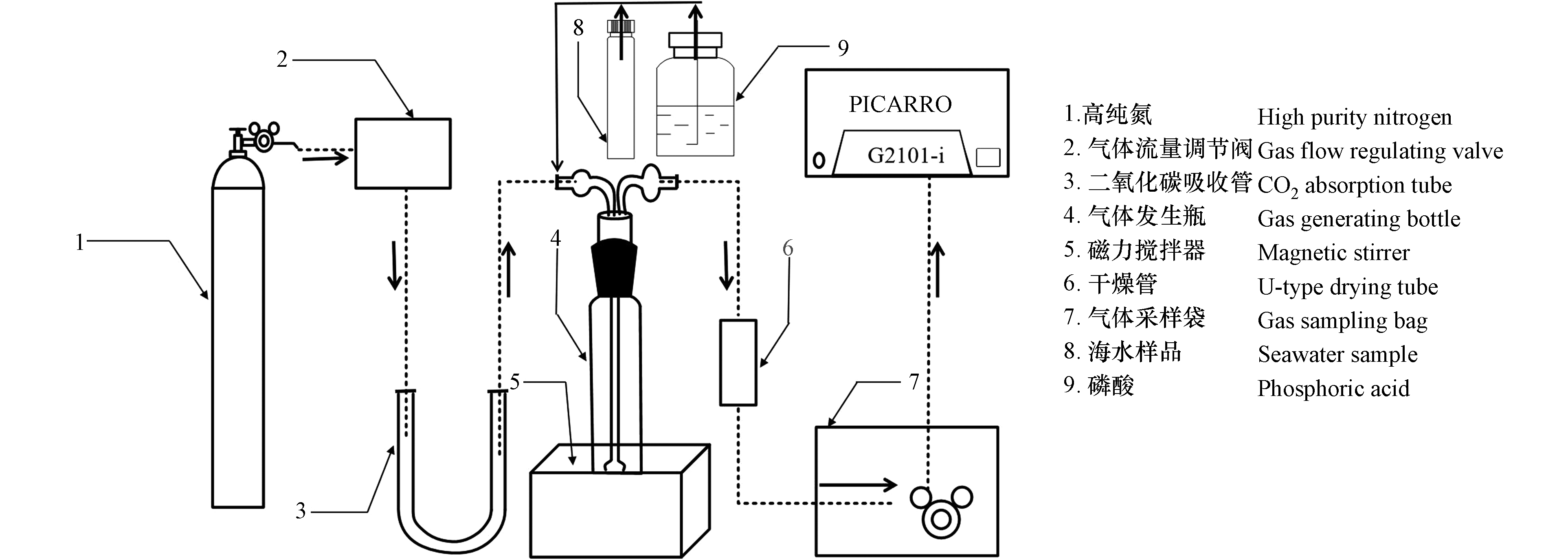
CO2的生成、收集以及测定系统如图2所示. 在室温条件下,首先开启高纯氮(纯度>99.999%)阀门,通过高精度气体流量调节阀(SS-33S3F型,北京熊川科技公司)精准调节好所需载气流速,载气通过装满碱石灰的U型CO2吸收管(消除高纯氮中可能残余的CO2气体)进入气体发生瓶,吹洗1 min以去除气体发生瓶内部的CO2气体. 随后使用针头注射器向气体发生瓶中加入海水样品和过量的1 mL 85%磷酸,立即打开磁力搅拌器和气体采样袋阀门并开始计时,酸化产生的CO2气体在载气的推动下通过装有高氯酸镁的干燥管定量地收集到气体采样袋中(最大容积1 L,MBT41型铝塑复合膜—旋塞侧向阀,大连海得公司),收集结束后立即关闭气体采样袋阀门. CO2气体收集完毕后将气体采样袋通过硅胶管与G2121-i型CO2同位素分析仪(美国Picarro公司)相连,进行δ13CDIC的测定. 为了确保测定结果的准确性,在样品的采集、预处理与测定过程中,注意避免样品被大气CO2污染;实验用到的玻璃器皿,均提前用2 mol·L−1盐酸浸泡24 h并用超纯水清洗干净;气体采样袋在使用前用高纯氮清洗3次,并将其抽真空,关闭侧向阀,备用.
δ13CDIC值的定义为:δ13CDIC=[(R样品/RV-PDB)−1]×1000‰,其中R=13C/12C. 样品的实际δ13CDIC值通过直线工作曲线(线性范围从−34.13‰V-PDB到5.89‰V-PDB,n=4, r2> 0.99999)进行校正.
标准物质选用不同碳同位素组成的尿素标准品(δ13C=−34.13‰V-PDB, −9.14‰V-PDB和5.89‰V-PDB, Biogeochemical Laboratories, Indiana University)和IAEA-600标准品(咖啡因,δ13C= −27.771‰V-PDB,国际原子能机构),通过与G2121-i型CO2同位素分析仪串联的元素分析仪(型号ECS4024,意大利Costech Technologies公司)以燃烧法进样.
-
综合考虑G2121-i型同位素与气体浓度分析仪的仪器需求(待测气体中CO2的浓度须达到2000—4000 μL·L−1;检测时间>10 min)以及实际海水的DIC浓度范围(2000—2400 μmol·kg−1),测定时设置海水样品量为30 mL. 为了有效吹出并收集海水样品中DIC转化的CO2,从而保证δ13CDIC的精确测定,本研究考察了室温条件下预处理过程中搅拌情况、吹扫载气流速和吹扫时间对海水样品中δ13CDIC测定的影响,并同时测定DIC的回收率. 回收率的计算方法为:
式中,初始值为条件实验前海水平行样的DIC值,剩余值为实施条件实验的海水样品中残余的DIC值. 每种实验条件均平行实施3次(下同). 首先,固定吹扫时间5 min,选择不同载气流速(60、100、150、200 mL·min−1)进行δ13CDIC的预处理及测定,评估载气流速对δ13CDIC测定的影响,以此优化载气流速;同时在不同载气流速条件下考察样品搅拌与否对δ13CDIC测定的影响. 随后,在优化的载气流速条件下,考察吹扫时间(2—7 min)对δ13CDIC测定的影响,并确定最优吹扫时间. 最后,在选取的优化预处理条件下,对鳌山湾海水样品平行测定6次,考察本方法对于δ13CDIC测定的精密度.
1.1. 样品采集与辅助数据分析
1.2. δ13CDIC的预处理及测定
1.2.1. 样品预处理及测定流程
1.2.2. 实验条件的选择与优化
-
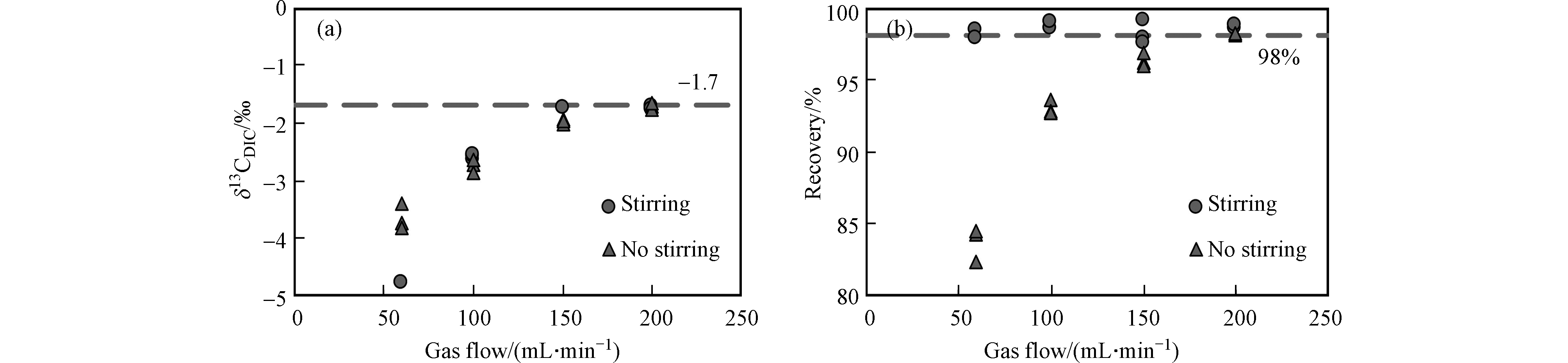
海水样品中DIC转化的CO2气体能否被有效收集,是影响δ13CDIC测定准确度的关键. 吹扫载气流速的条件实验结果(图3)显示,无论搅拌与否,δ13CDIC值都随着流速的增加先快速升高,然后趋于稳定. 这主要受控于同位素动力学非平衡分馏效应,相对来说轻的同位素组分活性更高,能够更快、更容易地在产物中富集,故流速较小时,12CO2被相对优先吹出,δ13CDIC测定值偏负,而随着载气流速增大,13CO2也被有效吹出,δ13CDIC值会随之升高,并逐步趋至样品的δ13CDIC真值. 相比于未搅拌条件,搅拌能够提高δ13CDIC的测定精度,尤其是在低流速条件下,δ13CDIC测定的标准偏差(SD)由未搅拌时的0.19‰降至搅拌时的0.03‰,而且搅拌能够明显提高DIC提取的回收率,有效增大其提取效率,使得在较低的吹扫流速下,δ13CDIC提前趋于稳定. 不过在高流速条件下(200 mL·min−1),搅拌与否对δ13CDIC的测定影响不大. 当载气流速条件为150 mL·min−1和200 mL·min−1时,有搅拌的实验组在吹扫5 min之后的δ13CDIC值分别为−1.75‰(SD=0.09‰, n = 3)和−1.73‰(SD=0.03‰, n=3),这两个δ13CDIC平均值之间的差异仅为0.02‰,优于当前对海水δ13CDIC测定的精密度要求(±0.05‰)[33],并且此时回收率已达98%—99%,因此在后续实验的预处理过程中选择加入搅拌步骤,且设定载气流速为150 mL·min−1.
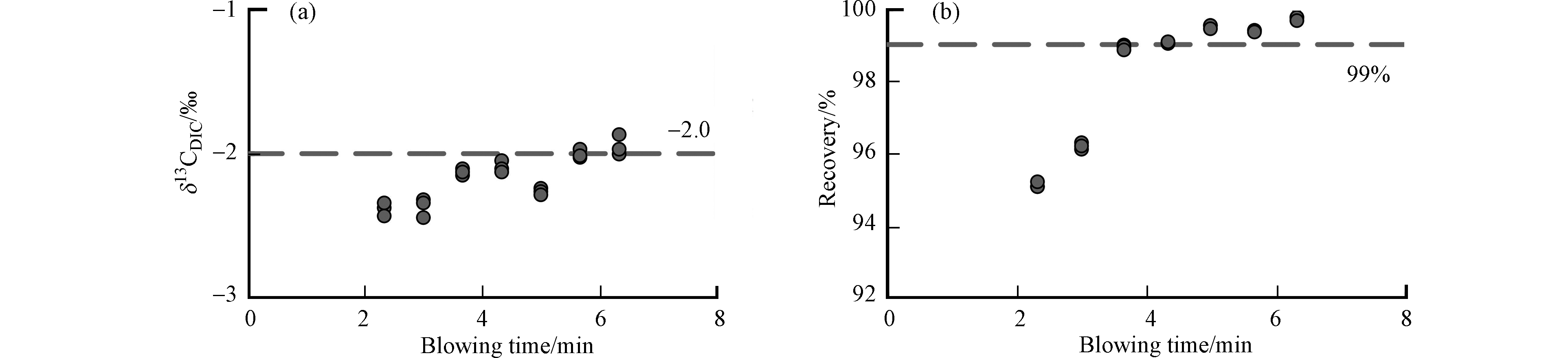
针对吹扫时间的条件实验结果(图4)显示,在载气流速150 mL·min−1条件下,2—3 min的吹扫时间太短,DIC未完全转化为CO2,且根据动力学分馏效应,此时12CO2居多,δ13CDIC值偏负,平均值为−2.38‰,且DIC的回收率偏低,不足97%. 随着吹扫时间增加,δ13CDIC值在3 min 40 s和6 min 20 s的平均值分别为−2.13‰(SD=0.03‰, n=3)和−1.95‰(SD=0.07‰, n=3),在此时间段内样品间标准偏差仅为0.12‰,可以满足研究需要[34],并且回收率也超过99%. 因此为了同时节省时间成本和满足仪器的检测浓度要求,在载气流速150 mL·min−1条件下,选择4 min 20 s作为样品的吹扫时间.
-
在基于最优预处理条件下,对鳌山湾近岸海水的δ13CDIC进行了测定,其中δ13CDIC的平均值为−1.12‰,标准偏差为0.05‰(n = 6),极差为0.16‰. 根据前人研究结果,基于CRDS技术对海水δ13CDIC的测定精度应该优于0.20‰[25, 34],而在本研究优化的预处理条件下,测定精度已经达到这一标准,完全可以满足研究的需要.
-
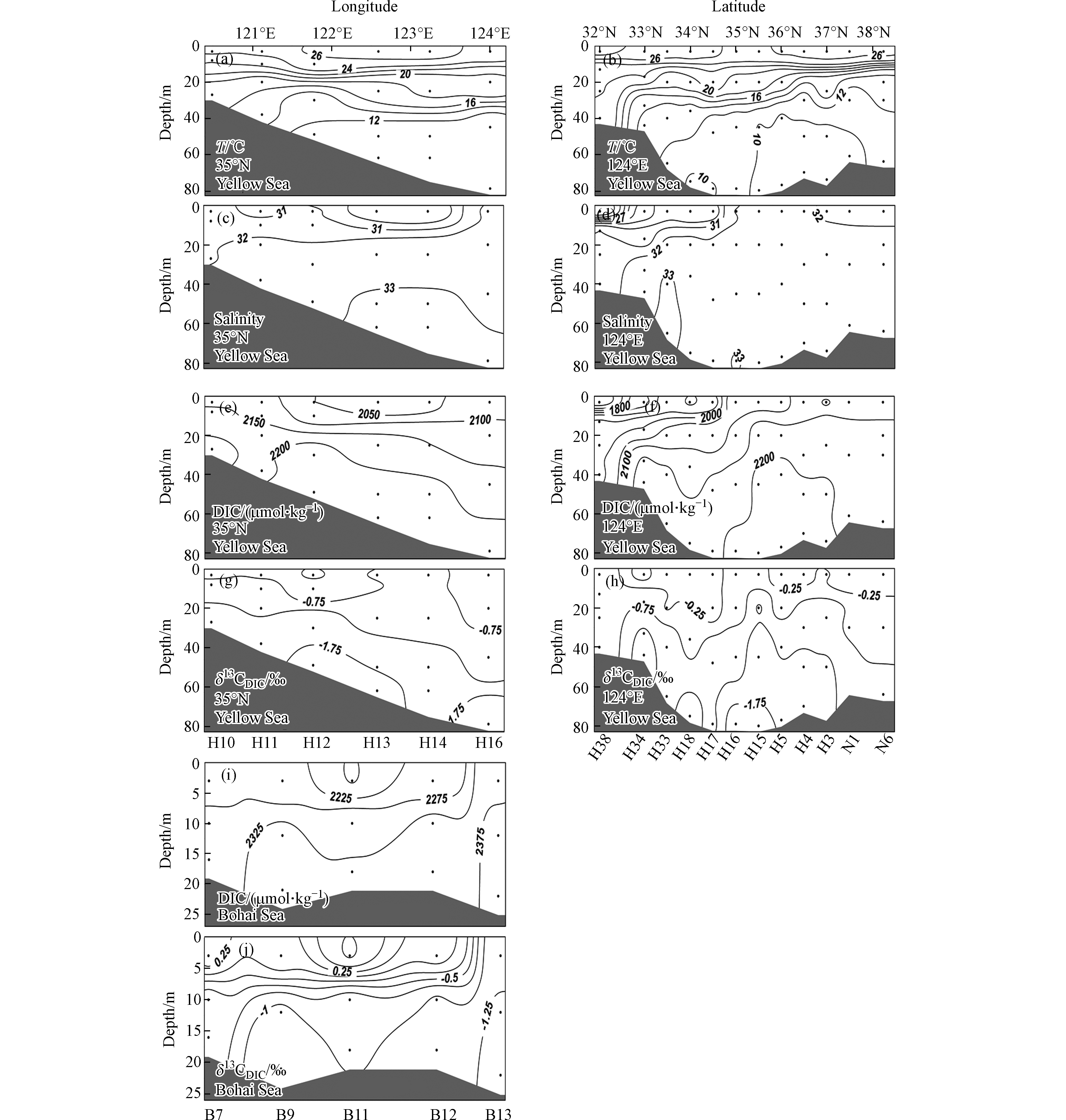
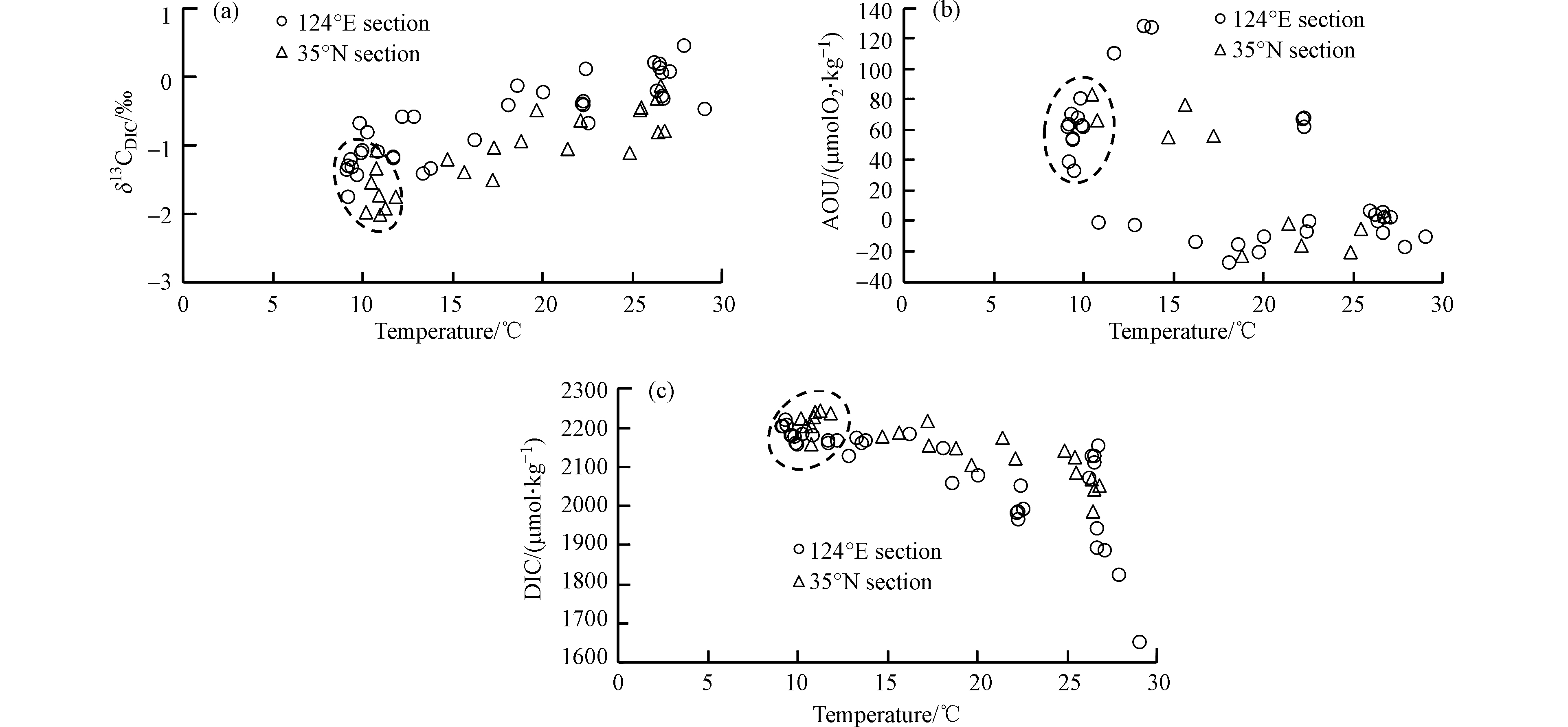
黄海夏季出现显著的水体层化现象(图5a、b). 表层海水因受到阳光的强烈照射,水温高到24.9—29.1 ℃,平均值为(26.6±0.9) ℃. 底层水温分布差异较大,某些沿岸站位和南黄海南端站位的底层水温较高,而在中央及以北海域,底层水温仅为9.2—10.9 ℃,平均水温为(10.0±0.7 )℃(图5b). 黄海表层存在两个低盐区(图5c、d),一个在黄海南端,平均盐度为27.7±3.0,另一个在西部H13、H14站位,平均盐度为29.1±0.2,其余海域的平均盐度为31.8±0.5. 相比表层来说,底层水盐度分布较为均匀,平均盐度为32.6±0.5. 黄海夏季底层低温水反映出黄海冷水团的典型特征,该冷水团的盐度往往超过32(图5c、d).
黄海DIC的分布趋势与盐度的分布趋势基本一致. 在表层,除低盐区的DIC平均值较小,仅为(1841±114) μmol·kg−1以外(图5e、f),其它区域DIC平均值为(2110±35) μmol·kg−1;底层水的DIC整体较高,平均值为(2189±58) μmol·kg−1. 相对于黄海来说,渤海水的DIC较高(图5i),表层水平均值为(2239±70) μmol·kg−1;而底层水的DIC平均值为(2336±24) μmol·kg−1,最高值出现在B13站位,DIC达2380 μmol·kg−1.
黄海表层水的δ13CDIC分布范围在−1.1‰—0.5‰之间,除了黄海西部海域表层δ13CDIC比较偏负以外,整体分布比较均匀,平均值为−0.2‰±0.5‰. 而底层水差异较大,分布范围在−2.0‰—−0.4‰之间,平均值为−1.4‰±0.5‰,在黄海中央出现低值区. 相对于黄海来说,渤海表层水的δ13CDIC数值变异较大,范围在−1.2‰—1.0‰之间,而底层水的δ13CDIC范围在−1.3‰—−0.5‰之间,低值出现在西北部水体.
黄渤海表层水的δ13CDIC分布在−1.2‰—1.0‰之间,大部分数据集中在−0.5‰—0.5‰范围,这与盐度超过30的其它海域表层海水的δ13CDIC值分布范围基本一致(图5g、h). 例如,长江口外东海北部盐度大于30的水体中δ13CDIC值分布在−1.2‰—0.8‰之间[15],珠江口外南海北部盐度大于30的水体中δ13CDIC的平均值为0.0‰[17]. 在美国墨西哥湾北部有陆源水输入的区域,表层海水δ13CDIC值分布在−4.0‰—0.0‰之间,而该海域底层水的δ13CDIC则一般在−2.0‰—0.0‰之间[18]. 本研究得到的黄渤海底层水的δ13CDIC分布在−2.0‰—−0.4‰之间,平均值为−1.3‰±0.5‰,与墨西哥湾北部相近.
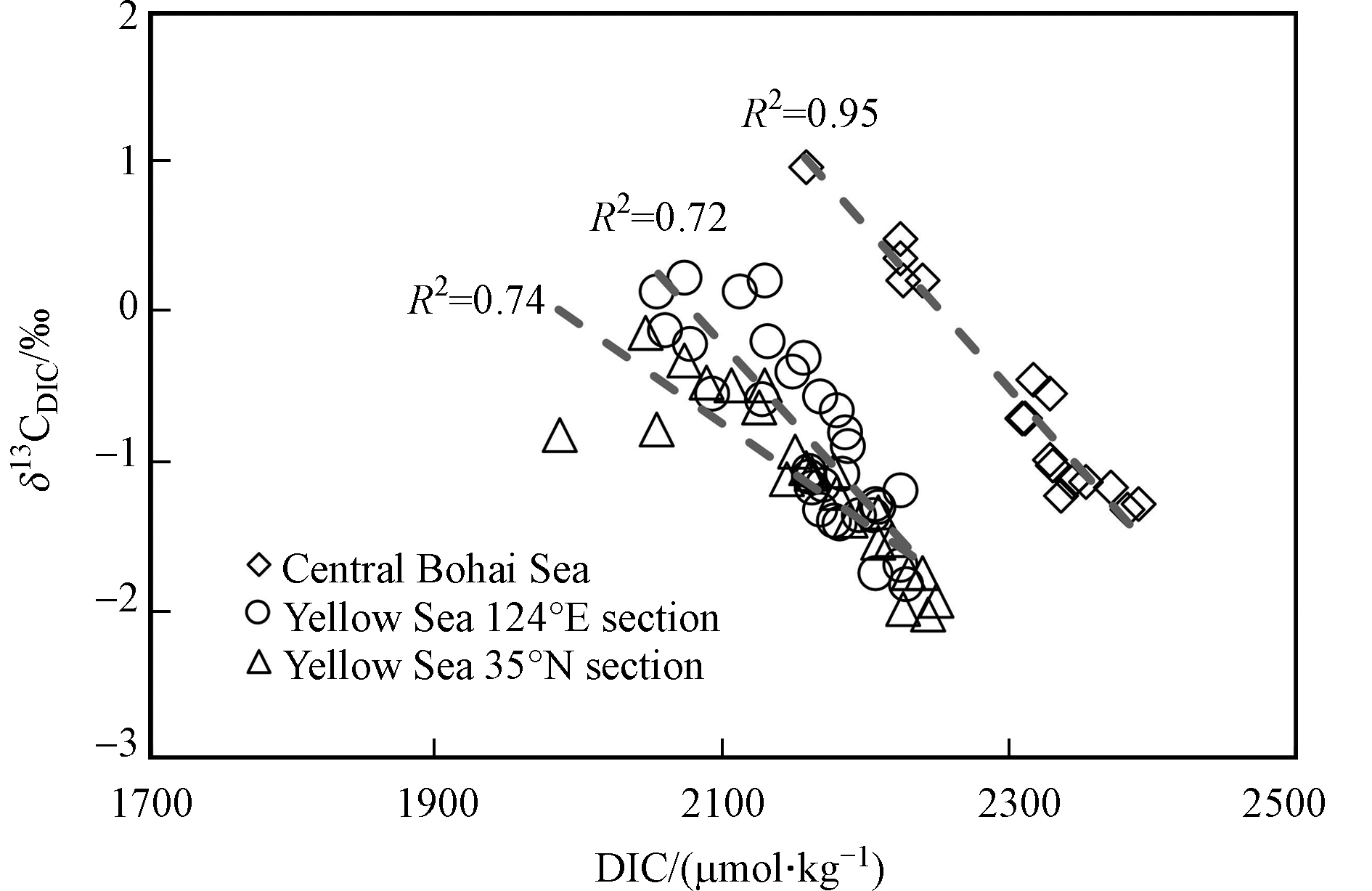
整体而言,黄渤海δ13CDIC的分布呈现表层高、深层低的特征,与南海东北部以及大西洋、太平洋等开阔海域的δ13CDIC垂直分布特征[13, 35]一致. 近岸海域的δ13CDIC和DIC通常受到河海水混合、海-气交换、初级生产、有机物降解、碳酸钙的形成与溶解等多种生物地球化学过程的影响[36]. 本研究只考虑其中最主要的海气交换、初级生产和生物呼吸等过程,通过分析全水柱δ13CDIC与DIC之间的关系,定性解释表、底层水的δ13CDIC差异.
无论渤海还是黄海,δ13CDIC值与DIC都呈负相关(图6),在渤海相关性最强,r2高达0.95. 对于表层水体来说,在海-气交换过程中,DIC的不同组分均会与大气CO2产生同位素交换,且造成的分馏效应依赖于温度[37]. 以
${\rm{HCO}}_3^{-} $ 为例,当其与大气CO2交换达到平衡时,有以下碳稳定同位素平衡关系:13CO2(气)+H12${\rm{CO}}_3^{-} $ (水)==12CO2(气)+H13${\rm{CO}}_3^{-} $ (水)[38]. 在此平衡关系中,${\rm{HCO}}_3^{-} $ 相对大气CO2富集了约8.5‰的13C,而海水DIC整体表现为比大气CO2富集了约8‰的13C(当水温为20 ℃),因此表层水的δ13CDIC值通常在0‰左右[9]. 另一方面,由于夏季浮游植物生长旺盛时轻碳(12C)形成碳链要比重碳(13C)形成碳链稍快,并且能量消耗稍少,因此发生动力学分馏效应,表层浮游植物倾向于利用海水中的12CO2转化为有机碳,并将较多的13CO2留在海水中,使得海表DIC较低,而δ13CDIC偏正.然而对于黄渤海的底层水来说,冷水团区域内的δ13CDIC显著偏负,大多低于−1.0‰ (图7a),特别是在35°N与124°E交汇处附近,可观察到连片的底层水体δ13CDIC低值区,最低值出现在H16站位(图5h),δ13CDIC值为−2.0‰. 相应的耗氧量和DIC数据(图7b—c)与之前报道的夏季黄海冷水团数据[19]一致. 本研究再次说明,夏季黄海冷水团海域的水体层化现象隔绝了底层低温水与大气之间的气体交换,使水体群落呼吸造成的耗氧量和CO2积累,DIC升高(图7c),平均值达到(2202±21) μmol·kg−1. 本研究观测到的δ13CDIC低值区(图7a)与之前报道的耗氧酸化的夏季冷水团位置(图1)吻合[19],是因为底层水体的δ13CDIC变化主要受控于群落呼吸作用和当年沉降颗粒物的矿化作用. 由于沉降颗粒有机碳主要来自于表层浮游植物光合作用形成的生源颗粒,其δ13C值显著偏负,因而在其矿化过程中产生大量贫13CO2的DIC,造成底层耗氧量和DIC双高水体的δ13CDIC值偏负.
对于渤海中部近岸海域,观测到表层水的δ13CDIC平均值为0.2‰±0.7‰,而底层水的δ13CDIC平均值为−1.0‰±0.3‰,最低值位于其北端的B13站位,该站中部和底层水(10 m以深)相对于其它站位DIC含量明显较高(图5i),δ13CDIC值显著偏负(图5j),DO含量都小于3 mg·L−1,说明此处水体中有机物的耗氧过程十分显著. 当年的生源有机物强烈矿化/呼吸作用释放的大量贫13C的CO2造成水体DIC偏高,而δ13CDIC值偏负. 这些结果与该海域近年来常有大规模赤潮[39],底层水体低氧现象频频发生[20]等文献报道是一致的.
上述数据结果再次显示,水体的δ13CDIC可以与缺氧酸化现象有机结合起来[15, 17-18],未来或许可以通过δ13CDIC数值的变异开展对黄渤海缺氧酸化水体碳循环过程的定量研究,而河海水混合以及碳酸钙的形成与溶解等过程对黄渤海δ13CDIC值的影响也需要进一步研究.
2.1. 预处理条件的选择与优化
2.2. 条件优化后的精密度
2.3. 黄渤海夏季的δ13CDIC分布及影响因素
-
本研究优化了一套δ13CDIC预处理装置,并通过光腔衰荡光谱法实现对δ13CDIC的精确测定,首次得到黄渤海典型断面不同水层的δ13CDIC数据. 初步结果显示,不同水层的δ13CDIC分布存在差异,表层受光合作用主导,δ13CDIC偏正,而底层主要受控于有机物的呼吸/矿化作用,δ13CDIC相对偏负. 黄渤海的δ13CDIC数据揭示了丰富的海洋生物地球化学信息,对于该海域低氧酸化的耗氧有机物来源研究有着重要的参考意义,有助于充分认识生态系统的物质循环过程.



 下载:
下载: