-
铁(Fe)作为大气气溶胶中一种主要的微量元素[1],其通过促进水中浮游生物的光合、呼吸、固氮[2],从而影响碳的生物化学循环进而最终影响地球的气候[3]。Fe来源广泛,包括自然源(如沙尘)和人为源(如交通排放、钢铁及其他工业活动等)[4]。研究发现,全球大气Fe循环的95%以上来自于沙尘地区,而人为源气溶胶Fe含量仅占全球大气铁循环的5%。然而,人为源气溶胶中铁的溶解度远远大于沙尘气溶胶中铁的溶解度,尽管人为源气溶胶Fe含量较少,但其贡献的可溶性Fe超过50%[5-6]。一方面,人为源气溶胶中的可溶性Fe由于具有生物可利用性进而对Fe的生物地球化学循环有重要意义;另一方面,溶解性铁对二次气溶胶的形成也有重要的作用,比如Fe(Ⅲ)具有较高的氧化性,可以通过催化与氧化反应将S(IV)转化为S(VI) [7], Fe(Ⅲ)也可与大气中的有机酸络合从而参与光化学反应[8]。
西安地处关中平原中部,北有黄土高原,南有秦岭山脉,为典型的盆地地形,空气污染较为严重,开展该地区大气气溶胶中溶解性Fe的分布特征研究对于探究Fe的环境效应有着重要的作用。因此,本研究通过对西安市混合功能区大气颗粒物中不同化学形态Fe的浓度特征、昼夜分布、粒径分布及季节变化特征的研究,以期探究大气颗粒物中Fe的溶解度和氧化还原特征。
-
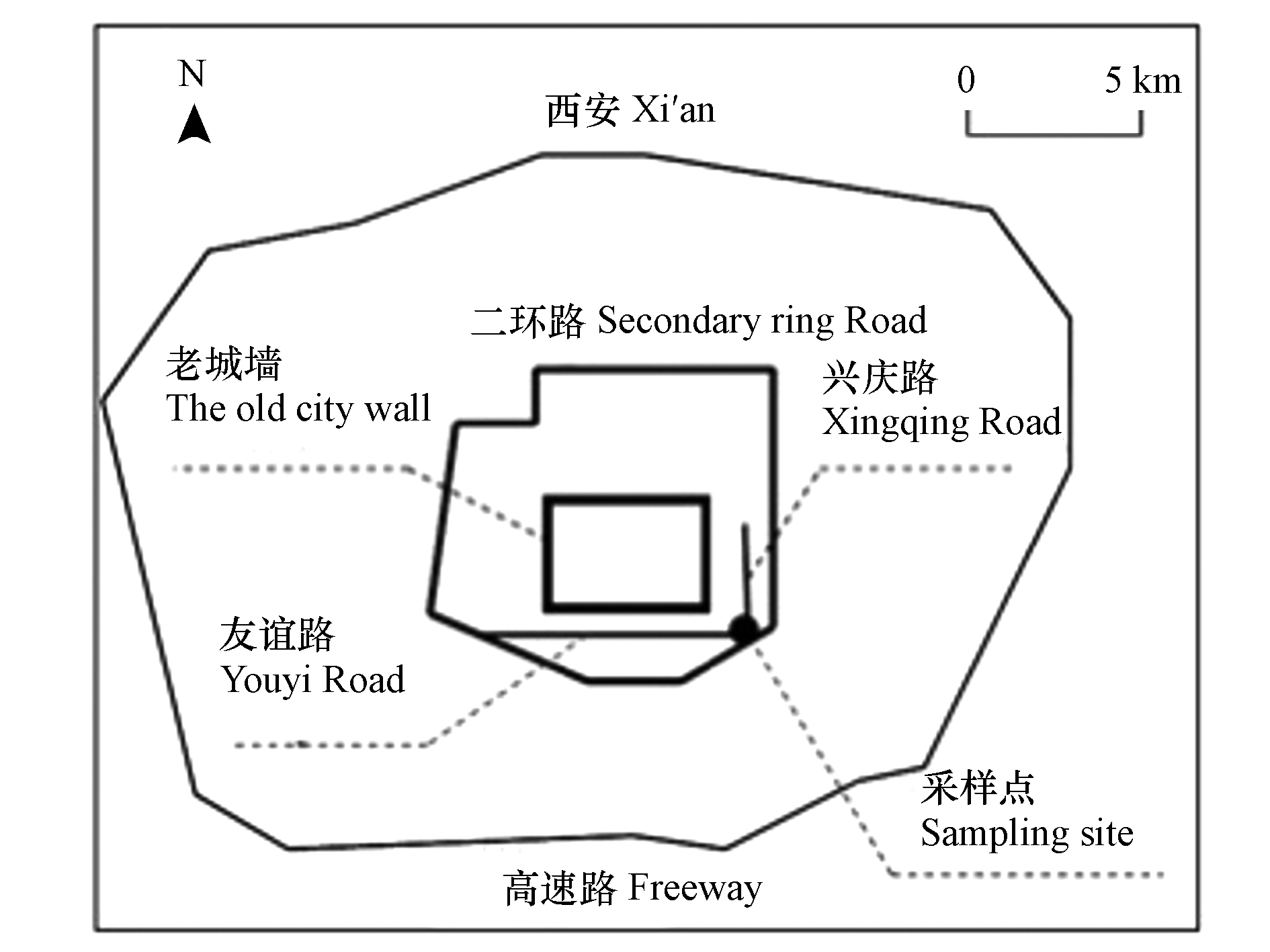
本研究的采样点在西安交通大学教学二区化工楼顶(见图1),采样头距离地面约为15 m。西边是西安交通大学教学区以及生活区,南面临近二环南路,北边和东边均是学生或者居民住宅区,为城市大气混合区域,具有大气观测代表性。
-
2018年7月17日至7月30日以及2019年1月8日至1月22日对西安市混合功能区的颗粒物进行夏、冬加强观测,使用自主研发的分粒径采样器,流量为50 L·min−1,分别收集昼、夜12 h,即8:00到20:00采集白昼12 h的样品,20:00至次日8:00采集夜晚12 h的样品。该采样器将大于10 μm的颗粒物截留在第1层滤膜上,将2.5—10 μm的颗粒物截留在第2层滤膜上,将小于2.5 μm的颗粒物截留在第3层滤膜上。本次采样共采集56个粒径大于10 μm的粗颗粒物样品,56个粒径在2.5—10 μm之间的颗粒物样品以及56个粒径小于2.5 μm的细颗粒物样品。
采样前后,在恒定的湿度和温度环境下,将滤膜在恒温恒湿箱中(21 ℃,40%—42%)放置24 h,电子微量天平(Model MC5, Sartorius AG, Goettingen, Germany)上称重,空白膜与样品膜最后两次称重误差分别不超过20 μg、40 μg。
-
颗粒物中全铁的分析使用的仪器是能量色散X射线荧光光谱仪(Epsilon 4,Netherlands),采用的方法是XRF-HJ829-2017,将每个样品在30 °C下暴露于高灵敏度的X射线荧光(XRF),22 min后进行分析,可测得样品中的金属Fe的含量,Fe的检测限为0.022 μg·cm−2。
使用改良的液体波导毛细管池(LWCC)方法测量不同价态铁的浓度(如图2)。通过测量溶液中亚铁-嗪络合物的光学吸收来间接测定亚铁的浓度。将滤膜样品的提取物分为3部分,分别用于Fe(Ⅱ)和Fe(Ⅲ)以及总可溶性Fe分析。将Ferrozine溶液(每5 mL提取物中加500 μL)添加到样品提取物中,并保持10 min,直到发色反应完成。分析之前,将LWCC用表面活性剂(三乙醇胺),2 mol·L−1 HCl和Milli-Q水冲洗。对于Fe(Ⅱ)分析,使用1 mL注射器手动将溶液(包括Ferrozine溶液)泵入1 m光程的LWCC中。吸收光谱波长范围为490 nm至680 nm,其中包括Fe(Ⅱ)-ferrozine配合物的强吸收峰。由于Fe(Ⅱ)的浓度与其吸光度成正比,因此可以通过与Fe(Ⅱ)标准储备液的校准曲线进行比较来确定Fe(Ⅱ)的浓度。通过添加HA溶液将Fe(Ⅲ)还原为Fe(Ⅱ),将950 μL HA溶液添加至5 mL提取物中,等待10 min以确保完整存储。然后加入Ferrozine(每5 mL提取物中加650 μL),并在分析前保持10 min。根据样品的多次重复分析,使提取物的吸光度信号再现性在6%以内。将添加了相应体积Ferrozine溶液的缓冲液作为空白对比,空白对样本信号的贡献范围是从LWCC测量的最高和最低信号的0.2%至2%。样品提取和最终分析的不确定度在10%以内。通过以下方程式计算可溶性Fe(Ⅲ)的浓度。
c(Fe(Ⅲ)sol) = c(Fe(Ⅱ)total ) - c(Fe(Ⅱ)sol ) (1)
式中,c(Fe(Ⅲ)sol) 为可溶性Fe(Ⅲ),即Fe(Ⅲ)sol的浓度,c(Fe(Ⅱ)sol ) 为可溶性Fe(Ⅱ),即Fe(Ⅱ)sol的浓度, c(Fe(Ⅱ)total )为总可溶性Fe的浓度,即加入HA溶液后的提取物中Fe(Ⅱ)的浓度。
-
采样期间夏季8:00-20:00的气温为(33.4±1.7) ℃,20:00—8:00的气温为(27.9±1.3 )℃;冬季8:00—20:00的气温为(1.4±1.9) ℃,20:00—8:00的气温为(-4.7±2.6 )℃;采样期间夏季的风向以东北风为主,平均风速为4.6 m·s−1;冬季的风向以西北风为主,平均风速为1.5 m·s−1。气象数据来自网站https://www.wunderground.com。
采样期间夏季7月17日至7月30日的14日中,11日是晴天,3日是多云;冬季2019年1月8日至1月22日的15日内,4日是晴天,11日是多云或阴天。天气数据来自于采样记录。
-
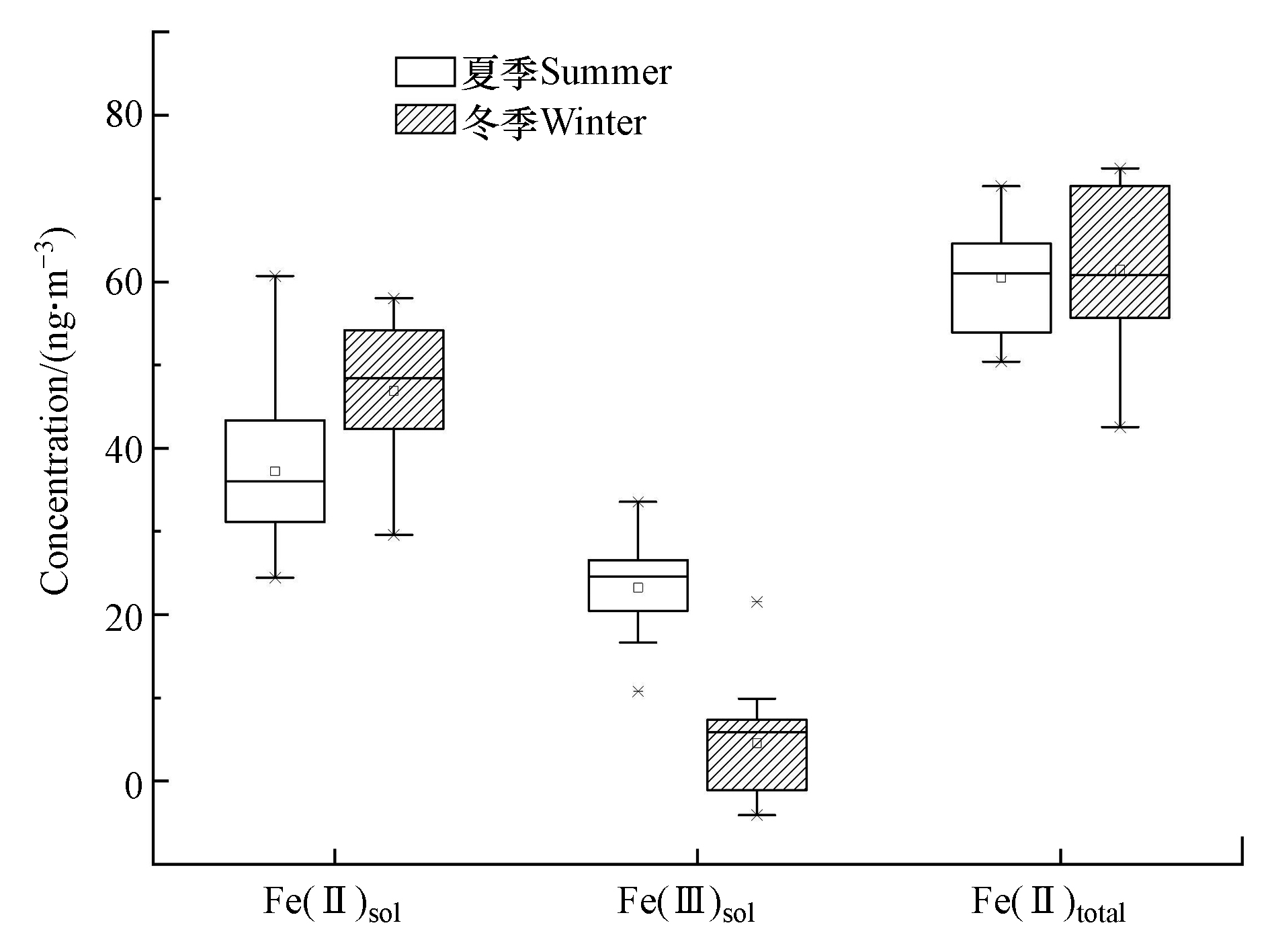
如图3所示,冬夏季PM2.5中Fe(Ⅱ)total、Fe(Ⅱ)sol和Fe(Ⅲ)sol含量表现出不同的特征。Fe(Ⅱ)total在冬季的范围为56.1 — 83.5 ng·m−3,平均值为72.3 ng·m−3,在夏季的范围为50.4 — 71.5 ng·m−3,平均值为60.4 ng·m−3,浓度呈现出冬季高于夏季的特征。冬季较高的Fe浓度与冬季较高的颗粒物浓度有关。由于西安冬季有较长的采暖期(每年11月15日至次年3月15日),城市周边和郊区燃煤和生物质取暖排放对颗粒物浓度有较大的贡献[9-10]。观测表明,西安冬季PM2.5浓度均值为夏季的2倍以上[11],冬季霾期间PM2.5浓度甚至超过300 μg·m−3[12]。也有研究者发现,生物质燃烧排放[13]和燃煤[14]会产生可溶性Fe,并且生物质燃烧和燃煤会增加Fe的溶出[15],尤其是Fe(Ⅱ)sol[16]。此外,夏季的风速高于冬季,且夏季降水丰富,颗粒物易扩散和湿沉降[17],也导致夏季Fe浓度较低。同时,有研究者通过水溶性离子平衡计算得出冬季大气气溶胶呈现酸性[18],颗粒结合铁与酸性物质反应,增加Fe的溶出,使Fe(Ⅱ)total浓度高于夏季。与其他城市相比,西安气溶胶的Fe(Ⅱ)total浓度处于偏高的水平,BEN等研究了2012年冬季青岛的大气气溶胶中的Fe(Ⅱ)total[19],以纯水为介质所提取的浓度为12.8—79.7 ng·m−3,平均为43.3 ng·m−3。Akinori Ito等研究了2016—2018年间澳大利亚的大气气溶胶中的可溶性铁的溶解度[20],以水和醋酸铵为介质提取的铁的溶解度为16%±20%,Fe(Ⅱ)tota的浓度为(1.4±2.3) ng·m−3。徐青研究了2017年上海市浦东新区的PM2.5中的Fe(Ⅱ)total[21],以纯水为介质所提取的年均浓度约为5 ng·m−3,这些结果的差异与Fe溶出介质的选择有关,也与气溶胶来源和铁的矿物组成,以及远距离输送过程中所经历的大气过程不同等有关[22]。西安Fe(Ⅱ)sol浓度在冬季的范围为39.6 — 67.6 ng·m−3,平均为56.9 ng·m−3,在夏季的浓度范围为24.4 — 60.7 ng·m−3,平均值为37.2 ng·m−3,冬季明显高于夏季,可能是由于冬季污染物水平较高,SO2等还原性物质较多,Fe(Ⅲ)将SO2催化氧化成为硫酸盐等物质后,Fe(Ⅲ)还原为Fe(Ⅱ) [18]。Fe(Ⅲ)sol在冬季的范围为5.9 — 31.5 ng·m−3,平均14.5 ng·m−3,在夏季的浓度范围10.8 — 33.6 ng·m−3,平均值为23.2 ng·m−3,表现出夏季略高于冬季的特征,可能是由于夏季光照强度较强,温度较高,臭氧浓度高,氧化性强,Fe(Ⅱ)光氧化为Fe(Ⅲ)。文献中也普遍认为在颗粒物中观察到铁的含量,Fe(Ⅲ)与Fe(Ⅱ)的浓度通常受到酸性物质[23]和阳光[24]的影响。
-
观测期间分别采集了2018年7月17日—7月29日白天12 h和晚上12 h的PM2.5样品。如表1所示,Fe(Ⅱ)sol和Fe(Ⅱ)total表现出明显的昼夜变化特征。白天,Fe(Ⅱ)total的质量浓度为33.6 — 72.5 ng·m−3,平均值为52.4 ng·m−3。Fe(Ⅱ)sol的质量浓度为27.4 — 60.7 ng·m−3,平均值为38.8 ng·m−3,夜晚,Fe(Ⅱ)total的质量浓度为27.5 — 61.4 ng·m−3,平均值为37.7 ng·m−3。Fe(Ⅱ)sol的质量浓度为11.3 — 34.5 ng·m−3,平均值为22.7 ng·m−3,白天PM2.5中Fe(Ⅱ)sol和Fe(Ⅱ)total的质量浓度和溶解度都大于夜晚的PM2.5样品,可能是由于光照条件的改变,光照增强促进Fe(Ⅱ)和总可溶性Fe的溶出,但是Fe(Ⅲ)sol的质量浓度以及溶解度没有表现出较强的昼夜变化特征。在13 d的昼夜PM2.5样品中,4个白天样品的Fe(Ⅲ)sol的质量浓度高于夜晚,夜晚8个样品的Fe(Ⅲ)sol的质量浓度高于白天,说明除了光照条件还有其他因素更能影响Fe(Ⅲ)的溶出,比如氧分子,臭氧浓度及其他气象条件。一些研究表明,大多数可溶性铁与长期大气输送过程中的化学变化有关。如气溶胶中铁的溶解度甚至高达80%[25],但Fe(Ⅱ)在缺氧环境中热力学不稳定[26], Fe(Ⅲ)-有机配合物会发生光诱导分解并与大气羧酸和在大气水相(如云)中产生的ROS(活性氧簇)发生反应[27]。
另外,从表1中可以看出,Fe(Ⅱ)sol与Fe(Ⅱ)total的比值也有明显的昼夜变化特征。白天Fe(Ⅱ)sol/Fe(Ⅱ)total的质量分数在57 %— 86%,夜晚则在31%— 76%,该比值在白天明显高于夜晚。通过比较昼夜Fe(Ⅱ)与总可溶性Fe的百分比变化特征可知,光照条件是Fe(Ⅱ)溶出的重要因素,在光照条件下,Fe(Ⅱ)占总可溶性Fe的百分比的平均值为73%,所以Fe(Ⅱ)的溶出率决定了总铁的溶出率。原因可能是光辐射下,粒子表面上发生了一个光电子从Fe(Ⅲ)原子到有机键的转移,铁原子从稳定到不稳定,并以铁的还原态Fe(Ⅱ)溶解了出来。
-
观测期间分别采集了粒径大于PM10、PM2.5-10以及PM2.5的样品。如表2所示,Fe的溶解度出现了随粒径增大而减小的趋势,在PM2.5的细粒子中Fe的溶解度在20% — 30%之间;在较粗的颗粒物(2.5 — 10 µm)中,溶解度下降到15 %— 20%;在更粗的粒子(> 10 µm)中,溶解度下降的更快(10%以下)。这一结果与中国东部的花鸟岛气溶胶中超过 50%的Fe分布在3.3 µm左右的细粒子上的结果一致[28]。白天和夜晚的样品中全Fe质量浓度的粒径分布完全一致。这说明在PM2.5中Fe的可溶性有很大提高,粒径大于PM2.5的颗粒物样品中Fe(Ⅱ)sol、Fe(Ⅲ)sol和Fe(Ⅱ)total的浓度相差不大,大气中铁的形成与颗粒大小有着十分重要的关系。Ooki等研究中也报道了,在日本采集的沙尘气溶胶中,粗粒子中Fe溶解度仅仅为0.52%,但是在细粒子中Fe的溶解度为3%,细粒子中的溶解度是粗粒子中的5—20倍[29]。
如表2所示,白天和夜晚的样品中有相似的特征。Fe(Ⅱ)sol在细粒子中的质量浓度远高于粗粒子中,且在PM2.5中浓度的变化范围更大。粒径大于10 µm的颗粒物中Fe(Ⅱ)sol的质量浓度较低,变化范围为0.3 — 6.4 ng·m−3,PM2.5-10中Fe(Ⅱ)sol的质量浓度同样较低,但是略高于大于10 µm的颗粒物,浓度范围为0.9 — 10.3 ng·m−3,PM2.5中Fe(Ⅱ)sol的质量浓度明显变高,变化范围为17.4 — 60.7 ng·m−3,从表2中可以看出,不同粒径中Fe(Ⅲ)sol的浓度变化规律和Fe(Ⅱ)相同,3种粒径中的质量浓度变化范围在PM2.5中的质量浓度最高,变化范围最大为8.8 — 26.6 ng·m−3;在粗粒子(> 10 µm)中质量浓度最低,变化范围比Fe(Ⅱ)的略大,夜晚的颗粒物中Fe(Ⅲ)的浓度规律相同。
如图4,不同粒径的样品中,可测出Fe(Ⅱ)sol与Fe(Ⅱ)total之比呈现出不太一致趋势,粒径最细的PM2.5样品中Fe(Ⅱ)sol与Fe(Ⅱ)total之比的变化范围为20%至70%。较粗的样品(2.5 — 10 µm)中,Fe(Ⅱ)sol与Fe(Ⅱ)total之比的变化范围略小,为17% — 60%。在粒径大于10 µm的粗粒子中,Fe(Ⅱ)sol与Fe(Ⅱ)total之比的变化范围明显缩小,为12% — 38%。PM2.5样品的变化最大,表明Fe(Ⅱ)和Fe(Ⅲ)之间的转化更为活跃。这可能是由于大气氧化能力的变化促进了这种转化[30]。
-
本研究通过对比冬夏季PM2.5中Fe特征发现,Fe(Ⅱ)sol浓度冬季高于夏季,可能是由于冬季污染物水平较高,SO2等还原性物质较多,Fe(Ⅲ)催化氧化成为硫酸盐等物质后被原为Fe(Ⅱ)。而Fe(Ⅲ)sol浓度则正好相反,表现出夏季高于冬季的特征,夏季光照强度较强,臭氧浓度高,氧化性强,Fe(Ⅱ)光氧化为Fe(Ⅲ)。Fe(Ⅱ)sol和Fe(Ⅲ)sol含量浓度在昼夜变化、粒径变化中都表现出一定的分布特征。白天PM2.5中Fe(Ⅱ)sol和Fe(Ⅱ)total的质量浓度和溶解度都大于夜晚的PM2.5样品,可能是由于光照条件的改变,光照增强促进Fe(Ⅱ)sol和Fe(Ⅱ)total的溶出,但是Fe(Ⅲ)sol没有展现出很强的昼夜变化特征。较粗的样品(2.5 — 10 µm)中,Fe(Ⅱ)sol与Fe(Ⅱ)total之比的变化范围略小一些,为17% — 60%,在粒径大于10 µm的粗粒子中Fe(Ⅱ)sol与Fe(Ⅱ)total之比的变化范围明显小了很多,为12% — 38%,PM2.5样品中Fe(Ⅱ)sol与Fe(Ⅱ)total之比的变化最大,表明粒径越小,Fe(Ⅱ)和Fe(Ⅲ)之间的转化更为活跃。
西安市混合功能区冬夏季大气颗粒物中可溶性Fe的分布特征
Characteristics of soluble Fe in atmospheric particles during winter and summer in an urban mixed-use area in Xi'an
-
摘要: 可溶性铁(Fe)一方面作为营养元素影响着生物地球化学循环,另一方面作为氧化剂对大气二次气溶胶的形成也有重要影响。本文分别开展了西安市混合功能区冬夏季不同粒径大气颗粒物的观测研究,通过使用改良的液体波导毛细管池(LWCC)测定颗粒物中酸性介质提取的可溶性铁浓度,并探究其季节变化、昼夜分布及粒径分布特征。季节分布特征表明,可溶性Fe(Ⅱ)浓度冬季高于夏季,而可溶性Fe(Ⅲ)浓度则夏季高于冬季。不同价态的可溶性Fe的季节分布特征差异明显,白天PM2.5中可溶性Fe(Ⅱ)和总可溶性性Fe的质量浓度和溶解度都大于夜晚的PM2.5样品,Fe(Ⅲ)则白天与夜晚无明显区别。粒径分布结果表明,溶解性Fe主要分布在细颗粒物中,且大气颗粒物的粒径越小,Fe(Ⅱ)sol与Fe(Ⅱ)total之比的变化范围越大,可溶性Fe(Ⅱ)和Fe(Ⅲ)之间的转化更为活跃。Abstract: Soluble Fe influenced on the Biogeochemical cycle and the secondary aerosol formation. In this study, diurnal, seasonal variation and size distribution of soluble Fe in atmospheric aerosols were investigated in an urban mixed-use area site in Xi’an. In this paper, we have carried out observational studies of atmospheric particulates with different particle sizes in an urban mixed-use area site of Xi’an in winter and summer. By using an improved liquid waveguide capillary cell (LWCC) to determine the concentration of soluble iron extracted from the acidic medium in the particulates, and to explore its seasonal changes, day and night distribution and particle size distribution characteristics. The results show that the concentration of soluble Fe(Ⅱ) in winter was higher than that in summer, while for summer soluble Fe(Ⅲ) level was higher than that in winter. The mass concentration and solubility of soluble Fe(Ⅱ) and total soluble Fe in PM2.5 during daytime were found to be greater than those during nighttime. However, Fe(Ⅲ) showed no obvious difference between day and night. The size distribution results showed more active conversion between Fe(Ⅱ) and Fe(Ⅲ) at smaller particle size, which indicated that the conversion rate of Fe(Ⅱ) and Fe(Ⅲ) in PM2.5 was higher than those in PM2.5-10 and PM10.
-
Key words:
- PM2.5 /
- Fe(Ⅱ) /
- Fe(Ⅲ) /
- size distribution
-

-
表 1 夏季Fe(Ⅱ)sol、Fe(Ⅲ)sol和Fe(Ⅱ)total浓度的日内对比
Table 1. Diurnal comparison of Fe(Ⅱ)sol, Fe(Ⅲ)sol and Fe(Ⅱ)total concentrations in Summer
c(Fe(Ⅱ)sol)/(ng·m-3) c(Fe(Ⅲ)sol)/(ng·m−3) c(Fe(Ⅱ)total)/(ng·m−3) 溶解度/% 白天 38.8±9.5 12.7±9.7 52.4±12.0 73.3±9.9 夜晚 22.7±7.7 15.0±7.1 37.7±10.2 56.1±12.3 表 2 溶解性Fe的粒径分布
Table 2. Particle size distribution of soluble Fe
PM2.5 PM2.5−10 PM10 昼Fe(Ⅱ)sol/(ng·m−3) 32.3±11.4 5.4±2.6 2.3±1.0 夜Fe(Ⅱ)sol/(ng·m−3) 28.2±10.2 6.7±3.9 3.5±2.8 昼Fe(Ⅲ)sol/(ng·m−3) 16.6±6.8 8.8±2.7 5.4±2.5 夜Fe(Ⅲ)sol/(ng·m−3) 17.0±7.1 7.1±3.3 4.3±2.3 昼Fe溶解度/% 26.7±2.3 19.7±2.2 9.7±4.0 夜Fe溶解度/% 21.1±6.6 16.8±2.2 6.8±4.7 -
[1] WANG Y R, BALKANSKI O, BOUCHER L, et al. Sources, transport and deposition of iron in the global atmosphere [J]. Atmospheric Chemistry and Physics, 2015, 15: 11. [2] 林明月, 潘大为, 胡雪萍, 等. 烟台近海水体不同形态铁的检测分析 [J]. 环境化学, 2016, 35(2): 297-304. doi: 10.7524/j.issn.0254-6108.2016.02.2015092301 LIN M Y, PAN D W, HU X P, et al. Speciation analysis of iron in Yantai coastal waters [J]. Environmental Chemistry, 2016, 35(2): 297-304(in Chinese). doi: 10.7524/j.issn.0254-6108.2016.02.2015092301
[3] SHI Z, KROM M D, BONNEVILLE S, et al. Influence of chemical weathering and aging of iron oxides on the potential iron solubility of Saharan dust during simulated atmospheric processing[J]. Global Biogeochemical Cycles, 201l, 25(2): 52-71. [4] SHI Z, KROM M D, JICKELLS T D, et al. Impacts on iron solubility in the mineral dust by processes in the source region and the atmosphere: A review [J]. Aeolian Research, 2012, 5(7): 21-27. [5] LUO C, MAHOWALD N, BOND T, et al. Combustion iron distribution and deposition [J]. Global Biogeochemical Cycles, 2008, 22(1): 122-131. [6] SRINIVAS B, SARIN M M, RENGARAJAN R. Atmospheric transport of mineral dust from the lndo-Gangetic Plain: Temporal variability, acid processing, and iron solubility [J]. Geochemistry, Geophysics, Geosystems, 2014, 15(8): 3226-3243. doi: 10.1002/2014GC005395 [7] WIN M S, YONEMOCHI S, WANG Q, et al. Atmospheric HULIS and its ability to mediate the reactive oxygen species (ROS): A review [J]. Journal of Environmental Sciences, 2017, 71(9): 16-34. [8] GONZALEZ D H, CALA C K, PENG Q, et al. HULIS Enhancement of Hydroxyl Radical Formation from Fe(Ⅱ): Kinetics of Fulvic Acid-Fe(Ⅱ) Complexes in the Presence of Lung Antioxidants [J]. Environmental Science and Technology, 2017, 51(13): 7676. [9] SUN J, SHEN Z X, CAO J J, et al. Particulate matters emitted from maize straw burning for winter heating in rural areas in Guanzhong Plain, China: Current emission and future reduction [J]. Atmospheric Research, 2017, 184: 66-76. doi: 10.1016/j.atmosres.2016.10.006 [10] WANG X, SHEN Z X, LIU F B, et al. Saccharides in summer and winter PM2.5 over Xi'an, Northwestern China: Sources, and yearly variations of biomass burning contribution to PM2.5 [J]. Atmospheric Research, 2018, 214: 410-417. doi: 10.1016/j.atmosres.2018.08.024 [11] ZHANG T, SHEN Z X, ZHANG L M, et al. PM2.5 Humic-like substances over Xi'an, China: Optical properties, chemical functional group, and source identification [J]. Atmospheric Research, 2020, 234: 104784. doi: 10.1016/j.atmosres.2019.104784 [12] ZHANG Q, SHEN Z X, CAO J J, et al. Variations in PM2.5, tsp, BC, and trace gases (NO2, SO2, and O3) between haze and non-haze episodes in winter over Xi'an, China [J]. Atmospheric Environment, 2015, 112: 64-71. doi: 10.1016/j.atmosenv.2015.04.033 [13] MATSUI H, MAHOWALD N M, MOTEKI N, et al. Anthropogenic combustion iron as a complex climate forcer [J]. Nature Communications, 2018, 9(1): 1593. doi: 10.1038/s41467-018-03997-0 [14] LIN Y C, CHEN J P, HO T Y, et al. Atmospheric iron deposition in the northwestern Pacific Ocean and its adjacent marginal seas: The importance of coal burning [J]. Global Biogeochemical Cycles, 2015, 29(2): 138-159. doi: 10.1002/2013GB004795 [15] SCANZA R A, HAMILTON D S, PEREZ GARCIA-PANDO C, et al. Atmospheric Processing of Iron in Mineral and Combustion Aerosols: Development of an Intermediate-Complexity Mechanism Suitable for Earth System Models [J]. Atmospheric Chemistry and Physics, 2018, 18(19): 1-39. [16] TRAPP J M, MILLERO F J, PROSPERO J M. Trends in the solubility of iron in dust-dominated aerosols in the equatorial Atlantic trade winds: Importance of iron speciation and sources [J]. Geochemistry, Geophysics, Geosystems, 2010, 11(3): 1525-2027. [17] SHEN Z X, ZHANG L M, CAO J J, et al. Chemical composition, sources, and deposition fluxes of water-soluble inorganic ions obtained from precipitation chemistry measurements collected at an urban site in northwest China [J]. J Environ Monit, 2012, 14(11): 3000-3008. doi: 10.1039/c2em30457k [18] SHEN Z X, RICHARD A, CAO J J, et al. Seasonal variations and evidence for the effectiveness of pollution controls on water-soluble inorganic species in total suspended particulates and fine particulate matter from Xi'an, China [J]. Journal of the Air & Waste Management Association, 2008, 58: 1560-1570. [19] BEN X, SHI J, QIU S, et al. Solubility of iron in atmospheric aerosols and related influence factors in Qingdao, China [J]. Acta entiae Circumstantiae, 2015, 35(1): 65-71. [20] ITO A , PERRON M M G , PROEMSE B C , et al. Evaluation of aerosol iron solubility over Australian coastal regions based on inverse modeling: implications of bushfires on bioaccessible iron concentrations in the Southern Hemisphere[J]. Progress in Earth and Planetary Science, 2020, 42: 7. [21] 徐青. 上海市浦东新区大气细颗粒物中重金属污染特征及来源解析 [J]. 环境监控与预警, 2020, 12(1): 8. doi: 10.3969/j.issn.1674-6732.2020.06.003 XU Q. Characteristics and sources of heavy matels in air fine particulate matter in Pudong new area, Shanghai [J]. Environmental Monitoring and Forewarning, 2020, 12(1): 8(in Chinese). doi: 10.3969/j.issn.1674-6732.2020.06.003
[22] BAKER A R, CROOT P L. Atmospheric and marine controls on aerosol iron solubility in seawater [J]. Marine Chemistry, 2010, 120(1/4): 4-13. [23] FI H, LIN J, SHANG G, et al. Solubility of iron from combustion source particles in acidic media linked to iron speciation [J]. Environmental Science & Technology, 2012, 46(20): 11119-11127. [24] KUMAR A, SARIN M M. Aerosol iron solubility in a semi-arid region: temporal trend and impact of anthropogenic sources [J]. Tellus B:Chemical and Physical Meteorology, 2010, 62B: 125-132. [25] AGUILAR-ISLAS A M, WU J F, REMBER R, et al. Dissolution of aerosol-derived iron in seawater: Leach solution chemistry, aerosol type, and colloidal iron fraction [J]. Marine Chemistry, 2010, 120(1/4): 25-33. [26] HAN Q, ZENDER C S, MOORE J K, et al. Global estimates of mineral dust aerosol iron and aluminum solubility that account for particle size using diffusion-controlled and surface-area-controlled approximations [J]. Global Biogeochemical Cycles, 2012, 26: 2038. [27] GUO L, CHEN Y, WANG F J, et al. Effects of Asian dust on the atmospheric input of trace elements to the East China Sea [J]. Marine Chemistry, 2014, 163: 19-34. doi: 10.1016/j.marchem.2014.04.003 [28] OOKI A, NISHIOKA J, ONO T, et al. Size dependence of iron solubility of Asian mineral dust particles [J]. Journal of Geophysical Research:Atmospheres, 2009, 114(D3): 320-339. [29] MAJESTIC B J, SCHAUER J J, SHAFER M M. Application of synchrotron radiation for measurement of iron red-ox speciation in atmospherically processed aerosols [J]. Atmospheric Chemistry and Physics, 2007(10): 2475-2487. [30] SEGURET M J M, KOCAK M, THEODOSI C, et al. Iron solubility in crustal and anthropogenic aerosols: The Eastern Mediterranean as a case study [J]. Marine Chemistry, 2011, 126(1/4): 229-238. -



 下载:
下载: