-
近年来碳点(carbon dots,CDs)作为一种新型具有冷发光特性的准零维碳纳米材料受到广泛关注。CDs由碳质核心和表面钝化层两部分构成,具有良好的水溶性、荧光性能、生物相容性、超微的粒径(一般小于10 nm)、制备简便和成本低廉等优点,被广泛应用于生物成像[1 -3]、传感器、光电器件[4- 5]和光催化[6-7]等领域[8]。CDs作为传感器应用于检测重金属如Hg2+[9-10]、Cu2+[11-12]、Cr6+[13-14]、Fe3+[15-17]等,有机污染物如四环素[18-19]、对硝基苯酚(p-NP)[20-22]等和致病菌[23-24]。CDs的碳源有很多,除化学试剂外,大量生物质也可作为荧光CDs的前驱体。而细菌作为一种广泛存在于自然界的微生物,其数量巨大。由于其本身含有本征杂原子(例如S、P等),在合成过程中这些杂原子可能进入最终产物,形成掺杂碳点,提高其光学性能[22]。
Fe是世界上最丰富的元素之一,它在工业和农业生产中应用最为广泛,工农业废水中Fe含量过高时会影响水体的色、嗅、味等且可能使水生动植物死亡进一步污染水体,破坏水体生态平衡。Fe也是对人体非常重要的一种金属元素,缺乏铁会导致细胞减少氧气的运输,从而造成人体疲劳,工作状态不佳或免疫力下降;含铁量过高则会导致贫血、糖尿病、心脏衰竭和癌症等严重疾病[15-16,25]。因此,对Fe3+的检测具有重要研究意义。目前,基于原子吸收/发射光谱、电感耦合等离子体质谱(ICP-MS)等分析方法已被广泛用于Fe3+的检测。然而,这些技术需昂贵和复杂的设备,而且样品制备过程复杂。基于荧光的传感技术具有快速、灵敏、选择性和简单等优点[26]。
p-NP及其衍生物毒性强,难降解,被广泛用于各种工业领域。含p-NP废水的排放给水生生物及人类带来了严重的威胁[27-28]。几种基于生物传感器、电化学检测、毛细管电泳、色谱检测p-NP的方法在实际应用中不够灵活且耗费时间,有时结果也不够准确[21]。相比之下,荧光分析是一种低成本、高灵敏度的快速检测方法,样品预处理过程简单,所需的溶剂量较少,因此,许多荧光探针被用于p-NP的检测[22]。
本文以S.oneidensis MR-1为唯一碳源,通过一步水热法合成荧光碳点(CDs@MR-1)。采用透射电子显微镜(TEM)、X射线光电子能谱(XPS)、荧光光谱(PL)、紫外-可见吸收光谱(UV-vis)和红外光谱(FT-IR)对合成的CDs@MR-1进行表征,探讨如何基于荧光猝灭现象,设计出一种纳米荧光探针用于快速、灵敏地检测Fe3+和p-NP。
-
CuSO4·5H2O、AlCl3·6H2O、BaCl2·2H2O、CaCl2·2H2O、MgCl2·6H2O、MnCl2·4H2O、NiCl2·6H2O、SnCl2·2H2O、CoCl2·6H2O、AgNO3、FeCl3·6H2O购自国药集团化学试剂有限公司。Cd、Hg、Pb标准样品购自国家有色金属及电子材料分析测试中心。甲苯(methylbenzene)、苯胺(aniline)、1,4-二氯苯(1,4-Dichlorobenzene)、3-氯硝基苯(3-Nitrochlorobenzene)、间二硝基苯(1,3-dinitrobenzene)、苯酚(phenol)、p-NP、邻硝基苯酚(ο-NP)、间硝基苯酚(m-NP)、对氯苯酚(p-chlorophenol)、2,4,6-三氯苯酚(2,4,6-Trichlorophenol)购自上海麦克林生化科技有限公司。培养S. oneidensis MR-1(ACTT 700550, 南加尼福利亚大学的K.H. Nealson教授提供)的 LB培养基为胰蛋白胨10 g·L −1、氯化钠10 g·L −1、酵母粉5 g·L −1、pH = 7.0。
-
接种S. oneidensis MR-1于600 mL新鲜灭菌LB培养基,30 ˚C、150 r·min−1恒温摇床培育24 h后离心(6000 r·min−1,5 min)弃上清液,沉淀重悬于30 mL无菌去离子水,转移至聚四氟乙烯内衬反应釜200 ℃加热24 h,自然冷却至室温后离心(9000 r·min−1,15 min)去除大颗粒物质,再次过滤(0.22 μm)3次后即得CDs@MR-1溶液。样品储存在4 ℃环境中。
-
材料形貌、晶体结构、元素组成和官能团分析分别采用JEM-2100型透射电子显微镜(日本JEOL公司)、SmartLab9KW型X射线衍射仪(日本Rigaku公司)、ESCALAB 250Xi型X射线光电子能谱仪(美国Thermo Fisher公司)和Vertex80+Hyperion2000型傅里叶红外显微系统(德国BRUKER OPTICS公司);光学性质表征主要使用F-4500型荧光分光光度计(日本HITACHI公司)和U-4100型紫外可见近红外分光光度计。荧光量子产率使用Fluoromax-4型稳态瞬态荧光光谱仪测量,计算方法如公式(1)[9]:
其中,Ec和Ea分表代表样品和空白样的发射峰积分面积,La和Lc分别代表空白样和样品的吸收峰积分面积。
-
以14种金属离子为对象,测试金属离子加入到CDs@MR-1溶液前后荧光强度变化。配制浓度均为1 g·L −1的金属离子溶液Cu2+、Al3+、Ba2+、Ca2+、Mg2+、Mn2+、Ni2+、Sn2+、Co2+、Ag+和Fe3+;Cd2+、Hg2+和Pb2+作为标准样品。在5 mL离心管中加入40 μL CDs@MR-1原液(终浓度315 μg·mL−1)和不同种类200 μL金属离子溶液(终浓度100 g·L −1),定容至2 mL后混合均匀,测试荧光强度变化;
类似的以甲苯、苯胺、1,4-二氯苯、3-氯硝基苯、间二硝基苯、苯酚、对硝基苯酚、邻硝基苯酚、间硝基苯酚、对氯苯酚、2,4,6-三氯苯酚11种芳香族化合物为对象,采用超纯水配制浓度均为5 mmol·L −1上述11种芳香族化合物溶液,然后在5 mL离心管中加入40 μL CDs@MR-1原液(终浓度315 μg·mL−1)和不同种类的200 μL配制溶液(终浓度500 μmol·L −1),定容至2 mL后混合均匀,测试荧光强度变化。
-
准确称量0.1350 g FeCl3·6H2O和0.0696 g p-NP,用超纯水定容至50 mL,配制成浓度为0.01 mol·L −1的母液。将配好的FeCl3·6H2O母液依次稀释成浓度为5 mmol·L−1、2.5 mmol·L−1、1.25 mmol·L−1、1 mmol·L−1、625 μmol·L −1、500 μmol·L −1、312.5 μmol·L −1、156.3 μmol·L −1、125 μmol·L −1、78.1 μmol·L −1、15.6 μmol·L −1、6.3 μmol·L −1的待测样品;将配好的p-NP母液依次稀释成5 mmol·L −1、4 mmol·L −1、3 mmol·L −1、2 mmol·L −1、1 mmol·L −1、500 μmol·L −1、250 μmol·L −1、125 μmol·L −1、62.5 μmol·L −1、31.25 μmol·L −1、15.62 μmol·L −1、7.81 μmol·L −的待测样品,然后在5 mL离心管中加入40 μL CDs@MR-1原液(终浓度315 μg·mL−1)和不同种类的200 μL Fe3+溶液或p-NP,定容至2 mL并混合均匀,测试荧光强度。
-
固定CDs@MR-1浓度,考察不同条件:pH(3、5、7、9、11)、紫外灯照射时间(0—4 h)、盐浓度(0—1 mmol·L −1)和储存时间(0—60 d)下的荧光强度,评价CDs@MR-1的稳定性。
-
TEM表征结果显示(图1(a))CDs@MR-1形状近似椭圆,分布较均一,其平均粒径为4.05 nm(图1(b))。XRD图谱(图1(c))显示CDs@MR-1大约在22 °处有一独特衍射峰,与石墨结构的层间间距一致。采用FT-IR对CDs@MR-1表面基团进行解析,如图1(d)所示,1400 cm−1处的吸收峰源自O—H/C—H的弯曲振动或C—N的伸缩振动[29];3280 cm−1和3400 cm−1处的吸收归结于N—H和O—H的伸缩振动;2870 cm−1和2928 cm−1处的吸收来源于—CH2的伸缩振动,表明CDs@MR-1上表面存在部分烷基[30];1655 cm−1处的吸收来源于酰胺键(CONH—) 或者羧基(—COOH)中C=O的伸缩振动[21];1087 cm−1处的吸收来自C—O—C的伸缩振动[3]。这表明,CDs@MR-1表面含有含氧官能团,具有良好的水溶性。
XPS分析结果表明(图2),CDs@MR-1主要由5种元素组成,分别为C(286 eV)、N(400 eV)、O(532 eV)、S(163.7 eV)和P(133.83 eV)。C1s高分辨谱(图2(b))显示CDs@MR-1主要有3种含碳官能团,分别为C—C(288.4 eV)、C—N/C—O(286.1 eV)和C=O(288.3 eV)。N1s高分辨谱中(图2(c))显示的两个峰属于两种含氮官能团,包括C—N—C(399.85 eV)和N—H(400.5 eV)[29]。O1s高分辨谱中(图2(d))显示的两个峰可归结于C=O(531.3 eV)和C—OH /C—O—C(532.3 eV)官能团[31]。
以上结果与FT-IR数据基本保持一致,表明CDs@MR-1表面有许多含氧官能团(如—OH、—NH2、—COOH、—CONH—),证明了其优异的亲水性和生物相容性[21]。
-
CDs@MR-1荧光性质表征结果如下:紫外-可见吸收光谱(图3(a))显示在258 nm和320 nm处各有一个吸收峰,可归结于C=C的π-π*跃迁和C=O的n-π*跃迁[32], 符合碳点在紫外区的吸收特征且在紫外灯照射下呈明亮蓝绿色(图3(b))。荧光光谱(图3(c))表明激发光在303—383 nm范围内荧光强度先增大后降低,在343 nm处达到最大且随着激发光的增大发射峰逐渐红移,表明CD@MR-1具有激发波长依赖性,这是CDs的典型荧光特征。按公式(1)计算得CDs@MR-1绝对量子产率为6.2%。
-
CDs@MR-1的荧光稳定性试验结果如图4所示。pH在3—11(图4(a))范围内CDs@MR-1荧光强度几乎不变;紫外灯照射4 h(图4(b))后CDs@MR-1荧光依旧良好;盐浓度(图4(c))达到1 mmol·L −1时,CDs@MR-1荧光几乎无影响;存放了60 d(图4(d))后碳点荧光强度仅有略微下降,综上表明了CDs@MR-1具有很高的荧光稳定性。
分析了14种金属阳离子和11种芳香族化合物对CDs@MR-1荧光强度的影响,结果如图5所示: 金属离子(图5(a))中Sn2+、Ag+、Cd2+、Hg2+和Fe3+均可使CDs@MR-1荧光有不同程度的猝灭,其中Fe3+对其影响最大且可以使得荧光几乎完全猝灭;同样的,芳香族化合物(图5(b))中p-NP使得CDs@MR-1荧光几乎完全消失,故后续实验将Fe3+和p-NP单独作为对象,深入研究它们对CDs@MR-1荧光猝灭效率和机理。
-
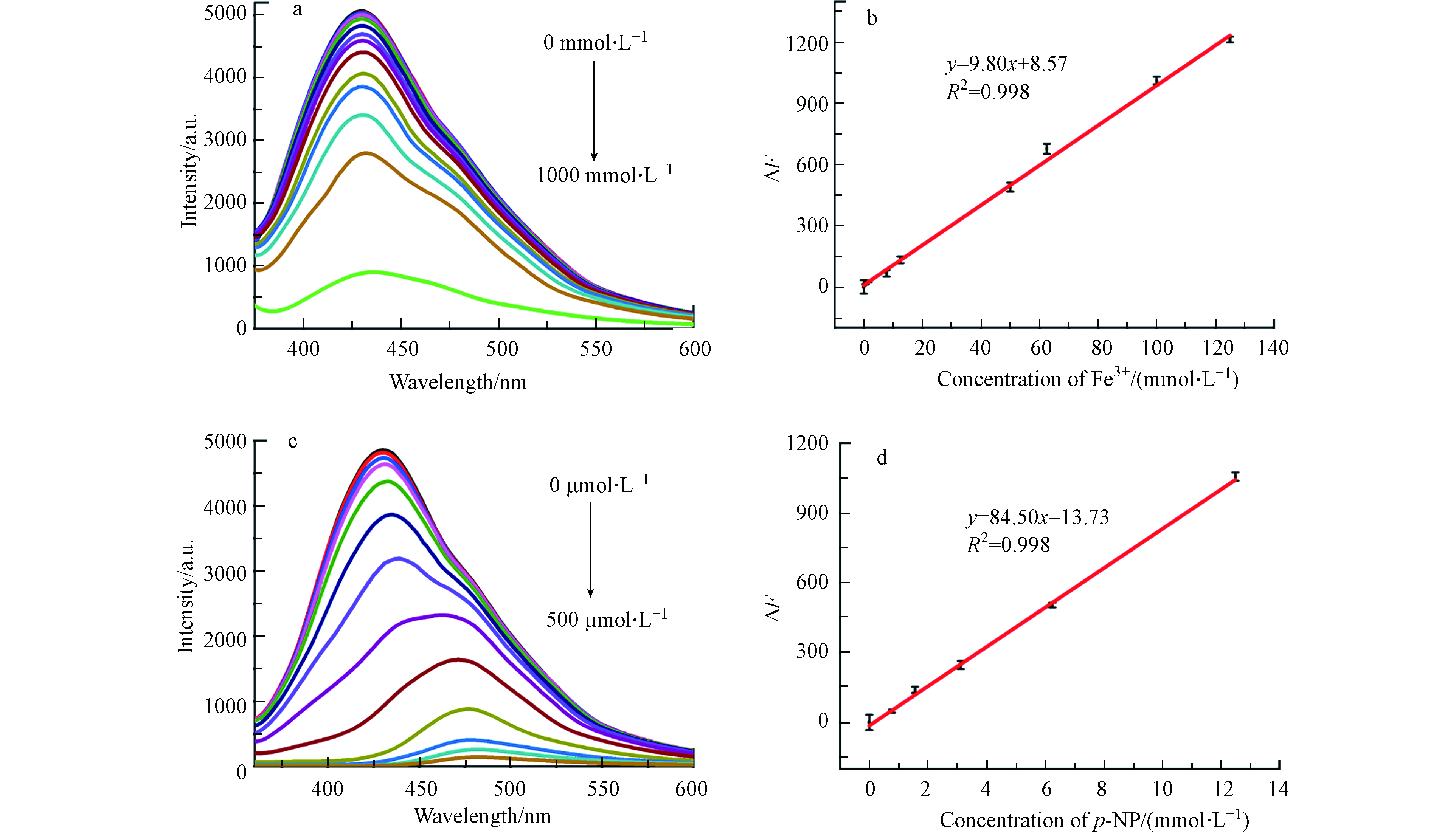
加入不同浓度Fe3+测试CDs@MR-1荧光光谱,结果如图6所示:随Fe3+浓度(图6(a))的增大,CDs@MR-1荧光强度下降,且在0—125 μmol·L −1(图6(b))范围内呈线性相关,线性方程为ΔF(F0-F)= 9.82x+8.57(R2 = 0.998)。其中F和F0分别代表加入Fe3+和空白样品的荧光强度,通过计算(3δ/k,其中δ代表11次空白样品的标准偏差,k代表线性方程的斜率)得检出限为0.48 μmol·L−1.
对p-NP的选择性检测进行了类似的研究,随着p-NP浓度(图6(c))的不断增大,CDs@MR-1荧光强度不断降低且伴随着明显的红移现象(430—480 nm),在0—12.5 μmol·L−1(图6(d))时线性关系良好,线性方程为ΔF = 84.50x+13.73(R2 = 0.998),计算得其检出限为0.25 μmol·L−1.
-
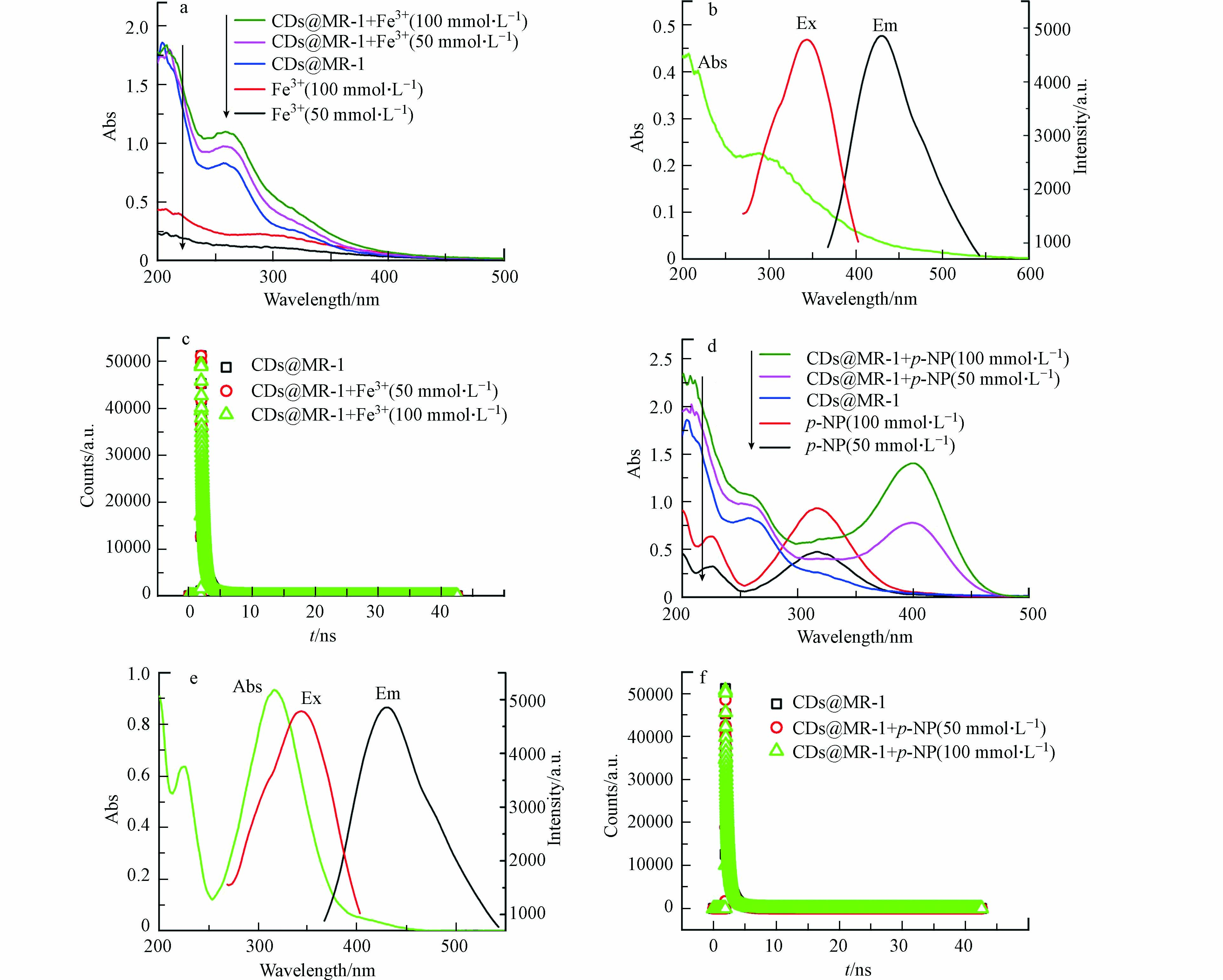
荧光碳点的猝灭效应包括动态猝灭(SQ)、静态猝灭(DQ)、光诱导电子转移(PET)、荧光共振能量转移(FRET)和內滤效应(IFE)[3]。比较Fe3+和CDs@MR-1加Fe3+前后的紫外-可见吸收光谱(图7(a))后发现,加入Fe3+时CDs@MR-1吸收增强但未出现蓝移或红移,这是由于Fe3+与CDs@MR-1表面基团结合形成复合物导致。实际上,CDs@MR-1表面覆盖着大量的含氧官能团,尤其是羧基和羟基,且Fe3+可吸附在CDs@MR-1表面,并与碳点表面的羟基协同。因Fe3+对CDs的这些含氧官能团具有较高的亲和力,并形成铁-羟基或铁-羧基配合物[33],导致CDs的非极性聚集,最终导致荧光猝灭[34]。叠加Fe3+紫外-可见吸收光谱和CDs@MR-1荧光光谱(图7(b))发现Fe3+在218 nm和288 nm处有较强吸收,并不与CDs@MR-1的激发峰(343 nm)和发射峰(430 nm)有重叠,既不会掩蔽CDs@MR-1的激发光,也不会吸收CDs@MR-1的发射光,因而不会发生內滤效应(IFE)[14]和荧光共振能量转移效应(FRET)[35]。
另一方面,因共振能量转移(RET)机制会显著降低供体的荧光寿命,比较荧光寿命图(图7(c))发现加入Fe3+后CDs@MR-1的荧光寿命曲线与未加之前几乎完全重合,表明荧光寿命几乎没有发生变化。因此RET在本系统的猝灭过程中可能没有发挥作用[14]。基于以上分析可将Fe3+对CDs@MR-1的作用机理归结于静态猝灭机制。
观察紫外-可见吸收光谱(图7(d)),发现在加入了CDs@MR-1后,p-NP的最大吸收波长移动到了更长的波长(400 nm)[21-22]。对比p-NP的吸收光谱与CDs@MR-1的激发谱图(图7(e))发现p-NP的吸收峰和CDs@MR-1的激发峰有很大重叠部分,为內滤现象的出现提供了可能。比较荧光寿命(图7(f))发现,与Fe3+类似,在加入p-NP后CDs@MR-1荧光寿命并未发生明显变化。这表明內滤效应在p-NP对CDs@MR-1的荧光猝灭过程中起至关重要的作用,这与之前的报道也一致[6,10,17]。
-
(1)以S.oneidensis MR-1为碳源,通过一步水热法合成荧光碳点,XPS、FT-IR等手段表明CDs@MR-1主要由C、N、O元素构成,较高的O(22.56%)和N(7.36%)含量以及丰富的含氧与含氮官能团(如—OH、—COOH、—NH2、—CONH),使得其水溶性良好。TEM和粒径分布图显示CDs@MR-1大小均一且分散性良好。
(2)通过荧光分光光度计测得CDs@MR-1最佳激发和发射波长分别为343 nm和430 nm,且随着激发光波长的增大而逐渐红移;基于荧光猝灭现象CDs@MR-1可以同时对两种污染物(Fe3+和p-NP)具有高选择性和灵敏性。
(3)基于静态猝灭机制,Fe3+浓度在0—125 μmol·L−1范围内与CDs@MR-1荧光响应ΔF(F0-F)有良好线性关系,检出限为0.48 μmol·L−1;基于內滤效应,p-NP在0—12.5 μmol·L−1范围内与CD@MR-1荧光响应ΔF线性关系最好,检出限为0.25 μmol·L−1。
基于希瓦氏菌合成的荧光碳点及其用于Fe3+和对硝基苯酚(p-NP)的检测
The synthesis of fluorescent carbon dots based on Shewanella Oneidensis MR-1 and their application for Fe3+ and p-NP detection
-
摘要: 本文以Shewanella oneidensis MR-1为原料,通过一步水热法合成了荧光碳点(CDs@MR-1)。采用透射电子显微镜(TEM)、X射线光电子能谱(XPS)、傅里叶红外光谱(FT-IR)、X射线衍射(XRD)和荧光光谱(PL)等手段对CDs@MR-1的形貌、结构和组成、表面基团以及光学性能进行了表征。研究结果表明CDs@MR-1尺寸均一,主要由C、N、O、S和P等5种元素组成,表面富含羟基、羧基等含氧官能团,水溶性良好。此外,CDs@MR-1具有优异的光学性能可作为对Fe3+和对硝基苯酚(p-NP)进行快速检测且灵敏的纳米探针。基于静态猝灭和内滤效应,此碳点对Fe3+和p-NP的荧光猝灭效率分别在0—125 μmol·L −1(R2 = 0.998)和0—12.5 μmol·L −1(R2 = 0.998)范围内有良好的线性关系,检出限分别为0.48 μmol·L −1和0.25 μmol·L −1,表明其作为纳米探针检测Fe3+和p-NP的潜在应用前景。
-
关键词:
- 荧光碳点 /
- 奥奈达希瓦氏菌MR-1 /
- 三价铁离子 /
- 对硝基苯酚 /
- 荧光探针
Abstract: In this paper, fluorescent carbon dots (CDs) were successfully synthesized via one-step hydrothermal process using Shewanella Oneidensis MR-1 as raw material. The morphology, composition and structure, surface groups and optical properties of obtained CDs@MR-1 were characterized using transmission electron microscope (TEM), X-ray photoelectron spectroscopy (XPS), X-ray diffraction (XRD), photoluminescence spectroscopy (PL) and etc. The results show that CDs@MR-1 is uniform in size and mainly composed of five elements C, N, O, S and P. The surface is rich in oxygen-containing functional groups such as hydroxyl group and carboxyl group, and has good water solubility. In addition, CDs@MR-1 has excellent optical properties and can be used as a fast and sensitive nanoprobe for the detection of Fe3+ and p-nitrophenol (p-NP). Based on the static quenching (SQ) and internal filtration effect (IFE), the fluorescence quenching efficiency of Fe3+ and p-NP showed a good linear relationship in the range of 0—125 μmol·L−1 (R2 = 0.998) and 0—12.5 μmol·L−1 (R2 = 0.998), and the detection limits were 0.48 μmol·L−1 and 0.25 μmol·L−1, respectively. These results indicate that CDs@MR-1 has the potential application prospect as a nanoprobe in the detection of Fe3+ and p-NP.-
Key words:
- fluorescence carbon dots /
- Shewanella Oneidensis MR-1 /
- Fe3+ /
- p-NP /
- fluorescence probe
-

-
图 6 (a)不同Fe3+浓度下CDs@MR-1的荧光光谱,(b)ΔF与Fe3+浓度线性关系图(0—125 μmol·L−1),(c)不同p-NP浓度下CDs@MR-1的荧光光谱,(d)ΔF与p-NP浓度线性关系图(0—12.5 μmol·L−1)
Figure 6. (a)Fluorescence spectra of CDs@MR-1 after adding various concentrations of Fe3+,(b)Linear relationship between ΔF(F0-F) and the Fe3+ concentration (0—125 μmol·L−1),(c)Fluorescence spectra of CDs@MR-1 after adding various concentrations of p-NP,(d)Linear relationship between ΔF(F0-F) and the p-NP concentration(0—12.5 μmol·L−1)
图 7 (a)CDs@MR-1、Fe3+和CDs@MR-1 +Fe3+的紫外-可见吸收光谱,(b)Fe3+的紫外-可见吸收光谱与CDs@MR-1的荧光光谱,(c)CDs@MR-1和CDs@MR-1+ Fe3+的荧光寿命曲线,(d)CDs@MR-1、p-NP和CDs@MR-1 +p-NP的紫外-可见吸收光谱,(e)p-NP的紫外吸收光谱和CDs@MR-1的荧光光谱,(f)CDs@MR-1和CDs@MR-1+p-NP的荧光寿命曲线
Figure 7. (a)UV-vis absorption spectra of CDs@MR-1, Fe3+, and CDs@MR-1 + Fe3+,(b)UV-vis absorption of Fe3+ and fluorescence spectra of CDs@MR-1,(c)the FL decay lifetime of CDs@MR-1 and CDs@MR-1+ Fe3+, (d)UV-vis absorption spectra of CDs@MR-1, p-NP, and CDs@MR-1 +p-NP,(e)UV-vis absorption of p-NP and fluorescence spectra of CDs@MR-1,(f)the FL decay lifetime of CDs@MR-1 and CDs@MR-1+p-NP
-
[1] ANWAR S, DING H Z, XU M S, et al. Recent advances in synthesis, optical properties, and biomedical applications of carbon dots [J]. ACS Applied Bio Materials, 2019, 2(6): 2317-2338. doi: 10.1021/acsabm.9b00112 [2] CHU X H, WU F, SUN B H, et al. et al. Genipin cross-linked carbon dots for antimicrobial, bioimaging and bacterial discrimination [J]. Colloids and Surfaces B-Biointerfaces, 2020, 190(11): 930-937. [3] TU Y J, WANG S P, YUAN X T, et al. A novel fluorescent nitrogen, phosphorus-doped carbon dots derived from Ganoderma Lucidum for bioimaging and high selective two nitrophenols detection [J]. Dyes and Pigments, 2020, 178(10): 8316-8323. [4] HEKMAT M, ROSTAMYAN F, SHAFIEKHANI A, et al. Barrier coating and plasmonic effect by using diamond-like carbon and silver nanoparticles on quantum dots sensitize solar cells [J]. Semiconductor Science and Technology, 2020, 35(4): 5019-5025. [5] QIN Z X, WANG W H, WEN M, et al. Multicolor emissive sulfur, nitrogen co-doped carbon dots and their application in ion detection and solid lighting [J]. Spectrochimica Acta Part a-Molecular and Biomolecular Spectroscopy, 2020, 229(11): 7859-7866. [6] ACHILLEOS DS, KASAP H, REISNER E. Photocatalytic hydrogen generation coupled to pollutant utilisation using carbon dots produced from biomass [J]. Green Chemistry, 2020, 22(9): 2831-2839. doi: 10.1039/D0GC00318B [7] SONG S L, WU K, WU H D, et al. Multi-shelled ZnO decorated with nitrogen and phosphorus co-doped carbon quantum dots: synthesis and enhanced photodegradation activity of methylene blue in aqueous solutions [J]. RSC Advances, 2019, 9(13): 7362-7374. doi: 10.1039/C9RA00168A [8] BAIG MMF, CHEN Y C. Bright carbon dots as fluorescence sensing agents for bacteria and curcumin [J]. Journal of Colloid and Interface Science, 2017, 501: 341-349. doi: 10.1016/j.jcis.2017.04.045 [9] VENKATESWARLU S, VISWANATH B, REDDY AS, et al. Fungus-derived photoluminescent carbon nanodots for ultrasensitive detection of Hg2+ ions and photoinduced bactericidal activity [J]. Sensors and Actuators B-Chemical, 2018, 258: 172-175. doi: 10.1016/j.snb.2017.11.044 [10] YUAN X T, TU Y J, CHEN W, et al. Facile synthesis of carbon dots derived from ampicillin sodium for live/dead microbe differentiation, bioimaging and high selectivity detection of 2, 4-dinitrophenol and Hg(Ⅱ) [J]. Dyes and Pigments, 2020, 175(10): 8187-8197. [11] MURUGAN N, PRAKASH M, JAYAKUMAR M, et al. Green synthesis of fluorescent carbon quantum dots from Eleusine coracana and their application as a fluorescence 'turn-off ' sensor probe for selective detection of Cu2+ [J]. Applied Surface Science, 2019, 476: 468-480. doi: 10.1016/j.apsusc.2019.01.090 [12] MU Y X, ZHUANG Q F, HUANG S P, et al. Adenine-stabilized carbon dots for highly sensitive and selective sensing of copper(II) ions and cell imaging [J]. Spectrochimica Acta. Part A-Molecular and Biomolecular Spectroscopy, 2020, 239: 118531-118539. doi: 10.1016/j.saa.2020.118531 [13] ATHIKA M, PRASATH A, DURAISAMY E, et al. Carbon-quantum dots derived from denatured milk for efficient chromium-ion sensing and supercapacitor applications [J]. Materials Letters, 2019, 241: 156-159. doi: 10.1016/j.matlet.2019.01.064 [14] WANG M, SHI R, GAO M J, et al. Sensitivity fluorescent switching sensor for Cr (Ⅵ) and ascorbic acid detection based on orange peels-derived carbon dots modified with EDTA [J]. Food Chemistry, 2020, 318(12): 6506-6517. [15] DENG X Y, FENG Y L, LI H R, et al. N-doped carbon quantum dots as fluorescent probes for highly selective and sensitive detection of Fe3+ ions [J]. Particuology, 2018, 41: 94-100. doi: 10.1016/j.partic.2017.12.009 [16] ATCHUDAN R, EDISON TNJI, ASEER KR, et al. Highly fluorescent nitrogen-doped carbon dots derived from Phyllanthus acidus utilized as a fluorescent probe for label-free selective detection of Fe3+ ions, live cell imaging and fluorescent ink [J]. Biosensors & Bioelectronics, 2018, 99: 303-311. [17] LIANG Y, XU L X, TANG K, et al. Nitrogen-doped carbon dots used as an "on-off-on" fluorescent sensor for Fe3+ and glutathione detection [J]. Dyes and Pigments, 2020, 178(10): 8358-8367. [18] YANG Q F, HONG H, LUO Y K. Heterogeneous nucleation and synthesis of carbon dots hybrid Zr-based MOFs for simultaneous recognition and effective removal of tetracycline [J]. Chemical Engineering Journal, 2020, 392(12): 3680-3690. [19] ZHAO N, WANG Y, HOU S S, et al. Functionalized carbon quantum dots as fluorescent nanoprobe for determination of tetracyclines and cell imaging [J]. Mikrochimica Acta, 2020, 187(6): 351-351. doi: 10.1007/s00604-020-04328-1 [20] HU Y P, GAO Z J. Sewage sludge in microwave oven: A sustainable synthetic approach toward carbon dots for fluorescent sensing of para-Nitrophenol [J]. Journal of Hazardous Materials, 2020, 382(12): 1048-1055. [21] QIN K H, ZHANG D F, DING Y F, et al. Applications of hydrothermal synthesis of Escherichia coli derived carbon dots in in vitro and in vivo imaging and p-nitrophenol detection [J]. Analyst, 2020, 145(1): 177-183. doi: 10.1039/C9AN01753D [22] ZHANG S T, ZHANG D F, DING Y F, et al. Bacteria-derived fluorescent carbon dots for highly selective detection of p-nitrophenol and bioimaging [J]. Analyst, 2019, 144(18): 5497-5503. doi: 10.1039/C9AN01103J [23] ZHAO M Y, GAO X, TAO Z H, et al. Sugar-metabolism-triggered pathogenic bacteria identification based on pH-sensitive fluorescent carbon dots [J]. Sensors and Actuators B-Chemical, 2020, 316(12): 8063-8071. [24] SAAD SM, ABDULLAH J, ABD RASHID S, et al. A carbon dots based fluorescence sensing for the determination of Escherichia coli O157: H7 [J]. Measurement, 2020, 160(10): 7845-7855. [25] 曲可琪, 尤月, 程扬, 等. 香菇碳量子点的制备及其对Fe3+的响应 [J]. 功能材料, 2019, 50(9): 9125-9220. QU K Q, YOU Y, CHENG Y, et al. Preparation of carbon quantum dots derived from mushroom and their response to Fe3+ [J]. function materials, 2019, 50(9): 9125-9220(in Chinese).
[26] NAN Z Z, HAO C C, ZHANG X G, et al. Carbon quantum dots (CQDs) modified ZnO/CdS nanoparticles based fluorescence sensor for highly selective and sensitive detection of Fe(Ⅲ) [J]. Spectrochimica Acta Part A-Molecular and Biomolecular Spectroscopy, 2020, 228(11): 7717-7724. [27] LI W, FAN X L, LIU B X, et al. Synthesis of microscale zinc-copper bimetallic particles and their performance toward p-nitrophenol removal: Characterization, mineralization, and response surface methodology [J]. Environmental Engineering Science, 2020, 37(4): 263-271. doi: 10.1089/ees.2019.0433 [28] LIU S Y, LAI C, LI B S, et al. Role of radical and non-radical pathway in activating persulfate for degradation of p-nitrophenol by sulfur-doped ordered mesoporous carbon [J]. Chemical Engineering Journal, 2020, 384(12): 3304-3314. [29] HUA X W, BAO Y W, WANG H Y, et al. Bacteria-derived fluorescent carbon dots for microbial live/dead differentiation [J]. Nanoscale, 2017, 9(6): 2150-2161. doi: 10.1039/C6NR06558A [30] ZHAO S J, LAN M H, ZHU X Y, et al. Green synthesis of bifunctional fluorescent carbon dots from garlic for cellular imaging and free radical scavenging [J]. ACS Applied Materials & Interfaces, 2015, 7(31): 17054-17060. [31] ZHANG L X, ZHANG Z S, GAO Z W, et al. Facile synthesis of N, B-co-doped carbon dots with the gram-scale yield for detection of iron (Ⅲ) and Escherichia coli[J]. Nanotechnology, 2020, 31(39):395702-395711 . [32] GAO Z, ZHAO C X, LI Y Y, et al. Beer yeast-derived fluorescent carbon dots for photoinduced bactericidal functions and multicolor imaging of bacteria [J]. Applied Microbiology and Biotechnology, 2019, 103(11): 4585-4593. doi: 10.1007/s00253-019-09782-3 [33] ZULFAJRI M, GEDDA G, CHANG C J, et al. Cranberry beans derived carbon dots as a potential fluorescence sensor for selective detection of Fe3+ ions in aqueous solution[J]. ACS Omega, 2019, 4(13): 15382-15392. [34] SAHOO NK, JANA GC, AKTARA MN, et al. Carbon dots derived from lychee waste: Application for Fe3+ ions sensing in real water and multicolor cell imaging of skin melanoma cells [J]. Materials Science & Engineering C-Materials for Biological Applications, 2020, 108(11): 429-441. [35] HU Q, SUN H J, ZHOU X Y, et al. Bright-yellow-emissive nitrogen-doped carbon nanodots as a fluorescent nanoprobe for the straightforward detection of glutathione in food samples [J]. Food Chemistry, 2020, 325(12): 6946-6955. -




 下载:
下载: