-
六价铬Cr(Ⅵ)是工业废水中主要的重金属污染物之一。Cr(Ⅵ)污染主要来源于皮革、颜料、电镀、采矿和钢铁等工业行业[1- 2]。由于其高毒性和强氧化性,Cr(Ⅵ)被认为是一种致癌物和诱变剂。Cr(Ⅵ)废水处理不当,会对生态系统造成严重问题,并对环境和人类健康造成影响[3]。吸附、化学沉淀、膜过滤和离子交换等方法是工业废水中Cr(Ⅵ)主要的去除方法[4]。在这些方法中,吸附法因其简单、高效等优点而被实际工程广泛应用。
去除水中Cr(Ⅵ)的吸附剂主要有:炭基材料、纳米金属氧化物、矿物材料、生物聚合物、含硫化合物等[5]。除了含硫化合物,其它几种吸附剂对Cr(Ⅵ)的吸附研究报道比较多,但是含硫化合物对水中Cr(Ⅵ)的吸附研究还比较缺乏。含硫化合物主要包括金属(复合)硫化物和有机无机杂化硫属化合物等。例如Fe3S4和3D花型MoS2纳米材料都可以有效吸附Cr(Ⅵ),同时还会将部分Cr(Ⅵ)还原成三价铬Cr(Ⅲ),从而降低铬的毒性,对Cr(Ⅵ)的最大吸附量分别为231.3 mg·g−1和238.1 mg·g−1 [6-7]。FeMgAl-MoS4材料快速吸附低浓度Cr(Ⅵ),对Cr(Ⅵ)的最大吸附量达到135.6 mg·g−1。同时,材料中的硫可以还原Cr(Ⅵ)而导致自身被氧化成硫酸根[8]。Mg/Al水滑石@MoS2基于静电吸引和外球面络合作用去除水中Cr(Ⅵ),相比Mg/Al水滑石,Mg/Al水滑石@MoS2表现出良好的化学稳定性,有利于实际应用,对Cr(Ⅵ)的最大吸附量为95.6 mg·g−1[9]。与Fe3O4纳米颗粒相比,MoS2@Fe3O4纳米颗粒对Cr(Ⅵ)的吸附量得到显著提高,同时还可以还原Cr(Ⅵ)[10]。因此,与其它吸附剂相比,含硫化合物吸附剂的显著优点是不但可以有效吸附Cr(Ⅵ),还可以将其还原来降低铬的毒性。
上述研究主要集中在金属(复合)硫化物,有机无机杂化硫属化合物对水中Cr(Ⅵ)的吸附研究鲜有报道。有机无机杂化层状硫属化合物是一种特殊结构的硫属化合物,主要是由无机硫属阴离子层[MxEyQz]n− (M=Fe、Mn、Al等;E = Ge、Sn等;Q = S、Se等)与有机阳离子模板通过静电引力形成的层状化合物[11-12]。主要有[(CH3)2NH2]2Ga2Sb2S7·H2O[11]、[(CH3CH2CH2)2NH2]5In5Sb6S19·1.45H2O[13]、[Me2NH2]2In2Sb2S7-xSex (x = 0、2.20、4.20、7)[14]及本研究组制备的[CH3NH3]2xMnxSn3-xS6·0.5H2O (x = 0.5—1.1)(CMS)[15]等。
采用CMS材料来研究去除水中Cr(Ⅵ),考察了反应温度、pH值、共存离子、反应时间等影响因素,分析了动力学、热力学和铬还原性,以期为有机无机杂化层状硫属化合物应用于去除Cr(Ⅵ)等重金属阴离子提供科学依据和技术基础。
-
CMS吸附剂通过水热反应方法制备[15]。将锡粉(2 mmol)、锰粉(4 mmol)、硫粉(9 mmol)和甲胺溶液(8 mL)放入反应釜(50 mL)中充分混合并密封后在160℃下反应4 d,然后自然冷却至室温。得到的固体产物用超纯水,CS2和乙醇依次分别洗涤多次,最后在真空干燥箱中干燥整晚待用。
-
用K2Cr2O7配置Cr(Ⅵ)模拟废水,在锥形瓶中放入一定浓度的Cr(Ⅵ)模拟废水,运用pH计,使用NaOH和HNO3调节模拟废水的pH值。然后往锥形瓶中分别加入CMS吸附剂粉末。最后将这些锥形瓶放入到恒温摇床中,在不同反应温度下以250 r·min−1振荡规定时间。取样后采用0.22 μm的水系过滤头过滤得到的溶液用ICP-OES测定Cr(Ⅵ)的浓度。CMS对模拟废水中Cr(Ⅵ)的吸附量计算用式(1)表示:
式中,qe代表的是吸附达到平衡时的吸附量(mg·g−1);C0和Cf 分别代表吸附前、吸附后后溶液中Cr(Ⅵ)的浓度(mg·L−1);V代表溶液体积(L);m代表CMS材料的质量(g)。
-
真空干燥箱(DZF-6020,上海博迅实业有限公司);水热反应釜(安徽科幂机械科技有限公司);电热恒温鼓风干燥箱(DHG-9030A型,上海浦东荣丰科学仪器有限公司);恒温摇床(ZHTY-70,上海知楚仪器有限公司);ICP-OES(optima 8300,美国珀金埃尔默仪器有限公司);pH计(UB-7,美国丹佛仪器公司);XRD(X'Pert Pro型,荷兰PANalytical B.V.公司);SEM(S-4800型,日本Hitachi公司);EDS(Genesis XM2型,美国EDAX公司);XPS(Quantum 2000型,美国PHI物理电子公司)。
-
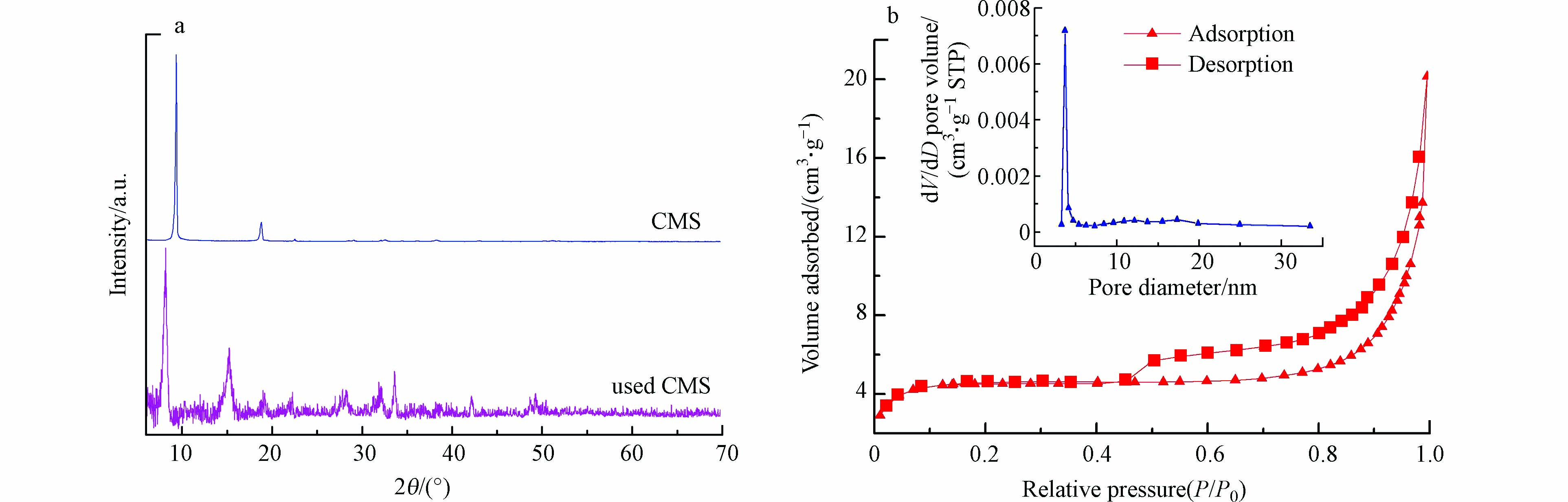
CMS吸附剂是以[MnxSn3-xS6]2x−为无机硫属阴离子层和以[CH3NH3]2x+为有机阳离子模板通过静电引力形成的层状化合物[15]。图1a是CMS吸附Cr(Ⅵ)前后的XRD图。在2θ = 10°和20°附近,CMS具有层状化合物的特征峰,此时说明CMS为层状硫属化合物。通过布拉格公式计算,CMS的层间距为0.94 nm。而吸附Cr(Ⅵ)后,CMS的层间距增大到1.07 nm,这主要是由于Cr(Ⅵ)进入层间并与硫发生化学作用而被吸附导致的。图1b是CMS的氮气吸脱附等温线和孔径分布图。它属于Ⅳ型等温线,并且具有滞后圈,同时孔径分布主要集中在3.7 nm处,说明CMS是介孔材料,这主要是由于片状CMS之间相互重叠或交错而形成的。
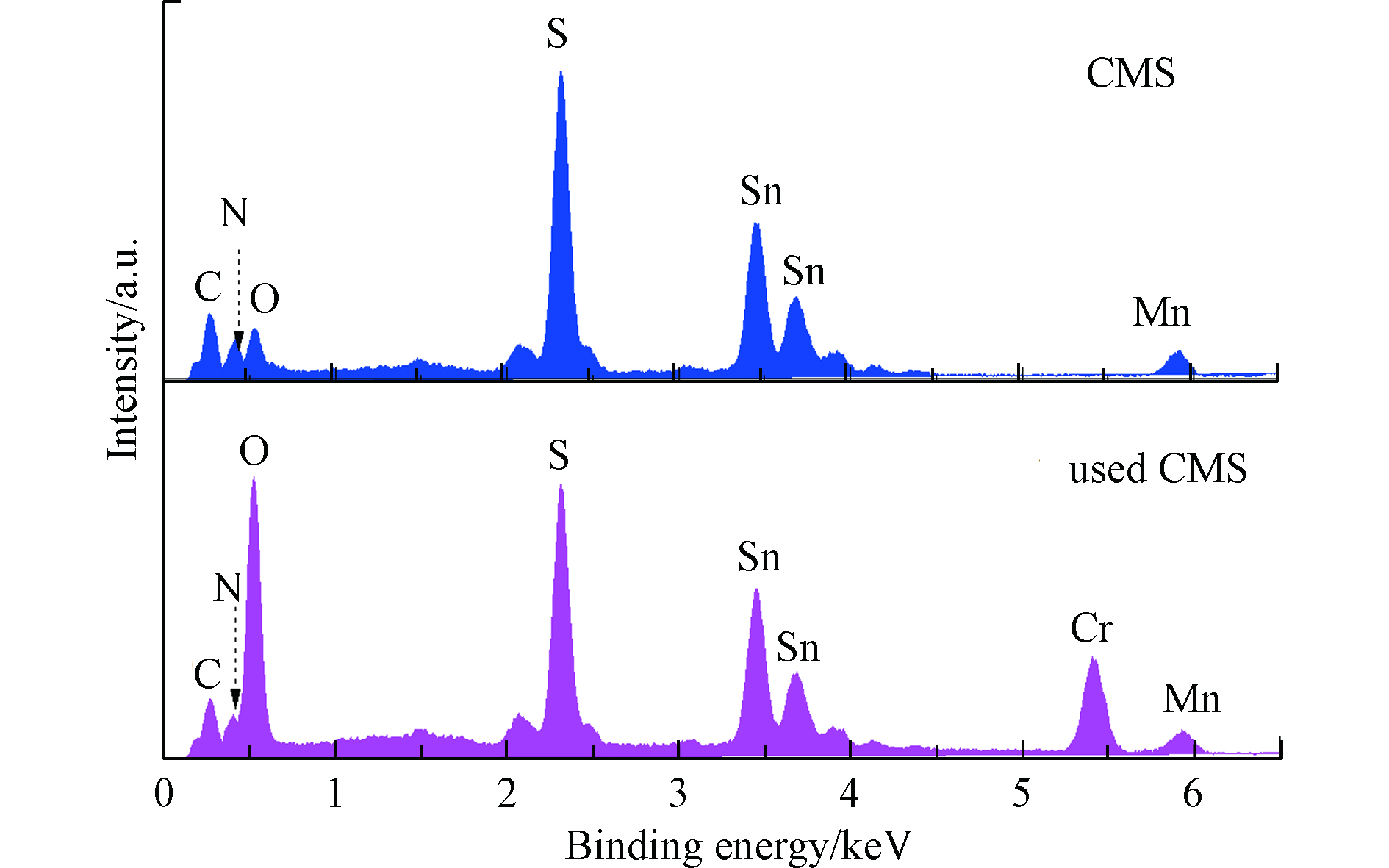
图2是CMS吸附Cr(Ⅵ)前后的SEM图。CMS材料呈片状结构且大小不一。由于CMS吸附Cr(Ⅵ)属于化学吸附,从而导致吸附后的薄片表面变得粗糙且薄片尺寸变小。根据前期的研究,层状硫属化合物KMS-1材料吸附铅离子后,它的薄片也会发生类似的现象[12]。图3是CMS吸附Cr(Ⅵ)前后的EDS图。CMS材料中所含的6种元素都能被检测到。CMS吸附Cr(Ⅵ)后,EDS上能检测到铬元素,而且氧元素的含量显著增加,这主要是由于铬以阴离子形式存在而被吸附。
-
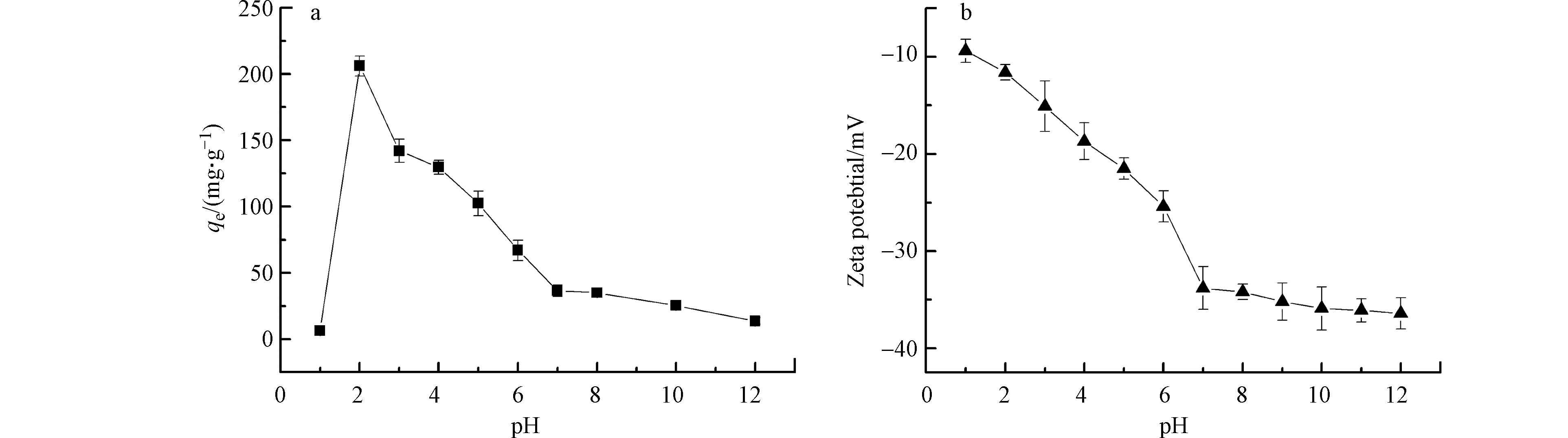
pH是影响水中污染物吸附的重要因素之一。为了研究溶液pH对吸附产生的影响,将CMS(300 mg)材料分别加入到pH=1—12的铬溶液中(500 mg·L−1(约为0.0096 mol·L−1),300 mL),在250 r·min−1的摇床中恒温25℃连续振荡24 h。根据文献报道,当pH值较低时,Cr(Ⅵ)主要以
${\rm{HCrO}}_4^ - $ 和${\rm{C}}{{\rm{r}}_{\rm{2}}}{\rm{O}}_{\rm{7}}^{{\rm{2 - }}} $ 两种形态存在。而同时当Cr(Ⅵ)浓度为0.01 mol·L−1或更低时,${\rm{HCrO}}_4^ - $ 为主要形态。但随着pH增加,${\rm{CrO}}_4^{2 - } $ 形态所占百分比也增加[16]。图4a是pH对铬吸附的影响。由图4可知,溶液的pH对铬去除具有显著影响。pH=1—2的区间,吸附量急剧增加到最大值。主要是由于在pH=1时,H+会与CMS中的部分硫发生反应产生H2S,导致吸附量的下降。而在pH≥2时,CMS在水中能稳定存在,随着pH值的增加吸附量也跟着减少。这主要是由于随着pH值的增加,水中的氢氧根也随之增加,会对Cr(Ⅵ)的吸附产生竞争作用。图4b是CMS的zeta电位图,在pH=1—12之间,CMS的zeta电位都为负值,主要是由于无机硫属阴离子层导致CMS呈现电负性。CMS的zeta电位随着pH的增加而减小。根据图4可知,由于在pH=1时CMS结构不稳定,所以只有在pH=2—12之间,CMS的吸附量随着zeta电位的减小而减小,两者呈正相关性。 -
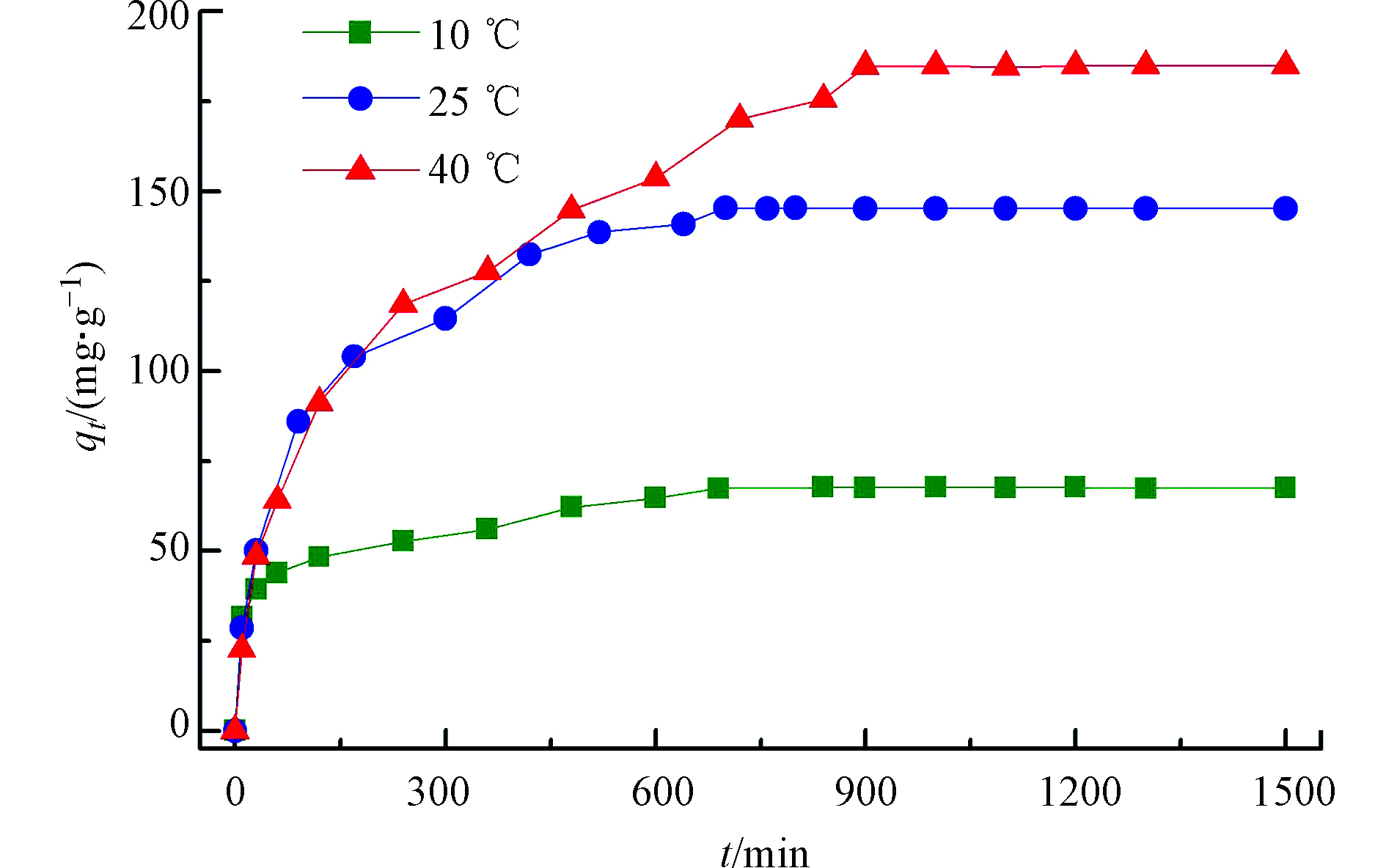
吸附剂对水中污染物的去除受到反应时间的影响。将300 mg的CMS粉末加入到铬溶液中(300 mL,pH=3.0,500 mg·L−1),分别于10℃、25℃及40℃的不同反应温度条件中,在250 r·min−1的摇床中不断振荡25 h。图5是不同反应温度下,反应时间对吸附量的影响。在10℃条件中,在初始的60 min内,CMS对Cr(Ⅵ)的吸附量增长非常快,随后增长缓慢。在25℃和40℃条件中,在初始的180 min内,CMS对Cr(Ⅵ)的吸附量也是急剧增加。在吸附的初始阶段,CMS中有充足的吸附活性位点用于吸附Cr(Ⅵ),吸附活性位点随着时间的增加也越来越少,因而吸附速度越来越慢,最后达到吸附平衡。在10℃、25℃和40℃的条件下,其离子交换平衡达到的时间分别是600、700、900 min。吸附量随着反应温度的增加而增加。
-
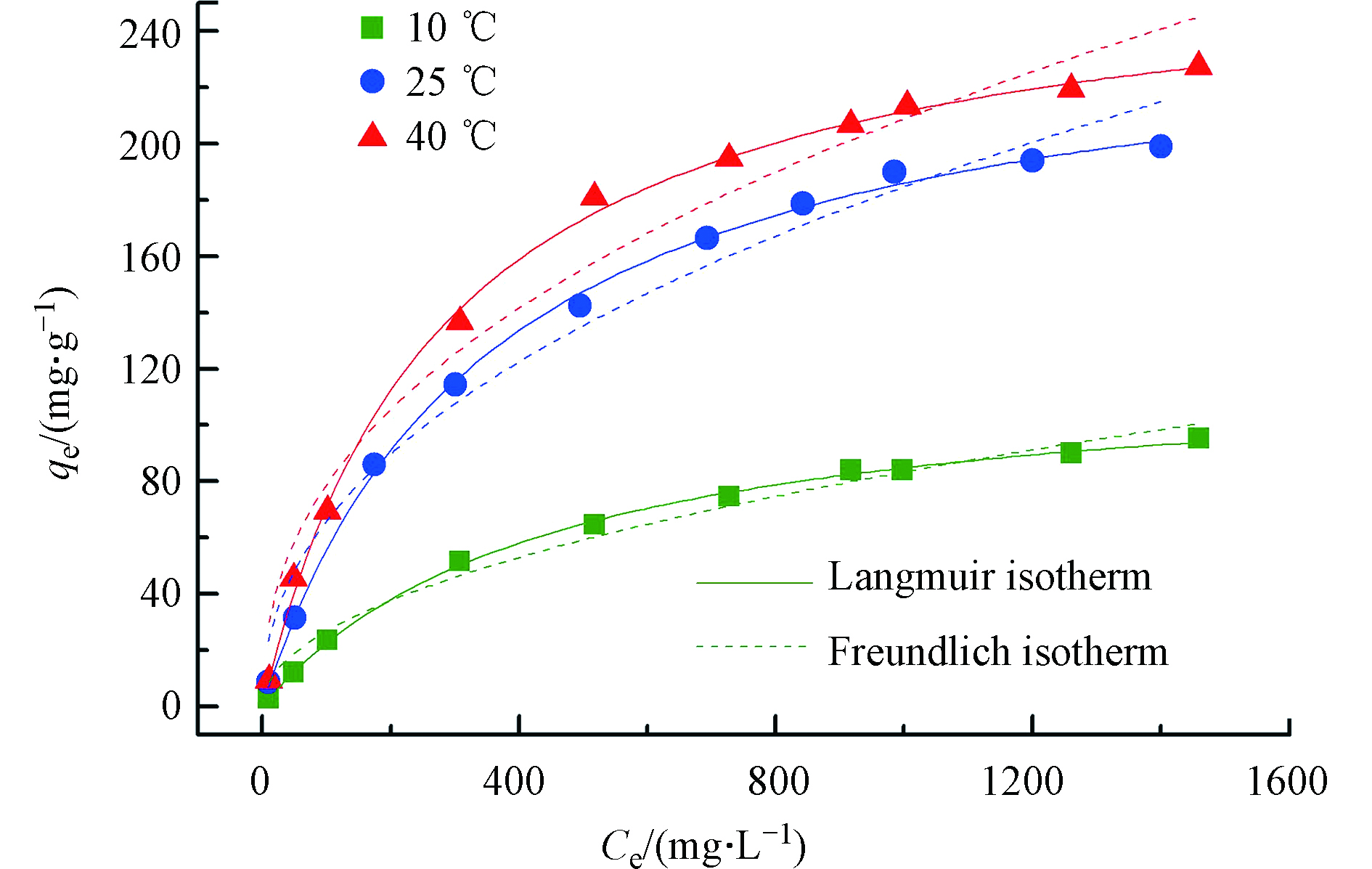
图6是在10℃、25℃及40℃条件下,CMS对Cr(Ⅵ)的等温吸附线。在不相同的温度下,随着初始浓度的增加CMS对Cr(Ⅵ)的吸附量均逐步增加。这是由于在低浓度的情况下,CMS中有足够的吸附活性位点可以吸附Cr(Ⅵ),但是随着浓度的增加,吸附活性位点接近极限,最后即使Cr(Ⅵ)浓度再增加,也不会有更多的Cr(Ⅵ)被吸附,故而吸附量越来越趋于平衡。选用Langmuir和Freundich吸附模型对数据进行拟合来研究等温吸附行为。
式中,Ce是Cr(Ⅵ)的初始浓度(mg·L−1);qm是最大吸附量(mg·g−1);KL是Langmuir吸附平衡常数(L·mg−1);Kf 和n是Freundlich常数。RL公式如方程(4)所示,当RL=0时,吸附是不可逆的;当RL=0—1之间,属于优势吸附;当RL=1时,属于线性吸附;当RL>1时,属于劣势吸附[12]。
表1是Langmuir和Freundich吸附模型的拟合结果,在10—40℃温度区间内,根据R2值可知,Langmuir模型可以说明CMS的吸附活性位点对Cr(Ⅵ)的作用过程类似于单分子层吸附过程[12, 17]。在10、25、40℃下,CMS对Cr(Ⅵ)的最大吸附量分别是122.4、251.9 、271.1 mg·g−1。其中RL介于0—1之间,说明CMS容易吸附Cr(Ⅵ)。表2是CMS与其他硫化物吸附剂的吸附量作比较。CMS对Cr(Ⅵ)的最大吸附量均大于其他吸附剂的最大吸附量,说明CMS对Cr(Ⅵ)具有良好的吸附性能。
-
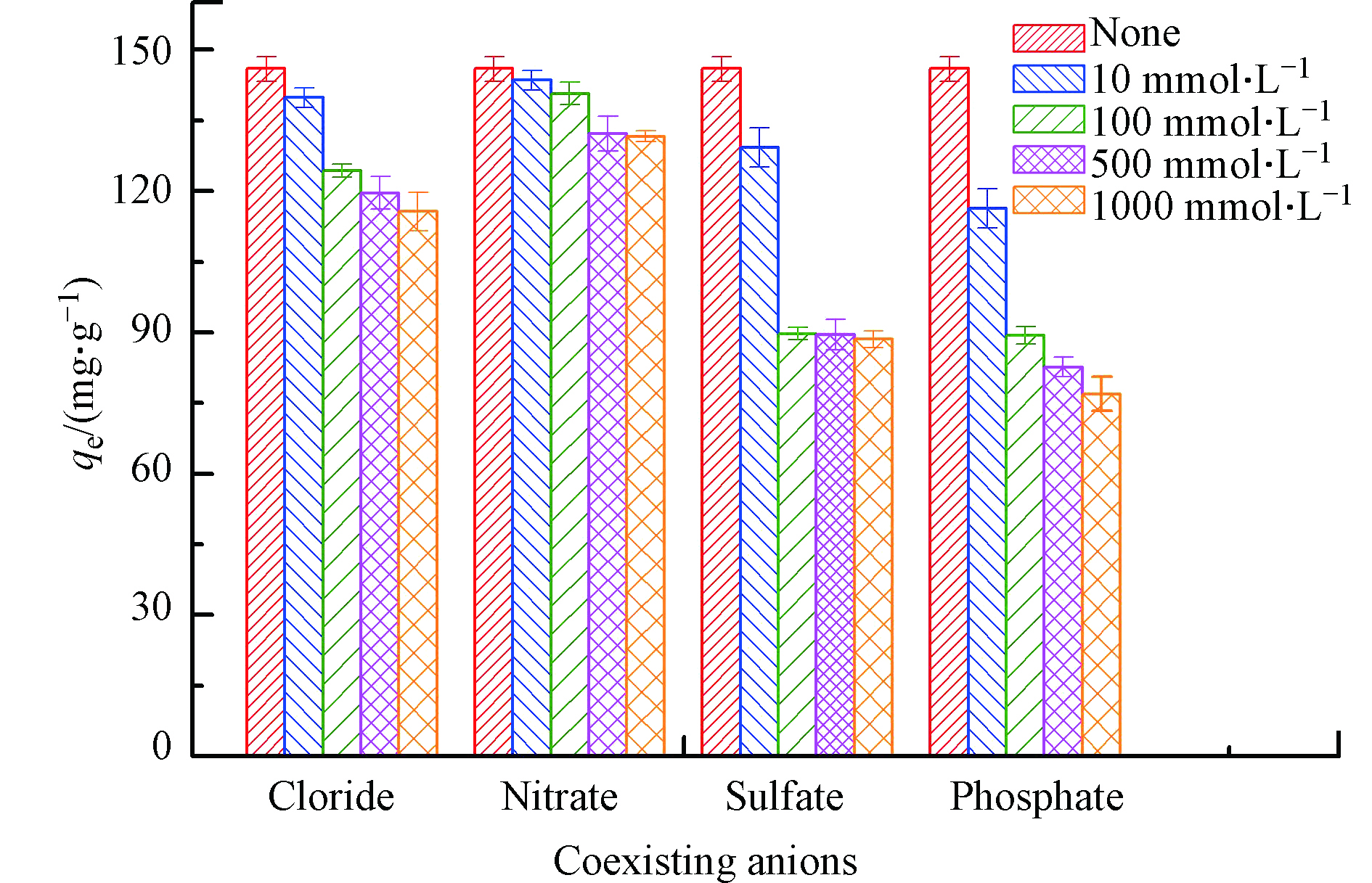
实际的废水中存在各种阴离子,会对Cr(Ⅵ)产生竞争吸附。图7是共存阴离子对Cr(Ⅵ)去除的影响。由图7可知,硝酸盐的浓度对吸附量的影响非常小,而硫酸盐和磷酸盐的浓度为100 mmol·L−1时,CMS对Cr(Ⅵ)约有39%的吸附量下降。但是随着浓度增加到1000 mmol·L−1时,吸附量也没有明显下降。而氯盐的存在,CMS对Cr(Ⅵ)的吸附量随着氯盐浓度的增加而逐渐下降,当浓度增加到1000 mmol·L−1时,吸附量下降约21%。这说明四者共存离子在不同浓度下都有一定的的影响,其影响顺序为:磷酸盐>硫酸盐>氯盐>硝酸盐。
-
为了研究CMS吸附水中Cr(Ⅵ)的动力学过程,采用准一级和准二级动力学模型,其方程分别如下:
式中,qt是t时刻时的吸附量(mg·g−1);k1为准一级吸附速率常数(min−1);k2是准二级吸附速率常数(g·mg−1·min−1)。
将图5中的数据分别代入到公式(5)和(6),通过模型拟合获得了动力学参数(列于表3)。准二级动力学方程的R2可以达到0.99,明显高于准一级动力学方程的R2。在10℃、25℃和40℃条件下,准二级动力学模型的qe cal值也更接近与实验值qe exp。另外,该模型是基于化学吸附是吸附过程中的控制步骤,而Cr(Ⅵ)进入层间会与硫形成化学吸附作用,从而也证明了CMS吸附Cr(Ⅵ)的过程符合准二级动力学模型。
通过Arrhenius方程可以计算吸附过程的反应活化能,其方程如下:
式中,Ea是反应活化能(kJ·mol−1);R是气体常数(8.314 J·mol−1·K−1)和T是绝对温度(K)。作图得到的拟合方程为:lnk2=−5693.91×1/T+11.36,通过线性拟合,其相关性R2可以达到0.9976。该拟合方程计算得到的Ea可以区别该反应是化学吸附还是物理吸附。当5 kJ·mol−1<Ea<40 kJ·mol−1,属于物理吸附;当40 kJ·mol−1<Ea<800 kJ·mol−1时,属于化学吸附。在本实验中,Ea = 47.34 kJ·mol−1,则表示CMS对Cr(Ⅵ)的吸附属于化学吸附[12],主要是因为Cr(Ⅵ)进入层间会与硫形成化学吸附作用。
-
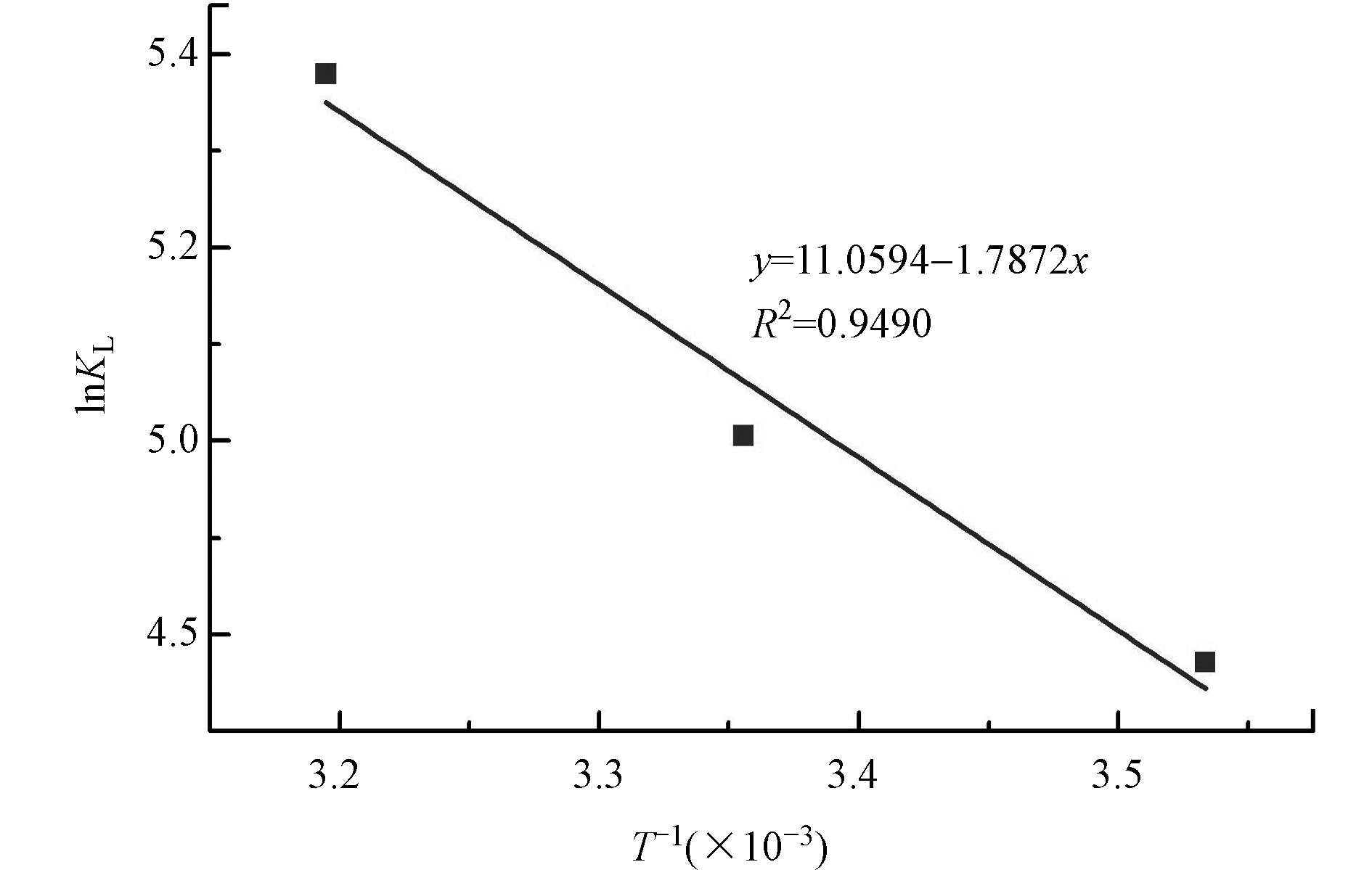
由图6可知,CMS对Cr(Ⅵ)的吸附量随温度升高而增大,说明吸附是吸热的,随着温度的升高,Cr(Ⅵ)与活性位点的有效碰撞概率增大,有利于更多的铬被吸附。通过热力学参数熵((ΔS)、焓(ΔH)和吉布斯自由能(ΔG))的评价,进一步解释吸附过程
其中,T(K)为反应温度,KL(L·mol−1)为Langmuir常数。如表4所示,负ΔG值(−11.23、−12.40、−14.00 kJ·mol−1)说明在所有温度下CMS自发吸附水中Cr(Ⅵ)。通过图8计算得到ΔH和ΔS。ΔH(14.86 kJ·mol−1)是正值表示CMS吸附Cr(Ⅵ)是一个吸热过程。ΔS(91.95 J·mol−1·K−1)是正值表示增加CMS与Cr(Ⅵ)模拟废水之间界面吸附的随机性。
-
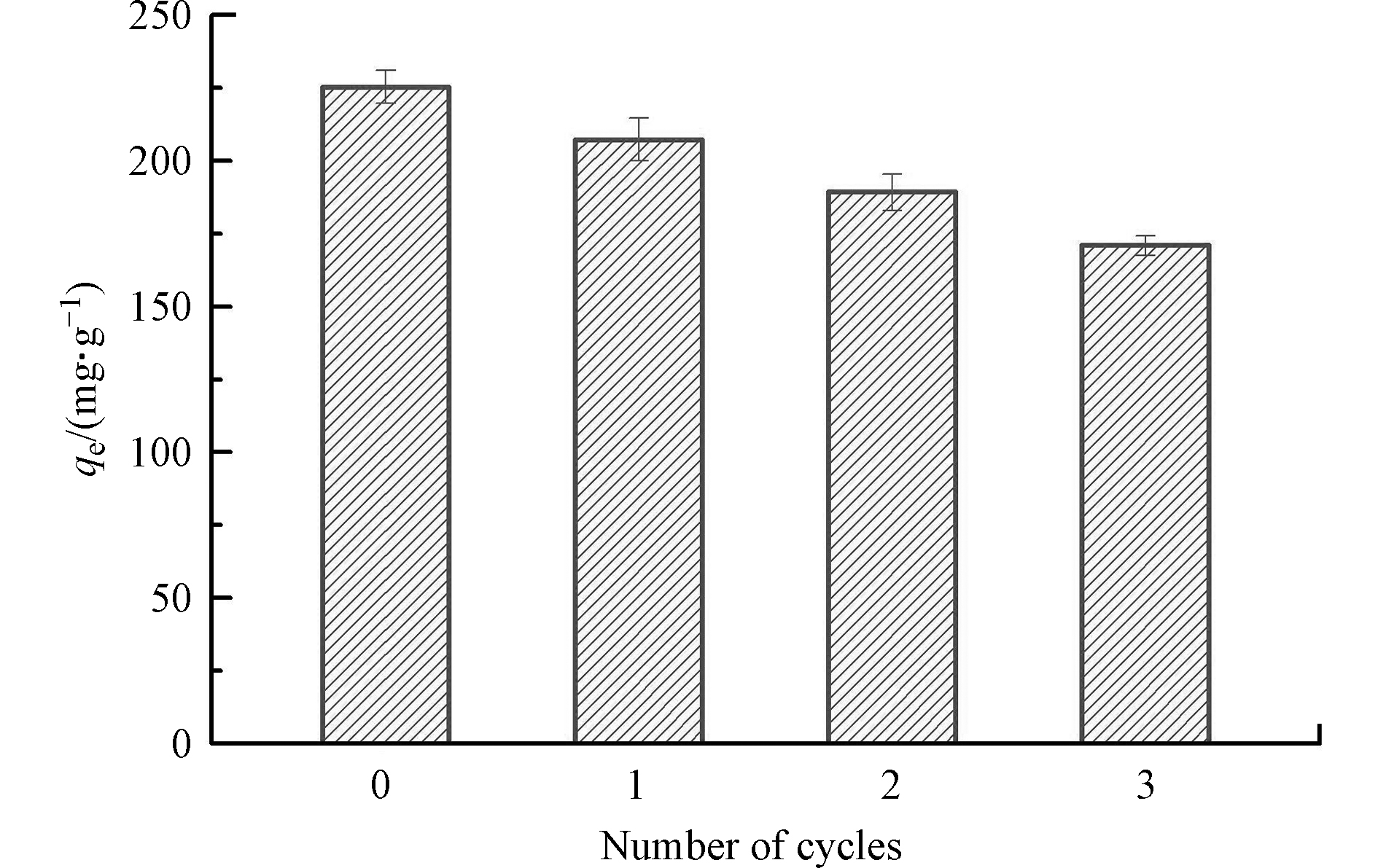
图9是CMS吸附Cr(Ⅵ)后采用1mol·L−1的NaOH进行再生,重复使用1次后,CMS对Cr(Ⅵ)的吸附量还是保持第一次使用时的约92%,重复使用3次后,吸附量能保持原有的约75%。因此CMS具备一定的再生和重复使用能力。
-
根据图1可知,被吸附的Cr(Ⅵ)会进入CMS的层间,Cr(Ⅵ)会被层上的硫所吸附从而导致层间距变大。图10a是Cr 2p的XPS图谱,Cr 2p3/2可以分成两个峰。在576.8 eV处的峰,属于Cr(Ⅲ);在578.4 eV处的峰,属于Cr(Ⅵ)[10, 19]。图10b是S 2p的XPS图谱,在161.1 eV、162.2 eV和168.5 eV处的峰,分别属于S2−、
${\rm{S}}_2^{2 - } $ 和${\rm{SO}}_4^{2 - }$ [20]。对于吸附前的CMS,相对于层状结构中的S2−和${\rm{S}}_2^{2 - } $ 而言,只有少量${\rm{SO}}_4^{2 - }$ 附着在吸附剂的表面。而对于吸附后的CMS,层状结构中一部分S2−和${\rm{S}}_2^{2 - }$ 被氧化成${\rm{SO}}_4^{2 - } $ 后释放出来,使得在吸附剂表面的${\rm{SO}}_4^{2 - }$ 含量会明显增加。从而证明由于一部分硫的氧化导致一部分吸附的Cr(Ⅵ)被还原,减小了吸附剂中铬的毒性。综上所述,Cr(Ⅵ)先是被层间的硫吸附,吸附后一部分的Cr(Ⅵ)又被还原。 -
(1) CMS可以有效去除水中Cr(Ⅵ),导致CMS层间距变大且表面变得粗糙。溶液的pH值会影响CMS对Cr(Ⅵ)的吸附量。当pH=2时,吸附量处于最大值。动力学过程符合准二级动力学模型且活化能为47.34 kJ·mol−1,这两者都说明了CMS吸附Cr(Ⅵ)属于化学吸附。
(2) 吸附平衡过程符合Langmuir等温吸附模型。在10、25、40℃下,CMS对Cr(Ⅵ)的最大吸附量分别是122.4、251.9、271.1 mg·g−1。CMS对Cr(Ⅵ)是一个吸热的吸附过程。
(3) 共存阴离会影响CMS对Cr(Ⅵ)的吸附,其影响顺序为:磷酸盐>硫酸盐>氯盐>硝酸盐。通过XPS分析发现一部分被吸附的Cr(Ⅵ)会被硫还原为Cr(Ⅲ),减小了铬的毒性。吸附后的CMS可以通过NaOH再生并重复使用。
有机无机杂化层状硫属化合物对水中六价铬的吸附
Adsorption of hexavalent chromium in water by organic-inorganic hybrid layered chalcogenide
-
摘要: 有机无机杂化层状硫属化合物[CH3NH3]2xMnxSn3−xS6·0.5H2O (x = 0.5—1.1)(CMS)对水中Cr(Ⅵ)具有良好的吸附性能。采用XRD、SEM、XPS、EDS等手段表征了CMS吸附前后的化学组成、结构和微观形貌。CMS吸附Cr(Ⅵ)后导致层间距变大和颗粒表面变粗糙。考察了pH、反应时间、反应温度、初始浓度和共存离子等因素对CMS吸附Cr(Ⅵ)的影响。溶液pH明显影响CMS对Cr(Ⅵ)的吸附量。结果表明,在pH=2时,CMS的吸附量达到最大值。吸附过程的活化能为47.34 kJ·mol−1且是一个吸热过程。在不同温度下,动力学数据符合准二级动力学模型。Langmuir等温吸附模型可以用来描述不同反应温度下的吸附平衡过程。在10、25、40℃下,CMS对Cr(Ⅵ)的最大吸附量分别是122.4、251.9 、271.1 mg·g−1。溶液中共存阴离子对吸附的影响顺序为:磷酸盐>硫酸盐>氯盐>硝酸盐。一部分被吸附的Cr(Ⅵ)会被还原为Cr(Ⅲ)。吸附后的CMS可以用NaOH(1 mol·L−1)再生并重复使用。本研究将为有机无机杂化层状硫属化合物去除重金属阴离子提供科学依据和技术基础。Abstract: The organic–inorganic hybrid layered chalcogenide [CH3NH3]2xMnxSn3−xS6·0.5H2O (x = 0.5—1.1) (CMS) exhibited excellent adsorption properties for Cr(Ⅵ) removal in water. XRD, SEM, XPS and EDS were used to characterize the chemical composition, crystal structure and micro-morphologies of CMS before and after adsorption. The interlayer of CMS became larger and the particle surface became coarse after adsorption of Cr(Ⅵ). The effects of pH, reaction time, reaction temperature, initial concentration and coexisting ions on Cr(Ⅵ) removal by CMS were investigated. The pH had obvious effect on the adsorption capacity. The adsorption on CMS reached the maximum point at pH of 2. The activation energy for the adsorption process was calculated to be 47.34 kJ·mol−1 and the adsorption process is endothermic. Kinetic data were fit well to a pseudo-second-order kinetic model at different temperatures. The Langmuir adsorption isotherm was used to fit the adsorption equilibrium process at different temperatures. The maximum adsorption capacity of CMS at temperature of 10 °C, 25 °C and 40 °C were 122.4 mg·g−1, 251.9 mg·g−1 and 271.1 mg·g−1, respectively. The degree of inhibition by coexisting anion followed the sequence: phosphate>sulfate>chloride>nitrate. A part of adsorbed Cr(Ⅵ) was reduced to Cr(Ⅲ). The adsorbed CMS can be regenerated by using NaOH (1 mol·L−1) and reused again. This study will provide the basis in theory and technique for the application of organic-inorganic hybrid layered chalcogenide compounds to remove heavy metal anions.
-
Key words:
- chalcogenide /
- chromium /
- adsorption /
- organic–inorganic hybrid
-

-
表 1 不同温度下CMS吸附Cr(Ⅵ)的Langmuir和Freundlich等温模型参数
Table 1. Langmuir and Freundlich isotherm models parameters for adsorption of Cr(Ⅵ) by CMS at different temperatures
温度/°C
TemperatureLangmuir Freundich qm/ (mg·g−1) KL/(L·mg−1) R2 RL n Kf/(L·mg−1) R2 10 122.4 0.00227 0.9988 0.23—0.98 2.03 2.77 0.9784 25 251.9 0.00287 0.9984 0.20—0.97 2.23 8.32 0.9712 40 271.1 0.00428 0.9981 0.14—0.96 2.36 11.18 0.9626 表 2 CMS与其他硫化物吸附剂的吸附量比较
Table 2. The comparison of adsorption capacity of CMS and other sulfide adsorbents
表 3 CMS吸附Cr(Ⅵ)的动力学参数
Table 3. Kinetic parameters for the adsorption of Cr(Ⅵ) onto CMS
温度/°C
Temperatureqe exp/(mg·g−1) Pseudo-first-order Pseudo-second-order k1/ min−1 qecal /(mg·g−1) R2 k2(×103)/(g·mg−1·min−1) qe cal/(mg·g−1) R2 10 67.6 0.343 44.4 0.7935 0.160 70.0 0.9982 25 145.3 0.305 109.9 0.9842 0.379 153.4 0.9986 40 184.8 0.188 154.9 0.9736 1.102 204.9 0.9930 表 4 热力学参数
Table 4. Thermodynamic parameter
T/°C KL/(L·mol−1) ΔG/ (kJ·mol−1) ΔH/ (kJ·mol−1) ΔS /(J·mol−1·K−1) 10 118.04 −11.23 14.86 91.95 25 149.24 −12.40 40 216.84 −14.00 -
[1] FILIK H, AVAN A A. Magnetic nanostructures for preconcentration, speciation and determination of chromium ions: A review [J]. Talanta, 2019, 203: 168-177. doi: 10.1016/j.talanta.2019.05.061 [2] 方润, 林江飞, 郑强辉, 等. 阳离子凝胶吸附和回收水中的Cr(Ⅵ) [J]. 环境化学, 2020, 39(3): 704-714. doi: 10.7524/j.issn.0254-6108.2019101103 FANG R, LIN Z F, ZHENG J H, et al. Adsorption and recovery of Cr(Ⅵ) from aqueous solution by cationic hydrogel [J]. Environmental Chemistry, 2020, 39(3): 704-714(in Chinese). doi: 10.7524/j.issn.0254-6108.2019101103
[3] 刘相尧, 王宝辉, 荆国林. 聚吡咯及其复合材料去除水体六价铬研究进展 [J]. 环境科学与技术, 2018, 41(3): 99-108. LIU X L, WANG B H, JING G L. Progress in application of polypyrrole and its conposites to removing hexavalent chromium from aqueous solution [J]. Environmental Science & Technology, 2018, 41(3): 99-108(in Chinese).
[4] GRACEPAVITHRA K, JAIKUMAR V, KUMAR P S, et al. A review on cleaner strategies for chromium industrial wastewater: Present research and future perspective [J]. Journal of Cleaner Production, 2019, 228: 580-593. doi: 10.1016/j.jclepro.2019.04.117 [5] ISLAM M A, ANGOVE M J, MORTON D W. Recent innovative research on chromium (Ⅵ) adsorption mechanism [J]. Environmental Nanotechnology, Monitoring & Management, 2019, 12: 100267. [6] YANG S, LI Q, CHEN L, et al. Synergistic removal and reduction of U(Ⅵ) and Cr(Ⅵ) by Fe3S4 micro-crystal [J]. Chemical Engineering Journal, 2020, 385: 123909. doi: 10.1016/j.cej.2019.123909 [7] GAO Y, CHEN C, TAN X, et al. Polyaniline-modified 3D-flower-like molybdenum disulfide composite for efficient adsorption/photocatalytic reduction of Cr(Ⅵ) [J]. Journal of Colloid and Interface Science, 2016, 476: 62-70. doi: 10.1016/j.jcis.2016.05.022 [8] AREGAY G G, ALI J, DU Y, et al. Efficient and selective removal of chromium (Ⅵ) by sulfide assembled hydrotalcite compounds through concurrent reduction and adsorption processes [J]. Journal of Molecular Liquids, 2019, 294: 111532. doi: 10.1016/j.molliq.2019.111532 [9] WANG J, WANG P, WANG H, et al. Preparation of molybdenum disulfide coated Mg/Al layered double hydroxide composites for efficient removal of chromium(Ⅵ) [J]. ACS Sustainable Chemistry & Engineering, 2017, 5: 7165-7174. [10] KUMAR A S K, JIANG S J, WARCHOL J K. Synthesis and characterization of two-dimensional transition metal dichalcogenide magnetic MoS2@Fe3O4 nanoparticles for adsorption of Cr(Ⅵ)/Cr(Ⅲ) [J]. ACS Omega, 2017, 2: 6187-6200. doi: 10.1021/acsomega.7b00757 [11] DING N, KANATZIDIS M G. Selective incarceration of caesium ions by Venus flytrap action of a flexible framework sulfide [J]. Nature Chemistry, 2010, 2: 187-191. doi: 10.1038/nchem.519 [12] 李建荣, 付明来. 层状金属硫属化物对水中锌的离子交换性能研究 [J]. 环境科学学报, 2015, 35(4): 1040-1047. LI J R, FU M L. Ion exchange property of layered metal chalcogenide for Zn2+ removal in water [J]. Acta Scientiae Circumstantiae, 2015, 35(4): 1040-1047(in Chinese).
[13] MANOS M J, KANATZIDIS M G. Metal sulfide ion exchangers: Superior sorbents for the capture of toxic and nuclear waste-related metal ions [J]. Chemical Science, 2016, 7: 4804-4824. doi: 10.1039/C6SC01039C [14] WANG K Y, FENG M L, KONG D N, et al. Layered indium chalcogenidoantimonates [Me2NH2]2In2Sb2S7-xSex (x = 0, 2.20, 4.20, 7) with tunable band gaps and photocatalytic properties [J]. Crystengcomm, 2012, 14: 90-94. doi: 10.1039/C1CE05879G [15] LI J R, WANG X, YUAN B, et al. Robust removal of heavy metals from water by intercalation chalcogenide [CH3NH3]2xMnxSn3-xS6·0.5H2O [J]. Applied Surface Science, 2014, 320: 112-199. doi: 10.1016/j.apsusc.2014.09.057 [16] 任守信. 水中铬的化学形态分布 [J]. 中国环境科学, 1989, 9(1): 40-44. REN S X. The speciation of chromium in water [J]. China Environmental Science, 1989, 9(1): 40-44(in Chinese).
[17] LI J R, XU L, FU M L, et al. Towards magnetic responsive chalcogenides for efficient separation in water treatment: facile synthesis of magnetically layered chalcogenide Fe3O4/KMS-1 composite adsorbents and their zinc removal application in water [J]. Inorganic Chemistry Frontiers, 2018, 5: 403-412. doi: 10.1039/C7QI00664K [18] MA L, ISLAM S M, LIU H, et al. Selective and efficient removal of toxic oxoanions of As(Ⅲ), As(Ⅴ), and Cr(Ⅵ) by layered double hydroxide intercalated with MoS42– [J]. Chemistry of Materials, 2017, 29: 3274-3284. doi: 10.1021/acs.chemmater.7b00618 [19] YANG S, LI Q, CHEN L, et al. Ultrahigh sorption and reduction of Cr(Ⅵ) by two novel core-shell composites combined with Fe3O4 and MoS2 [J]. Journal of Hazardous Materials, 2019, 379: 120797. doi: 10.1016/j.jhazmat.2019.120797 [20] LV D, ZHOU J, CAO Z, et al. Mechanism and influence factors of chromium(Ⅵ) removal by sulfide-modified nanoscale zerovalent iron [J]. Chemosphere, 2019, 224: 306. doi: 10.1016/j.chemosphere.2019.02.109 -



 下载:
下载: