-
自2019年12月首次发现新型冠状病毒(COVID-19)以来,新冠肺炎在全球范围内迅速传播,对人类健康和经济发展构成严重威胁。为了防止疫情的进一步恶化,我国筛选出针对COVID-19的抗病毒药物(antiviral drug,ATVs)并投入临床治疗。中国科学院在2020年初的研究中发现,新型冠状病毒已发生突变,突变后的病毒具有更强的感染性和侵略性[1]。近日,世界各地也不断出现有关新冠病毒变异的报道,病毒变异已成为人们关注的焦点。在英国、南非、美国、澳大利亚、日本、中国等几十个国家都相继发现了引发感染的新冠病毒变异株。很多病毒学专家认为COVID-19有可能转成慢性疾病,像流感一样与人类共存。因此,世界各国纷纷启动相关ATVs的研发和筛选,ATVs的需求和使用也在激增。此外,由于病毒性流感的频发以及部分地区医疗水平落后引起HIV病毒的传播,导致抗流感药物、抗HIV病毒药物等ATVs被广泛应用,这些ATVs所带来的生态环境问题同样不容小觑[2]。
ATVs属于药品及个人护理品(PPCPs),它通过阻止病毒复制,缩短疾病时间[3]。根据作用机制,ATVs大致可分为5类:抗流感病毒药物、抗疱疹病毒药物、抗巨细胞病毒药物、抗肝炎病毒药物和抗HIV病毒药物[4]。抗流感病毒药物又分为,以金刚烷胺和金刚乙胺为代表,通过M2离子通道抑制剂[4]阻断甲型流感病毒M2蛋白[5]。以奥司他韦和扎那米韦为代表,通过神经氨酸酶抑制剂特异性结合神经氨酸酶的活性部位,引起酶失活[5]。以利巴韦林为代表的广谱型病毒药物,通过抑制肌苷单磷酸脱氢酶阻断鸟苷一磷酸的合成。阿比多尔为代表的干扰素诱导药物阻断宿主细胞与病毒脂膜的融合。主要的抗疱疹病毒药物是广谱抗疱疹病毒药物阿昔洛韦,以及伐昔洛韦和喷昔洛韦衍生物,它们通过与病毒DNA聚合酶竞争来阻断病毒DNA合成[6]。常见的抗巨细胞病毒药物有能抑制脱氧鸟苷三磷酸与病毒DNA结合的更昔洛韦、能选择性抑制二磷酸与病毒DNA聚合酶结合的磷酸和能竞争性抑制DNA聚合酶中断DNA合成的西多福韦[7]。抗肝炎病毒药物包含干扰素和核苷酸类似物,干扰素可分为α(白细胞)型、β(成纤维细胞)型、γ(淋巴细胞)型,可起到免疫调节、抗病毒以及抗增殖的作用,它们是由病毒和诱生剂对生物体细胞作用下产生的分泌蛋白;核苷酸类似物中包含胞嘧啶核苷类似物恩典他滨,它的抗肝炎病毒活性为拉米夫定的4—10倍[8],以及用于乙型肝炎治疗的阿德福韦酯[9]和恩替卡韦[10]。医学中使用到的抗HIV病毒药物有3种,分别为HIV反转录酶抑制剂、HIV蛋白抑制药和融合蛋白抑制药,其中HIV反转录酶抑制剂包含核苷类药物齐多夫定和非核苷类反转录酶抑制剂地拉韦定。HIV蛋白抑制药包括可竞争性抑制或互补蛋白酶活性位点的沙奎那韦、利托那韦和奈非那韦等[11]。T20为最早医用的融合蛋白抑制药可将病毒阻断在感染源头[12]。
ATVs跟大多数药品一样很难被人体完全吸收,会以代谢物或原型经由有机体排泄物排出。通常情况下其在水体环境中的污染浓度很低,只处于ng·L−1的数量级[13]。但是,由于一些ATVs的使用量大,通过水系统进入人体,持续的输入产生假持续现象,它在水体或生物体中的富集效应会对生态环境造成影响。2008年Duffy[14]等已经发现,ATVs会存在于水体环境中。近年来的研究表明,中国、美国、意大利、西班牙等许多国家的水环境中都存在大量有毒的ATVs及其反应产生的二次产物。一般来说,中间产物的毒性会比最初的ATVs更大[15]。因为ATVs长期存留在自然水体中难以去除,甚至有引发病毒抗性的环境风险。然而,这些ATVs在水环境中的迁移转化以及对水生生态系统的毒性作用尚不清楚。在COVID-19爆发的情况下,人体排泄的ATVs在水环境中的环境行为及其可能产生的生物毒性效应不容忽视。
本文首先将对ATVs在水环境中污染现状、环境行为、毒性效应以及风险评估进行详细的综述,其次收集了全球不同区域水体中ATVs数据信息,并分析ATVs在水环境中所呈现的污染水平,最后评估了ATVs进入水环境后带来病毒耐药性的生态风险,为水环境中ATVs的迁移转化和归趋、水污染防治及水生态环境风险评价提供理论依据。
-
根据ATVs的不同功能,目前批准的ATVs可分为13类,包括5-取代20-脱氧尿苷类似物、核苷类似物、(非核苷)焦磷酸盐类似物、核苷逆转录酶(RT)抑制剂(NRTls)、非核苷逆转录酶抑制剂(NNRTIs)、蛋白酶抑制剂(PIs)、整合酶抑制剂、进入抑制剂、无环鸟苷类似物、无环核苷膦酸酯(ANP)类似物、丙型肝炎病毒(HCV)NS5A和NS5B抑制剂、抗流感病毒药物、免疫刺激剂,干扰素,寡核苷酸和抗有丝分裂抑制剂。目前临床上广泛应用的ATVs有9种,包括抗疱疹病毒、抗人类免疫缺陷病毒、抗乳头瘤状病毒、抗流感病毒、抗呼吸道合胞病毒和抗乙型肝炎病毒药物等[16]。全球药品销售数据显示,在治疗药物领域,ATVs的销售量处于领先地位。由于地区间的差异,不同地区常用的ATVs也有所区别。非洲地区常用的ATVs主要为抗逆转录病毒药物(ARV)包括替诺福韦、恩曲他滨、拉米夫定和依非韦伦。奥司他韦(OS)、扎那米韦(ZAN)、金刚乙胺(RIM)以及达菲(OS磷酸盐)是欧洲最常用的ATVs。
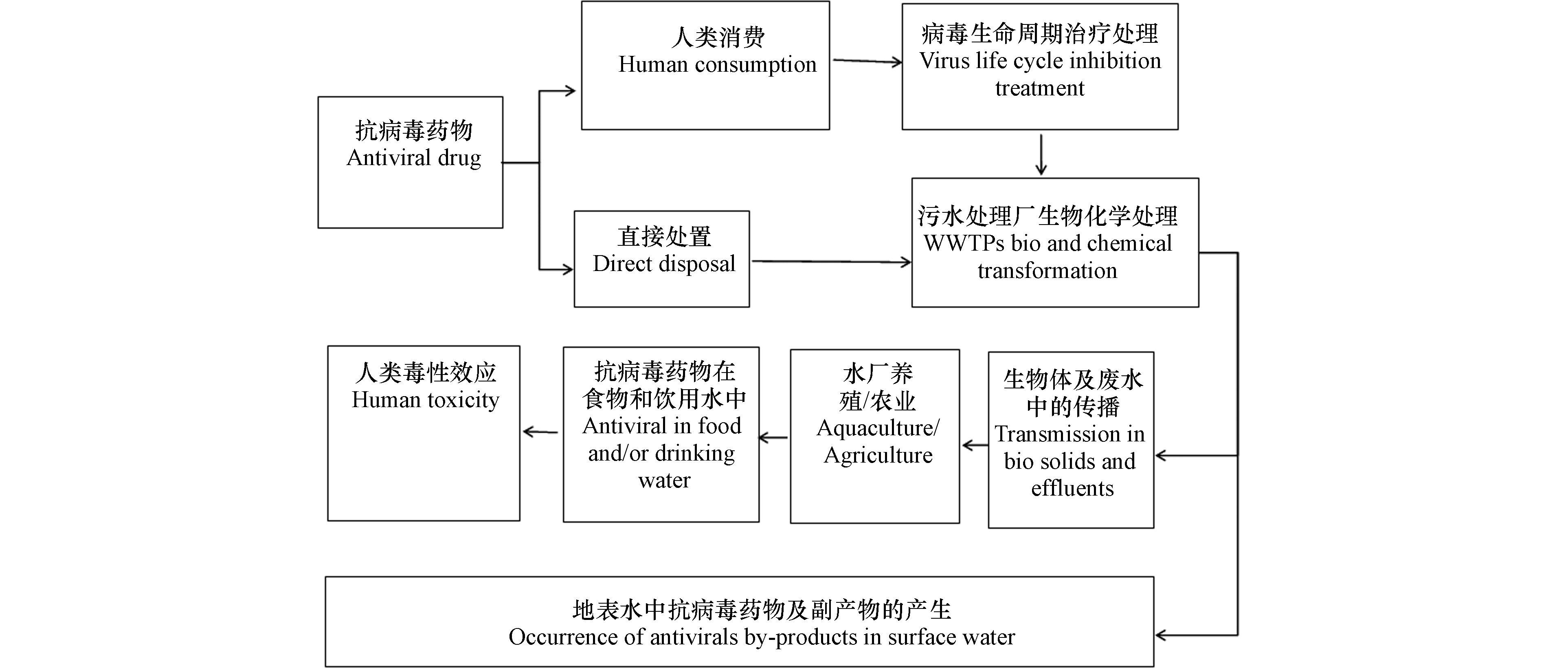
水环境中的ATVs主要来自于医院、制药厂、人类活动以及养殖业等[17](图1)。ATVs在人体内参与代谢,未被利用的成分会以有机体排泄物的形式排出体外[18]。污水处理厂和养殖场是水环境中ATVs的重要来源。污水处理厂现有的污水处理设施不能完全清除水体中的ATVs,导致ATVs及其中间产物在水环境中积累,对生态环境造成危害(图1)[16]。Funke等[19]在研究德国水域中的5种ATVs(阿巴卡韦,恩典他滨,更昔洛韦,拉米夫定和齐多夫定)时发现,除了齐多夫定外其他原始状态的ATVs均未检出,而水体中ATVs的转化产物(TPs)的检测范围从羧基拉米夫定的16 ng·L−1到羧基阿昔洛韦的750 ng·L−1。德国成品饮用水中检出3种羧基ATVs转化产物,说明德国水体中相当一部分ATVs转化物具有较高的环境持久性。
同时,为了应对禽流感等病毒性疾病的发生,水产养殖业也将使用ATVs。如果水产养殖业不合理地使用ATVs,将会造成养殖废水对天然水体的污染,甚至为天然水体中的病毒带来耐药性。吴慧珍等[21]对3种ATVs(金刚烷胺,金刚乙胺和美金刚)在畜禽粪便中残留研究发现金刚烷胺的最高检出限可达到633 μg·kg−1。
-
目前的文献报导中,自然水环境中的ATVs的检测浓度一般为ng·L−1的数量级,虽然浓度较低,但水环境中低浓度的ATVs仍然会引起水生生物和病毒的抗性,威胁人类的健康和水生生态系统的安全[21],在全球各地的水域中都不难发现它们的踪迹(表1)。德国黑森林的里德河中检测到9种ATVs和一种代谢产物,9种ATVs包括阿昔洛韦、阿巴卡韦、拉米夫定、奈韦拉平、奥司他韦、喷昔洛韦、利巴韦林、司他夫定、齐多夫定的最低测定限均达到ng·L−1数量级,检测到的最高浓度为拉米夫定可达到10 ng·L−1,最低浓度为阿昔洛韦、奥司他韦及其中间产物奥司他韦羧酸盐[13],为0.2 ng·L−1。南非的地表水中检测到12种ATVs,分别为扎西他滨、替诺福韦、拉米夫定、地高辛、司他夫定、阿巴卡韦、齐多夫定、奈韦拉平、茚地那韦、利托那韦、洛匹那韦和依法韦伦,平均浓度在26.5—430 ng·L−1之间[22]。Muriuki等[23]对肯尼亚的3个污水处理厂中废水悬浮颗粒(SPM)的活性药物成分进行监测,发现3种ATVs分别为拉米夫定、奈韦拉平和齐多夫定,统计数据显示,拉米夫定和齐多夫定在SPM中的平均浓度高于奈韦拉平。Azuma等[15]对日本淀川河流域ATVs浓度进行监测,发现在流感季节奥司他韦、培拉米韦和扎那米韦的检测浓度可分别达到20、10、89 ng·L−1,奥司他韦羧酸盐的浓度为70 ng·L−1。且ATVs法匹拉韦、拉尼米韦、金刚烷胺以及拉尼米韦中间产物仅出现在流感季节的淀川河中。在已发表的文章中,对非洲天然水和废水中ATV的研究最多,尤其是抗逆转录病毒药物[24],这与非洲地区艾滋病毒蔓延有关。针对欧洲和亚洲水环境中ATVs含量的研究主要分布在德国[19]、法国[25]和中国[26]、日本等地区[27]。挪威[28]、芬兰[29]以及美国[30]等国家的数据较少,而发表的文章大多是分析和评价流感大流行后奥司他韦等ATVs对水环境造成的影响[31]。
中国在世界范围的药品使用和制造中占有巨大份额。最新数据显示,我国药品生产和使用量仍处于稳步上升阶段。在我国水污染年度统计分析中,江河湖泊检出PPCPs158种,珠江流域检出PPCPs90多种,辽河流域检出PPCPs50多种[34]。然而,只有少数调查集中在ATVs上。Peng等[33]在我国珠江三角洲海域检测到6种ATVs,包括利巴韦林、更昔洛韦、奥司他韦、司他夫定、齐多夫定和1种中间体奥司他韦羧酸盐,其浓度范围在113 ng·L−1内。
根据以上的数据可以发现,全球水环境中最常检测出的ATVs包括法匹拉韦、奥司他韦、利巴韦林和奥司他韦羧酸盐等。原因可能与这些ATVs的结构有关,利巴韦林类的ATVs结构特点使其极易与水分子发生反应,易溶于水。得益于其环状结构,它在自然条件下难以被降解。而利巴韦林等核苷类药物在我国广泛应用,也是治疗COVID-19 的推荐药物,由于新冠肺炎疫情期间被大量使用,其在水环境中被检测出的可能性增大。在针对ATVs在水环境中赋存的调查研究中,由于非洲受HIV病毒的影响较深,抗逆转录病毒亚型的研究主要集中在非洲的天然水和废水上。欧洲对ATVs的研究集中在德国和英国,在中国和日本,关于水环境中ATVs的文章很多,然而,挪威、比利时和美国缺乏可用的研究数据。目前对ATVs生物毒性的研究主要集中在奥司他韦及其代谢产物奥司他韦羧酸盐上,而COVID-19相关ATVs的报道较少[16]。
法匹拉韦、奥司他韦、利巴韦林和奥司他韦羧酸盐在全球范围内使用广泛,因此在水环境中被检出的概率极高这4种ATVs的理化性质见表2,可发现它们的分子量都较高(>150 g·mol−1),且均存在环状结构。表2中,法匹拉韦是一种核苷类似物,2014 年在日本批准上市,用于甲型、乙型流感的抗病毒治疗,并能有效抑制埃博拉病毒、黄热病病毒、诺如病毒和肠病毒等[35]。奥司他韦是一种神经氨酸酶抑制剂,用于甲型、乙型流感的抗病毒治疗,它能够阻断病毒在受感染细胞中释放,其活性代谢产物奥司他韦羧酸盐也是一种具有选择性的神经氨酸酶抑制剂。利巴韦林是一种在中国最常用的核苷类广谱强效ATVs,用于治疗乙型脑炎和肝炎,对许多DNA 和RNA 病毒有抑制作用[36]。
-
水环境中的ATVs会发生吸附、降解和转化等过程,不同ATVs结构和性质的不同导致其在水环境中发生的反应也不同,环境条件的差异也决定了它在水环境中的环境行为和存在形式[15]。
-
不同结构特征的ATVs具有多样的理化性质。ATVs可分为亲脂性、中性和亲水性。在大多数情况下,ATVs在土壤或沉积物中的吸附属于非线性吸附,其在土壤中的吸附路径包括吸附滞后过程[5]。不同条件下,ATVs在水中吸附的状况也不同。在正常情况下,ATVs在水体中更容易被污泥所吸附,由于ATVs的两性离子和较高的进水浓度使得它在污泥中的吸附率可达到70%—90%[16]。然而,Evgenidou等[37]的研究发现吸附系数低的ATVs往往留在水相中,这有利于它们通过水的流动性进入污水处理厂。一般来说,lgKow值低于3.0的ATVs预计不会被显著吸附,因此这些颗粒在初级处理中的去除率较低。可见,ATVs在水环境中的吸附作用决定它在水相中的截留能力,甚至影响它在污水处理厂中的去除率。然而在Kumar[38]对ATVs归趋的研究中发现,大多数的ATVs在WWTPs中只有很少一部分吸附到沉积物和污泥中,并不能作为主要的去除手段。
-
根据降解方式的不同,水环境中ATVs的降解可分为水解、生物降解和光化学降解。由于自然水环境的复杂性,ATVs降解通常会在多种降解方式联合作用的方式下进行。BARTELS等[39]研究了奥司他韦(OS)的归趋,发现在无菌和非无菌、不同维度、不同日光照射下,50 μg· L−1OS的河水溶液中OS的半衰期为17.8 d,并且直接光解作用对奥司他韦羧酸盐(OC)的降解几乎没有效果,水环境中OC的降解可能是通过微生物代谢和直接光解共同作用进行的。结果表明,在单一降解模式下,ATVs在水环境中的降解速率缓慢,但在多种降解模式下降解效率较高。
-
ATVs的水解依赖于ATVs分子结构中存在的醇、酰胺和苷键等易水解基因,在相关的酶促反应作用下,这些醇、酰胺和苷键容易转化为羧酸、醇或胺[40]。在一般的情况下,酯类的ATVs比含有酰胺和苷键的ATVs更容易发生水解反应[41]。张小庆等[42]在对ATVs利巴韦林在蛋鸡体内代谢的研究中发现哺乳动物代谢利巴韦林的一种途径是酰胺水解。利巴韦林放射性标记试验表明有1/3的ATVs以原药形式排出体外而剩余的部分以1H-1,2,4-三氮唑-3-甲酰胺(TCONH2)和1-β-D-呋喃基核糖-三氮唑-3-羧酸(RTCOOH)的形式排出。TCONH2由核苷糖水解形成,并最终生成三氮唑羧酸(TCOOH)。生物体内参与ATVs水解反应的酶主要有胆碱酯酶、羧酸酯酶以及对氧磷脂酶,这些酶促反应使ATVs和葡萄糖醛酸或硫酸结合,然后随着胆汁进入肠道,在肠道微生物或水解酶作用下重新水解为原药,被肠道吸收后再次进入肝脏形成肝肠循环。
-
ATVs的生物降解发生于污水处理厂中以及自然环境中的生物联合作用过程中。在自然环境中,微生物通过混合基质的作用和自身的生理代谢,与水体中的ATVs发生生化反应,从而转化或完全矿化水体中的ATVs。Azuma等[15]研究表明,ATVs奥司他韦羧酸盐(OC)在生物降解下的半衰期比在自然条件下短3—10倍。如表3,在自然光下OS的半衰期为15—20 d,OC的半衰期为144—150 d,而在生物降解下OC的半衰期为15—53 d,拉尼米韦(LAN)在自然光下的半衰期为8 h,生物降解下半衰期可达0.5—2 d,法匹拉韦(FAV)在生物降解下表现出持久性,但在紫外线下状态不稳定,半衰期仅为1 h.
河流水样检测中金刚烷胺(AMN)、法匹拉韦(FAV)、奥司他韦羧酸盐(OC)、帕拉米韦(PER)、扎那米韦(ZAN)均表现出了高耐生物降解性[42]。就目前的研究而言,除拉尼那韦和奥司他韦外,其他ATVs均不能通过生物降解去除[38]。
-
由于ATVs分子结构含有一个或多个芳环或杂环,能够吸收一定的太阳光(波长≥290 nm),因此,光解是消除表面水层中ATVs的重要途径之一[16]。ATVs在水环境中的光解可以分为直接光解、间接光解和自敏化光解[23]。当ATVs的紫外-可见吸收光谱与太阳发射光谱一致时,ATVs的直接光解反应遵循准一级反应动力学。Karim等[43]研究了磷酸氯喹在紫外线和阳光照射下的光降解,发现磷酸氯喹的光降解受pH值和溶剂的影响。当反应速率较高,pH值为8时,光解符合准一级反应动力学。Azuma等[15]研究了流感爆发季节淀川河中相关ATVs的命运。结果表明,法匹拉韦和和拉尼米韦在光解过程中迅速消失(半衰期分别为1 h和8 h),光解动力学特征也符合准一级反应动力学。水环境中存在大量的光敏物质,它们通过光线激发发生催化氧化反应,产生各种光活性瞬态体和活性氧物质(ROS),在一定的条件下,活性氧等其他活性物质与ATVs发生间接光解[44]。在间接光解和自敏化反应中,由于ROS参与,光解反应动力学应遵循二级反应动力学[45]。光解通过改变污染物质在水体环境中的转化过程并干扰了水中有机污染物质发生的理化反应,ATVs在降解过程中不是直接被矿化,而是转化为中间产物。在这个过程中,它们的生物毒性也会发生相应的变化[24]。现有的研究发现,光解可能影响ATVs对生态环境的毒理效应[16]。同时ATVs的光化学降解受多种因素影响。Zhou等[46]研究发现,3种ATVs阿昔洛韦,拉米夫定和齐多夫定在溶解有机物(DOM)作为光吸收剂的作用下发生光化学降解。然而目前除了磷酸氯喹和法匹拉韦,对COVID-19其他相关ATVs的光解动力学研究仍鲜见报道,因此,有必要对ATVs的光解动力学开展研究以填补认知的空白。
-
由于ATVs对水环境的持续输入,使其在生物体中呈现出假持续的现象,ATVs会随着生物的捕食作用在更高级的动物体内富集[16]。尽管目前对ATVs的生物累积性研究较少,但ATVs的生物累积性仍然可以从仅有的数据中看出。Daouk等[47]发现,洛匹那韦在医院废水中的辛醇-水分配系数lgKow>3.9,具有很高的生物累积潜力。Haladyj等[48]发现ATVs羟氯喹和氯喹的lgKow值分别可达到4.67和3.03,也具有很高的生物累积能力。根据ATVs的药代动力学研究齐多夫定达峰时间(tmax)=1.1 h,药峰浓度(Cmax)=0.7 μg·mL−1,末端消除半衰期(t1/2)=(1.11±0.13 )h;拉米夫定tmax=1.52 h,Cmax=2.20 μg·mL−1,t1/2=(1.11±0.13) h;奈韦拉平Cmax=5.221 μg·mL−1,药时曲线下面积(AUC)=50.189 μg·h·mL−1,t1/2=25 h;依非韦伦Cmax大部分时间处于1—4 μg·mL−1的范围内,而在特殊情况下大于4 μg·mL−1,且其血浆半衰期可达40—50 h[49];替诺福韦tmax=(1.20±0.47) h,Cmax=(361.51±219.04) ng·mL−1,AUC=(4077.50±1554.88) ng·h·mL−1,t1/2=(29.53±14.12) h;服用300 mg·Qd−1替诺福韦tmax=2.3 h,Cmax=326 ng·mL−1,AUC=3020 ng·h·mL−1,t1/2=14.40 h[50]。由药代动力学参数可得部分ATVs的峰浓度高,消除半衰期长,吸收量AUC高难以快速消除,易在生物体富集[49]。
-
ATVs的毒性效应是指药物母体以及降解中间产物对生物体的危害,大量研究数据显示降解中间产物毒性强于药物母体。由于ATVs主要分布在水体中且蒸汽压小,导致ATVs易被光催化降解或发生光化学反应,产生两类光致毒性。目标污染物在吸收光辐射之后生成一系列的活性物质,这些活性物质会对生物大分子构成伤害。Jia等[21]在模拟太阳光下对阿昔洛韦在水中的光解研究中进行了发光细菌的急毒性试验,发现中间产物的毒性高于阿昔洛韦母体化合物,这些结果表明,阿昔洛韦的光合产物对水环境具有很大的潜在风险。研究发现,ATVs在降解过程中不是直接矿化,而是转化为某些中间产物,其生物毒性也会发生相应的变化[18]。An等[51]以发光菌、绿藻和大型溞为受试物,测试了经过TiO2光催化降解后的3种ATVs(1-金刚烷胺、2-金刚烷胺和金刚乙胺)的生物毒性,结果显示,随着时间的推移,毒性先增后降。然而,大多数毒性实验只关注单个ATVs的毒性,而联合ATVs的毒性可能具有协同效应。Pomati等[52]在研究中发现混合药物对人类的胚细胞的毒性高于单一药物的毒性。并且Escher[53]在研究单一ATVs及其中间产物混合物对目标生物绿藻的毒性研究时采用费氏弧菌作为指示物,数据显示当进行30 min生物发光抑制试验时EC50可达10.5 mmol·L−1,对亚螺藻毒性强度近似为4.3 g·L−1,而当进行24 h的光合作用抑制时EC50为15.5 mmol·L−1,相当于6.4 g·L−1。而对ATVs混合物相互作用进行研究,得出混合物效应相当于浓度加成,对绿藻的毒性作用中只有奥司他韦是基线毒物。
-
研究人员在对ATVs的毒性效应研究中发现水体中的ATVs及其光化学反应产生的中间产物会对部分水生生物产生毒性效应。Sanderson等[54]使用定量结构关系活性关系(quantitative structure-activity relationship,QSAR)模型收集了3000种不同的化合物的数据,研究发现ATVs对水环境具有威胁性,它会对水中的植物、大型溞(Daphnia magna)和鱼类产生毒性效应。在自然水体中,不同的水生生物对水体中ATVs的耐受情况存在差异,受到的毒性效应不同。Zurita等[55]采用了4种生态毒理学模型系统研究了磷酸氯喹的生物毒性效应,研究结果表明:对磷酸氯喹最敏感的生物是大型溞,最不敏感的是发光菌;在暴露24—72 h后,磷酸氯喹的毒性增加了五倍以上,因此可以确认磷酸氯喹对水生生物有害。这些ATVs在光化学转化过程中毒性发生的变化,可能是因为发生了光修饰毒性,或者生成ROS对生物体造成损伤,表现为光敏化毒性[23]。在另一项研究中,使用荧光杂交技术(FISH)观察了主要的淡水细菌α、β和γ-蛋白细菌以及拟杆菌,比较达菲及其代谢产物奥司他韦羧酸盐的毒性作用,发现在母体化合物存在下,细菌存活率较低[56]。在2019年水环境的安全数据表中可发现,大型溞在接触含羟基氯喹的天然水72 h后,其生长速度受到抑制[57]。目前大部分研究中只关注到ATVs及其降解中间产物的急性毒性效应,而忽视了可能带来更大风险的慢性毒性效应的持久性。Robson等[58]发现鱼类在浓度为20.6 ng·L−1的依法韦伦溶液中96 h后会发生肝脏损伤,并且随着时间延长,鱼类不断死亡。
-
天然水体中的ATVs成分会通过多种环境行为进入人类的饮用水系统中,然而目前的饮用水处理技术无法将ATVs有效去除,残留的ATVs成分会对人体产生一定的毒性效应。虽然饮用水中的ATVs含量处于低浓度状态,但在长期饮用的情况下可能会导致人体免疫能力减弱。在食物链作用的累积下,严重时可产生致畸、致癌和致突变的毒性效应[59]。Zurita等[55]在对磷酸氯喹(CQ)的研究中发现,CQ在包括人类在内的哺乳动物中具有剧毒,导致心脏骤停、心源性休克、传导障碍、室性心律不齐、失明、呼吸抑制和抽搐,CQ对大鼠和猴子有潜在的长期毒性,对狗毒性极强。国内外研究中大量毒性实验集中于ATVs对人体细胞线粒体以及哺乳动物致死量的影响。对CEM(人源T细胞)进行扎西他滨和非阿尿苷的处理后发现毒性浓度分别可达1.9 μmol·L−1和1.5 μmol·L−1。而暴露在10 μmol·L−1非阿尿苷环境中,4 d后HepG2细胞(来源于肝母细胞瘤)的细胞上清乳酸量增长明显[60]。Zeng等[61]在研究ATVs对猕猴的毒性效应时发现,当核苷类药物美他卡韦浓度达到40 mg·kg−1,齐多夫定浓度达到50 mg·kg−1时,猕猴全部致死,并且齐多夫定处理下的猕猴肌肉、肾、骨骼肌和心肌均受损,一些骨骼肌细胞线粒体内膜消失或肿大后形成液泡。Richardson等[62]则发现当每日投食7.5 mg·kg−1后的土拨鼠肝脏活性较正常状态下下降(8.8±1.3 )U·mg−1,肌肉活性较正常状态下下降(4.4±1.7) U·mg−1,并且出现1只土拨鼠致死的情况。然而并不是所有的ATVs及其降解产物都会对人体产生危害。最新的研究中发现,ATVs更昔洛韦、伐昔洛韦等抗热剂在最高浓度1000 mg·L−1下对试验生物藻类,水蚤等水生生物并无抑制作用,并且对鱼类以及人体的潜在风险系数也极低[63]。
-
COVID-19的全球流行引发ATVs的大量使用,诱导野生动物库的病毒产生抗药性,严重时会妨碍COVID-19患者的治疗[64]。病毒是否产生抗药性的研究主要是通过生物体抗性基因的检测以及ATVs对病毒株有效性的观察来实现。近期,在纽约布朗克斯动物园的8只老虎和狮子身上发现新冠病毒[65]。携带病毒的动物摄入受污染水源会促进病毒耐药性发展。病毒处于高负荷的抗病毒药物残留物及其代谢转化产物的环境中,通过突变获得耐药性,这种潜在的抗病毒耐药病毒在水体中不断积累,随后向人类传播,将会极大地妨碍疾病的治疗[43]。进入到天然水体的ATVs会对水中细菌、大型溞等生物以及人类的生命健康造成影响。同时,当自然界中的病毒长时间处于低浓度ATVs的环境时会产生抗药性,如果没有及时研发出新的ATVs可能会对水生生态系统的稳定性以及人类对于病毒的免疫能力产生影响。国内外的研究均发现生物体中产生了对ATVs的抗性,2009年墨西哥暴发的H1N1亚型猪流感病毒株对奥司他韦产生抗药性,极大程度地降低了奥司他韦的药效[2]。而在2012年中国出现的“速成鸡”事件中,由于养殖场长期给肉鸡喂食金刚烷胺和利巴韦林等ATVs,导致病毒株产生抗药性,养殖动物免疫力下降[66]。Ellis等[67]通过对伦敦东部流域研究,发现禽类中存在流感病毒。当采样点OS和OC的环境浓度达到80 μg·L−1时,环境风险升高,禽类流感病毒出现抗药性。由于每种病毒的生物学特征不同,病毒所显示出的耐药性也不同。Irwin等[68]研究丙型肝炎病毒(HCV)、流感病毒(IAV)和艾滋病毒(HIV)等RNA逆转录病毒的抗药性原理时发现,病毒抗药性在遗传、基因突变以及药理学多种因素共同作用下产生。
-
目前关于水体中ATVs的研究还比较少,对于水体中ATVs的风险评估还不够成熟。常用的风险评估方法包括风险熵值(RQ)评估法[32]。根据《人类药品环境风险评价指南》[69],以检测环境浓度(MEC)与预测无影响浓度(PNEC)的比值作为所选药物的RQ。当RQ≥1时为高风险,0.1≤RQ<1时为中风险,RQ<0.1时为低风险[70]。Ngumba等[32]采用RQ法对肯尼亚内罗毕河流域中3种ATVs齐多夫定(ZDV),拉米夫定(3TC)和奈韦拉平(NVP)进行了风险评估。研究发现除了3TC的RQ值可以忽略不计之外,其他ATVs对水体中的生物至少有一项RQ值是大于1的。藻类对于水体中的ATVs最为敏感,ZDV和NVP的最大RQ值分别可达到271.5和29.1。对于水体中的水生生物无论是藻类、鱼类还是水蚤,NVP的RQ最高值和中位值均大于1。RQ值的计算通常只考虑到水生生物摄入体内的ATVs含量,但是实际情况中仅有70%的3TC,25%的ZDV和2.7%的NVP残留在水生生物体内,其余的成分会被排泄出体外。这表明非洲的尼亚内罗毕河流域的污染风险很高,ATV对人类健康的影响可能远大于估计值,ATVs混合物在环境中通过鸡尾酒效应(cocktail effect)增加了总体风险。
-
COVID-19、禽流感、埃博拉、HIV等病毒的高频发生及广泛传播,导致人类对ATVs的消费量的急剧增加。残存的ATVs进入水环境,进而导致病毒株产生耐药性。由此产生的生态环境风险会威胁到人类的健康及生命安全,这亟需引起社会的广泛关注。由于政府缺乏系统政策防控ATVs进入水环境,ATVs持续通过废水排放进入水环境中造成污染。另外,由于ATVs水环境行为差异、受处理技术以及地理环境等因素限制了ATVs在水环境中的研究,因此新药开发与病毒突变之间的冲突不可避免。本文综述了水环境中ATVs的污染现状、环境行为、毒性效应及风险评估等方面的研究,并对现有数据进行了收集和更新,以提供不同地理区域水环境中ATVs的信息。
在收集的文献中,关于工业废水中出现ATVs的资料很少。制药行业应通过优化现有污水处理工艺,从源头上控制污染,加强WWTPs对水中ATVs的去除能力。根据收集到的水环境中ATVs研究的空间分布显示,非洲的水体和废水的研究最多,主要是针对抗逆转录病毒。这提醒人们更多的了解艾滋病感染者最多大陆的水环境现状,该地区低水平的卫生系统和饮用水处理以及低降水率更需要对水生环境和饮用水源进行全面研究。而在欧亚大陆水环境中ATVs的研究主要集中在德国、法国、中国以及日本等国家,同时美国、比利时等发达国家的数据较少。大部分研究是在流感大流行之后进行的,主要目的是评估几种常用ATVs对环境的系统性影响。
尽管关于ATVs新药的开发和使用的研究已开展了很多,针对ATVs大量使用后可能会给水环境带来的污染进行研究仍很困难,可能有以下原因:缺少COVID-19相关ATVs在水环境中迁移转化及其生物毒性风险的研究,现有的水处理技术并不能对水环境中的ATVs的去除做到完全无毒无害。同时由于天然水体中存在的ATVs的含量处于微量状态,研究人员无法精确地掌控水体中ATVs的变化情况;污水处理厂中ATVs归趋的信息尚未受到监控;水环境中ATVs对于人体健康影响的研究实验依然不够全面。
因此,为了解决目前在水环境中的ATVs的污染防控问题,本文提出以下建议:(1)深入研究我国ATVs的污染水平和分布特征,对ATVs在水环境中生态风险进行全方位的评估;(2)深入研究ATVs的降解路径,降解产物,母ATVs及其降解产物对环境的影响,阐明ATVs在环境介质中的迁移转化规律;(3)加强污水处理厂和自来水厂中对ATVs的监测,建立ATVs的水处理排放标准,做好防治结合工作;(4)开发具有针对性的、能有效去除水体中ATVs的水处理技术,例如高级氧化技术、絮凝混凝技术等,以取代低效的传统处理工艺;(5)从国家层面制定相应的政策,科学规范及引导ATVs的使用。
抗病毒药物在水环境中的污染现状及环境归趋
Pollution status and environment trend of antiviral drugs in water environment
-
摘要: 禽流感、埃博拉、HIV等病毒的传播也使得对抗病毒药物(ATVs)的消费量的增加,这些药物进入水体后将产生严峻的水环境污染和病毒耐药性问题。本文对ATVs在水环境中的污染现状、环境行为、毒性效应,以及生态风险评估研究状况进行了综述。中国、日本、德国等已针对亚洲、欧洲水环境中ATVs含量展开研究,美国等国家仅在流感大流行后评估了奥司他韦等ATVs对水环境造成的影响;在水环境中被检出频率最高的ATVs为法匹拉韦、奥司他韦、利巴韦林和奥司他韦羧酸盐;在含量上水环境中ATVs浓度多处于ng·L−1;中国珠江三角洲地区水环境中奥司他韦、利巴韦林和奥司他韦羧酸盐等常见ATVs均低于检出限;在空间分布上,非洲国家等不发达地区水环境中的ATVs含量高于发达国家,目前检出的中国水环境中ATVs含量低于非洲、欧洲、日本等地区和国家。ATVs在水环境中易发生光化学反应产生光致毒性,对水中的植物、大型溞和鱼类具有一定的毒性,对人体可造成致畸、致癌和致突变的毒性效应,引导病毒产生耐药性。对ATVs的风险评估研究表明,ATVs的生态风险较高,相关部门应重视对水环境中这类污染物的净化去除。最后,本文提出全面防控水环境中ATVs污染的建议,以期为ATVs水污染防治及水生态环境风险评价提供理论基础。Abstract: The global epidemic of new coronavirus pneumonia (COVID-19) has promoted a surge in related antiviral drugs (ATVs) use.The spread of avian influenza, Ebola virus, HIV and other viruses has also increased the consumption of ATVs, which will cause serious water pollution and virus resistance. The pollution status, environmental behaviors and toxic effects of ATVs in water environment were reviewed in detail, and the risk assessment was summarized in this paper. China, Japan and Germany have studied ATVs in water environment in Asia and Europe, while the United States only evaluated the impact of ATVs such as oseltamivir after the influenza pandemic. It has found that the most frequently detected ATVs include faraway, oseltamivir, ribavirin and oseltamivir carboxylate. The concentration of ATVs was mostly ng·L−1 in the water environment. The ATVs content in less developed regions such as African countries is higher than that in developed countries. The content of common ATVs such as oseltamivir, ribavirin and oseltamivir carboxylate in the Pearl River Delta of China were under the detection limit, and is lower than that in Africa, Europe and Japan. ATVs are prone to photochemical reactions in water environment, thus producing phototoxicity, which are toxic to plants, daphnia magna and fish in the water, causing teratogenic, carcinogenic and mutagenic toxic effects to human body, and guide the virus to develop drug resistance. The research on risk assessment of ATVs showed that ATVs have high ecological risks. Thus relevant departments should pay attention to the purification and removal of such pollutants in water environment. This paper put forward suggestions for the comprehensive prevention and control of ATVs pollution in water environment, so that could provide theoretical basis for ATVS water pollution prevention, control and water ecological environment risk assessment.
-
Key words:
- antiviral drugs /
- pollution status /
- environmental behavior /
- toxic effects /
- risk assessment
-

-
表 1 全球各地水域ATVs检测统计
Table 1. Antiviral drugs detection statistics in waters around the world
地区
AreaATVs种类
Types of antiviral drugsATVs浓度/(ng·L−1)
Concentration of antiviral drugs文献
Reference德国里德河 阿昔洛韦 1.00 [13] 德国里德河 阿巴卡韦 <LOQ(0.20) [13] 德国里德河 拉米夫定 10.00 [13] 德国里德河 奈韦拉平 1.00 [13] 德国里德河 奥司他韦 0.20 [13] 德国里德河 奥司他韦羧酸盐 0.20 [13] 德国里德河 喷昔洛韦 1.00 [13] 德国里德河 利巴韦林 4.00 [13] 德国里德河 司他夫定 1.00 [13] 德国里德河 齐多夫定 1.00 [13] 德国内卡 阿巴卡韦 <LOQ(5.00) [19] 德国韦施尼茨 阿巴卡韦 <LOQ(5.00) [19] 德国莫道 阿巴卡韦 <LOQ(5.00) [19] 德国施瓦茨巴赫 阿巴卡韦 <LOQ(5.00) [19] 德国罗道 阿巴卡韦 <LOQ(5.00) [19] 德国美因河 阿巴卡韦 <LOQ(5.00) [19] 德国拉赫 阿巴卡韦 <LOQ(5.00) [19] 德国拉恩 阿巴卡韦 <LOQ(5.00) [19] 德国莱茵河 阿巴卡韦 <LOQ(5.00) [19] 南非 扎西他滨 36.00 [22] 南非 替诺福韦 192.0 [22] 南非 拉米夫定 160.00 [22] 南非 地高辛 54.10 [22] 南非 司他夫定 431.00 [22] 南非 阿巴卡韦 n.q [22] 南非 齐多夫定 319.00 [22] 南非 奈韦拉平 360.00 [22] 南非 茚地那韦 n.q [22] 南非 利托那韦 n.q [22] 南非 洛匹那韦 239.00 [22] 南非 依法韦伦 n.q [22] 肯尼亚WWTPs1 拉米夫定 76000 [23] 肯尼亚WWTPs2 奈韦拉平 53700 [23] 肯尼亚WWTPs3 齐多夫定 847100 [23] 肯尼亚WWTPs1 拉米夫定 1300 [23] 肯尼亚WWTPs2 奈韦拉平 700 [23] 肯尼亚WWTPs3 齐多夫定 47300 [23] 肯尼亚WWTPs1 拉米夫定 322000 [23] 肯尼亚WWTPs2 奈韦拉平 481000 [23] 肯尼亚WWTPs3 齐多夫定 301000 [23] 日本淀川河 奥司他韦 20.00 [15] 日本淀川河 培拉米韦 10.00 [15] 日本淀川河 扎那米韦 89.00 [15] 日本淀川河 奥司他韦羧酸盐 70.00 [15] 波兰 达芦那韦 169.00(Max) [27] 美国 拉米夫定 4.00(Min) [30] 美国 阿巴卡韦 n.q [30] 美国 阿昔洛韦 12.00 [30] 美国 奥塞米韦 n.q [30] 美国 奈韦拉平 n.q [30] 芬兰派廷奈河 奈韦拉平 n.q [32] 肯尼亚内罗毕河 奈韦拉平 4859.00(Max) [32] 肯尼亚马萨瑞河 奈韦拉平 300.00(Max) [24] 法国 阿巴卡韦 2.60±1.70(Max) [25] 法国 拉米夫定 4.10±2.50(Max) [25] 法国 拉米夫定 0.80—2.60 [25] 法国 奈韦拉平 n.q [25] 法国 奈韦拉平 0.20—0.50 [25] 法国 利托那韦 12.00±5.00 [25] 法国 利托那韦 <LOQ(0.20) [25] 法国 齐多夫定 33.00±27.00 [25] 悉尼水域 奥司他韦 1.29 [28] 西班牙埃布罗河 奥司他韦 50.00 [31] 西班牙埃布罗河 奥司他韦 100.00 [31] 中国珠江三角洲 阿昔洛韦 <LOQ(6.00) [33] 中国珠江三角洲 更昔洛韦 <LOQ(9.00) [33] 中国珠江三角洲 奥司他韦 <LOQ(3.00) [33] 中国珠江三角洲 奥司他韦羧酸盐 <LOQ(5.00) [33] 中国珠江三角洲 利巴韦林 <LOQ(74.00) [33] 中国珠江三角洲 司他夫定 <LOQ(7.00) [33] 中国珠江三角洲 齐多夫定 <LOQ(7.00) [33] 中国长江三角洲 金刚烷胺 351.00(Max) [33] 注:n.q-Not quantified;Max-Maximum detection volume;Min-Minimum detection volume;LOQ - Minimum quantitation limit;WWTPs - Waste Water Treatment Plants. 表 2 法匹拉韦、奥司他韦、利巴韦林和奥司他韦羧酸盐的理化信息
Table 2. Physical and chemical information of chloroquine phosphate,ribavirin,remdesivir and fapilavir
化合物
Compound分子式
Molecular formulaCAS No. 分子结构
Molecular
Structure分子量
Molecular weight溶解度
Solubility正辛醇/水分配系数
lgKow酸度系数
pKa法匹拉韦
FavipiravirC5H4FN3O2 259793-96-9 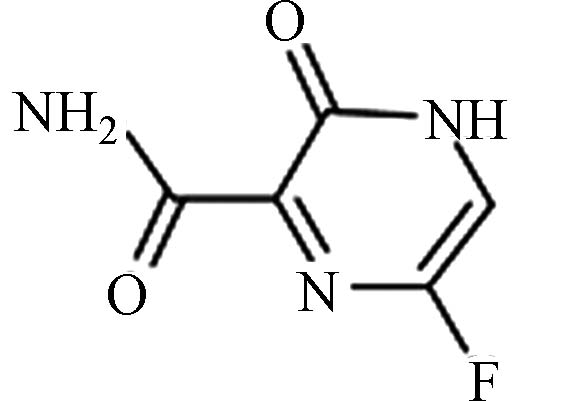
157.1 22.85 −0.96 8.77±0.60 奥司他韦
OseltamivirC16H28N2O4 196618−13-0 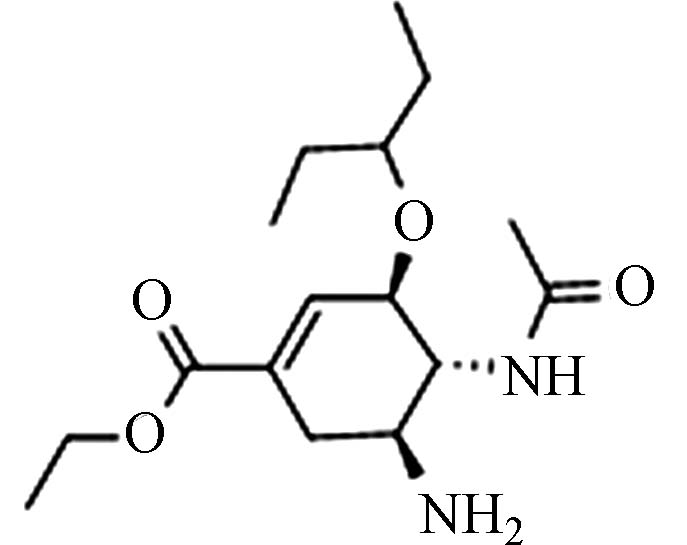
312.40 159.2 0.95 7.7±1.1 利巴韦林
RibavirinC8H12N4O5 36791-04-5 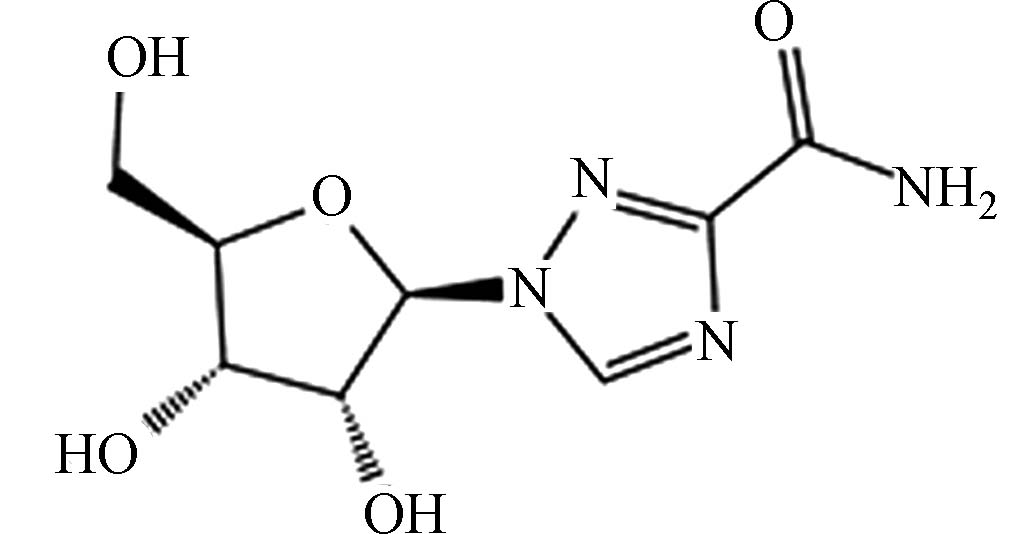
244.20 ≥100 −2.03 12.95±0.70 奥司他韦羧酸盐
Oseltamivir carboxylate
hydrochlorideC14H25ClN2O4 1415963-60-8 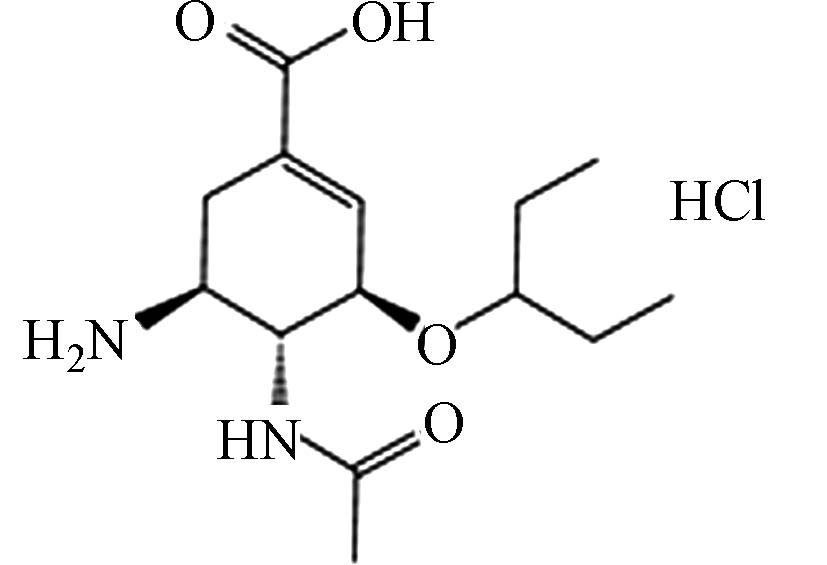
320.81 52.38 0.18 — -
[1] TANG X L, WU C C, LI X, et al. On the origin and continuing evolution of SARS-CoV-2 [J]. National Science Review, 2020, 7(6): 1012-1023. doi: 10.1093/nsr/nwaa036 [2] 穆朋倩. 禽产品中抗病毒药物的多残留检测方法研究[D]. 北京: 中国农业科学院, 2016. MU P Q. Study on multi-residue detection of antiviral drugs in poultry products[D]. Beijing: Chinese Academy of Agricultural Sciences, 2016(in Chinese).
[3] BAGGA S, BOUCHARD M J. Cell cycle regulation during viral infection[M]//Methods in Molecular Biology. New York: Springer New York, 2014: 165-227. [4] 许寅, 孟现民, 张永信, 等. 不同作用机制抗流感病毒药物的临床研究进展 [J]. 上海医药, 2014, 35(21): 58-60,70. XU Y, MENG X M, ZHANG Y X, et al. Research progress in anti-influenza virus drugs with different mechanisms of action [J]. Shanghai Medical & Pharmaceutical Journal, 2014, 35(21): 58-60,70(in Chinese).
[5] 刘春宇. 抗流行性感冒病毒药物研究综述 [J]. 中国医药指南, 2009, 7(11): 205-206. doi: 10.3969/j.issn.1671-8194.2009.11.156 LIU C Y. Review of research on anti-influenza virus drugs [J]. Guide of China Medicine, 2009, 7(11): 205-206(in Chinese). doi: 10.3969/j.issn.1671-8194.2009.11.156
[6] 白云, 牟永新. 我国抗病毒药物市场分析 [J]. 中国新药杂志, 2001, 10(8): 629-631. doi: 10.3321/j.issn:1003-3734.2001.08.028 BAI Y, (MOU| MU) Y X. Analysis of antiviral drug market in my country [J]. Chinese New Drugs Journal, 2001, 10(8): 629-631(in Chinese). doi: 10.3321/j.issn:1003-3734.2001.08.028
[7] 方峰. 抗巨细胞病毒药物的研究进展和临床应用 [J]. 临床儿科杂志, 2007, 25(7): 528-531. doi: 10.3969/j.issn.1000-3606.2007.07.003 FANG F. Progresses in the development of antiviral drugs for Cytomegalovirus diseases and their clinical applica-tions [J]. Journal of Clinical Pediatrics, 2007, 25(7): 528-531(in Chinese). doi: 10.3969/j.issn.1000-3606.2007.07.003
[8] 蔡丽娜, 张明江. 恩曲他滨分散片的制备与溶出度检查方法验证 [J]. 贵州医药, 2009, 33(3): 261-262. doi: 10.3969/j.issn.1000-744X.2009.03.031 CAI L N, ZHANG M J. Preparation of emtricitabine dispersible tablets and verification of dissolution test method [J]. Guizhou Medical Journal, 2009, 33(3): 261-262(in Chinese). doi: 10.3969/j.issn.1000-744X.2009.03.031
[9] LOCAMINI S, QI X, ARTERBUM S, et al. Incidence and predictors of emergence of adefovir resistant HBV during four years of adefovir dipivoxil (ADV) therapy for patients with chronic hepatitis B (CHB) [J]. Journal of Hepatology, 2005, 42: 17. [10] TENNEY D J, ROSE R E, BALDICK C J, et al. Two-year assessment of entecavir resistance in lamivudine-refractory hepatitis B virus patients reveals different clinical outcomes depending on the resistance substitutions present [J]. Antimicrobial Agents and Chemotherapy, 2007, 51(3): 902-911. doi: 10.1128/AAC.00833-06 [11] MONINI P, SGADARI C, BARILLARI G, et al. HIV protease inhibitors: Antiretroviral agents with anti-inflammatory, anti-angiogenic and anti-tumour activity [J]. Journal of Antimicrobial Chemotherapy, 2003, 51(2): 207-211. doi: 10.1093/jac/dkg086 [12] 史卫国, 郄建坤, 刘克良. HIV融合抑制剂的研究进展[J]. 中国新药杂志, 2006, 15(17): 1429-1435. SHI W G, QIE J K, LIU K L. Current status and trends of HIV fusion inhibitors[J]. Chinese Journal of New Drugs, 2006, 15(17): 1429-1435(in Chinese).
[13] PRASSE C, SCHLVSENER M P, SCHULZ R. Antiviral drug in wastewater and surface waters: A new pharmaceutical class of environmental relevance [J] Environmental Science & Technology, 2010, 44 (5): 1728-1735. [14] DUFFY S, SHACKELTON L A, HOLMES E C. Rates of evolutionary change in viruses: Patterns and determinants [J]. Nature Reviews. Genetics, 2008, 9(4): 267-276. doi: 10.1038/nrg2323 [15] AZUMA T, ISHIDA M, HISAMATSU K, et al. Fate of new three anti-influenza drugs and one prodrug in the water environment [J]. Chemosphere, 2017, 169: 550-557. doi: 10.1016/j.chemosphere.2016.11.102 [16] NANNOU C, OFRYDOPOULOU A, EVGENIDOU E, et al. Antiviral drugs in aquatic environment and wastewater treatment plants: A review on occurrence, fate, removal and ecotoxicity [J]. Science of the Total Environment, 2020, 699: 134322. doi: 10.1016/j.scitotenv.2019.134322 [17] 王珍. 阿昔洛韦在水环境中的光降解行为及机理的研究[D]. 广州: 广东工业大学, 2017. WANG Z. Study on photolytic degradation and mechanisms of acyclovir in aqueous environment[D]. Guangzhou: Guangdong University of Technology, 2017(in Chinese).
[18] NCUBE S, MADIKIZELA L M, CHIMUKA L, et al. Environmental fate and ecotoxicological effects of antiretrovirals: A current global status and future perspectives [J]. Water Research, 2018, 145: 231-247. doi: 10.1016/j.watres.2018.08.017 [19] FUNKE J, PRASSE C, TERNES T A. Identification of transformation products of antiviral drugs formed during biological wastewater treatment and their occurrence in the urban water cycle [J]. Water Research, 2016, 98: 75-83. doi: 10.1016/j.watres.2016.03.045 [20] JIA T C, GUO J T, WANG Z, et al. Photodegradation mechanisms of acyclovir in water and the toxicity of photoproducts [J]. Journal of Radioanalytical and Nuclear Chemistry, 2019, 320(3): 823-830. doi: 10.1007/s10967-019-06543-4 [21] 吴慧珍. 畜禽排泄物及其衍生物中环境风险物质的分析检测与安全评价[D]. 杭州: 浙江工业大学, 2017. WU H Z. Analysis and environmental risk assessment for the harmful substances in the livestock excreta and organic fertilizer[D]. Hangzhou: Zhejiang University of Technology, 2017(in Chinese).
[22] WOOD T P, DUVENAGE C S J, ROHWER E. The occurrence of anti-retroviral compounds used for HIV treatment in South African surface water [J]. Environmental Pollution, 2015, 199: 235-243. doi: 10.1016/j.envpol.2015.01.030 [23] MURIUKI C, KAIRIGO P, HOME P, et al. Mass loading, distribution, and removal of antibiotics and antiretroviral drugs in selected wastewater treatment plants in Kenya [J]. Science of the Total Environment, 2020, 743: 140655. doi: 10.1016/j.scitotenv.2020.140655 [24] K'OREJE K O, VERGEYNST L, OMBAKA D, et al. Occurrence patterns of pharmaceutical residues in wastewater, surface water and groundwater of Nairobi and Kisumu city, Kenya [J]. Chemosphere, 2016, 149: 238-244. doi: 10.1016/j.chemosphere.2016.01.095 [25] AMINOT Y, LITRICO X, CHAMBOLLE M, et al. Development and application of a multi-residue method for the determination of 53 pharmaceuticals in water, sediment, and suspended solids using liquid chromatography-tandem mass spectrometry [J]. Analytical and Bioanalytical Chemistry, 2015, 407(28): 8585-8604. doi: 10.1007/s00216-015-9017-3 [26] PENG Y, FANG W D, KRAUSS M, et al. Screening hundreds of emerging organic pollutants (EOPs) in surface water from the Yangtze River Delta (YRD): Occurrence, distribution, ecological risk [J]. Environmental Pollution, 2018, 241: 484-493. doi: 10.1016/j.envpol.2018.05.061 [27] GIEBUŁTOWICZ J, TYSKI S, WOLINOWSKA R, et al. Occurrence of antimicrobial agents, drug-resistant bacteria, and genes in the sewage-impacted Vistula River (Poland) [J]. Environmental Science and Pollution Research, 2018, 25(6): 5788-5807. doi: 10.1007/s11356-017-0861-x [28] KHAN G A, LINDBERG R, GRABIC R, et al. The development and application of a system for simultaneously determining anti-infectives and nasal decongestants using on-line solid-phase extraction and liquid chromatography-tandem mass spectrometry [J]. Journal of Pharmaceutical and Biomedical Analysis, 2012, 66: 24-32. doi: 10.1016/j.jpba.2012.02.011 [29] de NAKADA N, SHINOHARA H, MURATA A, et al. Removal of selected pharmaceuticals and personal care products (PPCPs) and endocrine-disrupting chemicals (EDCs) during sand filtration and ozonation at a municipal sewage treatment plant [J]. Water Research, 2007, 41(19): 4373-4382. doi: 10.1016/j.watres.2007.06.038 [30] GLASSMEYER S T, FURLONG E T, KOLPIN D W, et al. Nationwide reconnaissance of contaminants of emerging concern in source and treated drinking waters of the United States [J]. The Science of the Total Environment, 2017, 581/582: 909-922. doi: 10.1016/j.scitotenv.2016.12.004 [31] GONÇALVES C, PÉREZ S, OSORIO V, et al. Photofate of oseltamivir (tamiflu) and oseltamivir carboxylate under natural and simulated solar irradiation: Kinetics, identification of the transformation products, and environmental occurrence [J]. Environmental Science & Technology, 2011, 45(10): 4307-4314. [32] NGUMBA E, GACHANJA A, TUHKANEN T. Occurrence of selected antibiotics and antiretroviral drugs in Nairobi River Basin, Kenya [J]. Science of the Total Environment, 2016, 539: 206-213. doi: 10.1016/j.scitotenv.2015.08.139 [33] XU W H, ZHANG G, ZOU S C, et al. Determination of selected antibiotics in the Victoria Harbour and the Pearl River, South China using high-performance liquid chromatography-electrospray ionization tandem mass spectrometry [J]. Environmental Pollution, 2007, 145(3): 672-679. doi: 10.1016/j.envpol.2006.05.038 [34] PENG X Z, WANG C W, ZHANG K, et al. Profile and behavior of antiviral drugs in aquatic environments of the Pearl River Delta, China [J]. Science of the Total Environment, 2014, 466/467: 755-761. doi: 10.1016/j.scitotenv.2013.07.062 [35] YAO X T, YE F, ZHANG M, et al. In vitro antiviral activity and projection of optimized dosing design of hydroxychloroquine for the treatment of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) [J]. Clinical Infectious Diseases, 2020, 71(15): 732-739. doi: 10.1093/cid/ciaa237 [36] MARTINEZ M A. Compounds with therapeutic potential against novel respiratory 2019 coronavirus [J]. Antimicrobial Agents and Chemotherapy, 2020, 64(5): e00399. [37] EVGENIDOU E N, KONSTANTINOU I K, LAMBROPOULOU D A. Occurrence and removal of transformation products of PPCPs and illicit drugs in wastewaters: A review [J]. Science of the Total Environment, 2015, 505: 905-926. doi: 10.1016/j.scitotenv.2014.10.021 [38] KUMAR M, MAZUMDER P, MOHAPATRA S, et al. A chronicle of SARS-CoV-2: Seasonality, environmental fate, transport, inactivation, and antiviral drug resistance [J]. Journal of Hazardous Materials, 2021, 405: 124043. doi: 10.1016/j.jhazmat.2020.124043 [39] BARTELS P, von TÜMPLING W Jr. The environmental fate of the antiviral drug oseltamivir carboxylate in different waters [J]. Science of the Total Environment, 2008, 405(1/2/3): 215-225. [40] 杨术鹏. 镰刀菌毒素及其隐蔽型形式的代谢研究[D]. 北京: 中国农业大学, 2016. YANG (S /Z)P. Metabolism of fusarial toxins and their masked forms[D]. Beijing: China Agricultural University, 2016(in Chinese).
[41] 张小庆. 抗病毒药物利巴韦林在蛋鸡体内代谢产物探究[D]. 北京: 中国农业科学院, 2017. ZHANG X Q. Metabolic study of antiviral drug ribavirin in laying hens[D]. Beijing: Chinese Academy of Agricultural Sciences, 2017(in Chinese).
[42] 阳海, 安太成, 李桂英, 等. 光催化技术降解水中环境药物的研究进展 [J]. 生态环境学报, 2010, 19(4): 991-999. doi: 10.3969/j.issn.1674-5906.2010.04.044 YANG H, AN T C, LI G Y, et al. Recent advances in photocatalytic degradation of aquatic environmental pharmaceuticals [J]. Ecology and Environmental Sciences, 2010, 19(4): 991-999(in Chinese). doi: 10.3969/j.issn.1674-5906.2010.04.044
[43] KARIM E I A, IBRAHIM K E E, ABDELRAHMAN A N, et al. Photodegradation studies on chloroquine phosphate by high-performance liquid chromatography [J]. Journal of Pharmaceutical and Biomedical Analysis, 1994, 12(5): 667-674. doi: 10.1016/0731-7085(93)E0026-J [44] 马杜娟. 水环境中萘普生光化学降解行为研究[D]. 广州: 广东工业大学, 2013. MA D J. The study of photolytic behavior of naproxen in aqueous environment[D]. Guangzhou: Guangdong University of Technology, 2013(in Chinese).
[45] 安继斌. 水体中典型有机污染物的光催化降解动力学及降解机理研究[D]. 兰州: 兰州理工大学, 2011. AN J B. Photocatalytic degradation kinetics and mechanism of model organic pollutants in water environment[D]. Lanzhou: Lanzhou University of Technology, 2011(in Chinese).
[46] ZHOU C Z, XIE Q, WANG J Q, et al. Effects of dissolved organic matter derived from freshwater and seawater on photodegradation of three antiviral drugs [J]. Environmental Pollution, 2020, 258: 113700. doi: 10.1016/j.envpol.2019.113700 [47] DAOUK S, CHÈVRE N, VERNAZ N, et al. Prioritization methodology for the monitoring of active pharmaceutical ingredients in hospital effluents [J]. Journal of Environmental Management, 2015, 160: 324-332. doi: 10.1016/j.jenvman.2015.06.037 [48] HAŁADYJ E, SIKORA M, FELIS-GIEMZA A, et al. Antimalarials - are they effective and safe in rheumatic diseases? [J]. Reumatologia, 2018, 56(3): 164-173. doi: 10.5114/reum.2018.76904 [49] 王璐. 抗逆转录病毒药物临床药动学及药效学研究[D]. 北京: 中国协和医科大学, 2008. WANG L. Studies on the pharmacokinetics and pharmacodynamics of drugs used for HAART in Chinese patients[D]. Beijing: Peking Union Medical College, 2008(in Chinese).
[50] 寇惠娟. 三种抗病毒药物在中国艾滋病患者的临床药效学和药动学研究[D]. 北京: 北京协和医学院, 2012. KOU H J. Study on pharmacodynamics and pharmacokinetics of three antiretroviral drugs in Chinese patients with HIV infection[D]. Beijing: Peking Union Medical College, 2012(in Chinese).
[51] AN J B, LI G Y, AN T C, et al. Photocatalytic degradation of three amantadine antiviral drugs as well as their eco-toxicity evolution [J]. Catalysis Today, 2015, 258: 602-609. doi: 10.1016/j.cattod.2015.01.004 [52] POMATI F, KELLMANN R, CAVALIERI R, et al. Comparative gene expression of PSP-toxin producing and non-toxic Anabaena circinalis strains [J]. Environment International, 2006, 32(6): 743-748. doi: 10.1016/j.envint.2006.03.010 [53] ESCHER B I, BRAMAZ N, LIENERT J, et al. Mixture toxicity of the antiviral drug Tamiflu® (oseltamivir ethylester) and its active metabolite oseltamivir acid [J]. Aquatic Toxicology, 2010, 96(3): 194-202. doi: 10.1016/j.aquatox.2009.10.020 [54] SANDERSON H, JOHNSON D J, REITSMA T, et al. Ranking and prioritization of environmental risks of pharmaceuticals in surface waters [J]. Regulatory Toxicology and Pharmacology, 2004, 39(2): 158-183. doi: 10.1016/j.yrtph.2003.12.006 [55] ZURITA J L, JOS A, del PESO A, et al. Ecotoxicological evaluation of the antimalarial drug chloroquine [J]. Aquatic Toxicology (Amsterdam, Netherlands), 2005, 75(2): 97-107. doi: 10.1016/j.aquatox.2005.07.009 [56] BARRA CARACCIOLO A, GRENNI P, SACCÀ M L. Effect of the antiviral drug oseltamivir (tamiflu) on the bacterial community structure of a surface water ecosystem analyzed using fluorescence in situ hybridization [J]. Bulletin of Environmental Contamination and Toxicology, 2010, 85(5): 443-446. doi: 10.1007/s00128-010-0114-x [57] U. S. EPA. Guidelines for Human Exposure Assessment. [DB/OL]. Risk Assessment Guidance, 2019-10, 19(1): 443-446. www. epa. gov/risk. [58] ROBSON L, BARNHOORN I E J, WAGENAAR G M. The potential effects of efavirenz on Oreochromis mossambicus after acute exposure [J]. Environmental Toxicology and Pharmacology, 2017, 56: 225-232. doi: 10.1016/j.etap.2017.09.017 [59] 张国栋, 董文平, 刘晓晖, 等. 我国水环境中抗生素赋存、归趋及风险评估研究进展 [J]. 环境化学, 2018, 37(7): 1491-1500. doi: 10.7524/j.issn.0254-6108.2017112003 ZHANG G D, DONG W P, LIU X H, et al. Occurrence, fate and risk assessment of antibiotics in water environment of China [J]. Environmental Chemistry, 2018, 37(7): 1491-1500(in Chinese). doi: 10.7524/j.issn.0254-6108.2017112003
[60] COLACINO J M, MALCOLM S K, JASKUNAS S R. Effect of fialuridine on replication of mitochondrial DNA in CEM cells and in human hepatoblastoma cells in culture [J]. Antimicrobial Agents and Chemotherapy, 1994, 38(9): 1997-2002. doi: 10.1128/AAC.38.9.1997 [61] ZENG W, CHENG A C, CHEN Z L, et al. In vivo assessment of mitochondrial toxicity of metacavir in Rhesus monkeys after three months of intravenous administration [J]. Acta Pharmacologica Sinica, 2009, 30(12): 1666-1673. doi: 10.1038/aps.2009.163 [62] RICHARDSON F C, TENNANT B C, MEYER D J, et al. An evaluation of the toxicities of 2' -fluorouridine and 2'-fluorocytidine-HCI in F344 rats and woodchucks (Marmota monax) [J]. Toxicologic Pathology, 1999, 27(6): 607-617. doi: 10.1177/019262339902700601 [63] STRAUB J O. Combined environmental risk assessment for the antiviral pharmaceuticals ganciclovir and valganciclovir in Europe [J]. Environmental Toxicology and Chemistry, 2017, 36(8): 2205-2216. doi: 10.1002/etc.3758 [64] AHMED W, ANGEL N, EDSON J, et al. First confirmed detection of SARS-CoV-2 in untreated wastewater in Australia: A proof of concept for the wastewater surveillance of COVID-19 in the community [J]. Science of the Total Environment, 2020, 728: 138764. doi: 10.1016/j.scitotenv.2020.138764 [65] BRADFORD B. Bronx Zoo tiger tests positive for coronavirus, officials say[N/OL]. Fox News. 2020-04-05. https://www.foxnews.com/science/tiger-bronx-zoo-coronavirus. [66] 程忠刚, 傅伟龙, 刘树中. 动物抗病毒药物的应用研究进展 [J]. 兽医导刊, 2010(8): 42-45. doi: 10.3969/j.issn.1673-8586.2010.08.020 CHENG Z G, FU W L, LIU S Z. Application research progress of animal antiviral drugs [J]. Veterinary Orientation, 2010(8): 42-45(in Chinese). doi: 10.3969/j.issn.1673-8586.2010.08.020
[67] ELLIS J B. Antiviral pandemic risk assessment for urban receiving waters [J]. Water Science and Technology, 2010, 61(4): 879-884. doi: 10.2166/wst.2010.002 [68] IRWIN K K, RENZETTE N, KOWALIK T F, et al. Antiviral drug resistance as an adaptive process [J]. Virus Evolution, 2016, 2(1): vew014. doi: 10.1093/ve/vew014 [69] WHOMSLEY R, GRIFFIN E, Jensen J, et al. Commentary on the draft revised guideline on the environmental risk assessment of medicinal products for human use [J]. Environmental Sciences Europe, 2019, 31(1): 1-4. doi: 10.1186/s12302-018-0176-7 [70] PEREIRA A M P T, SILVA L J G, MEISEL L M, et al. Environmental impact of pharmaceuticals from Portuguese wastewaters: Geographical and seasonal occurrence, removal and risk assessment [J]. Environmental Research, 2015, 136: 108-119. doi: 10.1016/j.envres.2014.09.041 -



 下载:
下载:





