-
砷(As)是一种广泛分布在自然环境中的有毒类金属元素,在美国有毒物质和疾病登记署列出的物质优先名录(ATSDR’s substance priority list)(2019年)中居于首位[1]。水体中的砷主要以砷酸盐(As(Ⅴ))形式存在,其次是亚砷酸盐(As(Ⅲ))和多种有机砷(如一甲基化砷(MMA)、二甲基化砷(DMA))[2-4]。微藻在水环境中广泛存在,可以通过不同的途径来降低砷的毒性,包括细胞表面结合、砷酸盐还原、亚砷酸盐氧化、甲基化、As(Ⅲ)与谷胱甘肽和植物螯合素的螯合以及砷的外排[5]。
微藻在生长过程中释放到细胞外的大分子物质形成胞外聚合物(EPS),可为自身提供碳源和能量,在藻际环境中发挥重要的生态学功能[6],如改变细胞的电荷、亲疏水及絮凝特性。在重金属胁迫下(如Cd2+、Pb2+等),微藻多糖合成基因(如capD、csaB、tagH和epsL)会大量表达,促使EPS分泌量增加[7-8]。自上世纪90年代以来,有关EPS去除重金属的研究不断增加[9-15]。EPS中含有多种官能团,通过表面吸附减少微藻细胞对砷的吸收[16-17];同时EPS的结合位点也有助于砷的形态变化,从而降低砷对藻细胞的胁迫[13]。
硅藻是海洋中的初级生产者,生物多样性丰富,生物量巨大,约占海洋初级产量的50% 和全球初级产量的25%,对水生环境具有重要的生态学意义[10]。大部分硅藻可以通过硅质壳的裂缝(壳缝)或顶端开孔处分泌多聚物[18]。三角褐指藻是模式硅藻,生长速度快,易于培养,是一种常用的实验材料。丁腾达等[19]研究发现三角褐指藻(Phaeodactylum sp.)在20 mg·L−1 As(Ⅲ)下正常生长,对砷有较高的耐性。近年来,有关砷和硅藻的研究关注了砷对硅藻的生长抑制、氧化损伤等方面,而对砷在硅藻细胞内外的分配及赋存形态的变化规律研究较少,需要进一步探讨EPS对硅藻砷的毒性、富集和转化的影响。
因此本研究以三角褐指藻为材料,探讨在不同砷酸盐处理下,硅藻生长和EPS分泌情况及特性,以及在去除和未去除EPS的条件下,三角褐指藻对As(Ⅴ)的富集和转化的规律,从而明确三角褐指藻EPS与砷毒性、富集和形态转化之间的关系,为利用硅藻胞外大分子有机物进行水体砷污染的控制和修复提供依据。
-
三角褐指藻(Phaeodactylum tricornutum)购自于中国科学院遗传生物资源库-海藻种质库。采用添加Si元素的f/2培养基,加入10 mmol·L−1的HEPES缓冲液,调节pH值为8.00±0.02,121 ℃高压灭菌。藻种培养温度为(23±2) ℃,光照周期为12 h,光照强度为2000 lux。藻种传代培养过程中均保证无菌操作。
-
将处于生长指数期的P. tricornutum接种至新鲜的f/2培养基中,设置初始细胞数约为1×106 cells·mL−1,As(Ⅴ)处理浓度为0、10、100、500、1000、2000 μg·L−1,每个浓度处理设置3个平行。培养7 d后,酶标仪测定其吸光度OD450 nm后取500 mL藻液离心收集藻细胞,用35‰的NaCl溶液洗脱细胞表面的培养液,加入20 mmol·L−1的EDTA提取液(20 mmol·L−1的EDTA提取液提取EPS后P. tricornutum仍正常生长),180 r·min−1振荡3 h。然后于8418 r·min−1下离心10 min,收集上清液,用0.45 μm滤膜过滤,得到结合态EPS溶液。利用紫外-可见分光光度计进行EPS主要成分(多糖、蛋白、DNA)测定。三者含量的测定分别采用苯酚-硫酸法、Bradford比色法和二苯胺法[20],分别以葡萄糖、牛血清蛋白和小牛胸腺DNA为标准物质。
-
将培养至生长指数期的P. tricornutum细胞通过EDTA法去除细胞表面EPS,设置去除和未去除EPS的藻细胞对照试验,分别加入0、2000 μg·L−1 As(Ⅴ)处理,培养7 d后收集藻细胞。获得去除和未去除EPS的藻细胞以及加入As(Ⅴ)处理的去除和未去除EPS的4种藻细胞样品。将藻细胞样品在2.5%的戊二醛中预混合8 h,用磷酸盐缓冲液洗涤3次后,样品经梯度酒精脱水、干燥、喷金镀膜,利用SEM(Carl Zeiss Supra 55)观察藻细胞的形态。
-
ATR-IR(Thermo Fisher Scientific Inc.)可以区分藻细胞表面的官能团和结构。将培养至生长指数期的P. tricornutum细胞接种至新鲜的f/2培养基中,分别加入0、2000 μg·L−1 As(Ⅴ) 培养7 d后,使用EDTA法提取结合态EPS,经0.45 μm滤膜过滤后,放入透析袋中处理72 h,冷冻干燥。取适量干燥后经研磨均匀的固体样品粉末均匀的铺展在ATR窗口的上表面,压紧使紧密接触,采集全反射光谱。波数范围为500—4000 cm−1,结果用OMNIC32软件处理。
-
设置去除和未去除EPS的对照试验。将去除和未去除EPS的P. tricornutum分别接种至新鲜的f/2培养基中,设置初始细胞数约为1×106 cells·mL−1,As(Ⅴ)处理浓度为0、10、100、500、1000、2000 μg·L−1,每个浓度处理设置3个平行。同时设置不加藻只加砷的空白对照。
每天固定时间用酶标仪(PE EnSight)测定吸光度OD450 nm表征P. tricornutum的生长。培养7 d后收集藻液并分为3份。取一份藻液在8500 r·min−1下离心分离上清液和藻细胞,上清液经0.45 μm滤膜过滤后用于培养液中砷形态和砷总量的测定,藻细胞用35‰ NaCl溶液洗涤、冷冻干燥、电热消解提取后,用于砷富集量的测定。第二份藻液离心收集藻细胞,加入10 mL预冷的0.1 mol·L−1磷酸盐缓冲液(PBS),浸泡10 min后,离心收集藻细胞,重复两遍(去除吸附在细胞表面的砷),用电热消解法提取用于胞内砷吸收量的测定。第三份藻液先使用PBS缓冲液洗涤后收集藻细胞,再用稀硝酸提取,用于胞内砷形态的测定。藻细胞砷吸附量用差减法获得,即细胞砷富集总量减去胞内砷吸收量。
砷富集量和吸收量的提取使用电热消解法[21]:准确称取待测藻样,加入3 mL的HNO3溶液,振荡摇匀后封口膜密封,静置过夜。使用石墨消解仪电热消解((118±2) ℃)至样品呈无色透明状,然后开盖赶酸剩约0.5 mL液体取出,静置冷却至室温,用去离子水转移并定容至容量瓶,使用0.45 μm的水系滤器过滤。用高效液相色谱-电感耦合等离子体质谱联用(HPLC-ICP-MS,PerkinElmer NexION 2000)测定砷含量。
胞内砷形态提取使用稀硝酸提取法[22]:准确称取待测藻样,加入2 mL 1.75% HNO3,用超声波清洗机超声10 min(90 ℃),8500 r·min−1下离心10 min,收集上清液(重复3次),用1.75% 稀HNO3定容。在测定前,将藻样提取液和培养液样品过0.45 μm的水系滤器,同时配制含有As(Ⅴ)、As(Ⅲ)、DMA和MMA的混合标准溶液,采用17.5 mmol·L−1的(NH4)2HPO4(pH 5.8)为流动相,然后用HPLC-ICP-MS测定培养液和胞内各形态砷含量。
-
将上面试验测得的生长数据用Naveed等[23]的方法换算成EC10值(导致细胞生长速率降低10%的As(Ⅴ)浓度),以此表征As(Ⅴ)对三角褐指藻的毒性。结果用SigmaPlot 12.5拟合成S型剂量反应曲线方程来推算。
式中,BR代表生物效应,BRmin和BRmax分别对应最小和最大的生物效应,EC50是导致细胞生长速率降低50%的砷浓度(mg·L−1),Hillslope值来反应曲线斜率因子。
-
用羊栖菜(ONMIJ CRM 7405-a)和鱼肝油(DOLT-5)两种标准物质来对试验结果的可靠性进行评估,与样品的消解同时进行,并设3个平行。本次试验测得羊栖菜和鱼肝油中的总As的回收率均在80%—90%之间,表明数据精密度较好,实验数据可靠。
-
试验所有数据均以平均值±标准差(n=3)来表示。数据处理采用Microsoft Excel 2019,作图采用Sigma Plot 12.5,处理之间的差异显著性(P<0.05)采用SPSS 20.0软件中的单因素方差分析(Duncan)确定。
-
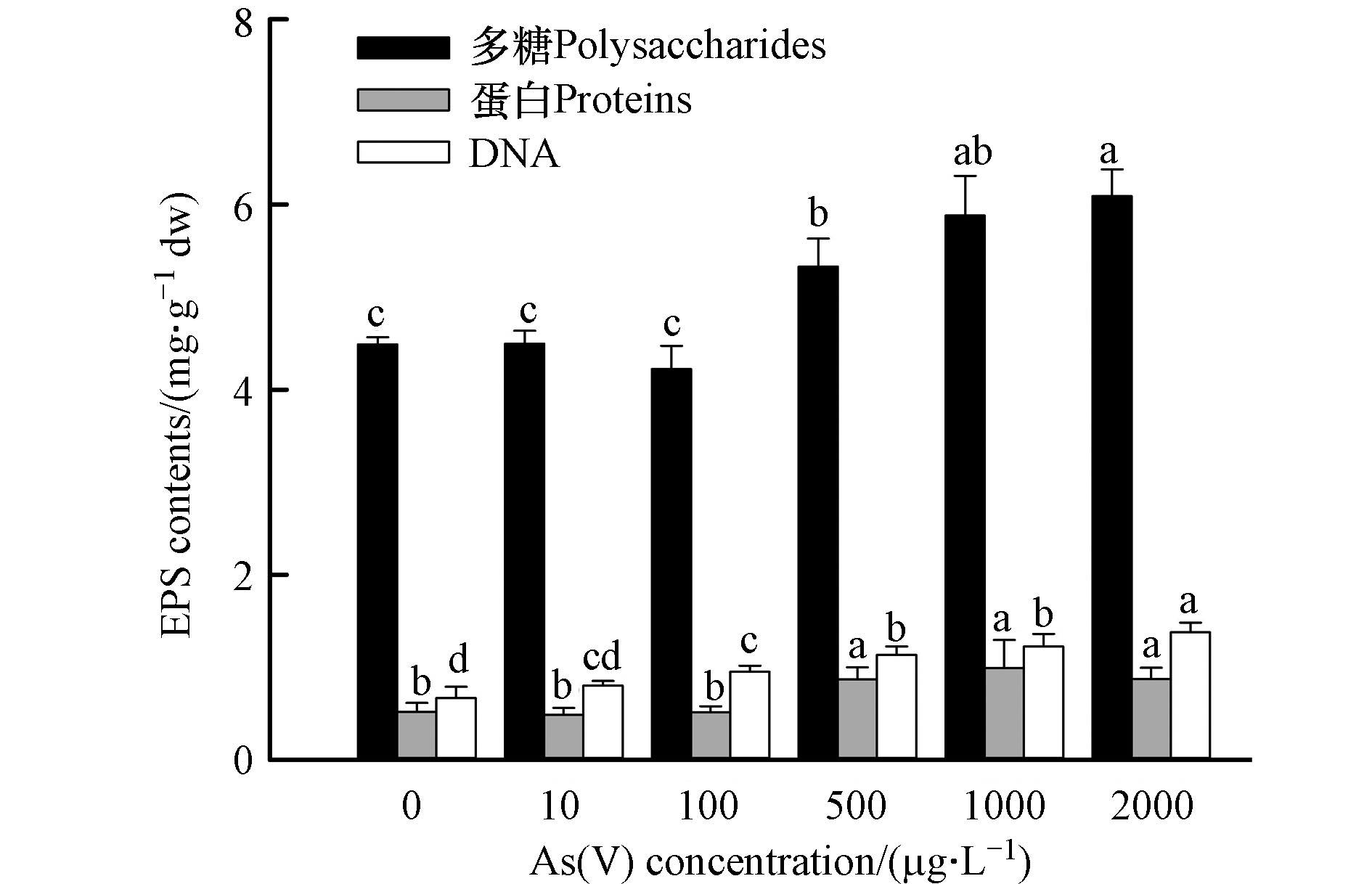
不同As(Ⅴ)浓度(0、10、100、500、1000、2000 μg·L−1)处理7 d后,对照组的P. tricornutum EPS分泌量达5.68 mg·g−1 dw,主要由多糖、核酸和蛋白组成(图1)。其中,多糖占EPS总量的比值最大(79.07%),其次是DNA(11.79%),蛋白质占比(9.14%)最小。As(Ⅴ)处理对EPS分泌量及组分变化有重要影响。随着砷处理浓度的升高,EPS总量(多糖、蛋白和DNA含量的总和)呈显著增加的趋势(P<0.05),说明 P. tricornutum细胞通过调控自身EPS的分泌应对砷胁迫。大量分泌的EPS能够通过其自身所特有的胶体带电性、疏松性和生物活性3种方式有效地避免有毒物质的侵害[24]。黄飞等[17]的研究结果也表明,随着砷暴露浓度的升高,蛋白核小球藻EPS的分泌量也增多,且As(Ⅲ)对蛋白核小球藻EPS分泌的促进作用显著低于As(Ⅴ)。蓝藻(Lyngbya putealis HH-15和Synechocystis sp. PCC 6803)和普通小球藻(Chlorella vulgaris)胞外多糖的大量产生也体现了藻类在金属胁迫下生存的策略,因为这些聚合物具有与金属离子发生强烈相互作用的潜力[25-27]。
-
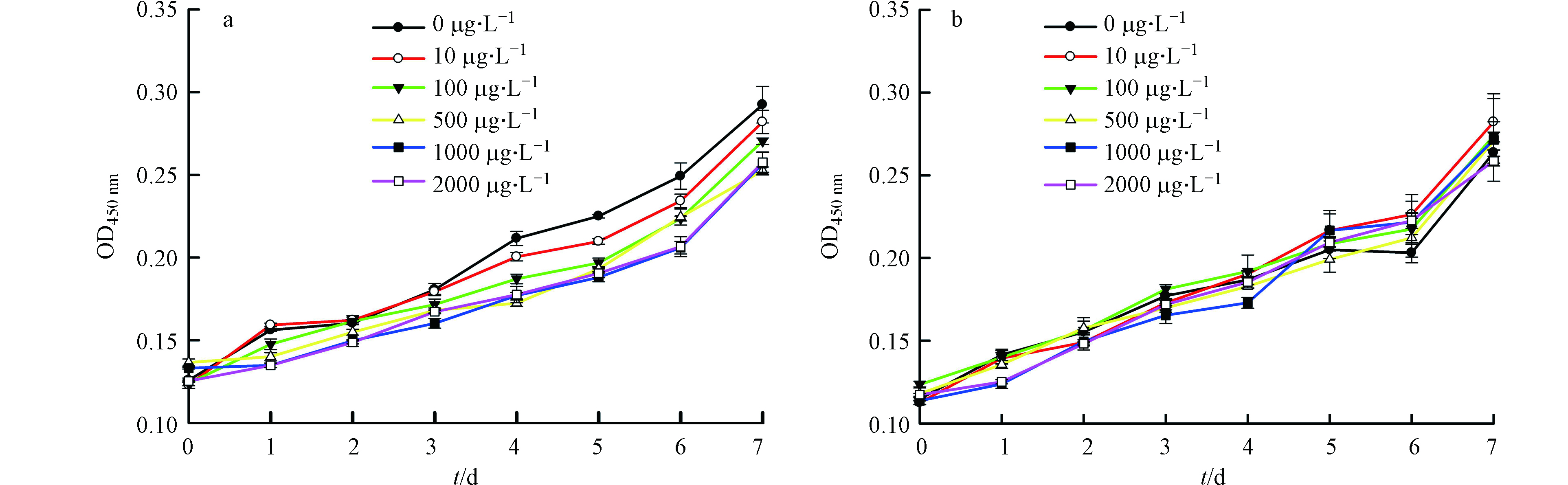
与空白对照相比,低浓度下的As(Ⅴ)处理会促进藻细胞的生长,但随着As(Ⅴ)处理浓度的增加,藻细胞的生长逐渐受到抑制(图2a)。72 h的EC10值为1.75 mg·L−1,说明P. tricornutum能够耐受一定浓度的砷处理。当藻细胞去除EPS后,As(Ⅴ)对其生长的影响变小。在2000 μg·L−1 As处理7 d时,与未加砷的对照组相比,有EPS的三角褐指藻OD从0.292下降到0.257,而去除EPS后OD则从0.264下降为0.259,各处理浓度之间差异不显著(P<0.05)。这与前人报道的有所不同,例如,Naveed等[23]发现在提取EPS后,集胞藻细胞对As的耐受性显著降低。这可能与有EPS的P. tricornutum细胞富集的砷含量较多、产生更大毒性有关。因此下文将从细胞表面变化以及对砷的富集、转化能力方面,进一步探讨EPS在藻细胞对砷解毒过程中的作用。
-
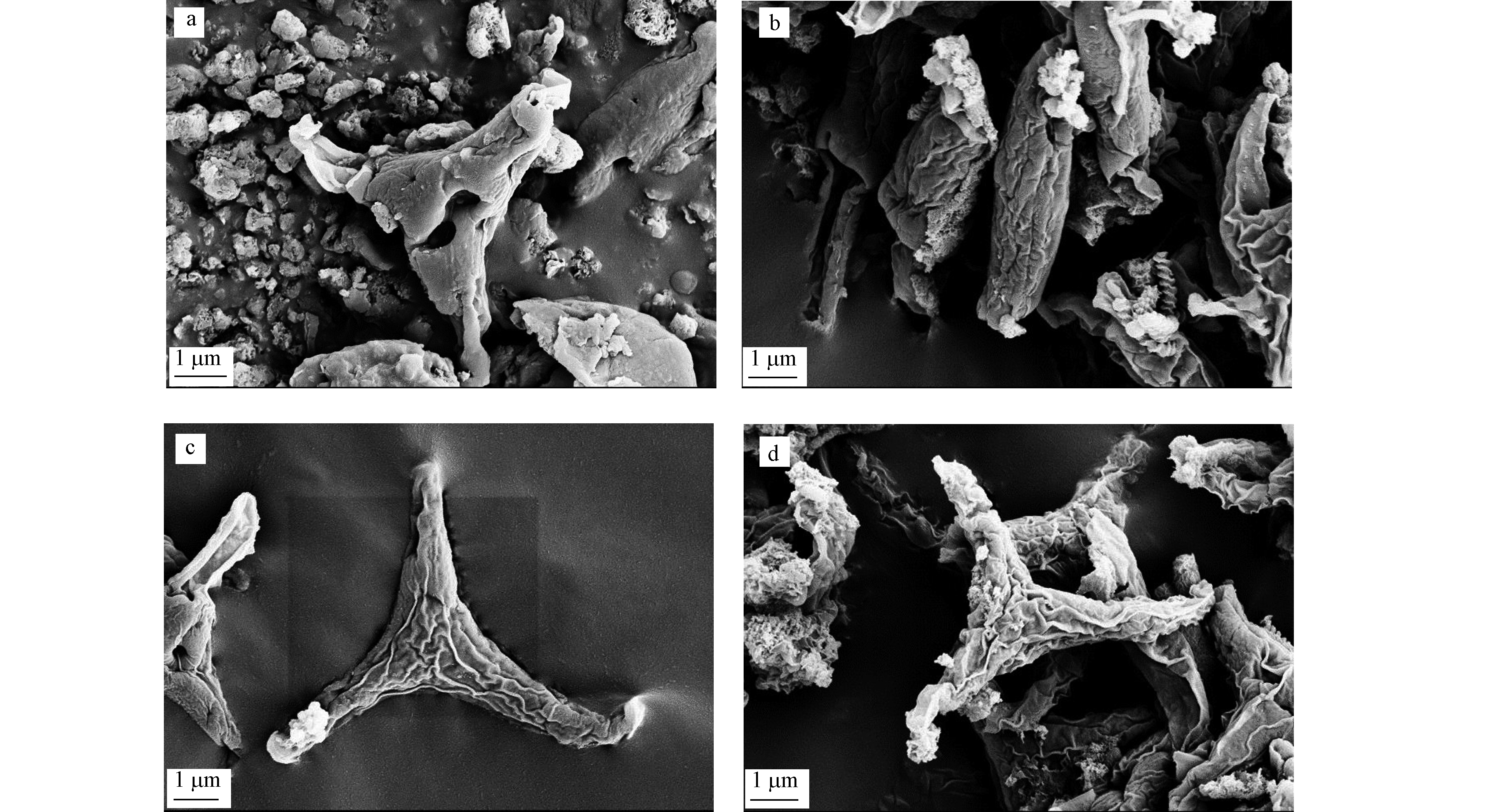
P. tricornutum分为卵圆形、梭形和三辐射形三种不同的形态类型,其中主要以梭形和三辐射形存在[28]。去除EPS(图3c)与未去除EPS的藻细胞(图3a)相比,EDTA法提取效果较好,细胞表面没有EPS分泌物且细胞无破损,对细胞再培养的生长状况影响很小。这与李崇华等[20]的研究结果一致。加砷处理(图3b、d)与未加砷处理(图3a、c)相比,As(Ⅴ)处理导致了三角褐指藻细胞表面发生折皱,且表面分泌物增加。之前很多研究[13, 15]表明,重金属可以诱导EPS的分泌,阻止金属离子进入细胞,维持细胞的完整性。
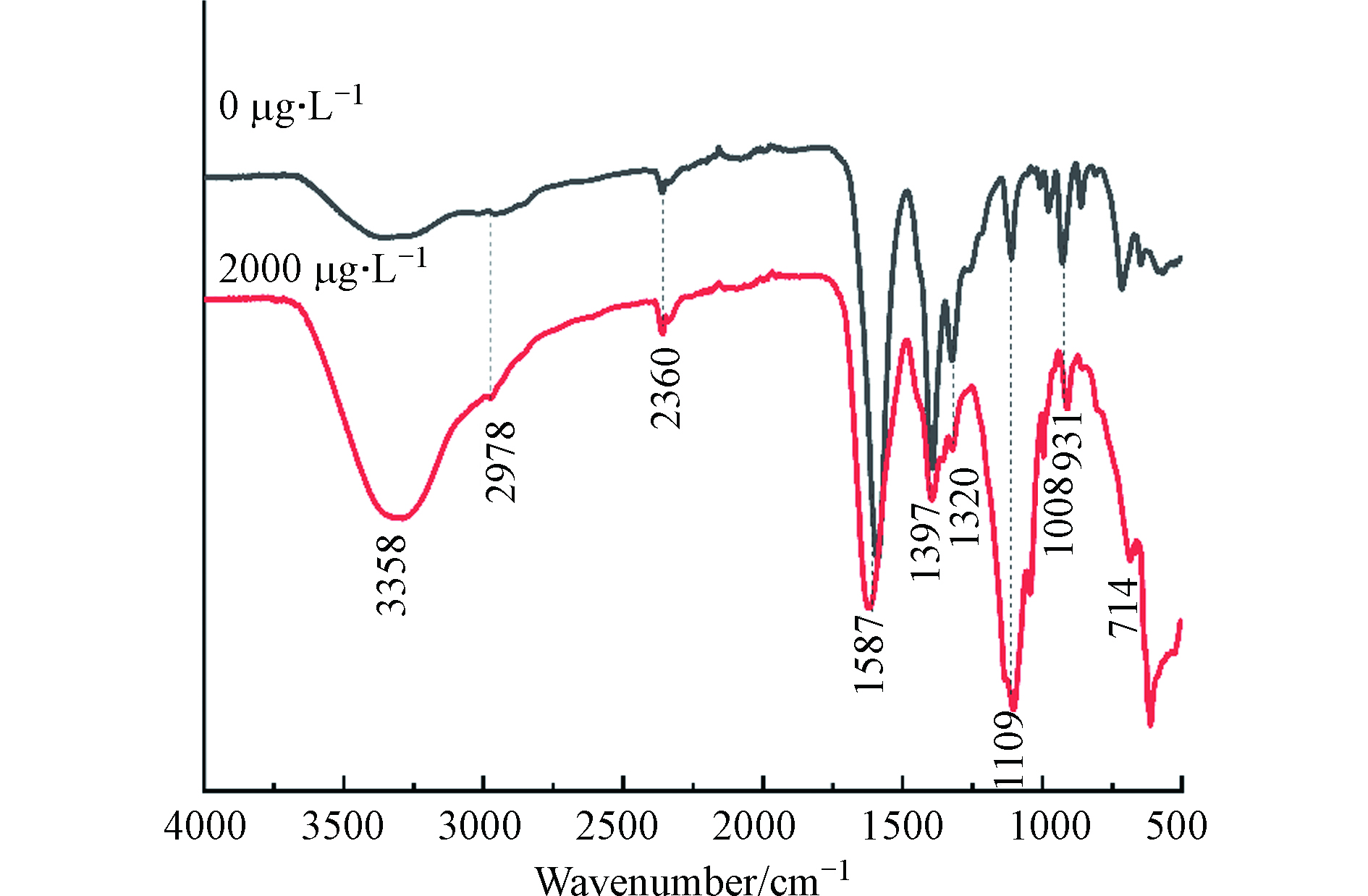
有研究表明,藻细胞表面的功能基团(如羟基、羧基、氨基、硫醇、磷酸盐和酰胺等)能增加与重金属结合的潜力[12-13]。ATR-IR光谱分析结果表明,P. tricornutum的EPS有多个吸收峰(图4),分别代表着糖类(931、1008、1109、3358 cm−1)、蛋白质(1320、1397、1587 cm−1)和脂类(2978 cm−1)等大分子的功能基团。As(Ⅴ)处理下,3358 cm−1处(C—OH)的宽峰带移位至3289 cm−1处;而在1587 cm−1处(C=O/ N—H)的光谱带变为1622 cm−1,且峰强度下降,在1109 cm−1处(多糖中的C—O—C)的光谱带变为1104 cm−1,931 cm−1处(糖环振动)峰强度也显著下降。说明上述基团能与As相互作用,这与Naveed等[23]研究相似,他们发现集胞藻EPS中的—NH、C=C、—OH和C=O等官能团参与了对As的吸附。这些相关波段的官能团的变化表明细胞表面活性发生了改变,从而影响藻细胞的金属结合能力[12]。
-
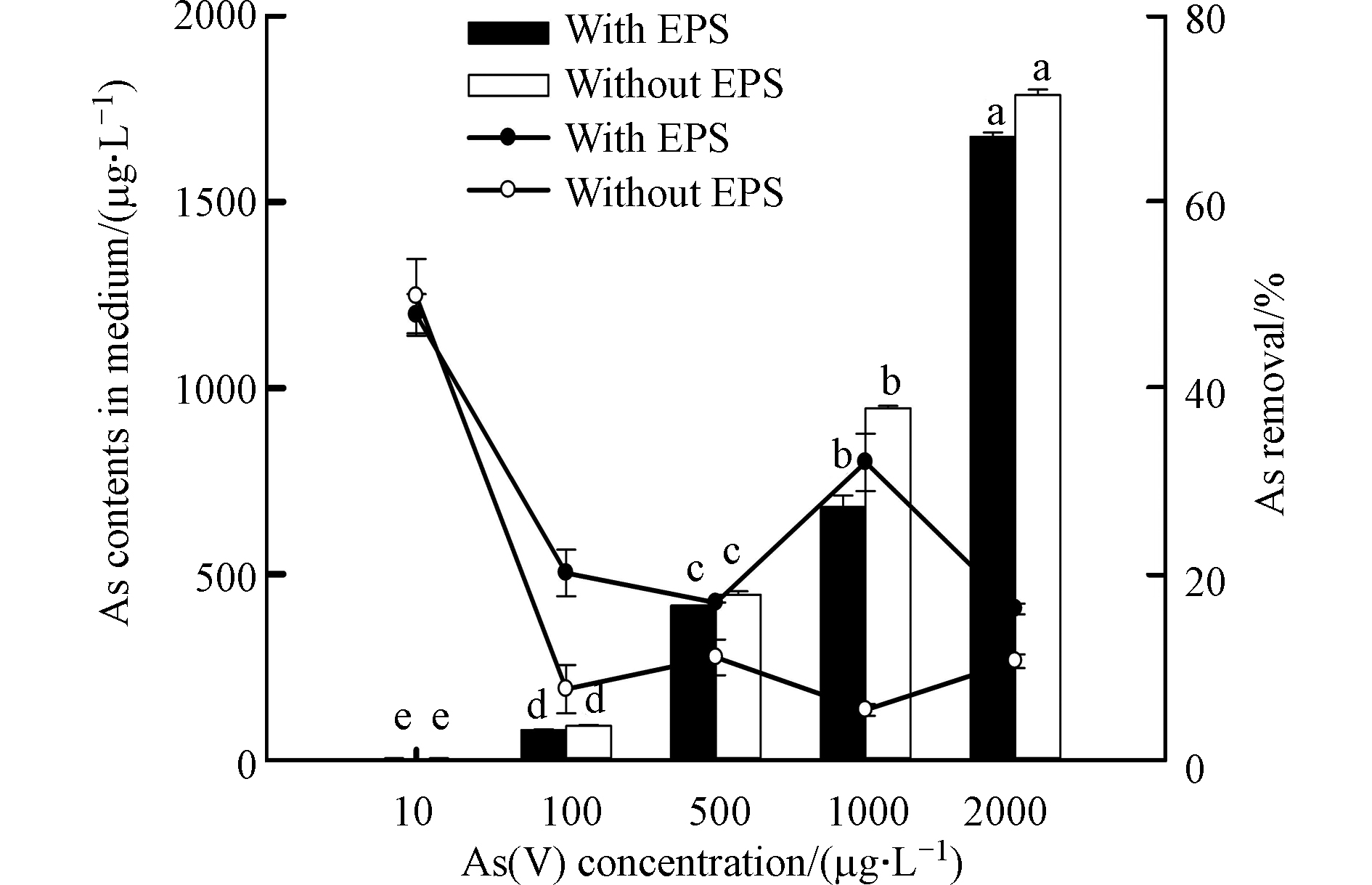
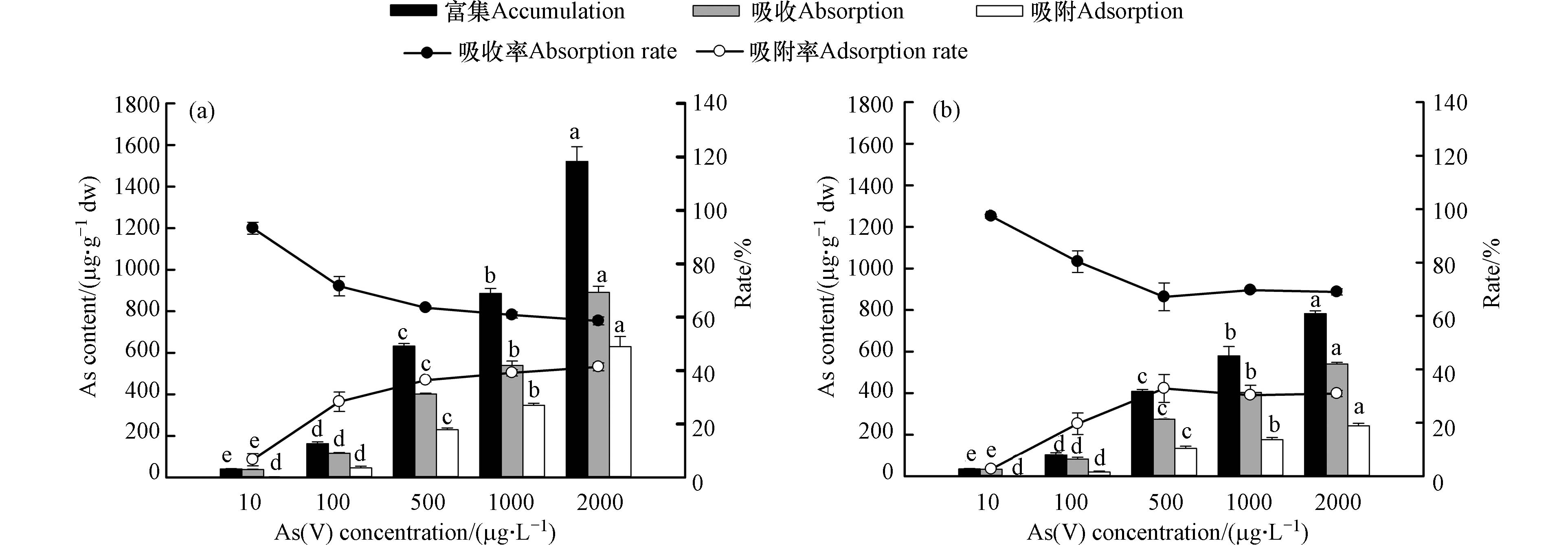
由图5可知,随着施加的As(Ⅴ)浓度的增加,培养液中的砷总量也呈显著增加的趋势(P<0.05);10 μg·L−1 As(Ⅴ)处理下,有EPS(培养液中残留量为5.21 μg·L−1)和去除EPS(残留量为5.01 μg·L−1)的藻细胞对As(Ⅴ)的去除率均最高,分别可达47.86 %和49.87 %,而随着As(Ⅴ)处理浓度(100—2000 μg·L−1范围内)的增加,藻细胞对As的去除率下降,特别是去除EPS后的藻细胞。这说明砷去除率取决于砷暴露浓度,与先前的研究(如:蓝藻、蛋白核小球藻、莱茵衣藻等对砷的富集试验)结果一致[12, 20, 29],去除率都是随着砷处理浓度的增加而降低。而高砷暴露浓度下去除率下降的原因可能是细胞表面吸附位点的饱和[23]。与有EPS的P. tricornutum相比,去除EPS后的藻细胞对As(Ⅴ)的去除率减少,表明EPS的存在能够促进藻细胞对As(Ⅴ)的去除。
不同浓度As(Ⅴ)处理下,P. tricornutum对砷的富集、吸附、吸收含量及所占比例如图6所示。在有EPS的对照组(图6 a)中发现P. tricornutum对As的吸收率一直大于吸附率(2000 μg·L−1As(Ⅴ)处理下吸收和吸附率分别为58.60%和41.40%),说明细胞外层的离子能够从磷酸盐吸收通道快速进入细胞内[30-31],增加胞内吸收量。Foster等[30]的研究亦证明了三角褐指藻对As(Ⅴ)的结合主要是以胞内吸收为主,而不是胞外吸附。随着施加As浓度的增加,藻细胞吸附率逐渐增高,这可能和EPS的数量增加有关,EPS的存在增加了金属吸附的结合位点从而导致细胞表面吸附增加[17]。而不同浓度As(Ⅴ)处理下,去除EPS后的P. tricornutum对砷的富集量要远远低于有EPS的藻细胞,但吸收率增高,表明EPS屏障缺失使As进入细胞,导致更多的As在细胞内积累[12, 23]。
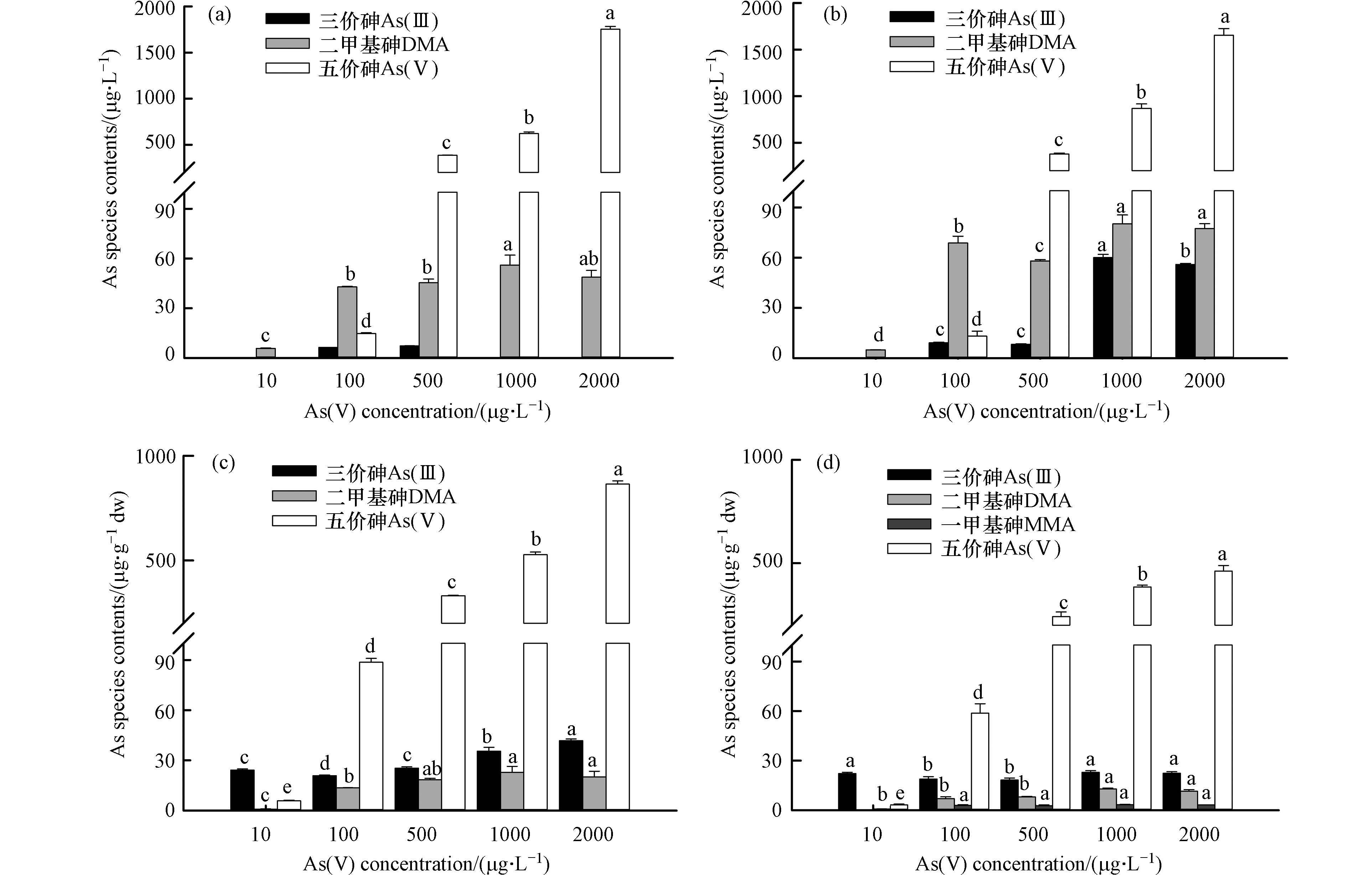
As的毒性取决于其形态,一般认为无机砷比有机砷毒性更大[32]。本文对不同浓度As(Ⅴ)处理7 d后,去除和未去除EPS的P. tricornutum培养液中及胞内砷形态研究结果如图7所示。
经检测,不加藻的含砷培养液内主要以As(Ⅴ)形态存在,说明没有藻细胞时,As(Ⅴ)形态保持稳定。有EPS的三角褐指藻培养液砷形态主要以施加的As(Ⅴ)为主(图7a),其次是DMA,还有少量As(Ⅲ),而且随着As(Ⅴ)处理浓度的增加,胞内As(Ⅴ)的形态转化率逐步降低(从81.07%降至6.68%),但形态转化量在逐渐增加。说明P. tricornutum具有将砷转化为毒性较低的砷形态的能力,以承受胞内高砷负荷[33]。特别是在10 μg·L−1As(Ⅴ)处理下,培养液中只检测到DMA的存在。有研究表明三角褐指藻比其他微藻更具有外排甲基化砷的能力[30]。
对比三角褐指藻培养液和胞内砷形态含量(图7a与7c相比;7b与7d相比),发现培养液和胞内砷形态含量存在很大差异,胞内As(Ⅲ)含量多,甲基化砷含量少;而培养液中As(Ⅲ)含量少,甲基化砷含量多。因为微藻可以利用细胞膜中的磷酸盐途径将As(Ⅴ)吸收进入细胞内,然后在胞内利用硫醇(如谷胱甘肽)的作用As(Ⅴ)转化为As(Ⅲ),随后利用生物甲基化作用将As(Ⅲ)转化为甲基砷(如DMA和MMA)[34]。合成的甲基砷随后被快速排出胞外,导致胞内砷含量少,培养液中含量多;而胞内As(Ⅲ)由于被甲基化或者与谷胱甘肽、植物螯合素等络合,造成排出胞外的As(Ⅲ)更少[35],甚至检测不到(图7a中1000、2000 μg·L−1 As(Ⅴ)处理下)。培养液中As(Ⅲ)含量少的另一个原因是f/2培养基偏碱性(pH>8),As(Ⅲ)外排后立即被氧化为As(Ⅴ)。
对比去除和未去除EPS的胞内砷形态发现(图7c、d),胞内砷形态主要以As(Ⅴ)为主,其次是As(Ⅲ)和DMA;而去除EPS后胞内还含有少量MMA(占胞内总砷比值约为0.64—2.83%),说明EPS在砷形态转化方面也起着重要作用。有EPS的P. tricornutum细胞中的As(Ⅴ)还原能力(20.85—41.83 mg·kg−1)比去除EPS(18.26—22.93 mg·kg−1)的能力更强(图7c、d),这与Naveed等[23]研究结果一致。因为EPS中存在一些还原性化合物,如糖的半缩醛和乙酰基、氧化还原活性蛋白(c型、细胞色素)和芳香族化合物[36-38],这些化合物可能会导致As(Ⅴ)还原为As(Ⅲ),ATR-IR数据结果也证明了氨基、酚基、羟基和醛基等官能团会参与金属的还原,说明藻细胞上的EPS增强了细胞内As转化[23]。去除EPS后的P. tricornutum细胞内DMA含量小于有EPS的细胞(图7c、d),而培养液中去除EPS后DMA含量大于有EPS的细胞(图7a、b),可能是因为去除EPS后,甲基砷更易外排至培养液中[30]。
-
(1)随着As(Ⅴ)浓度的增加,P. tricornutum生长速度减慢,EPS含量增加,EPS中多糖占比最高。
(2)As(Ⅴ)会使P. tricornutum表面形貌发生变化,而EPS存在会缓解As(Ⅴ)引起的细胞形变。细胞表面及EPS中含有与As(Ⅴ)反应的官能团,砷处理下—OH、—NH2、C—O—C等官能团发生了变化。
(3)EPS在P. tricornutum砷富集和形态转化过程中起着重要作用。EPS会增加藻细胞对As(Ⅴ)富集和胞外吸附,同时促进胞内砷形态转化,但减弱了砷的外排。
胞外聚合物对三角褐指藻砷酸盐富集和形态转化的影响
Effects of extracellular polymeric substances on the accumulation and transformation of As(Ⅴ) by Phaeodactylum tricornutum
-
摘要: 微生物分泌的胞外聚合物(EPS)对重金属吸附有重要作用,然而EPS对硅藻生长及砷(As)的富集和转化有何影响尚不清楚。为此本文选取三角褐指藻,研究了不同浓度砷酸盐(As(Ⅴ))处理下EPS各组分含量、藻细胞生长以及细胞形貌的变化,并比较了EPS提取前后藻细胞对砷的富集和形态转化的差异。结果表明,三角褐指藻对As(Ⅴ)有一定的耐性,72 h 的EC10值为1.75 mg·L−1。随着As(Ⅴ)浓度的升高,EPS的分泌量呈增加的趋势,最大可达到对照组的1.47倍。藻细胞吸收As(V)后,转化为亚砷酸盐(As(Ⅲ))、二甲基砷(DMA)和一甲基砷(MMA)并外排至培养液,EPS能促进藻细胞对As(V)的富集、还原和甲基化。衰减全反射傅里叶变换红外光谱(ATR-IR)数据表明,EPS中存在—OH、—NH、C—O—C等官能团,增加了藻细胞对砷的吸附,从而限制了As的跨膜运输。总之,EPS增强了三角褐指藻对As(Ⅴ)的耐性、富集和形态转化。研究结果可为利用硅藻EPS治理水体As污染提供理论依据。Abstract: Extracellular polymeric substances (EPS) secreted by microorganisms play an important role in the adsorption of heavy metals. However, effects of EPS on the accumulation and transformation of arsenic (As) in diatoms are still unclear. As such, Phaeodactylum tricornutum was selected to study the variations in the composition of EPS, growth and morphology of algal cells under different treatments of arsenate (As(Ⅴ)). Besides, the accumulation and transformation of As by algae cells before and after EPS extraction were compared. The results showed that P. tricornutum had certain tolerance to As(Ⅴ), and the EC10 value at 72 h was 1.75 mg·L−1. With the increase of As(Ⅴ) concentration, the secretion of EPS showed an increasing trend, which maximally reached 1.47 times higher than those of the control group. Arsenate (As(Ⅴ)) absorbed into the cells was converted into arsenite (As(Ⅲ)), dimethyl arsenic (DMA) and monomethyl arsenic (MMA), which were then released into the culture medium. The EPS also promoted the As(Ⅴ) accumulation, reduction and methylation by the algae cells. At the same time, ATR-IR data confirmed the presence of —OH, —NH and C—O—C functional groups, which increased the extracellular adsorption of As by algal cells and thereby limited the As transport across membrane. In summary, EPS promoted the As(Ⅴ) tolerance, accumulation and transformation by P. tricornutum to As(Ⅴ). The results of this study may provide a theoretical basis for remediation of As pollution in water bodies using diatom EPS.
-
Key words:
- EPS /
- Phaeodactylum tricornutum /
- arsenic /
- accumulation /
- transformation
-

-
图 6 不同浓度As(V)处理下有EPS(a)和去除EPS(b)三角褐指藻的富集、吸附和吸收砷含量及比例(柱子和线条分别代表砷含量和吸附/吸收率;不同字母表示不同浓度As(V)之间差异显著,P<0.05)
Figure 6. The concentration and ratio of arsenic in the accumulation, adsorption and absorption of P. tricornutum with EPS (a) and without EPS (b) under different As(V) concentrations (Columns and lines represent Ascontent and adsorption/ absorption rate respectively; Different letters indicate significant differences among various As(V) concentrations, P<0.05)
图 7 不同浓度As(V)处理下有EPS(a、c)和去除EPS(b、d)的三角褐指藻培养液中(a、b)和胞内(c、d)砷形态及含量(不同字母表示不同浓度As(V)之间差异显著,P<0.05)
Figure 7. Speciation and contents of As in the culture solution (a, b) and cells (c, d) of P. tricornutum with EPS (a, c) and without EPS (b, d) under different As(V) concentrations (Different letters indicate (Different letters indicate significant differences among various As(V) concentrations , P<0.05)
-
[1] MOHMOOD I, LOPES C B, LOPES I, et al. Remediation of mercury contaminated saltwater with functionalized silica coated magnetite nanoparticles [J]. Science of The Total Environment, 2016, 557: 712-721. [2] YE J, RENSING C, ROSEN B P, et al. Arsenic biomethylation by photosynthetic organisms [J]. Trends in Plant Science, 2012, 17(3): 155-162. doi: 10.1016/j.tplants.2011.12.003 [3] XU D, SCHAUM C E, LI B, et al. Acclimation and adaptation to elevated pCO2 increase arsenic resilience in marine diatoms[J]. The ISME Journal, 2021, 15: 1599-1613. [4] 陈保卫, LE X. CHRIS. 中国关于砷的研究进展 [J]. 环境化学, 2011, 30(11): 1936-1943. CHEN B W, LE X. CHRIS. Recent progress in arsenic research in China [J]. Environmental Chemistry, 2011, 30(11): 1936-1943(in Chinese).
[5] WANG Y, WANG S, XU P P, et al. Review of arsenic speciation, toxicity and metabolism in microalgae [J]. Reviews in Environmental Science and Bio/Technology, 2015, 14(3): 427-451. doi: 10.1007/s11157-015-9371-9 [6] 张圣洁, 蔡中华, 朱伟胜, 等. 藻际环境中胞外聚合物的研究进展 [J]. 微生物学报, 2020, 60(8): 1521-1533. ZHANG S J, CAI Z H, ZHU W S, et al. Advances in extracellular polymeric substances in phycosphere environment [J]. Acta Microbiologica Sinica, 2020, 60(8): 1521-1533(in Chinese).
[7] GAN N Q, XIAO Y, ZHU L, et al. The role of microcystins in maintaining colonies of bloom‐forming Microcystis spp [J]. Environmental Microbiology, 2012, 14(3): 730-742. doi: 10.1111/j.1462-2920.2011.02624.x [8] 毕相东, 戴伟, 张树林, 等. 微囊藻群体的竞争优势及其形成机制的研究进展 [J]. 环境科学与技术, 2014, 37(7): 41-44. BI X D, DAI W, ZHANG S L, et al. Research progress on the competitive advantages and formation mechanism of Microcystis colony [J]. Environmental Science & Technology, 2014, 37(7): 41-44(in Chinese).
[9] VOLESKY B, HOLAN Z. Biosorption of heavy metals [J]. Biotechnology Progress, 1995, 11(3): 235-250. doi: 10.1021/bp00033a001 [10] XIAO R, ZHENG Y. Overview of microalgal extracellular polymeric substances (EPS) and their applications [J]. Biotechnology Advances, 2016, 34(7): 1225-1244. doi: 10.1016/j.biotechadv.2016.08.004 [11] MOHITE B V, KOLI S H, NARKHEDE C P, et al. Prospective of microbial exopolysaccharide for heavy metal exclusion [J]. Applied Biochemistry and Biotechnology, 2017, 183(2): 582-600. doi: 10.1007/s12010-017-2591-4 [12] ZHANG J Y, ZHOU F, LIU Y X, et al. Effect of extracellular polymeric substances on arsenic accumulation in Chlorella pyrenoidosa [J]. Science of The Total Environment, 2020, 704: 135368. doi: 10.1016/j.scitotenv.2019.135368 [13] NAVEED S, LI C H, LU X D, et al. Microalgal extracellular polymeric substances and their interactions with metal(loid)s: A review [J]. Critical Reviews in Environmental Science and Technology, 2019, 49(19): 1769-1802. doi: 10.1080/10643389.2019.1583052 [14] WEI L L, LI J J, XUE M, et al. Adsorption behaviors of Cu2+, Zn2+ and Cd2+ onto proteins, humic acid, and polysaccharides extracted from sludge EPS: Sorption properties and mechanisms [J]. Bioresource Technology, 2019, 291: 121868. doi: 10.1016/j.biortech.2019.121868 [15] LI C H, ZHENG C, FU H X, et al. Contrasting detoxification mechanisms of Chlamydomonas reinhardtii under Cd and Pb stress [J]. Chemosphere, 2021, 274: 129771. doi: 10.1016/j.chemosphere.2021.129771 [16] 梁君, 宋文成, 马金宝, 等. 微生物胞外聚合物对水中As(V)的吸附性能研究 [J]. 环境工程, 2016(S1): 226-229. LIANG J, SONG W C, MA J B, et al. Study on sorption performances of As(V) by extracellular polymeric substance [J]. Environmental Engineering, 2016(S1): 226-229(in Chinese).
[17] 黄飞, 周昉, 姜舒扬, 等. 绿藻胞外聚合物对无机砷生物累积特征的影响 [J]. 环境化学, 2019, 38(5): 1021-1027. HUANG F, ZHOU F, JIANG S Y, et al. Effects of extracellular polymeric substances on the bioaccumulation of inorganic arsenic by green microalgae [J]. Environmental Chemistry, 2019, 38(5): 1021-1027(in Chinese).
[18] HOAGLAND K D, ROSOWSKI J R, GRETZ M R, et al. Diatom extracellular polymeric substances: Function, fine structure, chemistry and physiology [J]. Journal of Phycology, 1993, 29(5): 537-566. doi: 10.1111/j.0022-3646.1993.00537.x [19] 丁腾达. 硅藻对三价砷的吸附吸收行为及机制[D]. 杭州: 浙江大学, 2014. DING T D. Biosorption behavior and mechanism of arsenite on diatoms[D]. Hangzhou: Zhejiang University, 2014(in Chinese).
[20] 李崇华, 赵方慈, 喻琪盛, 等. 胞外聚合物对莱茵衣藻砷富集和形态转化的影响 [J]. 湖南农业大学学报(自然科学版), 2019, 45(4): 384-390. LI C H, ZHAO F C, YU Q S, et al. Effects of extracellular polymeric substances on the accumulation and transformation of arsenic by Chlamydomonas reinhardtii [J]. Journal of Hunan Agricultural University (Natural Sciences), 2019, 45(4): 384-390(in Chinese).
[21] 张金羽, 葛滢, 张春华. 水生生物中砷的提取和形态分析的研究进展 [J]. 理化检验-化学分册, 2020, 56(7): 836-844. ZHANG J Y, GE Y, ZHANG C H. Research progress on extraction and species analysis of arsenic in aquatic organisms [J]. Physical Testing and Chemical Analysis (Part B:Chemical Analysis), 2020, 56(7): 836-844(in Chinese).
[22] GE Y, NING Z B, WANG Y, et al. Quantitative proteomic analysis of Dunaliella salina upon acute arsenate exposure [J]. Chemosphere, 2016, 145: 112-118. doi: 10.1016/j.chemosphere.2015.11.049 [23] NAVEED S, YU Q N, ZHANG C H, et al. Extracellular polymeric substances alter cell surface properties, toxicity, and accumulation of arsenic in Synechocystis PCC6803 [J]. Environmental Pollution, 2020, 261: 114233. doi: 10.1016/j.envpol.2020.114233 [24] 康福星, 龙健, 王倩, 等. 微生物胞外聚合物对水体重金属和富营养元素的环境生化效应研究展望 [J]. 应用与环境生物学报, 2010, 16(1): 129-134. doi: 10.3724/SP.J.1145.2010.00129 KANG F X, LONG J, WANG Q, et al. Environmental & biochemical effects of microbial extracellular polymeric substances on the heavy metals and eutrophic elements in water areas: A review [J]. Chinese Journal of Applied and Environmental Biology, 2010, 16(1): 129-134(in Chinese). doi: 10.3724/SP.J.1145.2010.00129
[25] KIRAN B, KAUSHIK A. Chromium binding capacity of Lyngbya putealis exopolysaccharides [J]. Biochemical Engineering Journal, 2008, 38(1): 47-54. doi: 10.1016/j.bej.2007.06.007 [26] HUERTAS M J, LOPEZ-MAURY L, GINER-LAMIA J, et al. Metals in cyanobacteria: analysis of the copper, nickel, cobalt and arsenic homeostasis mechanisms [J]. Life, 2014, 4(4): 865-886. doi: 10.3390/life4040865 [27] ZHAO J F, LIU S X, LIU N, et al. Accelerated productions and physicochemical characterizations of different extracellular polymeric substances from Chlorella vulgaris with nano-ZnO [J]. Science of the Total Environment, 2019, 658: 582-589. doi: 10.1016/j.scitotenv.2018.12.019 [28] MA J, ZHOU B B, CHEN F Y, et al. How marine diatoms cope with metal challenge: Insights from the morphotype-dependent metal tolerance in Phaeodactylum tricornutum [J]. Ecotoxicology and Environmental Safety, 2021, 208: 111715. doi: 10.1016/j.ecoenv.2020.111715 [29] YIN X X, CHEN J, QIN J, et al. Biotransformation and volatilization of arsenic by three photosynthetic cyanobacteria [J]. Plant Physiology, 2011, 156(3): 1631-1638. doi: 10.1104/pp.111.178947 [30] FOSTER S, THOMSON D, and MAHER W. Uptake and metabolism of arsenate by anexic cultures of the microalgae Dunaliella tertiolecta and Phaeodactylum tricornutum [J]. Marine Chemistry, 2008, 108(3-4): 172-183. doi: 10.1016/j.marchem.2007.11.005 [31] 郑燕恒, 李颢, 张春华, 等. 胞内砷磷含量和比值对莱茵衣藻砷酸盐和亚砷酸盐耐性的影响 [J]. 环境化学, 2018, 37(1): 75-81. doi: 10.7524/j.issn.0254-6108.2017040702 ZHENG Y H, LI H, ZHANG C H, et al. Effects of intracellular arsenic and phosphorus content and ratio on the tolerance of arsenate and arsenite in Chlamydomonas reinhardtii [J]. Environmental Chemistry, 2018, 37(1): 75-81(in Chinese). doi: 10.7524/j.issn.0254-6108.2017040702
[32] TAMAKI S, FRANKENBERGER W T. Environmental biochemistry of arsenic [J]. Reviews of Environmental Contamination and Toxicology, 1992, 124: 79-110. [33] DEBNATH M, BHADURY P. Adaptive responses and arsenic transformation potential of diazotrophic Cyanobacteria isolated from rice fields of arsenic affected Bengal Delta Plain [J]. Journal of Applied Phycology, 2016, 28(5): 2777-2792. doi: 10.1007/s10811-016-0820-9 [34] PAPRY R I, ISHII K, MAMUN M A A, et al. Arsenic biotransformation potential of six marine diatom species: Effect of temperature and salinity [J]. Scientific Reports, 2019, 9: 10226. doi: 10.1038/s41598-019-46551-8 [35] 王亚, 张春华, 王淑, 等. 带菌盐藻对不同形态砷的富集和转化研究 [J]. 环境科学, 2013, 34(11): 4257-4265. WANG Y, ZHANG C H, WANG S, et al. Accumulation and transformation of different arsenic species in nonaxenic Dunaliella salina [J]. Environmental Science, 2013, 34(11): 4257-4265(in Chinese).
[36] BOGGS M A, JIAO Y Q, DAI Z R, et al. Interactions of plutonium with Pseudomonas sp. strain EPS-1W and its extracellular polymeric substances [J]. Applied and Environmental Microbiology, 2016, 82(24): 7093-7101. doi: 10.1128/AEM.02572-16 [37] ZHANG X, YANG C W, YU H Q, et al. Light-induced reduction of silver ions to silver nanoparticles in aquatic environments by microbial extracellular polymeric substances (EPS) [J]. Water Research, 2016, 106: 242-248. doi: 10.1016/j.watres.2016.10.004 [38] ZHOU L, LI A, MA F, et al. Sb(V) reduced to Sb(III) and more easily adsorbed in the form of Sb(OH)3 by microbial extracellular polymeric substances and core-shell magnetic nanocomposites [J]. ACS Sustainable Chemistry & Engineering, 2019, 7(11): 10075-10083. -



 下载:
下载: