-
随着社会发展的加快,人类在各种生产活动中排放出大量砷(As)等污染物[1],当这些污染物入侵到环境之后,给生态系统带来的风险日益增大[2-3]. 其中,食物链的存在对砷的迁移与转化过程尤为重要,砷会通过食物链的累积作用到达人体,对人体健康造成危害[4]. 有大量研究显示,在海洋和湖泊中,几乎所有的水生生物体内均有砷元素,而生活在不同环境的不同生物,其体内的砷含量均有所不同[5-6].
目前,砷在水体和沉积物中的富集与分布方面已有较多研究,但是关于砷在食物链上的生物累积与转化过程的研究相对较少[7-8]. 有研究发现,在生物累积和转化砷的过程中,生物体一般从环境中累积砷酸[As(Ⅴ)]和亚砷酸[As(Ⅲ)]等无机砷,之后在体内甲基化为一甲基砷酸(MMA)、二甲基砷酸(DMA)、砷甜菜碱(AsB)等有机砷[9]. AsB是海洋鱼类中主要的砷形态,在总砷中的占比可达80%—95%[10]. AsB也存在于淡水鱼中,但其在总砷中所占的比值相对较小,而MMA、DMA等甲基类的砷占据重要位置[11]. 有研究者在湖泊中检测了不同营养级的动植物,发现在不同类型的生物体内砷含量差异较大,其中浮游动物砷含量最大,其次为杂食性鱼类,最后到肉食性鱼类[12],随着营养级的增加,生物体内所累积的砷含量减小.
杂食性淡水鱼类尼罗罗非鱼(Oreochromis niloticus),是我国引进的最重要的淡水鱼类养殖品种之一,深受人们喜爱. 本研究选取尼罗罗非鱼为供试对象,并以浮水植物青萍(Lemna minor L.)、沉水植物轮叶黑藻(Hydrilla verticillate)、节肢动物日本沼虾(Macrobrachium nipponense)作为罗非鱼的食物,探究尼罗罗非鱼在摄食不同类型含砷食物之后,其对砷的累积与转化作用,为人类的饮食安全提供科学依据.
-
实验所用的尼罗罗非鱼(下文简称:罗非鱼)购于广东省富隆渔场,选择体长为6—9 cm的鱼苗,当天空运到实验室,用曝气超过24 h的自来水驯化培养7 d. 驯养过程投喂罗非鱼专用饲料(由渔场同批发货),每天定时投喂2次,投喂量为鱼缸内所有鱼体重的2%—3 %,经检测得:曝气后的自来水中砷含量为(5.72±0.02) μg·g −1,饲料中砷的含量为(0.18±0.07) mg·kg −1,由于背景水样和罗非鱼饲料中的砷含量相对较小,所以它们对鱼体内砷的累积将忽略不计。在实验过程中仅选取鱼体的肌肉部分(不含鱼皮)进行测定和分析。罗非鱼培养在循环水曝气玻璃鱼缸(125 cm×60 cm×50 cm),鱼缸内实际水量为300 L,每组实验放入罗非鱼50—60条,养殖密度约为2.40 kg·m−3. 鱼缸内溶解氧浓度大致维持在(6.97±0.83) mg·L−1,为罗非鱼的日常活动提供充足的氧气.
-
在前期探索实验中,用不同种类的食物来喂鱼,观察罗非鱼对每种食物的喜爱程度、摄食量等,最终选择了浮水植物青萍、沉水植物轮叶黑藻、节肢动物日本沼虾作为食物相. 首先将这3种食物分别暴露培养于1 mg·L−1 As(Ⅴ)溶液中20 d,在第1、5、10、15、20 d取样,检测青萍、轮叶黑藻、日本沼虾中的砷含量及砷形态变化. 经过检测数据分析,选择动植物体内总砷累积及砷形态变化达到平衡时的样品投喂罗非鱼. 取出的样品用纯水洗净,轮叶黑藻用剪刀剪碎投喂鱼,青萍和日本沼虾洗净后直接投喂;青萍和轮叶黑藻的投喂量为每条鱼50 mg(鲜重),日本沼虾的投喂量为每条鱼80 mg(鲜重)。投喂过程持续1—6 min,前期由于鱼体数量较多,有摄食竞争行为,投喂时间较短,到培养后期投喂时间相对较长. 虽然食物在投喂前经过纯水清洗,但考虑其在水中微弱的释放作用[13],所以在食物相暴露实验中每5 d为罗非鱼换水1次.
在食物相暴露实验中,以饲喂罗非鱼未添加砷的专用饲料为对照组(CK),在暴露过程中,将罗非鱼分成3组培养在不含砷的水中,每组设置3个平行实验,每个鱼缸中各放入50条鱼,共450条. 每天分别用青萍、轮叶黑藻、日本沼虾3种饵料定时投喂2次. 利用充氧泵为鱼体供氧,通过恒温鱼缸将水体温度控制在27 ℃左右. 并于第1、5、10、15、20、25、30 d取样,每次在每个鱼缸内随机取5条罗非鱼样品,经过解剖、冷冻干燥、研磨处理后,进行鱼体肌肉组织中总砷和各形态砷的测定.
-
采集水样经0.45 μm滤膜过滤后,根据仪器检出限稀释相应倍数,进行总砷和各形态砷测定. 鱼样用纯水清洗后进行解剖,每条鱼只取肌肉部分(不含鱼皮)为试验样品,并将每个实验组5条鱼的肌肉部分混合为1个样,放入真空冷冻干燥机(宁波新芝,Scientz—N)进行冻干,冻干后的样品用组织研磨仪(上海测博,CEBO—24)进行研磨和均化. 青萍、轮叶黑藻、日本沼虾用纯水清洗3次直接进行冻干和研磨;将所有预处理好的样品密封后放入低温冰箱保存待测.
-
参照GB5009.11—2003《食品中总砷及无机砷的测定》进行样品消解. 准确称取0.05 g处理好的样品(精确至0.001 g)于消解罐中,加入5 mL硝酸(65%,优级纯,上海阿拉丁试剂),放置30 min,将消解罐放入微波消解仪(ANKS—SR6,青岛艾尼克斯)中,在功率1200 W条件下,控制温度(120 ℃、6 min,180 ℃、10 min,190 ℃、15 min)进行消解. 将消化液转移至25 mL容量瓶中,用少量纯水洗涤罐内3次,合并洗涤液并定容至刻度,混匀待测.
-
形态分析未有具体的国标,所以参照先前的一些研究方法,并结合实验室现有条件,进行样品处理与分析[14]. 称取0.1 g(精确至0.001 g)预处理好的样品,加入15 mL 50%甲醇—水溶液(无水甲醇,优级纯,天津市大茂化学试剂厂),混匀振荡10 min,室温下超声提取30 min,使用高速冷冻离心机(TGL—16M)8000 r·min−1 离心10 min,转移上清液于洁净的100 mL离心管中;继续往原样品离心管中加入15 mL 50%甲醇-水溶液,重复提取4次;合并上清液,在40 ℃下旋转蒸发浓缩至1—2 mL,转移至10 mL离心管中,用超纯水定容稀释至10 mL,测试前经0.45 μm滤膜过滤,在3 d内测试分析完毕.
-
总砷和砷形态采用高效液相色谱—质谱联用仪(HPLC—ICP—MS;Agilent 1100, USA;detection limit = 0.01 μg·L−1)联用系统进行测定,测定总砷含量使用1000 mg·L−1 As的标准溶液(GBW08611). 实验过程中使用的As(Ⅲ)溶液标准物质(GBW08666)、As(Ⅴ)溶液标准物质(GBW08667)、MMA溶液标准物质(GBW08668)、DMA溶液标准物质(GBW08669)、AsB溶液标准物质(GBW08670)均来自于中国国家标准物质研究中心. 总砷的加标回收率为88.1%—105.3%. 砷形态的加标回收率为85%—105%.
-
由于不同食物相中的砷含量存在较大差异,因此暴露30 d后,每种食物对鱼类肌肉组织中砷的营养转移因子(trophic transfer factor, TTF)使用以下公式计算:TTF=(鱼体肌肉中累积的砷浓度-鱼体肌肉中的背景砷浓度)/食物中的砷浓度[8].
-
实验获得的检测数据用excel 17.0 软件进行分析与整理,并采用IBM SPSS Statistics 25.0进行数据分析,利用单因素方差分析(ANOVA)来检测不同实验组中的相关水平差异,当概率水平P <0.05被认为具有统计学意义. 采用Origin2020(OriginLab Corporation,Northampton,MA,USA)绘图.
-
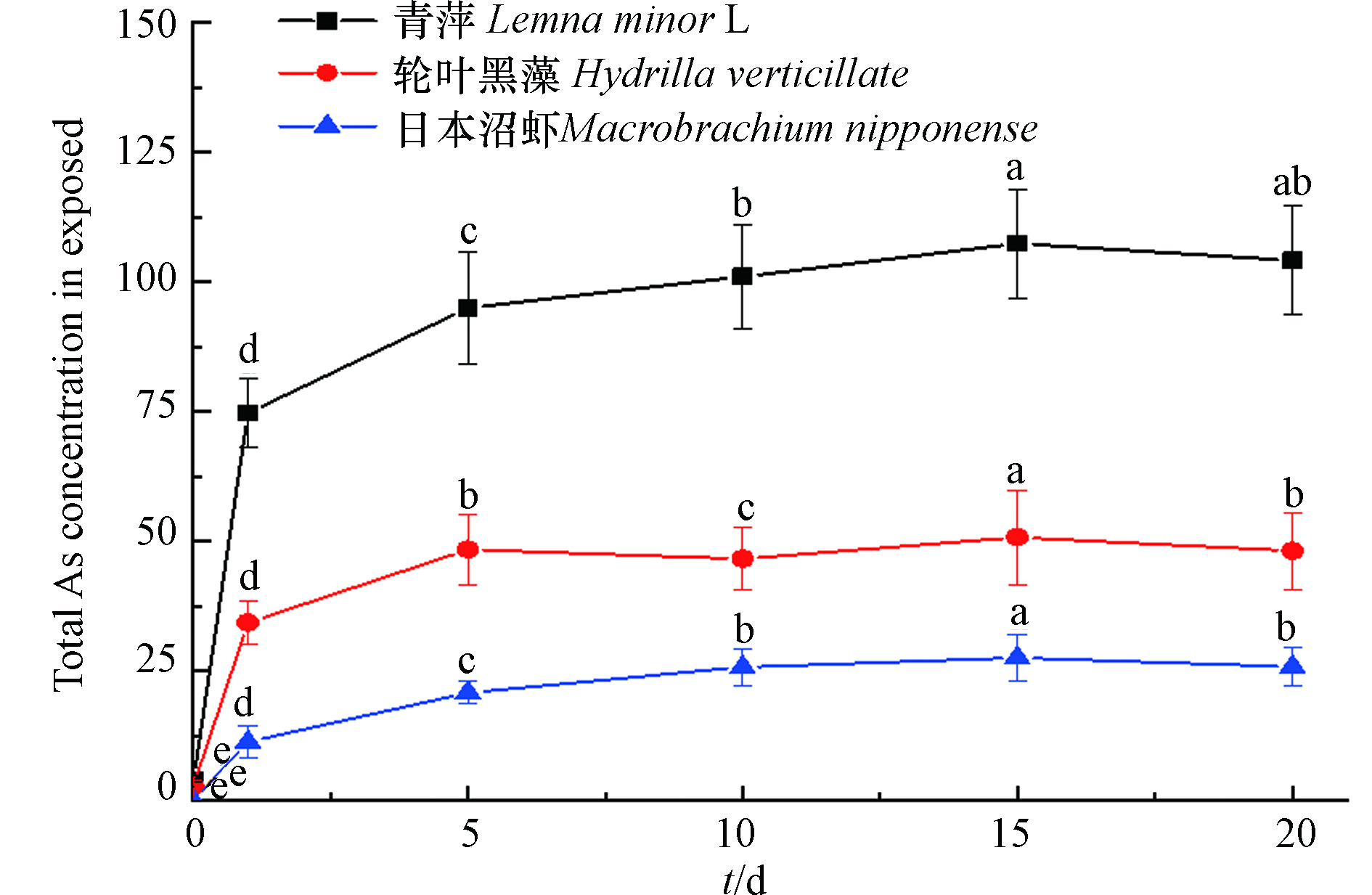
将食物相—青萍、轮叶黑藻、日本沼虾暴露培养于浓度为1 mg·L−1 As(Ⅴ)的水溶液中20 d,分别在第0、1、5、10、15、20 d取样后测定总砷及各形态砷的含量. 由图1可知,该浓度暴露培养的青萍能很好地生长,在暴露培养前期(0—5 d),青萍对砷的累积速率较快,随后逐渐减缓,其对砷的累积于第10—15 d趋于平衡. 轮叶黑藻对水中砷的累积于第5—10 d趋于平衡,较青萍先达到累积平衡,但其对总砷的累积量要小于青萍. 日本沼虾对水中砷的累积速度较慢,且累积的总砷量也小于水生植物,其对砷的累积于第10—15 d趋于平衡. 3种食物相中总砷的累积量均于第15 d达到峰值.
暴露培养15 d后,食物相体内累积的总As、As形态浓度及其占比如表1所示,青萍和轮叶黑藻体内As(Ⅲ)含量占比均最高,青萍体内检测出较高浓度的DMA和As(Ⅴ),而轮叶黑藻体内As(Ⅲ)和As(Ⅴ)则是主要的砷形态,占总砷含量的90%左右;在日本沼虾体内检测到了As(Ⅲ)、As(Ⅴ)、DMA、AsB 等4种形态的砷,并且它们在总砷中的占比有所不同,其中As(Ⅴ)是主要的砷形态,相比于前两种水生植物,虾体内检测出AsB且占比相对较高.
青萍对砷的累积速率较快,随后逐渐减缓,说明随着暴露时间的增加,植物体对水中较高的砷浓度有了一定适应性,这使得植物体对砷的生物积累降低[15]. 有研究发现沉水植物比浮水植物有较高的砷去除率[2,16],但实验中选用的轮叶黑藻根、茎、叶都较为稀疏,其能吸附和累积水中砷的效果相对较差;而浮水植物青萍,虽个体生物量小,但体内含水率高,经过实验冻干处理后,单位体积的含砷量则相对较高. As(Ⅲ)是植物体内主要的砷形态[17],甚至有些植物体内部分器官中As(Ⅲ)占总砷的比值可达92%以上,As(Ⅴ)在植物体内转化成As(Ⅲ),是植物的一种解毒机制[18]. 植物从环境中吸收与累积As(Ⅴ)之后,在其他条件不变的情况下,一般只转化为无机形态的砷,难以甲基化[19]. 在青萍体内检测到28%的DMA,说明青萍有大部分植物体不具备的甲基化能力,也曾有研究表明,在水生环境中浮水植物能将无机砷形态转化为甲基化形态. 当水体中砷浓度较高时,植物中的磷酸盐转运蛋白会主动吸收As(Ⅴ)[20],所以本研究中两种水生植物对As(Ⅴ)的吸收量较大. 轮叶黑藻能从含砷的水环境中累积砷,但其进入新环境时需要时间适应,所以对砷的转化能力相对较小,且由于其累积能力的有限性,对水中砷的累积也逐渐减少[21]. 轮叶黑藻体内检测到的DMA含量在总砷中的占比较小,说明轮叶黑藻对砷甲基化的能力小于青萍. 当实验开始,日本沼虾对水中砷的累积速度较两种水生植物慢,且累积的总砷量也小于两种水生植物. 暴露培养15 d后,在虾体内检测到了As(Ⅲ)、As(Ⅴ)、DMA、AsB 的4种形态砷,说明在日本沼虾体内持续发生砷的生物转化,将As(Ⅴ)还原为As(Ⅲ),然后甲基化为AsB或DMA[22]. 相较于两种植物相,日本沼虾体内有机砷占比较高,为39%。Zhang[8]等也发现,As(Ⅴ)暴露条件下的水生动物体内有机砷占比较植物高,在牡蛎(Saccostrea cucullata)和蛤蜊(Asaphis violascens)体内的有机砷占比可达78%和95%,这显著高于植物石莼(Ulva lactuca)体内所累积的有机砷(10%),此外,日本沼虾体内出现23%的AsB,刘淑晗等[23]在南极磷虾(Euphausia superba)的检测分析中也发现,AsB在总砷中的占比在11%左右。赵艳芳等[24]则发现,AsB是虾蛄(Oratosquilla oratoria)所有可食组织中的主要砷形态,其占总砷的75.0%—95.7%.
-
经过检测与分析食物相砷暴露的数据之后,选取暴露培养于第15 d的动植物样品投喂罗非鱼(第15 d食物相中累积的总砷和各砷形态含量处于相对平衡),经过食物相暴露的罗非鱼于第30 d取样。对鱼体肌肉组织总砷的测定发现,在30 d的培养周期内,尼罗罗非鱼经过摄食不同种类且含不同砷浓度的食物之后,体内均产生了对砷的累积,总As浓度显著高于背景浓度。不同的食物投喂罗非鱼后,在鱼的肌肉组织部分检测到的砷含量有所不同(P<0.05)。用青萍投喂的罗非鱼体内的总砷含量最高,轮叶黑藻投喂之后,在鱼体内检测到的砷含量次之,而用日本沼虾投喂后检测到的罗非鱼体内的总砷含量相对最低(图2A),这与青萍、轮叶黑藻、日本沼虾这3个食物相体内所累积总砷含量的变化趋势相一致. TTF可以在相对较短的暴露时间内更好地说明鱼体中砷的生物利用度,这些计算值远低于1(表2).
3种食物相暴露条件下,罗非鱼体内均检测出较高浓度的AsB,占比75%以上,此外,两种植物相暴露组的罗非鱼肌肉组织中出现不同浓度的其他各形态砷,依次为As(Ⅲ)、DMA、As(Ⅴ)和MMA,当用节肢动物日本沼虾投喂罗非鱼之后,检测到鱼体肌肉组织中所含的AsB占比要显著高于用两种植物投喂的实验组,在82%左右,而其他形态的砷占比则较小(表2). 在比较了3种食物相暴露条件下罗非鱼中有机砷与无机砷的比值后发现,不同食物组间存在较大差异(P<0.05),为投喂日本沼虾组>投喂轮叶黑藻组>投喂青萍组(图2B).
饮食摄入可能是鱼类砷生物富集的主要途径[25],也是无机砷进入鱼体的主要方式[26]。用不同的食物投喂罗非鱼后,鱼体内的总砷含量与青萍、轮叶黑藻、日本沼虾这3个食物相体内所累积的总砷含量的趋势相一致,说明鱼体肌肉组织中累积的砷含量与其饮食中食物相的砷含量相关. 本研究中,观察从第一营养级—青萍、轮叶黑藻、日本沼虾体内的含砷量,到利用它们投喂罗非鱼之后,第二营养级—罗非鱼体内累积的砷含量,可发现:随着营养级水平的增加,砷的含量有所下降,这与Fang[27]等在安徽巢湖研究食物网中微量金属的分布、生物富集和营养转移时,所发现的随着营养水平的增加,Pb、Cr、Cd、As和Hg的含量都有所下降的规律一致,Foust[13]也发现初级生产者中砷浓度为702 mg·kg−1,第二营养水平中为3.4 mg·kg−1,沿海地区顶层食物网中的砷含量小于1.3 mg·kg−1. 此外,砷的生物利用度可通过TTF进行量化,本研究中3种食物相暴露条件下,TFF的计算值都显著低于1,表明As在营养转移过程中没有在罗非鱼中生物放大[8]. 这与Maher[28]等的研究一致,他们在两种海草生态系统中未发现As生物放大的证据. 尽管食物相中所累积的砷形态浓度存在较大差异,但无论食用什么类型的食物,尼罗罗非鱼都能通过饮食作用将砷累积到体内[10],这表明As可沿食物链传递. 同样地,鱼在砷本底值相同的情况下,食用含砷的食物之后,体内肌肉组织中As(Ⅲ)、As(Ⅴ)和DMA在总砷中的占比上升,AsB的占比相应下降.
随着饮食中砷的长期暴露,鱼类的适应策略可能影响不同形态砷的含量[15],并且不同的饮食方式、不同的食物类型、生活环境和暴露时间,都可能使得鱼类肌肉组织中的砷形态不同[29]. 当鱼通过饮食摄入砷时,As(Ⅴ)具有转化为As(Ⅲ)并分布在鱼肉中的高潜力,As(Ⅴ)的高还原潜力和随后的传递能力都有助于鱼体对砷的累积,但在本研究中,鱼体的肌肉组织中检测到的As(Ⅴ)含量很小,可能的解释是:在暴露结束前,大部分的As(Ⅴ)被还原为As(Ⅲ),而As(Ⅲ)又甲基化为MMA、DMA,再进一步转化为AsB之后,才分布在鱼肉中[30]. 早在1989年Francesconi[31]就观察到黄眼鱼(Aldrichetta forsteri)在喂食了一系列含砷食物后,其肌肉组织中的As(Ⅴ)保留率较低. 在30 d的培养周期中,鱼体肌肉组织中仅检测到微量的MMA,这是由于MMA为甲基化过程的中间体[32],其代谢速度比其他中间体更快[33]. 通过对不同营养级生物中的砷形态进行检测发现,随着食物链中营养级的提高,有机砷占总砷的比值有所增加,其中出现了较高比值的AsB[8,34],这是水生动物有别于植物的砷解毒机制之一[22],海鱼可以将饮食接触后累积的80%的无机砷转化为AsB[10],也有研究发现,AsB是淡水鱼中的主要砷形态,其在总砷中的占比较高[35-38],与食用青萍相比,食用轮叶黑藻的罗非鱼肌肉组织中的AsB占比相对较高,当用含有不同砷形态的虾来投喂鱼之后,虽然鱼体累积的总砷含量小于用植物投喂的实验组,但鱼体肌肉组织中所含的AsB占比则要显著高于投喂植物的鱼体,说明投喂日本沼虾的罗非鱼对砷的生物转化能力更高,此外,在比较了不同食物相暴露组中罗非鱼体内有机砷与无机砷的比值后,发现投喂日本沼虾的罗非鱼体内有机砷与无机砷的比值最高,即投喂日本沼虾的罗非鱼对砷的生物转化能力最高,这可能与日本沼虾体内有机砷占比较两种植物高有关,暴露培养15 d后,日本沼虾体内有机砷占比为39%,分别高于青萍和轮叶黑藻11%、32%. 另一方面,在比较了食物相及罗非鱼体内各形态砷含量后发现,虽然食物相体内累积的As(Ⅴ)和As(Ⅲ)含量较高,但进入到鱼体中的这两种形态砷含量占比则较低,分别在0.3%—3%、8%—11%,这表明无机砷通过食物链进行传递时效率较有机砷低,因为它们在鱼肌肉组织中进行生物转化,而不是直接积累[8].
-
(1)当动植物暴露培养于含砷水环境时,它们都能吸收并累积水中的砷,且随着暴露时间的增加,水生生物对含砷水环境有了一定的适应性,使得砷的生物吸收与累积达到平衡.
(2)不同的生物对砷的累积和转化方式不同,水生动物更易将无机砷甲基化为毒性较小的AsB。尼罗罗非鱼摄食不同类型的食物之后,其肌肉组织中累积的砷含量不同,但总砷量与食物相中的浓度趋势相一致,为投喂青萍组>投喂轮叶黑藻组>投喂日本沼虾组,当罗非鱼通过食物摄入砷,相较于MMA和DMA,As(Ⅴ)更容易转化为As(Ⅲ),砷被蓄积与转化后主要以AsB的稳态形式存在.
(3)比较了不同食物相暴露组罗非鱼体内有机砷与无机砷的比值,投喂日本沼虾的罗非鱼对砷的生物转化能力最高。本研究中3种食物相暴露条件下,TFF的计算值都显著低于1,表明As可沿食物链传递,但在营养转移过程中没有在罗非鱼中生物放大.
食物相暴露条件下尼罗罗非鱼对砷的累积与转化
Accumulation and transformation of arsenic in Oreochromis niloticus under food phase exposure
-
摘要: 为研究不同类型、不同营养级的生物对砷(As)的累积与转化作用,采用室内培养试验,选取杂食性淡水鱼类尼罗罗非鱼(Oreochromis niloticus)为研究对象,让其分别摄食暴露于1 mg·L−1砷酸[As(Ⅴ)]水溶液中15 d的浮水植物青萍(Lemna minor L.)、沉水植物轮叶黑藻(Hydrilla verticillate)、节肢动物日本沼虾(Macrobrachium nipponense),研究不同食物相暴露条件下尼罗罗非鱼对砷的累积与转化作用. 结果发现,动植物能吸收并累积水中的砷,且随着暴露时间的增加,其对含砷水环境有一定的适应性;尼罗罗非鱼摄食不同类型的食物之后,其肌肉组织中累积的砷含量不同,但总砷量与食物相中的浓度趋势一致,为投喂青萍组>投喂轮叶黑藻组>投喂日本沼虾组;当罗非鱼通过食物摄入砷,相较于一甲基砷酸(MMA) 和二甲基砷酸(DMA),As(Ⅴ)更容易转化为亚砷酸[As(Ⅲ)],砷被蓄积与转化后主要以砷甜菜碱(AsB)的稳态形式存在;不同生物对砷的累积和转化方式不同,水生动物更易将无机砷甲基化为毒性较小的AsB;投喂日本沼虾的罗非鱼对砷的生物转化能力最高,砷在营养转移过程中可沿食物链传递但没有在罗非鱼中生物放大.Abstract: In order to study the accumulation and transformation of arsenic(As) by different types and different trophic levels of organisms, an indoor culture experiment was carried out. The omnivorous freshwater fish Oreochromis niloticus was selected as the research object, and they were exposed to the floating plant Lemna minor L.
, submerged plant Hydrilla verticillate and arthropod Macrobrachium nipponense which exposed to 1 mg·L−1 arsenate [As(Ⅴ)] aqueous solution for 15 days to study the accumulation and transformation of arsenic in Oreochromis niloticus under different food exposure conditions. The results show that animals and plants can absorb and accumulate arsenic in ponding, and they have a certain adaptability to arsenic containing water environment with the increase of exposure time; After feeding different types of food, the arsenic content accumulated in muscle tissue of Oreochromis niloticus was different, but the total arsenic content was consistent with the concentration trend in food phase, which was feeding Lemna minor L. group > feeding Hydrilla verticillate group > feeding Macrobrachium nipponense group; When Oreochromis niloticus ingests arsenic through food, compared with monomethyl arsenic (MMA) and dimethyl arsenic (DMA), As(Ⅴ) was easier to convert to arsenite [As(Ⅲ)]. After arsenic was accumulated and transformed, it mainly existed in the steady-state form of arsenic betaine (AsB) in fish; Different organisms had different ways of arsenic accumulation and transformation. Aquatic animals were more likely to methylate inorganic arsenic into less toxic AsB; Oreochromis niloticus fed with Macrobrachium nipponense had the highest biotransformation ability of arsenic, and arsenic can be transferred along the food chain during nutrient transfer, but it was not biomagnified in fish. -
Key words:
- Oreochromis niloticus /
- arsenic /
- food chain /
- trophic transfer /
- bioaccumulation /
- biotransformation
-

-
表 1 暴露15 d食物相体内累积的总As、As形态浓度及其占比
Table 1. Total As, As species concentrations and distribution in exposed food after exposure for 15 d
As形态浓度(μg·g−1)
As species concentrations总As浓度/(μg·g−1)
Total AsAs(Ⅲ) As(Ⅴ) DMA AsB 青萍 47.06±6.23
(44.11%±5.18%)29.39±2.19
(27.54%±1.45%)30.25±2.78
(28.35%±4.28%)ND 104.18±10.42 轮叶黑藻 26.25±2.53
(51.74%±6.01%)20.86±1.39
(41.11%±2.71%)3.63±0.93
(7.15%±1.39%)ND 48.15±7.41 日本沼虾 2.14±1.23
(7.77%±5.18%)14.79±2.19
(53.72%±1.45%)4.20±2.78
(15.25%±4.28%)6.41±1.21
(23.27%±2.65%)25.81±3.71 ND,未检出. 括号内数值为占比. ND, not detected. The value in brackets is the proportion. 表 2 不同食物投喂30 d后鱼体肌肉中累积的总As、As形态浓度及其占比
Table 2. Total As, As species concentrations and distribution in the musle of fish after different dietborne exposure for 30 d
As形态浓度(μg·g−1)
As species concentrations营养转移
因子(TTF)
Trophic Transfer
FactorAs(Ⅲ) As(Ⅴ) MMA DMA AsB CK 0.02±0.07
(5.46%±2.92%)ND ND ND 0.38±0.06
(94.54%±7.67%)投喂青萍组 0.31±0.03
(11.12%±1.89%)0.10±0.02
(3.46%±0.48%)0.03±0.01
(0.91%±0.23%)0.25±0.05
(9.03%±1.40%)2.08±0.22
(75.47%±3.53%)0.026 投喂轮叶黑藻组 0.16±0.07
(10.25%±3.17%)0.05±0.01
(3.46%±0.85%)0.01±0.01
(0.91%±0.20%)0.11±0.02
(7.03%±2.17%)1.23±0.43
(78.35%±3.83%)0.033 投喂日本沼虾组 0.08±0.07
(8.37%±1.00%)0.003±0.006
(0.27%±0.23%)ND 0.08±0.02
(8.37%±2.01%)0.81±0.12
(82.98%±4.20%)0.038 注:括号内数值为占比. Note: The value in brackets is the proportion. -
[1] MARABOTTINI R, STAZI S R, PAPP R, et al. Mobility and distribution of arsenic in contaminated mine soils and its effects on the microbial pool [J]. Ecotoxicology and Environmental Safety, 2013, 96: 147-153. doi: 10.1016/j.ecoenv.2013.06.016 [2] 张楠, 韦朝阳, 杨林生. 淡水湖泊生态系统中砷的赋存与转化行为研究进展 [J]. 生态学报, 2013, 33(2): 337-347. doi: 10.5846/stxb201111171751 ZHANG N, WEI C Y, YANG L S. Advance in research on the occurrence and transformation of arsenic in the freshwater lake ecosystem [J]. Acta Ecologica Sinica, 2013, 33(2): 337-347(in Chinese). doi: 10.5846/stxb201111171751
[3] 吴丰昌, 孟伟, 宋永会, 等. 中国湖泊水环境基准的研究进展 [J]. 环境科学学报, 2008, 28(12): 2385-2393. doi: 10.3321/j.issn:0253-2468.2008.12.001 WU F C, MENG W, SONG Y H, et al. Research progress in lake water quality criteria in China [J]. Acta Scientiae Circumstantiae, 2008, 28(12): 2385-2393(in Chinese). doi: 10.3321/j.issn:0253-2468.2008.12.001
[4] SCHAEFFER R, FRANCESCONI K A, KIENZL N, et al. Arsenic speciation in freshwater organisms from the river Danube in Hungary[J]. Talanta. 2006, 69(4): 856-865. [5] TISLER T, ZAGORC-KONCAN J. Acute and chronic toxicity of arsenic to some aquatic organisms [J]. Bulletin of Environmental Contamination and Toxicology, 2002, 69(3): 421-429. doi: 10.1007/s00128-002-0079-5 [6] HUNTER D A, GOESSLER W, FRANCESCONI K A. Uptake of arsenate, trimethylarsine oxide, and arsenobetaine by the shrimp Crangon crangon [J]. Marine Biology, 1998, 131(3): 543-552. doi: 10.1007/s002270050346 [7] KUROIWA T, OHKI A, NAKA K, et al. Biomethylation and biotransformation of arsenic in a freshwater food chain: Green alga (Chlorella vulgaris) shrimp (Neocaridina denticulata) killifish (Oryzias iatipes) [J]. Applied Organometallic Chemistry, 1994, 8(4): 325-333. doi: 10.1002/aoc.590080407 [8] ZHANG W, WANG W X, ZHANG L. Comparison of bioavailability and biotransformation of inorganic and organic arsenic to two marine fish [J]. Environmental Science & Technology, 2016, 50(5): 2413-2423. [9] KNAUER K, BEHRA R, HEMOND H. Toxicity of inorganic and methylated arsenic to algal communities from lakes along an arsenic contamination gradient [J]. Aquatic Toxicology, 1999, 46(3/4): 221-230. [10] ZHANG W, CHEN L Z, ZHOU Y Y, et al. Biotransformation of inorganic arsenic in a marine herbivorous fish Siganus fuscescens after dietborne exposure [J]. Chemosphere, 2016, 147: 297-304. doi: 10.1016/j.chemosphere.2015.12.121 [11] CUI D, ZHANG P, LI H P, et al. The dynamic effects of different inorganic arsenic species in crucian carp (Carassius auratus) liver during chronic dietborne exposure: Bioaccumulation, biotransformation and oxidative stress [J]. Science of the Total Environment, 2020, 727: 138737. doi: 10.1016/j.scitotenv.2020.138737 [12] CHEN C Y, PICKHARDT P C, XU M Q, et al. Mercury and arsenic bioaccumulation and eutrophication in Baiyangdian Lake, China [J]. Water, Air, and Soil Pollution, 2008, 190(1/2/3/4): 115-127. [13] FOUST R D Jr, BAUER A M, COSTANZA-ROBINSON M, et al. Arsenic transfer and biotransformation in a fully characterized freshwater food web [J]. Coordination Chemistry Reviews, 2016, 306: 558-565. doi: 10.1016/j.ccr.2015.03.005 [14] 安艳, 李贞, 王三祥, 等. HPLC-ICP-MS在砷形态分析中应用 [J]. 中国公共卫生, 2008, 24(12): 1416-1418. doi: 10.3321/j.issn:1001-0580.2008.12.065 AN Y, LI Z, WANG S X, et al. Application of HPLC-ICP-MS in speciation analysis of arsenic [J]. Chinese Journal of Public Health, 2008, 24(12): 1416-1418(in Chinese). doi: 10.3321/j.issn:1001-0580.2008.12.065
[15] ERICKSON R J, MOUNT D R, HIGHLAND T L, et al. The effects of arsenic speciation on accumulation and toxicity of dietborne arsenic exposures to rainbow trout [J]. Aquatic Toxicology, 2019, 210: 227-241. doi: 10.1016/j.aquatox.2019.03.001 [16] 王谦, 成水平. 大型水生植物修复重金属污染水体研究进展 [J]. 环境科学与技术, 2010, 33(5): 96-102. doi: 10.3969/j.issn.1003-6504.2010.05.022 WANG Q, CHENG S P. Review on phytoremediation of heavy metal polluted water by macrophytes [J]. Environmental Science & Technology, 2010, 33(5): 96-102(in Chinese). doi: 10.3969/j.issn.1003-6504.2010.05.022
[17] XU X Y, MCGRATH S P, ZHAO F J. Rapid reduction of arsenate in the medium mediated by plant roots[J]. The New Phytologist, 2007(3), 176: 590-599. [18] PICKERING I J, PRINCE R C, GEORGE M J, et al. Reduction and coordination of arsenic in Indian mustard [J]. Plant Physiology, 2000, 122(4): 1171-1178. doi: 10.1104/pp.122.4.1171 [19] 黄永炳, 王丽丽, 李晓娟, 等. 砷形态转化及其环境效应研究 [J]. 环境污染与防治, 2013, 35(1): 16-19,34. doi: 10.3969/j.issn.1001-3865.2013.01.004 HUANG Y B, WANG L L, LI X J, et al. Transformation of arsenic species and its environmental effect [J]. Environmental Pollution & Control, 2013, 35(1): 16-19,34(in Chinese). doi: 10.3969/j.issn.1001-3865.2013.01.004
[20] KHANG H V, HATAYAMA M, INOUE C. Arsenic accumulation by aquatic macrophyte coontail (Ceratophyllum demersum L. ) exposed to arsenite, and the effect of iron on the uptake of arsenite and arsenate [J]. Environmental and Experimental Botany, 2012, 83: 47-52. doi: 10.1016/j.envexpbot.2012.04.008 [21] XUE P Y, YAN C Z. Arsenic accumulation and translocation in the submerged macrophyte Hydrilla verticillata (1. f. ) royle [J]. Chemosphere, 2011, 85(7): 1176-1181. doi: 10.1016/j.chemosphere.2011.09.051 [22] SÖRÖS C, BODÓ E T, FODOR P, et al. The potential of arsenic speciation in molluscs for environmental monitoring [J]. Analytical and Bioanalytical Chemistry, 2003, 377(1): 25-31. doi: 10.1007/s00216-003-1971-5 [23] 刘淑晗, 张海燕, 娄晓祎, 等. 高效液相色谱-(紫外)氢化物发生原子荧光光谱法测定南极磷虾及其制品中6种砷形态 [J]. 分析测试学报, 2019, 38(9): 1085-1090. doi: 10.3969/j.issn.1004-4957.2019.09.009 LIU S H, ZHANG H Y, LOU X Y, et al. Determination of six arsenic speciations in Antarctic krill and its products using high performance liquid chromatography-(ultraviolet)hydride generation-atomic fluorescence spectrometry [J]. Journal of Instrumental Analysis, 2019, 38(9): 1085-1090(in Chinese). doi: 10.3969/j.issn.1004-4957.2019.09.009
[24] 赵艳芳, 康绪明, 宁劲松, 等. 虾蛄可食组织中镉和砷的形态及分布特征 [J]. 食品科学, 2020, 41(8): 282-287. doi: 10.7506/spkx1002-6630-20190119-229 ZHAO Y F, KANG X M, NING J S, et al. Speciation and distribution characteristics of cadmium and arsenic in the edible tissues of Oratosquilla oratoria [J]. Food Science, 2020, 41(8): 282-287(in Chinese). doi: 10.7506/spkx1002-6630-20190119-229
[25] CUI D, ZHANG P, LI H P, et al. The dynamic changes of arsenic biotransformation and bioaccumulation in muscle of freshwater food fish crucian carp during chronic dietborne exposure [J]. Journal of Environmental Sciences, 2021, 100: 74-81. doi: 10.1016/j.jes.2020.07.005 [26] ZHANG W, HUANG L M, WANG W X. Arsenic bioaccumulation in a marine juvenile fish Terapon jarbua [J]. Aquatic Toxicology, 2011, 105(3/4): 582-588. [27] FANG T, LU W X, CUI K, et al. Distribution, bioaccumulation and trophic transfer of trace metals in the food web of Chaohu Lake, Anhui, China [J]. Chemosphere, 2019, 218: 1122-1130. doi: 10.1016/j.chemosphere.2018.10.107 [28] MAHER W A, FOSTER S D, TAYLOR A M, et al. Arsenic distribution and species in two Zostera capricorni seagrass ecosystems, New South Wales, Australia [J]. Environmental. Chemistry, 2011, 8(1): 9. doi: 10.1071/EN10087 [29] JIA Y Y, WANG L, LI S, et al. Species-specific bioaccumulation and correlated health risk of arsenic compounds in freshwater fish from a typical mine-impacted river [J]. Science of the Total Environment, 2018, 625: 600-607. doi: 10.1016/j.scitotenv.2017.12.328 [30] RADABAUGH T R, APOSHIAN H V. Enzymatic reduction of arsenic compounds in mammalian systems: Reduction of arsenate to arsenite by human liver arsenate reductase [J]. Chemical Research in Toxicology, 2000, 13(1): 26-30. doi: 10.1021/tx990115k [31] FRANCESCONI K A, EDMONDS J S, STICK R V. Accumulation of arsenic in yelloweye mullet (Aldrichetta forsteri) following oral administration of organoarsenic compounds and arsenate [J]. Science of the Total Environment, 1989, 79(1): 59-67. doi: 10.1016/0048-9697(89)90053-3 [32] HELLWEGER F L, LALL U. Modeling the effect of algal dynamics on arsenic speciation in Lake Biwa [J]. Environmental Science & Technology, 2004, 38(24): 6716-6723. [33] ZHANG W, HUANG L M, WANG W X. Biotransformation and detoxification of inorganic arsenic in a marine juvenile fish Terapon jarbua after waterborne and dietborne exposure [J]. Journal of Hazardous Materials, 2012, 221/222: 162-169. doi: 10.1016/j.jhazmat.2012.04.027 [34] MAEDA S, MAWATARI K, OHKI A, et al. Arsenic metabolism in a freshwater food chain: Blue-green alga (Nostoc sp. )→shrimp (Neocaridina denticulata)→carp (Cyprinus carpio) [J]. Applied Organometallic Chemistry, 1993, 7(7): 467-476. doi: 10.1002/aoc.590070705 [35] BEARS H, RICHARDS J G, SCHULTE P M. Arsenic exposure alters hepatic arsenic species composition and stress-mediated gene expression in the common killifish (Fundulus heteroclitus) [J]. Aquatic Toxicology, 2006, 77(3): 257-266. doi: 10.1016/j.aquatox.2005.12.008 [36] CUI D, ZHANG P, LI H P, et al. Biotransformation of dietary inorganic arsenic in a freshwater fish Carassius auratus and the unique association between arsenic dimethylation and oxidative damage [J]. Journal of Hazardous Materials, 2020, 391: 122153. doi: 10.1016/j.jhazmat.2020.122153 [37] SUHENDRAYATNA, OHKI A, NAKAJIMA T, et al. Studies on the accumulation and transformation of arsenic in freshwater organisms I. Accumulation, transformation and toxicity of arsenic compounds on the Japanese Medaka, Oryzias latipes [J]. Chemosphere, 2002, 46(2): 319-324. doi: 10.1016/S0045-6535(01)00084-4 [38] SUHENDRAYATNA, OHKI A, NAKAJIMA T, et al. Studies on the accumulation and transformation of arsenic in freshwater organisms II. Accumulation and transformation of arsenic compounds by Tilapia mossambica [J]. Chemosphere, 2002, 46(2): 325-331. doi: 10.1016/S0045-6535(01)00085-6 -



 下载:
下载:


