-
全氟烷基化合物(perfluorinated allkyl substances,PFASs)是一类由有机氟烷基链和亲水性官能团组成的新型有机物,化学通式为F(CF2)n—R,其中R为亲水性官能团. 自20世纪50年代被3M公司首次合成以来,PFASs至今已有70多年的使用历史[1-2]. 环境中存在的PFASs主要包括全氟烷基羧酸类(PFCAs)、全氟烷基磺酸类(PFSAs)、氟调聚醇类(FTOHs)、全氟酰胺类(FOSAs)和全氟聚醚类,几种典型的PFASs见表1[3-5]. 在众多PFASs中,全氟辛酸(PFOA)和全氟辛烷磺酸(PFOS)最具代表性,由于它们的生产使用量较大,同时也是多种PFASs在环境和生物体内转化的最终产物,因此环境检出频率极高[6-7]. PFASs具有良好的疏水疏油性、耐高温、耐强氧化性以及一定的表面活性,被广泛应用于生产生活中,如纺织、皮革、电镀等工业生产过程,食品包装材料、服装防水涂层及地毯抛光剂等民用产品[8-9]. 与传统持久性有机污染物类似,PFASs可通过“蚱蜢跳效应”造成全球性污染,不仅在人群居住地附近的水体、灰尘、土壤等环境介质中有不同程度的检出,对南北极冰川以及高原雪山也有不同程度的污染[10-11]. 环境中的PFASs可以通过多种途径进入人体,其中最主要的是饮用水摄入和食物链传递. 进入人体的PFASs的半衰期可达数年之久,同时还可能诱导多种疾病的发生,如肝脏损伤、免疫性疾病、生殖和神经系统疾病等[12-13]. 更为严重的是,有研究发现PFASs还具有一定的致畸致癌效应[14].
考虑到PFASs对生态环境和人体健康的危害,美国、加拿大以及欧盟在内的多个国家和地区已经全面禁止了PFOA和PFOS的生产,仅在半导体、航空液压油、电镀和照相业等少数短期内缺乏替代物的工业领域允许继续使用[15-16]. PFOS和PFOA也于2009年和2015年相继被列入到斯德哥尔摩公约持久性有机污染物优先控制名录中,而我国作为斯德哥尔摩公约的缔约国,也已禁止了PFOA和PFOS的生产使用[17-19]. 尽管如此,PFASs的环境持久性使得其在自然环境中仍然广泛存在[20]. 与此同时,与PFOA和PFOS具有类似结构的PFASs替代物也被不断生产使用[21]. 因此,亟需开发出可高效处理这类污染物的技术.
目前,现有的PFASs的去除技术主要包括吸附、化学氧化、化学还原和生物降解四类[22],但都存在不同程度的缺点,如反应条件苛刻、选择性较差、能耗较高以及易产生二次污染等. 前人已对上述技术分别进行了综述[6-7, 23-26],在此基础上,本文不仅整理归纳了PFASs的各类去除技术,内容全面,还对不同类别技术的常用材料、去除效率、反应时间、能耗、反应机理和优缺点进行了详细的阐述和对比,更直观的总结归纳了目前研究所存在的问题、面临的挑战和发展前景,指导意义强,希望能为开发更高效的PFASs去除技术提供参考.
-
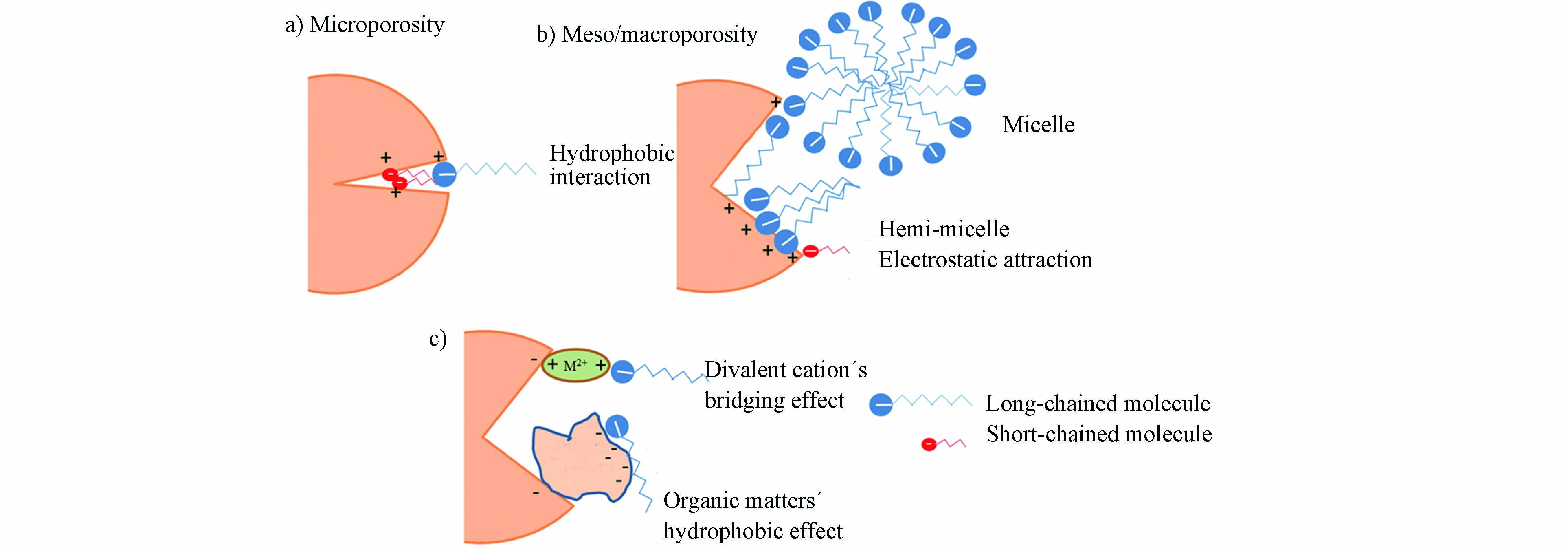
吸附技术主要利用吸附剂对吸附质的吸引作用,将污水中的PFASs富集于吸附剂表面,从而降低污水中PFASs的浓度. 常用的吸附剂主要包括活性炭(AC)、离子交换树脂,矿物和其他新型吸附材料等. 由于具有成本低廉,操作简便,去除效率高的优点,吸附技术现已被广泛应用于污水处理. 吸附法去除水中PFASs的原理主要包括疏水作用、静电作用、离子交换、桥连作用、氢键作用、范德华力、配体交换中的一种或几种[23, 27]. 如图1所示,PFASs多以阴离子的形式存在于溶液中,故主要通过静电作用和疏水作用吸附于AC的表面,当溶液中存在有机物或金属离子时,桥连作用也会促进上述吸附过程的发生[28]. 对于离子交换树脂,PFASs主要通过离子交换和静电吸引作用吸附于其表面. 对于矿物材料,配体交换、氢键作用和静电作用在PFASs的吸附过程中占主导地位. 而对于带有氨基、羟基(·OH)的新型吸附材料,其能与阴离子型PFASs发生偶极相互作用,将PFASs有效吸附[27]. 吸附技术去除PFASs的主要影响因素有吸附材料的性质、PFASs的物理化学性质、溶液pH、无机离子和共存有机物等[29-30].
-
AC是一种优良的吸附剂,因具有较大的比表面积、发达的孔隙结构、丰富的表面官能团和对疏水性有机物的高亲和性而被广泛应用于多种有机污染物的处理过程. Xiao等利用颗粒活性炭(GAC)处理受30余种PFASs污染的饮用水,结果显示GAC对不同种类的PFASs均有吸附,对PFOA和PFOS的最大吸附率可达90%以上[30]. Yu等对比研究了不同种类AC对PFOA和PFOS的吸附,结果表明AC的粒径对吸附过程有显著影响,GAC(0.9—1.0 mm)对PFOA和PFOS的最大吸附量分别为0.39 mmol·g−1和0.37 mmol·g−1,而粒径更小的粉末活性炭(PAC,< 0.1 mm)对PFOA和PFOS的吸附效率更高,最大吸附量可达0.67 mmol·g−1和1.04 mmol·g−1[31]. 随后该课题组又研究了pH对上述吸附过程的影响,结果显示酸性环境有利于吸附的进行,在pH 3的环境中,AC对PFOA和PFOS的最大吸附量分别为0.38 mmol·g−1和0.51 mmol·g−1,而在pH 7的环境中,AC的最大吸附量则降低至0.3 mmol·g−1和0.41 mmol·g−1,这可能是因为酸性环境下PFOA和PFOS为分子态,与AC的疏水相互作用更强[31]. Xiao等研究了AC对不同结构PFASs的吸附,结果显示AC对长链PFASs的吸附效率较高,但平衡时间较长,而对短链PFASs几乎没有吸附[30]. 为提高AC对PFASs的吸附性能,研究人员使用生物质原料、氢氧化钾、金属氧化物、季铵盐等多种方法对AC进行了改性,并取得了较好的效果[32-33].
离子交换树脂由树脂基体骨架和骨架上的活性离子基团构成,具有化学稳定性好,交换能力强,可再生能力强等优点,是一种常用的工业废水末端处理技术. Senevirathna等对比研究了两种离子交换树脂,3种非离子交换树脂和一种GAC对PFOS的吸附去除,结果显示对于低浓度(1 μg·L−1)PFOS,离子交换树脂、非离子交换树脂对其的吸附量分别是GAC的4倍和3倍;对于较高浓度(>1 μg·L−1)PFOS,离子交换树脂对其的吸附效果最佳. 吸附动力学实验表明,离子交换树脂和GAC在4 h内即能达到吸附平衡,非离子交换树脂则需要10—80 h不等[34],这可能是因为PFOS在水中呈离子态,故与离子交换树脂之间的静电作用较强,结合能力更强. Zaggia等研究了3种阴离子交换树脂(A520E、A600E、A532E)对饮用水中4种痕量PFASs的去除,结果显示3种树脂对PFASs的吸附能力与其交换官能团的疏水性具有很强的相关性,高疏水性的A532E对PFOS的吸附能力最强,最大吸附量可达260.5 mg·g−1. 进一步研究3种树脂的可重复利用性,结果显示A520E(中度疏水性)和A600E(非疏水性)可通过氯化铵稀溶液或氨水洗涤再生,而A532E则需要甲醇或乙醇和1%氯化铵的混合浓溶液才可以实现再生,可重复利用性较差[35]. 在实际应用中,Park等利用磁性离子交换树脂处理地下水中初始浓度约为300 ng·L−1的PFASs,当树脂用量大于15 mL·L−1时,PFASs的去除率达到80%以上[36].
天然矿物一般具有可调节的介孔或可变的层状结构,通常被认为是一类环境友好型吸附材料. Zhao等研究了4种PFASs在蒙脱石(MMT)、高岭石(KL)和赤铁矿(HM)上的吸附,结果显示3种矿物材料对PFASs的吸附能力排序为HM > KL > MMT,但最大吸附量只有不到350 μg·g−1 [37]. 为提高天然矿物对PFASs的吸附效果,研究人员对其进行了一系列改性. Zhou等研究了十六烷基三甲基溴化铵(CTAB)改性的MMT对PFOS的吸附,并通过改变有机碳含量,以获得对PFOS的最佳吸附性能,结果显示随着CTAB含量的增加,MMT的层间距不断增大,对PFOS的吸附量也逐渐增加[38]. 考虑到CTAB具有潜在的生物毒性,Wang等利用天然阳离子表面活性剂肉碱和胆碱改性的MMT吸附PFOA,结果显示改性后的MMT对PFOA的结合能力从0.31 mol·kg−1分别提高到0.43 mol·kg−1和0.34 mol·kg−1,故对PFASs污染水体具有更好的处理效果,应用前景良好[39]. 进一步考虑到水中共存有机物的干扰,Du等研究了有机氟阳离子表面活性剂改性的MMT对水中PFASs的去除,基于有机氟阳离子表面活性剂与PFASs之间的相似相溶原理和静电吸引作用,改性MMT对PFASs的吸附效率较高,且吸附PFASs后的MMT还可以通过甲醇溶液的洗脱实现重生再利用,重复吸附脱附实验5次后,MMT对PFASs的吸附效率几乎不变[40]. 后续该课题组还在黏土层间原位合成了磁性铁矿,进一步实现了吸附PFASs后的矿物材料的快速分离和再利用[41].
-
为提高吸附剂对PFASs的吸附性能和抗环境干扰性,具有高选择性去除PFASs的有机聚合材料逐渐成为该领域的研究热点. Ji等开发出一种胺功能化共价有机骨架,成功实现了对环境水体中PFASs的快速吸附,在所研究的13种PFASs中,胺功能化共价有机骨架对其中12种的去除率均能达到90%以上[42]. Zhang等合成了一种交联壳聚糖生物吸附剂,其对PFOS的最大吸附量可达5.5 mmol·g−1,远远高于被报道的AC和树脂,应用前景良好[43]. Guo等以碳微球为载体合成了一种新型分子印迹聚合物成功实现了在酸性条件下对PFOS的特异性去除,在pH 3的环境中,新型分子印迹聚合物对PFOS的吸附量可达75.99 mg·g−1,吸附平衡时间约为1 h[44]. Xiao等制备了以β-环糊精为基础的聚合物网络材料,成功将1 μg·L−1 PFOA的浓度降至10 ng·L−1以下,达到美国环保署规定的饮用水中PFOA的健康限制浓度(70 ng·L−1),且吸附过程不受水中共存有机物的影响[45]. Bhattarai等进一步研究发现伯胺化的β-环糊精可与PFASs阴离子通过二次电子重排实现对其的高效选择性去除,去除率接近100%[46]. 上述研究结果也使更多的科研人员开始着手PFASs高效选择性吸附材料的开发.
综上所述,尽管上述吸附材料能够实现对水中PFASs的去除,但每一项技术都存在着实际应用的瓶颈. AC作为一种亲脂性吸附剂,对疏水疏脂性PFASs的作用力较弱,特别是对痕量PFASs的去除效率极低,且吸附过程易受环境中共存物质的干扰[46]. 对于离子交换树脂,由于天然水体中存在很多与PFASs相同电性的其他物质,静电作用能否实现对PFASs的选择性吸附依然存疑. 而对于有机改性矿物材料,改性剂本身的稳定性和毒性使得该技术在实际应用中具有较大的不确定性. 一些高效选择性吸附PFASs的新型材料虽然实现了对环境浓度PFASs的高效去除,但昂贵的成本也使得其很难大规模商用. 因此,对无毒无害,高效廉价的选择性吸附剂的开发,是未来的一大研究趋势.
此外,吸附技术只是将PFASs从一相转移到了另一相,并未真正将其去除,必须结合相关降解技术,才能真正达到将PFASs无害化处理的目的. 如Baghirzade等报道了吸附PFASs后的GAC可以通过热解再生,被吸附的PFASs也会同时被高温降解矿化[47]. Führer等将吸附PFASs后的阴离子交换树脂与醇混合,通过加热促进酯化反应的发生,形成酯化氟化物,后再通过蒸馏和皂化反应得到高纯度的PFASs,成功实现了对废水中PFASs的去除和回收[48].
-
化学氧化技术主要利用·OH和硫酸根自由基(SO4·-)等具有强氧化性的活性物质氧化降解污染物,使高毒性污染物转化为低毒或无毒化合物. 目前应用于PFASs降解的化学氧化技术主要包括Fenton和类Fenton反应体系、硫酸根自由基降解体系、电化学降解体系、光催化降解体系和超声化学降解体系等. 因为具有技术成熟、降解效果良好、操作简便等优点而受到环境人的推崇,现已成为处理有机污染物的重要方法之一. 化学氧化技术去除水中PFASs的原理主要为脱羧-羟基化-消去-水解[49-52]. 如图2所示,以电化学降解技术为例,其去除PFCAs的机理主要有两种:一种是脱羧-羟基化-消去:PFCA(CnF2n+1COO−)首先被电化学阳极夺去一个电子生成CnF2n+1COO·,后脱去羧基生成CnF2n+1·,再与·OH反应生成不稳定的醇(CnF2n+1OH),CnF2n+1OH在·OH的作用下脱去H2O和CF2O变成Cn-1F2n-1·,再重复与·OH的反应实现逐渐的短链化,最终完全矿化为氟离子和二氧化碳;一种是脱羧-羟基化-消去-水解:体系中生成的不稳定的醇(CnF2n+1OH)消去氢原子和氟原子生成Cn-1F2n-1COF,再进一步通过水解反应生成PFCA(Cn-1F2n-1COO−),后不断重复上述反应生成碳链更短的PFCAs,最终完全矿化为氟离子和二氧化碳. 而PFSAs则是在阳极的作用下先脱去磺酸基团转化为PFCAs,再进行上述反应[52]. 化学氧化技术去除PFASs的主要影响因素有PFASs的物理化学性质、反应温度、溶液pH、无机离子和共存有机物等[53-55].
-
Fenton和类Fenton反应体系主要利用·OH与目标污染物中的氢原子反应而氧化降解污染物[56]. ·OH可通过过氧化氢(H2O2)光解或亚铁离子活化、臭氧氧化和超声分解等途径产生. Tang等研究了紫外(UV)-Fenton体系对PFOA的降解,结果显示体系中的·OH和Fe3+将PFOA转化为了氟离子和短链PFCAs[57]. Huang等使用光催化和臭氧氧化技术联合降解PFOA,反应4 h后,PFOA的降解率达到99.1%,是单独UV/二氧化钛(TiO2)和UV/臭氧体系的4.18倍和3.01倍. 在PFOA的降解过程中,光生空穴起着主导作用,而臭氧的加入不仅能够快速与光生电子反应而保护光生空穴,还能生成·OH参与PFOA的转化,从而促进了对PFOA的降解效率[58]. Lin等研究了碱性条件下,臭氧氧化技术对PFOA和PFOS的去除,并通过添加适量的H2O2溶液,进一步提高·OH的产率,反应4 h后,PFOA和PFOS的降解率达到99%,但未分析降解路径和产物[59]. 尽管上述研究显示·OH在一些特殊条件下能够降解PFASs,但也受到了一些学者的质疑. Mitchell等利用Fe3+催化H2O2产生的·OH和超氧阴离子等活性物质降解PFOA,反应2.5 h后,PFOA的降解率达到89%. 随后该团队比较了3种活性物质对PFOA的降解情况,当只有·OH存在的情况下,PFOA不发生任何降解[60]. 此外,对于FTOH、FOSA等PFCAs、PFSAs前体物质,·OH也只能促进其向更难降解的PFOA、PFOS转化,而无法真正将其矿化. Ellis等在光化学烟雾(主要含有·OH、一氧化氮和氧气)箱中模拟了3种FTOHs的降解过程,降解产物主要包括PFOA、全氟壬酸(PFNA)和其他的短链PFCAs[61]. Plumlee等利用H2O2光解产生的·OH降解N-乙基全氟辛基磺酰胺(N-EtFOSA)等全氟表面活性剂,结果显示·OH只能将几种全氟表面活性剂转化为PFOA和PFOS,而不能促进进一步转化[62]. Lv等研究了FOSA在天然黏土矿物表面的光转化行为,结果显示矿物表面活性氧产生的·OH只能促进FOSA最终转化为PFOA和PFOS[63].
-
SO4·-降解体系主要利用SO4·-氧化降解污染物,相比于·OH,SO4·-具有相似的氧化能力,更长的半衰期和更广的pH适用范围,因此对污染物的矿化程度更高[64]. SO4·-主要通过过硫酸盐(PS)和过一硫酸盐(PMS)的活化产生,活化方式主要包括热活化、光活化、过渡金属活化和超声活化等. Liu等利用热活化PS产生的SO4·-降解PFOA,在85 ℃的反应条件下,0.5 µmol·L−1的PFOA在30 h内即可降解完全,降解产物为氟离子和二氧化碳[65]. Qian等利用UV活化PS产生的SO4·-降解PFOA,反应8 h后,150 µmol·L−1 PFOA的降解率可达85.6%,降解速率是单独UV体系的10倍以上[66]. Lee等利用微波水热法活化PS产生的SO4·-降解PFOA,在60 ℃的环境中反应8 h后,253.8 µmol·L−1 的PFOA被降解完全,而在27 ℃的环境中,PFOA在8 h内的降解率仅有约20%. 同时,对影响因素的探究可知,此反应存在最适温度,在一定的范围内,随着温度的增加,PFOA的降解率先增加后降低;且酸性环境有利于反应的进行,当pH从11.5降到2时,PFOA的降解率从19.4%显著提高到79.1%[67]. 为增强此方法在室温下的实际应用性,Lee等又研究了铁改性AC活化PS对PFOA的降解,结果显示此方法大大提高了对PFOA的降解效率,在25 ℃的条件下,PFOA在此体系中的降解率比单独PS体系快9.5倍[68]. 郭等利用电化学恒电位电解法活化PS降解PFOA,反应4 h后,5 mg·L−1 PFOA的降解率为60%. 当体系中共存硝酸根、异丙醇和过硫酸钠时,PFOA的降解率提高到90%,共存次氯酸根时,PFOA的降解率约为76.8%,但共存碳酸氢根和氯离子时,PFOA的降解反被抑制[69]. 基于SO4·-的氧化技术目前已被尝试用于实际PFASs污染场地的修复,且效果良好. 如Bruton等直接利用地热能活化PS原位处理受PFASs污染的地下水,反应1 h后,环境中的PFASs全部转化为了短链PFCAs,反应至4 h,全氟戊酸(PFPeA)、全氟己酸(PFHxA)和全氟庚酸(PFHpA)全部降解完全,只剩下少量的全氟丁酸(PFBA)[70].
-
电化学降解技术一般通过阳极氧化降解污染物,阳极氧化又分为直接氧化和间接氧化两种,直接氧化法是直接依靠阳极的氧化作用,间接氧化法是利用阳极产生的高价金属离子、·OH、H2O2等强氧化性活性物质氧化降解污染物[71]. 由于PFASs中的碳氟键具有极高的键能,氟原子又具有较高的还原电位,间接氧化法对该类物质的处理效果不明显,故现有研究主要集中于电化学阳极直接氧化法. 目前常用的电极材料主要包括掺硼的金刚石电极(BBD)和掺杂、未掺杂的氧化物电极等. Ochiai等研究了BBD电极对PFOA的降解,降解过程符合假一级动力学特征,反应速率较快(k = 4×10−2 dm3·h−1)[72]. Zhuo等利用BBD电极降解包括PFOA和PFOS在内的7种PFASs,结果显示BBD对不同链长的PFASs均有一定的降解,随着电流密度从0.12 mA·cm−2增加到0.59 mA·cm−2,PFOA的降解率从0增加到97.48%,随后对pH的探究发现,该体系较适合酸性环境[73]. Lin等制备了Ti/二氧化锡(SnO2)-锑(Sb),Ti/SnO2-Sb/二氧化铅(PbO2)和Ti/SnO2-Sb/二氧化锰(MnO2)3种电极材料氧化降解PFOA,反应1.5 h后,PFOA的降解率分别达到90.3%、91.1%和31.7%;在优化体系电流密度、极板间距、pH以及初始PFOA浓度后,Ti/SnO2-Sb对PFOA的降解达到最佳效果,反应至90 min,PFOA的降解率和脱氟率分别可达98.8%和73.9%[74]. Zhuo等利用Sb和铋(Bi)对Ti/SnO2进行掺杂改性,并利用改性后的电极氧化降解PFOA,反应至3 h,初始浓度为50 mg·L−1 PFOA的降解率可达93.3%[75]. Yang等进一步研究了氟参杂改性的Ti/SnO2电极对PFOA的降解,改性后的电极具有了更好的电子传递能力,反应至30 min,初始浓度为100 mg·L−1 PFOA的降解率即能达到99%,是Sb改性Ti/SnO2电极的2倍以上[76]. Zhao等制备了一种新型碳气凝胶(CA)/SnO2-Sb电极具有较大的比表面积和较强的吸附能力和电催化活性,反应至5 h,PFOA的降解率和体系总有机碳(TOC)的去除率分别可达91%和86%,是Ti/SnO2-Sb电极的3.5倍和6倍[77].
-
光化学法处理污染物主要包括直接光解、光催化氧化和光还原等3种途径,在PFASs的降解研究中展现了良好的应用前景. 研究发现,PFOA能够吸收200 nm以下的UV光,并发生直接光解,但降解效率较低[78]. 而实际上,太阳光的波长范围一般大于280 nm,常见汞灯的发射光波长也大于200 nm. 故为实现对更长波长光的利用,研究人员开发出了多种光催化剂,主要用于清洁能源生产与环境污染治理. 目前可被用于PFASs降解的光催化剂主要包括TiO2、氧化铟(In2O3)和氧化镓(Ga2O3)等. Panchangam等利用溶胶凝胶法合成了TiO2光催化剂,在超声辅助作用下光解PFOA,经过7 h的UV辐照,PFOA的降解率可达65%—70%;随后对pH的研究发现,该体系对PFOA的降解效率排序为碱性 > 酸性 > 中性[79]. 该课题组后续又研究了高氯酸根改性的TiO2对PFASs的去除,结果显示PFOA、PFNA、全氟癸酸(PFDA)3种PFASs在7 h内的降解率均可达99%,脱氟率也达到了38%以上[80]. Song等以MWCNTs和TiO2为原料合成了一种新型的纳米材料,不仅有效抑制了光催化剂表面光生空穴和光生电子的复合,还增加了PFASs在TiO2表面的吸附,进而显著促进了PFASs的降解,反应8 h后,PFOA即被降解完全[81]. 除此之外,贵金属的掺杂也可以显著促进TiO2对PFOA的光催化降解效率. Li等分别用铂(Pt)、钯(Pd)和银(Ag)改性的TiO2降解PFOA,结果显示PFOA在上述体系中的假一级反应速率常数比在未改性的TiO2体系中分别提高了12.5、7.5、2.2倍[82]. 此外,半导体材料In2O3和Ga2O3作为两种宽禁带半导体催化剂,对PFASs的光催化降解也受到了广泛关注. Li等利用In2O3作为光催化剂氧化降解PFOA,结果显示PFOA在此体系中的降解速率常数是以TiO2作为光催化剂的体系中的8.4倍,但脱氟效率较低,降解产物一般为C2—C7的短链PFCAs[83]. 为进一步提升In2O3的光催化效率,该课题组合成了微球状、盘状和管状的3种不同结构的In2O3纳米材料,结果表明,微球状In2O3的活性最高,对PFOA的降解速率是TiO2的74.7倍. 这主要是因为微球结构具有巨大的比表面积和大量的氧空穴,不但能吸附大量的PFOA,还有助于其本身夺取PFOA的电子,从而提高对PFOA的降解效率[84]. Zhao等利用微波辐射水热法制成了β-Ga2O3纳米棒,在厌氧气氛下,PFOA的降解率和脱氟率分别可达98.8%和56.2%[85]. Shao等通过聚乙烯醇辅助水热-后热处理法合成了束状结构的β-Ga2O3,其对PFOA的降解速率是TiO2和商用β-Ga2O3的44倍和16倍,反应至3 h,PFOA的降解率可达100%,脱氟率也达到61%[54].
-
近年来,超声降解技术被广泛应用于辅助或强化降解水体中的有机污染物. 其主要通过超声波作用,在液体介质中产生空化气泡,并利用大量气泡的溃陷营造高温(约5000 ℃)高压(约500 atm)环境,使水蒸气热解为·OH和氢自由基等活性物质,从而实现对污染物的降解[86]. Moriwaki等于2005年首次利用超声技术实现了对PFOA等有机污染物的降解,在频率为200 Hz,辐射强度为3 W·cm−2的超声作用下,PFOA的降解半衰期为45 min;当反应气氛为氩气时,PFOA的半衰期缩短至22 min[87]. 赵等对超声氧化体系降解PFOA的影响因素进行了详细的探讨,结果显示在不同的超声波频率下,PFOS和PFOA的降解均符合假一级反应动力学,且随着超声波频率的不断升高,PFOS和PFOA的降解反应速率常数呈现先增大后减小的趋势,其中在358 kHz时的降解效果为最佳,这主要是因为超声波频率越高,超声周期越短,为空化气泡生长溃陷提供的正压时间越短,空化过程发生的概率和频率越小,从而导致PFOA和PFOS的降解效率越低;对于不同PFOS、PFOA的初始浓度,浓度越高,溶液中的饱和气体越少,气泡核在空化过程中热传递损失的能量越多,空化气泡馈陷减少,降解速率越低;对饱和气体种类的探究发现,PFOS和PFOA的降解速率排序为氩气 > 氮气 > 氧气 > 空气,这是因为气体的比热容越大,空化过程获得的声化学效应越多,越有利于空化气泡的馈陷[88]. 为评估该技术对实际水体的应用效果,Cheng等研究了超声降解法对垃圾填埋场地下水中PFOA的降解,结果显示PFOA在实际污水环境中比在纯水环境中的降解率降低了56%,这主要是因为地下水中含有大量的有机质,其在竞争空化气泡的同时也降低了气泡溃陷提供的温度,故抑制了PFOA的降解;此外,该研究还发现地下水中的碳酸氢根等无机阴离子也能够通过离子配体作用与PFOA竞争空化气泡,从而进一步降低PFOA等PFASs的降解率[89]. 近年来,研究人员还开发了超声技术与其他技术联用体系,以增强对污染物的处理效果. Yang等利用UV辅助超声波降解PFOA,结果显示PFOA在此体系中的降解率比单独超声体系提高了12.01%[90].
综上所述,尽管电化学氧化技术能够在一定程度上去除PFASs,但实际应用性较差. 由于氟原子的强电负性和碳氟键的高键能,·OH在环境状态下不仅不能降解PFASs,还会促进PFASs前体物质转化为PFASs,增加去除难度. 基于SO4·-的氧化技术虽然能够高效降解PFOA、PFOS等PFASs,但不能使其完全脱氟,且降解产物多以短链PFASs的形式积累,具有二次污染的隐患. 电化学降解技术目前还处于实验室模拟阶段,主要适用于高浓度PFASs污水的处理,而实际水环境中PFASs的浓度往往只有ng·L−1—µg·L−1,处理效果不佳;且电极材料的稳定性一般,可能会对环境造成二次污染. 超声降解技术因为具有环境适应性差、能量损耗高、转化率较低等缺点也不能在实际场地中大规模使用.
-
PFASs中所含的碳氟键具有极高的键能,且分子表面的电子云密度较高,故其很难被氧化型自由基降解,但氟原子具有极高的电负性,可以通过吸收一个电子发生还原降解,因此可以通过还原反应实现对PFASs的高效降解. 近年来,还原技术对PFASs的降解效率和机制被广泛研究,其主要是利用水合电子(eaq−),零价铁(ZVI)等强还原性活性物种降解污染物. 目前应用于PFASs降解的还原技术主要包括基于eaq−、超氧阴离子以及纳米ZVI的还原体系.
-
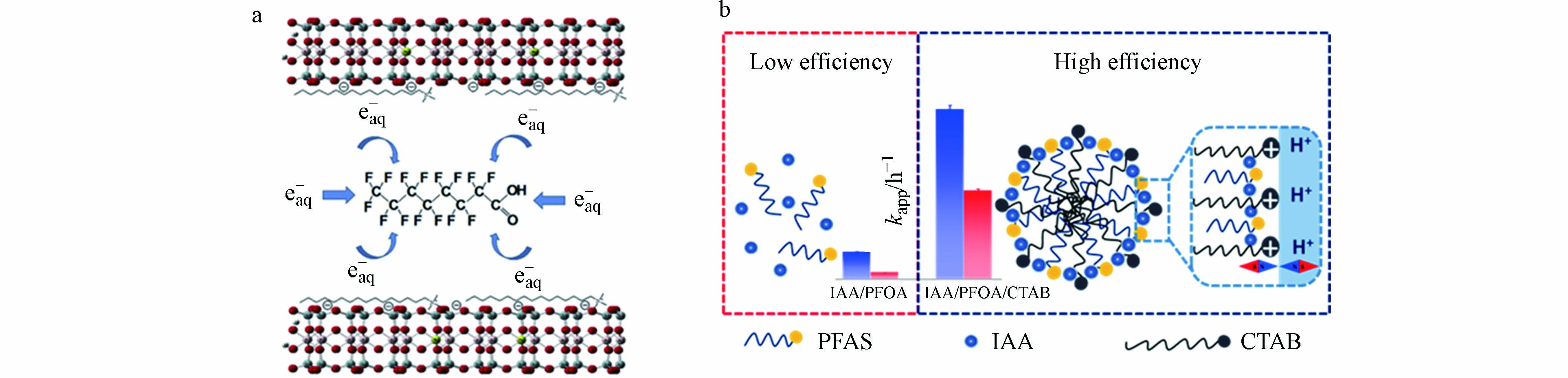
eaq−一般是由一个孤电子及周围的4—8个水分子组成,具有极高的还原电位(-2.9 V),是目前已知还原能力最强的物种之一[91]. 此外,eaq−还具有较高的扩散系数和极强的迁移能力,并能够维持反应活化能处于较低水平不变,所以与污染物的反应效率较高[92]. eaq−的来源有多种途径,如宇宙射线、光辐作用电离自然水体等,但环境中的eaq−一旦产生就会与O2、H3O+、H2O2等快速反应而被猝灭. 近年来,UV辐照亚硫酸盐、碘化物、氰化钾、吲哚类物质等多种可高效产生eaq−的体系被相继报道[93-95]. 除此之外,自然水体和土壤中的腐殖质也能在UV辐照下产生eaq−. 如图3所示,eaq−与PFASs的反应机理主要分为两种,一种是氢/氟交换:CnF2n+1COO− 受到 eaq−攻击后易发生氢/氟交换行为生成CnF2nHCOO−,后重复上述氢/氟交换过程实现降解脱氟;一种是脱羧-水解:CnF2n+1COO−受 eaq−攻击后脱去羧基生成 CnF2n+1·,后结合一个·OH生成不稳定的醇(CnF2n+1OH),CnF2n+1OH 易消去氢原子和氟原子生成 Cn-1F2n-1COF,再进一步通过水解反应生成短链PFCA(Cn-1F2n-1COO−),后不断重复上述反应生成碳链更短的PFCAs,最终完全矿化为氟离子和二氧化碳[96]. 基于eaq−的还原技术去除PFASs的主要影响因素有pH、温度、PFASs初始浓度、共存离子和有机物等[93, 97-98].
Jin等在碱性厌氧条件下,利用真空UV185辐照水体产生的eaq−降解PFOS,结果显示直链PFOS的降解速率较低,反应速率常数为0.0175 h−1,含有支链的PFOS的反应速率较高,反应速率常数为0.0806 min−1,反应至3 h,含有支链的PFOS即被完全降解[94]. Song等利用UV激发亚硫酸盐产生的eaq−还原降解PFOA,反应至24 h,PFOA的降解率达到100%,脱氟率也达到88.5%;且体系中eaq−的产量随着亚硫酸盐浓度的增加而增加,PFOA的降解脱氟速率也随之显著提高[95]. Gu等研究了pH对UV-亚硫酸盐体系降解PFOA的影响,结果发现在碱性(pH> 9.2)环境中,初始浓度为38.7 µmol·L−1的PFOA在10 min内可被完全降解,反应速率常数为0.455 min−1[97]. Park等利用UV辐照碘化钾产生的eaq−降解包含PFOA和PFOS在内的6种PFASs,当加入10 mmol·L−1碘化钾时,初始浓度为0.24 µmol·L−1 PFOA的反应速率常数为0.0014 min−1,初始浓度为0.2 µmol·L−1 PFOS的反应速率常数为0.003 min−1[99]. Qu等进一步研究了碱性(pH 9)厌氧条件下,UV-碘化钾体系对PFOA的降解,反应至14 h,PFOA的降解反应速率常数为0.0073 min−1,脱氟率也高达98%[93]. 随后该课题组又研究了pH和共存有机质(NOM)对该降解过程的影响,在酸性和中性环境中,eaq−因为易被质子猝灭而对PFOA的降解效率较低;对于NOM,研究发现其的加入能够促进PFOS的降解,反应至1.5 h,PFOS的脱氟率比之前增加了11.6倍,这主要是因为NOM中的醌式结构可以作为电子穿梭体促进电子向污染物转移,从而促进PFASs的降解脱氟效率[98]. Sun等利用三乙酸铵作为光敏剂和·OH猝灭剂,诱导水UV光解的同时抑制·OH与eaq−的复合反应,研究结果显示,反应至10 h,PFOS的降解率和脱氟率分别达到85.4%和46.8%[100]. 此外,该课题组还研究了另外一种·OH猝灭剂乙二胺四乙酸钠对PFOS还原降解的影响,结果显示,乙二胺四乙酸钠的加入不仅拓宽了eaq−还原体系的适用范围,还优化了反应条件,进而促进对PFOS的降解[101]. 此外,Huang等利用激光闪光光解技术研究了eaq−与不同链长PFASs(三氟乙酸(TFA)、PFBA和PFOA)的反应速率,结果显示随着碳链长度的增加,PFASs的降解反应速率常数逐渐增大,其中PFOA最大,为(1.7 ± 0.5)×107 (mol·L−1)−1·S−1[102]. 为进一步研究PFASs碳链长度对其降解脱氟效率的影响,Bentel等利用实验研究与理论计算相结合的方法系统研究了不同链长PFASs在eaq−体系中的降解过程,结果显示,长链PFASs更容易被eaq−降解,而短链PFASs的最终脱氟率较高;理论计算的结果进一步显示,这主要与体系中不同链长PFASs的降解路径不同有关[96]. 研究人员已尝试将此技术应用于实际场地的修复中. 如Tenorio等利用UV-亚硫酸盐体系处理含AFFF的废水,在eaq−的作用下,体系中PFOA和PFOS的降解率分别达到93%和98%,脱氟率也有50以上%[103].
eaq−还原技术降解去除PFASs等有机污染物的最大优势在于eaq−极高的还原电位可以实现对PFASs的完全降解矿化,但极高的还原势也使得eaq−在环境状态下不稳定,极易被氧气等氧化性物质猝灭. 除此之外,上述体系的应用一般需要满足高浓度的eaq−源物质、较强的碱性环境、厌氧氛围和长时间的UV光照等条件,这也限制了该技术的实际应用. 近年来,研究人员在如何简化反应条件,提高eaq−产率,从而进一步提高PFASs的降解脱氟效率等方面做了大量探索. 未来应多加关注该技术的实际应用性,并开发出能够在环境状态下高效利用的eaq−还原技术.
本课题也一直致力于开发出高效降解PFASs的eaq−还原技术. Tian和Chen等利用UV/3-吲哚乙酸(3-IAA)/CTAB改性的蒙脱石体系成功实现了对PFASs的先吸附后降解. 如图4(a)所示,改性后的蒙脱石可同时将3-IAA和PFOA吸附到黏土有机层间,从而有效保护UV激发3-IAA产生的eaq−不被溶液中的氧气和质子猝灭,反应至5 h,PFOA即被完全降解,反应至10 h,PFOA的脱氟率即有90%以上[104]. 随后对影响因素的探究可知,该体系的反应条件温和,能够抵抗pH的变化和氧气的干扰,有效解决了以往研究需要控制厌氧、碱性环境的难题[105],且适用于成分复杂的工业废水,能够抵挡溶液中共存有机质的影响,成功实现了对复杂环境中PFASs的高效去除[106]. Chen等随后又构建了由3-IAA、CTAB和污染物PFASs共同组成的三元自组装胶束体系,在环境条件下即实现了对PFASs的快速、高效去除. 如图4(b)所示,该胶束体系逆转了eaq−源物质3-IAA与PFOA之间的静电排斥效应,显著增加了两者之间的接触时间和反应效率,并通过胶束表面的正势垒将质子排斥在胶束外,进而降低了质子对eaq−的猝灭,进一步提高了反应效率,反应至2.5 h,初始浓度为10 mg·L−1 PFOA的浓度即降低到60 ng·L−1,符合美国环保署规定的饮用水中PFOA的健康限制浓度(70 ng·L−1),脱氟率也提高至90%. 而且经过UV辐照,该胶束在生长团聚后会自动发生沉降,即反应后的溶液不需要任何处理,体系中的溶解性有机碳(DOC)浓度就能降低至3 mg·L−1以下[107]. 进一步的研究发现,以羟基苯乙酸作为eaq−源物质所构建的自组装胶束体系也可以实现对PFASs的有效降解,Chen等研究了此体系对一种新型PFAS(六氟环氧丙烷三聚体酸(HFPO-TA))的降解效果,结果表明,反应至2.5 h,此体系对HFPO-TA的降解率可达95%以上,这也为类似结构PFASs替代物的降解提供了新的思路[108]. 为进一步简化反应体系,在上述研究的基础上,Chen等又开发了一种更为简单的二元复合体系(吲哚/PFASs),成功实现了在环境状态下对PFASs的高效降解脱氟,为简化PFASs降解反应体系的研究提供了新的思路[109].
-
近年来,ZVI由于具有较强的还原势(E = −0.44 V)而被广泛研究用来还原去除环境中的污染物[110]. 相比于其他技术,ZVI具有廉价易得、反应活性高、无二次污染等优点. 然而,较高的表面能和磁相互作用也使得其自身易发生团聚,从而降低反应性能[111]. 因此,研究人员多将ZVI负载于多孔吸附介质上形成复合材料,这样不仅增加了材料的稳定性,也进一步提高了反应效率[112-114]. ZVI还原体系对PFASs的降解主要受pH、温度、负载材料、PFASs初始浓度和共存有机质等因素的影响[113-114].
Hori等研究了不同零价金属在亚临界水中对PFOS的降解情况,结果显示不同金属的还原能力顺序为Al0 < Cu0 < Zn0 << ZVI,在添加了ZVI的体系中,反应至6 h,初始浓度为93 — 372 µmol·L−1 PFOS的降解率即超过98%,脱氟率也达到51.4%[115]. 此外,该课题组还研究了ZVI体系对全氟己烷磺酸(PFHxS)的降解脱氟,在350 ℃的亚临界反应环境中,初始浓度为741 µmol·L−1的PFHxS被迅速降解脱氟,脱氟率达到40.3%[116]. Arvaniti等利用镁-氨基黏土包覆的ZVI复合材料降解4种常见的PFASs,在pH 3的酸性环境中,该材料对所研究PFASs的去除效率排序为PFOA < PFNA < PFOS ≈ PFDA(降解率为96%). 后续该课题组又对反应影响因素进行了探究,结果表明新合成的材料在酸性、低温的环境中对PFASs的去除效果最好[113]. Park等利用Pd包覆的纳米ZVI复合材料降解PFOS,在厌氧条件下,该材料对PFOS的降解效果良好,且随着ZVI浓度的增加,降解率逐渐增大[114]. Liu等研究了ZVI与生物炭复合材料对PFOA和PFOS的降解,结果显示PFOA和PFOS在此体系中的降解率分别达到60%和94%,而在单独ZVI的体系中,PFOA的降解率仅有20%[117].
综上所述,尽管ZVI还原技术体系能够实现对PFASs的有效去除,但距离实际应用还有较长距离,这主要是因为该体系易团聚产生大量的铁泥. 因此,未来应开发出更高效率的负载材料以降低ZVI的团聚性,从而实现对PFASs的高效去除.
-
19世纪以来,生物降解技术在水处理领域扮演着极其重要的角色,被广泛应用于多种水处理工艺. 其主要利用微生物的代谢作用,将有机污染物转化为无毒的二氧化碳和水. 但由于碳氟键具有一定的生物惰性,生物降解技术对PFASs的降解效率较低,转化产物大多为短链PFASs,易造成二次污染. 此外,PFCAs和PFSAs的前体物质FTOHs和FOSAs等还能通过生物降解转化为毒性更强、生物蓄积性更高的PFOA、PFOS等,增加去除难度和污染风险.
Dinglasan等利用混合微生物系统研究了8:2 FTOH的好氧微生物降解过程,结果发现8:2 FTOH的最终降解产物为不饱和氟调聚酸和PFOA[118]. Zhang等也发现,6:2 FTOH在产甲烷的厌氧消化污泥中经生物反应转化为了PFHxA和PFPeA[119]. Chen等调查了我国9个城市12个污水处理厂进出水中FTOHs的存在情况,结果显示,经过好氧处理,4:2 FTOH、6:2 FTOH和8:2 FTOH的质量占比均有所下降,12种PFCAs的质量占比却从18% ± 16%增加到165% ± 15%,这表明FTOHs在好氧单元中可能发生生物反应转化为了PFCAs[120]. Rhoads等研究了N-EtFOSA、FOSA等全氟污染物在活性污泥中的降解,结果显示经过10 d的好氧生物反应,N-EtFOSA的主要产物为FOSA和PFOS,而FOSA的主要产物为PFOS[121]. Dimitrov等利用分解代谢软件(CATABOL)在微生物降解模拟器中模拟了171种PFASs的微生物降解代谢过程,结果显示,尽管其中60%以上的PFASs母体都会发生降解,但大部分转化成了PFOA和PFOS[122]. 薛等以PFASs为基质,从中驯化、筛选、分离出两种以含氟有机物为唯一碳源的菌株G+和G-杆菌,其可以存活于高浓度PFASs的环境中并对PFASs进行生物降解,但未给出脱氟的相关数据[123]. Huang等孵育了一种嗜酸菌sp. Strain A6,其能够利用还原性铵离子、氢气提供的电子降解PFASs,孵育至100 d,PFOA和PFOS的降解率才可以达到60%[124]. Luo等利用漆酶催化PFOA的生物氧化反应,反应至157 d,PFOA的降解率约为50%,但脱氟率极低[125].
综上所述,生物降解技术在去除PFASs这类持久性污染物的过程中存在着降解周期长、效率低、降解不彻底、反应条件苛刻等应用瓶颈,且去除效果较差. 因此,能否筛选、驯化出可高效降解PFASs的微生物是该技术能被实际应用的关键.
-
除了上述被广泛研究的PFASs降解技术体系,膜分离法、机械法和低温等离子体氧化法近年来也受到了国内外学者的关注.
膜分离技术是近年来迅速崛起的一种PFASs去除技术,其主要利用特殊的薄膜对溶液中粒径不同的混合物进行选择性分离. 膜根据孔径尺寸可分为微滤膜(MF)、纳滤膜(NF)、超滤膜(UF)和反渗透膜(RO)等. Appleman等利用NF270滤膜去除水中的PFASs,结果显示不管污染与否,N270对PFASs的去除率均可达到93%以上[126]. Tang等对比研究了5种RO膜和3种NF膜对PFOS的去除,对于初始浓度为10 mg·L−1的PFOS,NF膜的截留效率大于90%,而RO膜的截留效率大于99%,且不受膜表面电位的影响[127]. 虽然膜分离技术具有能耗低、工艺简单、处理周期短等优点,但价格昂贵、易受污染、对痕量PFASs污染水体的适应性差等缺点也限制了该技术在水处理领域的推广使用.
近年来,机械球磨技术因为具有操作简单、降解产物便于处理等优点而受到广泛关注. 其主要是利用剪切、挤压和摩擦等机械外力,使PFASs等污染物的结构和物理化学性质发生变化,从而达到降解的目的. Deng等利用ZVI和高铁酸盐作为共研磨试剂降解PFHxS,反应至4 h,研磨比例为1:2的实验组效果最佳,对PFHxS的降解率可达100%,脱氟率也达95%以上[111]. Zhang等以氢氧化钾作为研磨剂,成功实现了对PFASs的快速高效去除,反应至3 h,PFOA的降解率和脱氟率分别达到100%和97%[128]. 因此,寻找有效的研磨剂是该技术应用的关键.
低温等离子体技术也是一种有效的PFASs去除方法. 当反应体系有电流等外界能量输入时,体系中的分子吸收能量转变为激发态,并进一步电离出·OH等活性自由基粒子,与PFASs等污染物发生化学反应而将其去除. Kim等利用水等离子体技术降解CF4,在输出功率为2.5 kW,水流速度为6 mL·min−1的条件下,CF4的分解率达到99%以上. 随后对影响因素的探究发现,CF4的分解率随着气流速率的降低和电流强度的增加而增加[129]. Kuroki等研究了电感耦合等离子体技术对CF4的去除效果,在V(O2):V(CF4) = 0.9,体系压力为29—53 Pa,流速为0.189 L·min−1时,CF4能够被完全降解[130]. 目前,该技术的应用还面临着副产物多、能耗高等难题,后续研究应在继续保持较高降解率的基础上,通过控制反应条件减少有毒副产物的产生,并降低能耗.
-
近年来,由于PFASs在环境中被频繁检出,且具有生物累积性和较强的毒性,故对其去除技术的开发成为了环境领域的研究热点. 目前,PFASs的去除技术主要包括上述吸附、Fenton和类Fenton反应体系、硫酸根自由基体系、电化学降解、光催化降解、超声化学降解、eaq−降解、ZVI降解、膜分离、机械化学和低温等离子体技术体系,因为反应机理和适用条件存在差异,对PFASs的去除效果也不同. 不同处理技术的常用材料、去除效果、反应时间、反应机理、能耗、优缺点与展望详见表2.
-
本文主要总结归纳了持久性有机污染物PFASs的物理(吸附)、化学(氧化、还原)和生物去除技术,尽管上述技术在实验室内的模拟效果良好,但距离实际应用还有一段很长的路要走. 吸附技术因为成本低廉、能耗较低、操作简单且适用于较宽浓度范围的PFASs而被广泛研究,但吸附时间较长、吸附剂选择性差、再生能力弱、吸附后的污染物仍需二次处理等问题也限制了其进一步的实际应用;由于碳氟键的高键能以及氟的高电负性,PFASs几乎对多数化学氧化技术表现出排斥性,且技术本身也易受复杂环境因素的干扰,能否应用于实际场地修复还有待优化研究;化学还原技术作为一种新兴的污水处理技术,能够对PFASs进行矿化处理,但目前应用最多的eaq−易被氧化,需要控制碱性、厌氧等严苛的反应条件,大多数技术无法满足实际场地修复的要求;生物技术目前尚未找到合适的菌株降解PFASs,且处理周期极长,一般需要几十天到上百天的时间,能否真正应用还存在诸多争议.
因此,上述单一的技术体系都很难实现对PFASs污染实际水体的高效治理. 在未来的研究中,多种处理技术耦合使用可能是成功处理PFASs污染水体的关键,如首先通过选择性吸附剂将复杂水体中的PFASs高效富集,随后配合高效降解技术将脱附的PFASs无害化处理. 目前相关去除技术体系需要进一步完善,未来对PFASs去除技术的研究范围也应该进一步拓展,重点应关注:
(1)优化反应体系,增加现有技术的高效性、选择性和环境适应性,降低能耗,节约成本,并开展降解产物的综合毒性和生态风险评价,降低有毒物质的生成.
(2)进一步阐明相关技术去除实际废水中PFASs的作用机制,采取措施削弱废水中不利因素的影响,尽快推动上述技术的实际场地应用.
(3)开发联用技术体系,如利用吸附技术对废水进行预处理,富集浓缩PFASs后,再利用高级氧化/还原技术降解矿化PFASs,彻底消除其有害影响.
(4)开发与PFASs具有相似应用价值而毒性更低更易降解的环境友好型替代品,使其更易被现有的去除技术体系降解矿化.
全氟烷基化合物的去除技术研究进展
Research progress on the removal of perfluorinated allkyl substances: A review
-
摘要: 全氟烷基化合物(PFASs)是一类新型持久性有机污染物,具有环境持久性、生物蓄积性和毒性. 近年来,PFASs引起的环境问题受到国内外学者的广泛关注和研究,与此同时,PFASs的去除技术也被广泛研究. 现有的PFASs去除技术主要包括吸附、化学氧化、化学还原和生物降解等,因为反应机理和适用条件的差异,各种技术对PFASs的去除效果也有所不同. 本文主要对不同PFASs去除技术的常用材料、反应效率、反应机理、能耗和影响因素进行了详细的阐述和对比,同时总结归纳了目前研究所存在的问题、面临的挑战以及未来发展的前景,以期为开发更高效的PFASs去除技术提供参考.Abstract: Perfluorinated allkyl substances (PFASs) are a new class of persistent organic pollutants with persistence, biotoxicity and bioaccumulation. Recently, PFASs related environmental issues have been widely concerned by worldwide scientists. Meanwhile, PFASs removal techniques including adsorption, chemical oxidation, chemical reduction and biological treatment have been widely studied. However, due to the differences of reaction mechanisms and applicable conditions, various techniques show different removal efficiencies on PFASs. In this study, the common materials, removal efficiency, reaction time, reaction mechanism, energy consumption and the influence factors of different treatment techniques were summarized and elaborated in detail. Moreover, the existing problems, challenges and future outlooks of current researches were summarized, so as to provide reference for the development of effective removal techniques of PFASs.
-

-
化合物
Compounds分子量/(g·mol−1)
Molecular weight溶解度/(mg·L−1)
Water solubilitylg Kow (25 ℃) pKa PFOA 414.07 3300 4.81 2.8 PFOS 500.13 570 4.49 < 1.0 全氟壬酸(PFNA) 464.08 0.0625 5.48 -0.21 全氟癸酸(PFDA) 514.08 — — — 全氟己烷磺酸(PFHxS) 400.11 6.2 3.16 0.14 六氟环氧丙烷三聚体酸(HFPO-TA) 498.06 100000 — 200000 5.555 -0.07 8:2氟调聚醇(8:2 FTOH) 464.00 0.194 5.58 — N-乙基全氟辛基磺酰胺(N-EtFOSA) 527.20 — — — 表 2 不同PFASs去除技术对比
Table 2. Comparisons of different PFASs treatment techniques
去除技术
Techniques技术分类
Classification常用材料
Materials去除效果
Removal efficiency反应时间/h
Time能耗/
(kW·h mmol−1)
Energy
consumption反应机理
Mechanism优点
Advantages不足
Disadvantages展望
Future outlook参考文献
References吸附 物理 颗粒/粉末活性炭、改性活性炭、碳纳米管、离子交换树脂、矿物材料、改性矿物材料、新型吸附材料等 0.03—2960.3 mg·g−1
(20%—100%)0.33—480 — 静电作用、疏水作用、离子交换作用、范德华力、氢键作用等、桥连作用、配体交换等 成本低廉、能耗较低、操作简单、适用于较广浓度范围的PFASs、吸附后的污染物可以洗脱再利用等 吸附时间长、再生能力弱、选择性差、吸附后的污染物需要二次处理,改性剂自身的稳定性和毒性不能保证 开发无毒无害、高效廉价的选择性吸附剂 [30-48] Fenton和类
Fenton反应体系化学 ·OH、臭氧等 20%—99.1% 2.5—120 4.6—5.0×106 氧化作用 技术较成熟 反应机理不明确、去除效果差、不具有选择性 深入探究降解机理及路径、与其他技术联用 [56-63] SO4·-降解 化学 SO4·- 60%—100% 4—30 1.7—66.2 氧化作用 去除效果好、实际应用性强 脱氟效果较差、降解产物以短链PFASs积累、大量PS的使用造成环境盐碱度的升高 优化反应条件,与其他技术联用 [65-70] 电化学降解 化学 BBD电极、 Ti/SnO2-Sb (Se、Bi)电极、 Ti/SnO2-Sb/PbO2电极、Ti/SnO2-Sb/MnO2电极、改性电极等 31.7%—100% 0.5—5 2.9 × 10−3—37 氧化作用 绿色环保、能耗较低、
能够对PFASs实现
完全矿化选择性差、环境适应性差、电极材料的稳定性不能保证 开发合适的电极材料、增强环境适应性 [72-77] 光催化降解 化学 TiO2、改性 TiO2、In2O3、Ga2O3等 45%—100% 0.33—48 — 0.46—147 催化氧化 直接利用太阳能、绿色经济、完全矿化PFASs 反应条件严苛、
能耗较高开发出稳定性高、抗污染性能强的光催化剂 [54,79-85] 超声化学降解 化学 超声波 26%—100% 1—5 24.5—190 高温热解、空穴、·OH 能够对PFASs实现有效的降解脱氟 环境适应性差、能耗较高、去除效率低 优化反应条件、提高环境适应性 [87-90] eaq-降解 化学 eaq- 40%—100% 0.33—24 2.5—5165.3 脱氟加氢、
脱羧基水解能够实现对PFASs的完全降解矿化 eaq-易被氧化性物质猝灭、反应条件严苛 提高eaq-利用率、简化反应体系、提高环境适应性 [93-109] ZVI降解 化学 ZVI 8%—96% 1—2880 — 电子转移还原 能够对PFASs实现有效的降解脱氟 ZVI易发生团聚、实际
应用性差开发出更高效率的负载材料降低ZVI的团聚性 [113-117] 生物降解 生物 微生物 50%—100% 240—4224 — 微生物代谢 绿色环保、无需能耗 反应周期长、反应条件苛刻、去除不彻底 筛选、驯化出可高效降解PFASs的微生物 [118-125] 膜分离 物理 RO膜、NF膜等 90%—99% — — 截留 能耗较低、适用于较广浓度范围的PFASs、截留后的污染物可以洗脱再利用等 价格昂贵、截留作用不彻底、可重复利用性差、实际应用性差、 与其他技术联用,提高膜处理的选择性和实际应用性 [126-127] 机械化学 化学 — 100% 4 — 剪切、挤压和摩擦等
机械外力操作简单、降解产物便于处理、能够对PFASs实现完全降解脱氟 反应周期长、能耗高 寻找有效的助磨剂 [111,128] 低温等离子体氧化 化学 — >99% — — 氧化作用 去除效果好、能够对PFASs实现完全降解脱氟 反应副产物多、
能耗较高、优化反应条件、减少有毒副产物的生成、降低能耗 [129-130] -
[1] PABON M, CORPART J M. Fluorinated surfactants: Synthesis, properties, effluent treatment [J]. Journal of Fluorine Chemistry, 2002, 114(2): 149-156. doi: 10.1016/S0022-1139(02)00038-6 [2] de VOOGT P, SÁEZ M. Analytical chemistry of perfluoroalkylated substances [J]. TrAC Trends in Analytical Chemistry, 2006, 25(4): 326-342. doi: 10.1016/j.trac.2005.10.008 [3] 郭睿, 张超杰, 周琪. 水环境中全氟化合物的去除技术研究综述 [J]. 净水技术, 2016, 35(6): 18-24. doi: 10.15890/j.cnki.jsjs.2016.06.003 GUO R, ZHANG C J, ZHOU Q. Research overview of technology of perfluorinated compounds removal in water environment [J]. Water Purification Technology, 2016, 35(6): 18-24(in Chinese). doi: 10.15890/j.cnki.jsjs.2016.06.003
[4] PAUL A G, JONES K C, SWEETMAN A J. A first global production, emission, and environmental inventory for perfluorooctane sulfonate [J]. Environmental Science & Technology, 2009, 43(2): 386-392. [5] PODDER A, SADMANI A H M A, REINHART D, et al. Per and poly-fluoroalkyl substances (PFAS) as a contaminant of emerging concern in surface water: A transboundary review of their occurrences and toxicity effects [J]. Journal of Hazardous Materials, 2021, 419: 126361. doi: 10.1016/j.jhazmat.2021.126361 [6] 牛军峰, 王冲, 商恩香. 水中全氟化合物电化学去除技术研究进展 [J]. 中国科学:技术科学, 2017, 47(12): 1233-1255. doi: 10.1360/N092017-00116 NIU J F, WANG C, SHANG E X. Removal of perfluorinated compounds from wastewaters by electrochemical methods: A general review [J]. Scientia Sinica (Technologica), 2017, 47(12): 1233-1255(in Chinese). doi: 10.1360/N092017-00116
[7] 梁宇, 马安周, 宋茂勇, 等. 全氟辛烷磺酸生物降解研究进展 [J]. 微生物学通报, 2020, 47(8): 2536-2549. doi: 10.13344/j.microbiol.china.190981 LIANG Y, MA A Z, SONG M Y, et al. Advances in biodegradation of perfluorooctane sulfonate(PFOS) [J]. Microbiology China, 2020, 47(8): 2536-2549(in Chinese). doi: 10.13344/j.microbiol.china.190981
[8] SAGIV S K, RIFAS-SHIMAN S L, WEBSTER T F, et al. Sociodemographic and perinatal predictors of early pregnancy per- and polyfluoroalkyl substance (PFAS) concentrations [J]. Environmental Science & Technology, 2015, 49(19): 11849-11858. [9] NELSON J W, HATCH E E, WEBSTER T F. Exposure to polyfluoroalkyl chemicals and cholesterol, body weight, and insulin resistance in the general US population [J]. Environmental Health Perspectives, 2010, 118(2): 197-202. doi: 10.1289/ehp.0901165 [10] KANNAN K. Perfluoroalkyl and polyfluoroalkyl substances: Current and future perspectives [J]. Environmental Chemistry, 2011, 8(4): 333. doi: 10.1071/EN11053 [11] ZHAO Z, XIE Z Y, MÖLLER A, et al. Distribution and long-range transport of polyfluoroalkyl substances in the Arctic, Atlantic Ocean and Antarctic coast [J]. Environmental Pollution, 2012, 170: 71-77. doi: 10.1016/j.envpol.2012.06.004 [12] ZENG Z T, SONG B, XIAO R, et al. Assessing the human health risks of perfluorooctane sulfonate by in vivo and in vitro studies [J]. Environment International, 2019, 126: 598-610. doi: 10.1016/j.envint.2019.03.002 [13] PARSONS J R, SÁEZ M, DOLFING J, et al. Biodegradation of perfluorinated compounds [J]. Reviews of Environmental Contamination and Toxicology, 2008, 196: 53-71. [14] VIEIRA V M, HOFFMAN K, SHIN H M, et al. Perfluorooctanoic acid exposure and cancer outcomes in a contaminated community: A geographic analysis [J]. Environmental Health Perspectives, 2013, 121(3): 318-323. doi: 10.1289/ehp.1205829 [15] US EPA. 2010/2015 PFOA stewardship program[R]. 2016 [16] WILHELM M, KRAFT M, RAUCHFUSS K, et al. Assessment and management of the first German case of a contamination with perfluorinated compounds (PFC) in the Region Sauerland, North Rhine-Westphalia [J]. Journal of Toxicology and Environmental Health. Part A, 2008, 71(11/12): 725-733. [17] 国家环保总局发布“高污染、高环境风险”产品名录[R]. 2008. The State Environmental Protection Administration released the List of “High Pollution, High Environmental Risk Products” issued by the State Environmental Protection Administration[R]. 2008.
[18] 环境保护部. 关于《关于持久性有机污染物的斯德哥尔摩公约》新增列九种持久性有机污染物的《关于附件A、附件B和附件C修正案》和新增列硫丹的《关于附件A修正案》生效的公告[R]. 2014. Ministry of Environmental Protection. <Amendments to Annexes A, B and C> to the <Stockholm Convention on Persistent Organic Pollutants> for nine new POPs and <Amendments to Annex A> to add endosulfan[R]. 2014.
[19] 生态环境部. 关于禁止生产、流通、使用和进出口林丹等持久性有机污染物的公告[R]. 2019. Ministry of Ecology and Environment. Announcement on Prohibiting the Production, Circulation, Use and Import and Export of Lindane and Other Persistent Organic Pollutants[R]. 2019.
[20] TAN K Y, LU G H, PIAO H T, et al. Current contamination status of perfluoroalkyl substances in tapwater from 17 cities in the Eastern China and their correlations with surface waters [J]. Bulletin of Environmental Contamination and Toxicology, 2017, 99(2): 224-231. doi: 10.1007/s00128-017-2109-3 [21] STRYNAR M, DAGNINO S, MCMAHEN R, et al. Identification of novel perfluoroalkyl ether carboxylic acids (PFECAs) and sulfonic acids (PFESAs) in natural waters using accurate mass time-of-flight mass spectrometry (TOFMS) [J]. Environmental Science & Technology, 2015, 49(19): 11622-11630. [22] LI P P, ZHI D, ZHANG X X, et al. Research progress on the removal of hazardous perfluorochemicals: A review [J]. Journal of Environmental Management, 2019, 250: 109488. doi: 10.1016/j.jenvman.2019.109488 [23] 洪雷, 丁倩云, 亓祥坤, 等. 吸附法去除水中全氟化合物的研究进展 [J]. 环境化学, 2021, 40(7): 2193-2203. doi: 10.7524/j.issn.0254-6108.2020031303 HONG L, DING Q Y, QI X K, et al. The research progress of removing perfluoroalkyl substances by adsorption in water [J]. Environmental Chemistry, 2021, 40(7): 2193-2203(in Chinese). doi: 10.7524/j.issn.0254-6108.2020031303
[24] 詹宇航, 秦雅鑫, 陈博磊, 等. 全氟辛酸和全氟辛基磺酸的光降解技术及机理研究进展 [J]. 环境化学, 2022, 41(1): 46-56. doi: 10.7524/j.issn.0254-6108.2020121402 ZHAN Y H, QIN Y X, CHEN B L, et al. Photodegradation technology and mechanism of perfluorooctanoic acid(PFOA) and perfluorooctane sulfonic acid(PFOS): A critical review [J]. Environmental Chemistry, 2022, 41(1): 46-56(in Chinese). doi: 10.7524/j.issn.0254-6108.2020121402
[25] 刘洋, 胡筱敏, 赵研, 等. 全氟化合物及其替代品的处理技术 [J]. 环境化学, 2018, 37(8): 1860-1868. doi: 10.7524/j.issn.0254-6108.2017122904 LIU Y, HU X M, ZHAO Y, et al. Treatment techniques for perfluorinated compounds and their alternatives [J]. Environmental Chemistry, 2018, 37(8): 1860-1868(in Chinese). doi: 10.7524/j.issn.0254-6108.2017122904
[26] 罗梅清, 卓琼芳, 许振成, 等. 全氟化合物处理技术的研究进展 [J]. 环境科学与技术, 2015, 38(8): 60-67. LUO M Q, ZHUO Q F, XU Z C, et al. Research trends on degradation of perfluorinated compounds-a review [J]. Environmental Science & Technology, 2015, 38(8): 60-67(in Chinese).
[27] KAH M, SIGMUND G, XIAO F, et al. Sorption of ionizable and ionic organic compounds to biochar, activated carbon and other carbonaceous materials [J]. Water Research, 2017, 124: 673-692. doi: 10.1016/j.watres.2017.07.070 [28] VU C T, WU T T. Recent progress in adsorptive removal of per- and poly-fluoroalkyl substances (PFAS) from water/wastewater [J]. Critical Reviews in Environmental Science and Technology, 2022, 52(1): 90-129. doi: 10.1080/10643389.2020.1816125 [29] DU Z W, DENG S B, BEI Y, et al. Adsorption behavior and mechanism of perfluorinated compounds on various adsorbents—A review [J]. Journal of Hazardous Materials, 2014, 274: 443-454. doi: 10.1016/j.jhazmat.2014.04.038 [30] XIAO X, ULRICH B A, CHEN B L, et al. Sorption of poly- and perfluoroalkyl substances (PFASs) relevant to aqueous film-forming foam (AFFF)-impacted groundwater by biochars and activated carbon [J]. Environmental Science & Technology, 2017, 51(11): 6342-6351. [31] YU Q, ZHANG R Q, DENG S B, et al. Sorption of perfluorooctane sulfonate and perfluorooctanoate on activated carbons and resin: Kinetic and isotherm study [J]. Water Research, 2009, 43(4): 1150-1158. doi: 10.1016/j.watres.2008.12.001 [32] YUAN C, HUANG Y, CANNON F S, et al. Adsorption mechanisms of PFOA onto activated carbon anchored with quaternary ammonium/epoxide-forming compounds: A combination of experiment and model studies [J]. Journal of Environmental Sciences, 2020, 98: 94-102. doi: 10.1016/j.jes.2020.05.019 [33] DU Z W, DENG S B, LIU D C, et al. Efficient adsorption of PFOS and F53B from chrome plating wastewater and their subsequent degradation in the regeneration process [J]. Chemical Engineering Journal, 2016, 290: 405-413. doi: 10.1016/j.cej.2016.01.077 [34] SENEVIRATHNA S T M L D, TANAKA S, FUJII S, et al. A comparative study of adsorption of perfluorooctane sulfonate (PFOS) onto granular activated carbon, ion-exchange polymers and non-ion-exchange polymers [J]. Chemosphere, 2010, 80(6): 647-651. doi: 10.1016/j.chemosphere.2010.04.053 [35] ZAGGIA A, CONTE L, FALLETTI L, et al. Use of strong anion exchange resins for the removal of perfluoroalkylated substances from contaminated drinking water in batch and continuous pilot plants [J]. Water Research, 2016, 91: 137-146. doi: 10.1016/j.watres.2015.12.039 [36] PARK M, DANIELS K D, WU S M, et al. Magnetic ion-exchange (MIEX) resin for perfluorinated alkylsubstance (PFAS) removal in groundwater: Roles of atomic charges for adsorption [J]. Water Research, 2020, 181: 115897. doi: 10.1016/j.watres.2020.115897 [37] ZHAO L X, BIAN J N, ZHANG Y H, et al. Comparison of the sorption behaviors and mechanisms of perfluorosulfonates and perfluorocarboxylic acids on three kinds of clay minerals [J]. Chemosphere, 2014, 114: 51-58. doi: 10.1016/j.chemosphere.2014.03.098 [38] ZHOU Q, DENG S B, YU Q, et al. Sorption of perfluorooctane sulfonate on organo-montmorillonites [J]. Chemosphere, 2010, 78(6): 688-694. doi: 10.1016/j.chemosphere.2009.12.005 [39] WANG M C, ORR A A, JAKUBOWSKI J M, et al. Enhanced adsorption of per- and polyfluoroalkyl substances (PFAS) by edible, nutrient-amended montmorillonite clays [J]. Water Research, 2021, 188: 116534. doi: 10.1016/j.watres.2020.116534 [40] DU Z W, DENG S B, ZHANG S Y, et al. Selective and high sorption of perfluorooctanesulfonate and perfluorooctanoate by fluorinated alkyl chain modified montmorillonite [J]. The Journal of Physical Chemistry C, 2016, 120(30): 16782-16790. doi: 10.1021/acs.jpcc.6b04757 [41] DU Z W, DENG S B, ZHANG S Y, et al. Selective and fast adsorption of perfluorooctanesulfonate from wastewater by magnetic fluorinated vermiculite [J]. Environmental Science & Technology, 2017, 51(14): 8027-8035. [42] JI W, XIAO L L, LING Y H, et al. Removal of GenX and perfluorinated alkyl substances from water by amine-functionalized covalent organic frameworks [J]. Journal of the American Chemical Society, 2018, 140(40): 12677-12681. doi: 10.1021/jacs.8b06958 [43] ZHANG Q Y, DENG S B, YU G, et al. Removal of perfluorooctane sulfonate from aqueous solution by crosslinked chitosan beads: Sorption kinetics and uptake mechanism [J]. Bioresource Technology, 2011, 102(3): 2265-2271. doi: 10.1016/j.biortech.2010.10.040 [44] GUO H Q, LIU Y, MA W T, et al. Surface molecular imprinting on carbon microspheres for fast and selective adsorption of perfluorooctane sulfonate [J]. Journal of Hazardous Materials, 2018, 348: 29-38. doi: 10.1016/j.jhazmat.2018.01.018 [45] XIAO L L, LING Y H, ALSBAIEE A, et al. β-cyclodextrin polymer network sequesters perfluorooctanoic acid at environmentally relevant concentrations [J]. Journal of the American Chemical Society, 2017, 139(23): 7689-7692. doi: 10.1021/jacs.7b02381 [46] BHATTARAI B, MURUGANANDHAM M, SURI R P S. Development of high efficiency silica coated β-cyclodextrin polymeric adsorbent for the removal of emerging contaminants of concern from water [J]. Journal of Hazardous Materials, 2014, 273: 146-154. doi: 10.1016/j.jhazmat.2014.03.044 [47] BAGHIRZADE B S, ZHANG Y, REUTHER J F, et al. Thermal regeneration of spent granular activated carbon presents an opportunity to break the forever PFAS cycle [J]. Environmental Science & Technology, 2021, 55(9): 5608-5619. [48] FÜHRER S, HINTZER K, LOHR G, et al. Method of recov-ering fluorinated acid surfactants from adsorbent particles loaded therewith: US 7754914 [P]. 2010. [49] YANG L, HE L Y, XUE J M, et al. Persulfate-based degradation of perfluorooctanoic acid (PFOA) and perfluorooctane sulfonate (PFOS) in aqueous solution: Review on influences, mechanisms and prospective [J]. Journal of Hazardous Materials, 2020, 393: 122405. doi: 10.1016/j.jhazmat.2020.122405 [50] CHAPLIN B P. Critical review of electrochemical advanced oxidation processes for water treatment applications [J]. Environmental Science. Processes & Impacts, 2014, 16(6): 1182-1203. [51] XU B T, AHMED M B, ZHOU J L, et al. Photocatalytic removal of perfluoroalkyl substances from water and wastewater: Mechanism, kinetics and controlling factors [J]. Chemosphere, 2017, 189: 717-729. doi: 10.1016/j.chemosphere.2017.09.110 [52] RODRIGUEZ-FREIRE L, BALACHANDRAN R, SIERRA-ALVAREZ R, et al. Effect of sound frequency and initial concentration on the sonochemical degradation of perfluorooctane sulfonate (PFOS) [J]. Journal of Hazardous Materials, 2015, 300: 662-669. doi: 10.1016/j.jhazmat.2015.07.077 [53] CARTER K E, FARRELL J. Oxidative destruction of perfluorooctane sulfonate using boron-doped diamond film electrodes [J]. Environmental Science & Technology, 2008, 42(16): 6111-6115. [54] SHAO T, ZHANG P Y, LI Z M, et al. Photocatalytic decomposition of perfluorooctanoic acid in pure water and wastewater by needle-like nanostructured gallium oxide [J]. Chinese Journal of Catalysis, 2013, 34(8): 1551-1559. doi: 10.1016/S1872-2067(12)60612-3 [55] WU D, LI X K, ZHANG J X, et al. Efficient PFOA degradation by persulfate-assisted photocatalytic ozonation [J]. Separation and Purification Technology, 2018, 207: 255-261. doi: 10.1016/j.seppur.2018.06.059 [56] VECITIS C D, PARK H, CHENG J, et al. Treatment technologies for aqueous perfluorooctanesulfonate (PFOS) and perfluorooctanoate (PFOA) [J]. Frontiers of Environmental Science & Engineering in China, 2009, 3(2): 129-151. [57] TANG H Q, XIANG Q Q, LEI M, et al. Efficient degradation of perfluorooctanoic acid by UV-Fenton process [J]. Chemical Engineering Journal, 2012, 184: 156-162. doi: 10.1016/j.cej.2012.01.020 [58] HUANG J Y, WANG X, PAN Z Q, et al. Efficient degradation of perfluorooctanoic acid (PFOA) by photocatalytic ozonation [J]. Chemical Engineering Journal, 2016, 296: 329-334. doi: 10.1016/j.cej.2016.03.116 [59] LIN A Y C, PANCHANGAM S C, CHANG C Y, et al. Removal of perfluorooctanoic acid and perfluorooctane sulfonate via ozonation under alkaline condition [J]. Journal of Hazardous Materials, 2012, 243: 272-277. doi: 10.1016/j.jhazmat.2012.10.029 [60] MITCHELL S M, AHMAD M, TEEL A L, et al. Degradation of perfluorooctanoic acid by reactive species generated through catalyzed H2O2 propagation reactions [J]. Environmental Science & Technology Letters, 2014, 1(1): 117-121. [61] ELLIS D A, MARTIN J W, DE SILVA A O, et al. Degradation of fluorotelomer alcohols: A likely atmospheric source of perfluorinated carboxylic acids [J]. Environmental Science & Technology, 2004, 38(12): 3316-3321. [62] PLUMLEE M H, MCNEILL K, REINHARD M. Indirect photolysis of perfluorochemicals: Hydroxyl radical-initiated oxidation of N-ethyl perfluorooctane sulfonamido acetate (N-EtFOSAA) and other perfluoroalkanesulfonamides [J]. Environmental Science & Technology, 2009, 43(10): 3662-3668. [63] LV K, GAO W, MENG L Y, et al. Phototransformation of perfluorooctane sulfonamide on natural clay minerals: A likely source of short chain perfluorocarboxylic acids [J]. Journal of Hazardous Materials, 2020, 392: 122354. doi: 10.1016/j.jhazmat.2020.122354 [64] OLLER I, MALATO S, SÁNCHEZ-PÉREZ J A. Combination of advanced oxidation processes and biological treatments for wastewater decontamination—A review [J]. Science of the Total Environment, 2011, 409(20): 4141-4166. doi: 10.1016/j.scitotenv.2010.08.061 [65] LIU C S, HIGGINS C P, WANG F, et al. Effect of temperature on oxidative transformation of perfluorooctanoic acid (PFOA) by persulfate activation in water [J]. Separation and Purification Technology, 2012, 91: 46-51. doi: 10.1016/j.seppur.2011.09.047 [66] QIAN Y J, GUO X, ZHANG Y L, et al. Perfluorooctanoic acid degradation using UV-persulfate process: Modeling of the degradation and chlorate formation [J]. Environmental Science & Technology, 2016, 50(2): 772-781. [67] LEE Y C, LO S L, CHIUEH P T, et al. Efficient decomposition of perfluorocarboxylic acids in aqueous solution using microwave-induced persulfate [J]. Water Research, 2009, 43(11): 2811-2816. doi: 10.1016/j.watres.2009.03.052 [68] LEE Y C, LI Y F, CHEN M J, et al. Efficient decomposition of perfluorooctanic acid by persulfate with iron-modified activated carbon [J]. Water Research, 2020, 174: 115618. doi: 10.1016/j.watres.2020.115618 [69] 郭丽, 袁颐进, 冯丽贞, 等. 电活化过硫酸盐降解全氟辛酸及其中间产物的探究分析 [J]. 环境科学学报, 2020, 40(6): 2045-2054. doi: 10.13671/j.hjkxxb.2020.0068 GUO L, YUAN Y J, FENG L Z, et al. Electrochemical activated persulfate to degrade perfluorooctanoic acid and the analysis of intermediate products [J]. Acta Scientiae Circumstantiae, 2020, 40(6): 2045-2054(in Chinese). doi: 10.13671/j.hjkxxb.2020.0068
[70] BRUTON T A, SEDLAK D L. Treatment of aqueous film-forming foam by heat-activated persulfate under conditions representative of in situ chemical oxidation [J]. Environmental Science & Technology, 2017, 51(23): 13878-13885. [71] PANIZZA M, BOCCA C, CERISOLA G. Electrochemical treatment of wastewater containing polyaromatic organic pollutants [J]. Water Research, 2000, 34(9): 2601-2605. doi: 10.1016/S0043-1354(00)00145-7 [72] OCHIAI T, IIZUKA Y, NAKATA K, et al. Efficient electrochemical decomposition of perfluorocarboxylic acids by the use of a boron-doped diamond electrode [J]. Diamond and Related Materials, 2011, 20(2): 64-67. doi: 10.1016/j.diamond.2010.12.008 [73] ZHUO Q F, DENG S B, YANG B, et al. Degradation of perfluorinated compounds on a boron-doped diamond electrode [J]. Electrochimica Acta, 2012, 77: 17-22. doi: 10.1016/j.electacta.2012.04.145 [74] LIN H, NIU J F, DING S Y, et al. Electrochemical degradation of perfluorooctanoic acid (PFOA) by Ti/SnO2-Sb, Ti/SnO2-Sb/PbO2 and Ti/SnO2-Sb/MnO2 anodes [J]. Water Research, 2012, 46(7): 2281-2289. doi: 10.1016/j.watres.2012.01.053 [75] ZHUO Q F, DENG S B, YANG B, et al. Efficient electrochemical oxidation of perfluorooctanoate using a Ti/SnO2-Sb-Bi anode [J]. Environmental Science & Technology, 2011, 45(7): 2973-2979. [76] YANG B, JIANG C J, YU G, et al. Highly efficient electrochemical degradation of perfluorooctanoic acid (PFOA) by F-doped Ti/SnO2 electrode [J]. Journal of Hazardous Materials, 2015, 299: 417-424. doi: 10.1016/j.jhazmat.2015.06.033 [77] ZHAO H Y, GAO J X, ZHAO G H, et al. Fabrication of novel SnO2-Sb/carbon aerogel electrode for ultrasonic electrochemical oxidation of perfluorooctanoate with high catalytic efficiency [J]. Applied Catalysis B:Environmental, 2013, 136/137: 278-286. doi: 10.1016/j.apcatb.2013.02.013 [78] HORI H, HAYAKAWA E, EINAGA H, et al. Decomposition of environmentally persistent perfluorooctanoic acid in water by photochemical approaches [J]. Environmental Science & Technology, 2004, 38(22): 6118-6124. [79] PANCHANGAM S C, LIN A Y C, TSAI J H, et al. Sonication-assisted photocatalytic decomposition of perfluorooctanoic acid [J]. Chemosphere, 2009, 75(5): 654-660. doi: 10.1016/j.chemosphere.2008.12.065 [80] PANCHANGAM S C, LIN A Y C, SHAIK K L, et al. Decomposition of perfluorocarboxylic acids (PFCAs) by heterogeneous photocatalysis in acidic aqueous medium [J]. Chemosphere, 2009, 77(2): 242-248. doi: 10.1016/j.chemosphere.2009.07.003 [81] SONG C, CHEN P, WANG C Y, et al. Photodegradation of perfluorooctanoic acid by synthesized TiO2-MWCNT composites under 365 nm UV irradiation [J]. Chemosphere, 2012, 86(8): 853-859. doi: 10.1016/j.chemosphere.2011.11.034 [82] LI M J, YU Z B, LIU Q, et al. Photocatalytic decomposition of perfluorooctanoic acid by noble metallic nanoparticles modified TiO2 [J]. Chemical Engineering Journal, 2016, 286: 232-238. doi: 10.1016/j.cej.2015.10.037 [83] LI X Y, ZHANG P Y, JIN L, et al. Efficient photocatalytic decomposition of perfluorooctanoic acid by indium oxide and its mechanism [J]. Environmental Science & Technology, 2012, 46(10): 5528-5534. [84] LI Z M, ZHANG P Y, SHAO T, et al. Different nanostructured In2O3 for photocatalytic decomposition of perfluorooctanoic acid (PFOA) [J]. Journal of Hazardous Materials, 2013, 260: 40-46. doi: 10.1016/j.jhazmat.2013.04.042 [85] ZHAO B X, LI X, YANG L, et al. ß-Ga2O3 nanorod synthesis with a one-step microwave irradiation hydrothermal method and its efficient photocatalytic degradation for perfluorooctanoic acid [J]. Photochemistry and Photobiology, 2015, 91(1): 42-47. doi: 10.1111/php.12383 [86] 谢冰. 超声波作用下有机污染物的降解 [J]. 水处理技术, 2000, 26(2): 114-119. doi: 10.3969/j.issn.1000-3770.2000.02.013 XIE B. The degradation of organic pollutants using ultrasound [J]. Technology of Water Treatment, 2000, 26(2): 114-119(in Chinese). doi: 10.3969/j.issn.1000-3770.2000.02.013
[87] MORIWAKI H, TAKAGI Y, TANAKA M, et al. Sonochemical decomposition of perfluorooctane sulfonate and perfluorooctanoic acid [J]. Environmental Science & Technology, 2005, 39(9): 3388-3392. [88] 赵德明, 丁成, 徐新华, 等. 超声波降解全氟辛烷磺酸和全氟辛酸的动力学 [J]. 化工学报, 2011, 62(3): 829-835. ZHAO D M, DING C, XU X H, et al. Kinetics of perfluorooctane sulfonate and perfluorooctanoate degradation by ultrasound irradiation [J]. CIESC Journal, 2011, 62(3): 829-835(in Chinese).
[89] CHENG J, VECITIS C D, PARK H, et al. Sonochemical degradation of perfluorooctane sulfonate (PFOS) and perfluorooctanoate (PFOA) in landfill groundwater: Environmental matrix effects [J]. Environmental Science & Technology, 2008, 42(21): 8057-8063. [90] YANG S W, SUN J, HU Y Y, et al. Effect of vacuum ultraviolet on ultrasonic defluorination of aqueous perfluorooctanesulfonate [J]. Chemical Engineering Journal, 2013, 234: 106-114. doi: 10.1016/j.cej.2013.08.073 [91] ROSSKY P J, SCHNITKER J. The hydrated electron: Quantum simulation of structure, spectroscopy, and dynamics [J]. The Journal of Physical Chemistry, 1988, 92(15): 4277-4285. doi: 10.1021/j100326a009 [92] MEZYK S P, HELGESON T, COLE S K, et al. Free radical chemistry of disinfection-byproducts. 1. kinetics of hydrated electron and hydroxyl radical reactions with halonitromethanes in water [J]. The Journal of Physical Chemistry A, 2006, 110(6): 2176-2180. doi: 10.1021/jp054962+ [93] QU Y, ZHANG C J, LI F, et al. Photo-reductive defluorination of perfluorooctanoic acid in water [J]. Water Research, 2010, 44(9): 2939-2947. doi: 10.1016/j.watres.2010.02.019 [94] JIN L, ZHANG P Y. Photochemical decomposition of perfluorooctane sulfonate (PFOS) in an anoxic alkaline solution by 185 nm vacuum ultraviolet [J]. Chemical Engineering Journal, 2015, 280: 241-247. doi: 10.1016/j.cej.2015.06.022 [95] SONG Z, TANG H Q, WANG N, et al. Reductive defluorination of perfluorooctanoic acid by hydrated electrons in a sulfite-mediated UV photochemical system [J]. Journal of Hazardous Materials, 2013, 262: 332-338. doi: 10.1016/j.jhazmat.2013.08.059 [96] BENTEL M J, YU Y C, XU L H, et al. Defluorination of per- and polyfluoroalkyl substances (PFASs) with hydrated electrons: Structural dependence and implications to PFAS remediation and management [J]. Environmental Science & Technology, 2019, 53(7): 3718-3728. [97] GU Y R, LIU T Z, ZHANG Q, et al. Efficient decomposition of perfluorooctanoic acid by a high photon flux UV/sulfite process: Kinetics and associated toxicity [J]. Chemical Engineering Journal, 2017, 326: 1125-1133. doi: 10.1016/j.cej.2017.05.156 [98] SUN Z Y, ZHANG C J, CHEN P, et al. Impact of humic acid on the photoreductive degradation of perfluorooctane sulfonate (PFOS) by UV/Iodide process [J]. Water Research, 2017, 127: 50-58. doi: 10.1016/j.watres.2017.10.010 [99] PARK H, VECITIS C D, CHENG J, et al. Reductive defluorination of aqueous perfluorinated alkyl surfactants: Effects of ionic headgroup and chain length [J]. Journal of Physical Chemistry. A, 2009, 113(4): 690-696. doi: 10.1021/jp807116q [100] SUN Z Y, ZHANG C J, XING L, et al. UV/nitrilotriacetic acid process as a novel strategy for efficient photoreductive degradation of perfluorooctanesulfonate [J]. Environmental Science & Technology, 2018, 52(5): 2953-2962. [101] GU P F, ZHANG C J, SUN Z Y, et al. Enhanced photoreductive degradation of perfluorooctanesulfonate by UV irradiation in the presence of ethylenediaminetetraacetic acid [J]. Chemical Engineering Journal, 2020, 379: 122338. doi: 10.1016/j.cej.2019.122338 [102] HUANG L, DONG W B, HOU H Q. Investigation of the reactivity of hydrated electron toward perfluorinated carboxylates by laser flash photolysis [J]. Chemical Physics Letters, 2007, 436(1/2/3): 124-128. [103] TENORIO R, LIU J Y, XIAO X, et al. Destruction of per- and polyfluoroalkyl substances (PFASs) in aqueous film-forming foam (AFFF) with UV-sulfite photoreductive treatment [J]. Environmental Science & Technology, 2020, 54(11): 6957-6967. [104] TIAN H T, GAO J, LI H, et al. Complete defluorination of perfluorinated compounds by hydrated electrons generated from 3-indole-acetic-acid in organomodified montmorillonite [J]. Scientific Reports, 2016, 6: 32949. doi: 10.1038/srep32949 [105] TIAN H T, GU C. Effects of different factors on photodefluorination of perfluorinated compounds by hydrated electrons in organo-montmorillonite system [J]. Chemosphere, 2018, 191: 280-287. doi: 10.1016/j.chemosphere.2017.10.074 [106] CHEN Z H, TIAN H T, LI H, et al. Application of surfactant modified montmorillonite with different conformation for photo-treatment of perfluorooctanoic acid by hydrated electrons [J]. Chemosphere, 2019, 235: 1180-1188. doi: 10.1016/j.chemosphere.2019.07.032 [107] CHEN Z H, LI C, GAO J, et al. Efficient reductive destruction of perfluoroalkyl substances under self-assembled micelle confinement [J]. Environmental Science & Technology, 2020, 54(8): 5178-5185. [108] CHEN Z H, TENG Y, LI C, et al. Rapid photodegradation and defluorination of hexafluoropropylene oxide trimer acid (HFPO-TA) under ambient conditions: the synergistic effects of hydrated electron and stable self-assembled micelle [J]. Chemical Engineering Journal, 2021, 56: 136254. [109] CHEN Z H, TENG Y, MI N, et al. Highly efficient hydrated electron utilization and reductive destruction of perfluoroalkyl substances induced by intermolecular interaction [J]. Environmental Science & Technology, 2021, 55(6): 3996-4006. [110] CHEN J H, QIU X Q, FANG Z Q, et al. Removal mechanism of antibiotic metronidazole from aquatic solutions by using nanoscale zero-valent iron particles [J]. Chemical Engineering Journal, 2012, 181/182: 113-119. doi: 10.1016/j.cej.2011.11.037 [111] DENG S S, BAO Y X, CAGNETTA G, et al. Mechanochemical degradation of perfluorohexane sulfonate: Synergistic effect of ferrate(VI) and zero-valent iron [J]. Environmental Pollution, 2020, 264: 114789. doi: 10.1016/j.envpol.2020.114789 [112] SAKULCHAICHAROEN N, O'CARROLL D M, HERRERA J E. Enhanced stability and dechlorination activity of pre-synthesis stabilized nanoscale FePd particles [J]. Journal of Contaminant Hydrology, 2010, 118(3/4): 117-127. [113] ARVANITI O S, HWANG Y, ANDERSEN H R, et al. Reductive degradation of perfluorinated compounds in water using Mg-aminoclay coated nanoscale zero valent iron [J]. Chemical Engineering Journal, 2015, 262: 133-139. doi: 10.1016/j.cej.2014.09.079 [114] PARK S, ZENOBIO J E, LEE L S. Perfluorooctane sulfonate (PFOS) removal with Pd0/nFe0 nanoparticles: Adsorption or aqueous Fe-complexation, not transformation? [J]. Journal of Hazardous Materials, 2018, 342: 20-28. doi: 10.1016/j.jhazmat.2017.08.001 [115] HORI H, NAGAOKA Y, YAMAMOTO A, et al. Efficient decomposition of environmentally persistent perfluorooctanesulfonate and related fluorochemicals using zerovalent iron in subcritical water [J]. Environmental Science & Technology, 2006, 40(3): 1049-1054. [116] HORI H, NAGAOKA Y, SANO T, et al. Iron-induced decomposition of perfluorohexanesulfonate in sub- and supercritical water [J]. Chemosphere, 2008, 70(5): 800-806. doi: 10.1016/j.chemosphere.2007.07.015 [117] LIU Y Y, PTACEK C J, BALDWIN R J, et al. Application of zero-valent iron coupled with biochar for removal of perfluoroalkyl carboxylic and sulfonic acids from water under ambient environmental conditions [J]. Science of the Total Environment, 2020, 719: 137372. doi: 10.1016/j.scitotenv.2020.137372 [118] DINGLASAN M J A, YE Y, EDWARDS E A, et al. Fluorotelomer alcohol biodegradation yields poly- and perfluorinated acids [J]. Environmental Science & Technology, 2004, 38(10): 2857-2864. [119] ZHANG S, SZOSTEK B, MCCAUSLAND P K, et al. 6: 2 and 8: 2 fluorotelomer alcohol anaerobic biotransformation in digester sludge from a WWTP under methanogenic conditions [J]. Environmental Science & Technology, 2013, 47(9): 4227-4235. [120] CHEN H R, PENG H, YANG M, et al. Detection, occurrence, and fate of fluorotelomer alcohols in municipal wastewater treatment plants [J]. Environmental Science & Technology, 2017, 51(16): 8953-8961. [121] RHOADS K R, JANSSEN E M L, LUTHY R G, et al. Aerobic biotransformation and fate of N-ethyl perfluorooctane sulfonamidoethanol (N-EtFOSE) in activated sludge [J]. Environmental Science & Technology, 2008, 42(8): 2873-2878. [122] DIMITROV S, KAMENSKA V, WALKER J D, et al. Predicting the biodegradation products of perfluorinated chemicals using CATABOL [J]. SAR and QSAR in Environmental Research, 2004, 15(1): 69-82. doi: 10.1080/1062936032000169688 [123] 薛学佳, 周钰明, 吴敏, 等. 含氟有机化合物优势降解菌的筛选 [J]. 环境科学与技术, 2004, 27(1): 11-12,110. doi: 10.3969/j.issn.1003-6504.2004.01.006 XUE X J, ZHOU Y M, WU M, et al. Screening of dominant strains of degrading organo-fluorine compounds [J]. Environmental Science and Technology, 2004, 27(1): 11-12,110(in Chinese). doi: 10.3969/j.issn.1003-6504.2004.01.006
[124] HUANG S, JAFFÉ P R. Defluorination of perfluorooctanoic acid (PFOA) and perfluorooctane sulfonate (PFOS) by Acidimicrobium sp. strain A6 [J]. Environmental Science & Technology, 2019, 53(19): 11410-11419. [125] LUO Q, LU J H, ZHANG H, et al. Laccase-catalyzed degradation of perfluorooctanoic acid [J]. Environmental Science & Technology Letters, 2015, 2(7): 198-203. [126] APPLEMAN T D, DICKENSON E R V, BELLONA C, et al. Nanofiltration and granular activated carbon treatment of perfluoroalkyl acids [J]. Journal of Hazardous Materials, 2013, 260: 740-746. doi: 10.1016/j.jhazmat.2013.06.033 [127] TANG C Y, FU Q S, CRIDDLE C S, et al. Effect of flux (transmembrane pressure) and membrane properties on fouling and rejection of reverse osmosis and nanofiltration membranes treating perfluorooctane sulfonate containing wastewater [J]. Environmental Science & Technology, 2007, 41(6): 2008-2014. [128] ZHANG K L, HUANG J, YU G, et al. Destruction of perfluorooctane sulfonate (PFOS) and perfluorooctanoic acid (PFOA) by ball milling [J]. Environmental Science & Technology, 2013, 47(12): 6471-6477. [129] KIM D Y, PARK D W. Decomposition of PFCs by steam plasma at atmospheric pressure [J]. Surface and Coatings Technology, 2008, 202(22/23): 5280-5283. [130] KUROKI T, MINE J, ODAHARA S, et al. CF4 decomposition of flue gas from semiconductor process using inductively coupled plasma [J]. IEEE Transactions on Industry Applications, 2005, 41(1): 221-228. doi: 10.1109/TIA.2004.840954 -



 下载:
下载: