-
持久性有机污染物(persistent organic pollutants,POPs)通常具有半挥发性、难降解性、高毒性和高生物蓄积性,可长距离迁移至远离污染源的偏远地区,并在各环境介质中广泛分布,威胁全球生态安全和人类健康[1]. 土壤因其较高的吸附容量,成为POPs最重要的储存库之一[2]. 《关于POPs的斯德哥尔摩公约》和《远距离越境空气污染公约》等一系列区域或国际公约的生效,使得有机氯农药(OCPs)、多氯联苯(PCBs)和多环芳烃(PAHs)等故意或非故意排放的POPs逐步得到控制[3]. 对于这些纳入公约管控的污染物,人为产生的“一次排放源”逐渐减少,土壤等环境介质中POPs的“二次释放”成为愈加重要的环境过程[3-5]. 此外,尽管POPs具有持久性,其仍能在特定环境下发生降解转化[6]. POPs的部分降解转化产物可能有着比母体化合物更高的毒性[7]和/或更高的亲水性[8],给土壤-地下水系统带来未知风险,并通过各种暴露途径威胁人体健康. 对土壤中POPs的二次释放和降解过程及其降解转化产物的研究有助于准确评估POPs的生态效应与健康风险[6, 9].
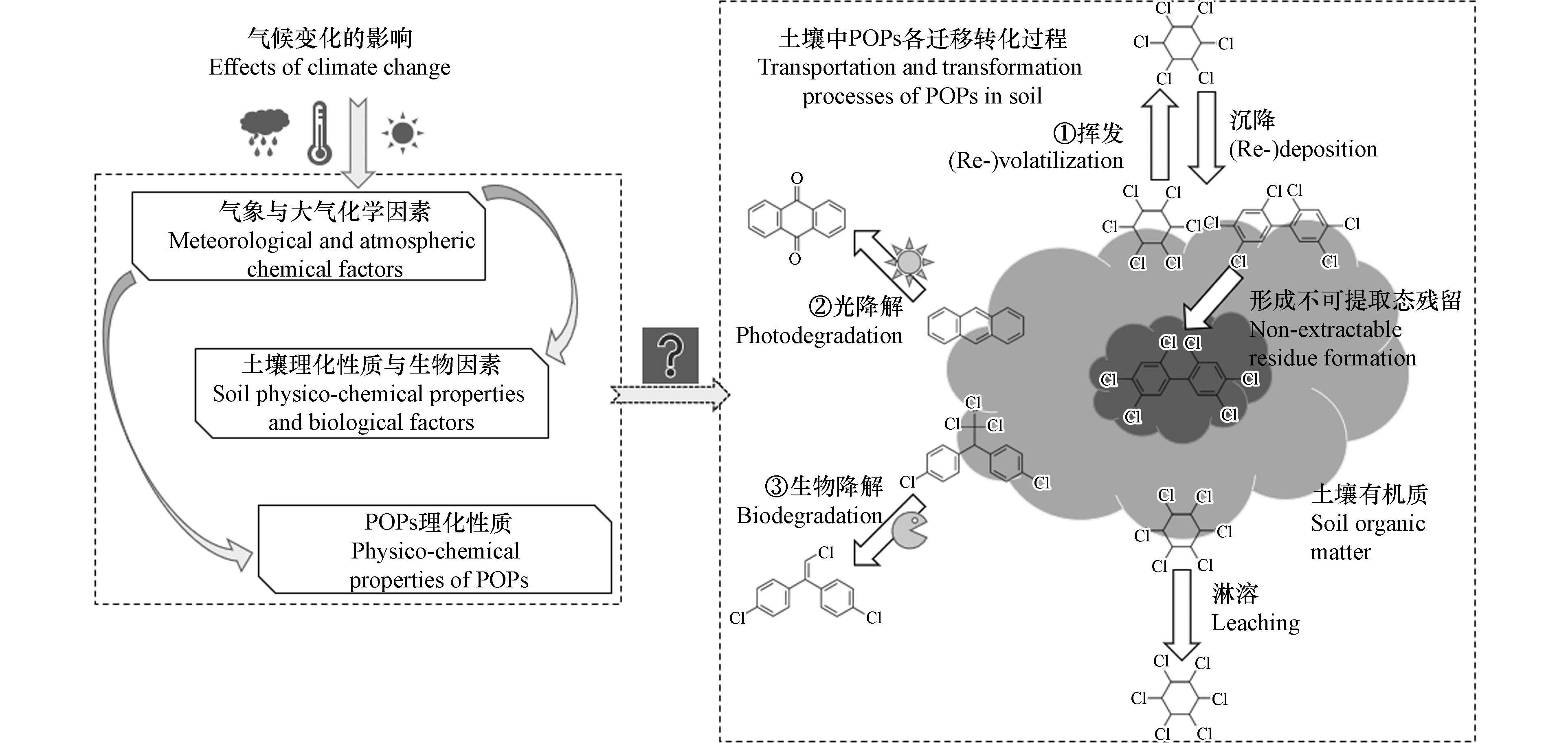
气候变暖是21世纪全球生态系统和人类社会面临的重大挑战. 政府间气候变化专门委员会(IPCC)第六次报告[10]指出,全球平均气温将在本世纪中叶至少升高1—1.8 ℃,升温幅度最高可达5.7℃. IPCC报告和联合国环境署(UNEP)[11]均强调应重视气候变暖下的环境污染问题. 气候变暖通过改变气象与大气化学条件、土壤理化性质和微生物活性等[12],直接或间接影响土壤中POPs的迁移转化(图1)及毒性效应.
气候变暖会加剧土壤中POPs向大气的二次释放,可能弱化甚至抵消POPs的减排效果[14];气候变暖也可能加速土壤中POPs的降解(包括生物降解和光降解)[3],有利于POPs的消除抑或提升其环境风险(根据降解转化产物毒性差异). 鉴于气候变化给全球POPs控制和削减引入了较大不确定性[12, 15],气候变化对POPs环境行为的影响受到格外关注[3, 16]. 另一方面,对于尚未纳入公约管控的新污染物[17],其中一部分也具有与POPs类似的理化性质,其二次挥发和降解过程同样受气候变化干扰,相关研究日益增多.
本文聚焦全球气候变暖情景下土壤中POPs各迁移转化过程的动态变化,总结了气候变化对土壤中POPs的二次挥发、降解以及毒性效应的影响,并对今后开展相关研究提出建议和展望.
-
土壤中POPs的挥发与气态沉降过程同时发生且难以区分,基于逸度理论的土-气交换(soil-air exchange)研究是探讨POPs二次挥发的常用手段[18-19]. 土-气交换的优势方向(净挥发或净沉降)可由土壤和大气间的逸度比率指示(公式1—4). 式中,fS和fA分别代表土壤和大气中POPs逸度(Pa),CS和CA分别代表土壤和大气中POPs浓度(mol·m−3),R为理想气体常数(8.314 Pa·m3·mol−1·K−1),T为环境温度(K),φOC为土壤有机碳比例,KOA为辛醇-气分配系数;ff为逸度比率(理论上,当ff=0.5时,代表土-气交换达到平衡,小于和大于该值分别代表POPs具有净沉降和净挥发趋势);N为POPs的挥发净通量(mol·m−2·h−1),DSA是土-气转移系数(mol·Pa−1·m−2·h−1)[18].
由公式3—4可知,当fA减小或fS增大时,土壤POPs的净挥发量增加. 比如,Lammel等[20]发现,来自印度洋的干净季风会降低印度西南部山区空气中多种POPs浓度,改变了该区域POPs的土-气逸度差(fA减小),进而增强了POPs的二次挥发. 对于纳入管控的传统POPs,近20—30年来,一次排放源减少,且经历长时间的土-气交换,部分类型POPs已接近土-气交换平衡(即ff≈0.5). 比如,中南欧地区土壤中的双对氯苯基二氯乙烯(DDE)[21]以及世界上大部分地区的低分子量PCBs[22]已达到土-气交换平衡. 对于未纳入管控的新型POPs,仍有较高频次和较大量的人为排放,且土-气交换时间相对较短. 远离排放的背景地区通常是这些污染物的净沉降区或汇区. 比如,北极地区有机磷酸酯(OPEs)的ff≈0[23],具有高净沉降潜力.
土-气分配系数(KSA)描述了POPs在土壤和大气间分配的平衡状态,反映了土壤对POPs的滞留能力或POPs的挥发性[22]. 较低的KSA值代表了较高的POPs挥发潜力,反之亦然. 一般可通过测量土壤和土壤表层气体中POPs浓度得到KSA-实测,见公式(5)[24];在缺乏实测数据时,可通过各类经验公式得到KSA-预测,比如由Hippelein和Mclachlan[25]推导的预测模型,见公式(6). 式中,CS*/CA*为已达平衡的土壤与表层气体POPs浓度之比(m3·kg−1),ρS为土壤密度(kg·m−3或kg·L−1),0.411为常数(L·kg−1). 由公式(6)可知,当KOA和/或φOC减小时,土壤POPs的挥发性增加(详细讨论见1.3小节).
季节变化会导致地表温度波动,进而影响POPs的挥发[26];大气环流周期性变化会影响POPs大气浓度[20];人为排放源也可能具有季节性(比如农药施放季节由农作物生长周期决定);不同类型POPs具有不同的土-气交换行为. 这些因素都会导致不同区域、不同季节的不同POPs具有不同的土-气交换状态,但在气候变暖影响下,各类POPs的二次挥发过程均会增强[5].
-
以高纬度和高海拔地区为代表的气候敏感区[10],升温迅速,有着极端脆弱的生态环境和较高的POPs二次挥发潜力. 在全球蒸馏效应(蚱蜢跳效应)[1]和高山冷凝效应[27]的作用下,这些地区长期被视为全球或区域环境中POPs的归宿地[28]. 极地与高山地区土壤中POPs的二次挥发带给区域乃至全球的生态及健康风险不容小觑.
北极是近百年全球升温最显著地区,其升温速率是其他地区的2倍以上;南极和青藏高原也是受气候变化影响显著的地区[10, 29]. 目前已有部分研究报道了气候变化对这些区域POPs二次挥发的影响. Ma等[16]基于斯瓦尔巴站点的长期监测与模型研究表明,北极地区土壤等地表介质中的各类POPs已通过二次挥发重新进入北极大气. Yu等[14]对北极地区3个站点大气PAHs的研究发现,受气候变暖影响,全球PAHs排放下降所带来的浓度下降被PAHs二次挥发量增加所抵消. Ren等[30]在青藏高原不同温度带的POPs土-气交换研究中发现,部分OCPs和PCBs的CA*与地表温度显著正相关,表明升温提升了土壤中POPs的挥发性;并计算出在升温1℃的情景下,部分OCPs的二次挥发量将增加60%—400%. 尽管青藏高原升温显著,但由于携带大量污染物的印度季风会在夏季进入青藏高原南部[30],导致该区域fA增加而使得土-气逸度差减小,该时段的净挥发可能被削弱. Cabrerizo等[31]对南极南设得兰群岛PCBs的土-气交换研究表明,虽然升温会增加土壤中PCBs的挥发性,但同时升温也会促进植被生长而使φOC增加,进而使fS减小并中和掉增加的PCBs挥发量. 该研究表明土壤中POPs的二次挥发过程由多因素共同影响,部分地区升温对二次挥发的促进作用可能被其他因素抵消,从而缓解POPs环境风险升高的威胁.
-
升温和降水模式改变等气象因素变化会作用于土壤理化性质和/或POPs理化性质,直接或间接影响POPs的二次挥发.
-
地表温度上升是加剧土壤中POPs二次挥发的最直接因素. 升温会导致KSA下降,即土壤中POPs的挥发性随升温而增强. 多个野外监测和室内研究均显示KSA与环境温度有较好相关性. 比如,青藏高原土壤中OCPs和PCBs[30]、南极地区土壤中PCBs[31]、西班牙和英国土壤中PAHs[32]的KSA-实测,以及人工加标土壤中OCPs[33]的KSA-实测,均与1/T(温度倒数)显著正相关.
KOA常用于预测KSA(公式(6)). KOA等描述POPs相分配的理化性质是温度的函数[34],见公式(7). 式中,KOA*为298.15 K下的KOA,ΔUOA为辛醇-气的相转移内能(J·mol−1). 升温会导致POPs的KOA(表1)和KSA-预测减小,即挥发性升高.
-
POPs的二次挥发速率受POPs与土壤基质的相互作用强度控制[35],土壤不同组分对POPs的吸附是影响POPs二次挥发的关键因素. 对于绝大多数中性POPs(包括OCPs、PCBs和PAHs等),土壤有机质(SOM)或土壤有机碳(SOC)对POPs的吸附(absorption)占主导地位[36],因此多数情况下会采用公式(6)对土壤中POPs的挥发性进行预测. 但对于极性和离子型POPs(比如全氟烷基化合物(PFASs)[4]),土壤矿物对POPs的吸附(adsorption)较为重要[37],土壤相对湿度可能显著影响POPs的挥发性,可采用公式(8)[33]进行预测. 式中,RH为相对湿度(%).
气候变暖会改变SOC含量或类型,进而影响POPs二次挥发. 以捷克为例[38],由于耕地土壤中SOC比例相对较低且污染负荷相对较高,该国45%的耕地土壤贡献了98%的OCPs挥发量,其余55%的森林或草原土壤仅贡献了2%的OCPs挥发量. 升温会降低农业土壤中SOC含量[12],因此气候变暖会进一步增加捷克农业土壤中的POPs净挥发量. Davidson和Janssens[39]对不同地区土壤中SOC的温度敏感性进行了评估,结果显示富含矿物的热带森林土壤中SOC的分解对温度不敏感(存在矿物化学保护),而新近耕作的温带草原土壤中SOC显示出较高温度敏感性,表明后者赋存POPs的二次挥发可能更易受气候变暖影响. 总体而言,气候变暖可促进SOC的分解,使结合在SOC中的POPs解吸或再活化[12],大量POPs分子重新具备挥发潜力.
土壤湿度增加可能会使水分子竞争性地替代污染物分子与土壤矿物表面以氢键形式结合,从而减弱POPs与土壤的吸附、增强POPs的二次挥发. 比如,Hippelein和McLachlan[40]系统考察了土壤相对湿度变化对PCBs土-气交换的影响. 结果显示,土壤相对湿度从29%升高到93%时,PCBs的KSA下降了90%—97%. 然而,湿度增加对于不同土壤和不同POPs的影响程度差异较大. Davie-Martin等[33]发现,土壤相对湿度从60%增加到90%时,OCPs的KSA下降了86%—98%(半干旱土壤;SOC含量0.9%)或50%—75%(火山土壤;SOC含量7.5%). 而Deng等[41]研究表明,土壤相对湿度从3%增加到100%时,多溴二苯醚(PBDEs)和有机磷酸阻燃剂(OPFRs)的KSA分别减少了52%—78%和13%—65%. 总体而言,土壤湿度增加对SOC含量较低的土壤(矿物质吸附占主导)、芳烃型结构POPs的二次挥发有更强的促进作用.
然而,气候变暖下由土壤湿度改变引起的POPs二次挥发变化因地区而异. 升温会增强土壤的蒸散作用,从而降低土壤湿度;而降水增加会提升土壤湿度[42]. 若仅考虑土壤湿度的贡献,在暖干化地区,土壤湿度会降低,可能削弱POPs的二次挥发;在暖湿化地区,土壤湿度的变化趋势难以一概而论. 若同时考虑SOM/SOC和人为活动的贡献,则情况更为复杂. 暖干化地区会加速SOC的分解,促进POPs的二次挥发;暖湿化地区有利于植被生长,可促进SOC的形成,从而增加土壤对POPs的吸附、减少POPs的二次挥发. 比如,尽管升温1℃会导致南极大气中PCBs浓度增加21%—45%,但同步升高0.5%的SOM(南极半岛植被扩张所致)会抵消这部分挥发量[31]. 土地利用方式的改变也会影响SOC的含量,并干扰POPs的二次挥发. Komprda等[38]在研究捷克土地利用方式对POPs挥发的影响时发现,升温1℃平均会增加8%的OCPs挥发通量,但若将该国10%的耕地转变为森林或草原则可以中和增加的挥发量.
值得注意的是,作为SOC的组成部分,黑碳(black carbon)对POPs的吸附能力被认为是无定形有机质(AOM)的10—100倍[43],部分学者[44-45]关注了土壤中黑碳含量对POPs土-气交换的影响. 但黑碳是自然或人为源下的不完全燃烧产物,形态稳定,不太容易受气候变化的影响. 此外,POPs在土壤中存在老化现象,会生成不可提取态残留(non-extractable residue,NER;又称结合态残留)(图1),而老化或NER的形成并不完全等同于SOC/SOM的吸附[46-47],且该过程同样会影响POPs的土-气交换过程[24]. 但当前关于NER形成过程对POPs二次挥发的影响极少见报道,有待进一步研究.
-
不同理化性质POPs的挥发性以及与土壤的吸附机制均不同,因此,不同POPs的二次挥发对于气候变暖的响应有较大差异. 对于挥发性较强(KOA较低)的POPs,其二次挥发更易受气候变暖影响. Ma和Cao[48]模拟了气候变暖下5种POPs的土-气交换,结果显示HCB受升温影响最大;在给定气候变化情景(升温速率0.1 K·a−1)下,HCB和α-HCH大气浓度分别可在一年内升高12%和10%. 对于挥发性较低(KOA较高)的POPs,其二次挥发受气候变暖影响较小. Hansen等[49]模拟了土壤等环境介质中PCBs对气候变暖的响应,结果显示气候变暖对高氯代PCBs(PCB 138—PCB 194)二次挥发的影响较小. 对于难挥发甚至无挥发性的新型POPs(比如离子型PFASs),土-气交换过程难以发生,故不受气候变暖影响[17].
Wania[50]评估了各类POPs的北极污染潜力,并按照KOA和KAW将POPs分为“飞行者”(flyer)、“游泳者”(swimmer)、“单次跳跃者”(single-hopper)和“多次跳跃者”(multi-hopper)四类. Lohmann等[17]认为,对于划为飞行者(比如HCB)和多次跳跃者(多数传统POPs)的POPs,其大气浓度受二次挥发影响较大,气候变暖对其影响更为显著;对于划为单次跳跃者的POPs(比如重环PAHs),具有被颗粒物吸附的极高倾向,其二次挥发对大气浓度的贡献相对较低,因此受气候变化影响较小(与Hansen等[49]的结论相符). 以表1中PAHs为例,在升高4 ℃(11.4→15.5 ℃)的情况下,lg KOA仅下降2.1%—2.4%;对于受气候变化影响较大的HCB和α-HCH[48],在升温条件(11.4→15.5 ℃)下,lg KOA下降幅度均不超过2%[51-52]. 由此可知,POPs的挥发性主要由化合物本身所决定,其挥发潜力分类[50]不大可能受气候变暖情景所改变.
-
POPs一般具有较长半衰期(数月至数年),但仍能发生不同程度的降解. POPs的降解类型可分为生物降解和非生物降解(包含光降解、水解和氧化降解等)[53]. 自然条件下,水体和土壤中POPs以生物降解为主,大气、表层水体和表层土壤中POPs可发生光降解[54].
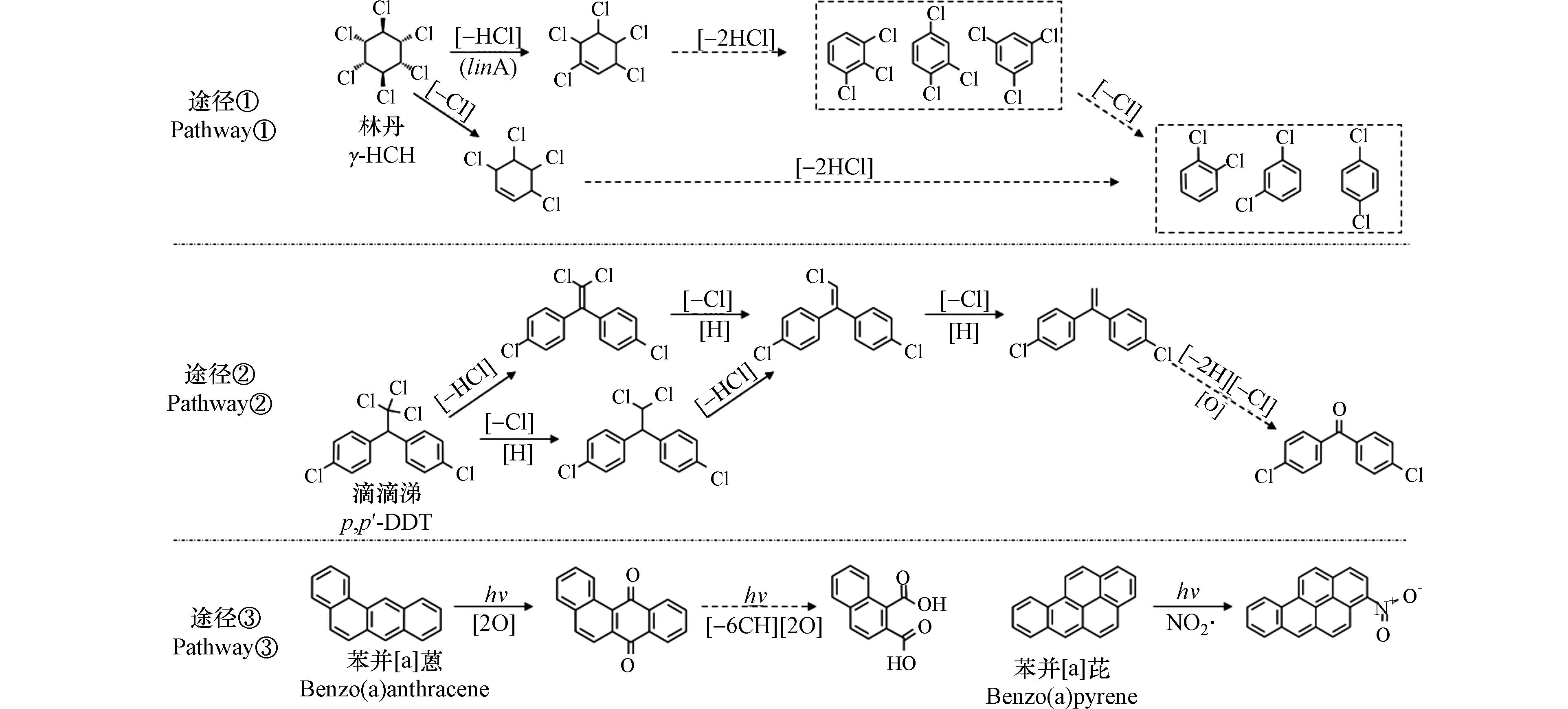
POPs的生物降解潜力取决于其结构,比如官能团性质和数量. 传统POPs多为氯代和/或芳烃类化合物,具有氯取代基和/或苯环结构;氯代和芳烃类化合物降解的重要环节分别是脱氯和开环[55]. 比如,土壤中γ-HCH可被好氧降解菌Sphingobium japonicum UT26在脱氯化氢酶linA的作用下,脱氯生成五氯环己烯[56](图2途径①). PAHs可在细菌或真菌加氧酶作用下,形成C—O键,并经加氢等过程使C—C键断裂,从而减少苯环数[57]. DDT同时具有含氯链烃和含氯芳烃,但在其生物降解过程中,一般先发生链烃的脱氯作用,生成一系列具含氯芳烃结构的DDX产物[58](图2途径②),之后再进行开环过程. 对于新型POPs,结构往往不同于传统POPs,因而具有不同的降解路径. 比如,PFASs具有氟化碳链和位于链端的取代基,具有脱氟和非脱氟(非氟取代基的降解)两种生物降解途径[59].
POPs的光降解主要通过吸收太阳辐射能、与OH自由基等氧化性物质反应来实现. 据估算[60],PAHs在白天与OH自由基的反应主导了大气PAHs的消除. 在多介质归趋模型领域[61],一般认为光降解仅发生在土壤表层1 mm内的土-气界面上,因而该过程可以忽略. 但多个研究表明[7, 9],在强太阳辐射下,表层土壤会发生明显的光降解过程. 比如,在天然光下,土壤中PAHs可与臭氧或OH自由基反应生成酮类、醌类、醛类、酚类和羧酸类产物;与NOx自由基反应生成硝基PAHs[9](图2途径③). 降水、土壤动物活动和人为翻耕等各种土壤扰动事件均会使表层1 mm以下土壤暴露在表层,使光降解影响范围超过土壤透光厚度.
-
升温、降水模式改变、大气CO2浓度升高以及伴随的土壤理化性质(包括土壤湿度、矿物质与SOM组成以及根际分泌物含量等)的改变,会直接或间接影响微生物群落结构和酶活性,进而影响POPs的生物降解.
-
理论上,在达到微生物的最适温度(通常>25 ℃)之前,升温会增强微生物代谢活动,进而提高POPs的生物降解速率. 比如,由基于活化能理论的阿伦尼乌斯方程[62](公式(9))可知,在给定升温情景下(11.4→15.5 ℃),4种PAHs的生物降解速率可平均提升48%(表2). 式中,HL为生物降解半衰期(d),HL*为298.15 K下的生物降解半衰期,Ea为反应活化能(65.4 kJ·mol-1[13]).
然而,生物降解过程与挥发等物理过程不同,降解速率受到微生物生长情况的限制,而微生物及酶活性可能不遵循沿温度单调变化的规律. 比如,升温会增强脲酶和反硝化酶活性,但会降低土壤蛋白酶和精氨酸转氨酶活性[63]. Ding等[6]在青藏高原东缘不同海拔梯度土壤OCPs的原位降解试验中发现,在排除土壤理化性质干扰的前提下,年均温分别为4 ℃和11.4 ℃的试验条件下具有几乎相同的降解速率和降解途径[54]. 部分学者发现升温对微生物活性的刺激是暂时性的,长时间尺度上微生物会适应新的环境条件[64]. 但毋庸置疑的是,在温度低于0 ℃的高山和极地土壤中,微生物活动受到极大限制(嗜冷菌除外),且相对湿度较低,微生物和污染物可能均无法充分移动和有效接触而使得POPs难以被降解[65]. 作为气候敏感区,升温以及冻土/冰雪融化预计会显著提升该区域土壤中POPs的生物降解速率.
-
如前所述,气候变暖下不同区域土壤有向暖干化或暖湿化发展的趋势. 在暖干化地区,土壤湿度降低可能会限制微生物活动并削弱POPs的生物降解[66];但较高的土壤湿度可能抑制好氧降解. 土壤中好氧微生物最大活性所需持水度一般为50%—60%[46]或50%—70%[64],若超过此范围,好氧降解受到抑制、厌氧降解逐渐增强. 值得注意的是,土壤微生物活性的最优湿度范围随温度上升而降低[64],因此,适度暖干化可能不会带来明显的生物降解速率变化. 气候变暖下降水模式发生改变,可能有更长期的干旱和更频繁的暴雨事件发生,而土壤的干-湿循环可能不利于污染物的生物降解. 比如,White等[67]发现干-湿循环会增强土壤对PAHs的锁定(包含表面吸附或微孔束缚等作用)、降低PAHs生物有效性,从而阻碍微生物对污染物的降解.
气候变暖引起的矿物质和SOM组成变化也会影响POPs的生物降解. 近来研究表明[12, 68],微生物与粘土矿物间可能存在协同作用,粘土矿物的存在可增强微生物对PAHs的降解. 气候变暖下暴雨事件的增多会加剧土壤侵蚀,表层土壤中粘土矿物含量减少[12],对生物降解的协同作用可能被削弱. 前已提及,升温总体上会促进SOM分解;但在植被生长良好的暖湿化地区,较多的凋落物可能会弥补分解掉的SOM. 然而,Yang等[69]研究发现,过低和过高含量的SOM均会抑制PAHs的生物降解. 在总有机碳(TOC)含量为0.23%的土壤中,微生物由于营养限制(SOM作为碳源供给不足)而导致活性较低;在TOC为7.1%的土壤中,高含量SOM对PAHs的锁定导致其生物有效性降低而难以被微生物利用[69]. 因此,在分析SOM的增加或减少是否对POPs生物降解产生促进或抑制作用时,须判断目标土壤中SOM含量是否处于微生物活性和POPs生物有效性的最适区间.
植物根系分泌物会影响根际微生物和土壤酶活性,升温和大气CO2浓度升高可促进植物生长以及根系分泌糖类、有机酸和氨基酸等有利于微生物生长的营养物质,进而促进POPs降解[64, 70]. 然而,Ai等[71]在开顶箱研究中发现,尽管升高的大气CO2浓度会增加土壤微生物总量和活性,但会降低与PAHs降解密切相关的革兰氏阳性菌丰度,从而削弱了PAHs降解. 此外,Cébron等[72]发现根系分泌物会改变菲-降解菌的细菌群落结构,但不会改变菲的生物降解速率,表明该降解过程的主导因素可能是由传质限制的菲晶体溶解速率而不是菲-降解菌的矿化潜力;SOM对菲的锁定及NER的生成降低了菲生物有效性,削弱了根系分泌物的影响.
-
不同POPs的生物降解潜力有较大差异,通常高氯代、高溴代、稠环和/或高分子量POPs难以被微生物降解,半衰期长达数年至数十年或更长时间. 理论上(基于OPERA模型预测[73])低分子量 γ-HCH和菲的生物降解半衰期分别为18.6 d和42 d,高分子量BDE 209和苯并[ghi]苝的生物降解半衰期分别为514 d和562 d. 然而,土壤与纯培养体系不同,土壤中POPs的降解速率不仅与微生物的降解能力有关,还与POPs的生物有效性有关[69, 72]. 一部分POPs与土壤基质结合形成稳定吸附组分或NER,导致微生物无法利用,因而几乎所有POPs在土壤中的生物降解半衰期均高于其理论值. 对于同一类型POPs,高分子量化合物可能同时具有较长的生物降解半衰期和较强的NER形成潜力. 比如,Ding等[13]发现苯并[ghi]苝相较于菲有更快的NER形成速率. 但对于不同类型POPs,该规律可能不再适用;且多数POPs(尤其新型POPs)的NER形成潜力尚未被报道[47],导致对于POPs生物降解速率或半衰期的准确预测极为困难.
前已提及,气候变暖下,POPs降解菌的活性可能增强或被抑制,SOM的分解速率可能增强或变化不明显,POPs-NER形成潜力也随SOM赋存特征而变化. 基于全球尺度的研究一般认为[15],气候变暖会导致微生物活性增强,因而POPs的生物降解速率会增强. 然而,除少部分POPs可被微生物作为唯一碳源外,多数POPs的生物降解途径是共代谢降解,且气候变暖导致的整体微生物活性增强并不意味着特定POPs降解菌的活性增强[71],导致前述观点(气候变暖会增强土壤中POPs的生物降解)可能在许多条件下不适用. 当前有关气候变化下POPs降解和环境归趋的模型研究[48]通常仅考虑POPs理化性质相关的微生物降解潜力贡献,而未考虑土壤基质对POPs生物有效性的影响,相关模型预测结果可能有较大的不确定性.
-
升温、辐射强度变化、光氧化剂(臭氧和OH自由基等)浓度变化以及土壤理化性质(土壤湿度、粒度、矿物质和腐殖质组成等)的改变,均会影响表层土壤中POPs的光降解速率.
-
高地表温度、高辐射强度和高光氧化剂浓度均可促进土壤中POPs的光降解. 比如,刘尘等[74]系统研究了温度、辐射强度和臭氧浓度等大气环境因素对土壤中PBDEs光降解的影响. 结果显示,夏季地面高温(40℃)下PBDEs的光降解速率远高于常温(25℃);紫外光下的光降解速率高于太阳光;高臭氧浓度(10 mg·L−1)下的光降解速率高于低臭氧浓度(0.3 mg·L−1). 此外,高温和高辐射强度可提升土壤中PAHs的光降解速率[7, 75]、增加PAHs的光降解产物类型[7].
然而,紫外辐射、臭氧等与气候变化间的关系较为复杂. 过去由于氟氯烃等化学品的使用,平流层臭氧的消耗问题越来越严重,未被臭氧层吸收的过量紫外辐射可到达地表土壤;《蒙特利尔议定书》的生效淘汰了臭氧消耗物质,且气候变化预计将降低平流层温度和水汽丰度[76],两者均会促进平流层臭氧的恢复,从而削弱紫外辐射. 但北半球空气质量的提升和气溶胶的减少预计将增加紫外辐射[77]. 人为活动排放产生的NOx和挥发性有机污染物(VOCs)是对流层臭氧的前体物,强紫外辐射会促进对流层臭氧和OH自由基的形成[78],从而提升表层土壤中POPs的光降解速率. 近地表紫外辐射和对流层臭氧浓度的变化随地区和季节波动,但根据模型预测结果,到2050年对流层臭氧浓度将持续上升,因而POPs的光降解程度会更加剧烈[3].
-
土壤湿度会显著影响POPs的光降解速率[79-80]. 一方面,土壤水分子占据了土壤矿物表面的吸附位点,减弱了POPs与矿物的吸附,使得参与光降解的POPs分子增多;另一方面,水分子可在光照条件下产生OH自由基等光氧化剂,促进POPs的光降解. 不同粒径土壤中POPs的光降解速率差异较大,一般粗颗粒、高孔隙度土壤的透光率较高,因而有更快的光降解速率[79]. 比如,王依雪等[81]发现2-氯萘的光降解率随土壤粒径的增加而增大. 土壤中的矿物组分可能有催化作用[79, 82],富含特定矿物组分的细粒土壤也可能有较高的POPs光降解速率. Marquès等[9]研究显示,细粒风积土中有更多铁锰矿物,在低光强时起光催化作用,轻中环PAHs的光降解速率高于粗粒红砂土;但高光强下,高透光率的红砂土中有更高的PAHs光降解率. 牛军峰等[83]报道表层土壤中γ-HCH光降解速率随Fe2O3含量的增加而增大.
作为土壤中SOM的重要组成部分(70%—80%),腐殖质(尤其是胡敏酸)是影响POPs光降解速率的重要因素. 腐殖质可作为光敏剂,在光照条件下产生大量的OH自由基等活性物质,促进POPs的光敏化降解[82]. 相反,腐殖质也可能是光稳定剂[79],腐殖质会与POPs竞争吸收光子而产生光屏蔽效应,或通过对POPs的锁定及形成NER而抑制其光降解. 张利红等[75]研究表明,胡敏酸可促进土壤中PAHs的光降解;但部分报道显示,腐殖质或胡敏酸对土壤中2-氯萘[81]、PBDEs[80]和全氟辛酸(PFOA)[84]光降解的抑制作用大于促进作用,且随腐殖质含量的增加,抑制作用增强.
如前所述,气候变化下不同区域土壤有朝着暖湿化或暖干化发展的趋势;升温总体上会加速SOM的分解,但在植被生长良好地区,分解的SOM会被新增的凋落物弥补. 因此土壤湿度和腐殖质对POPs光降解的促进或抑制效应具有不确定性. 但气候变化下极端降水事件更加频繁,与之相关的水土流失会导致表层土壤损失更多细粒组分[85]、增加透光率,可能会使更深土层中的POPs发生光降解.
-
与挥发和生物降解过程类似,POPs的光降解潜力(或光化学反应活性)也与目标污染物的理化性质密切相关. 当前有关POPs理化性质对于光降解潜力的影响研究多集中在传统POPs. 对于PAHs,潘相敏等[86]发现,高环PAHs的光降解速率通常高于中低环PAHs,相同环数PAHs的结构越紧密其光降解速率越低;Marquès等[9]报道,蒽和苯并[a]芘是中重环PAHs中光降解半衰期最短的化合物. 对于PCBs,蔡啸宇[87]研究表明,对称结构PCBs的光化学反应活性低于非对称结构PCBs,不同位置C-Cl键反应活性为邻位>间位>对位,且C-Cl键个数不影响反应活性. 对于OCPs,Zaleska等[88]报道,在不同的催化剂作用下,总体上甲氧氯的光降解速率最高、p,p’-DDT次之、γ-HCH的光降解速率最慢;丁洋[54]研究表明,青藏高原东缘高辐射地区(海拔>4000 m)表层土壤中γ-HCH的光降解程度弱于p,p’-DDT. 对于多氯二苯并对二噁英/呋喃(PCDD/Fs),其光降解速率随随氯代水平增加而降低[89].
总体而言,不同类型POPs间的光降解潜力差异较大. 但当前光降解实验研究多集中在大气、水体或纯溶剂中的部分传统POPs,表层土壤以及新型POPs的相关报道相对较少. 大气中POPs的光降解过程主要为POPs与大气OH自由基间的反应,目前已有多个模型(比如EPISuite模型中的AOPWIN模块、OPERA模型[54, 73]等)可对POPs在大气中的OH自由基反应速率常数进行预测;部分学者尝试利用定量结构-性质关系(QSPR)对水体中PCDD/Fs的光降解行为进行模拟[82];土壤中POPs光降解过程的模型研究极少见报道.
值得注意的是,土壤中POPs的挥发与降解过程同步发生. 研究表明[6, 9, 54],对于挥发性较强的POPs,挥发是其在土壤中最重要的环境过程(其光降解可能主要发生在大气中).土壤中腐殖质的存在可能会使POPs在土壤中的光降解行为不遵从其理化性质驱动的反应活性. 腐殖质作为部分POPs的光敏剂可促进其光降解;对于NER形成潜力较高的POPs,腐殖质含量越高,其光降解潜力越低.
-
在不考虑POPs排放源变化的前提下,气候变化对土壤中POPs毒性效应的影响主要包括3个方面:①气候变化作用于土壤中POPs的迁移转化,改变了POPs浓度和形态,进而影响土壤中POPs的毒性效应;②气候变化可能促进更高毒性的降解转化产物生成,放大毒性效应;③气候变化带来的环境胁迫改变了土壤生物的耐受性或免疫能力,进而影响其毒性效应[3]. 本节主要讨论第①、②部分的影响.
-
POPs进入土壤后,直接危害土壤生态系统(包括微生物、植物和动物),并可通过各种暴露途径间接威胁人体健康. POPs可能会减少微生物多样性、破坏微生物群落结构[90];抑制植物光合作用和/或具有遗传毒性[91];对动物和人体具有“三致”效应,具有细胞毒性、基因毒性、肝脏毒性和雌激素效应等[92]. 土壤中POPs的毒性效应主要取决于其生物有效性,一般认为能被土壤生物直接接触到的自由溶解态POPs才具有毒性[93],结合态POPs(POPs-NER[47])的环境风险较低.
对于已纳入公约管控的传统POPs,一次排放源不断减少,土壤中POPs“总浓度”(所有形态POPs浓度之和)逐渐降低. 然而,“总浓度”和“自由溶解态浓度”不同,前者下降并不意味着后者同步下降. 气候变暖总体上可促进SOM的分解,经过数十年累积的、锁定在SOM中的POPs(尤其是NER)可能被再活化为自由溶解态POPs. 由于土壤有机质的强大吸附能力和多孔结构,结合态POPs的浓度占比可能超过POPs总浓度的50%[47]. 因此,土壤中传统POPs总浓度的下降不代表其毒性效应同步降低;在短时间尺度上,如果SOM分解导致的自由溶解态POPs增加速率快于POPs的生物降解及挥发速率,其毒性效应和风险可能反而升高. 对于尚未纳入管控的新型POPs,人为排放源的广泛存在使得这些污染物不断通过大气沉降等途径进入土壤. 在其排放源减少前,其总浓度和自由溶解态浓度可能均表现为不断增加的趋势,毒性效应不断升高.
值得注意的是,土壤POPs生态与健康风险评价模型通常依赖于土壤POPs浓度[94],但当前研究默认采用总浓度而不是自由溶解态浓度计算,极大可能高估土壤中POPs的生态与健康风险[93, 95].
-
当前有关土壤中POPs二次挥发、降解和毒性效应的研究较多关注母体化合物,POPs降解转化产物的生态与健康风险常被忽视[96]. POPs次级降解转化产物的毒性通常更低,但初级降解转化产物的毒性可能与母体化合物相近甚至更高. Wetterauer等[97]研究了DDT四种次级降解转化产物(DDMS、DDMU、DDCN和DDA)的毒性,结果显示在细胞毒性测试中所有降解转化产物均存在正向剂量-反应关系,部分降解转化产物具有雌激素活性,并揭示了DDT次级降解转化产物的细胞毒性和雌激素活性低于DDT母体化合物. 然而,PCBs的羟基化代谢产物可能有着比母体化合物更高的毒性效应. 比如,PCB 180对大鼠肝脏的DNA损伤是其代谢产物3’-OH-CB 180导致[98]. 此外,NOx自由基等光氧化剂的存在,使得POPs的光降解(副)产物可能比母体化合物毒性更高. Marquès等[9]研究表明,土壤中PAHs会在太阳光照射下生成硝基PAHs,硝基PAHs对微生物和人体均具有比PAHs本身更高的致突变性[99].
然而,除少部分POPs初级降解转化产物(比如DDD和DDE)外,大部分POPs降解转化产物均未被纳入管控和常规环境监测中. Wetterauer等建议[97],在DDT次级降解转化产物浓度达到DDT母体浓度的100倍时,应将其纳入风险评估中. 气候变化下,土壤中母体POPs的环境风险可能更低(当浓度降低时),但土壤生物和人体对POPs降解转化产物的暴露可能增加[7]. 全球气候变暖下土壤中POPs降解转化产物浓度及其毒性效应的变化亟待深入研究.
-
本文从地表温度与大气化学因素、土壤理化性质与生物因素以及POPs理化性质3个方面,总结了全球气候变暖对土壤中POPs环境行为(二次挥发、生物降解和光降解)及毒性效应的影响. 总体而言,土壤中POPs的挥发、生物降解和光降解均对气候变化有不同程度的响应(表3). 土壤中POPs的挥发为物理过程,对升温、土壤湿度增加和SOM分解加快的响应均为单调递增变化;挥发性强的低KOA值POPs的二次挥发受气候变暖影响更大. 表层土壤中POPs的光降解为化学过程,对升温、辐射强度增强和光氧化剂浓度升高的响应为单调递增变化,对土壤理化性质改变的响应为非单调变化;不同类型POPs间的光降解潜力及其对气候变化的响应差异较大. 土壤中POPs的生物降解为生物过程,对升温和土壤理化性质改变的响应均为非单调变化;不同类型POPs间的生物降解潜力及其对气候变化的响应差异较大.
气候变化下土壤中POPs的毒性效应变化趋势与污染物类型有关. 对于已纳入公约管控的传统POPs,其自由溶解态浓度可能不随总浓度同步下降,基于自由溶解态浓度的污染物毒性可能下降或升高;对于尚未纳入公约管控的新型POPs,受人为排放影响,其浓度和毒性效应可能不断增加;对于POPs降解转化产物,其浓度和毒性效应变化尚待进一步研究.
为全面评估气候变化对土壤中POPs环境行为及毒性效应的影响,尚待解决的问题有:
(1)土壤中POPs的二次挥发、生物降解与光降解均受污染物-基质间相互作用的竞争影响,当前部分研究关注了吸附对生物降解和光降解速率的制约,但关于气候变化下POPs-NER的形成/释放及其对各环境过程和毒性效应的影响尚未见报道.
(2)目前已有大量研究关注了土壤中POPs的生物有效性及自由溶解态浓度测定方法,但当前土壤POPs毒性效应及风险评估研究一般仍基于POPs总浓度,极大可能高估其环境风险. 气候变化对土壤中POPs生物有效性的影响亟待进一步研究.
(3)当前,全球尺度的气候变化对POPs归趋影响模型研究常假定升温能促进POPs的生物降解,相关结果可能具有较高不确定性. 相较于挥发和光降解,微生物参与的生物降解过程更为复杂,有待开展考虑更多参数的气候变化下POPs生物降解预测研究.
(4)POPs降解转化产物可能比母体化合物有更高的毒性. 当前已有研究关注了部分POPs降解转化产物的浓度及毒性效应,但仍有大量POPs降解转化产物的环境行为及毒性效应尚未被报道. 此外,针对毒性更高的降解转化产物,其持久性和二次挥发问题也有待深入研究.
(5)POPs及其降解转化产物均具有跨介质迁移能力,气候变化下土壤中部分POPs毒性效应降低的同时,其他介质中的风险可能增加. 比如,土壤中POPs二次挥发增强使得大气POPs浓度升高,进而使陆生动物和人体的呼吸暴露增加;土壤中POPs降解转化产物可能具有亲水性,在淋溶或土壤侵蚀作用下进入地下水和地表水体,进而威胁水生生态系统. 此外,人类活动导致POPs排放源变化对POPs归趋的影响可能大于气候变化本身对POPs归趋的影响. 因此,综合考虑气候变化下土壤-大气-水体-生物等不同介质中POPs的环境行为与毒性效应以及人类活动的影响,将有助于系统认识POPs的环境风险.
气候变化下土壤中持久性有机污染物的二次挥发、降解及毒性效应研究进展
Re-volatilization, degradation, and toxicological effects of persistent organic pollutants (POPs) in soil under climate change: A review
-
摘要: 全球气候变化是21世纪人类社会面临的巨大挑战,其中,气候变暖下的环境污染问题受到国际广泛关注. 持久性有机污染物(persistent organic pollutants,POPs)是一类具有半挥发性、难降解性、高毒性和高生物累积性的高关注度化学物质,土壤是其主要储存库. 气候变暖直接或间接影响土壤中POPs的迁移转化及毒性效应,可能放大POPs对区域乃至全球的生态与健康风险. 本文综述了土壤中POPs二次挥发和降解过程的国内外研究进展,分别讨论了气候变化情景下土壤中POPs二次挥发、生物降解、光降解和毒性效应的动态变化趋势,并归纳分析了土壤中POPs环境行为及毒性效应研究中尚待解决的问题,以期为气候变化与POPs全球循环及其环境风险相关研究提供参考.Abstract: Global climate change is a huge challenge facing the world in the 21st century, and environmental pollution under climate warming has received extensive international attention. Persistent organic pollutants (POPs) are substances of very high concern which are usually semi-volatile, highly resistant to degradation, highly toxic, and highly bioaccumulative. Soil is the main reservoir of POPs. Climate warming directly or indirectly affects the transportation, transformation, and toxic effects of POPs in soil, which may amplify the ecological and health risks of POPs to the regional and global environment. Here we review the research progress of re-volatilization and degradation of POPs in soil; discuss the dynamic trends of re-volatilization, biodegradation, photodegradation, and toxic effects of POPs in soil under climate change scenarios; and summarize some unresolved problems in the domain of environmental behavior and toxic effects of POPs in soil. This article could provide references for future studies on global cycling and environmental risks of POPs under climate change.
-
Key words:
- emerging contaminants /
- soil-air exchange /
- degradation products /
- environmental risks /
- global warming
-

-
表 1 不同环境温度下四种PAHs的部分理化性质
Table 1. Selected physic-chemical properties of four PAHs under different environmental temperature
温度/℃
Temperature菲
Phenanthrene芘
Pyrene苯并[a]芘
Benzo(a)pyrene苯并[ghi]苝
Benzo(ghi)perylene辛醇-气分
配系数a
lg KOA辛醇-水分
配系数a
lg KOW饱和蒸
气压/Paa
lg PL辛醇-气分配系数
lg KOA辛醇-水分
配系数
lg KOW饱和蒸
气压/Pa
lg PL辛醇-气分配系数
lg KOA辛醇-水分
配系数
lg KOW饱和蒸
气压/Pa
lg PL辛醇-气分配系数
lg KOA辛醇-水分
配系数
lg KOW饱和蒸
气压/Pa
lg PL25.0 7.6 4.9 −1.0 8.9 5.6 −2.4 11.5 7.0 −5.1 12.6 7.7 −6.3 15.5 8.1 5.0 −1.4 9.3 5.7 −2.9 12.1 7.1 −5.8 13.2 7.9 −7.0 11.4 8.3 5.1 −1.6 9.5 5.7 −3.1 12.4 7.2 −6.0 13.5 7.9 −7.4 4.0 8.7 5.2 −2.0 9.9 5.8 −3.6 12.9 7.3 −6.6 14.1 8.1 −8.0 −3.3 9.0 5.3 −2.3 10.4 5.9 −4.0 13.5 7.4 −7.2 14.7 8.2 −8.6 a 此处PAHs理化性质(KOA、KOW和PL)的相转移内能取值见文献[13]. 表 2 不同地表温度下土壤中PAHs生物降解半衰期的统计数据[13, 54]
Table 2. Statistical data of biodegradation half-lives of PAHs in soil under different surface temperature
温度/℃
Temperature菲
Phenanthrene芘
Pyrene苯并[a]芘
Benzo(a)pyrene苯并[ghi]苝
Benzo(ghi)perylene中值/d
Median valueP5a/d P95b/d 中值/d
Median valueP5/d P95/d 中值/d
Median valueP5/d P95/d 中值/d
Median valueP5/d P95/d 25.0 21 6 155 246 52 635 261 220 600 635 539 2928 15.5 50 14 369 586 123 1513 622 524 1430 1513 1284 6977 11.4 74 20 547 868 182 2241 921 776 2117 2241 1902 10333 4.0 155 42 1144 1816 380 4688 1927 1624 4430 4688 3979 21616 −3.3 334 91 2466 3914 819 10103 4152 3500 9546 10103 8575 46583 a 第5百分位数统计值5th percentile values;b 第95百分位数统计值95th percentile values. 表 3 气候变化对土壤中POPs二次挥发、生物降解和光降解的影响
Table 3. Effects of climate change on re-volatilization, biodegradation, and photodegradation of POPs in soil
气候变化情景
Climate change scenarios二次挥发
Re-volatilization生物降解
Biodegradation光降解
Photodegradation气象与大气化学因素 升温 ↑ a ↑? b ↑ 辐射增强 ↑ 光氧化剂浓度升高 ↑ 土壤理化性质与生物因素 土壤湿度增加 ↑ ↑↓ c ↑ 细粒组分减少 ↑ 矿物质增加 ↑? ↑? SOM分解加快 ↑ ↑↓ ↑↓ 根际分泌物增加 ↑? a 增强Increased rates;b 增强或不确定变化Increased rates or uncertain trend;c 增强或减弱Increased or decreased rates. -
[1] WANIA F, MACKAY D. Peer reviewed: Tracking the distribution of persistent organic pollutants [J]. Environmental Science & Technology, 1996, 30(9): 390A-396A. [2] COUSINS I T, BECK A J, JONES K C. A review of the processes involved in the exchange of semi-volatile organic compounds (SVOC) across the air–soil interface [J]. Science of the Total Environment, 1999, 228(1): 5-24. doi: 10.1016/S0048-9697(99)00015-7 [3] 王小萍, 孙殿超, 姚檀栋. 气候变化与持久性有机污染物全球循环 [J]. 中国科学(地球科学), 2016, 46(10): 1301-1316. WANG X P, SUN D C, YAO T D. Climate change and global cycling of persistent organic pollutants: A critical review [J]. Scientia Sinica (Terrae), 2016, 46(10): 1301-1316(in Chinese).
[4] CABRERIZO A, MUIR D, de SILVA A O, et al. Legacy and emerging persistent organic pollutants (POPs) in terrestrial compartments in the high Arctic: Sorption and secondary sources [J]. Environmental Science & Technology, 2018, 52(24): 14187-14197. [5] GONG P, WANG X P. Critical roles of secondary sources in global cycling of persistent organic pollutants under climate change [J]. Journal of Hazardous Materials Advances, 2022, 6: 100064. doi: 10.1016/j.hazadv.2022.100064 [6] DING Y, LI L, WANIA F, et al. Do dissipation and transformation of γ-HCH and p, p’-DDT in soil respond to a proxy for climate change?Insights from a field study on the eastern Tibetan Plateau [J]. Environmental Pollution, 2021, 278: 116824. doi: 10.1016/j.envpol.2021.116824 [7] MARQUÈS M, MARI M, AUDÍ-MIRÓ C, et al. Climate change impact on the PAH photodegradation in soils: Characterization and metabolites identification [J]. Environment International, 2016, 89/90: 155-165. doi: 10.1016/j.envint.2016.01.019 [8] HEBERER T, DÜNNBIER U. DDT metabolite bis(chlorophenyl)acetic acid: The neglected environmental contaminant [J]. Environmental Science & Technology, 1999, 33(14): 2346-2351. [9] MARQUÈS M, MARI M, SIERRA J, et al. Solar radiation as a swift pathway for PAH photodegradation: A field study [J]. The Science of the Total Environment, 2017, 581/582: 530-540. doi: 10.1016/j.scitotenv.2016.12.161 [10] IPCC. AR6 Climate Change 2021: The Physical Science Basis[EB/OL]. 2021. [2022-05-01]. https://www.ipcc.ch/report/ar6/wg1/. [11] UNEP. Climate Change and POPs: Predicting the Impacts. Report of the UNEP/AMAP Expert Group[EB/OL]. 2011. [2022-05-01]. https://www.amap.no/documents/download/3237/inline. [12] BISWAS B, QI F J, BISWAS J K, et al. The fate of chemical pollutants with soil properties and processes in the climate change paradigm—A review [J]. Soil Systems, 2018, 2(3): 51. doi: 10.3390/soilsystems2030051 [13] DING Y, LI L, WANIA F, et al. Formation of non-extractable residues as a potentially dominant process in the fate of PAHs in soil: Insights from a combined field and modeling study on the eastern Tibetan Plateau [J]. Environmental Pollution, 2020, 267: 115383. doi: 10.1016/j.envpol.2020.115383 [14] YU Y, KATSOYIANNIS A, BOHLIN-NIZZETTO P, et al. Polycyclic aromatic hydrocarbons not declining in Arctic air despite global emission reduction [J]. Environmental Science & Technology, 2019, 53(5): 2375-2382. [15] NOYES P D, MCELWEE M K, MILLER H D, et al. The toxicology of climate change: Environmental contaminants in a warming world [J]. Environment International, 2009, 35(6): 971-986. doi: 10.1016/j.envint.2009.02.006 [16] MA J M, HUNG H, TIAN C G, et al. Revolatilization of persistent organic pollutants in the Arctic induced by climate change [J]. Nature Climate Change, 2011, 1(5): 255-260. doi: 10.1038/nclimate1167 [17] LOHMANN R, BREIVIK K, DACHS J, et al. Global fate of POPs: Current and future research directions [J]. Environmental Pollution, 2007, 150(1): 150-165. doi: 10.1016/j.envpol.2007.06.051 [18] KOBLIŽKOVÁ M, RŮŽIČKOVÁ P, ČUPR P, et al. Soil burdens of persistent organic pollutants: Their levels, fate, and risks. part IV. quantification of volatilization fluxes of organochlorine pesticides and polychlorinated biphenyls from contaminated soil surfaces [J]. Environmental Science & Technology, 2009, 43(10): 3588-3595. [19] 任娇, 王小萍, 龚平, 等. 持久性有机污染物气—土界面交换研究进展 [J]. 地理科学进展, 2013, 32(2): 288-10,15. doi: 10.11820/dlkxjz.2013.02.015 REN J, WANG X P, GONG P, et al. Research progress on exchange of persistent organic pollutants at the air-soil interface [J]. Progress in Geography, 2013, 32(2): 288-10,15(in Chinese). doi: 10.11820/dlkxjz.2013.02.015
[20] LAMMEL G, DEGRENDELE C, GUNTHE S S, et al. Revolatilisation of soil-accumulated pollutants triggered by the summer monsoon in India [J]. Atmospheric Chemistry and Physics, 2018, 18(15): 11031-11040. doi: 10.5194/acp-18-11031-2018 [21] RŮŽIČKOVÁ P, KLÁNOVÁ J, CUPR P, et al. An assessment of air-soil exchange of polychlorinated biphenyls and organochlorine pesticides across central and southern Europe [J]. Environmental Science & Technology, 2008, 42(1): 179-185. [22] LI Y F, HARNER T, LIU L Y, et al. Polychlorinated biphenyls in global air and surface soil: Distributions, air-soil exchange, and fractionation effect [J]. Environmental Science & Technology, 2010, 44(8): 2784-2790. [23] ZHANG Q Y, WANG Y, ZHANG C, et al. A review of organophosphate esters in soil: Implications for the potential source, transfer, and transformation mechanism[J]. Environmental Research, 2022, 204(Pt B): 112122. [24] WONG F, BIDLEMAN T F. Aging of organochlorine pesticides and polychlorinated biphenyls in muck soil: Volatilization, bioaccessibility, and degradation [J]. Environmental Science & Technology, 2011, 45(3): 958-963. [25] HIPPELEIN M, MCLACHLAN M S. Soil/air partitioning of semivolatile organic compounds. 1. method development and influence of physical–chemical properties [J]. Environmental Science & Technology, 1998, 32(2): 310-316. [26] WONG F, HUNG H, DRYFHOUT-CLARK H, et al. Time trends of persistent organic pollutants (POPs) and Chemicals of Emerging Arctic Concern (CEAC) in Arctic air from 25 years of monitoring [J]. Science of the Total Environment, 2021, 775: 145109. doi: 10.1016/j.scitotenv.2021.145109 [27] WANIA F, WESTGATE J N. On the mechanism of mountain cold-trapping of organic chemicals [J]. Environmental Science & Technology, 2008, 42(24): 9092-9098. [28] WANG X P, WANG C F, ZHU T T, et al. Persistent organic pollutants in the polar regions and the Tibetan Plateau: A review of current knowledge and future prospects [J]. Environmental Pollution, 2019, 248: 191-208. doi: 10.1016/j.envpol.2019.01.093 [29] 柴磊, 王小萍. 青藏高原持久性有机污染物研究现状与展望 [J]. 地球科学进展, 2022, 37(2): 187-201. CHAI L, WANG X P. Current knowledge and future prospects regarding persistent organic pollutants over the Tibetan Plateau [J]. Advances in Earth Science, 2022, 37(2): 187-201(in Chinese).
[30] REN J, WANG X P, GONG P, et al. Characterization of Tibetan soil as a source or sink of atmospheric persistent organic pollutants: Seasonal shift and impact of global warming [J]. Environmental Science & Technology, 2019, 53(7): 3589-3598. [31] CABRERIZO A, DACHS J, BARCELÓ D, et al. Climatic and biogeochemical controls on the remobilization and reservoirs of persistent organic pollutants in Antarctica [J]. Environmental Science & Technology, 2013, 47(9): 4299-4306. [32] CABRERIZO A, DACHS J, MOECKEL C, et al. Ubiquitous net volatilization of polycyclic aromatic hydrocarbons from soils and parameters influencing their soil-air partitioning [J]. Environmental Science & Technology, 2011, 45(11): 4740-4747. [33] DAVIE-MARTIN C L, HAGEMAN K J, CHIN Y P, et al. Influence of temperature, relative humidity, and soil properties on the soil-air partitioning of semivolatile pesticides: Laboratory measurements and predictive models [J]. Environmental Science & Technology, 2015, 49(17): 10431-10439. [34] LI N Q, WANIA F, LEI Y D, et al. A comprehensive and critical compilation, evaluation, and selection of physical–chemical property data for selected polychlorinated biphenyls [J]. Journal of Physical and Chemical Reference Data, 2003, 32(4): 1545-1590. doi: 10.1063/1.1562632 [35] DAS S, HAGEMAN K J. Influence of adjuvants on pesticide soil–air partition coefficients: Laboratory measurements and predicted effects on volatilization [J]. Environmental Science & Technology, 2020, 54(12): 7302-7308. [36] DEGRENDELE C, AUDY O, HOFMAN J, et al. Diurnal variations of air-soil exchange of semivolatile organic compounds (PAHs, PCBs, OCPs, and PBDEs) in a central European receptor area [J]. Environmental Science & Technology, 2016, 50(8): 4278-4288. [37] HELLSING M S, JOSEFSSON S, HUGHES A V, et al. Sorption of perfluoroalkyl substances to two types of minerals [J]. Chemosphere, 2016, 159: 385-391. doi: 10.1016/j.chemosphere.2016.06.016 [38] KOMPRDA J, KOMPRDOVÁ K, SÁŇKA M, et al. Influence of climate and land use change on spatially resolved volatilization of persistent organic pollutants (POPs) from background soils [J]. Environmental Science & Technology, 2013, 47(13): 7052-7059. [39] DAVIDSON E A, JANSSENS I A. Temperature sensitivity of soil carbon decomposition and feedbacks to climate change [J]. Nature, 2006, 440(7081): 165-173. doi: 10.1038/nature04514 [40] HIPPELEIN M, MCLACHLAN M S. Soil/air partitioning of semivolatile organic compounds. 2. influence of temperature and relative humidity [J]. Environmental Science & Technology, 2000, 34(16): 3521-3526. [41] DENG Y, XU W, ZENG Q H, et al. Effects of temperature and relative humidity on soil-air partition coefficients of organophosphate flame retardants and polybrominated diphenyl ethers[J]. Chemosphere, 2022, 291(Pt 1): 132716. [42] SENEVIRATNE S I, CORTI T, DAVIN E L, et al. Investigating soil moisture-climate interactions in a changing climate: A review [J]. Earth-Science Reviews, 2010, 99(3/4): 125-161. [43] CORNELISSEN G, GUSTAFSSON Ö, BUCHELI T D, et al. Extensive sorption of organic compounds to black carbon, coal, and kerogen in sediments and soils: Mechanisms and consequences for distribution, bioaccumulation, and biodegradation [J]. Environmental Science & Technology, 2005, 39(18): 6881-6895. [44] ALI U, SWEETMAN A J, RIAZ R, et al. Organohalogenated contaminants (OHCs) in high-altitude environments: A review and implication for a black carbon relationship [J]. Critical Reviews in Environmental Science and Technology, 2017, 47(13): 1143-1190. doi: 10.1080/10643389.2017.1345601 [45] 黄焕芳. 青藏高原有机氯农药的大气长距离迁移转化研究[D]. 武汉: 中国地质大学, 2018. HUANG H F. Long-range atmospheric transport and transformations of organochlorine pesticides (OCPs) in the Qinghai-Tibet plateau[D]. Wuhan: China University of Geosciences, 2018 (in Chinese).
[46] KÄSTNER M, NOWAK K M, MILTNER A, et al. Classification and modelling of nonextractable residue (NER) formation of xenobiotics in soil–A synthesis [J]. Critical Reviews in Environmental Science and Technology, 2014, 44(19): 2107-2171. doi: 10.1080/10643389.2013.828270 [47] 丁洋, 张原, 黄焕芳, 等. 土壤中持久性有机污染物不可提取态残留的测试方法、生成特征与环境风险研究进展 [J]. 环境化学, 2023, 42(1): 199-212. doi: 10.7524/j.issn.0254-6108.2021091504 DING Y, ZHANG Y, HUANG H F, et al. Determination, formation, and environmental risk of non-extractable residue (NER) of persistent organic pollutants (POPs) in soil: A review [J]. Environmental Chemistry, 2023, 42(1): 199-212(in Chinese). doi: 10.7524/j.issn.0254-6108.2021091504
[48] MA J M, CAO Z H. Quantifying the perturbations of persistent organic pollutants induced by climate change [J]. Environmental Science & Technology, 2010, 44(22): 8567-8573. [49] HANSEN K M, CHRISTENSEN J H, GEELS C, et al. Modelling the impact of climate change on the atmospheric transport and the fate of persistent organic pollutants in the Arctic [J]. Atmospheric Chemistry and Physics, 2015, 15(11): 6549-6559. doi: 10.5194/acp-15-6549-2015 [50] WANIA F. Assessing the potential of persistent organic chemicals for long-range transport and accumulation in polar regions [J]. Environmental Science & Technology, 2003, 37(7): 1344-1351. [51] SHEN L, WANIA F. Compilation, evaluation, and selection of physical–chemical property data for organochlorine pesticides [J]. Journal of Chemical & Engineering Data, 2005, 50(3): 742-768. [52] XIAO H, LI N Q, WANIA F. Compilation, evaluation, and selection of physical-chemical property data for α-, β-, and γ-hexachlorocyclohexane [J]. Journal of Chemical & Engineering Data, 2004, 49(2): 173-185. [53] 廖洋, 梁海鹏, 黄春萍, 等. 土壤持久性有机污染物控制与修复研究进展 [J]. 四川师范大学学报:自然科学版, 2013, 36(5): 777-786. LIAO Y, LIANG H P, HUANG C P, et al. Recent Development in Control and Remediation of Persistent Organic Pollutants in Soil Environment [J]. Journal of Sichuan Normal University (Natural Science), 2013, 36(5): 777-786(in Chinese).
[54] 丁洋. 青藏高原东缘土壤中典型持久性有机污染物的来源与迁移转化机制[D]. 武汉: 中国地质大学, 2021. DING Y. Source Identification and Mechanisms of Transportation and Transformation of Typical Persistent Organic Pollutants in the Soil from the Eastern Tibetan Plateau[D]. Wuhan: China University of Geosciences, 2021(in Chinese).
[55] 阮哲璞, 徐希辉, 陈凯, 等. 微生物降解持久性有机污染物的研究进展与展望 [J]. 微生物学报, 2020, 60(12): 2763-2784. RUAN Z P, XU X H, CHEN K, et al. Recent advances in microbial catabolism of persistent organic pollutants [J]. Acta Microbiologica Sinica, 2020, 60(12): 2763-2784(in Chinese).
[56] LAL R, PANDEY G, SHARMA P, et al. Biochemistry of microbial degradation of hexachlorocyclohexane and prospects for bioremediation [J]. Microbiology and Molecular Biology Reviews, 2010, 74(1): 58-80. doi: 10.1128/MMBR.00029-09 [57] 陶雪琴, 党志, 卢桂宁, 等. 污染土壤中多环芳烃的微生物降解及其机理研究进展 [J]. 矿物岩石地球化学通报, 2003, 22(4): 356-360. doi: 10.3969/j.issn.1007-2802.2003.04.014 TAO X Q, DANG Z, LU G N, et al. Biodegradation mechanism of polycyclic aromatic hydrocarbons (PAHs) in soil: A review [J]. Bulletin of Mineralogy, Petrology and Geochemistry, 2003, 22(4): 356-360(in Chinese). doi: 10.3969/j.issn.1007-2802.2003.04.014
[58] ZHU X J, DSIKOWITZKY L, KUCHER S, et al. Formation and fate of point-source nonextractable DDT-related compounds on their environmental aquatic-terrestrial pathway [J]. Environmental Science & Technology, 2019, 53(3): 1305-1314. [59] ZHANG Z M, SARKAR D, BISWAS J K, et al. Biodegradation of per- and polyfluoroalkyl substances (PFAS): A review[J]. Bioresource Technology, 2022, 344(Pt B): 126223. [60] AREY J, ATKINSON R. Photochemical reactions of PAHs in the atmosphere[M]//PAHs: An Ecotoxicological Perspective. Chichester, UK: John Wiley & Sons, Ltd, : 47-63. [61] SINKKONEN S, PAASIVIRTA J. Degradation half-life times of PCDDs, PCDFs and PCBs for environmental fate modeling [J]. Chemosphere, 2000, 40(9/10/11): 943-949. [62] SCHWARZENBACH R P, GSCHWEND P M, IMBODEN D M. Environmental Organic Chemistry[M]. Hoboken, NJ, USA: John Wiley & Sons, Inc. , 2002. [63] 张乃莉, 郭继勋, 王晓宇, 等. 土壤微生物对气候变暖和大气N沉降的响应 [J]. 植物生态学报, 2007, 31(2): 252-261. doi: 10.17521/cjpe.2007.0029 ZHANG N L, GUO J X, WANG X Y, et al. Soil microbial feedbacks to climate warming and atmospheric n deposition [J]. Chinese Journal of Plant Ecology, 2007, 31(2): 252-261(in Chinese). doi: 10.17521/cjpe.2007.0029
[64] ALKORTA I, EPELDE L, GARBISU C. Environmental parameters altered by climate change affect the activity of soil microorganisms involved in bioremediation [J]. FEMS Microbiology Letters, 2017, 364(19): fnx200. [65] OKERE U V, SEMPLE K T. Biodegradation of PAHs in ‘pristine’ soils from different climatic regions [J]. Journal of Bioremediation & Biodegradation, 2012, S1: 006. [66] BARRIOS R E, AKBARIYEH S, LIU C Y, et al. Climate change impacts the subsurface transport of atrazine and estrone originating from agricultural production activities [J]. Environmental Pollution, 2020, 265: 115024. doi: 10.1016/j.envpol.2020.115024 [67] WHITE J C, KELSEY J W, HATZINGER P B, et al. Factors affecting sequestration and bioavailability of phenanthrene in soils [J]. Environmental Toxicology and Chemistry, 1997, 16(10): 2040-2045. doi: 10.1002/etc.5620161008 [68] BISWAS B, SARKAR B, RUSMIN R, et al. Bioremediation of PAHs and VOCs: Advances in clay mineral-microbial interaction [J]. Environment International, 2015, 85: 168-181. doi: 10.1016/j.envint.2015.09.017 [69] YANG Y, ZHANG N, XUE M, et al. Effects of soil organic matter on the development of the microbial polycyclic aromatic hydrocarbons (PAHs) degradation potentials [J]. Environmental Pollution, 2011, 159(2): 591-595. doi: 10.1016/j.envpol.2010.10.003 [70] 邢维芹, 骆永明, 李立平, 等. 持久性有机污染物的根际修复及其研究方法 [J]. 土壤, 2004, 36(3): 258-263. doi: 10.3321/j.issn:0253-9829.2004.03.006 XING W Q, LUO Y M, LI L P, et al. Rhizosphere remediation from persistent organic pollutants and research approaches [J]. Soils, 2004, 36(3): 258-263(in Chinese). doi: 10.3321/j.issn:0253-9829.2004.03.006
[71] AI F X, EISENHAUER N, JOUSSET A, et al. Elevated tropospheric CO2 and O3 concentrations impair organic pollutant removal from grassland soil [J]. Scientific Reports, 2018, 8: 5519. doi: 10.1038/s41598-018-23522-z [72] CÉBRON A, LOUVEL B, FAURE P, et al. Root exudates modify bacterial diversity of phenanthrene degraders in PAH-polluted soil but not phenanthrene degradation rates [J]. Environmental Microbiology, 2011, 13(3): 722-736. doi: 10.1111/j.1462-2920.2010.02376.x [73] USEPA. Chemistry Dashboard[EB/OL]. [2022-05-01]. https://comptox.epa.gov/dashboard. [74] 刘尘, 牛晓君, 谢贵婷. 大气环境变化对污染土壤中PBDEs自然降解过程的影响研究 [J]. 环境科学学报, 2015, 35(10): 3242-3251. LIU C, NIU X J, XIE G T. Natural degradation process of PBDEs in polluted soil under the changes of atmospheric environment [J]. Acta Scientiae Circumstantiae, 2015, 35(10): 3242-3251(in Chinese).
[75] 张利红, 陈忠林, 徐成斌, 等. 表层土壤中菲的紫外光降解研究 [J]. 农业环境科学学报, 2009, 28(6): 1115-1119. ZHANG L H, CHEN Z L, XU C B, et al. The photodegradation of phenanthrene on soil surface under UV light [J]. Journal of Agro-Environment Science, 2009, 28(6): 1115-1119(in Chinese).
[76] UNEP. Environmental effects of ozone depletion and its interactions with climate change: 2010 Assessment[EB/OL]. 2010. [2022-05-01]. https://www.unep.org/resources/report/environmental-effects-ozone-depletion-and-its-interactions-climate-change-2010. [77] BAIS A F, MCKENZIE R L, BERNHARD G, et al. Ozone depletion and climate change: Impacts on UV radiation [J]. Photochemical & Photobiological Sciences, 2015, 14: 19-52. [78] 贾龙, 葛茂发, 徐永福, 等. 大气臭氧化学研究进展 [J]. 化学进展, 2006, 18(11): 1565-1574. doi: 10.3321/j.issn:1005-281X.2006.11.019 JIA L, GE M F, XU Y F, et al. Advances in atmospheric ozone chemistry [J]. Progress in Chemistry, 2006, 18(11): 1565-1574(in Chinese). doi: 10.3321/j.issn:1005-281X.2006.11.019
[79] 张利红, 李培军, 李雪梅, 等. 有机污染物在表层土壤中光降解的研究进展 [J]. 生态学杂志, 2006, 25(3): 318-322. ZHANG L H, LI P J, LI X M, et al. Research advance in photodegradation of organic pollutants in surface soil [J]. Chinese Journal of Ecology, 2006, 25(3): 318-322(in Chinese).
[80] PAN Y H, TSANG D C W, WANG Y Y, et al. The photodegradation of polybrominated diphenyl ethers (PBDEs) in various environmental matrices: Kinetics and mechanisms [J]. Chemical Engineering Journal, 2016, 297: 74-96. doi: 10.1016/j.cej.2016.03.122 [81] 王依雪, 康春莉, 刘汉飞, 等. 模拟太阳光作用下2-氯萘在土壤中的光降解 [J]. 科学技术与工程, 2015, 15(15): 222-224. doi: 10.3969/j.issn.1671-1815.2015.15.042 WANG Y X, KANG C L, LIU H F, et al. Photodegradation of 2-chloronaphthalene in soil under the simulated solar light [J]. Science Technology and Engineering, 2015, 15(15): 222-224(in Chinese). doi: 10.3969/j.issn.1671-1815.2015.15.042
[82] 牛军峰, 余刚, 刘希涛. 水相中POPs光化学降解研究进展 [J]. 化学进展, 2005, 17(5): 938-948. NIU J F, YU G, LIU X T. Advances in photolysis of persistent organic pollutants in water [J]. Progress in Chemistry, 2005, 17(5): 938-948(in Chinese).
[83] 牛军峰, 全燮, 陈景文, 等. 低有机碳含量表层土中Fe2O3对γ-666光解的催化作用 [J]. 环境科学, 2002, 23(2): 92-95. NIU J F, QUAN X, CHEN J W, et al. Effect of Fe2O3 on photodegradation of γ-666 in surface soils with low amount of organic substance [J]. Enviromental Science, 2002, 23(2): 92-95(in Chinese).
[84] LIU J Q, XIANG W R, LI C G, et al. Kinetics and mechanism analysis for the photodegradation of PFOA on different solid particles [J]. Chemical Engineering Journal, 2020, 383: 123115. doi: 10.1016/j.cej.2019.123115 [85] 阎百兴, 汤洁. 黑土侵蚀速率及其对土壤质量的影响 [J]. 地理研究, 2005, 24(4): 499-506. doi: 10.3321/j.issn:1000-0585.2005.04.002 YAN B X, TANG J. Study on black soil erosion rate and the transformation of soil quality influenced by erosion [J]. Geographical Research, 2005, 24(4): 499-506(in Chinese). doi: 10.3321/j.issn:1000-0585.2005.04.002
[86] 潘相敏, 陈立民, 成玉, 等. 气溶胶中多环芳烃光降解的初步研究 [J]. 环境化学, 1999, 18(4): 327-332. PAN X M, CHEN L M, CHENG Y, et al. A preliminary research on photodegradation of pahs in aerosols [J]. Environmental Chemistry, 1999, 18(4): 327-332(in Chinese).
[87] 蔡啸宇. 多氯联苯的光\光敏化降解机理研究[D]. 北京: 华北电力大学(北京), 2016. CAI X Y. Research on the photo and photosensitive degradation of PCBs[D]. Beijing: North China Electric Power University, 2016(in Chinese).
[88] ZALESKA A, HUPKA J, WIERGOWSKI M, et al. Photocatalytic degradation of lindane, p, p'-DDT and methoxychlor in an aqueous environment [J]. Journal of Photochemistry and Photobiology A:Chemistry, 2000, 135(2/3): 213-220. [89] NGUYEN V H, SMITH S M, WANTALA K, et al. Photocatalytic remediation of persistent organic pollutants (POPs): A review [J]. Arabian Journal of Chemistry, 2020, 13(11): 8309-8337. doi: 10.1016/j.arabjc.2020.04.028 [90] 张红, 吕永龙, 辛晓云, 等. 杀虫剂类POPs对土壤中微生物群落多样性的影响 [J]. 生态学报, 2005, 25(4): 937-942. doi: 10.3321/j.issn:1000-0933.2005.04.041 ZHANG H, LÜ Y L, XIN X Y, et al. Effects of organochlorine pesticides on soil microbial community functional diversity [J]. Acta Ecologica Sinica, 2005, 25(4): 937-942(in Chinese). doi: 10.3321/j.issn:1000-0933.2005.04.041
[91] 武彤, 田柳, 崔建升, 等. 六溴环十二烷对映体对玉米的生理和基因损伤研究 [J]. 环境科学学报, 2018, 38(12): 4864-4872. WU T, TIAN L, CUI J S, et al. Physiological and genetic damage effects of hexabromocyclododecane enantiomers on maize [J]. Acta Scientiae Circumstantiae, 2018, 38(12): 4864-4872(in Chinese).
[92] 罗云, 张保琴, 任晓倩, 等. 氯代多环芳烃的污染现状及毒性研究进展 [J]. 生态毒理学报, 2017, 12(3): 120-134. LUO Y, ZHANG B Q, REN X Q, et al. Advances in the researches on the occurrence and toxicity of chlorinated polycyclic aromatic hydrocarbons [J]. Asian Journal of Ecotoxicology, 2017, 12(3): 120-134(in Chinese).
[93] 胡霞林, 刘景富, 卢士燕, 等. 环境污染物的自由溶解态浓度与生物有效性 [J]. 化学进展, 2009, 21(2/3): 514-523. HU X L, LIU J F, LU S Y, et al. Freely dissolved concentration and bioavailability of environmental pollutants [J]. Progress in Chemistry, 2009, 21(2/3): 514-523(in Chinese).
[94] QU C, QI S, YANG D, et al. Risk assessment and influence factors of organochlorine pesticides (OCPs) in agricultural soils of the hill region: A case study from Ningde, southeast China [J]. Journal of Geochemical Exploration, 2015, 149: 43-51. doi: 10.1016/j.gexplo.2014.11.002 [95] ORTEGA-CALVO J J, HARMSEN J, PARSONS J R, et al. From bioavailability science to regulation of organic chemicals [J]. Environmental Science & Technology, 2015, 49(17): 10255-10264. [96] NADAL M, MARQUÈS M, MARI M, et al. Climate change and environmental concentrations of POPs: A review[J]. Environmental Research, 2015, 143(Pt A): 177-185. [97] WETTERAUER B, RICKING M, OTTE J C, et al. Toxicity, dioxin-like activities, and endocrine effects of DDT metabolites: DDA, DDMU, DDMS, and DDCN [J]. Environmental Science and Pollution Research, 2012, 19(2): 403-415. doi: 10.1007/s11356-011-0570-9 [98] 黄苑, 苏晓鸥, 王瑞国, 等. 多氯联苯羟基化代谢物及其雌激素效应研究进展 [J]. 生态毒理学报, 2018, 13(5): 58-68. doi: 10.7524/AJE.1673-5897.20180111001 HUANG Y, SU X O, WANG R G, et al. Advances on hydroxylated polychlorinated biphenyls metabolites and the estrogenic effects [J]. Asian Journal of Ecotoxicology, 2018, 13(5): 58-68(in Chinese). doi: 10.7524/AJE.1673-5897.20180111001
[99] 马涛, 孔继婕, 韩孟书, 等. 环境中硝基多环芳烃的污染现状及其毒性效应研究进展 [J]. 环境化学, 2020, 39(9): 2430-2440. doi: 10.7524/j.issn.0254-6108.2019062907 MA T, KONG J J, HAN M S, et al. Review on the pollution status and toxicity effects of nitrated polycyclic aromatic hydrocarbons in the environment [J]. Environmental Chemistry, 2020, 39(9): 2430-2440(in Chinese). doi: 10.7524/j.issn.0254-6108.2019062907
-



 下载:
下载: