-
雌激素作为环境中普遍存在的一类典型的内分泌干扰物(EDCs),具有分布广、浓度低、毒性强和风险高等特点[1 ‒ 2]. 该类有害化合物主要来源于污水处理厂和禽畜养殖场,它们在低剂量条件下就会导致水生生物雌性化甚至种群灭绝,已引起世界各国政府和公众的广泛关注[3]. 雌激素可通过粪肥还田、污水灌溉和地表径流等方式进入农业生态系统,其中畜禽粪污释放的雌激素约占总量的90%以上[4]. 中国每年约产生45亿t畜禽粪污,其中雌激素含量高达2.05 × 106 kg,远超美国和欧盟年均排放的畜禽粪污中雌激素(分别为4.9 × 104 kg和3.3 × 104 kg)总和[5]. 当农业生态系统中雌激素的浓度大于环境容量时,会对野生生物和人民健康构成严重危害. 已证实痕量浓度(1.0 ng·L−1)雌激素即可干扰生物体正常的代谢功能、影响有机体生殖发育,甚至导致物种癌变和死亡[6]. 因此,明确环境中雌激素污染现状、转化路径和生态风险极其重要.
目前,科学家已经探讨了沉积物和地表水中雌激素的来源、发生和环境归趋[7 ‒ 9],而关于粪肥源雌激素在农田土壤-作物生态系统内的存在形态、运移规律、降解机制和毒理风险的研究仍较少. 据报道生菜、萝卜和玉米等农产品均受到不同程度的粪肥源雌激素污染,其体内雌激素的残留量达到2.0 μg·kg−1以上[10 ‒ 12],高于联合国粮农组织/世界卫生组织(FAO/WHO)规定的儿童日摄入量最大值(0.5 μg·d−1). 由此可见,农产品中雌激素残留存在严重的膳食风险隐患.
本文概述了畜禽粪污中雌酮(E1)、17β-雌二醇(E2)、雌三醇(E3)、17α-炔雌醇(EE2)和双酚A(BPA)等5种代表性环境雌激素的污染现状和分布规律,总结了粪肥源雌激素在农田土壤-作物中的输运转化、吸收积累和降解机制,系统地评估了农业生态系统中雌激素对敏感生物和人群健康的污染风险,结果有望为消减农田土壤-作物雌激素污染风险奠定理论基础.
-
畜禽粪污中普遍存在的雌激素包括E1、E2、E3、EE2和BPA. 由于雌激素的蒸汽压值小、挥发性低,其释放到大气的部分可忽略不计. 如表1所示,雌激素活性基团的种类和空间排列是影响其理化性质的关键因素. 相比E1、E2和E3等3种天然雌激素,人工合成的EE2溶解度更低、疏水性更强. 但无论是天然雌激素还是人工合成雌激素,它们对生物体的内分泌干扰效应均可达到其他常见EDCs的数万倍. 虽然,经过常规技术处理后,污水中雌激素的残留浓度在ng·L−1—μg·L−1之间;但是,由于雌激素具有极强的环境持久性和难生物降解性,其在ng·L−1水平仍可对动物和人体造成危害. 据监测牛和家禽粪污中含有大量雌激素,英国农场年均向环境中排泄的E1和E2分别高达1315 kg和570 kg[6]. 因此,雌激素释放到环境中引发的污染风险不言而喻.
畜禽粪污中雌激素浓度变化差异显著,主要归因于动物类型、粪污特性、繁殖周期和牲畜的生物学特性[13 ‒ 14]. 例如,每头奶牛的雌激素日排放量可达1.5 mg(牛粪和浆液中E1含量分别高达39 μg·kg−1和4.5 μg·L−1)[15];而每头孕期奶牛的雌激素排泄量高达11300—31464 μg·d−1. 每头孕期猪粪中雌激素排泄量为32—120 μg·d−1,其尿液中E1排泄量高达704—17280 μg·d−1,而每头寻常猪粪中雌激素排泄量仅有7—36 μg·d−1[16 ‒ 17]. 可见,怀孕的猪牛能够排放更高的雌激素负荷,E1是畜禽粪污中雌激素负荷的主要贡献者.
-
雌激素具备中度疏水特性,它们进入农田生态系统后,可威胁土壤-作物安全和人民健康[18]. 人类和畜禽体内的雌激素会被机体部分代谢,而未被降解和代谢的雌激素及其产物则通过粪污排放到体外. 已证实人类排泄的雌激素主要以E1-3-葡萄糖苷酸盐(E1-3G)、E2-3-葡萄糖苷酸盐(E2-3G)和E3-16-葡萄糖苷酸盐(E3-16G)等结合态形式(约占95%)由尿液排放到环境中[15, 19]. 此外,在人类生产的某些避孕药中也可能存在不同结合态EE2,它们通过口服摄入体内并由孕体以EE2-3-葡萄糖苷酸盐(EE2-3G)和EE2-3-硫酸盐(EE2-3S)形态从尿液释放. 猪、牛、羊等不同类型的动物粪污中雌激素种类和含量存在显著地差异性. 比如,牛、羊是以粪便排放的游离态雌激素为主,仅尿液中含少量的结合态雌激素;与之相反,猪和家禽由尿液排放的雌激素占主导地位[14]. 与未怀孕状态的动物相比,孕期动物尿液中雌激素含量较高,且随着分娩时间的临近,其尿液中雌激素的含量逐渐升高. 相对于固体粪便中雌激素,尿液中雌激素的检出量普遍较高[20]. 在世界范围内,富含畜禽粪污的农田主要分布在欧洲、巴西、中国、东南亚和印度等地. 富含粪肥的栽培区(> 90%)占全球肥料应用量3.2%,主要分布在中国和印度[21]. 需强调,近30年全球畜禽密度持续增长,显著地提高了畜禽粪便和尿液中雌激素的排泄量.
-
运用固相萃取-高效液相色谱串联质谱(SPE-HPLC-MS/MS)分析手段,可明确畜禽粪污中雌激素分布特征[20, 22]. 养猪场粪便、沼渣肥料以及还田土壤中E1、E2、E3、EE2和己烯雌酚(DES)等5种雌激素的总量分别为94.5、35.1、0. 1 μg·kg−1,而尿液和沼液中分别为8882.2 ng·L−1和4388.6 ng·L−1,其中E1是畜禽粪污中最主要的雌激素[13];奶牛场粪便、堆肥、还田土壤中雌激素总量分别为84.6、16.2、0.1 μg·kg−1,而尿液和污水进水及出水中则分别为2636.7、2605.6、615.7 ng·L−1,其中E1和E2含量最高. 猪场和奶牛场排泄物中雌激素浓度主要表现为粪便 > 有机肥、尿液 > 污水. 在夏季雌激素的含量最高,并与溶解性有机碳浓度呈正相关,保留有机碳的营养管理可能有助于雌激素去除[23]. 厌氧发酵、厌氧-好氧组合工艺、固体粪便高温好氧堆肥等技术对猪场污水、奶牛场排泄物中雌激素具有良好的去除效果. 世界人口主要分布在亚洲的发展中国家,肉类和乳制品消费分别以每年4%和2%—3%的速度增长[24]. 雌激素的排放总量受该趋势影响,最终可能增加其在环境中的时空分布和污染风险.
-
雌激素进入农田生态环境后,涉及土壤吸附和微生物降解2个过程. 土壤通过疏水分配或π电子与氢键互用等机制吸附雌激素,其吸附行为与土壤有机质含量、矿物质组分和粒径分布等因素密不可分. 通常认为土壤中雌激素能够在6—8 h内达到吸附平衡状态,其前期吸附较快,达到吸附平衡后速率逐渐下降[25]. 由于土壤的吸附和降解作用,导致雌激素的迁移深度较浅. 雌激素田间传输试验证实,E1和E2在土壤大孔隙和径流条件下会发生快速迁移,而胶体可促进雌激素的迁移[26]. 但是,实际土壤环境较为复杂,雌激素的具体迁移路径仍需进一步研究.
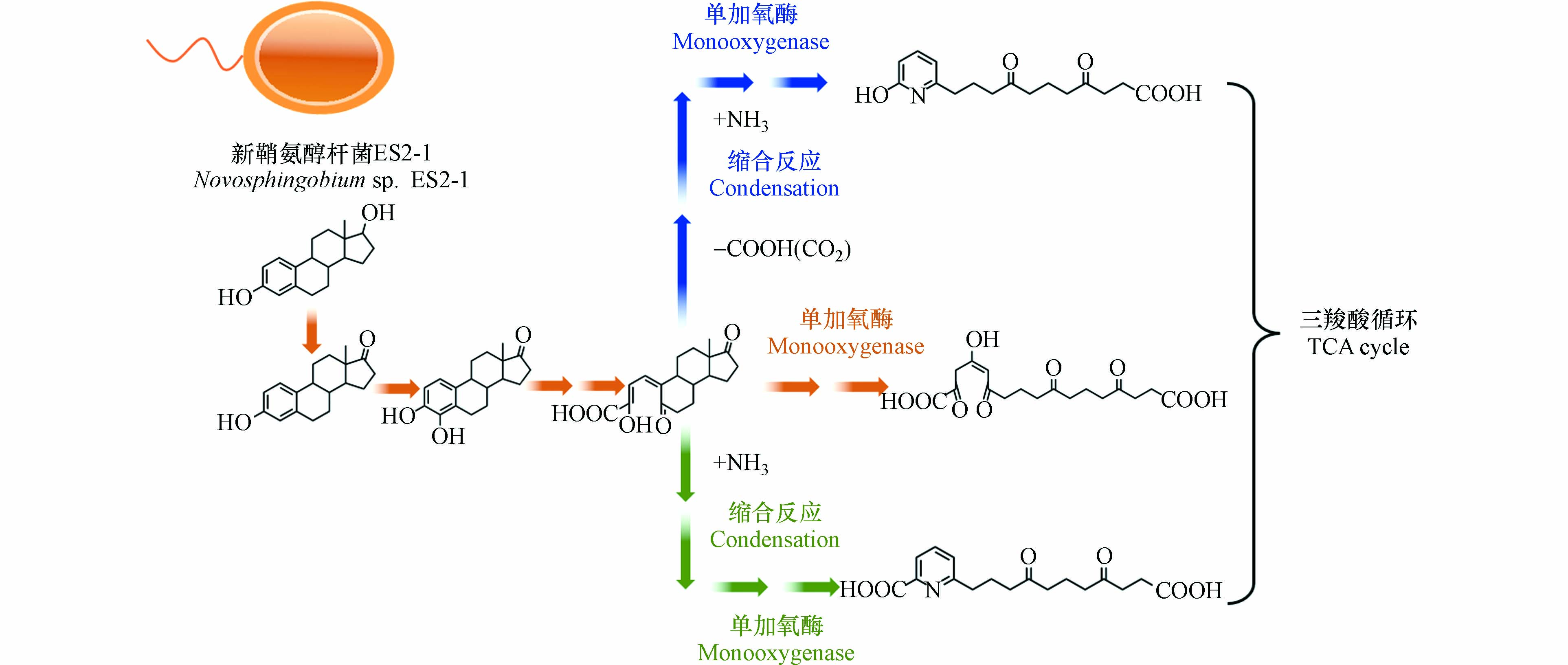
土壤中雌激素的降解主要包括微生物、化学和光降解. 不同雌激素的降解机制差异显著,其中天然雌激素E1和E2以微生物代谢为主,人工合成雌激素EE2以非生物转化为主. 有氧生物降解是土壤中雌激素的关键代谢机制,缺氧或厌氧状态下雌激素的代谢速率明显减缓. 因此,长期处于缺氧或厌氧环境下的沉积物被称为雌激素“天然储存库”[16]. 雌激素的降解过程通常表现为前期快速氧化降解,后期逐渐趋于平缓. 图1展示了环境微生物代谢E2的关键途径,包括脱氢、氧化、环裂解、脱碳、缩合等,最终通过三羧酸循环矿化为CO2和H2O[27]. 与人工合成雌激素相比,天然雌激素在环境中的生物降解速率明显较快. 需指出当EE2、E1、E2、E3等4种雌激素共存时,微生物可能通过共代谢作用提高EE2的降解效率[28]. 雌激素的降解速率和半衰期是决定其在生态系统中持久性和危害性的关键因素.
普通和粪便改良土壤中雌激素的降解半衰期存在显著性差异. 雌激素在普通土壤中降解半衰期为0.8—25 d,其在粪便改良土壤中降解半衰期则缩短至1—9 d[16 ‒ 17]. 影响土壤中雌激素降解半衰期的主要因素包括pH和温度,自然光照影响较小,低温和酸性条件下不利于雌激素生物降解. 例如,奶牛粪便中E2在强酸(pH < 2.0)和低温环境下转化率仅为15%,显著地低于碱性高温条件(> 80%)[16]. 此外,共存污染物也会影响雌激素在土壤中降解速率和半衰期. 已有报道指出添加抗生素会抑制雌激素降解,且不同抗生素产生的抑制效应存在明显差异,主要是因为抗生素阻碍了微生物生长繁殖[29]. 土壤中共存的重金属离子也会对雌激素的降解产生阻碍作用. 显然,雌激素在农田土壤中难以被微生物彻底分解代谢,其残留组分仍能被作物吸收积累,从而对农产品质量和安全构成严重威胁.
-
萝卜、生菜、小麦和玉米等作物均可通过根系吸收积累农田土壤中雌激素[30 ‒ 32]. 根系对雌激素的吸收与其lgKow、根脂肪含量呈正相关,与土壤有机质含量呈负相关[33 ‒ 34]. E1、E2、E3、EE2和BPA等雌激素的lgKow为2.81—4.12,它们可与根细胞壁中交换位点相互作用,进而被根脂肪含量较高的作物吸收和积累. 研究表明小麦根系主要通过主动吸收的方式积累E2,该过程涉及水通道蛋白和阴离子通道的跨膜运输[35]. 雌激素被根系吸收后,可在作物蒸腾拉力驱动下向茎叶运移,其转移效率与作物蒸腾流体积、叶绿素和蛋白质含量以及雌激素lgKow等因素密切相关. 作物暴露在雌激素最大毒害浓度时,会导致其生理功能损伤. 当E2暴露浓度为50 μg·L−1时,萝卜幼苗抗氧化能力明显降低,膜质过氧化水平加重[11]. 120—320 mg·L−1的BPA可显著地降低卷心菜、玉米和燕麦等作物生物量[36]. 此外,雌激素污染也会对作物矿质元素吸收、蛋白质组分、细胞器结构等生理生化功能造成毁灭性破坏[30]. 可见,雌激素污染会降低农产品的产量和品质.
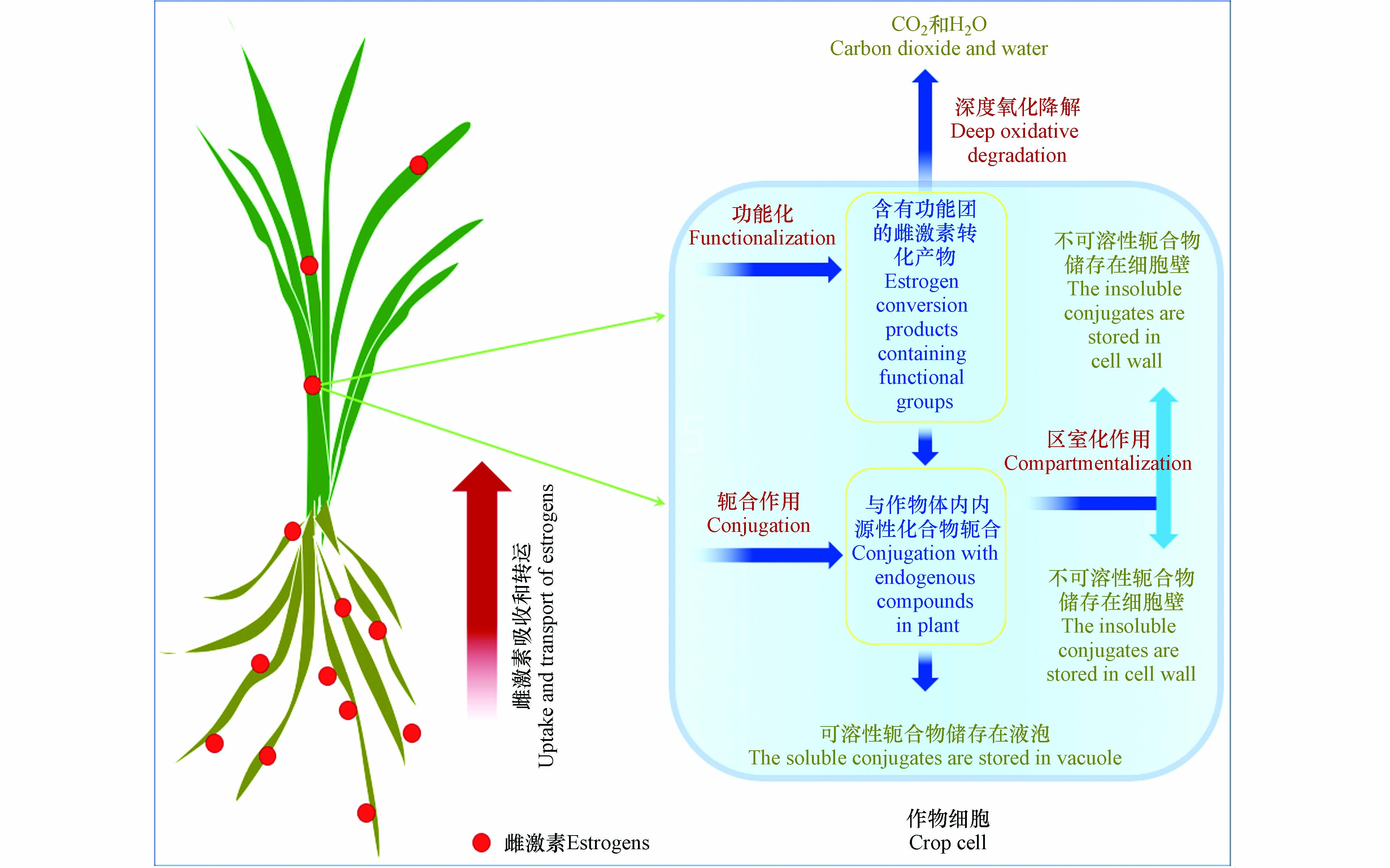
粪肥源雌激素在作物体内的代谢机理可能包括以下4个过程(图2)[37]:(1)作物体内的氧化酶和还原酶能够直接参与雌激素的氧化、还原和水解等作用,生成含有功能团的雌激素转化产物;(2)雌激素功能团化产物进一步与作物体内内源性化合物轭合,形成毒性小于母体化合物的轭合物;(3)作物通过区室化作用,将可溶性轭合物储存在液泡中,不可溶性轭合物则储存在细胞壁中;(4)部分雌激素功能团化产物经过深度氧化后,可完全转化为CO2和H2O. 例如,研究者采用14C放射性同位素示踪手段,在小麦和大豆细胞提取物中发现了大量14C-BPA糖基化、非可提取性和高极性轭合物,表明作物能代谢雌激素并通过区室化作用将其以轭合物的形式固定在细胞内[38]. 另有学者指出玉米幼苗可将根中E2氧化成E1,但在茎叶中并未检测到E2的转化产物[39]. 我国科学家也发现萝卜幼苗体内E2的积累量与E2污染浓度呈正相关,其在转运过程中发生代谢,生成具有低雌激素活性的E1[30]. 雌激素及其代谢产物在作物组织中的分布差异可能是由不同作物对雌激素吸收转运能力和代谢途径的差异导致,且受到作物体内有毒有机物降解酶系种类、数量和代谢活性的调控作用. 尽管如此,长期暴露在污染环境中的作物体内仍残留大量的雌激素,它们增加了人类膳食摄取风险.
-
采用水体中雌激素预测无效应浓度(PNECwater)和土水分配系数(KD)的乘积,计算农田土壤中雌激素预测无效应浓度(PNECsoil)值,如公式(1)所示:
式中,PNEC为预测无效应浓度,L(E)C50为半数致死(效应)浓度(ng·L−1),NOEC为最大无影响浓度(ng·L−1),AF为评估因子,其确定需要依据急性与慢性毒性量而定. KD考虑了土壤颗粒对雌激素的吸附作用,可用于确定土壤无脊椎动物的PNECsoil. E2、17α-E2、E1和E3对农业土壤无脊椎动物产生风险的PNECsoil值分别为1、7.9、2.5、711 ng·g−1[40].
农田土壤中雌激素进入作物体内,会干扰作物体内内源激素的合成和转运,从而影响植物发芽、生长和酶活性等. 例如,高浓度E2(10 mg·L−1)处理组中玉米种子的萌发时间比对照组的种子萌发时间延迟12 h. 水培试验发现,与不含雌激素的对照组相比,E1、E2、E3或EE2的存在会抑制生菜、玉米、番茄等作物根系生长,其抑制效应随雌激素浓度的增大(0.1 mg·L−1增加至10 mg·L−1)而增强[6]. 此外,作物在遭遇雌激素污染胁迫后,其体内抗氧化物酶活性会随着雌激素浓度的增大而显著增加,表明雌激素刺激了作物体内的抗氧化酶活性,但并不足以完全清除雌激素[32]. 该过程中产生和积累的活性氧,导致作物发生氧化损伤,最终表现为作物生长受到抑制.
微生物代谢可降低农田土壤中雌激素含量,从而减少雌激素由土壤向作物迁移. 研究人员发现测试点土壤风险商(RQ)值显著地高于1,说明土壤雌激素存在较高生态风险[17]. 这主要是因为土壤表土层是畜禽粪便的直接受体. 在亚粘土层,微生物丰富度较高,部分雌激素被微生物降解. 因此,亚黏土层的雌激素RQ值相对较低. 随着土壤深度的增加,微生物数量和活性逐渐降低,而雌激素发生积累,使得RQ值过高. 在含水层,雌激素受地下水的溶滤作用导致其浓度下降,RQ值也相应减低. 另外,雌激素的种类和组成也会干扰土壤细菌生长和代谢活动. 例如,与E1污染土壤相比,E2污染土壤中细菌的生长和代谢行为从最初就受到抑制,土壤呼吸强度较低,说明E2雌激素活性显著地高于E1,对细菌生长表现出明显地抑制作用[33]. 在雌激素降解过程中土壤呼吸强度和细菌总数的变化趋势表现出类似规律,证实土壤细菌在雌激素降解代谢中起到关键作用.
-
雌激素进入人体后,可扰乱人体正常内分泌功能,对生殖系统、神经系统和免疫系统等造成严重损伤[18]. 目前,WHO和美国环境保护局(EPA)尚未提供致癌风险评价参数和效力因子,以评估雌激素对人体的致癌效应. 因此,本文主要评估E1和E2的非致癌风险. 与成人相比,儿童对非致癌效应的敏感度更高,所以被选为污染受体. 土壤中雌激素的暴露途径主要包括口摄入、皮肤接触和吸入土壤颗粒物. 考虑人类会通过饮用地下水摄入雌激素,采用公式(2)和(3)分别计算经口摄入的土壤雌激素暴露量(OISERnc, kg·kg−1·d−1)和饮用受影响地下水对应的雌激素暴露量(CGWERnc, L·kg−1·d−1):
式中,OSIRc表示儿童每日摄入土壤量(为200 mg·d−1);EDc表示儿童暴露期(为6 a);EFc表示儿童暴露频率(为350 d·a−1);ABSa表示经口摄入进气吸收效率因子(数值取1);BWc表示儿童体重(为15.9 kg);ATnc表示非致癌效应平均时间(为2190 d);GWCRc表示儿童每日饮水量(L·d−1).
污染物的非致癌风险主要以剂量阈效应体现. 因此,通过商值法能够评估雌激素的非致癌风险. 当非致癌风险危险商(HQ) < 1时,表示不会产生非致癌风险;当HQ > 1时,表示非致癌风险超过可接受水平. 经口摄入途径的健康风险HQ计算参考公式(4)和(5):
式中,HQois指经口摄入土壤途径的危险商;HQcgw指饮用地下水途径的危险商;Csur指表层土壤中污染物浓度(mg·kg−1);SAF/WAF指暴露于土壤/地下水的污染物剂量分配系数(SAF取值0.2);RfDo指经口摄入参考剂量(5.00×10−5 mg·kg−1·d−1).
土壤中雌激素通过不同暴露途径的非致癌风险HQ均小于1,低于人体健康非致癌风险可接受值[17]. 多种暴露途径的综合非致癌风险HQ = 0.04618,表明测试点的雌激素对人类致癌风险较低,在可接受水平. 需强调,对于土壤中E1、E2和EE2的最大预测环境浓度(PEC),当它们的非致癌风险HQ > 1时,人类通过口腔摄入雌激素的风险更高. 总体上,雌激素污染的地表水的致癌风险较低,不会对儿童造成健康风险. 虽然,土壤摄入的雌激素致癌风险较高,但难以危害儿童健康,因为儿童通过口腔摄取农业土壤的可能性较小. 尽管如此,由于痕量浓度雌激素即可表现出较强的危害效力,不应假定雌激素在受污染的土壤和饮用水中的致癌风险在可接受水平.
目前,用于评估人类健康风险的雌激素生态风险模型并不准确,因为它们没有考虑环境基质中其他EDCs和协同物质. 此外,这些模型也没有涉及与雌激素周期性峰值浓度相关的急性毒性的可能性. 多数环境雌激素风险评估集中在其与乳腺癌的关系上,监测饮用水中雌激素浓度并评估人体对饮用水的每日允许摄入量也必不可少. 总体而言,全球饮用水中雌激素浓度在可接受风险水平范围内;而地表水雌激素浓度低于10 ng·L−1,并未超过美国EPA、WHO和欧盟规定限制. 尽管如此,暴露在低风险水平的雌激素仍会干扰生物体内的激素信号,引发有机体内分泌系统紊乱. 同时,饮用水中残留的少量雌激素也会影响人体生殖发育,导致更年期,并致使男性精子数量下降,呈现女性化. 因此,研究者应当将粪肥源雌激素和其他EDCs纳入常规筛查范围,并构建更加完善的雌激素生态风险评估模型,系统地揭示粪肥源雌激素在农田土壤-作物中的潜在风险.
-
采用RQ方法,可评估农田土壤中雌激素生态风险,如公式(6)所示:
式中,RQ表示风险商值,MEC和PNEC分别为实测雌激素环境暴露浓度和预测无效应浓度. PNEC主要由半数效应浓度(EC50)和半数致死浓度(LC50)推导计算获得[41].
根据研究者提出的RQ表征方法,可将其生态等级划分为3级[42]:当RQ ≥ 1.0,生态风险较高;当0.1 ≤ RQ < 1.0,污染物具有一定生态风险;当RQ < 0.1时,目标物对环境产生的风险相对较低. 我国科学家研究了城市污水出水并获得了雌激素的RQ值,其中EE2、E1和E3的RQ值高于1,为高生态风险物质[43];BPA的RQ值大于1的比例为30%—50%,生态风险相对较低;E2的RQ值均小于1. 因此,应优先控制EE2、E1和E3等3种雌激素污染物. 然而,由于PNEC具有可变性,不同时期监测到的雌激素浓度显著不同,且环境承载能力和自净能力也存在差异,同时对环境造成破坏时的阈值也在变化. 因此,RQ值并不完全确定.
-
E2是雌激素活性最强的一种环境EDCs. 因此,利用E2当量(EEQ)表征农田土壤中雌激素活性强度,可用于评价雌激素生态风险[44]. 雌激素的EEQ能够通过其相对E2当量因子(EEF)和环境中雌激素实测暴露浓度(MEC)进行计算,如公式(7)所示:
E1、E2、E3、EE2和BPA等5种雌激素的EEF分别为0.59、1.0、0.033、8.71、1.07 × 10-4[13]. EEF值由酵母雌激素筛选试验(YES)获得. EEF值越大,表示该物质的相对雌激素活性越大.
根据环境介质中雌激素浓度,计算EEQ:
风险等级分成3类:EEQ < 1 ng·L−1为无最低风险;1 ng·L−1 < EEQ < 10 ng·L−1为中等风险;EEQ > 10 ng·L−1为高风险[41]. 雌激素活性测定试验表明[43],EE2的EEQ最大,其EEQ高于1 ng·L−1的累积频率在98%以上,最高可达103 ng·L−1;E1和E2的EEQ高于1 ng·L−1的比例为70%—80%;E3有55%的EEQ大于1 ng·L−1;BPA的EEQ高于1 ng·L−1的比例也高达70%. 这些结果证实了类固醇和酚类雌激素活性较高,会对野生生物产生较大的内分泌干扰作用.
-
根据欧盟的技术指导文件,采用PEC方法,对农田土壤中雌激素进行风险评价,如公式(9)所示:
式中,APPLmanure表示施肥量(农业土壤0.5 kg·m−2),DEPTHsoil表示土壤混合深度(农场土壤为0.20 m),RHOsoil表示农业湿土容重(1700 kg·m−3).
值得注意的是,土壤中E1和E2的最大PEC对研究物种构成了威胁. 此外,施用粪肥也会在农田土壤中引入其他微量污染物,如抗生素和人工激素[45]. 例如,施用牛粪后在靠近牧场的地表径流和地下水中会出现硝酸盐、氯化物、睾酮和游离雌激素等微量污染物[46]. 因此,未来的风险评估应该包括对雌激素混合物与其他微污染物(如异种雌激素和抗生素)的毒性分析,并阐明它们之间的协同或拮抗作用.
-
全球粪肥源雌激素进入农田生态系统后,会对野生物种和人群健康构成严重威胁. 目前,科学家主要研究污水处理厂和地表水中雌激素的发生与风险,而关于农田土壤-作物中雌激素的污染风险鲜有报道. 因此,监测和控制畜禽粪污的排泄对降低雌激素在地表水、农田土壤和作物中的潜在风险至关重要. 本文从雌激素污染特征和分布规律、雌激素在农田土壤-作物中转运规律和机制、雌激素生态风险模型和生物毒性效应等角度,全面地综述了粪肥源雌激素在农田土壤-作物中转运机制和风险评估,研究结果为规避农田土壤-作物雌激素污染风险提供了理论依据. 尽管如此,国内外研究者仍需探索以下几点问题:1、粪肥源雌激素以游离态和结合态的形式排泄到农田生态环境中,加强结合态雌激素的研究十分必要;2、实时监测粪肥源雌激素在农田土壤和作物中含量,并进行毒理学测试和人类健康风险评估;3、为了量化雌激素对农田土壤栖息物种的风险,必须考虑粪肥施用的季节和频率;4、需要揭示雌激素可能与其他异种雌激素和微量污染物的协同或拮抗等作用机制.
粪肥源雌激素在农田土壤-作物中污染特征、转运规律及毒理风险
Animal manure derived-estrogens in farmland soil-crop ecosystems: Pollution characteristics, transport regularities, and toxicological risks
-
摘要: 雌酮(E1)、17β-雌二醇(E2)、雌三醇(E3)、17α-炔雌醇(EE2)和双酚A(BPA)等作为畜禽粪污中雌激素活性较强的环境内分泌干扰物,可在农田土壤-作物系统内输运和累积,并对野生物种的生殖发育、遗传代谢,以及农产品的质量和安全构成巨大威胁. 目前,国际上关于粪肥源雌激素在农田土壤-作物中污染特征、转运规律及毒理风险的报道仍较少. 本文综述了5种代表性粪肥源雌激素在农田生态系统中的污染特征和时空分布规律,归纳了雌激素在农田土壤-作物中的迁移转化、吸收积累和代谢机理,系统地评估了农田生态系统中雌激素生物毒性效应及其风险模型,旨在为规避农田土壤-作物雌激素污染风险、生产绿色农产品和保障人民健康等奠定理论基础.Abstract: In livestock manure, estrogens such as estrone (E1), 17β-estradiol (E2), estriol (E3), 17α-ethinylestradiol (EE2), and bisphenol A (BPA), act as a category of representative environmental endocrine disruptors with strong estrogenic activity. These estrogens can be migrated, transported, and accumulated in agroecosystems, which trigger a great threat to the reproductive development and inherited metabolic disorders, as well as the quality safety of agricultural products, thus arousing enormous pollution concerns. At present, there is little information available on the pollution characteristics, transport regularities, and toxicological risks of animal manure derived-estrogens in farmland soil-crop ecosystems. This study overviewed the pollution characteristics and temporal-spatial distribution of the above mentioned 5 kinds of typical manure derived-estrogens in agroecosystems. The uptake, accumulation, and metabolic mechanisms of estrogens in farmland soil-crop ecosystems were also summarized. Subsequently, the biotoxic effects of estrogens and their ecological risk models were systematically evaluated in farmland ecosystems. These findings provide a theoretical foundation for avoiding the estrogen-polluted risks of farmland soil-crop, yielding green agricultural products, and protecting public health.
-
Key words:
- animal manure /
- agroecological environment /
- estrogen pollution /
- transport pathways /
- health risks.
-
雌激素作为环境中普遍存在的一类典型的内分泌干扰物(EDCs),具有分布广、浓度低、毒性强和风险高等特点[1 ‒ 2]. 该类有害化合物主要来源于污水处理厂和禽畜养殖场,它们在低剂量条件下就会导致水生生物雌性化甚至种群灭绝,已引起世界各国政府和公众的广泛关注[3]. 雌激素可通过粪肥还田、污水灌溉和地表径流等方式进入农业生态系统,其中畜禽粪污释放的雌激素约占总量的90%以上[4]. 中国每年约产生45亿t畜禽粪污,其中雌激素含量高达2.05 × 106 kg,远超美国和欧盟年均排放的畜禽粪污中雌激素(分别为4.9 × 104 kg和3.3 × 104 kg)总和[5]. 当农业生态系统中雌激素的浓度大于环境容量时,会对野生生物和人民健康构成严重危害. 已证实痕量浓度(1.0 ng·L−1)雌激素即可干扰生物体正常的代谢功能、影响有机体生殖发育,甚至导致物种癌变和死亡[6]. 因此,明确环境中雌激素污染现状、转化路径和生态风险极其重要.
目前,科学家已经探讨了沉积物和地表水中雌激素的来源、发生和环境归趋[7 ‒ 9],而关于粪肥源雌激素在农田土壤-作物生态系统内的存在形态、运移规律、降解机制和毒理风险的研究仍较少. 据报道生菜、萝卜和玉米等农产品均受到不同程度的粪肥源雌激素污染,其体内雌激素的残留量达到2.0 μg·kg−1以上[10 ‒ 12],高于联合国粮农组织/世界卫生组织(FAO/WHO)规定的儿童日摄入量最大值(0.5 μg·d−1). 由此可见,农产品中雌激素残留存在严重的膳食风险隐患.
本文概述了畜禽粪污中雌酮(E1)、17β-雌二醇(E2)、雌三醇(E3)、17α-炔雌醇(EE2)和双酚A(BPA)等5种代表性环境雌激素的污染现状和分布规律,总结了粪肥源雌激素在农田土壤-作物中的输运转化、吸收积累和降解机制,系统地评估了农业生态系统中雌激素对敏感生物和人群健康的污染风险,结果有望为消减农田土壤-作物雌激素污染风险奠定理论基础.
1. 雌激素在农田生态系统中污染特征和分布规律(Pollution characteristics and distribution regularities of estrogens in farmland ecosystems)
1.1 畜禽粪污中雌激素浓度
畜禽粪污中普遍存在的雌激素包括E1、E2、E3、EE2和BPA. 由于雌激素的蒸汽压值小、挥发性低,其释放到大气的部分可忽略不计. 如表1所示,雌激素活性基团的种类和空间排列是影响其理化性质的关键因素. 相比E1、E2和E3等3种天然雌激素,人工合成的EE2溶解度更低、疏水性更强. 但无论是天然雌激素还是人工合成雌激素,它们对生物体的内分泌干扰效应均可达到其他常见EDCs的数万倍. 虽然,经过常规技术处理后,污水中雌激素的残留浓度在ng·L−1—μg·L−1之间;但是,由于雌激素具有极强的环境持久性和难生物降解性,其在ng·L−1水平仍可对动物和人体造成危害. 据监测牛和家禽粪污中含有大量雌激素,英国农场年均向环境中排泄的E1和E2分别高达1315 kg和570 kg[6]. 因此,雌激素释放到环境中引发的污染风险不言而喻.
表 1 畜禽粪污中5种典型雌激素的理化性能Table 1. The physicochemical properties of 5 representative estrogens in animal manure雌激素Estrogens 化学式Chemical structure 分子式Molecular formula 分子量Molecular weight 溶解度/(mg·L−1)Solubility 辛醇水分配系数(lgKow) E1 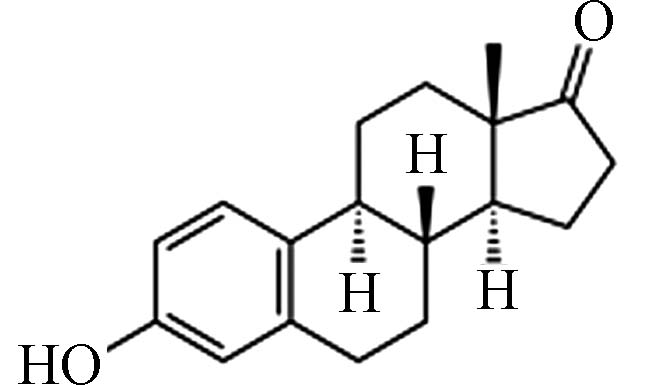
C18H22O2 270.37 13.0 3.43 E2 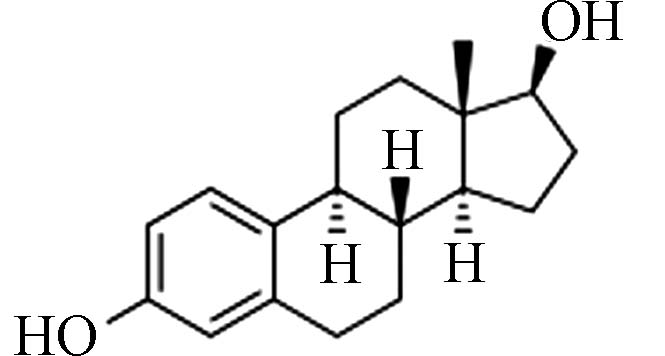
C18H24O2 272.38 13.3 3.94 E3 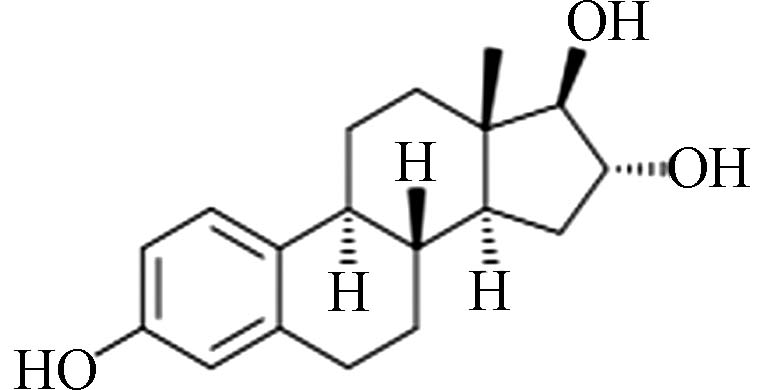
C18H24O3 288.38 13.3 2.81 EE2 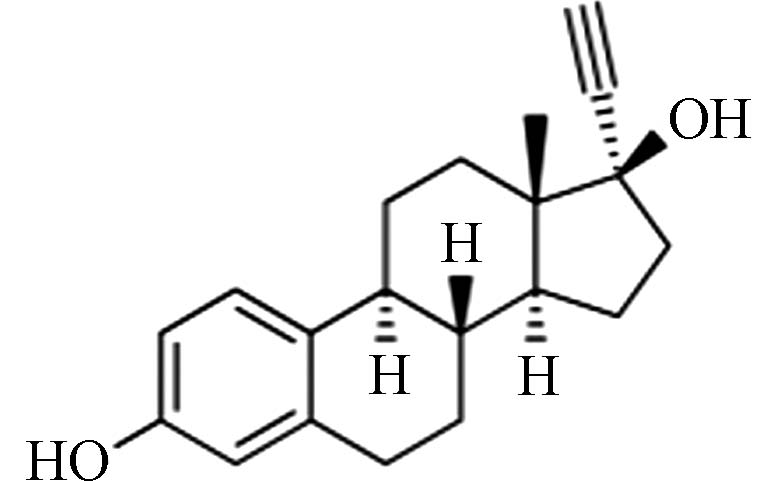
C20H24O2 296.40 4.8 4.12 BPA 
C15H16O2 228.29 120.0 3.32 畜禽粪污中雌激素浓度变化差异显著,主要归因于动物类型、粪污特性、繁殖周期和牲畜的生物学特性[13 ‒ 14]. 例如,每头奶牛的雌激素日排放量可达1.5 mg(牛粪和浆液中E1含量分别高达39 μg·kg−1和4.5 μg·L−1)[15];而每头孕期奶牛的雌激素排泄量高达11300—31464 μg·d−1. 每头孕期猪粪中雌激素排泄量为32—120 μg·d−1,其尿液中E1排泄量高达704—17280 μg·d−1,而每头寻常猪粪中雌激素排泄量仅有7—36 μg·d−1[16 ‒ 17]. 可见,怀孕的猪牛能够排放更高的雌激素负荷,E1是畜禽粪污中雌激素负荷的主要贡献者.
1.2 雌激素污染特征
雌激素具备中度疏水特性,它们进入农田生态系统后,可威胁土壤-作物安全和人民健康[18]. 人类和畜禽体内的雌激素会被机体部分代谢,而未被降解和代谢的雌激素及其产物则通过粪污排放到体外. 已证实人类排泄的雌激素主要以E1-3-葡萄糖苷酸盐(E1-3G)、E2-3-葡萄糖苷酸盐(E2-3G)和E3-16-葡萄糖苷酸盐(E3-16G)等结合态形式(约占95%)由尿液排放到环境中[15, 19]. 此外,在人类生产的某些避孕药中也可能存在不同结合态EE2,它们通过口服摄入体内并由孕体以EE2-3-葡萄糖苷酸盐(EE2-3G)和EE2-3-硫酸盐(EE2-3S)形态从尿液释放. 猪、牛、羊等不同类型的动物粪污中雌激素种类和含量存在显著地差异性. 比如,牛、羊是以粪便排放的游离态雌激素为主,仅尿液中含少量的结合态雌激素;与之相反,猪和家禽由尿液排放的雌激素占主导地位[14]. 与未怀孕状态的动物相比,孕期动物尿液中雌激素含量较高,且随着分娩时间的临近,其尿液中雌激素的含量逐渐升高. 相对于固体粪便中雌激素,尿液中雌激素的检出量普遍较高[20]. 在世界范围内,富含畜禽粪污的农田主要分布在欧洲、巴西、中国、东南亚和印度等地. 富含粪肥的栽培区(> 90%)占全球肥料应用量3.2%,主要分布在中国和印度[21]. 需强调,近30年全球畜禽密度持续增长,显著地提高了畜禽粪便和尿液中雌激素的排泄量.
1.3 雌激素时空分布
运用固相萃取-高效液相色谱串联质谱(SPE-HPLC-MS/MS)分析手段,可明确畜禽粪污中雌激素分布特征[20, 22]. 养猪场粪便、沼渣肥料以及还田土壤中E1、E2、E3、EE2和己烯雌酚(DES)等5种雌激素的总量分别为94.5、35.1、0. 1 μg·kg−1,而尿液和沼液中分别为8882.2 ng·L−1和4388.6 ng·L−1,其中E1是畜禽粪污中最主要的雌激素[13];奶牛场粪便、堆肥、还田土壤中雌激素总量分别为84.6、16.2、0.1 μg·kg−1,而尿液和污水进水及出水中则分别为2636.7、2605.6、615.7 ng·L−1,其中E1和E2含量最高. 猪场和奶牛场排泄物中雌激素浓度主要表现为粪便 > 有机肥、尿液 > 污水. 在夏季雌激素的含量最高,并与溶解性有机碳浓度呈正相关,保留有机碳的营养管理可能有助于雌激素去除[23]. 厌氧发酵、厌氧-好氧组合工艺、固体粪便高温好氧堆肥等技术对猪场污水、奶牛场排泄物中雌激素具有良好的去除效果. 世界人口主要分布在亚洲的发展中国家,肉类和乳制品消费分别以每年4%和2%—3%的速度增长[24]. 雌激素的排放总量受该趋势影响,最终可能增加其在环境中的时空分布和污染风险.
2. 雌激素在农田土壤-作物中迁移和转化(Migration and transformation of estrogens in farmland soil-crop ecosystems)
2.1 农田土壤中雌激素环境行为
雌激素进入农田生态环境后,涉及土壤吸附和微生物降解2个过程. 土壤通过疏水分配或π电子与氢键互用等机制吸附雌激素,其吸附行为与土壤有机质含量、矿物质组分和粒径分布等因素密不可分. 通常认为土壤中雌激素能够在6—8 h内达到吸附平衡状态,其前期吸附较快,达到吸附平衡后速率逐渐下降[25]. 由于土壤的吸附和降解作用,导致雌激素的迁移深度较浅. 雌激素田间传输试验证实,E1和E2在土壤大孔隙和径流条件下会发生快速迁移,而胶体可促进雌激素的迁移[26]. 但是,实际土壤环境较为复杂,雌激素的具体迁移路径仍需进一步研究.
土壤中雌激素的降解主要包括微生物、化学和光降解. 不同雌激素的降解机制差异显著,其中天然雌激素E1和E2以微生物代谢为主,人工合成雌激素EE2以非生物转化为主. 有氧生物降解是土壤中雌激素的关键代谢机制,缺氧或厌氧状态下雌激素的代谢速率明显减缓. 因此,长期处于缺氧或厌氧环境下的沉积物被称为雌激素“天然储存库”[16]. 雌激素的降解过程通常表现为前期快速氧化降解,后期逐渐趋于平缓. 图1展示了环境微生物代谢E2的关键途径,包括脱氢、氧化、环裂解、脱碳、缩合等,最终通过三羧酸循环矿化为CO2和H2O[27]. 与人工合成雌激素相比,天然雌激素在环境中的生物降解速率明显较快. 需指出当EE2、E1、E2、E3等4种雌激素共存时,微生物可能通过共代谢作用提高EE2的降解效率[28]. 雌激素的降解速率和半衰期是决定其在生态系统中持久性和危害性的关键因素.
普通和粪便改良土壤中雌激素的降解半衰期存在显著性差异. 雌激素在普通土壤中降解半衰期为0.8—25 d,其在粪便改良土壤中降解半衰期则缩短至1—9 d[16 ‒ 17]. 影响土壤中雌激素降解半衰期的主要因素包括pH和温度,自然光照影响较小,低温和酸性条件下不利于雌激素生物降解. 例如,奶牛粪便中E2在强酸(pH < 2.0)和低温环境下转化率仅为15%,显著地低于碱性高温条件(> 80%)[16]. 此外,共存污染物也会影响雌激素在土壤中降解速率和半衰期. 已有报道指出添加抗生素会抑制雌激素降解,且不同抗生素产生的抑制效应存在明显差异,主要是因为抗生素阻碍了微生物生长繁殖[29]. 土壤中共存的重金属离子也会对雌激素的降解产生阻碍作用. 显然,雌激素在农田土壤中难以被微生物彻底分解代谢,其残留组分仍能被作物吸收积累,从而对农产品质量和安全构成严重威胁.
2.2 作物对雌激素的吸收和代谢
萝卜、生菜、小麦和玉米等作物均可通过根系吸收积累农田土壤中雌激素[30 ‒ 32]. 根系对雌激素的吸收与其lgKow、根脂肪含量呈正相关,与土壤有机质含量呈负相关[33 ‒ 34]. E1、E2、E3、EE2和BPA等雌激素的lgKow为2.81—4.12,它们可与根细胞壁中交换位点相互作用,进而被根脂肪含量较高的作物吸收和积累. 研究表明小麦根系主要通过主动吸收的方式积累E2,该过程涉及水通道蛋白和阴离子通道的跨膜运输[35]. 雌激素被根系吸收后,可在作物蒸腾拉力驱动下向茎叶运移,其转移效率与作物蒸腾流体积、叶绿素和蛋白质含量以及雌激素lgKow等因素密切相关. 作物暴露在雌激素最大毒害浓度时,会导致其生理功能损伤. 当E2暴露浓度为50 μg·L−1时,萝卜幼苗抗氧化能力明显降低,膜质过氧化水平加重[11]. 120—320 mg·L−1的BPA可显著地降低卷心菜、玉米和燕麦等作物生物量[36]. 此外,雌激素污染也会对作物矿质元素吸收、蛋白质组分、细胞器结构等生理生化功能造成毁灭性破坏[30]. 可见,雌激素污染会降低农产品的产量和品质.
粪肥源雌激素在作物体内的代谢机理可能包括以下4个过程(图2)[37]:(1)作物体内的氧化酶和还原酶能够直接参与雌激素的氧化、还原和水解等作用,生成含有功能团的雌激素转化产物;(2)雌激素功能团化产物进一步与作物体内内源性化合物轭合,形成毒性小于母体化合物的轭合物;(3)作物通过区室化作用,将可溶性轭合物储存在液泡中,不可溶性轭合物则储存在细胞壁中;(4)部分雌激素功能团化产物经过深度氧化后,可完全转化为CO2和H2O. 例如,研究者采用14C放射性同位素示踪手段,在小麦和大豆细胞提取物中发现了大量14C-BPA糖基化、非可提取性和高极性轭合物,表明作物能代谢雌激素并通过区室化作用将其以轭合物的形式固定在细胞内[38]. 另有学者指出玉米幼苗可将根中E2氧化成E1,但在茎叶中并未检测到E2的转化产物[39]. 我国科学家也发现萝卜幼苗体内E2的积累量与E2污染浓度呈正相关,其在转运过程中发生代谢,生成具有低雌激素活性的E1[30]. 雌激素及其代谢产物在作物组织中的分布差异可能是由不同作物对雌激素吸收转运能力和代谢途径的差异导致,且受到作物体内有毒有机物降解酶系种类、数量和代谢活性的调控作用. 尽管如此,长期暴露在污染环境中的作物体内仍残留大量的雌激素,它们增加了人类膳食摄取风险.
3. 农田生态系统中雌激素生物毒性效应(Biotoxic effects of estrogens in farmland ecosystems)
3.1 土壤微生物
采用水体中雌激素预测无效应浓度(PNECwater)和土水分配系数(KD)的乘积,计算农田土壤中雌激素预测无效应浓度(PNECsoil)值,如公式(1)所示:
stringUtils.convertMath(!{formula.content}) (1) 式中,PNEC为预测无效应浓度,L(E)C50为半数致死(效应)浓度(ng·L−1),NOEC为最大无影响浓度(ng·L−1),AF为评估因子,其确定需要依据急性与慢性毒性量而定. KD考虑了土壤颗粒对雌激素的吸附作用,可用于确定土壤无脊椎动物的PNECsoil. E2、17α-E2、E1和E3对农业土壤无脊椎动物产生风险的PNECsoil值分别为1、7.9、2.5、711 ng·g−1[40].
农田土壤中雌激素进入作物体内,会干扰作物体内内源激素的合成和转运,从而影响植物发芽、生长和酶活性等. 例如,高浓度E2(10 mg·L−1)处理组中玉米种子的萌发时间比对照组的种子萌发时间延迟12 h. 水培试验发现,与不含雌激素的对照组相比,E1、E2、E3或EE2的存在会抑制生菜、玉米、番茄等作物根系生长,其抑制效应随雌激素浓度的增大(0.1 mg·L−1增加至10 mg·L−1)而增强[6]. 此外,作物在遭遇雌激素污染胁迫后,其体内抗氧化物酶活性会随着雌激素浓度的增大而显著增加,表明雌激素刺激了作物体内的抗氧化酶活性,但并不足以完全清除雌激素[32]. 该过程中产生和积累的活性氧,导致作物发生氧化损伤,最终表现为作物生长受到抑制.
微生物代谢可降低农田土壤中雌激素含量,从而减少雌激素由土壤向作物迁移. 研究人员发现测试点土壤风险商(RQ)值显著地高于1,说明土壤雌激素存在较高生态风险[17]. 这主要是因为土壤表土层是畜禽粪便的直接受体. 在亚粘土层,微生物丰富度较高,部分雌激素被微生物降解. 因此,亚黏土层的雌激素RQ值相对较低. 随着土壤深度的增加,微生物数量和活性逐渐降低,而雌激素发生积累,使得RQ值过高. 在含水层,雌激素受地下水的溶滤作用导致其浓度下降,RQ值也相应减低. 另外,雌激素的种类和组成也会干扰土壤细菌生长和代谢活动. 例如,与E1污染土壤相比,E2污染土壤中细菌的生长和代谢行为从最初就受到抑制,土壤呼吸强度较低,说明E2雌激素活性显著地高于E1,对细菌生长表现出明显地抑制作用[33]. 在雌激素降解过程中土壤呼吸强度和细菌总数的变化趋势表现出类似规律,证实土壤细菌在雌激素降解代谢中起到关键作用.
3.2 膳食风险
雌激素进入人体后,可扰乱人体正常内分泌功能,对生殖系统、神经系统和免疫系统等造成严重损伤[18]. 目前,WHO和美国环境保护局(EPA)尚未提供致癌风险评价参数和效力因子,以评估雌激素对人体的致癌效应. 因此,本文主要评估E1和E2的非致癌风险. 与成人相比,儿童对非致癌效应的敏感度更高,所以被选为污染受体. 土壤中雌激素的暴露途径主要包括口摄入、皮肤接触和吸入土壤颗粒物. 考虑人类会通过饮用地下水摄入雌激素,采用公式(2)和(3)分别计算经口摄入的土壤雌激素暴露量(OISERnc, kg·kg−1·d−1)和饮用受影响地下水对应的雌激素暴露量(CGWERnc, L·kg−1·d−1):
stringUtils.convertMath(!{formula.content}) (2) stringUtils.convertMath(!{formula.content}) (3) 式中,OSIRc表示儿童每日摄入土壤量(为200 mg·d−1);EDc表示儿童暴露期(为6 a);EFc表示儿童暴露频率(为350 d·a−1);ABSa表示经口摄入进气吸收效率因子(数值取1);BWc表示儿童体重(为15.9 kg);ATnc表示非致癌效应平均时间(为2190 d);GWCRc表示儿童每日饮水量(L·d−1).
污染物的非致癌风险主要以剂量阈效应体现. 因此,通过商值法能够评估雌激素的非致癌风险. 当非致癌风险危险商(HQ) < 1时,表示不会产生非致癌风险;当HQ > 1时,表示非致癌风险超过可接受水平. 经口摄入途径的健康风险HQ计算参考公式(4)和(5):
stringUtils.convertMath(!{formula.content}) (4) stringUtils.convertMath(!{formula.content}) (5) 式中,HQois指经口摄入土壤途径的危险商;HQcgw指饮用地下水途径的危险商;Csur指表层土壤中污染物浓度(mg·kg−1);SAF/WAF指暴露于土壤/地下水的污染物剂量分配系数(SAF取值0.2);RfDo指经口摄入参考剂量(5.00×10−5 mg·kg−1·d−1).
土壤中雌激素通过不同暴露途径的非致癌风险HQ均小于1,低于人体健康非致癌风险可接受值[17]. 多种暴露途径的综合非致癌风险HQ = 0.04618,表明测试点的雌激素对人类致癌风险较低,在可接受水平. 需强调,对于土壤中E1、E2和EE2的最大预测环境浓度(PEC),当它们的非致癌风险HQ > 1时,人类通过口腔摄入雌激素的风险更高. 总体上,雌激素污染的地表水的致癌风险较低,不会对儿童造成健康风险. 虽然,土壤摄入的雌激素致癌风险较高,但难以危害儿童健康,因为儿童通过口腔摄取农业土壤的可能性较小. 尽管如此,由于痕量浓度雌激素即可表现出较强的危害效力,不应假定雌激素在受污染的土壤和饮用水中的致癌风险在可接受水平.
目前,用于评估人类健康风险的雌激素生态风险模型并不准确,因为它们没有考虑环境基质中其他EDCs和协同物质. 此外,这些模型也没有涉及与雌激素周期性峰值浓度相关的急性毒性的可能性. 多数环境雌激素风险评估集中在其与乳腺癌的关系上,监测饮用水中雌激素浓度并评估人体对饮用水的每日允许摄入量也必不可少. 总体而言,全球饮用水中雌激素浓度在可接受风险水平范围内;而地表水雌激素浓度低于10 ng·L−1,并未超过美国EPA、WHO和欧盟规定限制. 尽管如此,暴露在低风险水平的雌激素仍会干扰生物体内的激素信号,引发有机体内分泌系统紊乱. 同时,饮用水中残留的少量雌激素也会影响人体生殖发育,导致更年期,并致使男性精子数量下降,呈现女性化. 因此,研究者应当将粪肥源雌激素和其他EDCs纳入常规筛查范围,并构建更加完善的雌激素生态风险评估模型,系统地揭示粪肥源雌激素在农田土壤-作物中的潜在风险.
4. 农田生态系统中雌激素风险模型(Risk models of estrogens in farmland ecosystems)
4.1 风险系数
采用RQ方法,可评估农田土壤中雌激素生态风险,如公式(6)所示:
stringUtils.convertMath(!{formula.content}) (6) 式中,RQ表示风险商值,MEC和PNEC分别为实测雌激素环境暴露浓度和预测无效应浓度. PNEC主要由半数效应浓度(EC50)和半数致死浓度(LC50)推导计算获得[41].
根据研究者提出的RQ表征方法,可将其生态等级划分为3级[42]:当RQ ≥ 1.0,生态风险较高;当0.1 ≤ RQ < 1.0,污染物具有一定生态风险;当RQ < 0.1时,目标物对环境产生的风险相对较低. 我国科学家研究了城市污水出水并获得了雌激素的RQ值,其中EE2、E1和E3的RQ值高于1,为高生态风险物质[43];BPA的RQ值大于1的比例为30%—50%,生态风险相对较低;E2的RQ值均小于1. 因此,应优先控制EE2、E1和E3等3种雌激素污染物. 然而,由于PNEC具有可变性,不同时期监测到的雌激素浓度显著不同,且环境承载能力和自净能力也存在差异,同时对环境造成破坏时的阈值也在变化. 因此,RQ值并不完全确定.
4.2 雌激素活性
E2是雌激素活性最强的一种环境EDCs. 因此,利用E2当量(EEQ)表征农田土壤中雌激素活性强度,可用于评价雌激素生态风险[44]. 雌激素的EEQ能够通过其相对E2当量因子(EEF)和环境中雌激素实测暴露浓度(MEC)进行计算,如公式(7)所示:
stringUtils.convertMath(!{formula.content}) (7) E1、E2、E3、EE2和BPA等5种雌激素的EEF分别为0.59、1.0、0.033、8.71、1.07 × 10-4[13]. EEF值由酵母雌激素筛选试验(YES)获得. EEF值越大,表示该物质的相对雌激素活性越大.
根据环境介质中雌激素浓度,计算EEQ:
stringUtils.convertMath(!{formula.content}) (8) 风险等级分成3类:EEQ < 1 ng·L−1为无最低风险;1 ng·L−1 < EEQ < 10 ng·L−1为中等风险;EEQ > 10 ng·L−1为高风险[41]. 雌激素活性测定试验表明[43],EE2的EEQ最大,其EEQ高于1 ng·L−1的累积频率在98%以上,最高可达103 ng·L−1;E1和E2的EEQ高于1 ng·L−1的比例为70%—80%;E3有55%的EEQ大于1 ng·L−1;BPA的EEQ高于1 ng·L−1的比例也高达70%. 这些结果证实了类固醇和酚类雌激素活性较高,会对野生生物产生较大的内分泌干扰作用.
4.3 农田土壤中雌激素预测浓度
根据欧盟的技术指导文件,采用PEC方法,对农田土壤中雌激素进行风险评价,如公式(9)所示:
stringUtils.convertMath(!{formula.content}) (9) 式中,APPLmanure表示施肥量(农业土壤0.5 kg·m−2),DEPTHsoil表示土壤混合深度(农场土壤为0.20 m),RHOsoil表示农业湿土容重(1700 kg·m−3).
值得注意的是,土壤中E1和E2的最大PEC对研究物种构成了威胁. 此外,施用粪肥也会在农田土壤中引入其他微量污染物,如抗生素和人工激素[45]. 例如,施用牛粪后在靠近牧场的地表径流和地下水中会出现硝酸盐、氯化物、睾酮和游离雌激素等微量污染物[46]. 因此,未来的风险评估应该包括对雌激素混合物与其他微污染物(如异种雌激素和抗生素)的毒性分析,并阐明它们之间的协同或拮抗作用.
5. 结论与展望(Conclusion and perspective)
全球粪肥源雌激素进入农田生态系统后,会对野生物种和人群健康构成严重威胁. 目前,科学家主要研究污水处理厂和地表水中雌激素的发生与风险,而关于农田土壤-作物中雌激素的污染风险鲜有报道. 因此,监测和控制畜禽粪污的排泄对降低雌激素在地表水、农田土壤和作物中的潜在风险至关重要. 本文从雌激素污染特征和分布规律、雌激素在农田土壤-作物中转运规律和机制、雌激素生态风险模型和生物毒性效应等角度,全面地综述了粪肥源雌激素在农田土壤-作物中转运机制和风险评估,研究结果为规避农田土壤-作物雌激素污染风险提供了理论依据. 尽管如此,国内外研究者仍需探索以下几点问题:1、粪肥源雌激素以游离态和结合态的形式排泄到农田生态环境中,加强结合态雌激素的研究十分必要;2、实时监测粪肥源雌激素在农田土壤和作物中含量,并进行毒理学测试和人类健康风险评估;3、为了量化雌激素对农田土壤栖息物种的风险,必须考虑粪肥施用的季节和频率;4、需要揭示雌激素可能与其他异种雌激素和微量污染物的协同或拮抗等作用机制.
-
表 1 畜禽粪污中5种典型雌激素的理化性能
Table 1. The physicochemical properties of 5 representative estrogens in animal manure
雌激素Estrogens 化学式Chemical structure 分子式Molecular formula 分子量Molecular weight 溶解度/(mg·L−1)Solubility 辛醇水分配系数(lgKow) E1 C18H22O2 270.37 13.0 3.43 E2 C18H24O2 272.38 13.3 3.94 E3 C18H24O3 288.38 13.3 2.81 EE2 C20H24O2 296.40 4.8 4.12 BPA C15H16O2 228.29 120.0 3.32 -
[1] 韩进, 程鹏飞, 周贤, 等. 基于畜禽粪便的有机肥中雌激素污染特征[J]. 农业资源与环境学报, 2019, 36(5): 673-678. doi: 10.13254/j.jare.2018.0264 HAN J, CHENG P F, ZHOU X, et al. Characteristics of estrogen contamination in organic fertilizers derived from livestock manures[J]. Journal of Agricultural Resources and Environment, 2019, 36(5): 673-678 (in Chinese). doi: 10.13254/j.jare.2018.0264
[2] 王梦杰, 李建华, 彭建彪, 等. 过氧化物酶对水中17β-雌二醇光降解的影响机制[J]. 环境化学, 2021, 40(11): 3351-3359. doi: 10.7524/j.issn.0254-6108.2021041604 WANG M J, LI J H, PENG J B, et al. The effect mechanism of peroxidase on the photodegradation of 17β-estradiol in water[J]. Environmental Chemistry, 2021, 40(11): 3351-3359 (in Chinese). doi: 10.7524/j.issn.0254-6108.2021041604
[3] WILLIAMS G P, DARBRE P D. Low-dose environmental endocrine disruptors, increase aromatase activity, estradiol biosynthesis and cell proliferation in human breast cells[J]. Molecular and Cellular Endocrinology, 2019, 486: 55-64. doi: 10.1016/j.mce.2019.02.016 [4] KHANAL S K, XIE B, THOMPSON M L, et al. Fate, transport, and biodegradation of natural estrogens in the environment and engineered systems[J]. Environmental Science & Technology, 2006, 40(21): 6537-6546. [5] GUDDA F O, ATEIA M, WAIGI M G, et al. Ecological and human health risks of manure-borne steroid estrogens: A 20-year global synthesis study[J]. Journal of Environmental Management, 2022, 301: 113708. doi: 10.1016/j.jenvman.2021.113708 [6] ADEEL M, SONG X M, WANG Y Y, et al. Environmental impact of estrogens on human, animal and plant life: A critical review[J]. Environment International, 2017, 99: 107-119. doi: 10.1016/j.envint.2016.12.010 [7] PRAVEENA S M, LUI T S, HAMIN N, et al. Occurrence of selected estrogenic compounds and estrogenic activity in surface water and sediment of Langat River (Malaysia)[J]. Environmental Monitoring and Assessment, 2016, 188(7): 442. doi: 10.1007/s10661-016-5438-5 [8] HU Y, YAN X, SHEN Y, et al. Occurrence, behavior and risk assessment of estrogens in surface water and sediments from Hanjiang River, Central China[J]. Ecotoxicology, 2019, 28(2): 143-153. doi: 10.1007/s10646-018-2007-4 [9] BILAL M, BARCELÓ D, IQBAL H M N. Occurrence, environmental fate, ecological issues, and redefining of endocrine disruptive estrogens in water resources[J]. Science of the Total Environment, 2021, 800: 149635. doi: 10.1016/j.scitotenv.2021.149635 [10] LI Y B, SALLACH J B, ZHANG W, et al. Insight into the distribution of pharmaceuticals in soil-water-plant systems[J]. Water Research, 2019, 152: 38-46. doi: 10.1016/j.watres.2018.12.039 [11] 陈兴财, 张丰松, 李艳霞, 等. 类固醇雌激素在土壤-植物体系中的迁移转化及其毒理效应[J]. 生态学报, 2021, 41(6): 2525-2535. CHEN X C, ZHANG F S, LI Y X, et al. Transport and transformation of steroid estrogens in soil-plant systems and their toxicological effects on plant[J]. Acta Ecologica Sinica, 2021, 41(6): 2525-2535 (in Chinese).
[12] CHEN X C, LI Y X, JIANG L S, et al. Uptake, accumulation, and translocation mechanisms of steroid estrogens in plants[J]. Science of the Total Environment, 2021, 753: 141979. doi: 10.1016/j.scitotenv.2020.141979 [13] 李艳, 潘杰, 梁紫薇, 等. 基于定位栏试验的奶牛粪便中雌激素含量特征[J]. 中国环境科学, 2022, 42(1): 119-126. doi: 10.3969/j.issn.1000-6923.2022.01.014 LI Y, PAN J, LIANG Z W, et al. Characterizing the estrogen content in cow feces based on gestation crate experiment[J]. China Environmental Science, 2022, 42(1): 119-126 (in Chinese). doi: 10.3969/j.issn.1000-6923.2022.01.014
[14] 梁紫薇, 李艳, 胡嘉梧, 等. 基于代谢笼试验的鸡粪中雌激素排放特征研究[J]. 农业环境科学学报, 2022, 41(2): 434-440. doi: 10.11654/jaes.2021-0633 LIANG Z W, LI Y, HU J W, et al. Emission characteristics of estrogens in chicken manure based on the metabolic cage test[J]. Journal of Agro-Environment Science, 2022, 41(2): 434-440 (in Chinese). doi: 10.11654/jaes.2021-0633
[15] JOHNSON A C, WILLIAMS R J, MATTHIESSEN P. The potential steroid hormone contribution of farm animals to freshwaters, the United Kingdom as a case study[J]. Science of the Total Environment, 2006, 362(1/2/3): 166-178. [16] 李艳霞, 韩伟, 林春野, 等. 畜禽养殖过程中雌激素的排放及其环境行为[J]. 生态学报, 2010, 30(4): 1058-1065. LI Y X, HAN W, LIN C Y, et al. Excretion of estrogens in the livestock and poultry production and their environmental behaviors[J]. Acta Ecologica Sinica, 2010, 30(4): 1058-1065 (in Chinese).
[17] 宋晓明. 农业土壤中类固醇雌激素的潜在风险与归趋机理研究[D]. 沈阳: 沈阳大学, 2018. SONG X M. Study on potential risks and fate mechanism of steroid estrogen in agricultural soil[D]. Shenyang: Shenyang University, 2018 (in Chinese).
[18] 冯承莲, 汪浩, 王颖, 等. 基于不同毒性终点的双酚A(BPA)预测无效应浓度(PNEC)研究[J]. 生态毒理学报, 2015, 10(1): 119-129. FENG C L, WANG H, WANG Y, et al. Predicted No effect concentration of bisphenol a(BPA) based on different toxicological endpoints[J]. Asian Journal of Ecotoxicology, 2015, 10(1): 119-129 (in Chinese).
[19] 李晓曼, 黄斌, 孙雯雯, 等. 类固醇雌激素环境行为研究进展[J]. 环境化学, 2014, 33(8): 1276-1286. doi: 10.7524/j.issn.0254-6108.2014.08.022 LI X M, HUANG B, SUN W W, et al. Research progress on the environmental behavior of steroid estrogens[J]. Environmental Chemistry, 2014, 33(8): 1276-1286 (in Chinese). doi: 10.7524/j.issn.0254-6108.2014.08.022
[20] 贺德春, 胡嘉梧, 梁紫薇, 等. 同位素内标-高效液相色谱-串联质谱法测定畜禽粪便中6种雌激素[J]. 生态环境学报, 2021, 30(2): 383-390. doi: 10.16258/j.cnki.1674-5906.2021.02.018 HE D C, HU J W, LIANG Z W, et al. Determination of six estrogens in livestock manures by isotope internal standard-high performance liquid chromatography coupled with tandem mass spectrometry[J]. Ecology and Environmental Sciences, 2021, 30(2): 383-390 (in Chinese). doi: 10.16258/j.cnki.1674-5906.2021.02.018
[21] 张克强, 杜连柱, 杜会英, 等. 国内外畜禽养殖粪肥还田利用研究进展[J]. 农业环境科学学报, 2021, 40(11): 2472-2481, 2591. doi: 10.11654/jaes.2021-1031 ZHANG K Q, DU L Z, DU H Y, et al. Application of livestock and poultry waste to agricultural land: A review[J]. Journal of Agro-Environment Science, 2021, 40(11): 2472-2481, 2591 (in Chinese). doi: 10.11654/jaes.2021-1031
[22] 薛敏, 王安, 王瑜, 等. 分子印迹固相萃取技术检测江水、尿液及牛奶中雌激素残留[J]. 分析化学, 2011, 39(6): 793-798. XUE M, WANG A, WANG Y, et al. Application of molecularly imprinted solid phase extraction for determination of estrogens in river water, milk and urine samples[J]. Chinese Journal of Analytical Chemistry, 2011, 39(6): 793-798 (in Chinese).
[23] DUAN S W, IWANOWICZ L R, NOGUERA-OVIEDO K, et al. Evidence that watershed nutrient management practices effectively reduce estrogens in environmental waters[J]. The Science of the Total Environment, 2021, 758: 143904. doi: 10.1016/j.scitotenv.2020.143904 [24] DELGADO C L. Rising consumption of meat and milk in developing countries has created a new food revolution[J]. The Journal of Nutrition, 2003, 133(11): 3907S-3910S. doi: 10.1093/jn/133.11.3907S [25] 袁哲军, 张洪昌, 胡双庆, 等. 典型雌激素在水稻土中的吸附特征及高岭土和猪粪DOM对吸附的影响[J]. 环境化学, 2018, 37(4): 652-660. doi: 10.7524/j.issn.0254-6108.2017082102 YUAN Z J, ZHANG H C, HU S Q, et al. Adsorption of typical estrogens to paddy soils and influence of Kaolin and pig manure DOM[J]. Environmental Chemistry, 2018, 37(4): 652-660 (in Chinese). doi: 10.7524/j.issn.0254-6108.2017082102
[26] 宋晓明, 杨悦锁, 温玉娟, 等. 雌激素在地下环境中的归宿及其生态调控[J]. 中国环境科学, 2016, 36(9): 2828-2840. doi: 10.3969/j.issn.1000-6923.2016.09.042 SONG X M, YANG Y S, WEN Y J, et al. Fate and ecological regulation of steroidal estrogens in subsurface environment[J]. China Environmental Science, 2016, 36(9): 2828-2840 (in Chinese). doi: 10.3969/j.issn.1000-6923.2016.09.042
[27] LI S Y, LIU J, WILLIAMS M A, et al. Metabolism of 17β-estradiol by Novosphingobium sp. ES2-1 as probed via HRMS combined with 13C3-labeling[J]. Journal of Hazardous Materials, 2020, 389: 121875. doi: 10.1016/j.jhazmat.2019.121875 [28] MOREIRA I S, LEBEL A, PENG X Z, et al. Sediments in the mangrove areas contribute to the removal of endocrine disrupting chemicals in coastal sediments of Macau SAR, China, and harbour microbial communities capable of degrading E2, EE2, BPA and BPS[J]. Biodegradation, 2021, 32(5): 511-529. doi: 10.1007/s10532-021-09948-9 [29] LI S Y, LIU J, SUN K, et al. Degradation of 17β-estradiol by Novosphingobium sp. ES2-1 in aqueous solution contaminated with tetracyclines[J]. Environmental Pollution, 2020, 260: 114063. doi: 10.1016/j.envpol.2020.114063 [30] 魏瑞成, 李金寒, 何龙翔, 等. 雌激素胁迫对萝卜种子萌芽和幼苗生长及其累积效应的影响[J]. 草业学报, 2013, 22(5): 190-197. doi: 10.11686/cyxb20130522 WEI R C, LI J H, HE L X, et al. Effects of estrogen stress on seed germination, seedling growth and accumulation in radish[J]. Acta Prataculturae Sinica, 2013, 22(5): 190-197 (in Chinese). doi: 10.11686/cyxb20130522
[31] CARD M L, SCHNOOR J L, CHIN Y P. Uptake of natural and synthetic estrogens by maize seedlings[J]. Journal of Agricultural and Food Chemistry, 2012, 60(34): 8264-8271. doi: 10.1021/jf3014074 [32] ADEEL M, YANG Y S, WANG Y Y, et al. Uptake and transformation of steroid estrogens as emerging contaminants influence plant development[J]. Environmental Pollution, 2018, 243: 1487-1497. doi: 10.1016/j.envpol.2018.09.016 [33] STUMPE B, MARSCHNER B. Factors controlling the biodegradation of 17β-estradiol, estrone and 17α-ethinylestradiol in different natural soils[J]. Chemosphere, 2009, 74(4): 556-562. doi: 10.1016/j.chemosphere.2008.09.072 [34] NAMIKI S, OTANI T, MOTOKI Y, et al. Differential uptake and translocation of organic chemicals by several plant species from soil[J]. Journal of Pesticide Science, 2018, 43(2): 96-107. doi: 10.1584/jpestics.D17-088 [35] CHEN L, ZHANG S Z, HUANG H L, et al. Partitioning of phenanthrene by root cell walls and cell wall fractions of wheat (Triticum aestivum L. )[J]. Environmental Science & Technology, 2009, 43(24): 9136-9141. [36] STAPLES C, FRIEDERICH U, HALL T, et al. Estimating potential risks to terrestrial invertebrates and plants exposed to bisphenol A in soil amended with activated sludge biosolids[J]. Environmental Toxicology and Chemistry, 2010, 29(2): 467-475. doi: 10.1002/etc.49 [37] SUN K, HABTESELASSIE M Y, LIU J, et al. Subcellular distribution and biotransformation of phenanthrene in pakchoi after inoculation with endophytic Pseudomonas sp. as probed using HRMS coupled with isotope-labeling[J]. Environmental Pollution, 2018, 237: 858-867. doi: 10.1016/j.envpol.2017.11.039 [38] SCHMIDT B, SCHUPHAN I. Metabolism of the environmental estrogen bisphenol A by plant cell suspension cultures[J]. Chemosphere, 2002, 49(1): 51-59. doi: 10.1016/S0045-6535(02)00142-X [39] CARD M L, SCHNOOR J L, CHIN Y P. Transformation of natural and synthetic estrogens by maize seedlings[J]. Environmental Science & Technology, 2013, 47(10): 5101-5108. [40] MARTÍN J, CAMACHO-MUÑOZ D, SANTOS J L, et al. Occurrence of pharmaceutical compounds in wastewater and sludge from wastewater treatment plants: Removal and ecotoxicological impact of wastewater discharges and sludge disposal[J]. Journal of Hazardous Materials, 2012, 239/240: 40-47. doi: 10.1016/j.jhazmat.2012.04.068 [41] 褚莹倩, 陈溪, 张晓林, 等. 中国地表水环境中药物与个人护理品生态风险评价的研究进展[J]. 生态毒理学报, 2021, 16(4): 80-92. CHU Y Q, CHEN X, ZHANG X L, et al. Ecological risk assessment of pharmaceutical and personal care products in the surface water of China: A review[J]. Asian Journal of Ecotoxicology, 2021, 16(4): 80-92 (in Chinese).
[42] HERNANDO M D, MEZCUA M, FERNÁNDEZ-ALBA A R, et al. Environmental risk assessment of pharmaceutical residues in wastewater effluents, surface waters and sediments[J]. Talanta, 2006, 69(2): 334-342. doi: 10.1016/j.talanta.2005.09.037 [43] 孙艳, 黄璜, 胡洪营, 等. 污水处理厂出水中雌激素活性物质浓度与生态风险水平[J]. 环境科学研究, 2010, 23(12): 1488-1493. doi: 10.13198/j.res.2010.12.46.suny.005 SUN Y, HUANG H, HU H Y, et al. Concentration of estrogen active substances and ecological risk level in effluent of sewage treatment plant[J]. Research of Environmental Sciences, 2010, 23(12): 1488-1493 (in Chinese). doi: 10.13198/j.res.2010.12.46.suny.005
[44] 韩进, 程鹏飞, 周贤, 等. 畜禽粪便堆肥过程中雌激素降解特征[J]. 农业资源与环境学报, 2019, 36(5): 679-686. doi: 10.13254/j.jare.2018.0346 HAN J, CHENG P F, ZHOU X, et al. Characteristics of estrogen degradation in livestock manures during composting[J]. Journal of Agricultural Resources and Environment, 2019, 36(5): 679-686 (in Chinese). doi: 10.13254/j.jare.2018.0346
[45] ZHOU X, WANG J, LU C, et al. Antibiotics in animal manure and manure-based fertilizers: Occurrence and ecological risk assessment[J]. Chemosphere, 2020, 255: 127006. doi: 10.1016/j.chemosphere.2020.127006 [46] ARNON S, DAHAN O, ELHANANY S, et al. Transport of testosterone and estrogen from dairy-farm waste lagoons to groundwater[J]. Environmental Science & Technology, 2008, 42(15): 5521-5526. 期刊类型引用(1)
1. 邓倩,于春洋,马瑞,张亚文,李姝霖,雷雨,冯利强,田建英. 环境雌激素EE2早期慢暴露对雄性大鼠成年后神经发育与空间学习行为的影响. 生态毒理学报. 2024(06): 64-75 .  百度学术
百度学术
其他类型引用(0)
-






 DownLoad:
DownLoad: