-
内分泌系统是环境污染物重要的靶系统之一[1]. 按组成功能的不同,内分泌系统可分为肾上腺激素系统,性激素系统,甲状腺激素系统,垂体激素系统,松果体激素系统和内分泌细胞激素系统等. 这些系统产生的激素对维持生物体体内稳态、调节生物体生长发育和新陈代谢等生物过程都具有重要作用[2 − 7].
内分泌干扰物是指能改变内分泌系统的功能从而对完整的生物体或其后代或(亚)种群产生不利的健康影响的外源性物质或混合物[8],可通过多种机制产生内分泌干扰作用,其中一种重要机制是激素的合成、运输与代谢. 农药会随各种途径进入水环境,对水生生物尤其是鱼类造成不利的内分泌影响[9]. 例如,联苯菊酯增大奇努克鲑幼鱼的睾酮(testosterone, T)含量[10];马拉硫磷和六氯环己烷显著降低雌性鲶鱼的血浆雌酮(estrone, E1)水平[11];此外,戊唑醇导致斑马鱼甲状腺功能紊乱并降低斑马鱼体内的甲状腺素(thyroxine, T4)和3,5,3'-三碘甲腺氨酸(3,5,3’-triiodothyronine, T3)水平[12]. 然而,现有研究关注的激素种类相对较少,通常只涉及少数几种激素. 如果想对农药的内分泌毒性进行全面了解,还需要在研究中尽可能多地覆盖更多的激素.
阿特拉津是一种被广泛使用的三嗪类农药,是美国使用量第二大的除草剂,也是我国主要使用的除草剂之一,主要用于玉米和高粱种植区的杂草去除[13]. 阿特拉津结构较稳定、在水中半衰期较长[14],实验室条件下,pH值为5—9时,阿特拉津在水中的浓度可稳定30 d,在中性状态下,阿特拉津的半衰期可达150—180 d[15]. 阿特拉津可通过降雨径流、大气沉降和地下水淋溶迁移到水生环境中[16],随着农药的生产和使用,阿特拉津在世界各国的地表水中都被广泛检出,含量在μg·L−1水平[17 − 18]. 在中国长江的泰州-南通段,阿特拉津的水体检出率达100%,含量为0.10—64.49 μg·L−1[19],在河南和张家口地区的地表水中,阿特拉津的平均含量分别为0.15 μg·L−1 [20]和6.7 μg·L−1 [21]. 阿特拉津也是一种内分泌干扰物[22],可通过增大垂体重量、降低类固醇代谢酶活性改变大鼠内分泌系统的功能进而对大鼠产生不利的健康影响[23]. 阿特拉津对鱼类的内分泌影响也已有报道,例如,阿特拉津会降低雄性大西洋鲑鱼对雌鱼激素的嗅觉反应[24],增高斑马鱼体内细胞色素P450的含量[25],诱导虹鳟鱼幼鱼体内的雄激素转化为雌激素,诱导氧化应激并改变鱼肝脏的代谢过程[26]. 然而,目前还没有阿特拉津对鱼类的内分泌效应的全面评估.
斑马鱼是一种小型热带淡水鱼,由于具有体积小(成年斑马鱼体长3—5 cm)、繁殖时间短(3—5个月)、对化学品敏感、内分泌系统的组成和功能与人体类似的优势[27],已成为研究激素和内分泌干扰物生物效应的重要模式生物[28]. 本研究选用斑马鱼幼鱼作为受试生物,探究环境浓度暴露下阿特拉津对斑马鱼不同内分泌激素系统中22种激素的影响,同时运用毒理学综合指数法(ToxPi)表征阿特拉津对鱼类的内分泌干扰效应,为评估阿特拉津的水生态风险提供依据.
-
阿特拉津(纯度> 97%)购自上海麦克林公司,22种内分泌激素和6种同位素内标购自中国百灵威公司,详细信息见表1. 购买的上述标准品均用乙腈配置成1 mg·mL−1的储备液,5%的乙腈溶液被用来梯度稀释配置低浓度单标和混标溶液. 实验所用试剂均为LC-MS级,乙腈购自美国J.T.Baker公司. 甲酸、分析纯中性Al2O3、无水MgSO4、NaCl购自中国百灵威公司,C18购自美国Welch Materials公司,吸附剂 N-丙基乙二胺(Primary secondary amine,PSA)购自美国Agilent Technologies公司. 在使用前,分析纯中性Al2O3在180 ℃下烘烤12 h活化,无水MgSO4和NaCl在450 ℃下烘烤4 h去除其中可能残留的有机物. 三卡因(纯度> 97%)购自上海麦克林公司,用于暴露实验后斑马鱼的麻醉处理,使用前用超纯水配置成0.8 g·L−1的溶液.
-
一月龄野生型AB品系斑马鱼幼鱼((0.08 ± 0.02) g, (10.4 ± 1.5) mm)购自上海费曦生物科技有限公司后,在实验室鱼房暂养两周后,挑选大小接近的斑马鱼作为试验鱼转移至装有曝气72 h自来水的实验容器中驯化1周,驯化期间,除驯化第1天和最后1天外每天喂食两次丰年虫. 驯化结束后进行暴露实验,暴露期间不喂食. 根据阿特拉津对鱼类的毒性(96 h LC50 = 4.5—100 mg·L−1)[29]和水环境残留水平,阿特拉津暴露浓度设置为低浓度组1 μg·L−1,中浓度组10 μg·L−1和高浓度组100 μg·L−1,同时设置对照组(含0.01%乙腈). 每组暴露12条斑马鱼,平均放置在两个1 L的烧杯中,进行为期3 d的半静态暴露实验,每24 h更换装置内一半的水并补充相应药剂维持暴露浓度. 在暴露期间,每天检测并记录环境温度、湿度、水体pH值、溶解氧值和水体温度,分别为(25.2 ± 1.6) ℃、(48% ± 6.5)%、(7.12 ± 0.13)、(7.19 ± 0.76) mg·L−1和(26.8 ± 0.5) ℃.
-
暴露实验结束后,将斑马鱼转移至含0.8 g·L−1的三卡因溶液的水缸中麻醉处理,待鱼静止后快速用镊子取出并切断颈部脊柱. 依据已有方法[30]进行样品预处理:每条鱼称重后加1 mL超纯水充分匀浆,匀浆液全部转移至10 mL离心管中并加入3 mL含0.1%甲酸的乙腈溶液、200 μL同位素内标混合液(各内标浓度为10 μg·L−1)后超声萃取10 min,加入NaCl和无水MgSO4各200 mg,涡旋混匀1 min后离心5 min(转速为
4000 r·min−1),上清液取至新的10 mL离心管中,加入50 mg PSA、30 mg C18、30 mg 中性Al2O3和20 mg无水MgSO4,涡旋混匀1 min后离心5 min(转速为4000 r·min−1),上清液取至新的10 mL离心管中,剩余部分加入2 mL含0.1%甲酸的乙腈溶液润洗后离心5 min(转速为4000 r·min−1),上清液合并后用氮吹仪吹至近干后,用200 μL 5%乙腈溶液复溶,复溶液过0.22 μm滤膜以去除可能含有的颗粒物,进UPLC-MS/MS分析. -
使用超高效液相色谱-三重四极杆串联质谱仪(Xevo TQ-S,Waters,美国)对样品中的激素进行分析,液相分离色谱柱为BEH C18柱(100 mm×2.1 mm,1.7 μm,Waters),柱温40 ℃,进样量10 μL,流动相采用二元洗脱液,A相为含0.1%甲酸的乙腈,B相为含0.1%甲酸的超纯水,梯度洗脱程序为:0 min 5% A,2 min 25% A,4 min 95% A,8 min 5% A,流速为0.2 mL·min−1. 离子化模式为电喷雾正负电离模式,多反应选择离子监测(multiple reaction monitoring,MRM). 电压设置为 3.5 kV,氮气作为脱溶剂气,流速为 800 L·h−1,温度为 350 ℃,氩气作为碰撞气.
所用分析方法为实验室此前所建方法,方法基质效应处于 67.3%—132.1% 之间,相对回收率处于 73.4%—110.2%之间,方法误差≤13.8%,方法相对标准偏差介于 0.3%—20.0%之间,各激素及同位素内标的质谱分析参数、方法学参数详见已发表的结果[31].
-
激素含量(ng·g−1)以鱼湿重计算,用平均值±标准误(SEM)表示,数据分析采用one-way ANOVA,在SPSS 26.0 软件中进行,P < 0.05视为显著性.
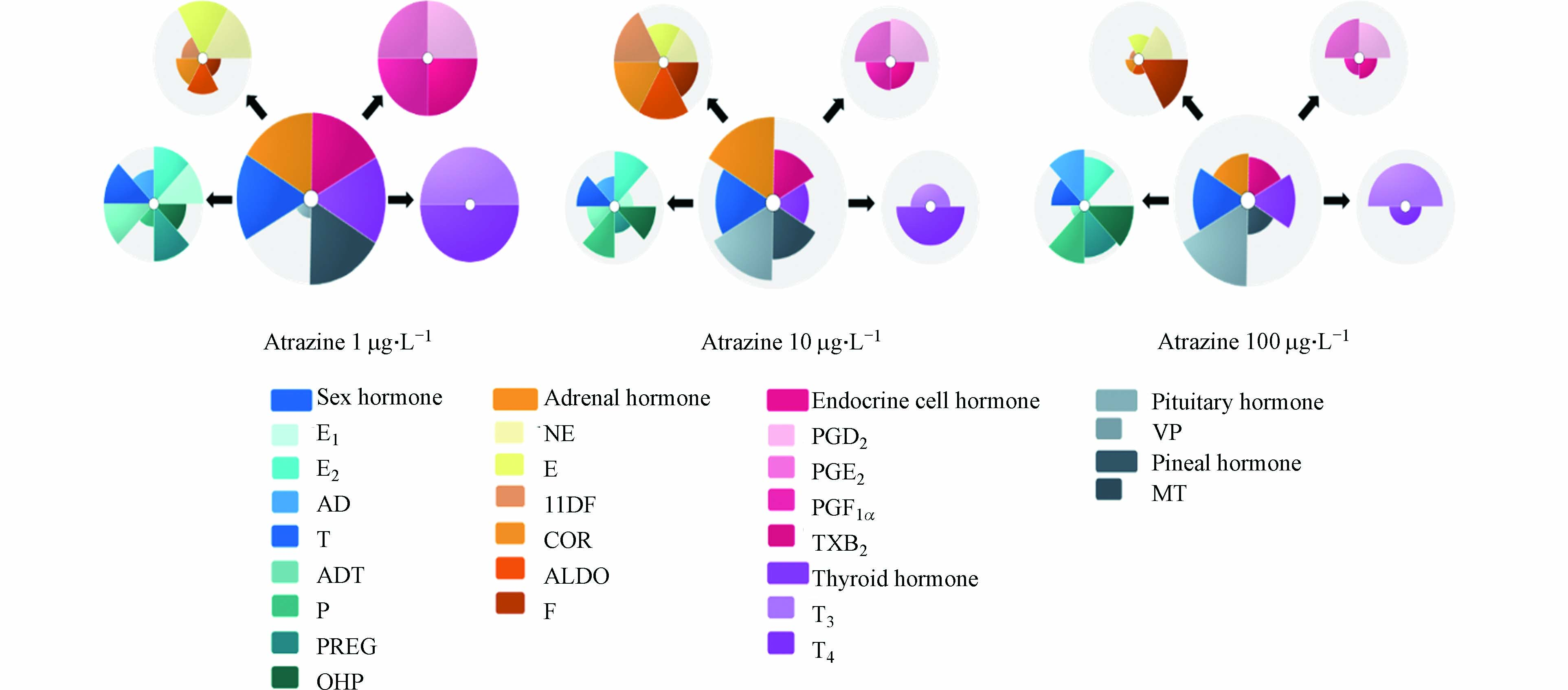
毒理学优先指数法ToxPi(Toxicological Prioritization Index)由Reif和Martin等提出[32],他们开发的ToxPi 软件(http://toxpi.org)可将多个不同来源的数据根据权重组合成一个毒理学优先指数(ToxPi 值)并进行可视化的表达(ToxPi 特征图),依据指数进行化学品的优先级排序[33]. 本研究使用ToxPi 软件对22种激素含量加权分析,得到阿特拉津在各暴露浓度下的综合内分泌干扰效应值(ToxPi 值)并绘制相应综合内分泌干扰效应图(ToxPi 特征图),ToxPi 值由软件归一化至0—1区间,0代表无综合内分泌干扰效应,数值越靠近1代表综合内分泌干扰效应越大. ToxPi 特征图包含颜色不同的扇形,不同颜色代表不同激素或是不同内分泌激素系统,扇形半径的大小指示受干扰程度的大小,半径越大代表受到的干扰越大.
-
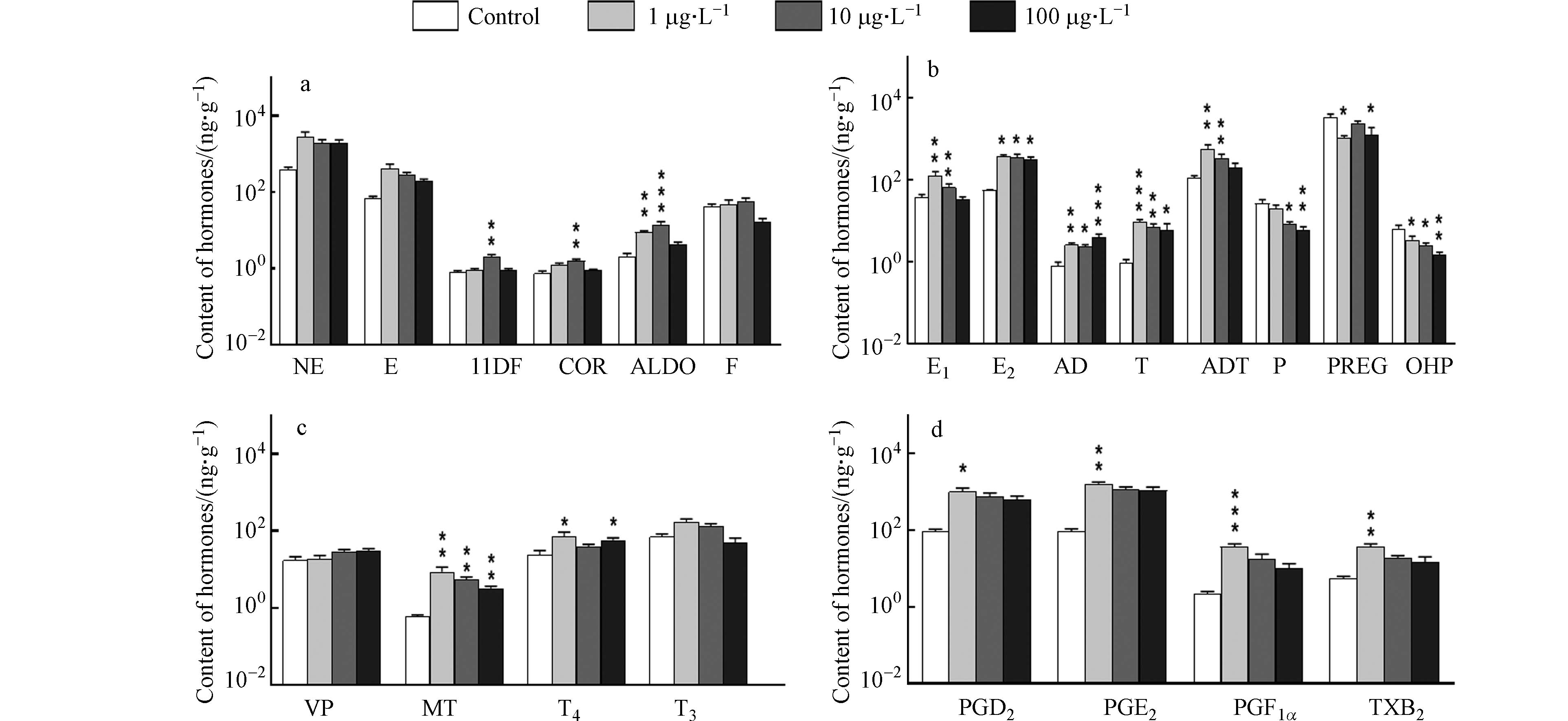
阿特拉津对来自不同内分泌激素系统的激素的影响如图1所示. 在肾上腺激素系统中(图1a),暴露于阿特拉津时,NE和E的含量均高于对照,但在统计学上没有显著性差异;11DF和COR含量也高于对照并在中暴露浓度下分别显著增大为对照组的2.5倍和2.1倍;ALDO含量同样高于对照,在低暴露浓度下就显著增大为对照的4.2倍,在中暴露浓度下显著增大为对照的6.5倍,而F含量在阿特拉津的各暴露浓度下均无显著变化. 以前的研究鲜有阿特拉津对鱼类肾上腺激素影响的报道,由本实验可见阿特拉津对斑马鱼的肾上腺激素系统具有一定的干扰作用,其中ALDO对阿特拉津的敏感度高于其他几种肾上腺激素. 在其他动物实验中,阿特拉津被证实可通过刺激促肾上腺皮质激素的释放增加雌性和雄性大鼠的血清COR水平[34 − 35],在阿特拉津作用于小鼠的实验中,同样观察到肾上腺皮质激素COR的分泌增强[36],11DF、COR和ALDO都是肾上腺皮质激素,推测本研究中这几种激素水平的显著增大源自阿特拉津诱导斑马鱼体内促肾上腺皮质激素的释放.
在性激素系统中(图1b),雌激素E1、E2,雄激素AD、T、ADT的含量均出现显著性增大,其中E1、T和ADT含量的增幅和暴露浓度负相关,例如T含量在低暴露浓度下由0.91 ng·g−1显著增大为9.09 ng·g−1,增大了8.9倍,在中暴露浓度下含量为6.91 ng·g−1,增大了6.5倍,在高暴露浓度下含量为5.97 ng·g−1,增大了5.5倍. 孕激素P、PREG和OHP的含量均低于对照组,其中P和OHP含量的降幅和暴露浓度正相关,例如,和对照组相比,P含量在低暴露浓度下降低25.8%,在中暴露浓度和高暴露浓度下分别显著降低68.4%和77.2%. AD和T分别是E1和E2的直接前体,除了由性腺分泌外,还能由肾上腺皮质细胞分泌. 此前研究发现高剂量(50 mg·kg−1)阿特拉津显著增加切除卵巢的雌性大鼠的血清E1和E2水平[37],推测是由于阿特拉津暴露诱导了包括AD和T在内的肾上腺类固醇的合成. 在本研究中,斑马鱼体内肾上腺类固醇类激素11DF、COR、ALDO、雄激素AD、T、ADT和雌激素E1、E2的含量的增大可能也来自于阿特拉津对肾上腺类固醇的诱导作用. 孕激素水平受到促黄体激素(Luteinizing Hormone,LH)的诱导,COR可抑制LH分泌[38]. 在本研究中,COR含量在阿特拉津暴露下增大,P、PREG和OHP含量都降低. 此前也有研究证实1 μg·L−1和10 μg·L−1的阿特拉津可抑制黄体细胞的孕酮P分泌[39],本研究中阿特拉津暴露下孕激素的含量下降可能是因为阿特拉津诱导COR的生成,抑制了LH的分泌并导致孕激素水平的下降.
在垂体、松果体和甲状腺激素系统中(图1c),阿特拉津暴露略微增大了VP含量,显著增加MT含量,MT含量在低、中、高浓度的阿特拉津暴露下分别显著增大为对照的13.1倍、8.1倍和4.3倍. MT具有抗氧化作用,可通过清除自由基、产生具有抗氧化性的代谢物和刺激抗氧化酶等方式直接或间接地抑制氧化损伤[40],已被证实可改善大鼠红细胞中阿特拉津诱导的氧化损伤[41]. 此前研究证实阿特拉津会诱导鲤鱼体内产生过量活性氧并诱导细胞产生氧化应激造成氧化损伤[42],本研究中MT含量的增大可能由于松果体为抑制阿特拉津造成的氧化损伤而大量合成MT. 阿特拉津暴露下的T4含量均高于对照组,当暴露于低浓度阿特拉津时,T4含量显著增加193.0%,暴露于高浓度阿特拉津时显著增大138.5%,暴露于中浓度阿特拉津时T4含量由24.1 ng·g−1增大为39.5 ng·g−1,但在统计学上没有显著性差异,T3含量受阿特拉津的影响不明显. T4可通过葡萄糖醛酸化、硫酸化和脱碘代谢[43],其中脱碘代谢的产物是T3,此前未有研究涉及环境浓度的阿特拉津暴露对鱼类甲状腺激素的影响,本研究中T4及其代谢产物T3的水平均有一定程度的增加,同暴露浓度下T4的增大程度大于T3,推测阿特拉津暴露诱导T4的合成或抑制T4其他通路的代谢,对T4向T3的转化未产生明显作用.
在内分泌细胞激素系统中(图1d),阿特拉津暴露下的前列腺素PGD2、PGE2、PGF1α和血栓素TXB2的含量均增大,增幅都与暴露浓度负相关,例如,PGD2含量在低暴露浓度时显著增大为对照的10.1倍,在中暴露浓度时由91.0 ng·g−1增大到759.4 ng·g−1,增大7.3倍,而在高暴露浓度时增大5.8倍. 类似地,TXB2含量在低暴露浓度时由5.6 ng·g−1增大到36.7 ng·g−1,增大555.6%,在中暴露浓度时增大到18.5 ng·g−1,增大230.5%,而在高暴露浓度时增大到14.6 ng·g−1,增大162.0%. 此前未有研究涉及阿特拉津对鱼类PGD2、PGE2、PGF1α和TXB2的影响,这4种激素的前体物质都是花生四烯酸,阿特拉津暴露下这4种激素含量的增大可能由于阿特拉津暴露诱导鱼体内花生四烯酸向PGD2、PGE2、PGF1α和TXB2的转化.
-
不同暴露浓度下阿特拉津对斑马鱼内分泌系统和系统中相应激素的影响如图2所示,阿特拉津在1 μg·L−1的暴露浓度下对斑马鱼综合内分泌干扰效应最大,其中对性激素系统、甲状腺激素系统、松果体激素系统和内分泌细胞激素系统的影响较大. 与另两个暴露浓度相比,10 μg·L−1 的阿特拉津暴露对肾上腺激素系统的影响较大,100 μg·L−1 的阿特拉津暴露对垂体激素系统的影响较大. 由此可见,不同浓度的阿特拉津对斑马鱼的不同内分泌激素系统的影响并不一致.
-
根据阿特拉津对内分泌激素的干扰效应进行综合内分泌干扰指数(ToxPi值)的计算,结果如下:
$ \mathbf{T}\mathbf{o}\mathbf{x}\mathbf{P}{\mathbf{i}}_{\mathbf{A}\mathbf{t}\mathbf{r}\mathbf{a}\mathbf{z}\mathbf{i}\mathbf{n}\mathbf{e}(1\mathbf{\mu }\mathbf{g}·{\text{L}}^{\text{-1}})}^{0.8561} $ >$ \mathbf{T}\mathbf{o}\mathbf{x}\mathbf{P}{\mathbf{i}}_{\mathbf{A}\mathbf{t}\mathbf{r}\mathbf{a}\mathbf{z}\mathbf{i}\mathbf{n}\mathbf{e}(10\mathbf{\mu }\mathbf{g}·{\text{L}}^{\text{-1}})}^{0.7082} $ >$ \mathbf{T}\mathbf{o}\mathbf{x}\mathbf{P}{\mathbf{i}}_{\mathbf{A}\mathbf{t}\mathbf{r}\mathbf{a}\mathbf{z}\mathbf{i}\mathbf{n}\mathbf{e}(100\mathbf{\mu }\mathbf{g}·{\text{L}}^{\text{-1}})}^{0.5941} $ . ToxPi值和阿特拉津的暴露浓度负相关,在这3种暴露浓度中,1 μg·L−1 阿特拉津暴露的ToxPi值最大,说明1 μg·L−1 的阿特拉津具有最强的综合内分泌干扰效应,而100 μg·L−1 的阿特拉津暴露的ToxPi值最小,说明100 μg·L−1 的阿特拉津具有最小的综合内分泌干扰效应. 这表明阿特拉津的综合内分泌干扰效应和暴露浓度负相关,低暴露浓度的阿特拉津会比高暴露浓度更能影响到鱼类的内分泌系统,给鱼类的能量代谢、生长发育和繁殖造成不利影响. 鉴于环境水体中的阿特拉津浓度大多集中在零点几到几 μg·L−1 的范围内,阿特拉津对鱼类乃至人体的健康风险值得重视. -
本研究表明,环境相关浓度的阿特拉津暴露会引起斑马鱼内分泌系统中的多种激素含量发生变化,从而可能产生内分泌毒性,进而影响斑马鱼内的分泌系统功能. 在3种暴露浓度中,低浓度(1 μg·L−1)阿特拉津暴露对斑马鱼的综合内分泌干扰效应高于中(10 μg·L−1)、高浓度(100 μg·L−1),且不同浓度的阿特拉津对斑马鱼的不同内分泌激素系统的影响并不一致.
阿特拉津对斑马鱼的综合内分泌干扰效应
Comprehensive endocrine disruptive effects of atrazine on zebrafish
-
摘要: 阿特拉津是一种广泛使用的除草剂,同时也是一种内分泌干扰物,在环境水体中被频繁检出,然而目前还缺乏有关阿特拉津对鱼类内分泌干扰效应的全面了解. 本文研究了环境相关浓度暴露下阿特拉津对斑马鱼幼鱼不同内分泌激素系统中22种激素的影响,并在激素水平、内分泌激素系统水平、综合内分泌干扰指数水平进行了分析. 结果表明,阿特拉津暴露能够引起斑马鱼体内11-脱氧皮质醇(11DF)、皮质酮(COR)、醛固酮(ALDO)、雌酮(E1)、雌二醇(E2)、雄烯二酮(AD)、睾酮(T)、雄酮(ADT)、褪黑素(MT)、甲状腺素(T4)、前列腺素D2(PGD2)、前列腺素E2(PGE2)、前列腺素F1α(PGF1α)、血栓素B2(TXB2)的含量升高,和导致孕酮(P)、孕烯醇酮(PREG)、17α羟基孕酮(OHP)的含量降低. 在3个暴露浓度(1、10、100 μg·L−1)中,低浓度的阿特拉津对斑马鱼性激素系统、甲状腺激素系统、松果体激素系统和内分泌细胞激素系统的干扰作用更加明显,同时也具有更强的综合内分泌干扰效应.Abstract: Atrazine is a widely used herbicide and also an endocrine disruptor that is frequently detected in aquatic environment. However, the comprehensive profile of endocrine disruption of atrazine has been not revealed in fish up to date. The effects of atrazine on 22 hormones of various endocrine hormone systems were investigated in larval zebrafish at environmentally relevant concentrations, and assessed at the levels of hormone, endocrine hormone system and comprehensive index in the study. The results indicated that exposure to atrazine increased the levels of 11-deoxycortisol (11DF), corticosterone (COR), aldosterone (ALDO), estrone (E1), estradiol (E2), androstenedione (AD), testosterone (T), androstenedione (ADT), melatonin (MT), thyroxine (T4), prostaglandin D2 (PGD2), prostaglandin E2 (PGE2), prostaglandin F1α (PGF1α) and thromboxane B2 (TXB2), and decreased the levels of progesterone (P), pregnenolone (PREG), and 17α-hydroxyprogesterone (OHP). Among the three exposure concentrations (1, 10 and 100 μg·L−1), the low concentration of atrazine induced stronger effects on the sex hormone system, thyroid hormone system, pineal hormone system and endocrine cell hormone system, and meanwhile posed a greatest comprehensive endocrine disruption in zebrafish.
-

-
表 1 各种激素及同位素内标详细信息
Table 1. The detailed information of hormones and isotope internal standards
分类
Category化合物
Compound英文全称
English name简称
Abbreviation纯度/%
Purity肾上腺激素系统 去甲肾上腺素 norepinephrine NE 98 肾上腺素 epinephrine E 100 11-脱氧皮质醇 11-deoxycortisol 11DF 99.3 皮质酮 corticosterone COR 99.1 醛固酮 aldosterone ALDO 97.0 皮质醇 cortisol F 98.0 性激素系统 雌酮 estrone E1 99.6 雌二醇 estradiol E2 95.4 雄烯二酮 androstenedione AD 99.3 睾酮 testosterone T 98.0 雄酮 androsterone ADT 98.4 孕酮 progesterone P 99.5 17α-羟基孕酮 17α-hydroxyprogesterone OHP 99.0 孕烯醇酮 pregnenolone PREG 100.0 甲状腺激素系统 3,3,5-三碘甲状腺原氨酸 3,3,5-triiodo-L-thyronine T3 100.0 甲状腺素 thyroxine T4 92.0 垂体激素系统 后叶加压素 vasopressin VP 98.0 松果体激素系统 褪黑素 melatonin MT 99.5 内分泌细胞激素系统 前列腺素 D2 prostaglandin D2 PGD2 100.0 前列腺素 E2 prostaglandin E2 PGE2 98.0 前列腺素 F1α prostaglandin F1α PGF1α 100.0 血栓素 B2 thromboxane B2 TXB2 100.0 同位素内标 褪黑素-d4 melatonin-d4 MT-d4 100.0 甲状腺素-c6 thyroxine-c6 T4-c6 99.3 睾酮-c3 testosterone-c3 T-c3 99.3 孕酮-d9 progesterone-d9 P-d9 100.0 皮质醇-d4 cortisol-d4 F-d4 99.1 前列腺素 E2-d4 prostaglandin E2-d4 PGE2-d4 100.0 -
[1] DIAMANTI-KANDARAKIS E, BOURGUIGNON J P, GIUDICE L C, et al. Endocrine-disrupting chemicals: An endocrine society scientific statement[J]. Endocrine Reviews, 2009, 30(4): 293-342. doi: 10.1210/er.2009-0002 [2] DI LORENZO M, BARRA T, ROSATI L, et al. Adrenal gland response to endocrine disrupting chemicals in fishes, amphibians and reptiles: A comparative overview[J]. General and Comparative Endocrinology, 2020, 297: 113550. doi: 10.1016/j.ygcen.2020.113550 [3] LINDEROTH M, LEDESMA M, ZEBÜHR Y, et al. Sex steroids in the female zebrafish (Danio rerio). Effects of cyproterone acetate and leachate-contaminated sediment extract[J]. Aquatic Toxicology (Amsterdam, Netherlands), 2006, 79(2): 192-200. doi: 10.1016/j.aquatox.2006.06.011 [4] MULLUR R, LIU Y Y, BRENT G A. Thyroid hormone regulation of metabolism[J]. Physiological Reviews, 2014, 94(2): 355-382. doi: 10.1152/physrev.00030.2013 [5] MATSUMOTO R, TAKAHASHI Y. Human pituitary development and application of iPSCs for pituitary disease[J]. Cellular and Molecular Life Sciences, 2021, 78(5): 2069-2079. doi: 10.1007/s00018-020-03692-8 [6] KIM H J, KIM H J, BAE M K, et al. Suppression of osteoclastogenesis by melatonin: A melatonin receptor-independent action[J]. International Journal of Molecular Sciences, 2017, 18(6): 1142. doi: 10.3390/ijms18061142 [7] ENGSTRÖM L, RUUD J, ESKILSSON A, et al. Lipopolysaccharide-induced fever depends on prostaglandin E2 production specifically in brain endothelial cells[J]. Endocrinology, 2012, 153(10): 4849-4861. doi: 10.1210/en.2012-1375 [8] IPCS (2002). Global assessment of the state-of-the-science of endocrine disruptors[R]. Geneva, Switzerland: World Health Organization, International Programme on Chemical Safety. [9] AMENYOGBE E, HUANG J S, CHEN G, et al. An overview of the pesticides’ impacts on fishes and humans[J]. International Journal of Aquatic Biology, 2021, 9(1): 55-65. [10] GIROUX M, GAN J, SCHLENK D. The effects of bifenthrin and temperature on the endocrinology of juvenile Chinook salmon[J]. Environmental Toxicology and Chemistry, 2019, 38(4): 852-861. doi: 10.1002/etc.4372 [11] SINGH S, SINGH T P. Impact of malathion and hexachlorocyclohexane on plasma profiles of three sex hormones during different phases of the reproductive cycle in Clarias batrachus[J]. Pesticide Biochemistry and Physiology, 1987, 27(3): 301-308. doi: 10.1016/0048-3575(87)90059-9 [12] LI S Y, WU Q, SUN Q Q, et al. Parental exposure to tebuconazole causes thyroid endocrine disruption in zebrafish and developmental toxicity in offspring[J]. Aquatic Toxicology, 2019, 211: 116-123. doi: 10.1016/j.aquatox.2019.04.002 [13] United States Environmental Protection Agency (USEPA). Atrazine Chemical Summary. [R/OL].[2023-02-17]. [14] WU S H, LI H R, LI X, et al. Performances and mechanisms of efficient degradation of atrazine using peroxymonosulfate and ferrate as oxidants[J]. Chemical Engineering Journal, 2018, 353: 533-541. doi: 10.1016/j.cej.2018.06.133 [15] 严登华, 何岩, 王浩. 东辽河流域地表水体中Atrazine的环境特征[J]. 环境科学, 2005, 26(3): 203-308. doi: 10.3321/j.issn:0250-3301.2005.03.041 YAN D H, HE Y, WANG H. Environmental characteristics of the atrazine in the waters in east Liaohe River Basin[J]. Environmental Science, 2005, 26(3): 203-308(in Chinese) doi: 10.3321/j.issn:0250-3301.2005.03.041
[16] OUYANG W, ZHANG Y, LIN C Y, et al. Metabolic process and spatial partition dynamics of Atrazine in an estuary-to-bay system, Jiaozhou bay[J]. Journal of Hazardous Materials, 2021, 414: 125530. doi: 10.1016/j.jhazmat.2021.125530 [17] GILLIOM R J, BARBASH J E, CRAWFORD C G, et al. Pesticides in the Nation's Streams and Ground Water, 1992–2001[R]. U. S. Geological Survey, Reston, Virginia, 2006. [18] BACHETTI R A, URSELER N, MORGANTE V, et al. Monitoring of atrazine pollution and its spatial-seasonal variation on surface water sources of an agricultural river basin[J]. Bulletin of Environmental Contamination and Toxicology, 2021, 106(6): 929-935. doi: 10.1007/s00128-021-03264-x [19] 杨敏娜, 周芳, 孙成, 等. 长江江苏段有毒有机污染物的残留特征及来源分析[J]. 环境化学, 2006, 25(3): 375-376 YANG M N, ZHOU F, SUN C, et al. Residual characteristics and source analysis of toxic organic pollutants in Jiangsu section of the Yangtze River[J]. Environmental Chemistry, 2006, 25(3): 375-376(in Chinese)
[20] YU J, BIAN Z Q, TIAN X H, et al. Atrazine and its metabolites in surface and well waters in rural area and its human and ecotoxicological risk assessment of Henan Province, China[J]. Human and Ecological Risk Assessment:an International Journal, 2018, 24(1): 1-13. doi: 10.1080/10807039.2017.1311768 [21] REN J, JIANG K. Atrazine and its degradation products in surface and ground waters in Zhangjiakou District, China[J]. Chinese Science Bulletin, 2002, 47(19): 1612-1616. doi: 10.1007/BF03184108 [22] GROSHART C, OKKERMAN P C. Towards the establishment of a priority list of substances for further evaluation of their role in endocrine disruption - preparation of a candidate list of substances as a basis for priority setting[R]. European Commission: DG Environment, The Netherlands, 2000. [23] VAINIO H, HESELTINE E, SHUKER L, et al. Meeting report: Occupational exposures in insecticide application and some pesticides[J]. European Journal of Cancer and Clinical Oncology, 1991, 27(3): 284-289. doi: 10.1016/0277-5379(91)90517-H [24] MOORE A, LOWER N. The impact of two pesticides on olfactory-mediated endocrine function in mature male Atlantic salmon (Salmo salar L. ) parr[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2001, 129(2/3): 269-276. [25] DONG X L, ZHU L S, WANG J H, et al. Effects of atrazine on cytochrome P450 enzymes of zebrafish (Danio rerio)[J]. Chemosphere, 2009, 77(3): 404-412. doi: 10.1016/j.chemosphere.2009.06.052 [26] SALABERRIA I, HANSEN B H, ASENSIO V, et al. Effects of atrazine on hepatic metabolism and endocrine homeostasis in rainbow trout (Oncorhynchus mykiss)[J]. Toxicology and Applied Pharmacology, 2009, 234(1): 98-106. doi: 10.1016/j.taap.2008.09.023 [27] SPRAGUE J, CLEMENTS D, CONLIN T, et al. The Zebrafish Information Network (ZFIN): The zebrafish model organism database[J]. Nucleic Acids Research, 2003, 31(1): 241-243. doi: 10.1093/nar/gkg027 [28] CABALLERO-GALLARDO K, OLIVERO-VERBEL J, FREEMAN J L. Toxicogenomics to evaluate endocrine disrupting effects of environmental chemicals using the zebrafish model[J]. Current Genomics, 2016, 17(6): 515-527. doi: 10.2174/1389202917666160513105959 [29] SAGLIO P, TRIJASSE S. Behavioral responses to atrazine and diuron in goldfish[J]. Archives of Environmental Contamination and Toxicology, 1998, 35(3): 484-491. doi: 10.1007/s002449900406 [30] GAO S Y, YANG F X. Behavioral changes and neurochemical responses in Chinese rare minnow exposed to four psychoactive substances[J]. Science of the Total Environment, 2022, 808: 152100. doi: 10.1016/j.scitotenv.2021.152100 [31] 张莹, 沈佳莹, 杨方星. QuEChERS-超高效液相色谱-串联质谱法同时测定斑马鱼中多种激素生物标志物[J]. 环境化学, 2021, 40(4): 964-973. doi: 10.7524/j.issn.0254-6108.2019113002 ZHANG Y, SHEN J Y, YANG F X. Simultaneous determination of multiple hormone biomarkers in zebrafish by QuEChERS and ultra-high performance liquid chromatography coupled with tandem mass spectrometry[J]. Environmental Chemistry, 2021, 40(4): 964-973 (in Chinese). doi: 10.7524/j.issn.0254-6108.2019113002
[32] REIF D M, MARTIN M T, TAN S W, et al. Endocrine profiling and prioritization of environmental chemicals using ToxCast data[J]. Environmental Health Perspectives, 2010, 118(12): 1714-1720. doi: 10.1289/ehp.1002180 [33] MARVEL S W, TO K, GRIMM F A, et al. ToxPi Graphical User Interface 2.0: Dynamic exploration, visualization, and sharing of integrated data models[J]. BMC Bioinformatics, 2018, 19(1): 80. doi: 10.1186/s12859-018-2089-2 [34] FRAITES M J P, COOPER R L, BUCKALEW A, et al. Characterization of the hypothalamic-pituitary-adrenal axis response to atrazine and metabolites in the female rat[J]. Toxicological Sciences, 2009, 112(1): 88-99. doi: 10.1093/toxsci/kfp194 [35] LAWS S C, HOTCHKISS M, FERRELL J, et al. Chlorotriazine herbicides and metabolites activate an ACTH-dependent release of corticosterone in male wistar rats[J]. Toxicological Sciences, 2009, 112(1): 78-87. doi: 10.1093/toxsci/kfp190 [36] PRUETT S B, FAN R P, ZHENG Q, et al. Modeling and predicting immunological effects of chemical stressors: Characterization of a quantitative biomarker for immunological changes caused by atrazine and ethanol[J]. Toxicological Sciences, 2003, 75(2): 343-354. doi: 10.1093/toxsci/kfg200 [37] COOPER R L, LAWS S C, DAS P C, et al. Atrazine and reproductive function: Mode and mechanism of action studies[J]. Birth Defects Research Part B:Developmental and Reproductive Toxicology, 2007, 80(2): 98-112. doi: 10.1002/bdrb.20110 [38] KAMEL F, KUBAJAK C L. Modulation of gonadotropin secretion by corticosterone: Interaction with gonadal steroids and mechanism of action[J]. Endocrinology, 1987, 121(2): 561-568. doi: 10.1210/endo-121-2-561 [39] WROBEL M H, MLYNARCZUK J. The inhibition of myometrial contractions by chlorinated herbicides (atrazine and linuron), and their disruptive effect on the secretory functions of uterine and ovarian cells in cow, in vitro[J]. Pesticide Biochemistry and Physiology, 2017, 142: 44-52. doi: 10.1016/j.pestbp.2017.01.002 [40] TAN D X, MANCHESTER L C, REITER R J, et al. Significance of melatonin in antioxidative defense system: Reactions and products[J]. Biological Signals and Receptors, 2000, 9(3/4): 137-159. [41] BHATTI J S, SIDHU I P S, BHATTI G K. Ameliorative action of melatonin on oxidative damage induced by atrazine toxicity in rat erythrocytes[J]. Molecular and Cellular Biochemistry, 2011, 353(1): 139-149. [42] WANG S C, ZHANG Q J, ZHENG S F, et al. Atrazine exposure triggers common carp neutrophil apoptosis via the CYP450s/ROS pathway[J]. Fish & Shellfish Immunology, 2019, 84: 551-557. [43] KELLY G S. Peripheral metabolism of thyroid hormones: A review[J]. Alternative Medicine Review, 2000, 5(4): 306-333. -



 下载:
下载: