-
非甾体抗炎药(non-steroidal anti-inflammatory drugs, NSAIDs)是一类不具有甾体结构的抗炎药,有消炎、镇痛、退热等功效,每年全球的处方量可达5亿[1]. 布洛芬(ibuprofen, IBP)作为一种典型的NSAIDs,在临床应用中安全有效. 它不仅在退热效果、时间和镇痛等方面都具有显著优势,并且副作用小,易于耐受. 在解热镇痛方面,IBP与对乙酰氨基酚和阿司匹林并称三大支柱药物[2]. 自20世纪70年代末,IBP开始在我国生产销售. 据统计,1999年到2018年的近三十年间,全国IBP原料药产量从由581 t增长到
9200 t,增长超过14倍,已成为人们生活中的必备药品[3]. 2020年以来,新冠肺炎的肆虐导致了全球范围内的用药需求增加. 其中,IBP等NSAIDs因其可以缓解感染者的发烧、肌肉酸痛等不适症状而被广泛使用,国务院联防联控机制发布的新冠感染者居家治疗指南及常用药参考中,IBP也作为针对发热症状的药物被列入其中.虽然IBP在预防和治疗人类和动物疾病方面具有重要作用,但其生产、使用和处理过程中也会大量释放进入环境,对周围生态环境造成巨大的压力. 现有数据表明,IBP在环境介质中广泛存在. 德国、西班牙河流地表水IBP含量分别最高可达2.38、11.89 μg·L−1;污水处理厂进水中IBP含量高于河流,加拿大污水处理厂进水中IBP的最高含量可达到75.8 μg·L−1[4]. 在对各大洲的71个国家环境检测中发现亚太和非洲地区的地表水中的IBP含量最高分别达20.5 μg·L−1和21.0 μg·L−1,全球IBP浓度最高的地区是西欧,其最高检测浓度为303 μg·L−1[5]. 由于海洋作为许多地表河流的汇流地和沿海排污的受纳水体,因此在世界各地的海水中也普遍检测到了IBP的存在. 环境调查与监测发现,位于法国南岸的地中海区域海水中发现了浓度约
1500 ng·L−1的IBP[6]. 在对巴西沿海地区药物的一项研究表明,海水样品中IBP存在普遍性,其浓度范围为326.1—2094.4 ng·L−1[7].目前关于IBP对水生生物毒性效应研究相对较少,且主要是针对淡水物种[8]. 斑马鱼暴露于50、500 μg·L−1浓度下的IBP后,其胚胎的孵化时间明显延迟,胚胎内自发运动显著减少,仔鱼的运动能力减弱[9]. IBP浓度为1.5 μg·L−1时,鲤鱼胚胎的死亡率和畸形率开始大幅增加,并且这些增加呈浓度和时间依赖性[4]. 将蓝贻贝暴露于不同浓度的IBP中,发现贻贝的生长空间缩小,足丝强度、数量均有所下降,表明IBP的存在无论浓度高低,均不利于贻贝的生长和生存[10]. 因此,亟需开展IBP对海洋生物毒性效应的研究,以探究其毒性作用的程度,评估其对海洋生物的潜在危害,并为海洋生态风险评估提供参考依据.
鱼类属低等脊椎动物,在水生态系统食物链中占据重要的位置,是水生生物不可或缺的代表,且与人类的关系密切,作为生态毒理研究材料具有较好的代表性[11]. 海洋青鳉鱼(Oryzias melastigma, O.M.)作为国际生命科学学会(ILSI)与健康和环境科学研究所(HESI)推荐的毒理学研究模型,具有青鳉属物种共有的优势[12],如易于大规模饲养、性别易辨别、世代周期短、对污染物敏感、易于观察等[13]. 本实验选用O.M.作为受试物种,研究了不同浓度IBP暴露对O.M.早期生命阶段的发育毒性、抗氧化系统和神经递质系统影响,为评估IBP潜在的生态风险提供了参考依据.
-
本实验所用IBP(IBP, C13H18O2, 纯度≥99%)产自安徽泽升科技有限公司. 药品于实验当天取10 mg IBP溶于10 mL二甲基亚砜(DMSO),配成1 g·L−1母液,母液避光置于冰箱-20 ℃保存. 实验用海水为商品海盐(法国红十字Instant Ocean小丑盐)按说明溶于经砂芯过滤后的纯水机超纯水. 母液每3天配置一次以防止浓度和成分发生变化,实验时将母液加入配好的海水中,依次稀释到所需质量浓度制成暴露溶液,暴露溶液中DMSO助溶剂浓度最高为0.1%,上述所用试剂均为分析纯.
实验用试剂盒:总蛋白质(检测范围: 0.2—1.3mg·mL−1,批间变异系数5.34%,批内变异系数103%)、超氧化物歧化酶(SOD)活性(检测范围: 0.5—122.1 U·mL−1,批间变异系数3.32%,批内变异系数5.50%)、过氧化氢酶(CAT)活性(检测范围: 0.2—24.8 U·mL−1,批间变异系数4.94%,批内变异系数1.9%)、还原型谷胱甘肽(GSH)含量(检测范围: 0.3—147.1 mgGSH·L−1,批间变异系数3.86%,批内变异系数1.2%)、谷胱甘肽巯基转移酶(GST)活性(检测范围: 6.0—22.0 U·mL−1,批间变异系数5.68%,批内变异系数2.9%)、丙二醛(MDA)含量(检测范围: 0—113.0 nmol·mL−1,批间变异系数5.34%,批内变异系数2.3%)、乙酰胆碱酯酶(AChE)活性(检测范围: 0.01—5.0 U·mL−1,批间变异系数6.87%,批内变异系数3.2%)试剂盒,所有试剂盒均购自南京建成生物工程研究所.
实验室仪器为:倒置显微镜(CKX53, Olympus)、体视显微镜(SZ61-TR, Olympus)、紫外可见光分光光度计(UV-2600i, Shimadzu)、光照培养箱(HPG-400BX,北京东联哈尔仪器制造有限公司)、手持高速匀浆器(F6/10,上海力辰邦西仪器科技有限公司)、高速冷冻离心机(GL-20G,上海安亭科学仪器厂)等.
-
采用的O.M.来自厦门大学近海海洋环境科学国家重点实验室,于实验室稳定培育三代以上. 实验前按雌雄比1.2:1挑选个体健康、无明显畸形的6月龄成鱼.
饲养条件:实验用海水为商品海盐(法国红十字Instant Ocean小丑盐)按说明溶于经砂芯过滤后的纯水机超纯水. 盐度为(30‰±1‰),温度为(28±2) ℃,溶解氧>6.0 mg·L−1,光暗周期14 h:10 h. 仔鱼和成鱼分别喂食购自日清丸红饲料科技有限公司的粉末型(由C1型号饲料制备)、B2型饲料,每日3次.
-
实验开始前一天傍晚将鱼缸中残留的胚胎清除掉,以保证进行暴露测试的胚胎均是实验当天所产,并在鱼缸中放入自制的取卵器用来收集胚胎. 雌性O.M.成鱼一般在早上8点至9点之间产卵(光照开始后2 h内),实验当天中午12点左右即可取出取卵器,收集其上的胚胎,同时也对鱼缸底部的胚胎进行收集. 将收集到的胚胎用塑料滴管轻轻反复吹洗,将胚胎表面的杂物反复冲洗干净. 随后,将所收集的胚胎放于倒置显微镜下进行观测,筛选生长健康且受精(色泽透亮且卵周间隙明显)的胚胎进行实验.
-
为探究不同浓度下IBP溶液对O.M.毒性效应,设置IBP溶液浓度为0(海水对照组)、1、10、100、
1000 μg·L−1,外加0.1% DMSO助溶剂对照组. 发育毒性实验分为胚胎和仔鱼两部分,胚胎实验以20 d为实验终点,未孵化出膜则视为死亡. 仔鱼实验周期自孵化时算起共30 d. 使用培养皿(直径10 cm)作为暴露容器,每个培养皿中加入60枚胚胎,每组浓度重复3次,环境参数与前文一致. 每日记录胚胎死亡数、孵化数,观察胚胎发育情况,并在5、8 dpf(day post fertilization,即胚胎受精后的发育时间)时于每个培养皿中随机挑选5枚胚胎使用体视显微镜测定心率. 测定方法为显微镜下记录30次心跳所需时间并换算成每分钟心率,每个胚胎重复3次. 仔鱼30 dph后成长为幼鱼,该阶段体长体重易于测量且存活数稳定,在第30 dph(day post hatching,即为仔鱼孵化出膜后的发育时间)时,统计每个培养皿中仔鱼死亡数,并从每个培养皿随机取出5条仔鱼,测量其体长、体重. 在实验期间每天更换一半暴露液,每周彻底更换一次暴露液,以防止暴露液浓度和成分发生变化,后续实验操作相同. -
设置实验浓度为0(海水对照组)、1、10、100、
1000 μg·L−1,外加0.1% DMSO助溶剂对照组. 将收集来的胚胎置于暴露液中(收集方法同“1.3.1”节),暴露时间为5 dpf和8 dpf,暴露完成后取出所需数量的胚胎,使用实验室超纯水将胚胎表面冲洗干净后用吸水纸吸干水分,置于冷冻管内用液氮冷冻保存. 待测定使用时,将其取出并根据对应试剂盒说明书进行测定实验,每组重复测量3次. -
在满足发育毒性、抗氧化系统及神经递质系统相关物质测定实验数据符合正态分布和方差齐性的前提条件下,采用SPSS 19.0软件中的单因素方差分析法(One way ANOVA)和最小显著性检验法(LSD)分析各组间的差异显著性结果以平均值±标准差表示. 分析采用95%(α=0.05)可信限,P<0.05时表示差异显著.
-
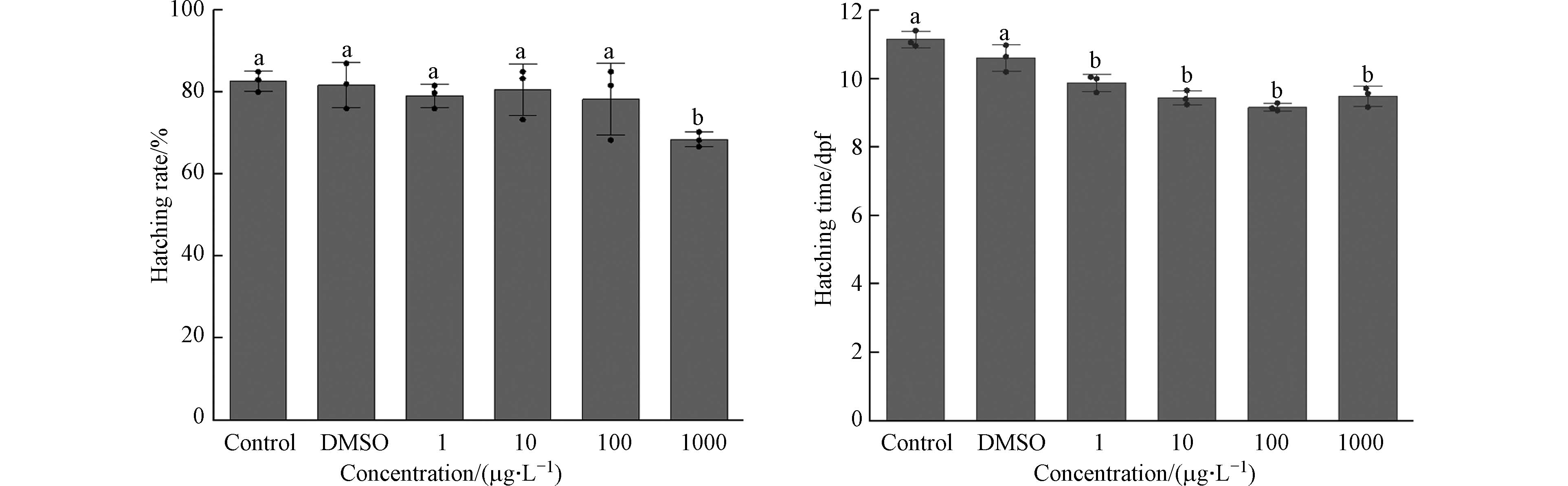
不同IBP浓度下O.M.胚胎持续暴露20 d的孵化率、孵化时间如图1所示. 与对照组孵化率相比,1、10、100 μg·L−1处理组的胚胎孵化率均不存在显著性差异(P>0.05),当浓度达到
1000 μg·L−1时,其孵化率仅为(68.43%±1.80%),与对照组孵化率相比存在显著性差异(P<0.05).与对照组孵化时间相比,各处理组的胚胎孵化时间均显著减少(P<0.05). 各处理组之间的孵化时间不存在显著性差异(P>0.05),孵化时间与浓度之间无明显剂量效应. 胚胎受到外界环境刺激后减少孵化时间的现象也有过报道,例如六价铬使得O.M.子代孵化时间与正常胚胎相比较短[14]. 这与环境污染物介导产生大量活性氧(ROS)使得胚胎的抗氧化系统失衡有关[15]. 但有趣的是有研究表明IBP会导致斑马鱼胚胎孵化时间延长[16],暴露时长可能是导致孵化时间存在差异的原因之一,斑马鱼通常2—3 d就可以孵化,而O.M.则需8—12 d,更长时间的刺激可能会使得胚胎通过提前孵化来保证生存. 淡水、海水的理化性质差异也可能导致相同污染物在不同水环境中呈现不同的效果[17].
-
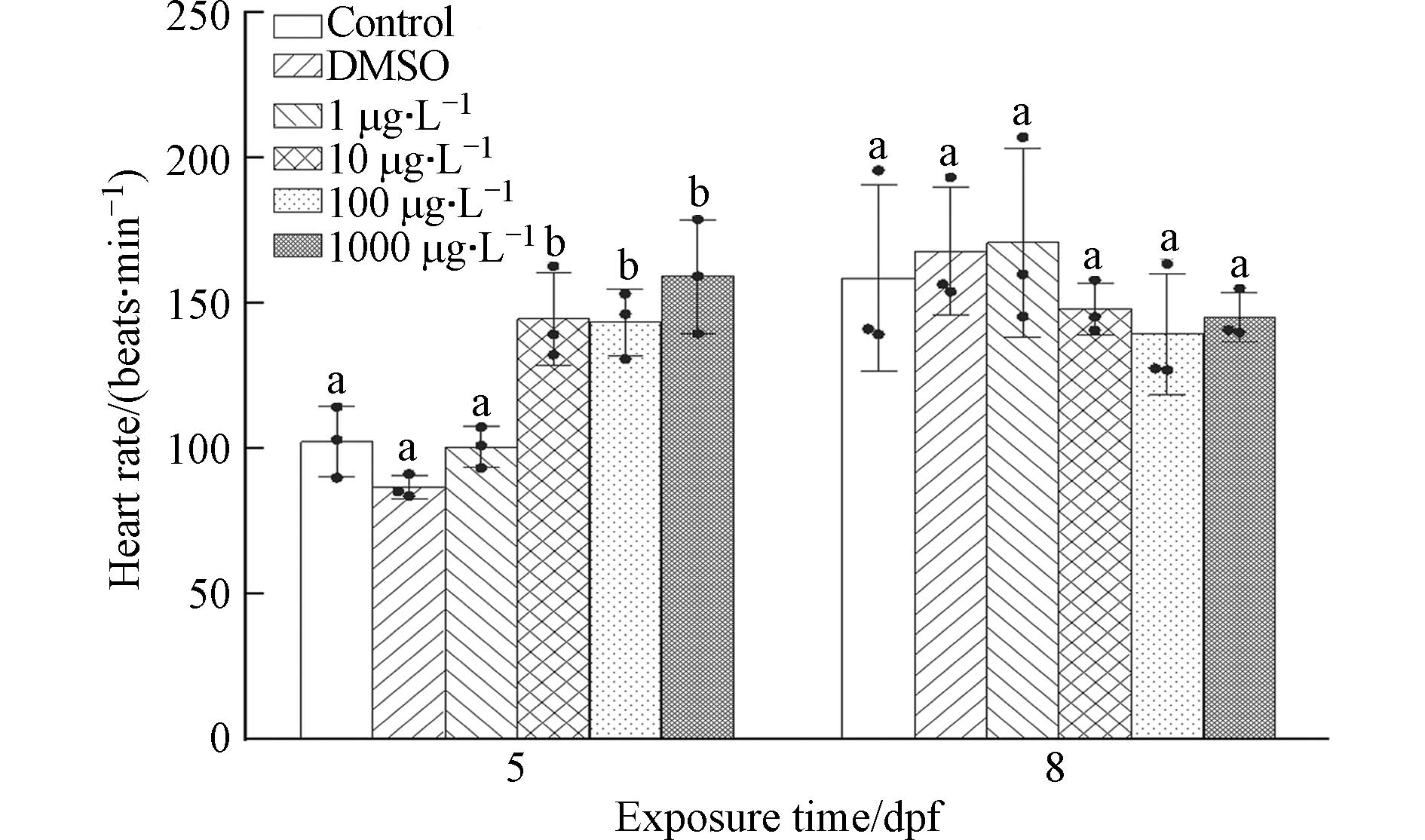
不同IBP浓度暴露下的O.M.胚胎心率如图2所示. 受精后第5天、8天和11天这3个时间点是O.M.胚胎心脏发育的关键时期[18],由于本实验在11 d时胚胎已基本孵化,故只测5、8 dpf心率. 5 dpf时,与对照组相比,除1 μg·L−1处理组心率不存在显著性差异(P>0.05)外,其余处理组均存在显著性差异(P<0.05). 8 dpf时,10、100、
1000 μg·L−1处理组相较于对照组心率出现了下降现象,但各组之间不存在显著性差异(P>0.05).IBP对O.M.心率的影响表现为短期暴露增加心率,而长期暴露抑制心率. 有研究表明,暴露于全氟辛烷磺酸下的O.M.在6 dpf时其心率增加,但在暴露10 dpf后胚胎心率都表现出显著降低[18]. 类似地,磷酸三苯酯对O.M.心率的影响也表现出低剂量、短期暴露增加心率,高剂量、长期暴露抑制心率[17]. 张利军等[19]在研究中发现IBP具有心血管毒性,会影响斑马鱼胚胎和仔鱼心脏结构和功能发育,在浓度为6.06 μmol·L−1 IBP溶液中斑马鱼心率出现下降现象,这与本文中实验结果有相似之处.
海洋生物早期发育阶段对环境的依赖和敏感度远高于其他阶段,特别是心脏的发育. 作为最早发挥功能的器官之一,心脏更容易受到环境条件的影响,因此对污染物的敏感程度也更高[20]. IBP属于NSAIDs类,通常用于缓解疼痛,通过抑制环氧酶(COX)活性发挥作用[21]. 环氧酶共有两种同工酶COX-1和COX-2,其中COX-2通常与鱼类心脏发育异常相关[18],这可能与本实验中处理组O.M.的心率异常有关.
-
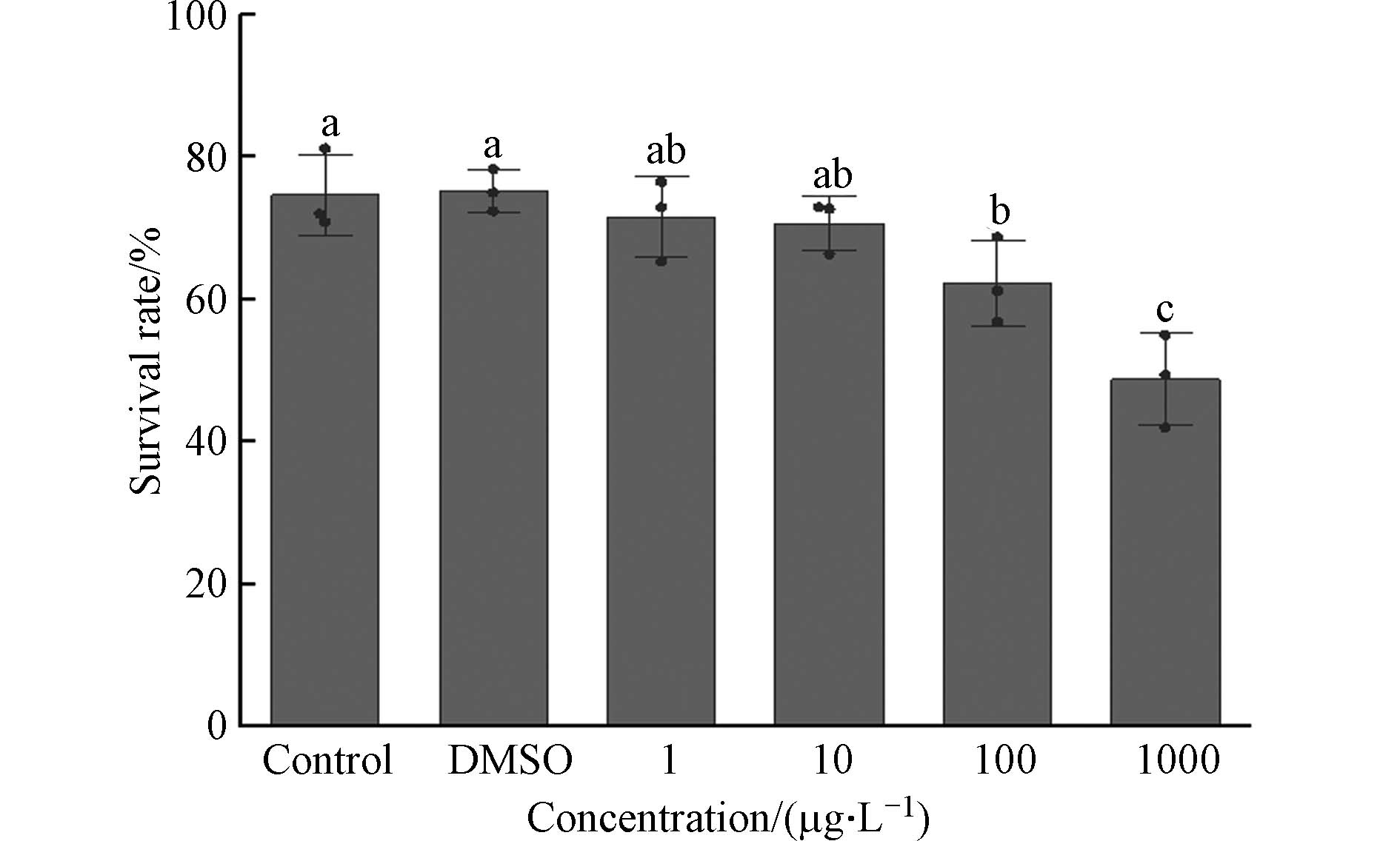
不同IBP浓度暴露下的O.M.仔鱼30 dph存活率如图3所示. 与对照组相比1 μg·L−1处理组的仔鱼存活率不存在显著性差异(P>0.05),存活率分别为(74.68%±5.68%)和(71.6%±5.72%). 但当浓度达到100 μg·L−1和
1000 μg·L−1时,存活率分别下降为(62.28%±6.03%)和(48.78%±6.54%),均与对照组存在显著性差异(P<0.05),其中100 μg·L−1和1000 μg·L−1处理组之间也存在显著性差异(P<0.05). 实验结果表明仔鱼存活率与浓度之间存在剂量效应关系,仔鱼存活率随IBP浓度升高而降低.已有研究表明,IBP对日本青鳉的影响随着暴露时间而增大,在30 dph时
1000 μg·L−1浓度的IBP溶液中,仔鱼的存活率发生了显著降低[22],这与本文研究结果相同. 通过图1和图3的比较可以发现,与胚胎孵化率相比,仔鱼存活率下降更明显. 可能是因为仔鱼在IBP溶液中暴露的时间更长,导致影响更加明显. 夏凉等[9]研究发现IBP的作用相对缓慢但效果也更加持久,也可能是由于胚胎期卵膜阻止了外来大分子的穿透进入,起到了保护的作用[23]. -
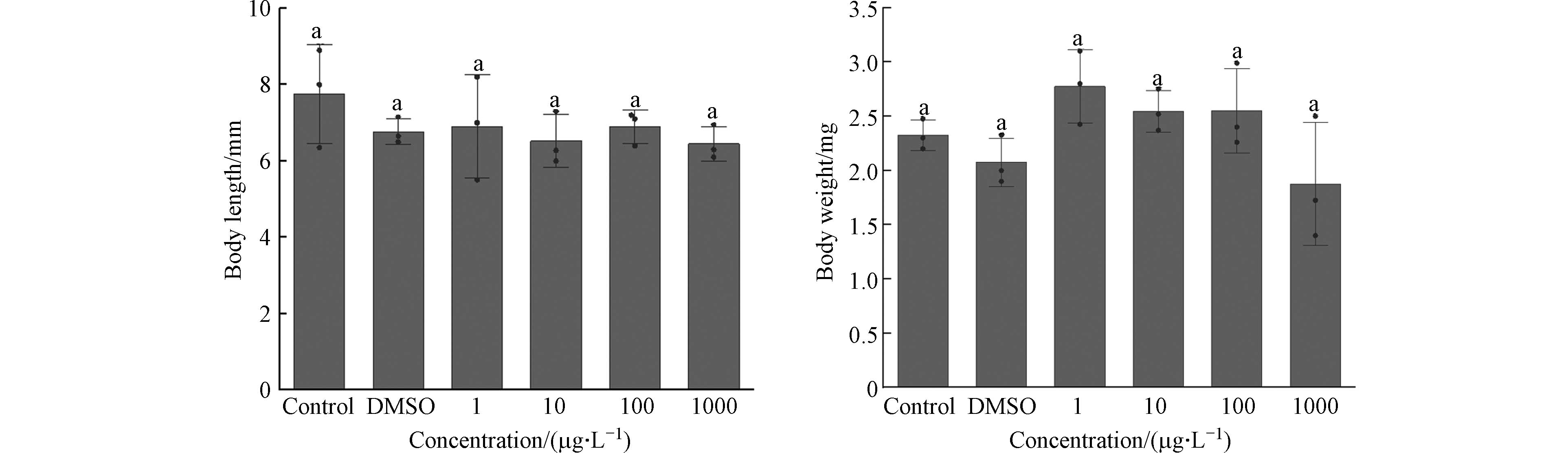
体长和体重是表征仔鱼发育程度的重要指标. 体长、体重变化趋势的出现提示外界因素可能干扰了其发育过程. 不同IBP浓度暴露下,仔鱼30 dph体长体重如图4所示,与对照组相比各处理组仔鱼的体长和体重均不存在显著性差异(P>0.05). 有研究结果表明在不同NSAIDs暴露液中斑马鱼仔鱼在96 hpf(hours post-fertilization,受精后小时)时期的体长均没有显著变化(P>0.05)[24],这与本文研究结果相似.
-
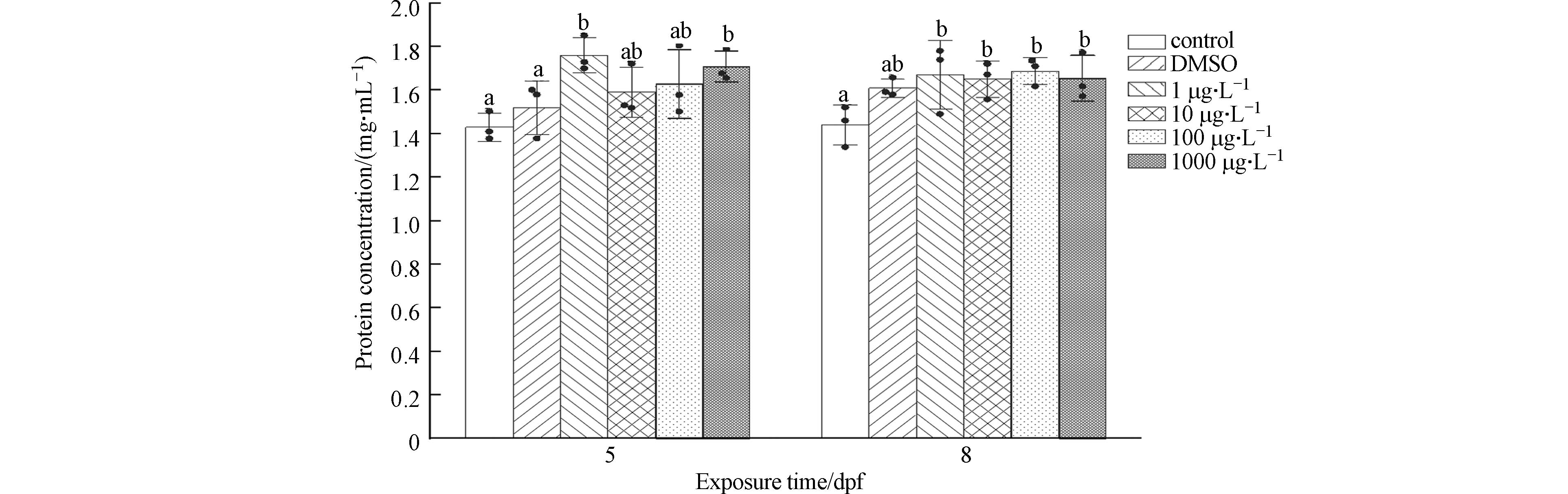
为防止由于匀浆浓度差异对实验结果造成影响,首先测定了实验样本的蛋白质浓度,后续通过均一化方法衡量IBP暴露对O.M.胚胎内生物标志物的影响. 蛋白质定量标准曲线拟合方程为y=1.82x+0.859(x:蛋白终浓度,y:吸光值),R2=
0.9997 ,胚胎总蛋白质浓度如图5所示. -
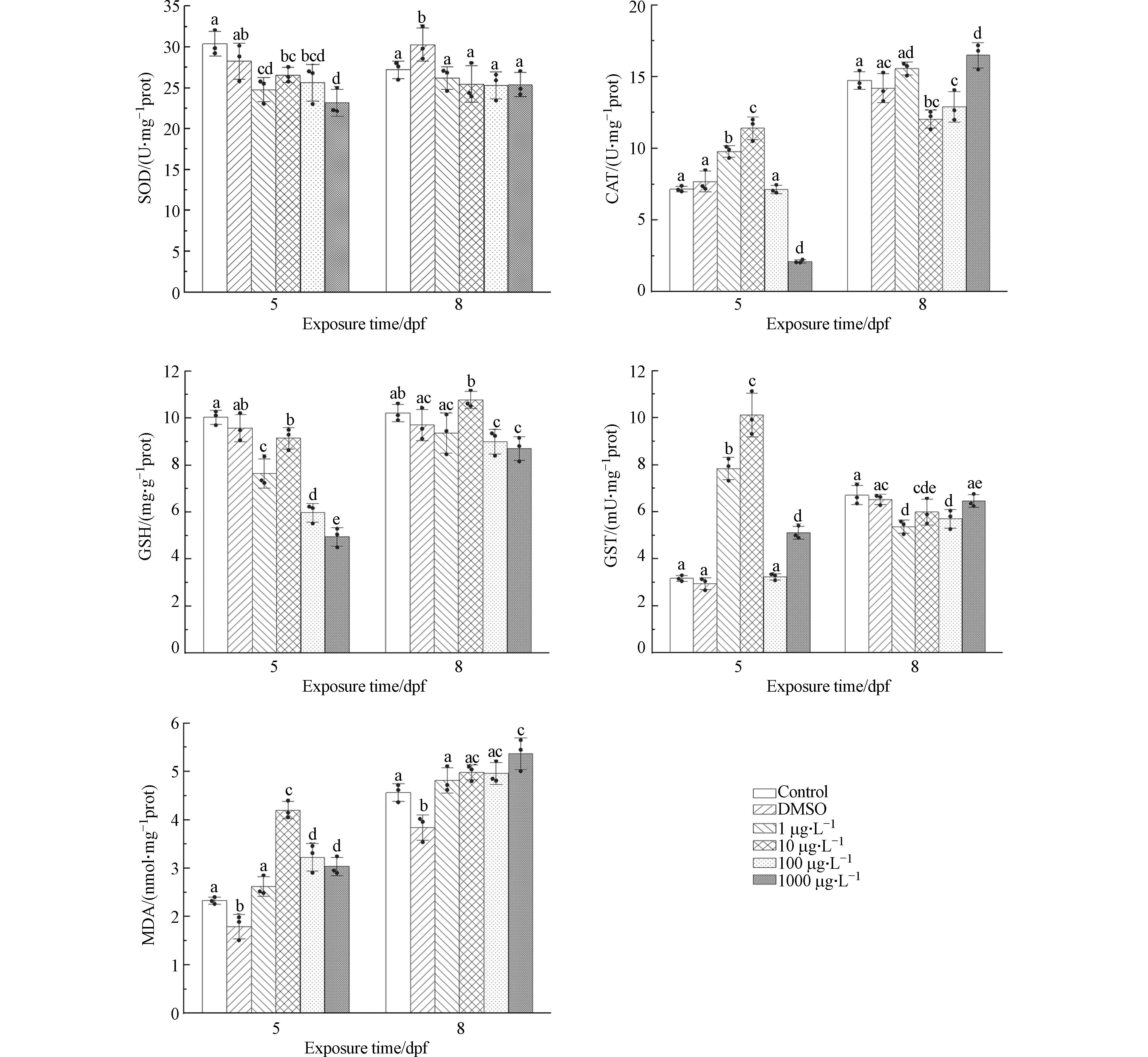
选择超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、还原型谷胱甘肽(GSH)、谷胱甘肽巯基转移酶(GST)以及丙二醛(MDA)作为不同IBP浓度暴露下5 dpf和8 dpf时胚胎的抗氧化标记物,其检测结果如图6所示.
在5 dpf时,不同处理组的SOD活性随IBP浓度升高呈下降的趋势,与对照组相比均存在显著性差异(P<0.05). 8 dpf时,各处理组的SOD活性与对照组相比不存在显著性差异(P>0.05). CAT活性在5 dpf时,随IBP浓度升高呈先上升后下降的趋势,1、10、
1000 μg·L−1处理组与对照组存在显著性差异(P<0.05). 8 dpf时,1 μg·L−1处理组与对照组的CAT活性相比不存在显著性差异(P>0.05),其余处理组与对照组相比存在显著性差异(P<0.05),但相较于5 dpf其差异幅度减小.SOD和CAT在生物体抗氧化系统防御氧化应激过程中发挥着重要作用,前者负责将细胞内氧自由基(O2-)转化为过氧化氢(H2O2)和分子氧(O2),后者随后将H2O2转化为水(H2O)和O2[25]. SOD活性在5 dpf时出现降低,可能是由于生物体内积累了大量的活性氧(ROS)而超出了机体自身的清除能力,导致SOD活性下降. 在8 dpf时,SOD活性没有显著性差异,这可能是由于机体存在自我修复的机制,对IBP带来的氧化损伤已经适应. CAT活性在5 dpf总体呈现先被激活后被抑制的趋势. CAT活性上升说明O.M.胚胎对H2O2的清除能力有所提升. 当胚胎内ROS含量增加时,会引起H2O2的累积,此时机体通过提升CAT的活性来提升自身清除H2O2的能力,最终保持机体内H2O2含量的平衡,以适应环境的变化[26],但当ROS含量积累过多时,其对CAT活性产生了抑制作用. 到8 dpf时,各处理组相较于对照组存在显著性差异,但总体而言差异相较于5 dpf时减小,可能是由于机体正在逐渐适应环境变化,CAT活性也趋于稳定. 刘昱等[27]研究了双氟磺草胺对斑马鱼CAT活性的影响,研究结果表明随浓度上升CAT活性呈先上升后下降趋势,到28 d时恢复到正常水平,与本实验研究结果相似.
5 dpf时,GSH含量整体呈下降趋势,各处理组与对照组相比均存在显著性差异(P<0.05). GST活性在5 dpf时整体呈先上升后下降的趋势. 1、10、
1000 μg·L−1处理组与对照组相比存在显著性差异(P<0.05). 8 dpf时,各处理组之间的GSH含量和GST活性总体而言不存在显著性差异(P>0.05).GSH是机体内非常重要的抗氧化剂和自由基清除剂,在增强鱼类抗氧化应激能力以及解毒能力方面发挥着重要的作用[28]. GSH既可以作为一种独立的抗氧化剂,也可以在GST催化下,与毒物结合生成可溶性无害物质,参与机体的解毒作用[29]. GST存在于生物机体的各种组织中,具有消除体内自由基和解毒的双重功能,其活性可以较好的反映自由基对生物体的影响及生物体抗氧化能力[30]. 在5 dpf时,GST活性上升可能是为了能够还原机体内过量的ROS并且清除多余的过氧化物,同时使得GSH与毒物结合的效率更高,导致各处理组与对照组相比GSH含量降低. 8 dpf时,O.M.逐渐适应环境,各浓度组的GSH含量和GST活性正在趋于稳定,但仍可能存在个体差异导致的显著性差异.
脂质过氧化物含量是反映氧化损伤发生程度的重要指标[31]. 当机体内过量的ROS不能被及时清除,ROS会与脂质发生反应,产生脂质过氧化损伤,而MDA则是脂质过氧化的重要产物. 因此,MDA的含量可以反映机体发生脂质过氧化损伤的程度[32]. 在5 dpf时,各处理组与对照组相比,其MDA含量均显著升高(P<0.05). 这可能是因为抗氧化酶和抗氧化剂不能及时清除过多的ROS,导致机体产生脂质过氧化现象,最终导致MDA含量增加. 增加趋势未呈剂量效应,这可能是由于个体间差异所致. 8 dpf时,由于机体存在自我修复自由基造成氧化损伤的机制,对带来的氧化损伤已经适应,MDA含量基本恢复到正常水平. 先前的研究也表明IBP导致黄颡鱼体内的MDA含量在72 h时显著升高,到168 h时各处理组与对照组之间的MDA含量没有明显差异[33],与本实验结果相似.
-
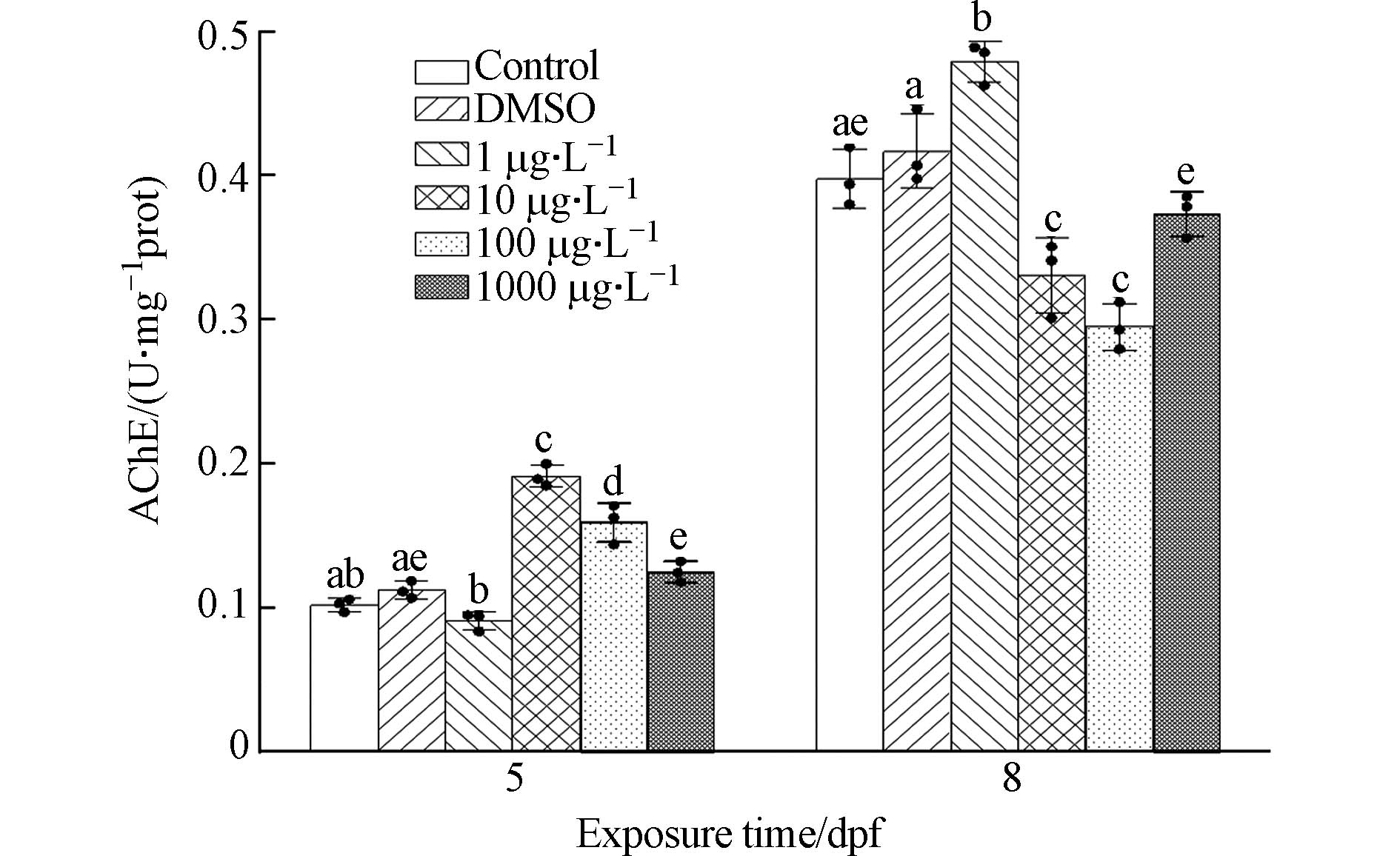
不同IBP浓度在不同时间暴露下对O.M.胚胎的AChE活性影响如图7所示. 在5 dpf时,AChE活性随IBP浓度的升高呈先上升后下降的趋势,10、100、
1000 μg·L−1处理组与对照组相比AChE活性存在显著性差异(P<0.05). 8 dpf时,各处理组与对照组相比AChE活性仍存在显著性差异(P<0.05),1 μg·L−1处理组相较于对照组活性增加,而其余处理组活性相较于对照组受到抑制.AChE是生物神经传导的关键酶,目前已成为反映水生生物受到污染物胁迫危害程度的经典毒理学指标[34]. AChE广泛存在各种动物组织中,在神经突触间隙中,通过催化水解神经递质乙酰胆碱来终止其对胆碱受体的兴奋作用,维持神经冲动的正常传递[35]。AChE活性升高会抑制兴奋的传递,活性降低则表现为过度兴奋,其活性升高或者降低都会对正常的生理功能产生影响[36]. 本文研究结果表明,IBP对O.M.的AChE活性影响不仅与浓度有关,还与作用时长有关. 随着IBP浓度的升高AChE活性总体上呈现先增加后抑制趋势. 短时间暴露对AChE活性起增加作用,长时间暴露则会抑制AChE活性. 有研究表明不同时长的抗癫痫药物卡马西平暴露在斑马鱼体内的毒性作用可能存在差异[37]. Yang等[38]研究发现不同浓度IBP均增加了鲫鱼体内的AChE活性,但在同一浓度下不同时间段的活性无显著差异,这可能和IBP在鲫鱼和O.M.体内的代谢效率不同有关.
-
(1) 模拟环境浓度下的IBP对O.M.不存在发育毒性,但当浓度逐渐升高时IBP对O.M.胚胎及仔鱼存在发育毒性,主要表现为胚胎孵化率降低、孵化时间提前、心率紊乱,仔鱼30 d存活率降低等.
(2) IBP暴露下,在5 dpf时,O.M.胚胎中SOD活性和GSH含量呈现下降趋势,CAT活性、GST活性以及MDA含量则呈现先上升后下降趋势. 在8 dpf时,SOD、CAT、GSH、GST、MDA与对照组相比差异减小,可能是由于时间推移,机体对IBP带来的氧化损伤逐渐适应.
(3) O.M.胚胎的AChE活性不仅受IBP浓度的影响,也与暴露时间有关. 随着IBP浓度的升高,AChE活性呈现先增加后抑制的趋势. 从作用时间来看,短时间暴露提升AChE活性,而较长时间暴露则起抑制作用.
布洛芬对海洋青鳉鱼生命初期毒性效应
Toxic effects of ibuprofen on early life stages of marine medaka (Oryzias Melastigma)
-
摘要: 为探究布洛芬(Ibuprofen,IBP)对海洋青鳉鱼(Oryzias melastigma)早期生命阶段的毒性效应,将海洋青鳉鱼胚胎在不同浓度(0、1、10、100、
1000 μg·L−1)IBP溶液中暴露至孵化后的第30 天(未孵化胚胎暴露20 d). 观察统计胚胎的孵化率、孵化时间、心率、仔鱼30 d存活率以及体长体重等发育参数,并检测胚胎的抗氧化酶(超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽巯基转移酶(Glutathione S-transferase,GST))活性、抗氧化剂(还原型谷胱甘肽(glutathione,GSH))、氧化产物(丙二醛(malonic dialdehyde,MDA))浓度和神经递质降解酶(乙酰胆碱酯酶(acetylcholinesterase,AChE))活性变化,以评估IBP对海洋青鳉鱼早期生命阶段的发育毒性、抗氧化系统以及神经递质系统的影响. 结果表明,1 μg·L−1IBP对海洋青鳉鱼胚胎及仔鱼不存在发育毒性,其余各浓度导致胚胎孵化率、孵化时间、心率和仔鱼存活率降低,所有浓度下仔鱼体长体重均未变化;在第5天时,随浓度升高,SOD活性和GSH含量呈下降趋势,CAT、GST活性和MDA含量先上升后下降,第8天时各指标趋于正常;IBP浓度的升高导致AChE活性先增加后降低. 综上,环境相关浓度下的IBP对海洋青鳉鱼胚胎及仔鱼不存在发育毒性,各浓度IBP均会导致胚胎产生氧化应激和神经毒性效应.Abstract: To investigate the toxic effects of ibuprofen (IBP) on the early life stages of marine medaka (Oryzias melastigma), marine medaka embryos were exposed to different concentrations (0, 1, 10, 100, and1000 μg·L−1) of IBP solution until 30 days after hatching (20 days for unhatched embryos). Various developmental parameters, including hatching rate, hatching time, heart rate, 30-day survival rate of larvae, body length and weight, were observed and recorded. Additionally, measurements were conducted to assess the activity of antioxidant enzymes (superoxide dismutase, SOD; catalase, CAT; glutathione S-transferase, GST), levels of antioxidant (glutathione, GSH), concentrations of oxidative product (malonic dialdehyde, MDA), and the activity of neurotransmitter degrading enzyme (acetylcholinesterase, AChE) in the embryos. These measurements aimed to evaluate the developmental toxicity, antioxidant system, and neurotransmitter system effects of Ibuprofen on the early life stages of marine medaka. The results indicated that IBP at a concentration of 1 μg·L−1 did not induce developmental toxicity in marine medaka embryos and larvae. However, exposure to higher concentrations resulted in decreased hatching rate, hatching time, heart rate, and larval survival rate, while no significant changes in body length and weight were observed across all concentrations. On the 5th day, increasing IBP concentration led to a decreasing trend in SOD activity and GSH content, while CAT and GST activities, as well as MDA levels, initially increased and then decreased, with all indicators returning to normal levels by the 8th day. Moreover, the increase in IBP concentration led to an initial increase and subsequent decrease in AChE activity. In conclusion, environmentally relevant concentrations of IBP did not exhibit developmental toxicity in marine medaka embryos and larvae. However, all tested concentrations of IBP resulted in oxidative stress and neurotoxic effects in the embryos. -

-
-
[1] 严清, 高旭, 彭绪亚. 污水处理系统中非甾体抗炎镇痛药(NSAIDs)去除的研究[J]. 水处理技术, 2012, 38(11): 13-19. doi: 10.16796/j.cnki.1000-3770.2012.11.003 YAN Q, GAO X, PENG X Y. Research and progress in removal of nonsteroidal anti-inflammatory drugs (nsaids) in wastewater treatment plants[J]. Technology of Water Treatment, 2012, 38(11): 13-19 (in Chinese). doi: 10.16796/j.cnki.1000-3770.2012.11.003
[2] 张娇. 布洛芬的临床研究进展[J]. 中国药业, 2010, 19(5): 63-64. doi: 10.3969/j.issn.1006-4931.2010.05.046 ZHANG J. Clinical research progress of ibuprofen[J]. China Pharmaceuticals, 2010, 19(5): 63-64 (in Chinese). doi: 10.3969/j.issn.1006-4931.2010.05.046
[3] 郭雅丽. 海洋细菌共代谢降解布洛芬研究[D]. 大连: 大连理工大学, 2020: 1-3. GUO Y L. Study on ibuprofen degradation by marine bacteria under co-metabolic conditions[D]. Dalian: Dalian University of Technology, 2020: 1-3(in Chinese).
[4] GUTIÉRREZ-NOYA V M, GÓMEZ-OLIVÁN L M, RAMÍREZ-MONTERO M D C, et al. Ibuprofen at environmentally relevant concentrations alters embryonic development, induces teratogenesis and oxidative stress in Cyprinus carpio[J]. The Science of the Total Environment, 2020, 710: 136327. doi: 10.1016/j.scitotenv.2019.136327 [5] AUS der BEEK T, WEBER F A, BERGMANN A, et al. Pharmaceuticals in the environment—Global occurrences and perspectives[J]. Environmental Toxicology and Chemistry, 2016, 35(4): 823-835. doi: 10.1002/etc.3339 [6] TOGOLA A, BUDZINSKI H. Multi-residue analysis of pharmaceutical compounds in aqueous samples[J]. Journal of Chromatography A, 2008, 1177(1): 150-158. doi: 10.1016/j.chroma.2007.10.105 [7] PEREIRA C D S, MARANHO L A, CORTEZ F S, et al. Occurrence of pharmaceuticals and cocaine in a Brazilian coastal zone[J]. Science of the Total Environment, 2016, 548/549: 148-154. doi: 10.1016/j.scitotenv.2016.01.051 [8] 谢丹, 王明丽, 王秀海, 等. 布洛芬对稀有鮈鲫早期生命阶段的急慢性毒性效应[J]. 中国海洋大学学报(自然科学版), 2022, 52(10): 76-85. doi: 10.16441/j.cnki.hdxb.20210269 XIE D, WANG M L, WANG X H, et al. Acute and chronic toxic effects of ibuprofen on the early life stages of Gobiocypris rarus[J]. Periodical of Ocean University of China, 2022, 52(10): 76-85 (in Chinese). doi: 10.16441/j.cnki.hdxb.20210269
[9] XIA L, ZHENG L, ZHOU J L. Effects of ibuprofen, diclofenac and paracetamol on hatch and motor behavior in developing zebrafish (Danio rerio)[J]. Chemosphere, 2017, 182: 416-425. doi: 10.1016/j.chemosphere.2017.05.054 [10] ERICSON H, THORSÉN G, KUMBLAD L. Physiological effects of diclofenac, ibuprofen and propranolol on Baltic Sea blue mussels[J]. Aquatic Toxicology, 2010, 99(2): 223-231. doi: 10.1016/j.aquatox.2010.04.017 [11] 武小燕, 彭颖, 廖伟, 等. 布洛芬对黄颡鱼Ⅰ相代谢酶及其抗氧化系统的影响[J]. 环境科学学报, 2013, 33(4): 1208-1214. WU X Y, PENG Y, LIAO W, et al. Effects of Ibuprofen on the phase Ⅰ metabolic enzymes and antioxidant defence system of the Yellow Catfish(Pelteobagrus fulvidraco)[J]. Acta Scientiae Circumstantiae, 2013, 33(4): 1208-1214 (in Chinese).
[12] INOUE K, TAKEI Y. Diverse adaptability in Oryzias species to high environmental salinity[J]. Zoological Science, 2002, 19(7): 727-734. doi: 10.2108/zsj.19.727 [13] 伍辛泷, 黄乾生, 方超, 等. 新兴海洋生态毒理学模式生物: 海洋青鳉鱼(Oryzias melastigma)[J]. 生态毒理学报, 2012, 7(4): 345-353. WU X L, HUANG Q S, FANG C, et al. Oryzias melastigma: A new promising model organism for marine ecotoxicology[J]. Asian Journal of Ecotoxicology, 2012, 7(4): 345-353 (in Chinese).
[14] 倪晓敏. 六价铬长期暴露对海洋青鳉鱼的毒性研究[D]. 厦门: 厦门大学, 2018: 86-90. NI X M. The toxicity of long-term hexavalent chromium exposure on marine medaka(Oryzias melastigma)[D]. Xiamen: Xiamen University, 2018: 86-90 (in Chinese).
[15] REGOLI F, GIULIANI M E. Oxidative pathways of chemical toxicity and oxidative stress biomarkers in marine organisms[J]. Marine Environmental Research, 2014, 93: 106-117. doi: 10.1016/j.marenvres.2013.07.006 [16] DAVID A, PANCHARATNA K. Developmental anomalies induced by a non-selective COX inhibitor (ibuprofen) in zebrafish (Danio rerio)[J]. Environmental Toxicology and Pharmacology, 2009, 27(3): 390-395. doi: 10.1016/j.etap.2009.01.002 [17] 钟代银. 典型有机磷阻燃剂磷酸三苯酯(TPhP)对海洋青鳉鱼的世代毒性研究[D]. 厦门: 厦门大学, 2019: 37-38. ZHONG D Y. Two-generation toxicological study of triphenyl phosphate(TPhP) in marine medaka(Oryzias melastigma)[D]. Xiamen: Xiamen University, 2019: 37-38(in Chinese).
[18] HUANG Q S, FANG C, WU X L, et al. Perfluorooctane sulfonate impairs the cardiac development of a marine medaka (Oryzias melastigma)[J]. Aquatic Toxicology, 2011, 105(1/2): 71-77. [19] 郭家彬, 苑晓燕, 史慧勤, 等. 应用斑马鱼胚胎和幼鱼评价布洛芬的心脏毒性[C]//2013年(第三届)中国药物毒理学年会暨药物非临床安全性评价研究论坛论文摘要. 苏州, 2013: 183. [20] HICKEN C E, LINBO T L, BALDWIN D H, et al. Sublethal exposure to crude oil during embryonic development alters cardiac morphology and reduces aerobic capacity in adult fish[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(17): 7086-7090. [21] CONAGHAN P G. A turbulent decade for NSAIDs: Update on current concepts of classification, epidemiology, comparative efficacy, and toxicity[J]. Rheumatology International, 2012, 32(6): 1491-1502. doi: 10.1007/s00296-011-2263-6 [22] HAN S, CHOI K, KIM J, et al. Endocrine disruption and consequences of chronic exposure to ibuprofen in Japanese medaka (Oryzias latipes) and freshwater cladocerans Daphnia magna and Moina macrocopa[J]. Aquatic Toxicology, 2010, 98(3): 256-264. doi: 10.1016/j.aquatox.2010.02.013 [23] 李健, 杨桂玲, 赵慧宇, 等. 毒死蜱和百菌清对斑马鱼早期发育阶段的联合毒性效应[J]. 浙江农业学报, 2018, 30(5): 756-763. LI J, YANG G L, ZHAO H Y, et al. Combined effects of chlorpyrifos and chlorothalonil on early development stage of zebrafish[J]. Acta Agriculturae Zhejiangensis, 2018, 30(5): 756-763 (in Chinese).
[24] 夏凉. 药物类污染对斑马鱼胚胎形态、行为和基因表达的生态毒理效应研究[D]. 上海: 华东师范大学, 2018: 38-39. XIA L. Ecotoxicity of several pharmaceutical pollutants on embryo morphology, behavior and genetic expression in zebrafish[D]. Shanghai: East China Normal University, 2018: 38-39. (in Chinese)
[25] WANG C X, HARWOOD J D, ZHANG Q M. Oxidative stress and DNA damage in common carp (Cyprinus carpio) exposed to the herbicide mesotrione[J]. Chemosphere, 2018, 193: 1080-1086. doi: 10.1016/j.chemosphere.2017.11.148 [26] LI X X, LI M F, SUN N, et al. Response of earthworm coelomocytes and catalase to pentanone and hexanone: A revelation of the toxicity of conventional solvents at the cellular and molecular level[J]. Environmental Science and Pollution Research, 2022, 29(29): 44282-44296. doi: 10.1007/s11356-022-18864-1 [27] 刘昱. 双氟磺草胺对斑马鱼成鱼及胚胎的毒性效应研究[D]. 泰安: 山东农业大学, 2022: 31-33. LIU Y. Toxic effects of florasulam on zebrafish adults and embryos[D]. Taian: Shandong Agricultural University, 2022: 31-33(in Chinese).
[28] 周艳玲, 孙育平, 黄燕华, 等. 水产动物谷胱甘肽营养生理作用的研究进展[J]. 饲料研究, 2016(19): 38-43,53. ZHOU Y L, SUN Y P, HUANG Y H, et al. Research progress on nutritional and physiological functions of glutathione in aquatic animals[J]. Feed Research, 2016(19): 38-43,53 (in Chinese).
[29] 陈可可, 李瑞, 李彤彤, 等. 还原型谷胱甘肽对青鱼幼鱼生长性能和生理功能的影响[J]. 现代农业科技, 2020(20): 182-185. CHEN K K, LI R, LI T T, et al. Effects of reduced glutathione on growth performance and physiological function of juvenile black carp[J]. Modern Agricultural Science and Technology, 2020(20): 182-185 (in Chinese).
[30] 谢美萍, 颜勇. 水体中3种磺胺类药物对斑马鱼的生态毒性效应[J]. 环境科技, 2015, 28(2): 30-34. XIE M P, YAN Y. Toxic effects on zebrafish exposed to three sulfonamides in aquatic ecosystem[J]. Environmental Science and Technology, 2015, 28(2): 30-34 (in Chinese).
[31] 陆妍, 陈曦, 裘丽萍, 等. 灭多威对斑马鱼胚胎抗氧化防御系统的影响[J]. 农业环境科学学报, 2022, 41(3): 472-480. LU Y, CHEN X, QIU L P, et al. Effects of methomyl on antioxidant defense system of zebrafish embryos[J]. Journal of Agro-Environment Science, 2022, 41(3): 472-480 (in Chinese).
[32] ZHANG Q M, ZHU L S, WANG J, et al. Oxidative stress and lipid peroxidation in the earthworm Eisenia fetida induced by low doses of fomesafen[J]. Environmental Science and Pollution Research, 2013, 20(1): 201-208. doi: 10.1007/s11356-012-0962-5 [33] 武小燕. 布洛芬、三氯生对黄颡鱼P450酶及抗氧化酶系的毒性效应[D]. 广州: 暨南大学, 2013: 20-21. WU X Y. Toxic effects of ibuprofen and triclosan on P450Enzymes and antioxidative system of the yellow catfish(Pelteobagrus fulvidraco)[D]. Guangzhou: Jinan University, 2013: 20-21(in Chinese).
[34] 李世凯, 张健龙, 江敏, 等. 伊维菌素对斑马鱼(Danio rerio)生理生化特性的影响[J]. 安全与环境学报, 2014, 14(1): 300-305. LI S K, ZHANG J L, JIANG M, et al. Effects of ivermectin on the physiological and biochemical characteristic features of Danio rerio[J]. Journal of Safety and Environment, 2014, 14(1): 300-305 (in Chinese).
[35] 叶东平, 陈斌, 何正波. 乙酰胆碱酯酶的分离纯化及生物学研究进展[J]. 安徽农业科学, 2011, 39(7): 3811-3814. doi: 10.3969/j.issn.0517-6611.2011.07.012 YE D P, CHEN B, HE Z B. Research progress of seperation, purification and biology of acetylcholinesterase[J]. Journal of Anhui Agricultural Sciences, 2011, 39(7): 3811-3814 (in Chinese). doi: 10.3969/j.issn.0517-6611.2011.07.012
[36] 郭建波. 重金属(铬、镍、砷)对大黄鱼幼鱼的毒性和毒理学研究[D]. 舟山: 浙江海洋大学, 2017: 46. GUO J B. Toxicity and toxicology studies on heavy metals (Cr6+, Ni2+, As3+) in juvenile pseudosciaena crocea[D]. Zhoushan: Zhejiang Ocean University, 2017: 46. (in Chinese)
[37] 杨慧婷, 谷孝鸿, 陈辉辉, 等. 环境相关浓度的卡马西平对斑马鱼幼鱼抗氧化系统和神经递质系统的影响[J]. 生态毒理学报, 2022, 17(3): 268-276. doi: 10.7524/AJE.1673-5897.20211206002 YANG H T, GU X H, CHEN H H, et al. Effects of environment-related concentrations of carbamazepine on antioxidant system and neurotransmitter system of juvenile zebrafish[J]. Asian Journal of Ecotoxicology, 2022, 17(3): 268-276 (in Chinese). doi: 10.7524/AJE.1673-5897.20211206002
[38] YANG X F, XU X P, WEI X Y, et al. Biomarker effects in Carassius auratus exposure to ofloxacin, sulfamethoxazole and ibuprofen[J]. International Journal of Environmental Research and Public Health, 2019, 16(9): 1628. doi: 10.3390/ijerph16091628 -



 下载:
下载: