-
抗生素作为一种可以有效抑制或者杀灭病原体的药物,在人类医疗和畜禽养殖中被广泛应用,进而通过污水处理厂等多种途径直接或间接进入环境,诱发各类抗生素耐药菌和抗性基因的广泛传播,对人类健康和生态安全造成长期潜在的威胁[1],引起了国际社会的广泛关注和高度重视. 我国是抗生素的生产和使用大国,它已经被列入了我国的重点管控新污染物清单,我国于2023年3月1日开始对其采取禁止、限制和限排等环境风险管控措施.
抗生素依照结构特征划分为四环素类、磺胺类,喹诺酮类、大环内酯类(macrolide antibiotic,MAs)等. 其中,MAs是一类分子结构中具有12—16 个碳内酯环的抗菌剂的统称. 根据Zhang等的调查,MAs在我国所有抗生素中使用量居于首位(达到26%)[2];而已有环境调查结果也显示MAs往往处于较高的污染水平[3 − 5]. 但是与四环素类、磺胺类和喹诺酮类相比较而言,MAs在环境中的存在种类、含量水平和风险评估研究较少[6]. 目前关注的MAs主要包括阿奇霉素、红霉素、罗红霉素、克拉霉素[7],然而,在实际应用于人类医疗和畜禽养殖的MAs还有很多,如竹桃霉素、乙酰螺旋霉素、交沙霉素、麦迪霉素、泰乐菌素、地红霉素、替米考星等,这些MAs共同暴露于环境中可能对生物造成协同或拮抗等联合毒性效应[8]. 朱松梅等以海洋发光菌为受试生物,研究发现红霉素与乙酰螺旋霉素复合污染能够发生协同作用[9]. 因此,有必要建立一种能够同时检测多种MAs的分析方法. 此外,林可霉素(林可酰胺类抗生素 [lincosamide antibiotics, LAs])是我国使用量最大的单个抗生素之一[2]. LAs主要包括林可霉素和氯林可霉素(也叫克林霉素),鉴于LAs与MAs抗菌作用机制类似[10],本研究考虑同时开展两类抗生素的环境研究.
将城市污水处理厂的污水经处理后进行再生回用,这是缓解城市水资源短缺问题的主要手段. 从2020年开始,再生水已经成为了北京市公园湖泊、河道等重要流域的主要补给水源. 但是,由于城市污水处理厂设计中很少考虑抗生素的去除,MAs等抗生素在污水处理厂出水和再生水中仍然频繁检出[11],环境水体接纳污水再生水补给后抗生素污染状况及风险需要开展进一步研究. 鉴于此,本研究以14种MAs和2种LAs为研究对象,应用固相萃取结合超高效液相色谱串联质谱仪(UPLC-MS/MS)建立高灵敏同时分析方法,并应用于接受再生水生态补水的北京北运河和永定河,初步调查MAs和LAs浓度水平、组成及分布特征,以期为今后科学地评估环境风险研究奠定基础.
-
超高效液相色谱串联质谱仪(ACQUITY UPLC/Xevo TQ-XS,Waters,美国);固相萃取仪(Supelco,美国);Milli-Q超纯水仪(Millipore,美国);24位氮吹仪(安普,上海);Vortex Cenie 2涡旋混匀器(Scientific Industries,美国).
Oasis HLB固相萃取柱(500 mg/6 cc,Waters);甲醇、乙腈(HPLC级,Fisher,美国);二氯甲烷(HPLC 级,ROE Science,美国);甲酸(分析级,北京);Na2EDTA(分析级,北京). 实验用标准品和同位素(见表1)均购自百灵威科技有限公司,纯度均大于97.0%.
-
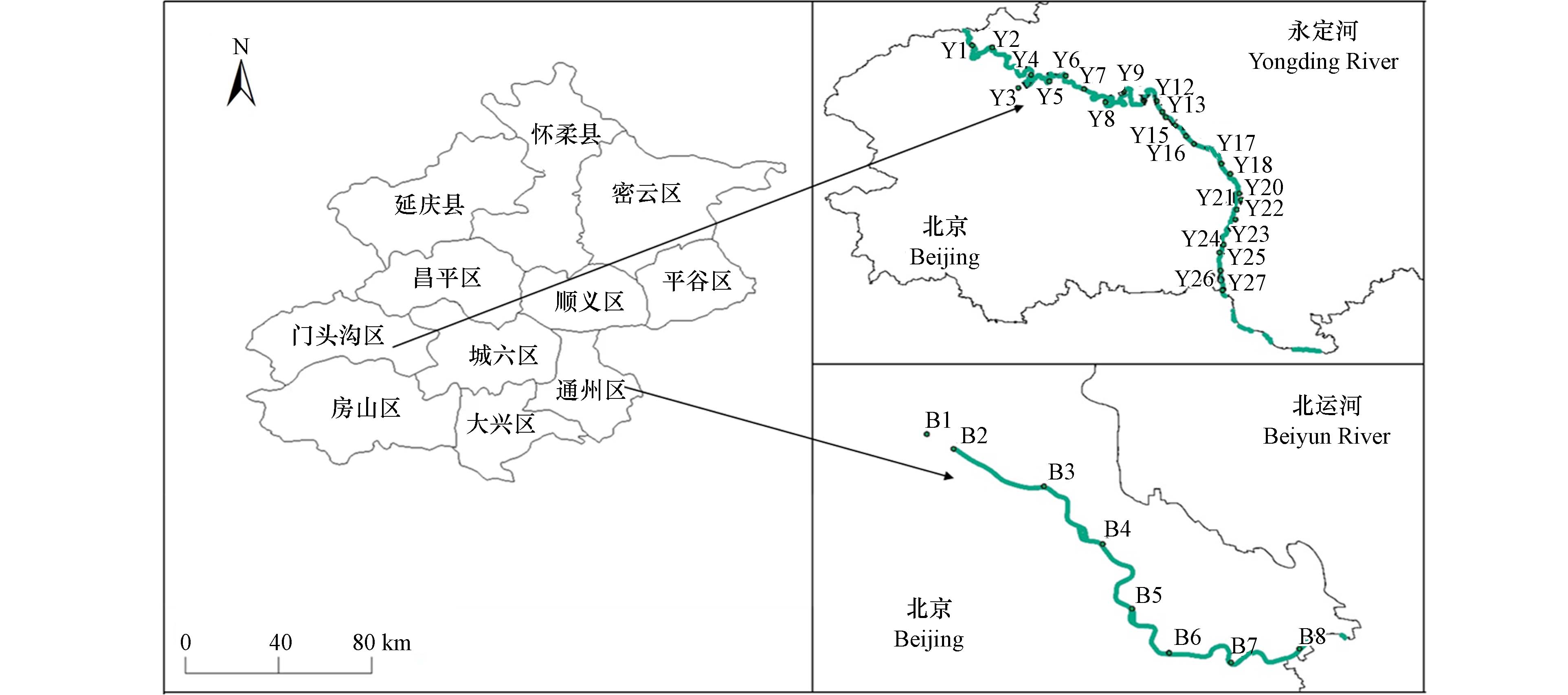
如图1所示,2022年1月,本研究对北京两条主要河流永定河(115.71°—116.26° E,39.58°—40.1° N)和北运河(116.64°—116.90° E,39.93°—39.77° N)进行GPS定位采样. 北京永定河自从2019年以来开展了大规模生态补水,上游主要是官厅水库进行补水,下游有污水处理厂再生水进行部分补水;而北运河上游是流经北京市区的通惠河,通惠河是高碑店污水处理厂出水的受纳水体. 水样的采集在水面以下0.5 m处,保存于预先润洗过的棕色玻璃瓶中,共计35个水样. 样品采集后在2 h 内运回实验室,并立即进行样品前处理.
-
水样经1.2 µm玻璃纤维滤膜(GF/C, Whatman, 英国)过滤后用量筒量取水样1 L,添加同位素过程内标(林可霉素-d3,螺旋霉素-d3,替米考星-d3,氯林可霉素-d3,泰乐菌素-d3,红霉素-d3,罗红霉素- d7),再加入Na2EDTA(0.5 g·L−1)充分溶解后,使用Oasis HLB固相萃取柱进行富集浓缩. Oasis HLB小柱首先依次使用6 mL二氯甲烷、6 mL甲醇以及12 mL超纯水进行活化,再以5—10 mL·min−1的流速上样,经12 mL超纯水淋洗后负压下抽去柱内残留水分,最后用6 mL含1%甲酸的甲醇溶液洗脱. 洗脱液棕色玻璃瓶收集、氮气吹干后100 µL甲醇定容,过滤膜后待测. 水样处理过程中避光,尽量避免光降解的影响.
-
采用超高效液相色谱串联质谱联用仪(UPLC-MS/MS)进行分析处理.
色谱柱为Waters BEH C18柱(100 mm×2.1 mm, 1.7 µm),柱温保持40 ℃. 流动相为0.1%甲酸水(A)和甲醇(B),采用梯度洗脱,具体程序为:B在1.5 min内由10%升至16%,继续在9 min内升至100%,恢复初始状态. 流速设为 0.3 mL·min−1,进样体积为2 μL.
串联质谱采用ESI正离子模式,毛细管电压为0.5 kV,离子源温度为150 ℃,脱溶剂气温度为500 ℃,锥孔气流量50 L·h−1,脱溶剂气流量为150 L·h−1;扫描方式为多反应监测模式(MRM).
-
由于14种MAs和2种LAs都是含氮富电子化合物、易于质子化,ESI-MS/MS在正离子模式下信号响应更高[12]. 本研究中,16种目标化合物均以质子化分子离子([M+H]+)作为母离子. MAs是通过糖苷键由一个14—16碳内酯环与1—3个中性糖或碱性糖(氨基糖)连接而成,在受到能量碰撞后,糖苷键易于发生断裂[13 − 14]. 由于氨基糖结构上的氮原子易于质子化,MAs质谱电离裂解往往是氨基糖碎片离子信号强度最高. 如表1所示,红霉素、脱水红霉A、罗红霉素、阿奇霉素、竹桃霉素等结构中含有氨基糖单糖,与内酯环结构发生裂解生成质荷比(m/z)为158的特征离子([C8H16NO2]+),N-去甲基红霉素A则生成m/z为144的特征离子([C7H12NO2]+);而泰乐菌素、螺旋霉素、新螺旋霉I、替米考星、吉他霉素、麦迪霉素、交沙霉素结构中氨基糖末端与单糖相连,发生裂解时氨基糖末端单糖进一步断裂生成m/z为174的特征离子([C8H16NO3]+)[13]. MAs除了糖苷键易于断裂[15],众多的羟基结构也易于发生H2O分子的中性丢失,如表1中罗红霉素另外一个特征离子(m/z 679)就是在氨基糖糖苷键断裂之后继续丢失2个H2O分子而形成的. 另外,高碰撞能量条件下,氨基糖碎片离子结构中的H2O分子和二甲基胺(—N(CH3)2)会继续发生丢失和断裂,如吉他霉素、麦迪霉素和交沙霉素分子中氨基糖m/z 174特征离子继续断裂生成m/z 109特征离子;同时氨基糖碎片离子也会发生开环反应,如生成m/z 116碎片离子[16],该碎片离子还可以脱甲基生成m/z 101、脱H2O生成m/z 98,以及同时脱甲基和H2O生成m/z 83. 由此可见,MAs结构中的氨基糖等糖相关结构较碳内酯环易于发生断裂和开环反应[16]. 关于林可霉素和氯林可霉素两个LAs,硫甲基断裂生成的[M+H-CH4S]+以及吡咯烷与酰胺联结C—C断裂生成的[C8H16N]+(m/z 126)是两个主要的特征离子.
在确定每个目标物质的分子离子和特征碎片离子之后,对各种ESI-MS/MS参数进行了优化,以提高检测灵敏度,具体优化结果见表1. 另外,流动相溶剂种类及其比例对离子化效果和分析灵敏度也有重要影响. 因两类抗生素均是碱性化合物,加入甲酸调节pH能够促进离子化[17]. 使用乙腈/0.1%甲酸水和甲醇/0.1%甲酸水,分别在反相C18柱上对16种目标抗生素进行梯度分离,因为乙腈相对于甲醇在C18柱上的洗脱能力更强,所以目标化合物在乙腈比例还比较低时就被洗脱下来,从而导致分析灵敏度明显低于以甲醇为流动相溶剂时的灵敏度[17]. 同时,在甲醇/0.1%甲酸水条件下更有利于获得尖锐对称的峰形[18],特别是对林可霉素、螺旋霉素、阿奇霉素等色谱保留较弱的化合物. 因此,本文采用甲醇/0.1%甲酸水作为流动相,在流速0.3 mL·min−1条件下考察并最终确定梯度淋洗程序,图2(a)为16种目标抗生素的色谱分离图.
-
MAs结构上键合了羟基和氨基等官能团,水样的pH值可能对萃取效果产生影响[19]. 已有研究结果表明,当水样的pH值小于4时,MAs回收率偏低,特别是红霉素易于转化为脱水红霉素[20],但当pH值在4—8之间时大多数抗生素回收率较高且差别不大[21]. 另外,MAs会与环境样品基质中的杂质二、三价的金属离子(如Ca2+、Mg2+、Al3+)发生螯合反应,降低萃取效果. 为提高目标化合物的萃取效率,水样在萃取前需要加入金属螯合剂(如Na2EDTA)释放出与金属离子结合的MAs. 因此,本研究未调节水样的pH值(纯水,pH值约为7),选用使用比较广泛的Oasis HLB固相萃取小柱进行萃取,考察不同Na2EDTA添加量(0、0.5、5 g·L−1)对萃取的影响. 如图3所示,水样未添加Na2EDTA目标抗生素的萃取效率基本在20%—60%之间,加入Na2EDTA能够显著提高萃取效率. 当添加5 g·L−1 Na2EDTA时,林可霉素、阿奇霉素、麦迪霉素和脱水红霉素的萃取效率偏低(<40%),而添加0.5 g·L−1 水平萃取效率基本高于50%,因此,本研究选择Na2EDTA添加0.5 g·L−1 水平. 除此之外,本研究还考察了固相萃取柱洗脱液组成对萃取效率的影响. 因为MAs和LAs为极性较强的化合物,甲醇常作为洗脱溶剂被用于洗脱该类污染物[22]. 如图3所示,与乙腈相比,甲醇更适合作为洗脱溶剂,尤其是对于替米考星、阿奇霉素、林可霉素和氯林可霉素. 进一步使用甲酸酸化的甲醇进行洗脱,大多数目标化合物的回收率都有明显提高,说明甲酸酸化的甲醇用于Oasis HLB柱上目标抗生素污染物的洗脱效果更好.
-
采用全过程同位素内标校正法定量分析(同位素内标包括:红霉素-d3、罗红霉素-d7、替米考星-d3、氯林可霉素-d3、泰乐菌素-d3、螺旋霉素-d3、林可霉素-d3),减少环境基质干扰和分析过程引起的损失、提高检测准确性. 定量标准曲线包括0.1、0.5、1.0、5.0、10.0、50.0、100.0 μg·L−1 等7个浓度水平,在这一范围内,所有目标化合物均具有良好的线性关系,相关系数均大于0.99. 实际采样过程中设置空白样品与平行样品(10%样品点位,4个),并在永定河上游和下游各选取1个点位水样进行加标回收率实验(n=3),经过内标校正后,所有的目标抗生素的平均回收率为77%—114%,相对标准偏差小于15%. 在空白样品中没有检出任何的目标抗生素,平行样本的相对标准偏差全部在10%以内. 依照出峰信噪比(S/N)为3时所对应的浓度水平进行计算,在北京的地表水样品(浓缩倍数为
5000 倍)中除新螺旋霉I检出限(LOD)为0.5 ng·L−1和琥乙红霉素为0.1 ng·L−1,其他目标抗生素的LOD均在0.004—0.06 ng·L−1之间. 质控数据详见表2. -
将建立的分析方法应用于采集自北京永定河和北运河的35个地表水样品,如图4所示,在16种目标抗生素中检出8种大环内酯类和2种林可酰胺类,分别是阿奇霉素、螺旋霉素、红霉素、泰乐菌素、N-去甲基红霉素A、脱水红霉素A、麦迪霉素、罗红霉素、林可霉素和氯林可霉素,浓度在0.01—71 ng·L−1之间. 图2(b)显示的是其中一个水样萃取液中检出目标抗生素的MRM-UPLC-MS/MS色谱图. 在北京北运河的8个水样中,10种检出物质有8种(螺旋霉素、泰乐菌素、红霉素、麦迪霉素、罗红霉素、阿奇霉素、林可霉素和氯林可霉素)检出率是100%;以往的研究中MAs主要关注脱水红霉素A、罗红霉素、阿奇霉素和泰乐菌素[21 − 22],本研究发现螺旋霉素和麦迪霉素也可能同样在环境中普遍存在,且含量水平并不低:北运河脱水红霉素A、罗红霉素、阿奇霉素和泰乐菌素的平均浓度分别为35、13、4.3、0.17 ng·L−1,而螺旋霉素和麦迪霉素的平均浓度也达到4.4 ng·L−1和5.0 ng·L−1. 关于红霉素,一般认为它在环境中主要以脱水产物形式检出[23],本研究发现红霉素在北运河中检出率达到100%(平均浓度2.4 ng·L−1),相比之下脱水红霉素A检出水平较高但检出率仅为38%;另外,本研究率先发现红霉素另外一种普遍存在的N-去甲基降解产物(N-去甲基红霉素A,检出率87%),平均浓度为1.2 ng·L−1. 与北运河相比,永定河27个水样中目标抗生素组成分布明显不同,永定河水样中脱水红霉素A是最主要的物质,平均浓度和检出率分别为12 ng·L−1和85%,但是红霉素没有检出;罗红霉素(0.30 ng·L−1)和阿奇霉素(0.79 ng·L−1)的浓度水平明显低于螺旋霉素(4.4 ng·L−1)和麦迪霉素(1.9 ng·L−1). 从目标抗生素含量水平上看,永定河水样中MAs和LAs总体来讲略低,特别是上游采样点. 2019年以来,北京永定河开展了大规模生态补水[23],上游的补水来源主要是官厅水库,这可能是永定河上游水样目标抗生素含量低的主要原因;下游的补水来源包括污水处理厂再生水,这可能是永定河下游水样目标抗生素含量增高的原因之一. 北京北运河的上游是流经北京市区的通惠河,而通惠河是高碑店污水厂排出水的受纳水体,考虑到污水经处理后(包括再生水)仍然存在抗生素残留[24 − 25],这可能是北运河水样目标抗生素含量水平整体高于永定河的主要原因之一.
-
(1)基于固相萃取技术结合超高效液相色谱串联质谱建立了同时检测地表水体中16种MAs和LAs的高灵敏分析方法,能有效识别和定量分析地表水体中的痕量污染.
(2)10种以上MAs和LAs在北京北运河和永定河地表水中仍然普遍存在,含量水平在0.01—50 ng·L−1之间,其可能造成的环境风险仍然需要关注.
(3)北京北运河MAs和LAs污染水平高于永定河,检出物质浓度组成分布明显不同,需要进一步关注污水再生水中的抗生素残留水平.
超高效液相色谱串联质谱法同时测定水中16种大环内酯和林可酰胺类抗生素
Simultaneous determination of 16 macrolides and linconamides antibiotics in water by ultra performance liquid chromatography tandem mass spectrometry
-
摘要: 据调查,大环内酯类抗生素(MAs)在我国所有抗生素中使用量居于首位、污染水平处于较高水平;林可霉素(林可酰胺类抗生素 [LAs])是我国使用量最大的单个抗生素之一. 鉴于两类抗生素抗菌作用类似,本研究建立了同时分析地表水中14种MAs以及2种LAs的超高效液相色谱串联质谱(UPLC-MS/MS)分析方法. 水样萃取前添加0.5 g·L−1 Na2EDTA减少金属阳离子螯合影响,之后采用Oasis HLB固相萃取柱富集净化,最后以1%甲酸甲醇洗脱. UPLC-MS/MS测定采用甲醇和0.1%甲酸水作为流动相,根据质谱碎裂规律确定质谱定性定量离子对并采用多反应监测(MRM)模式进行分析. 实际水样中目标抗生素的加标回收率为77%—114%,方法检出限绝大多数在0.004—0.06 ng·L−1之间. 方法应用于北京北运河和永定河的35个水样,检出8种MAs和2种LAs,浓度在0.01—71 ng·L−1之间. 总体来讲,北运河浓度高于永定河,北运河上游受纳污水处理厂出水可能是重要原因. 两条河流检出物质浓度组成差异也较大,北运河主要是脱水红霉素A和罗红霉素,而永定河主要是脱水红霉素A. 首次检出N-去甲基红霉素A,另外,螺旋霉素、麦迪霉素、林可霉素和氯林可霉素都普遍检出.Abstract: Macrolide antibiotics (MAs) are the most commonly used antibiotics in China, with a relatively high level of pollution. Lincomycin, a kind of lincosamide antibiotics (LAs), is one of the most widely used individual antibiotics. In view of the similar antibacterial effects of the two types of antibiotics, an ultra-high performance liquid chromatography tandem mass spectrometry (UPLC-MS/MS) method was established for simultaneous analysis of 14 MAs and 2 LAs in surface water. 0.5 g·L−1 of Na2EDTA was added to reduce the chelation effect of metal cations. Then antibiotics were extracted by Oasis HLB solid-phase extraction columns, eluted with 1% formic acid in methanol, and analyzed using UPLC-MS/MS under a multiple reaction monitoring (MRM) mode. Methanol and 0.1% formic acid in water were used as mobile phases. MS fragmentation patterns were studied to determine the qualitative and quantitative ion pairs. The results showed that the average recovery rates of target antibiotics in surface water ranged from 77% to 114%. The detection limit of the method was mostly in the range of 0.004—0.06 ng·L−1. This method was applied to 35 water samples from Beiyun River and Yongding River in Beijing, and 8 MAs and 2 LAs were detected with concentrations ranging from 0.01 ng·L−1 to 71 ng·L−1. Overall, the concentration level of antibiotics in the Beiyun River is higher than that of the Yongding River, and the effluent from the sewage treatment plant upstream of the Beiyun River may be an important source. The composition of antibiotics detected in the two rivers were also quite different, mainly dehydrated erythromycin A and roxithromycin in the Beiyun River, and dehydrated erythromycin A in the Yongding River. N-demethylerythromycin A was detected for the first time, and in addition, spiramycin, midecamycin, lincomycin, and chloramphenicol were generally detected.
-
Key words:
- emerging contaminants /
- antibiotics /
- macrolides /
- lincosamides /
- UPLC-MS/MS /
- surface water.
-

-
表 1 16种大环内酯类和林可酰胺类抗生素的质谱参数
Table 1. MS parameters of 16 macrolides and lincosamides.
中文名称
Chinese Name英文名称
Compounds内标
Internal standard仪器检出限/(μg·L−1)
Instrument detection limit质谱多反应监测
MRM碰撞能量/eV
CE锥孔电压/V
Cone林可霉素 Lincomycin 林可霉素-d3 0.014 407>126
407>35924
1820
20新螺旋霉I Neo Spiramycin I 螺旋霉素-d3 1.8 699>174
699>14218
2860
60螺旋霉素 Spiramycin 螺旋霉素-d3 0.15 439>174
439>10120
2225
25阿奇霉素 Azitromvcin 替米考星-d3 0.24 749>116
749>15850
5215
15替米考星 Tilmicosin 替米考星-d3 0.23 869>174
869>9848
5042
40竹桃霉素 Oleandomycin 氯林可霉素-d3 0.07 688>158
688>54428
1816
16氯林可霉素 Clindamycin 氯林可霉素-d3 0.014 429>377
429>12628
1830
28吉他霉素 Kitasamycin 替米考星-d3 0.15 805>109
805>17438
3542
38泰乐菌素 Tylosin 泰乐菌素-d3 0.12 916>174
916>8864
3610
10红霉素 Erythromycin 红霉素-d3 0.014 734>158
734>8350
3222
22N-去甲基红霉素A N-Desmethyl Erythromycin A 红霉素-d3 0.04 720>144
720>8346
3036
30琥乙红霉素 Erythromycin Ethyl Succinate 红霉素-d3 0.46 862>174
862>8346
2834
34交沙霉素 Josamycin 氯林可霉素-d3 0.036 828>109
828>17444
3256
56罗红霉素 Roxithromycin 罗红霉素-d7 0.06 873>158
873>67934
2224
30脱水红霉A Anhydroerythromycin A 红霉素-d3 0.16 726>158
726>8335
3320
20麦迪霉素 Medemycin 红霉素-d3 0.025 814>109
814>17442
3240
40表 2 16种MAs和LAs的方法检出限和加标回收率
Table 2. Limit of detection limit and recovery of 16 MAs and LAs
序号 抗生素
Antibiotics线性回归方程
Regression equationR2 方法检出限/(ng·L−1)
Limit of detection回收率/%
RecoveryRSD/% 1 林可霉素 y =1.19 x -0.304 0.999 0.004 103 9.7 2 新螺旋霉I y =0.15 x -0.057 0.993 0.500 110 15 3 螺旋霉素 y =2.89 x +0.867 0.992 0.032 77 5.7 4 阿奇霉素 y =7.68 x -2.345 0.998 0.060 95 15 5 替米考星 y =0.61 x -0.163 0.998 0.058 91 7.8 6 竹桃霉素 y =0.28 x -0.091 0.999 0.018 114 7.4 7 氯林可霉素 y =0.09 x -0.003 0.997 0.004 85 3.6 8 吉他霉素 y =1.02 x -0.295 0.998 0.034 92 9.7 9 泰乐菌素 y =1.19 x -0.326 0.996 0.030 109 1.2 10 红霉素 y =8.84 x +0.760 0.998 0.004 106 5.6 11 N-去甲基红霉素A y =2.39 x +0.501 0.996 0.010 107 6.8 12 琥乙红霉素 y =0.30 x -0.108 0.997 0.100 95 6.9 13 交沙霉素 y =3.29 x -1.254 0.999 0.008 84 9.6 14 罗红霉素 y =3.21 x -0.737 0.999 0.014 103 13 15 脱水红霉素A y =2.64 x +2.930 0.998 0.036 78 2.7 16 麦迪霉素 y =4.86 x -1.670 0.996 0.006 83 13 -
[1] HERNÁNDEZ F, SANCHO J V, IBÁÑEZ M, et al. Antibiotic residue determination in environmental waters by LC-MS[J]. TrAC Trends in Analytical Chemistry, 2007, 26(6): 466-485. doi: 10.1016/j.trac.2007.01.012 [2] ZHANG Q Q, YING G G, PAN C G, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China: Source analysis, multimedia modeling, and linkage to bacterial resistance[J]. Environmental Science & Technology, 2015, 49(11): 6772-6782. [3] LUO Y, XU L, RYSZ M, et al. Occurrence and transport of tetracycline, sulfonamide, quinolone, and macrolide antibiotics in the Haihe River Basin, China[J]. Environmental Science & Technology, 2011, 45(5): 1827-1833. [4] PENG X Z, ZHANG K, TANG C M, et al. Distribution pattern, behavior, and fate of antibacterials in urban aquatic environments in South China[J]. Journal of Environmental Monitoring:JEM, 2011, 13(2): 446-454. doi: 10.1039/C0EM00394H [5] YANG J F, YING G G, ZHAO J L, et al. Spatial and seasonal distribution of selected antibiotics in surface waters of the Pearl Rivers, China[J]. Journal of Environmental Science and Health. Part. B, Pesticides, Food Contaminants, and Agricultural Wastes, 2011, 46(3): 272-280. [6] 谭芳, 孙凯, 宋威, 等. SPE-HPLC法测定环境水样中3种痕量抗生素的含量[J]. 江汉大学学报(自然科学版), 2017, 45(3): 209-213. TAN F, SUN K, SONG W, et al. Determination of three antibiotics residue in environmental water samples with SPE-HPLC[J]. Journal of Jianghan University Natural Science Edition, 2017, 45(3): 209-213 (in Chinese).
[7] HU Y, ZHU Q Q, WANG Y W, et al. A short review of human exposure to antibiotics based on urinary biomonitoring[J]. Science of the Total Environment, 2022, 830: 154775. doi: 10.1016/j.scitotenv.2022.154775 [8] DRAISCI R, PALLESCHI L, FERRETTI E, et al. Confirmatory method for macrolide residues in bovine tissues by micro-liquid chromatography–tandem mass spectrometry[J]. Journal of Chromatography A, 2001, 926(1): 97-104. doi: 10.1016/S0021-9673(01)00838-X [9] 朱松梅, 方政, 董玉瑛. 3种大环内酯类抗生素对海洋发光菌的毒性作用[J]. 环境监控与预警, 2020, 12(5): 112-116. ZHU S M, FANG Z, DONG Y Y. Toxicity of three macrolide antibiotics to marine Photobacterium phosphoreum[J]. Environmental Monitoring and Forewarning, 2020, 12(5): 112-116(in Chinese).
[10] 岳振峰, 陈小霞, 谢丽琪, 等. 高效液相色谱串联质谱法测定动物组织中林可酰胺类和大环内酯类抗生素残留[J]. 分析化学, 2007, 35(9): 1290-1294. doi: 10.3321/j.issn:0253-3820.2007.09.010 YUE Z F, CHEN X X, XIE L Q, et al. Determination of residues of lincosamides and macrolides in animal tissue by high performance liquid chromatography tandem electrospray mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2007, 35(9): 1290-1294(in Chinese). doi: 10.3321/j.issn:0253-3820.2007.09.010
[11] 张国栋, 董文平, 刘晓晖, 等. 我国水环境中抗生素赋存、归趋及风险评估研究进展[J]. 环境化学, 2018, 37(7): 1491-1500. doi: 10.7524/j.issn.0254-6108.2017112003 ZHANG G D, DONG W P, LIU X H, et al. Occurrence, fate and risk assessment of antibiotics in water environment of China[J]. Environmental Chemistry, 2018, 37(7): 1491-1500 (in Chinese). doi: 10.7524/j.issn.0254-6108.2017112003
[12] WANG J. Determination of five macrolide antibiotic residues in honey by LC-ESI-MS and LC-ESI-MS/MS[J]. Journal of Agricultural and Food Chemistry, 2004, 52(2): 171-181. doi: 10.1021/jf034823u [13] 吴明媛, 余焘, 谢宗升, 等. 液相色谱-四极杆/静电场轨道阱高分辨质谱法快速筛查海水中大环内酯类抗生素[J]. 理化检验-化学分册, 2021, 57(5): 444-449. WU M Y, YU T, XIE Z S, et al. Rapid screening of macrolide antibiotics in seawater by liquid chromatography-quadrupole/electrostatic field orbitrap high resolution mass spectrometry[J]. Physical Testing and Chemical Analysis (Part B:Chemical Analysis), 2021, 57(5): 444-449 (in Chinese).
[14] 王明娟, 胡昌勤. 采用串联质谱法建立大环内酯类抗生素杂质谱的思路[J]. 药学学报, 2013, 48(5): 642-647. WANG M J, HU C. Impurity profiling of macrolide antibiotics by liquid chromatography-mass spectrometry[J]. Acta Pharmaceutica Sinica, 2013, 48(5): 642-647 (in Chinese).
[15] 仲伶俐, 郑幸果, 赵珊, 等. 超高效液相色谱-串联质谱法测定沼液中的林可霉素和大环内酯类抗生素[J]. 分析科学学报, 2021, 37(1): 57-62. ZHONG L L, ZHENG X G, ZHAO S, et al. Determination of lincomycin and macrolide antibiotics in biogas slurry by ultra-high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Analytical Science, 2021, 37(1): 57-62(in Chinese).
[16] HU F Y, HE L M, YANG J W, et al. Determination of 26 veterinary antibiotics residues in water matrices by lyophilization in combination with LC–MS/MS[J]. Journal of Chromatography B, 2014, 949/950: 79-86. doi: 10.1016/j.jchromb.2014.01.008 [17] 章琴琴, 汪昆平, 杨林, 等. 基于液相色谱法分析水环境中大环内酯类抗生素污染的研究进展[J]. 环境化学, 2012, 31(11): 1787-1796. ZHANG Q Q, WANG K P, YANG L, et al. Determination of macrolide antibiotic residues in water environment based on the liquid chromatography: A review[J]. Environmental Chemistry, 2012, 31(11): 1787-1796 (in Chinese).
[18] PLEASANCE S, KELLY J, LEBLANC M D, et al. Determination of erythromycin A in salmon tissue by liquid chromatography with ionspray mass spectrometry[J]. Biological Mass Spectrometry, 1992, 21(12): 675-687. doi: 10.1002/bms.1200211210 [19] 李涛, 王策, 徐兆安, 等. 基于分散固相萃取-超高效液相色谱串联质谱法测定沉积物中大环内酯类抗生素[J]. 环境化学, 2022, 41(1): 231-240. doi: 10.7524/j.issn.0254-6108.2020081601 LI T, WANG C, XU Z A, et al. Determination of macrolide antibiotics in the sediment based on dispersed solid-phase extraction coupled with ultra performance liquid chromatography-electrospray ionization tandem mass spectrometry[J]. Environmental Chemistry, 2022, 41(1): 231-240 (in Chinese). doi: 10.7524/j.issn.0254-6108.2020081601
[20] HU C, ZHANG Y, ZHOU Y, et al. A review of pretreatment and analysis of macrolides in food (Update Since 2010)[J]. Journal of Chromatography A, 2020, 1634: 461662. doi: 10.1016/j.chroma.2020.461662 [21] 徐洁, 邓超, 鲜啟鸣. 固相萃取-高效液相色谱-串联质谱测定水中5种大环内酯类抗生素[J]. 中国测试, 2017, 43(3): 58-62 doi: 10.11857/j.issn.1674-5124.2017.03.012 XU J, DENG C, XIAN Q M. Simultaneous determination of 5 macrolides antibiotics in natural water samples using solid phase extraction-high performance liquid chromatography-tandem mass spectrometry[J]. China Measurement & Testing Technology, 2017, 43(3): 58-62(in Chinese) doi: 10.11857/j.issn.1674-5124.2017.03.012
[22] DEUBEL A, FANDIÑO A S, SÖRGEL F, et al. Determination of erythromycin and related substances in commercial samples using liquid chromatography/ion trap mass spectrometry[J]. Journal of Chromatography A, 2006, 1136(1): 39-47. doi: 10.1016/j.chroma.2006.09.057 [23] 李一阳, 杨默远. 北京市永定河与潮白河流域生态补水特征对比分析[J]. 北京水务, 2021(增刊01): 33-38. LI Y Y, YANG M Y. Contrastive analysis on the water supplement characteristic of Yongding River and Chaobai River in Beijing[J]. Beijing Water, 2021(S01): 33-38 (in Chinese).
[24] 杨肖肖, 张昱, 李久义, 等. 再生水回用的环境系统中抗生素、抗药菌与抗性基因分布的研究进展[J]. 生态毒理学报, 2020, 15(6): 43-56 doi: 10.7524/AJE.1673-5897.20190531001 YANG X X, ZHANG Y, LI J Y, et al. Distribution of antibiotics, antibiotic resistant bacteria, antibiotic re-sistance genes in environmental system with reclaimed water irrigation: A review[J]. Asian Journal of Ecotoxicology, 2020, 15(6): 43-56(in Chinese) doi: 10.7524/AJE.1673-5897.20190531001
[25] WANG F H, QIAO M, LV Z E, et al. Impact of reclaimed water irrigation on antibiotic resistance in public parks, Beijing, China[J]. Environmental Pollution, 2014, 184: 247-253. doi: 10.1016/j.envpol.2013.08.038 -



 下载:
下载:




