-
二苯酮类化合物常用作个人护理品中的防晒剂以保护人体皮肤和头发免受紫外线照射,还被用作塑料表面涂层中的紫外线稳定剂[1]. 人们可以通过皮肤和口服途径接触到该类防晒剂,研究表明在使用含有二苯酮-3(BP-3)的防晒乳液后10 h内,大约有1%—2%的BP-3可穿透表皮屏障并进入血液[2]. 动物实验表明二苯酮类化合物具有多激素效应,其中二苯酮-1(BP-1)和BP-3具有较强的雌激素和抗雄激素效应[3],BP-3还具有致突变效应可使小鼠卵巢细胞姐妹染色体交换和染色体畸变[4]. 羟苯酯类化合物[5]是对羟基苯甲酸的烷基酯,由于其成本低、无异味、稳定性好等优点[6],常被添加于化妆品、药品和食品中用作防腐剂. 越来越多的证据表明,这些化合物可以干扰激素信号通路,具有潜在的致畸和诱变作用[7],并且还可能与多种生殖、免疫和呼吸系统疾病相关,如哮喘和乳腺癌[8 − 10]等,对人类的健康构成威胁. 三氯生(TCS)和三氯卡班(TCC)常被添加于个人护理品中,用作防腐抗菌剂,包括洗手液、手部消毒剂、洗发水和沐浴露等,但其亚致死浓度会增加细菌的抗性[11]. 流行病学研究显示,慢性的TCS[12]和TCC[13]暴露可能导致生育率下降、身体发育减缓以及内源性荷尔蒙活动的改变. 近期的研究显示,无论是TCS[14]还是TCC[15],都无法有效减少传染病菌或细菌的数量. 在世界各地,这两种防腐抗菌剂正逐渐被淘汰或者禁用,与此同时,替代品的使用正在增加,如对氯间二甲苯酚(PCMX). 和早期的防腐抗菌剂一样,PCMX也被认为是安全无毒的. 目前,世界各地的河流[16]和废水[17]中都检出高浓度的PCMX,而研究显示,环境中PCMX的慢性暴露会引发水生生物毒性[18 − 19]. 体内实验显示,慢性暴露于PCMX会延迟或抑制斑马鱼和虹鳟鱼的孵化,造成胚胎死亡、形态畸形,影响基因表达,并造成红细胞DNA损伤和神经毒性[18 − 19]. 此外,由于2019年冠状病毒的大流行大大增加了全球抗菌产品的消费量,从而大幅增加人类接触PCMX的频率和程度.
人类接触这些化学物质的主要途径是通过摄入或皮肤接触,最重要的来源是食物和个人护理产品[20 − 22]. 这些化学物质的代谢途径主要是通过尿液排出体外[23],因此,通常使用尿液中可测量的生物标志物进行内暴露评估. 人体生物监测被广泛应用于风险评估工作中,是国内外公认的有效评估化学物质暴露水平的方法,尤其是全国性的人体生物监测项目,具有系统性、专业性和大样本等特征,被视为人体环境污染物暴露评估的金标准[24]. 因此,需要高效准确的高通量前处理方法来更好地满足人体生物监测项目大批量样本的检测需求.
本课题组提出了固相萃取-高效液相色谱-质谱法同时测定人尿中12种个人护理品的检测方法[25],基于该项研究基础,本研究拓展了重点关注指标,新增二苯酮-6(BP-6)、PCMX和羟苯庚酯(HepP),同时优化了前处理方法,提出了96孔板酶解尿样,96孔板全自动固相萃取的高通量高效率前处理方法. 与文献报道的方法[26 − 31]相比较,本方法尿液样品需求量少,仅需要1 mL尿液,浓缩倍数为1倍;前处理部分全程采用96孔板酶解并全自动固相萃取,耗时短效率高,能够适应大批量样本的检测,同时减少了检测人员与有机溶剂的接触,对环境和检测人员更友好;方法检出限(LOD)较低,灵敏度和精密度较高;此外,新纳入的分析物PCMX,作为替代性抗菌剂的使用正在增加,研究表明其并非安全无毒,因此开展该物质的暴露评估刻不容缓,本方法为其进一步深入研究提供方法学支撑.
-
TQ-XS液相色谱-串联质谱仪(美国Waters公司);全自动固相萃取装置(德国Biotage公司);NDK200-1A 96孔板氮吹仪(杭州米欧仪器公司);96孔板离心机(北京鼎昊源科技有限公司);恒温水浴摇床(中国莱伯泰科仪器股份有限公司);Oasis HLB 96 孔板(30 mg,美国Waters公司).
6种二苯酮类化合物标准品,其中BP-1、二苯酮-2(BP-2)、二苯酮-8(BP-8)和4-羟基二苯甲酮(4-OHBP)购自加拿大TRC公司,纯度均为98%,BP-3购自美国CIL公司,纯度高于98%,BP-6购自坛墨质控科技股份有限公司,浓度为1 mg·mL−1. 6种羟苯酯类防腐剂标准品,包括羟苯甲酯(MP)、羟苯乙酯(EP)、羟苯丙酯(PP)、羟苯丁酯(BP)、羟苯苄酯(BzP)和HepP,购自加拿大TRC公司,纯度均为98%. 3种抗菌剂标准品,其中TCS购自美国Accustandard公司,纯度为99.5%, TCC和PCMX购自加拿大TRC公司,纯度均为98%. 14种稳定同位素内标(MP-13C6、EP-13C6、PP-13C6、BP-13C6、BzP-D7、HepP-D4、BP-1-D5、BP-2-D4、BP-3-D3、BP-8-D3、4-OHBP-D4、TCC-D4、TCS-13C6、PCMX-D6)均购自加拿大TRC公司,纯度高于97%,其中BP-6未购得对应稳定同位素内标,考虑到其保留时间与TCC-D4的保留时间比较接近,因此选择TCC-D4作为其定量内标.
甲醇、乙腈均为MS级(德国Merck公司);乙酸和乙酸铵均为MS级(美国Thermo Fisher公司);β-葡萄糖醛酸酶(>
85000 units·mL−1,美国Sigma aldrich公司);NIST SRM3672 和NIST SRM3673 (美国国家标准与技术研究院). -
本方法中色谱和质谱条件可参照文献方法[25],表1为BP-6、PCMX和HepP及其稳定同位素内标的详细质谱参数.
-
用甲醇配制浓度为10 μg·mL−1和0.5 μg·mL−1的标准和内标储备液,其中标准MP、BP-3和PCMX的质量浓度为40 μg·mL−1,低温冷藏保存. 内标储备液临用时稀释至0.1 μg·mL−1作为混合内标工作液. 参照文献[25]方法配制浓度为400、200、100、50、20、10、5、2 ng·mL−1的系列标准工作溶液(MP、BP-3和PCMX为该浓度的4倍).
-
从低温冰箱取出尿样,于4 ℃冰箱中解冻过夜后放置至室温. 涡旋混匀后,移取1 mL尿样至96孔板盘中,加入500 µL乙酸铵-酶缓冲溶液(500 units·mL−1)和75 μL混合内标工作液(7.5 ng),用聚丙烯盖垫密封. 涡旋混匀后,在37 ℃下水浴酶解过夜. 样品盘放置至室温后离心(
4000 r·min−1)10 min,用多道移液器吸取上清液至新的样品盘中,放置于全自动固相萃取仪中,进行自动固相萃取. 萃取流程为:依次采用1.5 mL甲醇和1 mL水活化平衡Oasis HLB 96孔固相萃取柱,之后分两次移取样品上清液至固相萃取柱,设置压力梯度(0.8 bar 2 min→2 bar 30 s→5 bar 30 s)使其顺利过柱,1 mL 25%乙腈水溶液快速淋洗,使用强压(5 bar)使淋洗液完全过柱并干燥. 最后1.5 mL甲醇-乙腈(V:V=1:1)溶液分2次缓慢洗脱(0.6 bar)2min. 萃取完成后,置于氮吹仪中氮气(N2)吹至近干,用20%乙腈水溶液复溶至0.5 mL,离心(4000 r·min−1)10 min 后待UPLC-MS/MS测定. -
按照文献方法进行质量控制[25],每批样品的测定序列包含2个过程空白样,1个NIST SRM
3672 和1个NIST SRM3673 质控样和3个平行样. 测定前均对标准品和内标的响应值进行评估,保证响应值不低于正常值的50%. 过程空白的测定值应低于方法检出限(LOD),NIST质控样中各分析物的测定值与证书参考值的比值应在0.8—1.2之间. 平行样(n=2)结果采用相对偏差(RD)进行评估,RD应低于5%,平行样(n>2)结果采用相对标准偏差(RSD)评估,RSD应低于10%. -
为提高样品前处理效率,本方法采用96孔板进行酶解. 前期研究中本课题组分别对酶的种类、酶解当量、酶解时间和酶解pH值等条件进行优化[25],在此基础上,本方法进一步比较水浴和空气浴两种加热方式对酶解效率的影响,采用加标回收率评估. 结果表明,15种分析物水浴和空气浴的绝对回收率相差不大(50%—70%),在内标的校正作用下,相对回收率可稳定在80%—120%. 但是,空气浴条件下,结果的重复性不如水浴,RSD未能保证在10%以内,这表明空气浴可能无法保证96孔板均匀受热,因此本方法选择水浴加热.
-
本方法分别收集实验过程中的样品过滤液、淋洗液和洗脱液,通过加标回收实验结果评估不同固相萃取柱对分析物的保留和净化效果. 前期研究中本课题组分别比较了Waters Oasis HLB、Agilent Bond Elut NEXUS和Waters Sep-Pak C18等3种固相萃取柱[25],最终确定最优固相萃取柱为Waters Oasis HLB. 本方法在此基础上,进一步比较Waters Oasis HLB和Prime HLB柱. 结果表明,在Prime HLB柱样品过滤液中可检出约40%的MP,表明Prime HLB柱对MP的保留效果较差,HLB柱对分析物有更好的保留,推断是由于HLB柱比Prime HLB柱有更好的极性化合物保留性能. 采用25%乙腈水溶液进行淋洗,HLB和Prime HLB柱都可以很好地保留分析物. 最终,评估两种萃取柱的洗脱液中分析物的回收率,发现HLB柱的相对回收率可以稳定保持在90%—110%,而Prime HLB柱仅能达到70%. 综合考虑HLB柱的高保留和高回收性,本研究最终选择HLB柱作为固相萃取柱.
-
考察了常用洗脱溶剂甲醇、乙腈和甲醇-乙腈(V:V =1:1)的洗脱效果. 结果显示,3种溶剂绝对回收率为甲醇-乙腈(V:V=1:1)>甲醇>乙腈,其中前两者较为接近(50%—80%),进一步比较信噪比(S/N),结果显示,仅PP和BP等个别物质表现为甲醇和甲醇-乙腈(V:V =1:1)相差不大外,其余物质甲醇-乙腈(V:V =1:1)均显示出较高信噪比,且峰形良好.
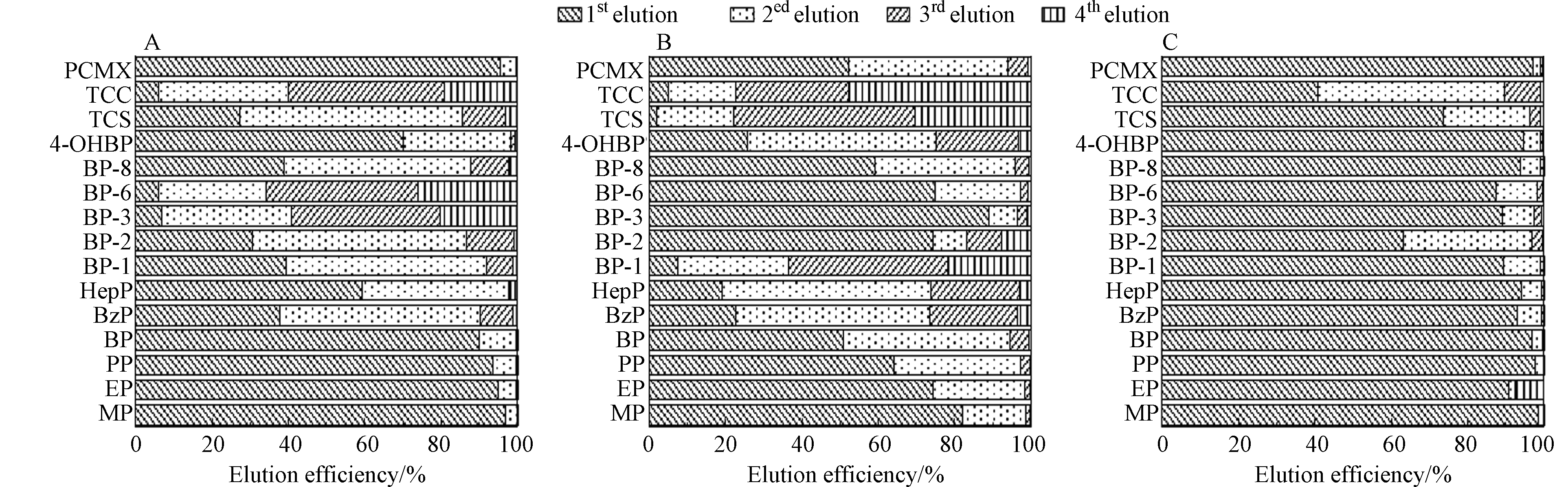
进一步优化洗脱液体积和洗脱次数等条件. 分别选用甲醇、乙腈和甲醇-乙腈(V:V =1:1)分4次洗脱分析物,单次洗脱体积为750 μL,共计3 mL,按照公式(1)计算单次洗脱效率. 结果如图1所示,洗脱液为甲醇和乙腈时均无法保证各分析物在1.5 mL(750 μL×2)内的洗脱效率为90%以上,而使用甲醇-乙腈(V:V =1:1)时,除BP-2、TCC和TCS外,其余化合物使用750 μL洗脱,洗脱效率即可达90%以上,1.5 mL洗脱效率为98%以上. 对于BP-2、TCC和TCS,在洗脱体积为1.5 mL时,洗脱效率也在90%以上,因此最终确定选择甲醇-乙腈(V:V =1:1)作为洗脱液,1.5 mL洗脱液分两次缓慢洗脱.
-
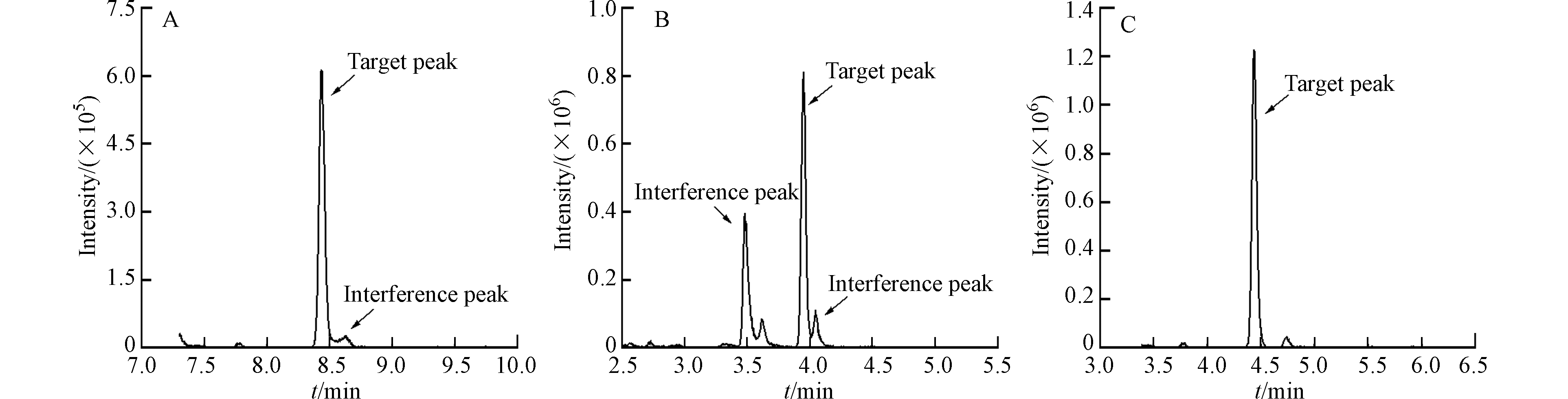
前期研究对C18和T3色谱柱进行比较,结果显示各分析物在C18柱上峰形良好且保留时间较短,因此确定C18柱为该方法的色谱柱,本方法在此基础上进一步考察了不同品牌的C18柱对分析物色谱峰形和保留时间的影响,包括Acquity BEH C18柱(100 mm×2.1 mm,1.7 µm)、Poroshell 120 EC-C18柱(100 mm×4.6 mm,2.7 µm)和Accucore C18柱(100 mm×4.6 mm,2.6 µm). 结果显示,在标准溶液和实际样品中,分析物经各色谱柱分离的灵敏度和信噪比(S/N)均表现为Poroshell 120 EC-C18柱显著低于Accucore C18柱和Acquity BEH C18柱,其中,除EP、BP-1等个别物质外Acquity BEH C18柱响应值均略高于Accucore C18柱. 对比分析物的峰形,三者均出现右拖尾现象,但Accucore C18柱拖尾严重,且在实际样品中出现干扰峰,如图2所示,因此综合考虑最终选择Acquity BEH C18柱作为本方法的分离柱.
-
生物样品的采集量通常不仅用于一次样品测定,因此需要考虑其反复冻融的稳定性. 将尿液样品放入-20 ℃冷冻,反复冻融3次,测定结果如下表2所示. 结果显示,尿液样品反复冻融3次后除BP-6的RSD为18%(<20%)以外,其余14种分析物RSD均低于10%,说明样品经反复冻融3次并不影响结果,反复冻融稳定性良好.
-
前处理后的样品可能会因某些不可抗因素无法立即进行测定,需对提取液进行保存. 因此,有必要评估提取液在冷藏条件下的稳定性. 本研究对同一实际样品进行前处理,收集提取液分装成5份,放置于4 ℃冰箱保存,分别于第1、2、3、5、7天进行测定,通过比较不同时间测得的分析物定量离子、同位素内标峰面积以及浓度值,评估其稳定性. 结果显示,峰面积随储存时间的延长出现逐渐下降趋势,但整体相对稳定(RSD在10%—20%之间). 内标校正后,实际样品浓度值的RSD在1.0%—8.9%范围内,样品浓度下降率在5%以内,表明提取液在冷藏条件下(4 ℃)保存1周不影响结果.
-
由于96孔板的进样时间较长,需考虑样品是否会在进样过程中降解. 将样品处理后,立即进样分析,在放置进样室中30 h之后再重复进样1次,比较两次测定的定量离子峰面积和分析物浓度值,考察是否会产生降解. 结果如表3所示,15种分析物在进样过程中并未发生明显降解,结果较稳定.
-
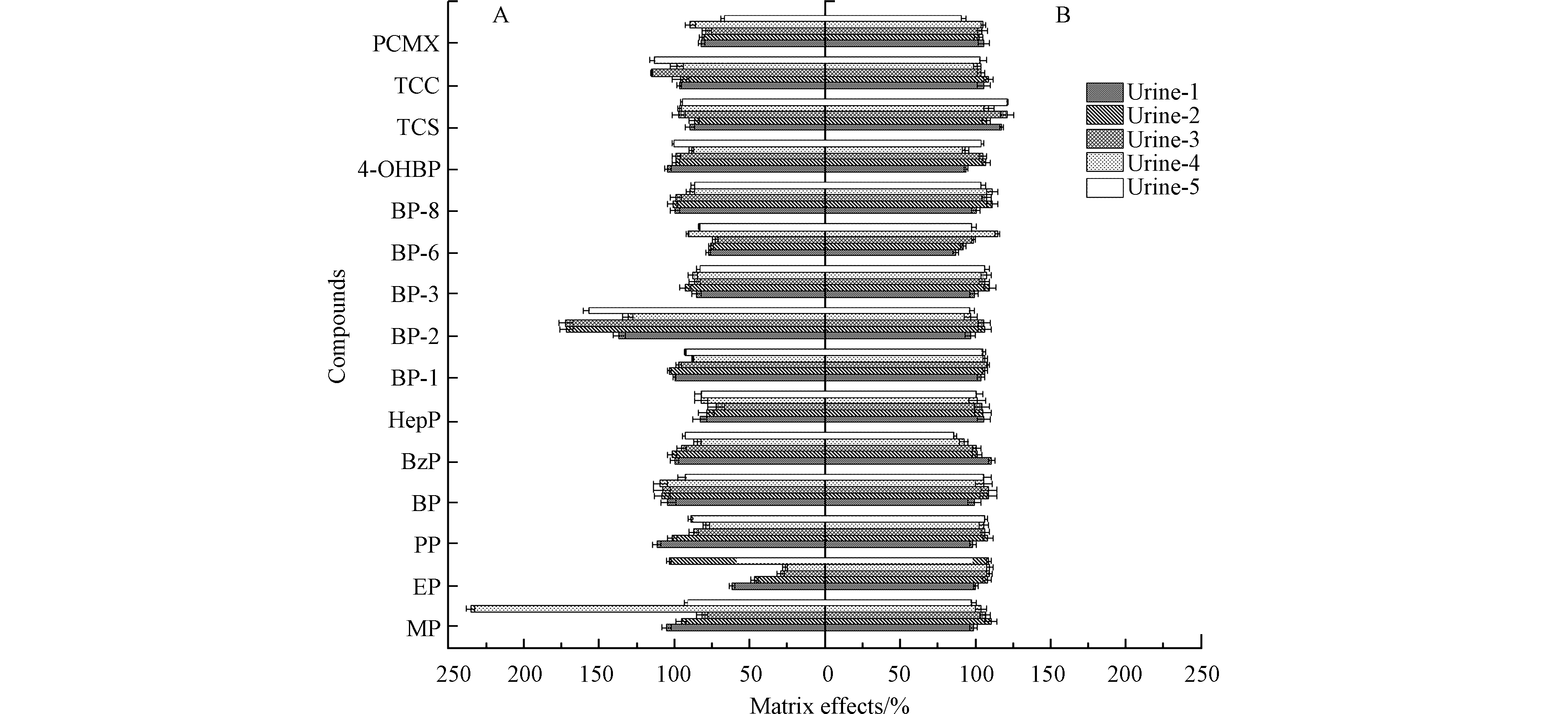
选用5个不同来源的尿样(含1份混合尿样),按1.4节进行前处理并收集洗脱液. 将5份尿样洗脱液和甲醇溶液作为基质,按1.3节配制成6条基质标准溶液上机测定. 按照文献方法[30]评估基质效应,结果如图3A显示,多数物质均属于弱基质效应,仅MP、EP和BP-2表现为强基质效应. 采用稳定同位素内标校正后,基质效应得到有效抵消(如图3B所示).
-
以分析物定量离子峰面积与内标离子峰面积之比(y)与对应质量浓度(x,ng·mL−1)绘制校准曲线,结果显示,MP、BP-3和PCMX在8.00—
1600 ng·mL−1,TCS在5.00—400 ng·mL−1,其余分析物在2.00—400 ng·mL−1范围内线性关系良好,相关系数(r)均大于0.999,对于低浓度的样品,采用回归方程加权的方法使得检测结果更加准确. 本方法采用美国环保署(USEPA)的检出限测定程序文件第二版(EPA 821-R-16-006)[31]计算方法LOD和LOQ. 由于实验过程中严格控制实验空白,15种分析物中仅MP和PCMX存在空白干扰. 对有空白干扰的2种分析物进行7次过程空白实验,计算过程空白的平均值(X)及标准偏差(SD),获得X+3SD和X+10SD结果,将该结果与通过加标方式获得的LOD和LOQ进行比较,较大者作为该物质的LOD和LOQ. 其余物质均采用加标方式确定,详细结果可见表4. -
方法的准确度和精密度分别用相对回收率和RSD表示. 结果如表5所示,在低、中、高3个加标浓度下,所有分析物的加标回收率为89.1%—110%,日内和日间精密度分别为0.9%—13%和 3.1%—14%. 回收率和RSD均在可接受范围内.
-
采用标准物质NIST SRM 3672和NIST SRM 3673,评估不同浓度水平的方法准确度. 如表6所示,7次测定结果的RSD分别为2.0%—8.1%和1.1%—12%,参照文献[26 − 29]结果满足测定要求.
-
采用本方法对300份尿液样本进行测定,结果如表7所示. 其中检出率较高的防晒剂为BP-1(53%)和BP-3(47%),其中位浓度为0.02 ng·mL−1和<LOD,检出率较高的防腐剂包括MP(100%)、EP(92%)、PP(82%)和PCMX(64%),中位值分别为11.5、0.53、0.65、2.09 ng·mL−1. 值得关注的是,MP和PCMX的第95百分位数检出浓度可达375 ng·mL−1和459 ng·mL−1,是中位浓度的几十倍,可见个别人群存在MP和PCMX的高暴露情况,需进一步开展大样本研究进行证实.
与近几年国内外的研究进行比较,发现伊朗女性[32]体内的PBs暴露值远高于本研究,MP、EP、PP和BP的中位检出浓度分别为
5195 、2502 、3320 、3700 ng·mL−1. 印度女性[33]体内的MP和PP的暴露浓度中位值高于本研究,分别为108 ng·mL−1和37.1 ng·mL−1,而EP的暴露浓度中位值(0.11 ng·mL−1)比较低. 在我国人群中,一项深圳成年人的研究[34]显示,除MP的暴露浓度中位值(5.78 ng·mL−1)略低外,其他暴露浓度中位值与本研究相当. 在一项广东人群的研究[35]中,除EP中位值与本研究相当外,其余物质中位值均高于本研究,且BP-6、TCS和TCC分别有92%、94%和92%的检出率. 一项北京男性的研究[36]显示,MP、EP和PP值均高于本研究,分别为15.4、2.08、5.87 ng·mL−1. 有关PCMX暴露的文献十分有限,Tan等[37]报道的广州儿童和孕妇PCMX浓度的GM分别为21.6 ng·mL−1和31.9 ng·mL−1,远高于本研究PCMX浓度(GM:3.95 ng·mL−1). 综合可见,PCPs在全球人群中暴露广泛,系统性开展人群中的暴露评估工作具有重要的现实意义,本方法能为该项工作提供有力的技术保障. -
本文通过对前处理、色谱和质谱条件进行优化,建立了一种同时测定人尿中15种防晒剂和防腐剂的分析方法,该方法前处理过程快速简便,有效实现高通量检测,方法线性范围宽,灵敏度高,对环境和工作人员友好,可有效应用于尿液样品中15种防晒剂和防腐剂的大批量检测.
自动固相萃取-超高效液相色谱-串联质谱法测定人尿中15种防晒剂和防腐剂
Determination of 15 UV absorbers and preservatives in human urine by automated solid-phase extraction-ultra performance liquid chromatography-tandem mass spectrometry
-
摘要: 本文建立了同时快速测定人尿液中15种防晒剂和防腐剂的高通量自动固相萃取-超高效液相色谱-串联质谱测定方法(automatic SPE-UPLC-MS/MS). 人尿液经β-葡萄糖醛酸酶过夜酶解后,以Waters HLB 96-well Plate(30 mg,30 μm)为基础,使用全自动固相萃取装置进行前处理,经25%乙腈溶液淋洗,甲醇-乙腈溶液(V:V=1:1)洗脱,氮吹至近干,20%乙腈溶液复溶后,采用Waters Acquity BEH C18色谱柱(100 mm×2.1 mm,1.7 μm)、二元梯度洗脱系统(流动相A为水,流动相B为乙腈)进行色谱分离. 质谱方法采用多反应监测(MRM)模式、电喷雾电离负离子模式和稳定同位素内标法进行数据采集和定量分析. 15种分析物在相应线性范围内的线性相关系数(r)均大于0.999,3个加标水平的加标回收率为89.1%—110%,日内和日间精密度分别为0.9%—13%和 3.1%—14%,样本稳定性、提取液稳定性、上样周期稳定性和反复冻融稳定性的相对标准偏差均在10%之内. 将本方法应用于300名志愿者随机尿液的测定,结果显示该人群尿液的主要检出成分为4种防腐剂,分别是羟苯甲酯(MP)、羟苯乙酯(EP)、羟苯丙酯(PP)和对氯间二甲苯酚(PCMX),检出率分别为100%、92%、82%和64%,中位浓度分别为11.5、0.53、0.65、2.09 ng·mL-1. 综上,本方法可应用于人尿液中15种防晒剂和防腐剂的快速提取、净化和定量分析,具有操作简便、灵敏度高、效率高、人员友好和绿色环保等优势,适用于大批量样品的检测应用.
-
关键词:
- 96孔板固相萃取 /
- 超高效液相色谱-三重四级杆串联质谱 /
- 尿液 /
- 防晒剂 /
- 防腐剂.
Abstract: A high-throughput automated solid-phase extraction-ultra performance liquid chromatography-tandem mass spectrometry (Automatic SPE-UPLC-MS/MS) method was developed for the simultaneous and rapid determination of 15 UV absorbers and preservatives in human urine. After overnight digestion by β-glucuronidase, human urine was extracted with a Waters HLB 96-well Plate (30 mg, 30 μm) using a fully automated solid-phase extraction device. The sample was washed with 25% acetonitrile solution and eluted with methanol: acetonitrile (V:V=1:1) solution. The eluate was evaporated to dryness under a gentle stream of nitrogen and reconstituted with 20% acetonitrile solution. The chromatographic separation was performed on a Waters Acquity BEH C18 column (100 mm×2.1 mm, 1.7 µm) with a binary gradient elution system (water as mobile phase A and acetonitrile as mobile phase B). The mass spectrometry was operated in multiple reaction monitoring (MRM) mode and negative electrospray ionization mode. Stable isotope internal standard was adopted for quantification. The linear correlation coefficients (r) of 15 target analytes were all greater than 0.999 in the corresponding linear ranges. The recovery rates at three spiked levels ranged from 89.1% to 110%. The intra-day and inter-day precisions were 0.9%—13% and 3.1%—14%, respectively. The deviations of sample stability, extract stability, auto-sampler stability, and freeze-thaw stability were found to be within 10%. This method was applied to 300 urine samples collected from volunteers, and found methyl paraben (MP), ethyl paraben (EP), propyl paraben (PP), and chloroxylenol (PCMX) had the highest detection rates (100%, 92%, 82%, and 64%, respectively). The median concentrations were 11.5, 0.53, 0.65, and 2.09 ng·mL-1 for MP, EP, PP, and PCMX, respectively. In conclusion, this method can be applied to the rapid extraction, purification, and quantitative of 15 UV absorbers and preservatives in human urine. The method had the advantages of easy operation, high sensitivity, high efficiency, personnel-friendly, and eco-friendly. It is suitable for the application of detecting samples on a large scale. -

-
表 1 BP-6、HepP和PCMX及其稳定同位素内标的质谱参数
Table 1. Mass spectrometric parameters of BP-6, HepP, PCMX and their stable isotope internal standards
分析物
Analyte缩写
Abbreviation保留时间/
min
tR母离子(m/z)
Precursor ion子离子/(m/z)
Product
ions锥孔电压/V
Cone
voltage碰撞能/eV
Collision
energy内标
Internal
Standard2,2'-Dihydroxy-4,4'-dimethoxybenzophenone BP-6 11.28 272.97 122.94*, 107.91 14 18, 38 TCC-D4 Heptyl paraben HepP 13.83 235.05 92.13*, 136.32 6 26, 20 HepP-D4 Chloroxylenol PCMX 9.70 154.88, 157.10 34.90*, 37.10 4 18, 24 PCMX-D6 HepP-D4 — 13.83 239.17 95.88 14 28 — PCMX-D6 — 9.66 160.85 34.91 8 16 — *, Quantitative ion分析物的定量离子. 表 2 15种目标分析物反复冻融稳定性评估
Table 2. Repeated freeze-thaw stability assessment of 15 target analytes
分析物
Analyte测定值/(ng·mL−1)
Experimental result相对标准偏差/%
RSD第1次
1st第2次
2nd第3次
3rdBP-1 14.0 14.0 13.7 1.2 BP-2 20.2 19.0 19.3 3.0 BP-3 5.83 5.76 5.62 1.9 BP-6 3.11 4.45 4.03 18 BP-8 12.7 12.0 10.7 9.0 4-OHBP 14.2 14.7 14.0 2.6 MP 66.3 62.3 64.7 3.1 EP 21.8 21.3 22.3 2.4 PP 23.3 23.5 23.2 0.65 BP 18.8 19.6 19.3 2.2 BzP 16.3 15.9 16.3 1.5 HepP 9.31 8.84 7.69 9.7 TCS 6.83 6.36 6.02 6.3 TCC 7.24 7.15 7.00 1.7 PCMX 205 202 212 2.5 表 3 15种目标分析物上样周期(30 h)稳定性
Table 3. Stability of the 15 target analytes at sampling intervals (30 h)
分析物
Analyte定量离子峰面积
Peak area ratio of quantitative ion测定值/(ng·mL−1)
Experimental result0 h 30 h 0 h 30 h 相对偏差/%
Relative deviationBP-1 7.29×105 7.65×105 15.4 14.8 2.1 BP-2 1.14×106 1.19×106 21.0 21.7 1.6 BP-3 7.44×103 7.58×103 10.2 9.80 2.1 BP-6 1.80×105 1.95×105 19.8 21.7 4.5 BP-8 9.86×103 1.02×104 12.8 12.1 2.7 4-OHBP 3.57×105 3.74×105 15.5 15.7 0.7 MP 2.60×106 2.48×106 64.8 64.5 0.2 EP 5.87×105 5.95×105 22.5 22.6 0.3 PP 1.04×106 1.11×106 25.0 25.4 0.8 BP 1.00×107 1.04×106 20.2 20.7 1.0 BzP 6.70×105 7.03×105 16.1 16.5 1.1 HepP 3.46×105 3.11×105 12.6 12.3 1.2 TCS 1.65×102 2.82×102 8.11 7.89 1.4 TCC 3.94×105 3.38×105 8.83 8.10 4.3 PCMX 1.12×105 1.26×105 206 205 0.02 表 4 15种目标分析物的线性范围、方法检出限和方法定量限
Table 4. Linear range, correlation coefficient, limit of detection(LOD), and limit of quantification(LOQ) for 15 kinds of target analytes
分析物
Analyte线性范围/(ng·mL−1)
Linear range相关系数
Correlation coefficient(r)检出限/(ng·mL−1)
LOD定量限/(ng·mL−1)
LOQBP-1 2—400 0.9994 0.01 0.04 BP-2 2—400 0.9994 0.01 0.04 BP-3 8— 1600 0.9998 0.08 0.26 BP-6 2—400 0.9997 0.02 0.05 BP-8 2—400 0.9997 0.04 0.12 4-OHBP 2—400 0.9994 0.01 0.04 MP 8— 1600 0.9995 0.35 0.72 EP 2—400 0.9998 0.02 0.05 PP 2—400 0.9996 0.01 0.04 BP 2—400 0.9998 0.01 0.02 BzP 2—400 0.9998 0.01 0.02 HepP 2—400 0.9996 0.01 0.02 TCS 5—400 0.9992 0.21 0.69 TCC 2—400 0.9992 0.03 0.10 PCMX 8— 1600 0.9991 1.20 2.50 y, peak area ratio of quantitative ion and isotope internal standard 定量离子与同位素内标的峰面积比;x, mass concentration 质量浓度 表 5 15种目标分析物在低浓度、中浓度和高浓度条件下的加标回收率和相对标准偏差、日内精密度和日间精密度
Table 5. Spiked recoveries,relative standard deviations (RSD) of intra-day and inter-day for 15 kinds of target analytes at low, medium and high concentrations
分析物
Analyte低浓度回收率/%
Low concentration recovery中浓度回收率/%
Medium concentration recovery高浓度回收率/%
High concentration recovery日内精密度/%
Intra-day RSD日间精密度/%
Inter-day RSDBP-1 89.5 99.5 101 1.1 4.2 BP-2 99.7 105 97.1 3.9 3.9 BP-3 89.8 91.0 99.0 2.4 7.1 BP-6 108 110 108 3.1 3.1 BP-8 105 101 104 2.8 7.1 4-OHBP 100 103 106 3.0 3.7 MP 93.2 101 107 2.1 4.9 EP 95.4 97.8 104 2.3 3.7 PP 97.1 97.1 104 4.6 4.4 BP 94.7 100 102 2.0 3.8 BzP 104 105 108 2.3 4.2 HepP 89.1 94.5 97.0 0.9 4.6 TCS 94.8 99.9 101 13 14 TCC 99.7 95.1 98.0 3.2 4.3 PCMX 98.6 103 102 4.7 5.8 注:加标浓度水平:0.5、10、50 ng·mL−1 (MP、BP-3和PCMX 为2、40、200 ng·mL−1).
Note: the spiked concentration at three levels are 0.5, 10 ,50 ng·mL−1 (2, 40 , 200 ng·mL−1 for MP, BP-3 and PCMX).表 6 NIST SRM
3672 和3673 测定值与参考值比较(n=7)Table 6. Comparison of experimental results and reference values of NIST SRM
3672 and3673 (n=7)分析物
AnalyteNIST SRM 3672 NIST SRM 3673 参考值/(µg·kg−1)
Reference value测定值/(µg·kg−1)
Experimental result相对标准
偏差/%
RSD参考值/(µg·kg−1)
Reference value测定值/(µg·kg−1)
Experimental result相对标准
偏差/%
RSDBP-3 186—196 200±10 2.0 267—281 299±8 2.1 MP 111—115 106±4 2.7 77.4—81.6 78.0±1.3 1.1 EP 7.92—8.32 8.09±0.18 3.1 10.0—10.6 9.9±0.4 2.9 PP 17.3—17.9 17.1±0.6 2.5 21.0—22.2 21.1±0.7 2.2 BP 10.9—11.3 10.9±0.2 3.3 1.08—1.14 1.14±0.05 2.8 TCS 17.2—18.2 16.0±0.9 8.1 5.95—6.59 5.86±0.73 12 表 7 15种内分泌干扰物在实际人群尿液中的测定值
Table 7. Concentrations of 15 endocrine disruptors in human urine
分析物
Analyte检出率/%
DF几何均值/
(ng·mL−1)
GM浓度值/(ng·mL−1)
Concentrations第5百分位数
P5第25百分位数
P25第50百分位数
P50第75百分位数
P75第95百分位数
P95BP-1 53 0.05 ND ND 0.02 0.26 2.50 BP-2 1.3 ND ND ND ND ND ND BP-3 47 0.26 ND ND ND 1.03 10.2 BP-6 27 0.03 ND ND ND 0.04 0.86 BP-8 0.0 ND ND ND ND ND ND 4-OHBP 21 ND ND ND ND ND 0.26 MP 100 16.6 1.81 4.63 11.5 51.08 375 EP 92 0.67 ND 0.12 0.53 3.82 58.8 PP 82 0.64 ND 0.05 0.65 5.98 99.4 BP 2.8 ND ND ND ND ND ND BzP 0.0 ND ND ND ND ND ND HepP 0.0 ND ND ND ND ND ND TCS 48 0.44 ND ND ND 0.95 11.8 TCC 9.8 ND ND ND ND ND 0.17 PCMX 64 3.95 ND ND 2.09 8.30 459 DF., detection frequency检出率; ND., no detectable 未检出; P5, P25, P50, P75 and P95 . , the mass concentration of targeted analytes of 5th, 25th, 50th, 75th and 95th percentile第5、25、50、75和95百分位数. -
[1] CALAFAT A M, WONG L Y, YE X Y, et al. Concentrations of the sunscreen agent benzophenone-3 in residents of the United States: National Health and Nutrition Examination Survey 2003: 2004[J]. Environmental Health Perspectives, 2008, 116(7): 893-897. doi: 10.1289/ehp.11269 [2] HAYDEN C G, ROBERTS M S, BENSON H A. Systemic absorption of sunscreen after topical application[J]. The Lancet, 1997, 350(9081): 863-864. doi: 10.1016/S0140-6736(05)62032-6 [3] SCHREURS R H M M, SONNEVELD E, JANSEN J H J, et al. Interaction of polycyclic musks and UV filters with the estrogen receptor (ER), androgen receptor (AR), and progesterone receptor (PR) in reporter gene bioassays[J]. Toxicological Sciences, 2005, 83(2): 264-272. [4] FRENCH J E. NTP technical report on the toxicity studies of 2-Hydroxy-4-methoxybenzophenone (CAS No. 131-57-7) Adminstered Topically and in Dosed Feed to F344/N Rats and B6C3F1 Mice[J]. Toxicity Report Series, 1992, 21: 1-14. [5] GUO Y, KANNAN K. A survey of phthalates and parabens in personal care products from the United States and its implications for human exposure[J]. Environmental Science & Technology, 2013, 47(24): 14442-14449. [6] HONDA M, ROBINSON M, KANNAN K. Parabens in human urine from several Asian countries, Greece, and the United States[J]. Chemosphere, 2018, 201: 13-19. doi: 10.1016/j.chemosphere.2018.02.165 [7] BŁĘDZKA D, GROMADZIŃSKA J, WĄSOWICZ W. Parabens. From environmental studies to human health[J]. Environment International, 2014, 67: 27-42. doi: 10.1016/j.envint.2014.02.007 [8] FARHAAN H, HOWARD M. An overview of parabens and allergic contact dermatitis[J]. Skin Therapy Letter, 2013, 18(5): 5-7. [9] JUNGE K M, BUCHENAUER L, STRUNZ S, et al. Effects of exposure to single and multiple parabens on asthma development in an experimental mouse model and a prospective cohort study[J]. Science of the Total Environment, 2022, 814: 152676. doi: 10.1016/j.scitotenv.2021.152676 [10] KRISTIN V H, CECILIE S, LÅSTAD L S H, et al. Exposure to environmental phenols and parabens, and relation to body mass index, eczema and respiratory outcomes in the Norwegian RHINESSA study[J]. Environmental Health:a Global Access Science Source, 2021, 20(1): 81. [11] DRURY B, SCOTT J, ROSI-MARSHALL E J, et al. Triclosan exposure increases triclosan resistance and influences taxonomic composition of benthic bacterial communities[J]. Environmental Science & Technology, 2013, 47(15): 8923-8930. [12] WEATHERLY L M, GOSSE J A. Triclosan exposure, transformation, and human health effects[J]. Journal of Toxicology and Environmental Health. Part B, Critical Reviews, 2017, 20(8): 447-469. doi: 10.1080/10937404.2017.1399306 [13] ROCHESTER J R, BOLDEN A L, PELCH K E, et al. Potential developmental and reproductive impacts of triclocarban: A scoping review[J]. Journal of Toxicology, 2017, 2017: 1-15. [14] KIM S A, MOON H, LEE K, et al. Bactericidal effects of triclosan in soap both in vitro and in vivo[J]. Journal of Antimicrobial Chemotherapy, 2015, 70(12): 3345-3352. [15] KIM S A, RHEE M S. Microbicidal effects of plain soap vs triclocarban-based antibacterial soap[J]. The Journal of Hospital Infection, 2016, 94(3): 276-280. doi: 10.1016/j.jhin.2016.07.010 [16] DSIKOWITZKY L, STRÄTER M, ARIYANI F, et al. First comprehensive screening of lipophilic organic contaminants in surface waters of the megacity Jakarta, Indonesia[J]. Marine Pollution Bulletin, 2016, 110(2): 654-664. doi: 10.1016/j.marpolbul.2016.02.019 [17] SMITH A J, McGOWAN T, DEVLIN M J, et al. Screening for contaminant hotspots in the marine environment of Kuwait using ecotoxicological and chemical screening techniques[J]. Marine Pollution Bulletin, 2015, 100(2): 681-688. doi: 10.1016/j.marpolbul.2015.08.043 [18] CAPKIN E, OZCELEP T, KAYIS S, et al. Antimicrobial agents, triclosan, chloroxylenol, methylisothiazolinone and borax, used in cleaning had genotoxic and histopathologic effects on rainbow trout[J]. Chemosphere, 2017, 182: 720-729. doi: 10.1016/j.chemosphere.2017.05.093 [19] SREEVIDYA V S, LENZ K A, SVOBODA K R, et al. Benzalkonium chloride, benzethonium chloride, and chloroxylenol - Three replacement antimicrobials are more toxic than triclosan and triclocarban in two model organisms[J]. Environmental Pollution, 2018, 235: 814-824. doi: 10.1016/j.envpol.2017.12.108 [20] FERGUSON K K, COLACINO J A, LEWIS R C, et al. Personal care product use among adults in NHANES: Associations between urinary phthalate metabolites and phenols and use of mouthwash and sunscreen[J]. Journal of Exposure Science & Environmental Epidemiology, 2017, 27(3): 326-332. [21] PHILIPPAT C, BENNETT D, CALAFAT A M, et al. Exposure to select phthalates and phenols through use of personal care products among Californian adults and their children[J]. Environmental Research, 2015, 140: 369-376. doi: 10.1016/j.envres.2015.04.009 [22] YE X Y, BISHOP A M, REIDY J A, et al. Temporal stability of the conjugated species of bisphenol A, parabens, and other environmental phenols in human urine[J]. Journal of Exposure Science & Environmental Epidemiology, 2007, 17(6): 567-572. [23] LIAO C Y, KANNAN K. Widespread occurrence of benzophenone-type UV light filters in personal care products from China and the United States: An assessment of human exposure[J]. Environmental Science & Technology, 2014, 48(7): 4103-4109. [24] 孙玮奇, 邬春华, 周志俊. 全国性人体生物监测项目研究进展[J]. 职业卫生与应急救援, 2021, 39(2): 230-235. SUN W Q, WU C H, ZHOU Z J. Research progress of national human biological monitoring project[J]. Occupational Health and Emergency Rescue, 2021, 39(2): 230-235 (in Chinese).
[25] 韩林学, 张续, 胡小键, 等. 超高效液相色谱-串联质谱法测定人尿中12种典型个人护理品[J]. 色谱, 2023, 41(4): 312-322. HAN L X, ZHANG X, HU X J, et al. Determination of 12 typical personal care products in human urine by ultra performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Chromatography, 2023, 41(4): 312-322 (in Chinese).
[26] DEWALQUE L, PIRARD C, DUBOIS N, et al. Simultaneous determination of some phthalate metabolites, parabens and benzophenone-3 in urine by ultra high pressure liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography B, 2014, 949/950: 37-47. doi: 10.1016/j.jchromb.2014.01.002 [27] REN L, FANG J Z, LIU G H, et al. Simultaneous determination of urinary parabens, bisphenol A, triclosan, and 8-hydroxy-2’-deoxyguanosine by liquid chromatography coupled with electrospray ionization tandem mass spectrometry[J]. Analytical and Bioanalytical Chemistry, 2016, 408(10): 2621-2629. doi: 10.1007/s00216-016-9372-8 [28] GAVIN Q W, RAMAGE R T, WALDMAN J M, et al. Development of HPLC-MS/MS method for the simultaneous determination of environmental phenols in human urine[J]. International Journal of Environmental Analytical Chemistry, 2014, 94(2): 168-182. doi: 10.1080/03067319.2013.814123 [29] Centers for Disease Control and Prevention, National Center for Environmental Health. Fourth National Report on Human Exposure to Environmental Chemicals[EB/OL]. [2023-04-19]. [30] 黎娟, 乔庆东, 庄景新, 等. 改进的高效液相色谱-串联质谱方法同时测定动物性食品中4种β2-受体激动剂残留[J]. 色谱, 2016, 34(2): 170-175. doi: 10.3724/SP.J.1123.2015.08033 LI J, QIAO Q D, ZHUANG J X, et al. Simultaneous determination of the residues of four β2-agonists in animal foods by modified high performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Chromatography, 2016, 34(2): 170-175 (in Chinese). doi: 10.3724/SP.J.1123.2015.08033
[31] United Stated Environmental Protection Agency. Definition and procedure for the determination of the method detection limit revision 2[EB/OL]. [2022-10-18]. [32] MALAKOOTIAN M, CHAVOSHANI A, HASHEMI M, et al. Concentrations of urinary parabens and reproductive hormones in Iranian women: Exposure and risk assessment[J]. Toxicology Reports, 2022, 9: 1894-1900. doi: 10.1016/j.toxrep.2022.10.001 [33] JALA A, VARGHESE B, DUTTA R, et al. Levels of parabens and bisphenols in personal care products and urinary concentrations in Indian young adult women: Implications for human exposure and health risk assessment[J]. Chemosphere, 2022, 297: 134028. doi: 10.1016/j.chemosphere.2022.134028 [34] ZHAO Y, LIU Y L, CHEN Y N, et al. Exposure to parabens and associations with oxidative stress in adults from South China[J]. Science of the Total Environment, 2021, 774: 144917. doi: 10.1016/j.scitotenv.2020.144917 [35] ZHANG H, LI J X, CHEN Y F, et al. Profiles of parabens, benzophenone-type ultraviolet filters, triclosan, and triclocarban in paired urine and indoor dust samples from Chinese university students: Implications for human exposure[J]. Science of the Total Environment, 2021, 798: 149275. doi: 10.1016/j.scitotenv.2021.149275 [36] YU L J, PENG F D, YUAN D, et al. Correlation study of parabens in urine, serum, and seminal plasma of adult men in Beijing, China[J]. Environmental Science and Pollution Research, 2021, 28(30): 41120-41126. doi: 10.1007/s11356-021-13625-y [37] TAN J H, KUANG H X, WANG C C, et al. Human exposure and health risk assessment of an increasingly used antibacterial alternative in personal care products: Chloroxylenol[J]. Science of the Total Environment, 2021, 786: 147524. doi: 10.1016/j.scitotenv.2021.147524 -



 下载:
下载: