-
近年来,有害藻类大量繁殖导致的水体富营养化现象在世界各国频繁出现[1 − 3]. 水华爆发时,以蓝藻为代表的有害藻类大量消耗水中溶解氧,造成水中其它水生植物、动物死亡,最终影响水环境质量,破坏水生态环境平衡,对人类健康和社会经济造成严重危害[4]. 同时,藻类在死亡过程中释放出的藻毒素和有机质等物质对环境造成二次污染. 因此,控制有害藻华繁殖,防治水体富营养化成为水污染控制的重要议题. 在此背景下,国家和地方在水华频繁爆发的地区制定出台政策文件,旨在控制水体富营养的危害. 国家发展改革委于2021年发布的《关于加强长江经济带重要湖泊保护和治理的指导意见》(发改地区[2021]1617号)明确,到2025年,确保太湖、巢湖地区不发生大面积蓝藻水华导致水体黑臭现象,以确保供水水源安全.
目前,已有多种除藻以及控制水华爆发的技术手段. 传统的治理手段主要包括化学法、物理法和生物法[5]. 化学法采用向水中投加混凝剂、絮凝剂等化学药剂,如CuSO4、Cl2等[6]. 在此过程中可能生成二次污染物,对水体造成不利影响[7]. 物理法采用超声波[8 − 10]、人工捕捞、紫外辐照[11 − 13]等手段,往往成本高且治标不治本,效果无法长期维持. 生物法采用种植沉水植物,改善水生态群落结构的方法,见效缓慢且作用效果不稳定,无法广泛应用[14 − 16]. 鉴于目前已有的除藻手段存在各自的缺陷,寻求一种新型高效环境友好的除藻手段迫在眉睫. 光催化技术是利用自然界中存在的太阳能激发材料产生高活性的自由基等,从而达到去除水中污染物的目的. 之前的研究中,光催化技术已被广泛应用于去除重金属[17]、活性染料[18]、抗生素类药物[19]等污染物,均取得了良好效果[20]. 蓝藻作为一种特殊的水体污染物,在光催化材料的作用下可被完全灭活从而从水体中去除. 同时,对于藻类死亡过程中产生的藻毒素类物质具有良好的协同降解作用,最终达到促进水体自净、恢复水生态平衡的目的. 本文从光催化材料的概念出发,系统梳理了已有的可除藻的光催化材料种类,阐明了光催化除藻的机理,并分析影响材料发挥性能的主要因素,并探讨了溶藻过程中藻毒素等有害副产物的释放与去除,对于现有光催化材料抑藻过程中尚存的不足进行分析,以期为后续研究提供参考和支撑.
-
光催化材料因其高效性,已被广泛用于杀菌消毒,降解难降解污染物等领域. 蓝藻作为一类古老的原核生物,在生理形态上与细菌有诸多相似性,使用光催化材料除藻具有丰厚的理论支撑,并展现出诱人前景[21 − 23]. 该综述包含对现有光催化材料的添加量,作用时间和藻去除率的调研,并特别考察了起作用的活性基团以及材料的可回收性. 表1列出了已有报道的光催化材料种类.
-
传统的半导体光催化材料(如TiO2)只可在紫外光下激发发挥作用,而对藻类的去除需要以阳光为能量来源. 为了满足在太阳光下发挥高效除藻率的特点,现有光催化除藻材料的研究大多是基于可见光进行. 使用贵金属沉积,如Pt、Ag等或非金属元素(如C、N、P元素)与TiO2材料掺杂[62,51,57],可缩窄禁带宽度,将光能的利用扩展到可见光范围. 染料敏化[50]或半导体复合[35]等方式形成异质结也是增强单一材料可见光利用率常用手段. 在目前研究中应用于抑藻的光催化材料种类除TiO2光催化剂之外[24,28,30,37,39,41-42,62-63],还包括氧化物光催化剂[35,61,64],石墨相氮化碳光催化剂[65]、铋基光催化剂[19,38,47]和石墨烯光催化剂[28,33,38]等. 近年来,有关金属有机框架(MOF)材料的新型光催化除藻剂[31,32,36,45]成为新的研究热点. 与传统纳米光催化剂先比,其具有比表面积大、热稳定性好、孔隙率高等有点. 有助于抑制电子-空穴的复合过程. 光催化材料的作用时间从数十分钟到数小时不等,大多数可实现90%以上的除藻效率.
-
传统的光催化材料大都为粉末状,直接投加到水体中易分散,影响其发挥除藻性能. 近年来,越来越多的学者将研究的重点放在开发新型可回收的光催化材料上. 良好的可回收性能有助于提升材料的环境友好特性,使用后不产生二次污染,同时对水生生物及生态环境造成尽可能小的影响. Song等用Al2O3改性的膨胀珍珠岩[47]作为可漂浮载体,将光催化剂负载于其上,在增加对可见光利用率的同时方便材料使用后的回收. 同时,膨胀珍珠岩的物理特性强化了负载材料对铜绿微囊藻的吸附性能. Tu等[38]研究了使用原料环保易得的丝瓜瓤负载rGO/BiOBr光催化材料后的除藻效果. Fan等[55]将AGUN光催化材料负载于自浮涂层海绵上,作为浮动载体,不仅增加了催化剂与藻细胞的有效接触,减少了水相中的能量损失,同时促进了对可见光的利用. 该研究团队还成功将Ag/AgCl@ZIF-8纳米材料负载于聚氨酯海绵[31]上,海绵疏松多孔的特性为纳米材料的结合提供了更多的结合位点,同时良好的亲水性增加了对藻细胞的吸附性能. 海绵中吸附的藻细胞一部分能够从海绵中去除,另一部分在吸附饱和后重新返回到溶液中,最终能够去除99.9%的藻细胞. 负载材料的使用还可以增加光催化剂的循环使用次数. Sun等[60]通过对聚氨酯海绵负载GBA催化剂的循环利用性能进行考察后认为,通过载体负载后的光催化剂至少可被重复回收使用3次. Wang等[24]用膨胀珍珠岩为载体负载F-Ce-TiO2纳米颗粒,借助膨胀珍珠岩优良的吸附性能,在初始1h内可吸附53.7%的铜绿微囊藻,最终除藻率可达98.1%. 此外,使用载体包覆纳米材料可防止材料中的重金属离子在使用过程中的释放. Fan等[45]使用壳聚糖和聚乙烯醇形成的具有3D交联结构的水凝胶对Ag2O/g-C3N纳米材料进行包裹负载,利用材料的可漂浮性能便于使用后的回收,同时防止Ag+的释放对水体造成危害.
除可漂浮基材外,通过掺杂磁性材料的方法,使得制备的光催化剂在使用后可通过外部磁场回收,也是一种提升材料回收性能的方式. Fan等[59]制备的ZnFe2O4/Ag3PO4/g-C3N4材料在可见光下可实现对铜绿微囊藻和MC-LR的同步去除. 除了掺杂含铁化合物外,Serrà等[61]合成的磁性Ni基材料Ni@ZnO@ZnS,其对勃那特螺旋藻和水华鱼腥藻具有良好的去除效果.
-
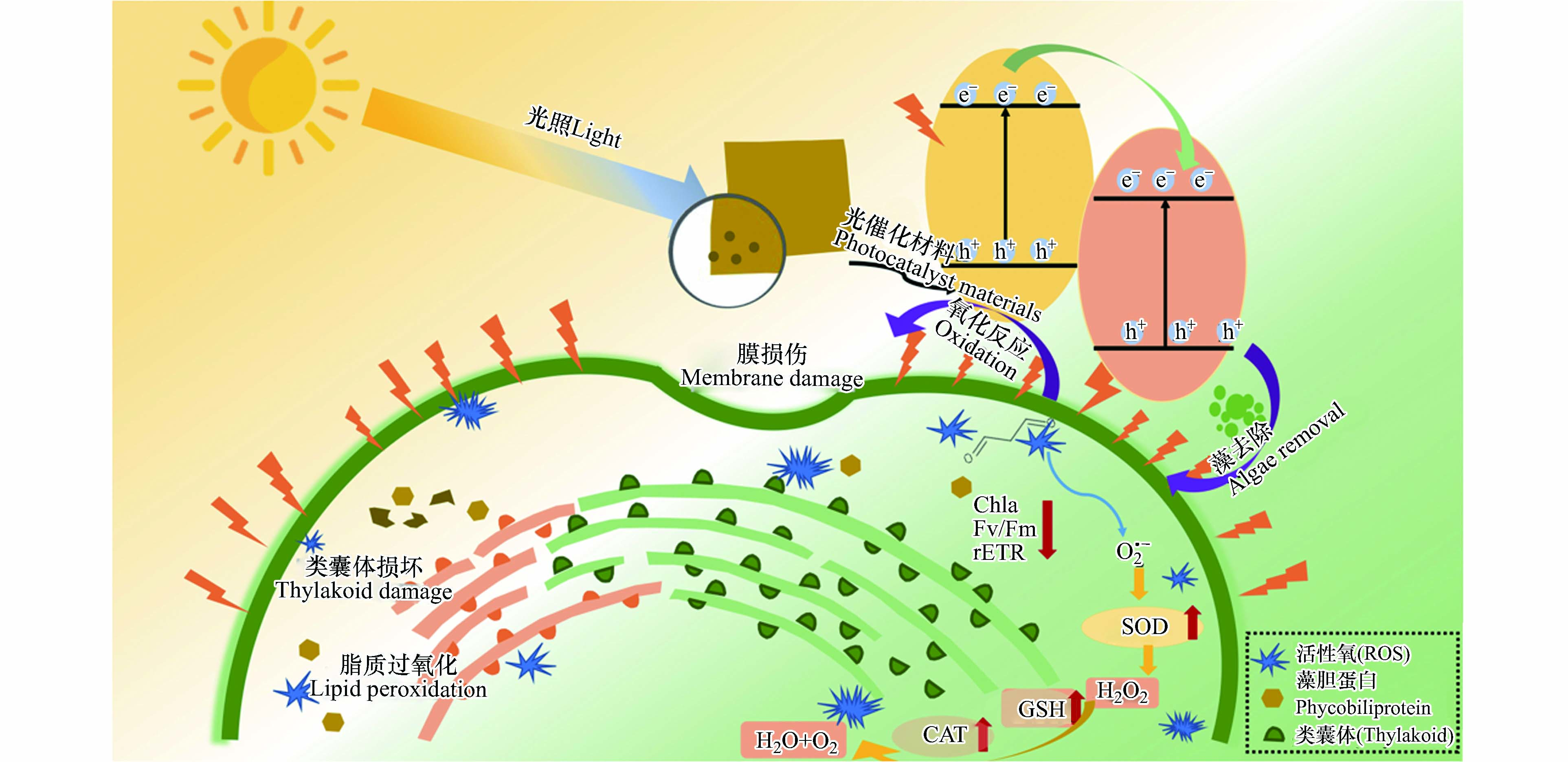
光催化技术基于在光辐照下,半导体材料中价带中的电子被激发跃迁至导带,在价带上留下相对稳定的空穴,从而形成电子-空穴对. 这些电子-空穴具有极强的氧化还原活性,能与水分子及多种离子发生反应生成自由基,进而与体系中的多种物质发生反应,达到降解污染物的目的. 在此过程中,材料表面由于光子激发产生电子跃迁导致大量活性基团的产生,这也是藻细胞最终失活的主因. 以TiO2为基材的光催化材料为例,在光下受到激发生的反应如(1)—(6)所示.
以往的研究发现,·O2−、·OH和h+都是起主要作用的活性基团,可进攻藻细胞,对藻类起杀灭作用(见图1).
-
光催化反应的发生分为在暗处的吸附反应和光下进行的降解反应. Zhou等[37]通过合成N掺杂的黑色TiO2材料,对其在光下的除藻性能进行考察时发现,在最初的1 h中叶绿素a的浓度迅速下降. 这是由于材料本身的吸附性能导致多达30%的藻细胞首先附着到材料表面,由此藻细胞从溶液中分离. 随后的1—8 h内,叶绿素a的含量相对稳定,说明吸附达到饱和后溶液中的藻细胞在此期间内的生长和死亡处于动态平衡状态. 可见,材料本身的吸附特性是光催化材料除藻实验中不可忽视的重要因素.
藻类细胞膜中含有多糖和蛋白质类成分,这也是纳米颗粒与藻细胞间产生相互作用的重要原因[66]. Song等[40]在探究可漂浮型的g-C3N4光催化材料CAE-2除藻效率时发现,暗反应0.5 h内材料对于铜绿微囊藻的吸附率可达到17.3%—24.1%. 在接下来的两次循环实验中,材料的吸附率随之下降,表明材料的吸附性能在多次实验后有所衰减. 对照光反应结束后的除藻率,即使材料在经过多次使用后表面会沉积藻类细胞残片,也并不影响材料的最终除藻性能. 随后考察了吸附作用对的藻细胞光合作用活性变化显示,藻细胞在吸附阶段的光合作用未受影响,可正常进行生命活动. 通过显微镜和流式细胞仪分析进一步证实,在暗反应吸附阶段,藻细胞的细胞结构未遭到破坏. 吸附对于藻细胞的去除只是物理过程,不涉及生化过程的抑制.
众多学者的研究显示,光反应开始初期,藻浓度在一段时间内下降不显著,之后才迅速下降. 针对此现象,Fan等[36]对材料除藻过程进行分析后认为,材料与藻细胞间的相互作用一开始表现为静电相互作用,带负电的藻细胞将材料表面的负电荷转变为正电荷,从而增加了材料对藻的吸附[67],这也有利于之后生成的活性基团攻击材料上的藻细胞. 在最初的数小时内,叶绿素a的浓度缓慢下降,当达到吸附平衡后,藻细胞由于活性氧(ROS)的攻击迅速失活.
-
光催化材料对于藻细胞的破坏是通过氧化胁迫使藻细胞内脂质过氧化产物不断累积,影响细胞膜的选择透过性. 光激发产生的活性氧通过脂质过氧化作用导致膜成分中的磷脂转化为脂质过氧化氢产物,从而进一步生成丙二醛[68]. 现有研究中检测到的多种ROS,如·O2−、·OH等,均对细胞膜具有强烈的破坏作用,并被认为是导致膜系统崩溃的诱因[53,56,59]. 在光催化抑藻的过程中,细胞膜内的丙二醛(MDA)含量上升以适应环境胁迫造成的损伤,而最终过量的ROS累积反而导致MDA含量的下降[26]. 藻细胞抵抗氧化胁迫的过程会造成细胞的脂质过氧化反应,生成的过氧化产物,如MDA,其含量累积标志着细胞氧化损伤程度高低[6]. Gu等[37]的研究确认了Cu2O纳米颗粒在暗反应时使胞内脂质过氧化产物MDA含量明显增加,在光的作用下产生的氧化胁迫使得MDA增加更多. 这表明材料本身产生的铜离子即可使藻细胞产生氧化应激反应,而在光下通过自由基产生的氧化胁迫进一步加剧对细胞的损伤. 过多的ROS会促进超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等酶活性升高,SOD将ROS转变为H2O2,在CAT的作用下H2O2进一步生成无毒的H2O和O2[69]. 抗氧化酶活性的升高表明,光催化材料产生的自由基开始对藻细胞的生理活动造成影响,抗氧化防御系统被激活从而清除细胞内多余的ROS. Fan等[32]合成的MOF材料在可见光下激发产生自由基的进攻使得铜绿微囊藻细胞中SOD和CAT含量在短时间内迅速上升,直到藻细胞衰亡时都维持在较高水平. Qi等[43]的研究发现,添加了Zn掺杂的Fe3O4颗粒作为实验组的SOD活性值从0.37×10−6 U·cell−1升至最高0.89×10−6 U·cell−1. 他们推测,SOD含量水平反映了藻细胞生理活性以及抵抗外部氧化胁迫的能力. 当细胞SOD活性处于较高水平时,说明此时细胞拥有较强的抗氧化能力并能维持自身的完整性;当SOD活性下降时,细胞丧失防御能力而出现损坏. 除此之外,SOD活性的变化与藻类去除率具有一致性,这表明藻类去除率是由光催化过程中细胞的抗氧化能力决定的. Fan等研究发现,过量的ROS经SOD催化转化生成的H2O2过多,超过了CAT可承受的限制,反而会抑制CAT的活性[55,59].
非酶类的还原型谷胱甘肽(GSH)也是衡量细胞受氧化胁迫程度大小的指标. 在ROS的作用下,GSH含量呈现先增加后下降的趋势[26]. 而GSH作为辅助CAT的因子,在清除ROS的过程中自身被消耗生成氧化型谷胱甘肽(GSSG). 当GSH的含量过低时,CAT的催化能力也将受到限制[70]. 过量的ROS往往导致抗氧化系统的失活,抗氧化酶无法抵御ROS长时间的攻击. 膜系统的承载力也有限,在长期不利的环境条件下,细胞膜结构和细胞器膜组成中的多糖和蛋白质等成分被破坏,最终导致藻细胞失活[60].
另一方面,纳米级的材料颗粒直接附着在细胞膜表面,造成细胞膜破裂. 此外,在纳米颗粒大小小于细胞壁上孔径的情况下,纳米颗粒可直接通过胞吞作用或经由细胞膜上载体蛋白和离子通道进入细胞质中,对细胞膜结构和细胞器造成破坏[71 − 72]. Zhou等[37]制备的N掺杂黑色TiO2材料会附着在藻细胞表面,这可能是促使藻细胞破裂死亡的原因之一. 扫描透射电镜显示,未经处理的藻细胞是光滑饱满的球体,在光催化剂的作用下逐渐变形、皱缩,最终破裂. Pinho等[42]观察到,TiO2催化剂会吸附在铜绿微囊藻粘液囊外部,在黑暗时不会对细胞造成明显损伤,而在紫外光激发下,细胞则出现明显变形.
细胞膜作为藻细胞的屏障,其上存在的胞外聚合物(EPS)可作为自由基清除剂保护藻细胞不受ROS损害,Fan等[65]探究了细胞膜表面EPS对于藻细胞灭活的影响后发现,在EPS的作用下,Ag2O/g-C3N4催化剂中Ag+的释放减半,金属毒性随之减弱.
细胞膜受到损伤后的选择透过性发生变化,胞内离子流出. 因此Fan等[36]认为离子释放量可被视为衡量细胞膜损害的重要指标之一. 在添加光催化剂反应6 h后,K+,Ca2+和Mg2+的释放比例分别达到97.18%、88.92%和20.42%. 大量的K+和Mg2+在第一个小时被释放,表明藻类细胞膜在1 h内已经损坏. K+和Mg2+的释放量在6 h接近100%,代表藻类细胞膜几乎全部破坏. 在另一份研究中[34],他们同时研究了离子释放与细胞形态之间的关系. 结果表明,随着离子从胞内释放量增加,细胞膜变形破裂,细胞质流出. Sun等[60]认为Ca2+和Mg2+是细胞壁中脂多糖的重要成分,在使用GBA漂浮型催化剂处理铜绿微囊藻11 h后,藻细胞中Ca2+和Mg2+的大量释放表明从而影响了细胞膜的通透性,间接证实了细胞结构的破坏.
-
藻类依靠光合作用为自身生长繁殖提供能量,光催化材料对光合系统的损伤可以切断藻类生长的能量来源,抑制藻的多种生理活动. 对于光和系统损害情况的研究是光催化材料促使藻细胞凋亡的重要机理之一. 研究中常测量叶绿素a色素含量的变化、相对电子传输速率rETR和光和效率Fv/Fm的数值定量表征光和系统受损程度. Zhou等认为,叶绿体是光合作用中最重要的色素,在光催化过程中常成为催化剂的活性位点被破坏[73],因此其含量下降与藻细胞受损程度直接相关[57]. Wang等[30]发现,使用PDDA改性的NPT-EGC光催化材料使藻类rETR、叶绿素a浓度和最大量子产量明显下降,光合系统受到损伤. 这一过程加速了藻细胞的衰亡. 他们的另一份研究也指出,光照本身就会使藻细胞光和系统的rETR下降,N\P掺杂TiO2材料在光激发下释放出的活性基团增强了其下降的程度[62].
光催化材料产生的遮蔽效应也会降低藻细胞对光的利用率,从而直接造成光合作用的抑制[74],而过量的材料则会影响光催化材料的性能. Fan等[32]通过Ag/AgCl@ZIF-8的MOFs材料去除铜绿微囊藻的研究,发现当催化剂的添加剂量小于10 mg·L−1时,藻去除率随材料剂量增加而逐渐增长,在6 h时可去除90%藻类,达到最优效果;当材料剂量超过10 mg·L−1达到50 mg·L−1时,藻去除率反而下降,在6 h时只能去除60%藻类. 造成此现象的可能原因是过多的材料剂量使得光的透过性变差,影响光催化的总体性能. Yang等[75]的研究也证实了,过量的TiO2会引起团聚和沉淀,这可能会导致其与基态催化剂的碰撞而使活化的TiO2颗粒失活.
细胞中的蛋白质是维持生命活动和各项生理功能的重要成分. 光催化材料产生的ROS通过进攻氨基酸侧和破坏肽链结构的方式,直接破坏藻细胞中蛋白质的功能[76]. 藻胆蛋白(PBPs)作为藻细胞中可溶性蛋白占比60%的蛋白成分,对细胞光合作用的进行和生理功能的维持发挥重要作用. 藻胆蛋白包含别藻蓝蛋白(APC)、藻蓝蛋白(PC)、藻红蛋白(PE)等,藻胆蛋白的破坏阻碍藻细胞对光能的捕获合输送,直接导致光合作用的抑制[77 − 78],并导致藻类失活[45,55,79]. Fan等研究发现,Ag/AgCl@ZIF-8纳米材料的投加导致藻细胞中可溶性蛋白含量下降为对照组的15.3%[31]. 包含别APC、PC、PE等在内的藻胆蛋白的破坏导致藻类失活[45,55,79]. 同时,Liu等研究也发现,BiOCl0.6I0.4/ZnO的加入导致铜绿微囊藻中APC、PE、PB的含量迅速下降并趋近平缓[80]. PBPs的降解损害多种细胞器并抑制生命活动的进行,从而促使藻细胞凋亡. 此外,叶绿体类囊体薄膜上光合蛋白也易受ROS进攻,从而导致电子传输的中断[81]. 图2详细描述了光催化材料灭活藻细胞的机理.
-
在光催化材料产生的自由基作用下,藻细胞裂解死亡. 此过程常伴随胞内物质的释放,包括藻毒素和有机质等. 副产物的释放加剧水体的污染状况. 因此,现有研究常需考察光催化材料对除除藻过程有害副产物的协同去除情况.
-
藻毒素是一种由藻类释放,具有高稳定性、高毒性、难降解的环状七肽化合物. 其累积可造成人类肝损伤、神经麻痹,对水生生物也有潜在危害[82]. 藻毒素可随食物链、食物网迁移累积,最终进入人体或饮用水中,对人类健康造成威胁[83]. 藻华爆发的过程中,随着藻类的生长繁殖及死亡,藻类释放的藻毒素不断进入水体[84]. 使用光催化除藻手段使藻细胞裂解死亡时,也伴随着大量藻毒素的释放. 因此,对于藻类被光催化材料去除过程中藻毒素的释放与降解也是研究的重要一环,旨在达到去除有害藻类协同脱除藻毒素的目的. Jin等[39]对了N-TiO2材料对拟柱孢藻和柱孢藻毒素的降解的研究揭示了藻毒素释放快慢与细胞受损程度间的关系,初始时由于藻细胞形态完好,柱孢藻毒素释放降解较为缓慢. 随着藻细胞裂解程度的加深,12 h后大量藻毒素由胞内释放到胞外,胞内藻毒素浓度下降而胞外藻毒素浓度上升,藻毒素降解速度加快.
光激发产生的ROS常进攻Adda侧链上的甲氧基、芳香环结构或碳碳双键,使其发生断裂或脱羧、脱酰、羧基化等反应[33]. 值得注意的是,MC-LR在降解过程中由于氨基酸支链的结构稳定,ROS的进攻很难将其完全矿化为小分子有机物. 但该过程中藻毒素的毒性也会降低,从而减小其环境危害性[85]. Wang等[30]研究了使用PDDA改性后的TiO2材料除藻的同时对藻毒素的降解路径. 他们发现材料在可见光激发下产生的活性基团可攻击藻毒素分子中的Adda侧链,并脱去谷氨酸、丙氨酸等基团,揭示了藻毒素质荷比由995.6下降到835.4的可能途径. 最终,使用0.2PDDA@NPT-EGC的光催化材料可在6 h后降解几乎100%的藻毒素. 这充分说明光催化技术具有灭藻细胞的同时降解产生的藻毒素的功能. 他们的研究也证实,藻细胞存在对藻毒素的降解效率也存在影响,这可能是由于MC-LR与藻细胞之间对光催化活性位点存在竞争关系. Fan等[34]研制的AGON光催化材料在120 min内可降解0.5 mg·L−1的MC-LR,而当体系中同时存在藻细胞与MC-LR时,8 h后的降解率只有91.2%. 同时,MC-LR的存在对于铜绿微囊藻的去除也存在抑制作用. 此外,Pelaez等[86]发现,同种材料对微囊藻毒素的不同亚型之间的降解率也有显著差异,相同时间内MC-LR的降解程度高于MC-RR.
-
溶解性有机质(dissolved organic matter, DOM)是一种广泛存在于水体环境中的复杂有机质,由脂肪族和芳香族以及多种含有羟基、羧基和氨基等官能团组成的有机物连续体或混合体. 水体中的DOM来源包括动植物残体腐败、藻类代谢产生的排泄物[87]. DOM能够与水体中重金属相互作用,影响营养盐释放,且可影响水体中微量金属离子的形态、毒性和迁移转化过程[88],在水域生态系统和生物地球化学循环过程中起重要作用[89]. DOM可分为胞外溶解性有机质(EDOM)和胞内溶解性有机质(IDOM). 在光催化除藻的过程中,藻类膜结构破坏,IDOM释出,EDOM含量提升. 目前研究多针对EDOM和IDOM的转化和藻死亡后EDOM的去除. Wang等[24]细致研究了F-Ce-TiO2/EP450除藻过程中胞外溶解性有机质(EDOM)与胞内溶解性有机质(IDOM)的含量变化情况. 结果显示EDOM包含的两个主峰中其中一个强度显著降低,说明EDOM得到部分去除;而另一个峰强度增加,说明IDOM随细胞破裂释出转化为EDOM. IDOM的峰强则未发生显著变化.
藻细胞表面带负电荷,其zeta电位呈现负值,而释放出的EDOM会附着在藻细胞表面,这会抑制藻细胞的灭活过程[90]. Zhou等[37]发现,藻类死亡初期释放的DOM包括蛋白质类物质、富里酸和腐殖酸等. 初期藻细胞破裂时DOM释出,随后在大量活性基团的作用下得到一定程度的降解. 仍有一部分DOM留存于水体中无法被彻底降解,后续产生的环境影响以及与其它污染物质相互作用机制尚待研究. Fan等[31.55,59]指出,IDOM的成分主要为芳香族蛋白质(如酪氨酸和色氨酸等),EDOM中的成分为腐殖酸和富里酸. IDOM的释放导致蛋白质类物质转化为富里酸和腐殖酸类物质. 相比于蛋白质类物质,腐殖酸和富里酸类物质更易被降解. 经过光催化材料作用后,其主要特征峰强度均减弱,而最终并未完全去除. 这说明只依靠ROS的作用,很难将EDOM彻底去除. 但在ROS的作用下,EDOM含量通常比藻华爆发时更低. 使用氧化剂(如臭氧[91]和高铁酸钾氧化[92])或电渗析法[93]可进一步去除水体中残留的EDOM.
-
光催化材料自身性质是影响光催化效果的首要因素. 以目前研究广泛的TiO2光催化材料为例,锐钛矿和金红石是常见的两种TiO2. 一般认为,金红石具有相对稳定的热力学稳定性,而锐钛矿作为亚稳定形态,具有最佳的光催化活性[94]. 因此研究中多围绕锐钛矿TiO2进行. Zhou等[37]在N2气氛中煅烧制得黑色或蓝色TiO2. 相比于一般的黄色TiO2而言,黑色TiO2具有不同的纳米粒子的结构、化学、电子以及光学性质,同时具有结构和化学缺陷、更强的导电性和更窄的禁带宽度. 目前的研究中常采用掺杂的方式对单一光催化材料性能进行改良,将光能的利用范围从紫外光区扩展到可见光区,同时提升光生电子和空穴的分离效率,减少复合率,提高除藻效率的同时也极大增加了实际应用的可行性. Song等[41]合成的g-C3N4/TiO2可漂浮型光催化材料对铜绿微囊藻和MC-LR表现出极高的吸附和降解效率.
-
水体中藻细胞密度对于光催化材料的去除效率也有重要影响. 已有研究表明,不同的初始藻密度对于金属或纳米颗粒的毒性效应有影响[95,96]. Sun等[60]的研究发现,在高浓度和低浓度的藻密度条件下,光催化材料均不能发挥最佳除藻性能. 当藻密度过低时,藻细胞与纳米颗粒间的有效接触减少,这延缓了藻细胞的灭活速率. 而当藻密度过高时,材料产生的ROS对应过多的藻细胞而减弱. 且当藻密度过高时,大量藻细胞将材料颗粒包裹覆盖,降低了材料对光能的利用效率. 同时,过多的藻细胞也了光在水中的传播,不利于材料发挥最佳性能. Wang等[28]的研究表明,当高浓度的藻细胞抑制了材料除藻的性能,可通过延长材料作用时间以达到相同的除藻率. 藻细胞浓度为2.7×106 cell·mL−1时需3 h达到去除效果,而当藻细胞浓度为5.2×106 cell·mL−1时则需9 h.
-
水体中的天然有机物(NOM)等腐殖质类物质对光催化效率也有影响. NOM的存在一方面增加了水体浊度,减小透光度[97],且易吸附在纳米材料表面,影响其光催化特性. 另一方面,Ren等[98]研究表明,腐殖质类物质和藻细胞之间竞争光催化材料表面的活性位点,影响藻类去除. Fan等[34]考察腐殖质中两类主要成分HA(腐殖酸)和FA(富里酸)对光催化效率的影响,在投加了10 mg·L−1的腐殖酸和富里酸后,Ag2CO3-N:GO的除藻率有所下降,然而6 h后藻去除率均达到100%. 当剂量为5 mg·L−1时,实验组中加入HA和FA的藻类细胞的去除率在5 h结束时分别为89%和97%. 随着NOM剂量的增加,藻细胞去除效率进一步降低,同时加入HA和FA的实验组藻类细胞的去除率降至68%和90%. 其中,HA对材料的抑制率比FA更为显著,这可能是由于HA比FA拥有更小的分子量和更高的O/C比,因此FA更容易被氧化. 而HA需要更长的时间和更多的ROS降解[99]. Jeong等[100]的研究表明,FA和HA的存在对于MC-LR的降解具有抑制作用. Tu等[38]发现,DOM的降解过程伴随着总有机碳(TOC)含量的下降,这与藻细胞的死亡过程生物质的消减相呼应.
-
在体系中加入一定浓度的H2O2也有利于增加材料产生ROS的效率和强度. Zhang等[51]研究发现,通过添加H2O2促进了b-N-TiO2/C纳米材料对藻细胞叶绿素a的降解,同时避免了除藻过程中的反应滞后阶段. Wang等[53]的研究发现,以40 μL作为最适剂量添加H2O2,S-CN材料对将铜绿微囊藻的灭活时间从3.5 h缩短到1.5 h. 这可能是由于H2O2可与自由电子反应,从而阻止电子-空穴的复合,增强·OH的生成和作用效果.
-
除此之外,不同藻种和藻毒素种类也会影响光催化材料除藻效率. Jin等[39]发现拟柱孢藻及其产生的柱孢藻毒素相比于铜绿微囊藻及其产生的微囊藻毒素更难降解. 这可能是由于拟柱孢藻在降解过程中先在ROS进攻下分解成更短的细丝,随后长度不断缩短最终破碎. 由于拟柱孢藻相对难降解的特性,在治理由此类藻爆发的水华灾害时将会面临更大的挑战.
Regulska等[101]认为,在工程项目中应用光催化降解污染物的难题主要来自于水体中复杂组分对光能捕获的干扰和对ROS的竞争. 实际水体中所含有机污染物成分和较高的盐离子浓度会抑制光催化材料的有效性[102],一些高盐度水体中所含的卤素离子(如Br-、Cl-)可与ROS反应以此竞争活性位点[103],从而削弱对藻类的去除作用. 水体的pH也是制约光催化剂除藻的重要条件. Fan等[50]的研究发现,酸性和碱性条件下Ag/AgCl@g-C3N4@UIO-66对铜绿微囊藻的抑制率均高于中性时. 这可能由于藻细胞表面带负电荷,当pH呈酸性时,静电相互作用更强,催化剂与藻细胞更好地接触,有利于增强光催化去除率. 当pH呈碱性时,OH-和h+间反应生成·OH. 这均有利于藻细胞的灭活.
-
本文在系统梳理已有光催化材料抑藻研究的基础上,阐明了材料发挥抑藻效能的机理. 现有的光催化除藻技术在抑藻率和对有害副产物的协同去除上展出了良好的应用前景. 凭借高效的除藻率,广泛的适用范围和低能耗的特点,将成为未来极具潜力的新型除藻方式. 这有助于解决我国长期存在的河湖富营养化问题. 但在目前实际工程的运用中,还存在以下问题待解决:(1)传统的光催化剂多为粉末状,这有利于投加到水体当中可均匀分散从而提高光催化效率,同时这也给材料的回收造成不便. 分散在水体中的材料可能会带来二次污染等问题. (2)部分研究中贵金属作为掺杂剂(如珀、银等),这些贵重金属离子在使用过程中存在释放问题,造成二次污染. 此外,贵金属(如珀、银)等的掺杂会增加光催化材料的成本,不利于其在富营养化水体中应用. 实际的富营养化水体往往面积较大,项目施工时需全面覆盖. 使用二氧化钛、石墨烯氮化碳等为基材的光催化材料则可大幅降低材料的合成成本,在大范围富营养化水体的施工应用中具有显著优势. (3)富营养化水体中常存在的重金属离子及其它有机污染物、营养盐等组分,对于光催化材料发挥效率的影响尚未完全清晰. (4)对于除藻过程中释放的有害副产物(如NOM等)的协同去除仍待探究.
综上,今后的研究可重点侧重于:(1)依托环保易回收的载体,提升材料抑藻效率的同时避免对环境产生次生危害. (2)避免贵金属掺杂剂的使用,在降低光催化抑藻材料成本的同时,可避免重金属离子的释放. 寻找抑藻效率与材料成本的最佳平衡点,为实际水体中大范围应用提供可能. (3)关注材料除藻过程中多种典型污染物以及有害副产物的协同净化效果,为净化水环境,恢复水生态平衡提供良好基础.
光催化抑藻材料的研究进展
Advances in photocatalytic materials for algae inhibition
-
摘要: 水体富营养化引起有害藻华爆发,严重危害了全球人类健康和生态环境. 这一难题困扰了湖泊生态环境保护的研究者们几十年,但目前各项传统除藻手段仍存在一定不足,亟需在此基础上引入各种新技术. 光催化技术凭借高效清洁、环境友好、操作简单等优势,在控制水体富营养化和抑制有害蓝藻水华爆发方面具有一定的应用前景. 本文综述了近年来光催化材料去除有害藻华爆发的研究进展,阐明了光催化技术的抑藻机理,强调了除藻过程中藻毒素类污染物质的释放与去除问题,最后总结了光催化抑藻的关键限制性条件,指出了该技术在应用推广中要关注的因素,并对未来光催化材料强化水生态自净能力的研究方向进行展望.Abstract: The eutrophication induced by harmful algal blooms has seriously endangered human health and ecological environment worldwide. It is a challenge that has plagued researchers for decades in the research direction of lake ecology and environment restoration. In the context of the existing algae removal methods, photocatalytic technology, with its advantages of high efficiency, cleanliness, environmental friendliness, and simplicity of operation, has some prospects for application in controlling harmful algal blooms and eutrophication. Therefore, this study reviews the research progress of photocatalytic materials for removing harmful algae in recent years, clarifies the mechanism of algae inhibition by photocatalytic materials, and emphasizes the release and removal of toxic pollutants in the process of algae removal. Finally, we summarize the crucial limiting factors of photocatalytic materials for algae inhibition, point out the remaining shortcomings in the application and promotion of this technology. We hope this review provides an outlook on the future research of photocatalytic materials to enhance the self-purification ability of aquatic ecology.
-
Key words:
- photocatalysis /
- nanomaterials /
- water eutrophication /
- algae removal.
-

-
表 1 现有光催化材料除藻性能及特性研究
Table 1. Research on the performance and characteristics of photocatalytic materials for algae removal
材料名称
Photocatalyst去除藻种
Algae species光源类型
Light source添加量
Dosage时间
Inactivation time去除率
Inactivation efficiency活性基团
ROS是否可回收
Recyclability参考文献
ReferenceF-Ce-TiO2/EP450 铜绿微囊藻 可见光 4 g·L−1 9 h 98.1% ·OH、h+、·O2- 是 [24] Zn-Fe LDHs 铜绿微囊藻 可见光 0.3 g·L−1 2.5 h 80.6% — 否 [25] Sg-Bi2Mo3O12 铜绿微囊藻 可见光 1 g·L-1 4 h >84% ·O2− 否 [26] Cp-Bi2Mo3O12 铜绿微囊藻 可见光 1 g·L−1 4 h 52% ·O2− 否 [26] B-SiO2@TiO2 野外绿藻 可见光 5 g·L−1 8.5 h 100% — 是 [27] AP-EGC-CT5 铜绿微囊藻 可见光 2 g·L−1 2 h 98.5% h+ 否 [28] NPT-EGC450 铜绿微囊藻 可见光 2 g·L−1 9 h 98.15% h+ 是 [29] 0.2PDDA@NPT-EGC 铜绿微囊藻 可见光 2 g·L−1 9 h 92.6% h+ 是 [30] Ag/AgCl@ZIF-8 sponge sponge 铜绿微囊藻 可见光 — 6 h 99.9% ·O2− 是 [31] Ag/AgCl@ZIF-8 铜绿微囊藻 可见光 10 g·L−1 6 h 93.1% ·O2− 否 [32] Ag2CO3-GO 铜绿微囊藻 可见光 0.1 g·L−1 9 h 100% ·OH、·O2- 否 [33] Ag2CO3-N:GO coating-4 铜绿微囊藻 可见光 4 g·L−1 5 h 100% ·O2− 是 [34] SnO2- montmorillonite 铜绿微囊藻 紫外光 0.3 g·L−1 1 h 95% — 否 [35] Ag2O/g-C3N4 铜绿微囊藻 可见光 0.05 g·L−1 6 h
99.94% ·O2− 否 [36] N掺杂黑色TiO2-N2(500℃) 铜绿微囊藻 可见光 0.2 g·L−1 12 h 99.09% ·O2−、·OH 否 [37] rGO/BiOBr 铜绿微囊藻 可见光 — 3 h 99% ·O2−、h+ 是 [38] N-TiO2 拟柱孢藻/铜绿微囊藻 可见光 0.2 g·L−1 20 h/14 h 100%/100% — 否 [39] 漂浮g-C3N4 铜绿微囊藻 可见光 2 g·L−1 6 h
74.7% ·O2−、·OH 是 [40] ZnO纳米颗粒 铜绿微囊藻 可见光 35 g·L−1 2 h 98% — 否 [41] g-C3N4/TiO2 铜绿微囊藻 可见光 2 g·L−1 6 h 88.1% ·OH、h+ 是 [41] TiO2 铜绿微囊藻 紫外光 0.2 g·L−1 — 100% — 否 [42] Zn掺杂的Fe3O4 铜绿微囊藻 可见光 0.05 g·L−1 6 h 96% — 否 [43] Ca-Ag3PO4 微绿球藻
可见光 0.9 g·L−1 12 h 96% ·OH 否 [44] Ag2O/g-C3N4 水凝胶 铜绿微囊藻 可见光 1 g·L−1 5 h 98.6% ·O2−、·OH 是 [45] Ag/AgCl@LaFeO3 铜绿微囊藻 可见光 50 mg·L−1 2 h >90% ·O2−、·OH 否 [46] g-C3N4/Bi-TiO2 铜绿微囊藻 可见光 — 6 h 75.9% ·OH、h+ 是 [47] Ag2O@PG 铜绿微囊藻 可见光 0.2 g·L−1 5 h 99.1% ·O2−、h+、·OH 否 [48] g-C3N4-MoO3 铜绿微囊藻 可见光 0.3 g·L−1 3 h 97% ·O2−、·OH 否 [49] Ag/AgCl@g-C3N4@UIO-66 铜绿微囊藻 可见光 30 g·L−1 3 h 99.9% ·O2−、h+、·OH 否 [50] b-N-TiO2/C 铜绿微囊藻 可见光 0.2 g·L−1 12 h 92.7% ·O2−、·OH 否 [51] F- TiO2 铜绿微囊藻 太阳光 0.75 g·L−1 8 h 97.5% ·O2−、h+、·OH 否 [52] 硫酸剥离的g-C3N4 铜绿微囊藻 可见光 0.3 g·L−1 3.5 h 92% h+、·OH 否 [53] Ag2CrO4-g-C3N4-TiO2/mEP 铜绿微囊藻 可见光 2 g·L−1 8 h 81.88% ·O2−、h+、·OH 是 [54] AGUN自浮泡沫 铜绿微囊藻 可见光 1 g·L−1 3 h 98% ·O2−、h+、·OH 是 [55] 改性TiO2/Ag3PO4 拟柱孢藻 可见光 0.3 g·L−1 5 h 91.75% ·O2− 否 [56] TiO2/Ag3PO4 铜绿微囊藻 可见光 0.2 g·L−1 8 h 95.0% ·O2 否 [57] Bi2O3@Cu-MOF 米氏凯伦藻 可见光 60 g·L−1 4 h 96.35% ·O2−、·OH 否 [58] ZnFe2O4/Ag3PO4/g-C3N4 铜绿微囊藻 可见光 100 g·L−1 3 h 96.33% ·O2−、·OH 是 [59] g-C3N4@Bi2MoO6@AgI 铜绿微囊藻 可见光 — 5 h >95% ·O2− 是 [60] Ni@ZnO@ZnS 勃那特螺旋藻、
水华鱼腥藻可见光 0.6 g·L−1 10—35 min 100% — 是 [61] “—”无数据. -
[1] HUANG C C, WANG X L, YANG H, et al. Satellite data regarding the eutrophication response to human activities in the Plateau Lake Dianchi in China from 1974 to 2009[J]. Science of the Total Environment, 2014, 485/486: 1-11. doi: 10.1016/j.scitotenv.2014.03.031 [2] O’NEIL J M, DAVIS T W, BURFORD M A, et al. The rise of harmful cyanobacteria blooms: The potential roles of eutrophication and climate change[J]. Harmful Algae, 2012, 14: 313-334. doi: 10.1016/j.hal.2011.10.027 [3] 李昂臻, 陈思旭, 李海燕, 等. 北方某省会城市主要水库富营养化程度、特征和防治对策[J]. 环境化学, 2020, 39(9): 2529-2539. doi: 10.7524/j.issn.0254-6108.2020040902 LI A Z, CHEN S X, LI H Y, et al. Characteristics and evaluation of eutrophication in major reservoirs of a northern city in China[J]. Environmental Chemistry, 2020, 39(9): 2529-2539 (in Chinese). doi: 10.7524/j.issn.0254-6108.2020040902
[4] SARAF S R, FRENKEL A, HARKE M J, et al. Effects of Microcystis on development of early life stage Japanese medaka (Oryzias latipes): Comparative toxicity of natural blooms, cultured Microcystis and microcystin-LR[J]. Aquatic Toxicology, 2018, 194: 18-26. doi: 10.1016/j.aquatox.2017.10.026 [5] SUN R, SUN P F, ZHANG J H, et al. Microorganisms-based methods for harmful algal blooms control: A review[J]. Bioresource Technology, 2018, 248: 12-20. doi: 10.1016/j.biortech.2017.07.175 [6] ZHOU S Q, SHAO Y S, GAO N Y, et al. Effects of different algaecides on the photosynthetic capacity, cell integrity and microcystin-LR release of Microcystis aeruginosa[J]. Science of the Total Environment, 2013, 463/464: 111-119. doi: 10.1016/j.scitotenv.2013.05.064 [7] 张小磊, 苍岩, 宋伟, 等. 二氧化氯预氧化含藻水过程中副产物的生成规律[J]. 环境化学, 2019, 38(2): 306-316. doi: 10.7524/j.issn.0254-6108.2018040203 ZHANG X L, CANG Y, SONG W, et al. By-product formation in algae-containing water pre-oxidized by chlorine dioxide[J]. Environmental Chemistry, 2019, 38(2): 306-316 (in Chinese). doi: 10.7524/j.issn.0254-6108.2018040203
[8] RAJASEKHAR P, FAN L H, NGUYEN T, et al. Impact of sonication at 20 kHz on Microcystis aeruginosa, Anabaena circinalis and Chlorella sp[J]. Water Research, 2012, 46(5): 1473-1481. doi: 10.1016/j.watres.2011.11.017 [9] LIN Z, XU Y F, ZHEN Z, et al. Application and reactivation of magnetic nanoparticles in Microcystis aeruginosa harvesting[J]. Bioresource Technology, 2015, 190: 82-88. doi: 10.1016/j.biortech.2015.04.068 [10] PARK J, SON Y, LEE W H. Variation of efficiencies and limits of ultrasonication for practical algal bloom control in fields[J]. Ultrasonics Sonochemistry, 2019, 55: 8-17. doi: 10.1016/j.ultsonch.2019.03.007 [11] OU H S, GAO N Y, DENG Y, et al. Immediate and long-term impacts of UV-C irradiation on photosynthetic capacity, survival and microcystin-LR release risk of Microcystis aeruginosa[J]. Water Research, 2012, 46(4): 1241-1250. doi: 10.1016/j.watres.2011.12.025 [12] JIA P L, ZHOU Y P, ZHANG X F, et al. Cyanobacterium removal and control of algal organic matter (AOM) release by UV/H2O2 pre-oxidation enhanced Fe(II) coagulation[J]. Water Research, 2018, 131: 122-130. doi: 10.1016/j.watres.2017.12.020 [13] WAN Y, XIE P C, WANG Z P, et al. Comparative study on the pretreatment of algae-laden water by UV/persulfate, UV/chlorine, and UV/H2O2: Variation of characteristics and alleviation of ultrafiltration membrane fouling[J]. Water Research, 2019, 158: 213-226. doi: 10.1016/j.watres.2019.04.034 [14] QIN H J, ZHANG Z Y, LIU H Q, et al. Fenced cultivation of water hyacinth for cyanobacterial bloom control[J]. Environmental Science and Pollution Research, 2016, 23(17): 17742-17752. doi: 10.1007/s11356-016-6799-6 [15] ZHANG H L, CHEN A W, LI J L, et al. Control of Microcystis (Cyanobacteria) using the fruit of Macleaya cordata: From laboratory experiment to in situ field test[J]. Phycologia, 2017, 56(4): 382-389. doi: 10.2216/16-87.1 [16] ZENG G M, ZHANG R, LIANG D, et al. Comparison of the advantages and disadvantages of algae removal technology and its development status[J]. Water, 2023, 15(6): 1104 doi: 10.3390/w15061104 [17] GAO X Y, MENG X C. Photocatalysis for heavy metal treatment: A review[J]. Processes, 2021, 9(10): 1729. doi: 10.3390/pr9101729 [18] PRIYA A, SENTHIL R A, SELVI A, et al. A study of photocatalytic and photoelectrochemical activity of as-synthesized WO3/g-C3N4 composite photocatalysts for AO7 degradation[J]. Materials Science for Energy Technologies, 2020, 3: 43-50. doi: 10.1016/j.mset.2019.09.013 [19] QIN K N, ZHAO Q L, YU H, et al. A review of bismuth-based photocatalysts for antibiotic degradation: Insight into the photocatalytic degradation performance, pathways and relevant mechanisms[J]. Environmental Research, 2021, 199: 111360. doi: 10.1016/j.envres.2021.111360 [20] YU M L, WANG J J, TANG L, et al. Intimate coupling of photocatalysis and biodegradation for wastewater treatment: Mechanisms, recent advances and environmental applications[J]. Water Research, 2020, 175: 115673. doi: 10.1016/j.watres.2020.115673 [21] SUN S Q, TANG Q X, XU H, et al. A comprehensive review on the photocatalytic inactivation of Microcystis aeruginosa: Performance, development, and mechanisms[J]. Chemosphere, 2023, 312: 137239. doi: 10.1016/j.chemosphere.2022.137239 [22] YANG Y, CHEN H, LU J F. Inactivation of algae by visible-light-driven modified photocatalysts: A review[J]. Science of the Total Environment, 2023, 858: 159640. doi: 10.1016/j.scitotenv.2022.159640 [23] XU D Y, LI G, DONG Y L, et al. Photocatalytic O2 activation enhancement and algae inactivation mechanism of BiO2− x/Bi3NbO7 van der Waals heterojunction[J]. Applied Catalysis B: Environmental, 2022, 312: 121402. doi: 10.1016/j.apcatb.2022.121402 [24] WANG X, WANG X J, ZHAO J F, et al. Solar light-driven photocatalytic destruction of cyanobacteria by F-Ce-TiO2/expanded perlite floating composites[J]. Chemical Engineering Journal, 2017, 320: 253-263. doi: 10.1016/j.cej.2017.03.062 [25] GU N, GAO J L, WANG K T, et al. Microcystis aeruginosa inhibition by Zn-Fe-LDHs as photocatalyst under visible light[J]. Journal of the Institute of Chemical Engineers, 2016, 64: 189-195. [26] LI P N, WANG L C, LIU H, et al. Facile sol-gel foaming synthesized nano foam Bi2Mo3O12 as novel photocatalysts for Microcystis aeruginosa treatment[J]. Materials Research Bulletin, 2018, 107: 8-13. doi: 10.1016/j.materresbull.2018.07.008 [27] ZHOU Q, YIN H B, WANG A L, et al. Preparation of hollow B-SiO2@TiO2 composites and their photocatalytic performances for degradation of ammonia-nitrogen and green algae in aqueous solution[J]. Chinese Journal of Chemical Engineering, 2019, 27(10): 2535-2543. doi: 10.1016/j.cjche.2019.01.036 [28] WANG X, WANG X J, ZHAO J F, et al. Adsorption-photocatalysis functional expanded graphite C/C composite for in situ photocatalytic inactivation of Microcystis aeruginosa[J]. Chemical Engineering Journal, 2018, 341: 516-525. doi: 10.1016/j.cej.2018.02.054 [29] WANG X, WANG X J, ZHAO J F, et al. Efficient visible light-driven in situ photocatalytic destruction of harmful alga by worm-like N, P co-doped TiO2/expanded graphite carbon layer (NPT-EGC) floating composites[J]. Catalysis Science & Technology, 2017, 7(11): 2335-2346. [30] WANG X, WANG X J, ZHAO J F, et al. Surface modified TiO2 floating photocatalyst with PDDA for efficient adsorption and photocatalytic inactivation of Microcystis aeruginosa[J]. Water Research, 2018, 131: 320-333. doi: 10.1016/j.watres.2017.12.062 [31] FAN G D, YOU Y F, WANG B, et al. Inactivation of harmful cyanobacteria by Ag/AgCl@ZIF-8 coating under visible light: Efficiency and its mechanisms[J]. Applied Catalysis B: Environmental, 2019, 256: 117866. doi: 10.1016/j.apcatb.2019.117866 [32] FAN G D, ZHOU J J, ZHENG X M, et al. Fast photocatalytic inactivation of Microcystis aeruginosa by metal-organic frameworks under visible light[J]. Chemosphere, 2020, 239: 124721. doi: 10.1016/j.chemosphere.2019.124721 [33] FAN G D, HONG L, LUO J, et al. Photocatalytic inactivation of harmful algae and degradation of cyanotoxins microcystin-LR using GO-based Z-scheme nanocatalysts under visible light[J]. Chemical Engineering Journal, 2020, 392: 123767. doi: 10.1016/j.cej.2019.123767 [34] FAN G D, CHEN Z, HONG L, et al. Simultaneous removal of harmful algal cells and toxins by a Ag2CO3-N: GO photocatalyst coating under visible light[J]. Science of the Total Environment, 2020, 741: 140341. doi: 10.1016/j.scitotenv.2020.140341 [35] GU N, MENG X Y, GAO J L, et al. SnO2-montmorillonite composite for removal and inhibition Microcystis aeruginosa assisted by UV-light[J]. Progress in Natural Science: Materials International, 2018, 28(3): 281-287. doi: 10.1016/j.pnsc.2018.04.010 [36] FAN G D, DU B H, ZHOU J J, et al. Stable Ag2O/g-C3N4 p-n heterojunction photocatalysts for efficient inactivation of harmful algae under visible light[J]. Applied Catalysis B: Environmental, 2020, 265: 118610. doi: 10.1016/j.apcatb.2020.118610 [37] ZHOU L, CAI M, ZHANG X, et al. In-situ nitrogen-doped black TiO2 with enhanced visible-light-driven photocatalytic inactivation of Microcystis aeruginosa cells: Synthesization, performance and mechanism[J]. Applied Catalysis B: Environmental, 2020, 272: 119019. doi: 10.1016/j.apcatb.2020.119019 [38] TU X M, KE S H, LUO S H, et al. Self-supporting rGO/BiOBr composite on loofah-sponge as a floating monolithic photocatalyst for efficient Microcystis aeruginosa inactivation[J]. Separation and Purification Technology, 2021, 275: 119226. doi: 10.1016/j.seppur.2021.119226 [39] JIN Y, ZHANG S S, XU H Z, et al. Application of N-TiO2 for visible-light photocatalytic degradation of Cylindrospermopsis raciborskii— More difficult than that for photodegradation of Microcystis aeruginosa?[J]. Environmental Pollution, 2019, 245: 642-650. doi: 10.1016/j.envpol.2018.11.056 [40] SONG J K, WANG X J, MA J X, et al. Visible-light-driven in situ inactivation of Microcystis aeruginosa with the use of floating g-C3N4 heterojunction photocatalyst: Performance, mechanisms and implications[J]. Applied Catalysis B: Environmental, 2018, 226: 83-92. doi: 10.1016/j.apcatb.2017.12.034 [41] SONG J K, WANG X J, MA J X, et al. Removal of Microcystis aeruginosa and Microcystin-LR using a graphitic-C3N4/TiO2 floating photocatalyst under visible light irradiation[J]. Chemical Engineering Journal, 2018, 348: 380-388. doi: 10.1016/j.cej.2018.04.182 [42] PINHO L X, AZEVEDO J, BRITO Â, et al. Effect of TiO2 photocatalysis on the destruction of Microcystis aeruginosa cells and degradation of cyanotoxins microcystin-LR and cylindrospermopsin[J]. Chemical Engineering Journal, 2015, 268: 144-152. doi: 10.1016/j.cej.2014.12.111 [43] QI J, LAN H C, LIU R P, et al. Efficient Microcystis aeruginosa removal by moderate photocatalysis-enhanced coagulation with magnetic Zn-doped Fe3O4 particles[J]. Water Research, 2020, 171: 115448. doi: 10.1016/j.watres.2019.115448 [44] DIAO Z H, PU S Y, QIAN W, et al. Photocatalytic removal of phenanthrene and algae by a novel Ca-Ag3PO4 composite under visible light: Reactivity and coexisting effect[J]. Chemosphere, 2019, 221: 511-518. doi: 10.1016/j.chemosphere.2019.01.044 [45] FAN G D, DU B H, ZHOU J J, et al. Porous self-floating 3D Ag2O/g-C3N4 hydrogel and photocatalytic inactivation of Microcystis aeruginosa under visible light[J]. Chemical Engineering Journal, 2021, 404: 126509. doi: 10.1016/j.cej.2020.126509 [46] FAN G D, CHEN Z, YAN Z S, et al. Efficient integration of plasmonic Ag/AgCl with perovskite-type LaFeO3: Enhanced visible-light photocatalytic activity for removal of harmful algae[J]. Journal of Hazardous Materials, 2021, 409: 125018. doi: 10.1016/j.jhazmat.2020.125018 [47] SONG J K, LI C Y, WANG X J, et al. Visible-light-driven heterostructured g-C3N4/Bi-TiO2 floating photocatalyst with enhanced charge carrier separation for photocatalytic inactivation of Microcystis aeruginosa[J]. Frontiers of Environmental Science & Engineering, 2021, 15(6): 129. [48] CHEN Y, LI Z, WANG J J, et al. Efficient photocatalytic inactivation of Microcystis aeruginosa by a novel Z-scheme heterojunction tubular photocatalyst under visible light irradiation[J]. Journal of Colloid and Interface Science, 2022, 623: 445-455. doi: 10.1016/j.jcis.2022.04.169 [49] WANG D X, AO Y H, WANG P F. Effective inactivation of Microcystis aeruginosa by a novel Z-scheme composite photocatalyst under visible light irradiation[J]. Science of the Total Environment, 2020, 746: 141149. doi: 10.1016/j.scitotenv.2020.141149 [50] FAN G D, ZHAN J J, LUO J, et al. Fabrication of heterostructured Ag/AgCl@g-C3N4@UIO-66(NH2) nanocomposite for efficient photocatalytic inactivation of Microcystis aeruginosa under visible light[J]. Journal of Hazardous Materials, 2021, 404: 124062. doi: 10.1016/j.jhazmat.2020.124062 [51] ZHANG X, CAI M, CUI N X, et al. One-step synthesis of b-N-TiO2/C nanocomposites with high visible light photocatalytic activity to degrade Microcystis aeruginosa[J]. Catalysts, 2020, 10(5): 579. doi: 10.3390/catal10050579 [52] WEI X C, ZHU H X, XIONG J H, et al. Anti-algal activity of a fluorine-doped titanium oxide photocatalyst against Microcystis aeruginosa and its photocatalytic degradation[J]. New Journal of Chemistry, 2021, 45(37): 17483-17492. doi: 10.1039/D1NJ02873A [53] WANG D X, CHEN J, GAO X, et al. Maximizing the utilization of photo-generated electrons and holes of g-C3N4 photocatalyst for harmful algae inactivation[J]. Chemical Engineering Journal, 2022, 431: 134105. doi: 10.1016/j.cej.2021.134105 [54] SONG J K, WANG X J, WANG J Y et al. Photocatalytic inactivation of algae using floating visible-light-responsive photocatalyst Ag2CrO4-g-C3N4-TiO2/modified expanded perlite [J]. Acta Materiae Compositae Sinica, 2021, 38(6): 1914. [55] FAN G D, ZHANG J K, ZHAN J J, et al. Recyclable self-floating A-GUN-coated foam as effective visible-light-driven photocatalyst for inactivation of Microcystis aeruginosa[J]. Journal of Hazardous Materials, 2021, 419: 126407. doi: 10.1016/j.jhazmat.2021.126407 [56] ZHOU L, ZHANG X, CAI M, et al. Enhanced photocatalytic inactivation of Cylindrospermopsis raciborskii by modified TiO2/Ag3PO4: Efficiency and mechanism[J]. Chemical Engineering Journal, 2023, 458: 141464. doi: 10.1016/j.cej.2023.141464 [57] ZHOU L, ZHANG X, CAI M, et al. New insights into the efficient charge transfer of the modified-TiO2/Ag3PO4 composite for enhanced photocatalytic destruction of algal cells under visible light[J]. Applied Catalysis B: Environmental, 2022, 302: 120868. doi: 10.1016/j.apcatb.2021.120868 [58] WANG M J, CHEN J F, HU L J, et al. Heterogeneous interfacial photocatalysis for the inactivation of Karenia mikimotoi by Bi2O3 loaded onto a copper metal organic framework (Bi2O3@Cu-MOF) under visible light[J]. Chemical Engineering Journal, 2023, 456: 141154. doi: 10.1016/j.cej.2022.141154 [59] FAN G D, LIN X, YOU Y F, et al. Magnetically separable ZnFe2O4/Ag3PO4/g-C3N4 photocatalyst for inactivation of Microcystis aeruginosa: Characterization, performance and mechanism[J]. Journal of Hazardous Materials, 2022, 421: 126703. doi: 10.1016/j.jhazmat.2021.126703 [60] SUN S Q, TANG Q X, YU T P, et al. Fabrication of g-C3N4@Bi2MoO6@AgI floating sponge for photocatalytic inactivation of Microcystis aeruginosa under visible light[J]. Environmental Research, 2022, 215: 114216. doi: 10.1016/j.envres.2022.114216 [61] SERRÀ A, PIP P, GÓMEZ E, et al. Efficient magnetic hybrid ZnO-based photocatalysts for visible-light-driven removal of toxic cyanobacteria blooms and cyanotoxins[J]. Applied Catalysis B: Environmental, 2020, 268: 118745. doi: 10.1016/j.apcatb.2020.118745 [62] WANG X, WANG X J, SONG J K, et al. A highly efficient TiOX (X = N and P) photocatalyst for inactivation of Microcystis aeruginosa under visible light irradiation[J]. Separation and Purification Technology, 2019, 222: 99-108. doi: 10.1016/j.seppur.2019.04.034 [63] KIM S C, LEE D K. Preparation of TiO2-coated hollow glass beads and their application to the control of algal growth in eutrophic water[J]. Microchemical Journal, 2005, 80(2): 227-232. doi: 10.1016/j.microc.2004.07.008 [64] GU N, GAO J L, LI H, et al. Montmorillonite-supported with Cu2O nanoparticles for damage and removal of Microcystis aeruginosa under visible light[J]. Applied Clay Science, 2016, 132/133: 79-89. doi: 10.1016/j.clay.2016.05.017 [65] FAN G D, LIN J H, XIA M Q, et al. Impact of extracellular polymeric substance in the inactivation of harmful algae by Ag2O/g-C3N4 under visible light[J]. Particle & Particle Systems Characterization, 2021, 38(2): 2000272. [66] CHEN F R, XIAO Z G, YUE L, et al. Algae response to engineered nanoparticles: Current understanding, mechanisms and implications[J]. Environmental Science: Nano, 2019, 6(4): 1026-1042. doi: 10.1039/C8EN01368C [67] SENDRA M, YESTE P M, MORENO-GARRIDO I, et al. CeO2 NPs, toxic or protective to phytoplankton?Charge of nanoparticles and cell wall as factors which cause changes in cell complexity[J]. Science of the Total Environment, 2017, 590/591: 304-315. doi: 10.1016/j.scitotenv.2017.03.007 [68] HE X H, WU P, WANG S L, et al. Inactivation of harmful algae using photocatalysts: Mechanisms and performance[J]. Journal of Cleaner Production, 2021, 289: 125755. doi: 10.1016/j.jclepro.2020.125755 [69] SIGNORELLA S, PALOPOLI C, LEDESMA G. Rationally designed mimics of antioxidant manganoenzymes: Role of structural features in the quest for catalysts with catalase and superoxide dismutase activity[J]. Coordination Chemistry Reviews, 2018, 365: 75-102. doi: 10.1016/j.ccr.2018.03.005 [70] LIU Y M, LI L, ZHENG L, et al. Antioxidant responses of triangle sail mussel Hyriopsis cumingii exposed to harmful algae Microcystis aeruginosa and high pH[J]. Chemosphere, 2020, 243: 125241. [71] WANG Y X, ZHU X S, LAO Y M, et al. TiO2 nanoparticles in the marine environment: Physical effects responsible for the toxicity on algae Phaeodactylum tricornutum[J]. Science of the Total Environment, 2016, 565: 818-826. doi: 10.1016/j.scitotenv.2016.03.164 [72] NAVARRO E, BAUN A, BEHRA R, et al. Environmental behavior and ecotoxicity of engineered nanoparticles to algae, plants, and fungi[J]. Ecotoxicology, 2008, 17(5): 372-386. doi: 10.1007/s10646-008-0214-0 [73] LI F M, LIANG Z, ZHENG X, et al. Toxicity of nano-TiO2 on algae and the site of reactive oxygen species production[J]. Aquatic Toxicology, 2015, 158: 1-13. doi: 10.1016/j.aquatox.2014.10.014 [74] ZHAO J A, CAO X S, LIU X Y, et al. Interactions of CuO nanoparticles with the algae Chlorella pyrenoidosa: Adhesion, uptake, and toxicity[J]. Nanotoxicology, 2016, 10(9): 1297-1305. doi: 10.1080/17435390.2016.1206149 [75] YANG L M, YU L E, RAY M B. Degradation of paracetamol in aqueous solutions by TiO2 photocatalysis[J]. Water Research, 2008, 42(13): 3480-3488. doi: 10.1016/j.watres.2008.04.023 [76] REZAYIAN M, NIKNAM V, EBRAHIMZADEH H. Oxidative damage and antioxidative system in algae[J]. Toxicology Reports, 2019, 6: 1309-1313. doi: 10.1016/j.toxrep.2019.10.001 [77] LI X, YU J G, JARONIEC M, et al. Cocatalysts for selective photoreduction of CO2 into solar fuels[J]. Chemical Reviews, 2019, 119(6): 3962-4179. doi: 10.1021/acs.chemrev.8b00400 [78] CHEN L F, WU X R, LIU C, et al. Study on removal of Microcystis aeruginosa and Cr (VI) using attapulgite-Fe3O4 magnetic composite material (MCM)[J]. Algal Research, 2021, 60: 102501. doi: 10.1016/j.algal.2021.102501 [79] TAO Y, MAO X Z, HU J Y, et al. Mechanisms of photosynthetic inactivation on growth suppression of Microcystis aeruginosa under UV-C stress[J]. Chemosphere, 2013, 93(4): 637-644. doi: 10.1016/j.chemosphere.2013.06.031 [80] LIU H, YANG L L, CHEN H W, et al. Preparation of floating BiOCl0.6I0.4/ZnO photocatalyst and its inactivation of Microcystis aeruginosa under visible light[J]. Journal of Environmental Sciences, 2023, 125: 362-375. doi: 10.1016/j.jes.2021.12.044 [81] NISHIYAMA Y, ALLAKHVERDIEV S I, MURATA N. A new paradigm for the action of reactive oxygen species in the photoinhibition of photosystem II[J]. Biochimica et Biophysica Acta (BBA) - Bioenergetics, 2006, 1757(7): 742-749. doi: 10.1016/j.bbabio.2006.05.013 [82] 张同舟, 张学振, 刘婉婧, 等. 微囊藻毒素急性暴露对斑马鱼卵巢的损伤效应[J]. 水生态学杂志, 2021, 42(2): 116-123. ZHANG T Z, ZHANG X Z, LIU W J, et al. Ovary damage in zebrafish resulting from acute exposure to MC-LR[J]. Journal of Hydroecology, 2021, 42(2): 116-123 (in Chinese).
[83] 郭雅欣, 钱宗耀, 龚婷婷, 等. 太湖贝类中微囊藻毒素的测定与健康风险评估[J]. 环境化学, 2020, 39(10): 2673-2682. doi: 10.7524/j.issn.0254-6108.2019120802 GUO Y X, QIAN Z Y, GONG T T, et al. Determination and health risk assessment of microcystins in shellfish from Lake Taihu[J]. Environmental Chemistry, 2020, 39(10): 2673-2682 (in Chinese). doi: 10.7524/j.issn.0254-6108.2019120802
[84] 黄艺, 张郅灏. 微囊藻毒素的致毒机理和人体健康风险评价研究进展[J]. 生态环境学报, 2013, 22(2): 357-364. HUANG Y, ZHANG Z H. Advances in the study of toxicology and human health risk assessment of microcystin[J]. Ecology and Environmental Sciences, 2013, 22(2): 357-364 (in Chinese).
[85] ALMUHTARAM H, HOFMANN R. Evaluation of ultraviolet/peracetic acid to degrade M. aeruginosa and microcystins-LR and-RR[J]. Journal of Hazardous Materials, 2022, 424: 127357. doi: 10.1016/j.jhazmat.2021.127357 [86] PELAEZ M, FALARAS P, KONTOS A G, et al. A comparative study on the removal of cylindrospermopsin and microcystins from water with NF-TiO2-P25 composite films with visible and UV-vis light photocatalytic activity[J]. Applied Catalysis B: Environmental, 2012, 121/122: 30-39. doi: 10.1016/j.apcatb.2012.03.010 [87] TANG J F, WANG W D, YANG L, et al. Seasonal variation and ecological risk assessment of dissolved organic matter in a peri-urban critical zone observatory watershed[J]. Science of the Total Environment, 2020, 707: 136093. doi: 10.1016/j.scitotenv.2019.136093 [88] 刘思谦, 刘洋, 赵婧, 等. 溶解性有机质作用下金属纳米颗粒的聚集和溶解[J]. 环境化学, 2018, 37(7): 1638-1646. doi: 10.7524/j.issn.0254-6108.2018012802 LIU S Q, LIU Y, ZHAO J, et al. Aggregation and dissolution of metal nanoparticles in the presence of dissolved organic matters[J]. Environmental Chemistry, 2018, 37(7): 1638-1646 (in Chinese). doi: 10.7524/j.issn.0254-6108.2018012802
[89] 于会彬, 高红杰, 宋永会, 等. 城镇化河流DOM组成结构及与水质相关性研究[J]. 环境科学学报, 2016, 36(2): 435-441. YU H B, GAO H J, SONG Y H, et al. Study on composition structure of DOM and its correlation with water quality in an urbanized river[J]. Acta Scientiae Circumstantiae, 2016, 36(2): 435-441 (in Chinese).
[90] NEILEN A D, HAWKER D W, O'BRIEN K R, et al. Phytotoxic effects of terrestrial dissolved organic matter on a freshwater cyanobacteria and green algae species is affected by plant source and DOM chemical composition[J]. Chemosphere, 2017, 184: 969-980. doi: 10.1016/j.chemosphere.2017.06.063 [91] 姚昊, 许航, 温昕, 等. 预臭氧氧化对混凝沉淀过程中有机物去除的影响[J]. 中国给水排水, 2022, 38(7): 33-42. YAO H, XU H, WEN X, et al. Effect of pre-ozonation on removal of organic matter during coagulation and sedimentation[J]. China Water & Wastewater, 2022, 38(7): 33-42 (in Chinese).
[92] 孙婧, 赵阁阁, 张运波, 等. 高铁酸钾氧化去除DOM的影响因素及荧光光谱特性[J]. 中国给水排水, 2021, 37(23): 21-27. SUN J, ZHAO G G, ZHANG Y B, et al. Influencing factors and fluorescence spectrum characteristics of DOM removed by potassium ferrate oxidation[J]. China Water & Wastewater, 2021, 37(23): 21-27 (in Chinese).
[93] 王杰琼, 乔显亮, 张耀玲, 等. 采用电渗析耦合反渗透法分离养殖海水中溶解性有机质[J]. 环境化学, 2016, 35(9): 1785-1791. doi: 10.7524/j.issn.0254-6108.2016.09.2016012902 WANG J Q, QIAO X L, ZHANG Y L, et al. Isolation of dissolved organic matter from mariculture seawaters by electrodialysis coupled with reverse osmosis[J]. Environmental Chemistry, 2016, 35(9): 1785-1791 (in Chinese). doi: 10.7524/j.issn.0254-6108.2016.09.2016012902
[94] CARP O, HUISMAN C L, RELLER A. Photoinduced reactivity of titanium dioxide[J]. Progress in Solid State Chemistry, 2004, 32(1/2): 33-177. [95] TANG Y L, XIN H J, YANG S, et al. Environmental risks of ZnO nanoparticle exposure on Microcystis aeruginosa: Toxic effects and environmental feedback[J]. Aquatic Toxicology, 2018, 204: 19-26. doi: 10.1016/j.aquatox.2018.08.010 [96] WU F, HARPER B J, CRANDON L E, et al. Assessment of Cu and CuO nanoparticle ecological responses using laboratory small-scale microcosms[J]. Environmental Science: Nano, 2020, 7(1): 105-115. doi: 10.1039/C9EN01026B [97] YE Y, BRUNING H, LIU W R, et al. Effect of dissolved natural organic matter on the photocatalytic micropollutant removal performance of TiO2 nanotube array[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2019, 371: 216-222. doi: 10.1016/j.jphotochem.2018.11.012 [98] REN M J, DROSOS M, FRIMMEL F H. Inhibitory effect of NOM in photocatalysis process: Explanation and resolution[J]. Chemical Engineering Journal, 2018, 334: 968-975. doi: 10.1016/j.cej.2017.10.099 [99] VALENCIA S, MARÍN J M, RESTREPO G, et al. Evaluations of the TiO2/simulated solar UV degradations of XAD fractions of natural organic matter from a bog lake using size-exclusion chromatography[J]. Water Research, 2013, 47(14): 5130-5138. doi: 10.1016/j.watres.2013.05.053 [100] JEONG B, OH M S, PARK H M, et al. Elimination of microcystin-LR and residual Mn species using permanganate and powdered activated carbon: Oxidation products and pathways[J]. Water Research, 2017, 114: 189-199. doi: 10.1016/j.watres.2017.02.043 [101] REGULSKA E, RIVERA-NAZARIO D, KARPINSKA J, et al. Zinc porphyrin-functionalized fullerenes for the sensitization of titania as a visible-light active photocatalyst: River waters and wastewaters remediation[J]. Molecules, 2019, 24(6): 1118. doi: 10.3390/molecules24061118 [102] NIVETHA M R S, KUMAR J V, AJAREM J S, et al. Construction of SnO2/g-C3N4 an effective nanocomposite for photocatalytic degradation of amoxicillin and pharmaceutical effluent[J]. Environmental Research, 2022, 209: 112809. doi: 10.1016/j.envres.2022.112809 [103] CAMACHO-MUÑOZ D, LAWTON L A, EDWARDS C. Degradation of okadaic acid in seawater by UV/TiO2 photocatalysis - Proof of concept[J]. Science of the Total Environment, 2020, 733: 139346. doi: 10.1016/j.scitotenv.2020.139346 -




 下载:
下载: