-
染料在为人类生活添加色彩的同时,也给水环境带来了持久性污染. 全球每年约有超过30万吨染料被使用,其中10%—20%的染料被排入水体中[1]. 我国纺织业每年产生超过360亿吨的印染废水[2],其中含有染料、氯化物和重金属等[3]. 染料会提高水体的色度而影响光的通过,使水中溶解氧降低,抑制水中动植物的新陈代谢,在细胞和生物体水平上体现出环境毒性[4],进而影响整个水生态系统的安全[5]. 偶氮染料是一种化工合成染料,因其价格低、染色强、易合成等特点而被广泛用于印染工业[6]. 偶氮染料分解过程中会产生很难降解的芳香结构[7],会增加人体生理毒性和致癌的风险[8 − 9]. 因此,偶氮染料对水环境的安全和人类的健康造成巨大的威胁.
过一硫酸盐(PMS)的高级氧化技术展现出强大的污染物降解能力[10]. PMS在活化后会产生具有强氧化能力的硫酸根自由基(SO4·−)、羟基自由基(·OH)和单线态氧(1O2)等活性氧物种[11],可用于处理难降解染料. 电化学(E)因高效、可靠和清洁的特点被广泛用于活化PMS,加速活性氧物种的产生. 高锰酸钾(PM)是一种廉价易得的选择性氧化剂,其经过电活化后产生的游离态的活性锰可降解染料[12],原位生成的无定型二氧化锰(MnO2)能进一步活化过硫酸盐[13],增强对难降解偶氮染料的处理[14].
本文以活性黄K-RN(Reactive Yellow 3)为目标偶氮染料,构建了E-PM-PMS体系,促进对PMS的活化产生诸多活性氧物种而提高降解染料的能力. 考察E-PM-PMS体系中单因素对活性黄K-RN降解效果的影响,探究降解活性黄K-RN的机理,通过对不同染料的降解效果来衡量E-PM-PMS体系的应用潜力,试图为降解水中偶氮染料提供理论依据和技术支撑.
-
活性黄K-RN(C21H17ClN8O7S2,99%)、活性艳蓝KN-R(C22H16N2Na2O11S3,99.8%)、活性红3BS(C31H19ClN7O19S6Na5)、活性黄3RS(C28H20ClN9Na4O16S5)、酸性橙7(C16H11N2NaO4S,AR)、过硫酸氢钾(KHSO5,AR)、无水硫酸钠(Na2SO4,AR)、无水碳酸钠(Na2CO3,AR)、氢氧化钠(NaOH,AR)、盐酸羟胺(ClH4NO,AR)、磷酸二氢钠(NaH2PO4,AR)、磷酸氢二钠(Na2HPO4,AR)、硫酸(H2SO4,AR)、高锰酸钾标准液(KMnO4,国标,0.1mol·L−1)、四甲基哌啶醇(TMPO,95%)、5,5-二甲基-1-吡咯啉-N-氧化物(DMPO,97%)和四甲基哌啶氮氧化物(TEMPO,95%). 实验用水均为超纯水(电阻率为18.25 MΩ·cm−1).
-
主要实验仪器:磁力搅拌器(85-2A型,金坛市城东新瑞仪器厂)、直流电源(PS-305D型,香港龙威仪器仪表有限公司)、钛镀铂电极(50 mm×30 mm)、磁力搅拌转子(B25,8 mm×25 mm)、反应器(DN100 mm×H120 mm). TOC分析仪(TOC-VCPH,ShimadzuCo.,Japan)、紫外可见分光光度计(T6新世纪,北京普析通用仪器有限公司)、电子自旋共振仪(JEM-2100Plus,日本电子株式会社).
-
实验方法:装有磁力搅拌转子的反应器置于磁力搅拌器之上,搅拌转速为
1200 r·min−1. 钛镀铂阴、阳极用电极夹垂直于反应器盖板平行固定,阴、阳极间距为2 cm,且在盖板孔中放入pH计. 预先用NaOH和H2SO4调反应液初始pH值为6,向反应液中加入作为电解质的无水Na2SO4充分搅拌,加入作为氧化剂的PMS和PM,电源调至预定电流,在设定时间用取样器取4 mL液体过0.45 μm滤膜后用于分析. 反应工况除特殊说明,PM浓度为0.8 mmol·L−1、PMS浓度为1 mmol·L−1、电流密度为26.29 mA·cm−2、初始pH为6、硫酸钠浓度为50 mmol·L−1,活性黄K-RN的浓度为0.1 mmol·L−1.分析方法:用紫外分光光度计测定活性黄K-RN的浓度之前,用盐酸羟胺处理消除高锰酸钾吸光度的影响,后经过紫外分光光度计扫描398 nm处的活性黄K-RN的吸光度值. 反应体系中产生的活性氧物种使用电子自旋共振仪(ESR)测定,在进行活性氧物种测定实验之前,分别向反应体系中加入20 mmol·L−1TMPO、40 mmol·L−1DMPO和20 mmol·L−1TEMPO作为自旋捕获试剂. 取2 mL不同时刻的反应液用0.22 μm滤膜过滤后储存至棕色样品瓶,并用超纯水稀释5倍后移放至冰箱中在4 ℃条件下保存,后用TOC分析仪测定矿化率.
-
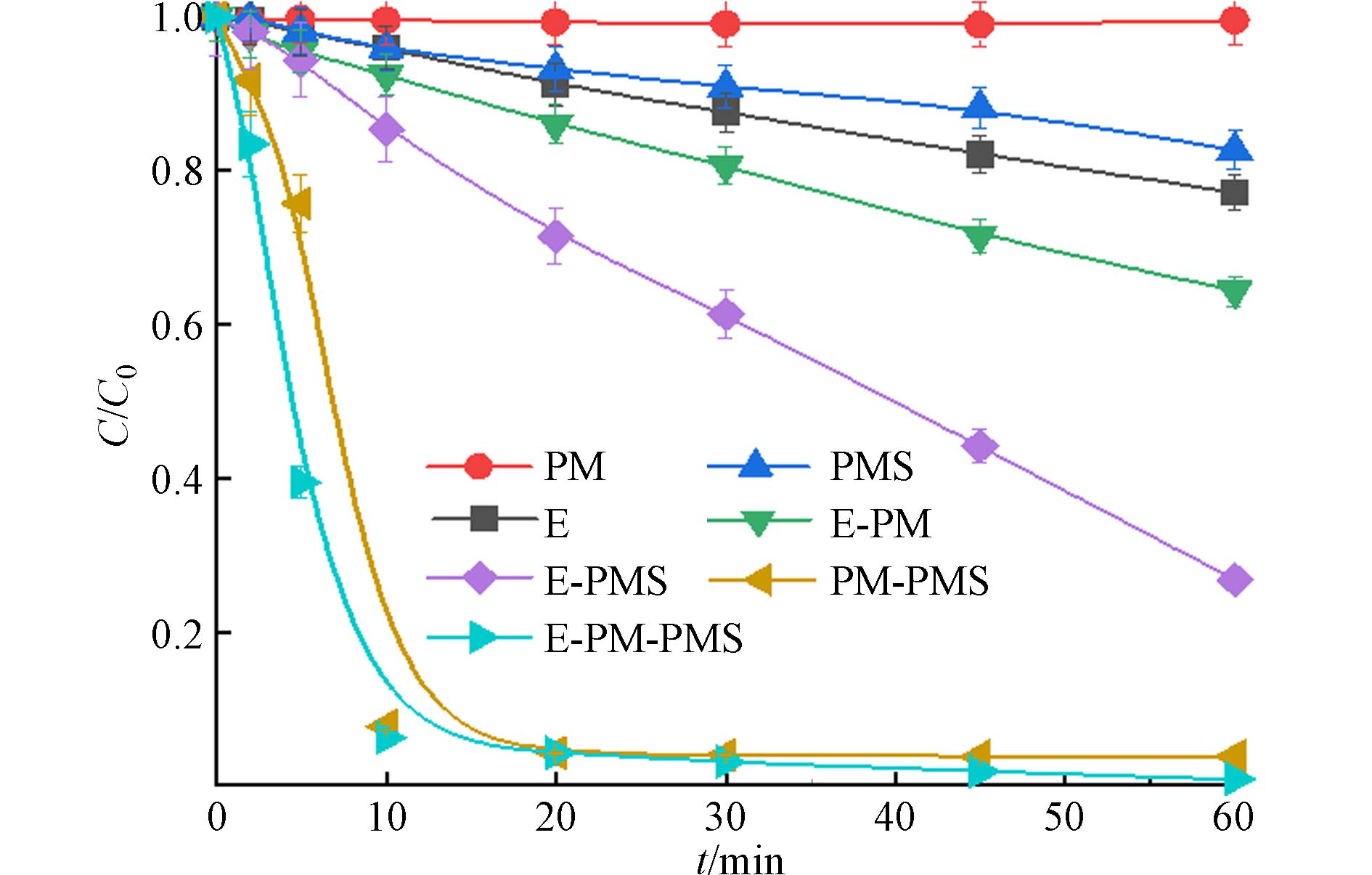
首先研究了E、PM、PMS体系及耦合体系对活性黄K-RN的降解效果. 如图1所示,反应进行10 min,PM-PMS、E-PM-PMS体系对活性黄K-RN的降解率已达90%以上. 反应20 min,E-PM-PMS体系对活性黄K-RN的降解率就已经达到了95.8%,反应60 min,除PM-PMS、E-PM-PMS体系对活性黄K-RN的降解率是96.2%、99.2%,其余体系均在90%以下. E-PM-PMS体系对活性黄K-RN的降解率最高. 同时,相比于其他研究者的体系[15 − 18],E-PM-PMS体系表现出显著的降解效果,可见,E-PM-PMS体系对活性黄K-RN降解效果最好.
为考察不同体系对活性黄K-RN的降解速率,用式(1)对反应前5 min的数据进行拟合,获得速率常数k如表1所示. 为进一步考察耦合体系降解活性黄K-RN的协同效果,用式(2)计算耦合体系的协同系数SI,结果如表1所示.
式中,C为活性黄K-RN不同时刻的浓度,mol·L−1;C0为活性黄K-RN的初始浓度,mol·L−1;k为速率常数,min−1;t为反应时刻,min;b为常数.
式中,SI为协同系数;k耦合体系为耦合体系的速率常数;k单一体系为单一体系的速率常数.
由表1可见,E-PM-PMS体系降解活性黄K-RN的反应速率常数远高于其他体系,说明E-PM-PMS体系降解活性黄K-RN的速度快. E-PM-PMS体系的协同系数高达21.697,远高于其他耦合体系,说明E、PM、PMS之间产生了显著的协同作用.
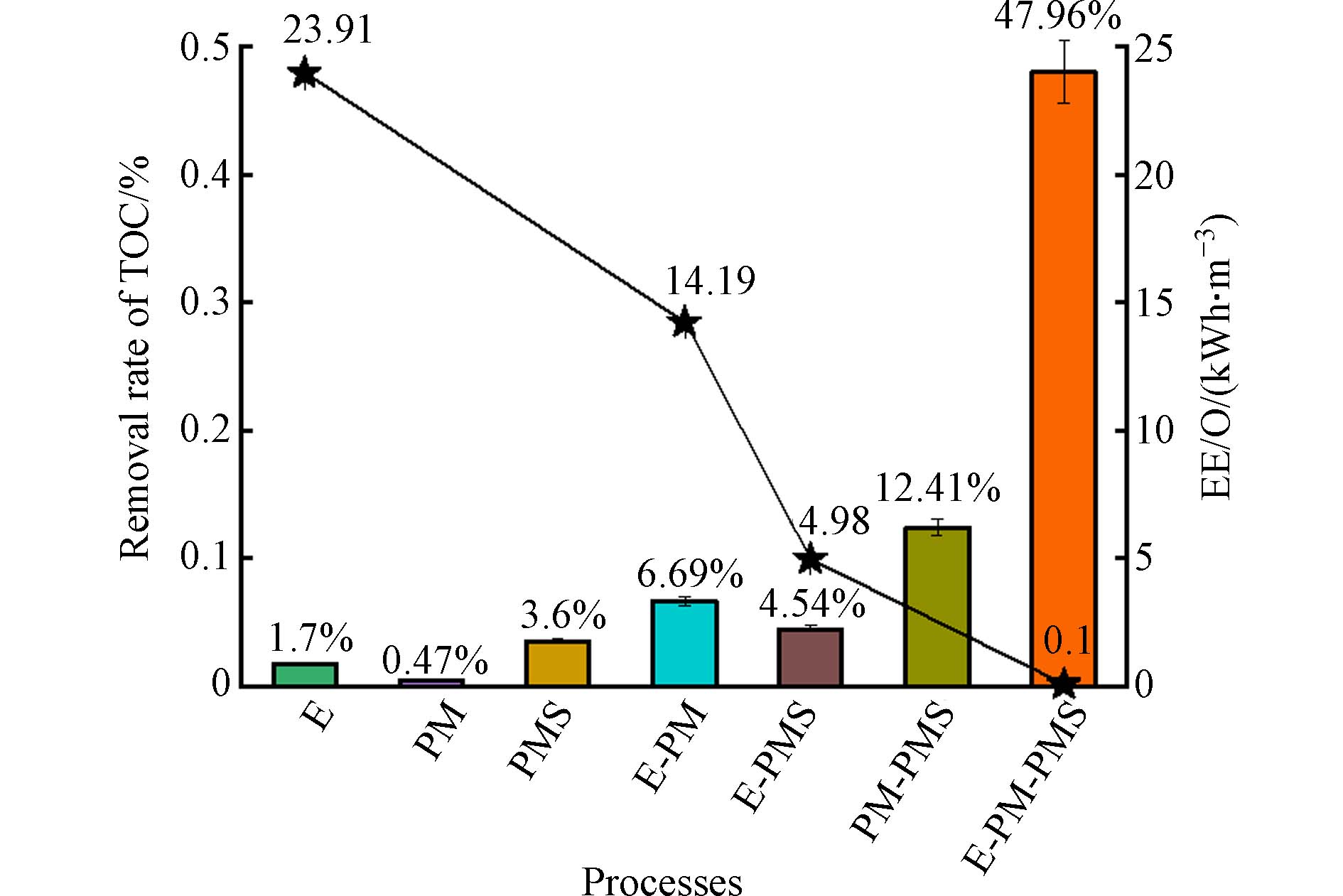
此外,考察了不同体系对活性黄K-RN的矿化能力. 如图2所示,不同体系对活性黄K-RN矿化120 min,其中,E-PM-PMS体系对活性黄K-RN的矿化率为47.96%,远高于其他体系的矿化率,说明E-PM-PMS体系相较于其他体系,对活性黄K-RN具有更好的矿化能力. 同时,用单位电能(EE/O)评估了各个电体系在降解活性黄K-RN过程中的电能能耗,计算公式见式(3),获得不同电体系的EE/O如图2所示. 其中,E-PM-PMS体系降解活性黄K-RN的EE/O仅为0.1 kWh·m−3,远远低于其他电体系的能耗. 由此可见,E-PM-PMS体系相比于其他体系,虽然额外添加了PMS和PM,但是E、PMS与PM之间的协同作用使电能的消耗大幅度降低,是一种高效低耗的反应体系.
其中,P是过程的额定功率,kW;V是不同反应时刻t时反应液的体积,L;Ci是初始活性黄K-RN的浓度,mol·L−1;Cf是反应终止后活性黄K-RN的浓度,mol·L−1.
-
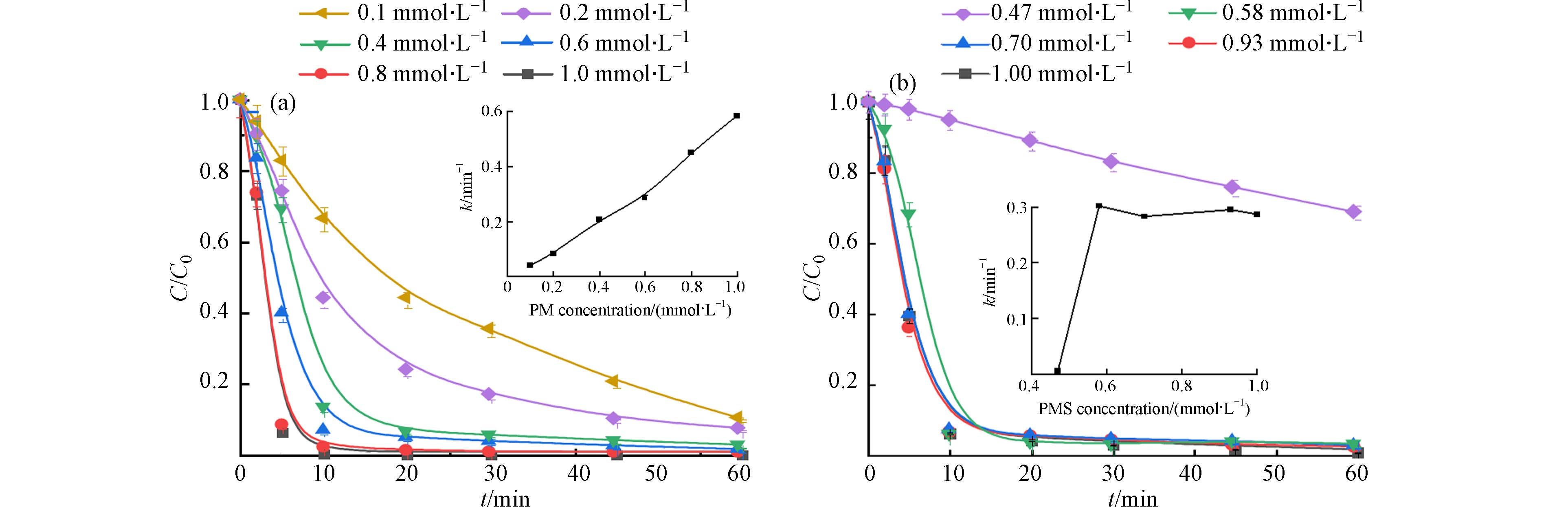
在确定E-PM-PMS体系有协同作用后,考察各工况因素对活性黄K-RN降解的影响. 首先考察PM浓度对E-PM-PMS体系降解活性黄K-RN的影响,降解效果见图3(a). 随着PM浓度的增加,E-PM-PMS体系对活性黄K-RN的降解率也随之增加. 这可能是由于PM浓度的提高,使E-PM-PMS体系中产生了更多的活性锰,加快了对活性黄K-RN的降解. 反应前10 min的一级动力学,如图3(a)所示,PM浓度增加使反应速率常数也随之增加,PM浓度与反应速率常数呈正相关. PM浓度>0.8 mmol·L−1后,E-PM-PMS体系对活性黄K-RN的降解相差无几,为减少投加药剂,确定PM浓度为0.8 mmol·L−1.
-
考察PMS浓度对E-PM-PMS体系降解活性黄K-RN的影响. E-PM-PMS体系对活性黄K-RN的降解效果如图3(b)所示,随着PMS浓度的增加,对活性黄K-RN的降解率也随之提高. 这是因为PMS浓度的增加会促使反应体系产生更多的活性氧物种,增强E-PM-PMS体系的降解能力. 但是PMS浓度大于0.7 mmol·L−1后,E-PM-PMS体系对活性黄K-RN的降解效果几乎一致,说明当体系中PMS达到一定浓度后,对活性黄K-RN的降解率提高程度有限. 分析反应前10 分钟的一级动力学,如图3(b)所示,除PMS浓度为0.47 mmol·L−1外,其余浓度均处于高速反应阶段. 这可能是因为初始PMS浓度过低,体系中产生的SO4·−、·OH等活性氧物种数量少,不能快速地降解活性黄K-RN. 综合考虑,确定最佳PMS浓度为1 mmol·L−1.
-
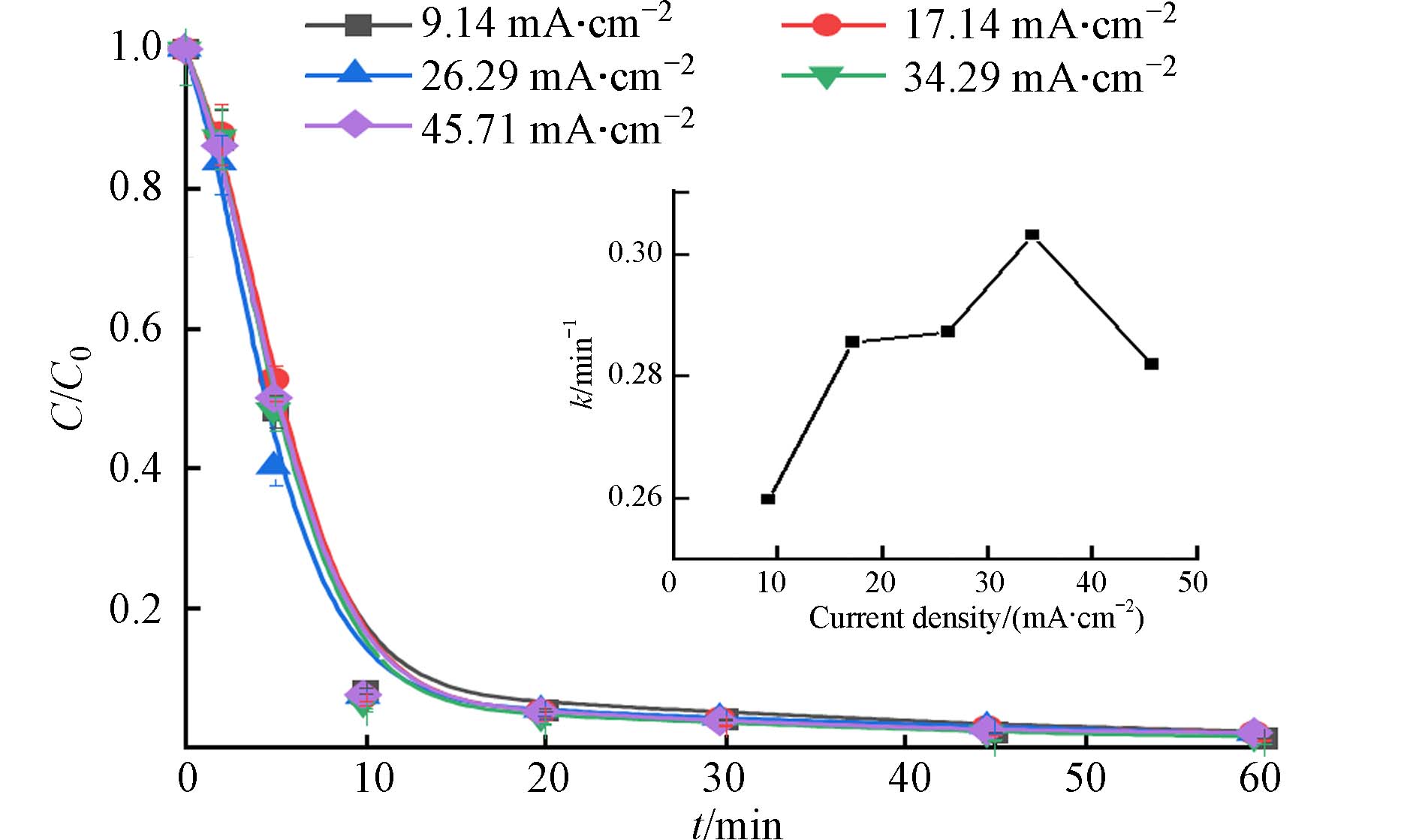
考察电流密度对E-PM-PMS体系降解活性黄K-RN的影响. 电流密度会影响体系中电子传导速率,从而影响PMS、PM的活化效率. 电流密度对活性黄K-RN降解的影响如图4所示,反应60 min,在各个电流密度下,E-PM-PMS体系对活性黄K-RN的降解率在99%左右,电流密度的变化对降解活性黄K-RN的影响不显著. 分析反应前10 min的一级动力学,如图4所示,在各个电流密度下,E-PM-PMS体系均处于高速反应阶段. 此外,电流密度过大会使析氢和析氧副反应发生剧烈,如式(4)和式(5)[19],导致部分电流不能用于活化PMS而用于析氢和析氧. 电流密度为26.29 mA·cm−2时,电流密度相对较小,处理效果也显著,确定为最佳电流密度.
-
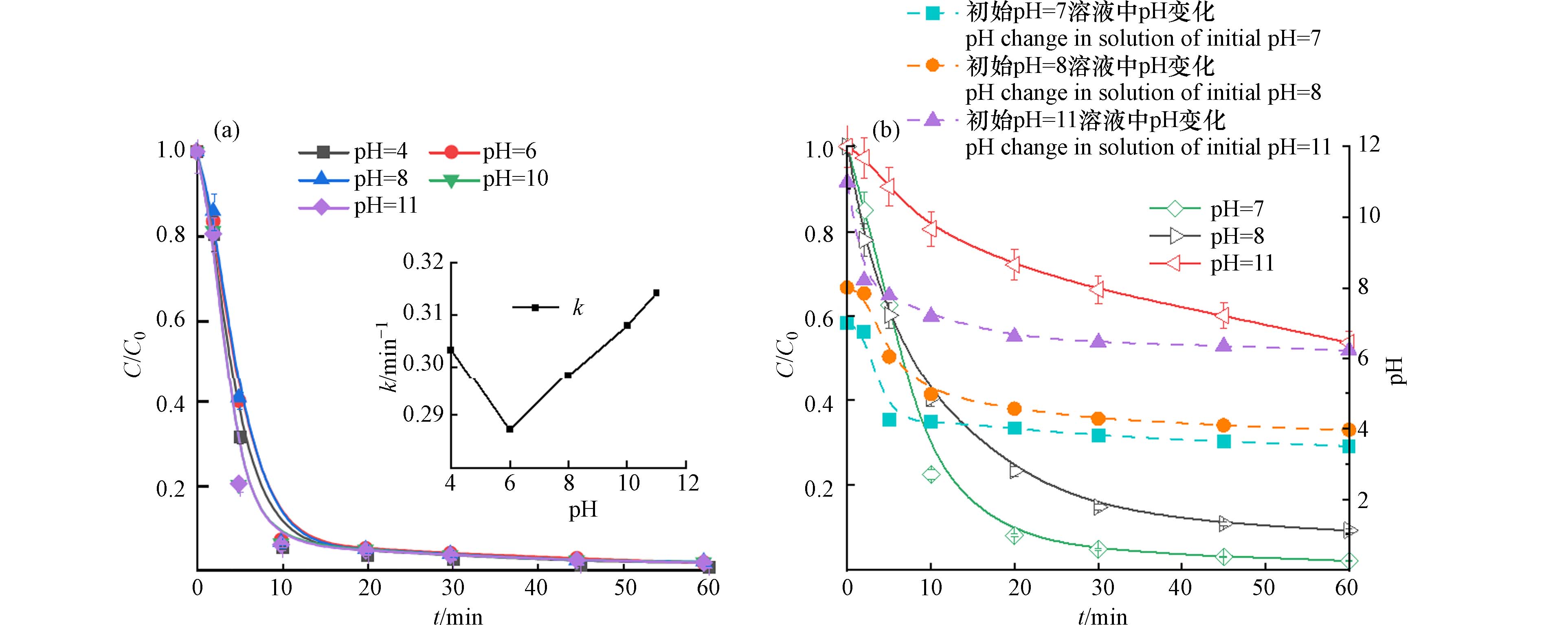
考察初始pH对E-PM-PMS体系降解活性黄K-RN的影响. 初始pH对反应体系中污染物的降解、氧化剂的活化、活性氧物种的生成影响显著,尤其对PM的影响最为明显. 在酸性条件下,PM氧化还原电位高,而在中性和碱性条件下氧化还原电位较低[20]. 初始pH对活性黄K-RN降解的影响如图5(a)所示. 反应60 min,在各个初始pH条件下,E-PM-PMS体系对活性黄K-RN的降解效果相差不大. 分析反应前10 min的一级动力学,如图5(a)所示,E-PM-PMS体系在各个初始pH时均有较快的降解速率,这是因为PM在酸性条件下保持着高氧化还原电位. 考虑到实际水体存在缓冲作用,可能使反应液呈中碱性,在缓冲液和实际水体的条件下考察pH对活性黄K-RN降解的影响. 如图5(b)所示,在有缓冲的条件下,活性黄K-RN的降解率随着pH的增大而减小. 通过对实验过程pH变化的检测,随着反应的进行,溶液的pH逐渐减小. 这是因为PMS被活化的过程中产生了大量的H+,促使溶液的pH不断向酸性变化[21]. 此外,E-PM-PMS体系在实际水体(pH=8)中降解活性黄K-RN也有着显著的效果. 因此,pH在中酸性条件对降解活性黄K-RN的影响较小,在碱性条件下会降低对活性黄K-RN的降解率.
-
在染色阶段,Na2SO4和Na2CO3常被用作助染剂,致使印染废水中的Na2SO4和Na2CO3含量较高. 此外,Na2SO4作为反应体系中的电解质会改变溶液的电导率而影响电化学过程. Na2CO3溶于水会生成CO32−,CO32−与·OH、SO4·−、·O2−等活性氧物种的反应速率常数分别为3×108、6.1×106、5×108 L·mol−1s−1[22 − 23],CO32−会与活性氧物种优先反应而与降解活性黄K-RN产生竞争. 因此,需考察Na2SO4、Na2CO3对E-PM-PMS体系降解活性黄K-RN的影响.
Na2SO4浓度对降解活性黄K-RN的影响见图6(a). Na2SO4浓度大于
1000 mmol·L−1时,E-PM-PMS体系对活性黄K-RN的降解率均小于在其他浓度的降解率. 反应前10分钟的一级动力学,如图6(a)所示,Na2SO4浓度为1000 、1500 mmol·L−1时的反应动力学常数均小于其他工况,处于低速反应阶段,其他工况的动力学常数相近,属于高速反应阶段. 可见,Na2SO4浓度增高会抑制E-PM-PMS体系对活性黄K-RN的降解效果. 这是由于SO42−的增加导致活化PMS产生活性氧物种的速率降低[24],影响降解效果. Na2SO4浓度为50 mmol·L−1时,投药量小,对活性黄K-RN处理效果好,确定为最佳Na2SO4浓度.Na2CO3对活性黄K-RN降解的影响如图6(b)所示. Na2CO3浓度越高,对活性黄K-RN的降解效果抑制程度越明显. 分析反应前10 min的一级动力学,如图6(b)所示,Na2CO3浓度的增高使反应速率常数减小. 这是因为CO32−优先与活性氧物种反应,与活性黄K-RN降解产生竞争. 因此,Na2CO3对E-PM-PMS体系降解活性黄K-RN有抑制作用.
-
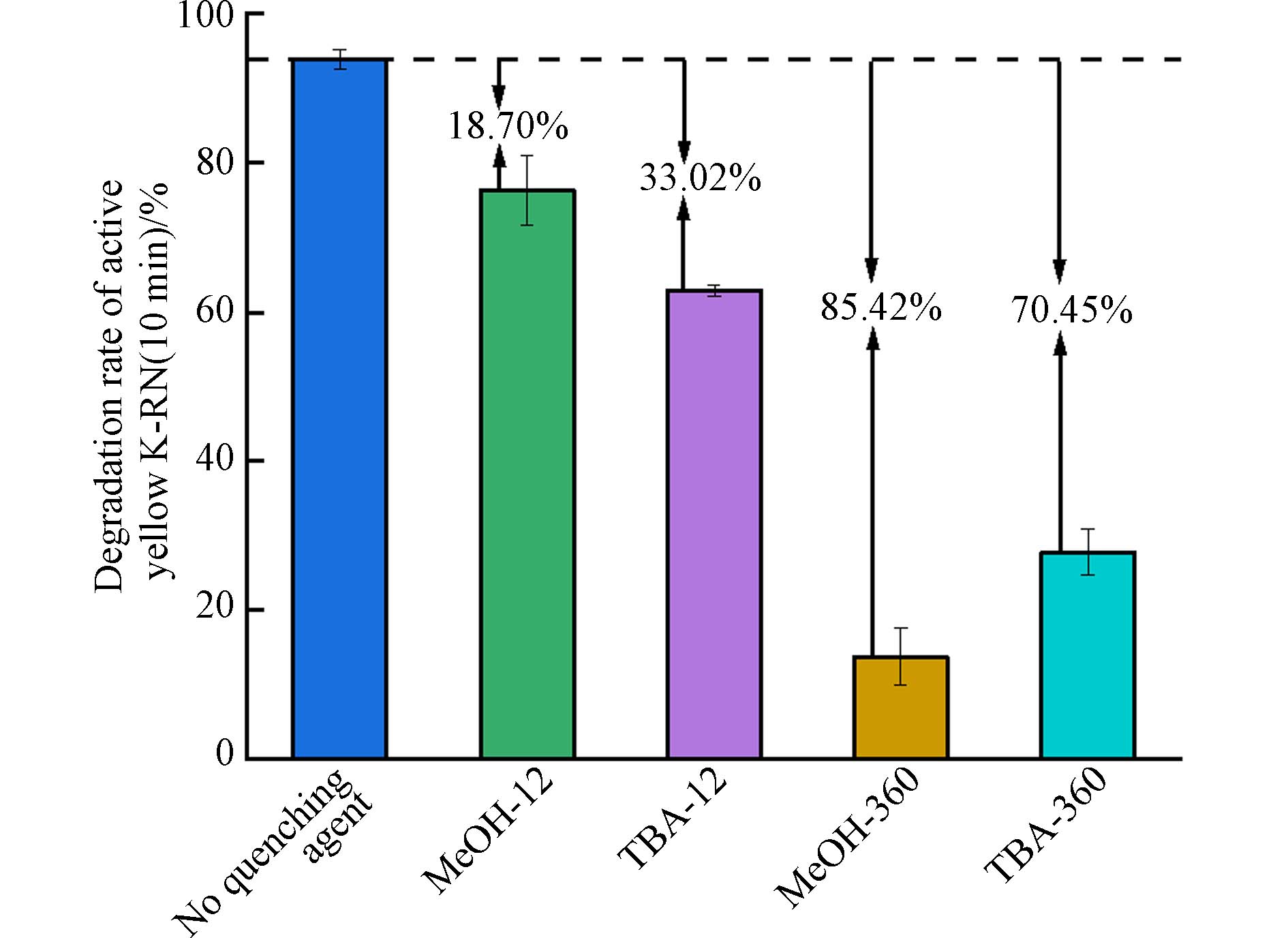
由2.1节可知,E-PM-PMS体系在降解活性黄K-RN过程中表现出协同作用,是因为体系中产生了诸多活性氧物种. 过量的醇类可以与活性氧物种快速发生反应,从而判断E-PM-PMS体系中是否产生活性氧物种. 甲醇(MeOH)与SO4·−、·OH、1O2和·O2−的反应速自由基率常数分别为2.5×107、9.7×108、3.0×103、1.1×107 L·mol−1s−1[25 − 30]. 叔丁醇(TBA)与SO4·−、·OH、1O2和·O2−的反应速自由基率常数分别为7.6×105、6.0×108、1.8×103、<103 L·mol−1·s−1[25 − 30]. 在同等工况条件下,MeOH和TBA对体系中产生的·OH和1O2清除速率相差无几,MeOH比TBA快2个数量级清除SO4·−和·O2−. 由图7可知,向E-PM-PMS体系中分别加入12 mmol·L−1MeOH和TBA,反应10 min,活性黄K-RN的降解率分别减少了18.70%和33.02%,活性黄K-RN的降解受到了抑制,说明E-PM-PMS体系中产生了活性氧物种. 向E-PM-PMS体系中分别加入360 mmol·L−1MeOH和TBA,反应10 min,活性黄K-RN的降解率分别减少85.42%和70.45%,活性黄K-RN的降解受到了明显抑制,说明E-PM-PMS体系产生了大量的活性氧物种.
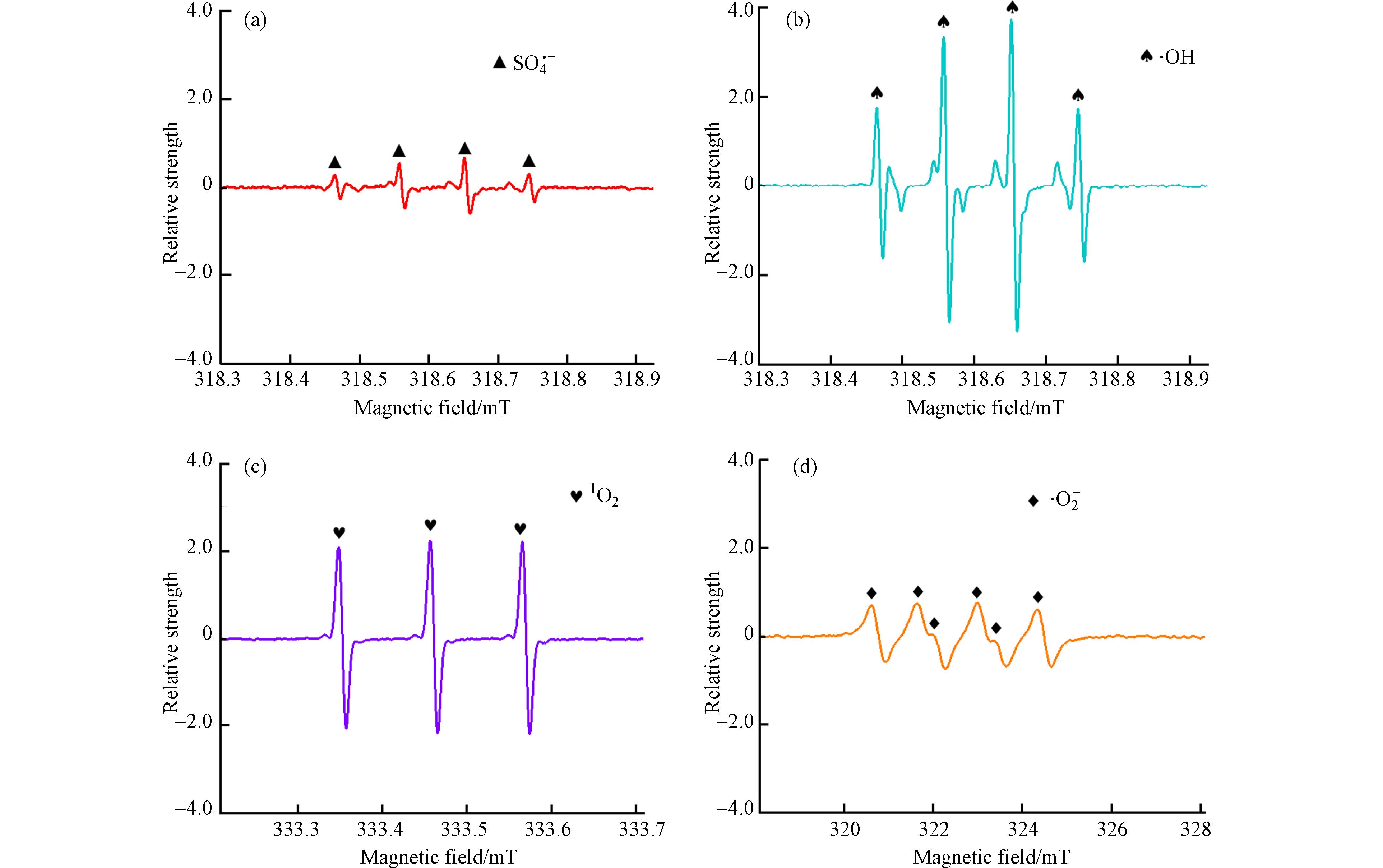
为进一步确定E-PM-PMS体系在降解活性黄K-RN的过程中产生的活性氧物种,采用电子自旋共振仪(ESR)检测活性氧物种. 5,5-二甲基-1-吡咯啉-N-氧化物(DMPO)可用于检测SO4·−和·OH[31]、四甲基哌啶醇(TMPO)可用于检测1O2[32]、四甲基哌啶氮氧化物(TEMPO)可用于检测·O2−[33]. 在E-PM-PMS体系降解活性黄K-RN的过程中,向体系中加入相应的捕获剂. 由图8(a)和图8(b)可知,向E-PM-PMS体系中加入40 mmol·L−1DMPO,出现了DMPO-SO4和DMPO-OH特征峰,说明体系中产生了SO4·−和·OH. 由图8(c)可知,向体系中加入20 mmol·L−1的TMPO,出现了TMPN特征峰,说明体系中产生了1O2. 由图8(d)可知,向体系中加入20 mmol·L−1TEMPO,出现了TEMPO-·O2−特征峰,说明体系中产生了·O2−. ESR检测结果证明,E-PM-PMS体系在降解活性黄K-RN的过程中产生了SO4·−、·OH、1O2和·O2−等活性氧物种.
为进一步确定E-PM-PMS体系降解活性黄K-RN的过程是否为自由基主导的降解过程,向体系中添加MeOH用于淬灭体系中的活性氧物种,并依据反应速率常数来判断降解贡献比. 其中,E-PM-PMS体系中可能存在直接电解的降解路径,因此需要考察E的贡献. 对反应前5 min的数据进行动力学拟合,获得反应速率常数如表2所示. 无淬灭剂的反应速率常数与加MeOH的反应速率的差值为自由基贡献的反应速率常数,加MeOH的反应速率常数与E体系的反应速率的差值为非自由基贡献的反应速率常数. 获得的反应速率常数与无淬灭剂的反应速率常数比值即为不同物质的降解贡献比,结果如表2所示. 自由基降解贡献比高达95.26%,说明E-PM-PMS体系降解活性黄K-RN的过程为自由基主导的降解过程.
基于实验结果推测,E-PM-PMS体系降解活性黄K-RN是自由基主导的降解过程. E促使PMS发生了活化,产生的SO4·−、·OH、1O2对活性黄K-RN进行降解,反应方程式如式(6)—(8)[34 − 37]. PM中的Mn通过价态转化催化PMS产生·O2−,生成的·O2−可作为反应中间体进一步生成1O2[38 − 39],产生的·O2−和1O2参与对活性黄K-RN的降解.
-
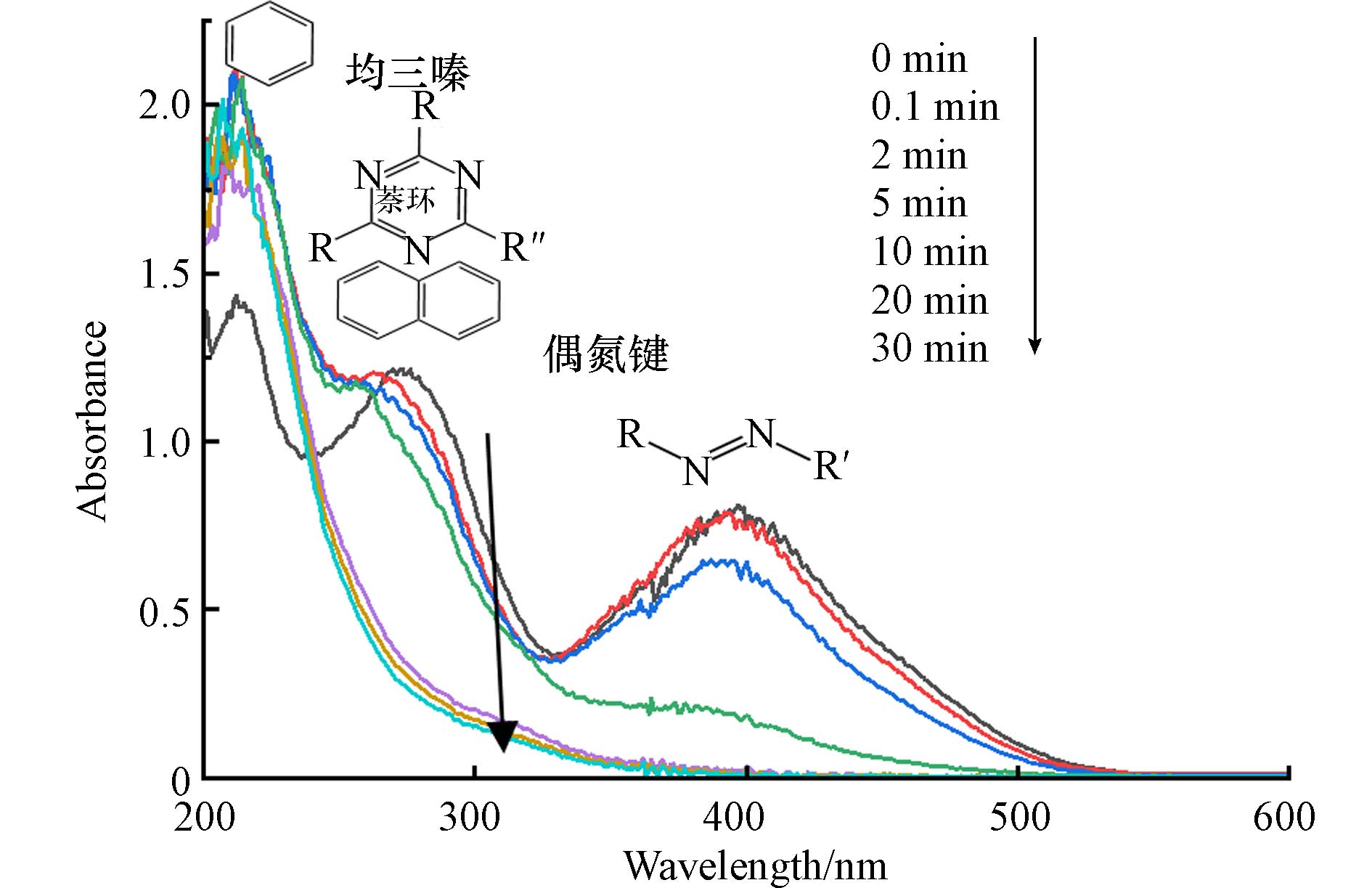
为探究E-PM-PMS体系降解活性黄K-RN的降解机理,对体系的降解过程进行分析. 图9中,紫外吸收光谱图出现3个较大的吸收峰,其中,210、270、398 nm左右处的吸收峰分别对应活性黄K-RN结构中的苯环、萘环和均三嗪、偶氮键[40 − 42]. 活性黄K-RN中苯环的吸收峰强度随着反应的进行先增强后减弱,是因为在活性黄K-RN的降解过程中产生了大量的含有苯环的中间产物,之后又被降解. 活性黄K-RN中萘环和均三嗪吸收峰的强度随着反应的进行而减弱,说明活性黄K-RN中的萘环和均三嗪持续断裂. 偶氮键的吸收峰强度随着反应的进行而快速减弱,说明E-PM-PMS体系降解活性黄K-RN时断裂偶氮键的能力很强. 此外,在反应开始不久,偶氮键的断裂比其他键的断裂更快,到反应后期偶氮键的断裂才逐渐减弱,这可能是因为E-PM-PMS体系对活性黄K-RN的降解是由偶氮键的断裂引发的[40],随着偶氮键的不断断裂,活性黄K-RN分子变成诸多更小的芳香结构而进一步降解.
基于以上实验结果推测,E-PM-PMS体系降解活性黄K-RN的机理如图10所示. 主要以SO4·−、·OH、1O2和·O2−等活性氧物种主导的自由基对活性黄K-RN进行降解,其中包括偶氮键断裂、还原反应和开环反应等反应. SO4·−和·OH可能通过夺氢、加成和电子转移等途径对活性黄K-RN进行降解,1O2可能与活性黄K-RN中饱和碳原子上的氢反应而进行降解,·O2−可能通过夺氢、取代和电子转移等途径促进活性黄K-RN的降解[20]. 活性黄K-RN最终被降解成CO2、H2O、N2、NH4+、SO42−等小分子物质.
-
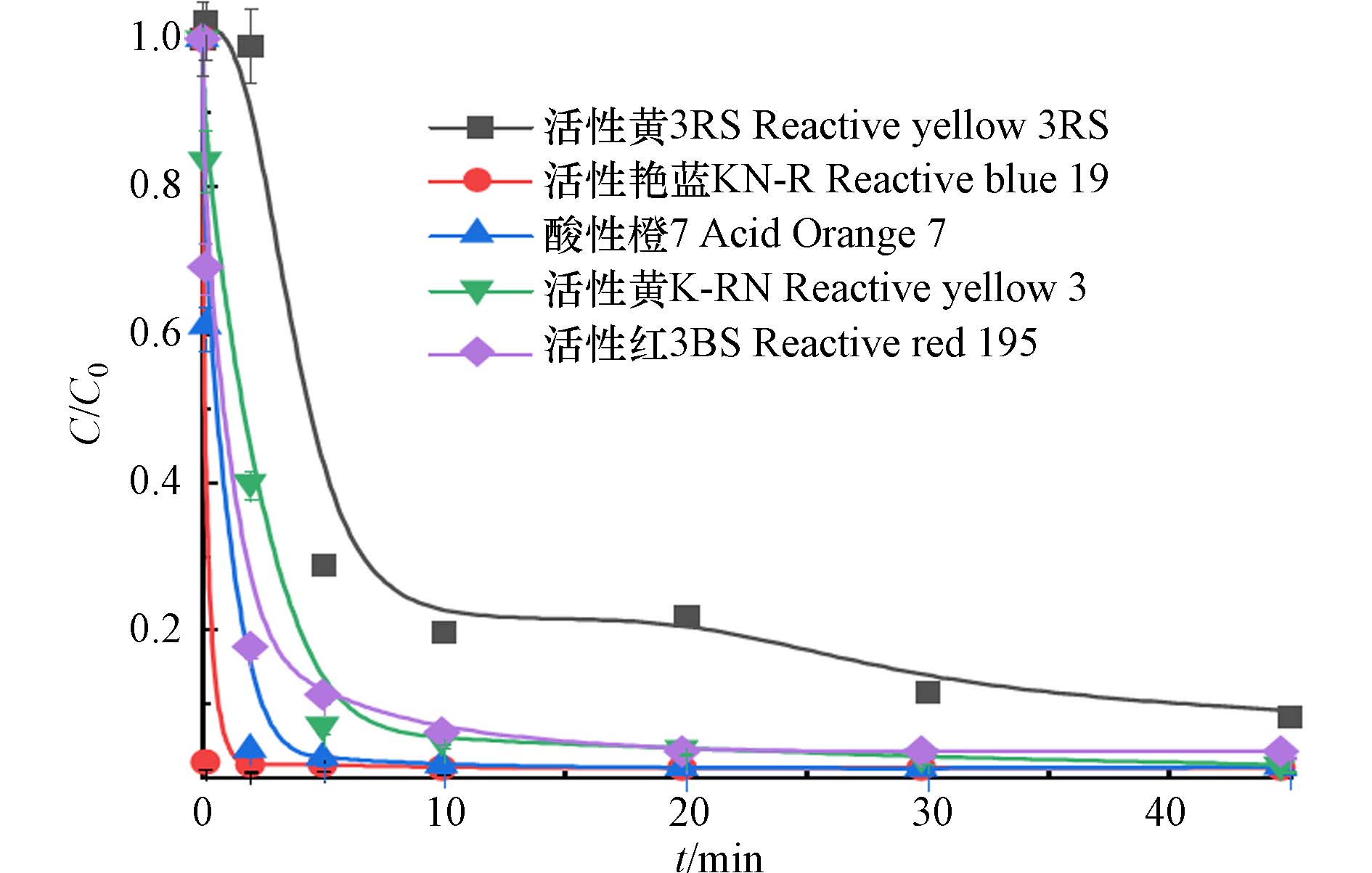
考察E-PM-PMS体系对不同染料的降解效果. 活性艳蓝KN-R、活性黄K-RN、酸性橙7、活性红3BS、活性黄3RS是常用的染料,用E-PM-PMS体系对这几种染料进行降解,考察E-PM-PMS体系的降解能力. 如图11所示,反应2 min时,活性艳蓝KN-R的降解率达99.3%,表现出较快的降解速率. 反应45 min时,活性艳蓝KN-R、活性黄K-RN、酸性橙7的降解率均达到99%以上,活性黄3RS、活性红3BS的降解率也可达到90%以上,染料大部分被降解. E-PM-PMS体系对不同的染料降解效果显著,体现出对染料降解的适应性和广泛性,具有降解不同染料的应用潜力.
-
(1) E、PM、PMS之间有显著的协同作用,对活性黄K-RN有明显的降解和矿化效果. 在PM浓度为0.8 mmol·L−1、PMS浓度为1 mmol·L−1、电流密度为26.29 mA·cm−2、初始pH为6、Na2SO4浓度为50 mmol·L−1的条件下,反应20 min对活性黄K-RN的降解率达95.8%,反应120 min对活性黄K-RN的矿化率为47.96%.
(2)E-PM-PMS体系在降解活性黄K-RN的过程中产生了SO4·−、·OH、1O2和·O2−等活性氧物种,E-PM-PMS体系降解活性黄K-RN的过程为自由基主导的降解过程,主要通过偶氮键断裂、还原反应、开环反应等反应过程使活性黄K-RN降解成小分子物质.
(3)E-PM-PMS体系对活性艳蓝KN-R、酸性橙7、活性红3BS、活性黄3RS等染料均有显著的降解效果.
电-高锰酸钾-过一硫酸盐体系的构建及对偶氮染料活性黄K-RN的降解
Construction the process of electro-potassium permanganate-peroxymonosulfate and degradation of azo dye Reactive Yellow 3
-
摘要: 为解决水中偶氮染料难降解的问题,构建了电-高锰酸钾-过一硫酸盐体系(E-PM-PMS体系),以活性黄K-RN为目标偶氮染料,考察了PM浓度、PMS浓度、电流密度、初始pH、水体背景对活性黄K-RN降解的影响. 结果表明,E、PM、PMS之间有明显的协同作用. 在PM浓度为0.8 mmol·L−1、PMS浓度为1 mmol·L−1、电流密度为26.29 mA·cm−2、初始pH为6、硫酸钠浓度为50 mmol·L−1的条件下,反应20 min对活性黄K-RN的降解率为95.8%,反应120 min对活性黄K-RN的矿化率为47.96%. 电子自旋共振(ESR)测试证明,E-PM-PMS体系在降解活性黄K-RN的过程中产生了SO4·−、·OH、1O2和·O2−等活性氧物种,E-PM-PMS体系降解活性黄K-RN是以自由基为主导的降解过程. 此外,考察了E-PM-PMS体系对不同染料有显著的降解效果. 该研究提出的E-PM-PMS体系为偶氮染料的降解提供了理论依据和技术参考.Abstract: The electro-potassium permanganate- peroxymonosulfate (E-PM-PMS) process was constructed to address the challenge of the recalcitrant degradation of azo dyes in water. In this study, Reactive Yellow 3 azo dye was as the degradation target, and the effects of PM concentration, PMS concentration, current density, initial pH, and aqueous background were investigated, the results indicated a clear synergistic effect between E, PM, and PMS. The degradation rate of Reactive Yellow 3 after 20 minutes of reaction was 95.8%, and the mineralization rate of Reactive Yellow 3 after 120 minutes of reaction was 47.96%, under the experimental conditions: PM concentration was 0.8 mmol·L−1, PMS concentration was 1 mmol·L−1, current density was 26.29 mA·cm−2, initial pH was 6, and Na2SO4 concentration was 50 mmol·L−1. Moreover, the E-PM-PMS process produced reactive oxygen species, including SO4·−, ·OH, 1O2, and ·O2−, which was detected by the electron spin resonance (ESR) test. The main drivers of degradation of Reactive Yellow 3 were free radicals in the E-PM-PMS process. In addition, the significant effects was shown by degrading various dyes in the E-PM-PMS process. The proposed E-PM-PMS process offers a theoretical foundation and technical guidance for the degradation of azo dyes.
-
Key words:
- electrochemical /
- potassium permanganate /
- peroxymonosulfate /
- azo dyes /
- reactive yellow 3.
-

-
表 1 不同体系降解活性黄K-RN的协同系数
Table 1. Synergistic index of degradation Reactive Yellow 3 in different processes
体系
ProcessE PM PMS E-PM E-PMS PM-PMS E-PM-PMS k/min−1 0.0053 0.00042 0.00578 0.01284 0.00751 0.06387 0.24952 R2 1 0.3655 1 1 1 0.9998 0.9992 SI — — — 2.245 0.6778 10.302 21.697 表 2 不同体系的反应速率常数及降解贡献比
Table 2. Reactionrateconstant of different processes and degradation contribution ratio
无淬灭剂
No quenching agent加MeOH
Add MeOHE体系
E process自由基
Free radical非自由基
Non-free radical动力学常数/(×10−3 min−1) 249.52 11.84 5.3 237.68 6.54 贡献/% — — 2.12 95.26 2.62 -
[1] LI Y Y, CAO P, WANG S, et al. Research on the treatment mechanism of anthraquinone dye wastewater by algal-bacterial symbiotic system[J]. Bioresource Technology, 2022, 347: 126691. doi: 10.1016/j.biortech.2022.126691 [2] LIU Z C, KHAN T A, ISLAM M A, et al. A review on the treatment of dyes in printing and dyeing wastewater by plant biomass carbon[J]. Bioresource Technology, 2022, 354: 127168. doi: 10.1016/j.biortech.2022.127168 [3] PENSUPA N, LEU S Y, HU Y Z, et al. Recent trends in sustainable textile waste recycling methods: Current situation and future prospects[J]. Topics in Current Chemistry, 2017, 375(5): 76. doi: 10.1007/s41061-017-0165-0 [4] RAWAT D, SHARMA R S, KARMAKAR S, et al. Ecotoxic potential of a presumably non-toxic azo dye[J]. Ecotoxicology and Environmental Safety, 2018, 148: 528-537. doi: 10.1016/j.ecoenv.2017.10.049 [5] 李春庚, 甄新, 李亚丽, 等. 印染废水染料降解技术研究进展[J]. 应用化工, 2022, 51(5): 1439-1444. doi: 10.3969/j.issn.1671-3206.2022.05.043 LI C G, ZHEN X, LI Y L, et al. Advances in dye degradation technology of printing and dyeing wastewater[J]. Applied Chemical Industry, 2022, 51(5): 1439-1444 (in Chinese). doi: 10.3969/j.issn.1671-3206.2022.05.043
[6] 宗刚, 高存. 金属氧化物光催化剂降解偶氮染料废水的研究进展[J]. 应用化工, 2023, 52(3): 874-879. doi: 10.3969/j.issn.1671-3206.2023.03.044 ZONG G, GAO C. Research progress on degradation of azo dye wastewater by metal oxide photocatalyst[J]. Applied Chemical Industry, 2023, 52(3): 874-879 (in Chinese). doi: 10.3969/j.issn.1671-3206.2023.03.044
[7] ZAFAR S, BUKHARI D A, REHMAN A. Azo dyes degradation by microorganisms - An efficient and sustainable approach[J]. Saudi Journal of Biological Sciences, 2022, 29(12): 103437. doi: 10.1016/j.sjbs.2022.103437 [8] YAMJALA K, NAINAR M S, RAMISETTI N R. Methods for the analysis of azo dyes employed in food industry - A review[J]. Food Chemistry, 2016, 192: 813-824. doi: 10.1016/j.foodchem.2015.07.085 [9] SEN S K, RAUT S, BANDYOPADHYAY P, et al. Fungal decolouration and degradation of azo dyes: A review[J]. Fungal Biology Reviews, 2016, 30(3): 112-133. doi: 10.1016/j.fbr.2016.06.003 [10] LIU L M, CHEN Z, ZHANG J W, et al. Treatment of industrial dye wastewater and pharmaceutical residue wastewater by advanced oxidation processes and its combination with nanocatalysts: A review[J]. Journal of Water Process Engineering, 2021, 42: 102122. doi: 10.1016/j.jwpe.2021.102122 [11] LIU Z, DING H J, ZHAO C, et al. Electrochemical activation of peroxymonosulfate with ACF cathode: Kinetics, influencing factors, mechanism, and application potential[J]. Water Research, 2019, 159: 111-121. doi: 10.1016/j.watres.2019.04.052 [12] ZHU Y H, ZHAO C, LIANG J L, et al. Rapid removal of diclofenac in aqueous solution by soluble Mn(III) (aq) generated in a novel Electro-activated carbon fiber-permanganate (E-ACF-PM) process[J]. Water Research, 2019, 165: 114975. doi: 10.1016/j.watres.2019.114975 [13] ZHU Y, DING H J, FAN J H, et al. Nonradical activation of peroxydisulfate with in situ generated amorphous MnO2 in an electro-permanganate process: Involvement of singlet oxygen, electron transfer, and Mn(Ⅲ)aq[J]. ACS ES& T Engineering, 2022, 2(7): 1316-1325. [14] ZHU Y H, WANG X X, ZHANG J, et al. Generation of active Mn(Ⅲ)aq by a novel heterogeneous electro-permanganate process with manganese(II) as promoter and stabilizer[J]. Environmental Science & Technology, 2019, 53(15): 9063-9072. [15] 吴永杭, 胡方明, 张珊, 等. 商用TiO2催化臭氧降解活性黄3RE的研究[J]. 广东化工, 2022, 49(15): 125-127. doi: 10.3969/j.issn.1007-1865.2022.15.043 WU Y H, HU F M, ZHANG S, et al. Catalytic ozonation of aqueous reactive yellow 3RE with commercial TiO2[J]. Guangdong Chemical Industry, 2022, 49(15): 125-127 (in Chinese). doi: 10.3969/j.issn.1007-1865.2022.15.043
[16] 唐孟姣, 薛秀玲, 赖小丽. Al~0-O2体系降解活性黄3RS溶液[J]. 环境化学, 2015, 34(7): 1350-1355. doi: 10.7524/j.issn.0254-6108.2015.07.2014122303 TANG M J, XUE X L, LAI X L. Degradation of reactive yellow 3RS by the Al0-O2 system[J]. Environmental Chemistry, 2015, 34(7): 1350-1355 (in Chinese). doi: 10.7524/j.issn.0254-6108.2015.07.2014122303
[17] 朱驯, 项东升, 刘德驹, 等. 内电解-超声波耦合处理活性黄3RX染料废水的研究[J]. 工业水处理, 2010, 30(3): 25-27,71. doi: 10.3969/j.issn.1005-829X.2010.03.008 ZHU X, XIANG D S, LIU D J, et al. Experimental study on the treatment of active yellow 3RX wastewater by internal electrolysis and ultrasonic irradiation[J]. Industrial Water Treatment, 2010, 30(3): 25-27,71 (in Chinese). doi: 10.3969/j.issn.1005-829X.2010.03.008
[18] PAPIĆ S, VUJEVIĆ D, KOPRIVANAC N, et al. Decolourization and mineralization of commercial reactive dyes by using homogeneous and heterogeneous Fenton and UV/Fenton processes[J]. Journal of Hazardous Materials, 2009, 164(2/3): 1137-1145. [19] PANIZZA M, CERISOLA G. Removal of organic pollutants from industrial wastewater by electrogenerated Fenton’s reagent[J]. Water Research, 2001, 35(16): 3987-3992. doi: 10.1016/S0043-1354(01)00135-X [20] 张静, 张宏龙, 王定祥, 等. 强化高锰酸钾氧化体系中自由基的产生与利用研究进展[J]. 环境化学, 2021, 40(2): 487-496. doi: 10.7524/j.issn.0254-6108.2020062603 ZHANG J, ZHANG H L, WANG D X, et al. Generation and utilization of radicals during enhanced permanganate oxidation: A review[J]. Environmental Chemistry, 2021, 40(2): 487-496 (in Chinese). doi: 10.7524/j.issn.0254-6108.2020062603
[21] WANG L H, JIANG J, PANG S Y, et al. Further insights into the combination of permanganate and peroxymonosulfate as an advanced oxidation process for destruction of aqueous organic contaminants[J]. Chemosphere, 2019, 228: 602-610. doi: 10.1016/j.chemosphere.2019.04.149 [22] KHAN A, ZHANG K K, SUN P, et al. High performance of the A-Mn2O3 nanocatalyst for persulfate activation: Degradation process of organic contaminants via singlet oxygen[J]. Journal of Colloid and Interface Science, 2021, 584: 885-899. doi: 10.1016/j.jcis.2020.10.021 [23] LIANG C J, WANG Z S, MOHANTY N. Influences of carbonate and chloride ions on persulfate oxidation of trichloroethylene at 20 ℃[J]. Science of the Total Environment, 2006, 370(2/3): 271-277. [24] 吕亭亭. NTA-Fe(Ⅲ)活化过一硫酸钾降解阿特拉津的效能研究[D]. 沈阳: 沈阳建筑大学, 2018. LÜ/LV/LU/LYU) T T. Study on the degradation efficiency of atrazine by NTA-Fe(Ⅲ) activated potassium persulfate[D]. Shenyang: Shenyang Jianzhu University, 2018 (in Chinese).
[25] SONG H R, YAN L X, MA J, et al. Nonradical oxidation from electrochemical activation of peroxydisulfate at Ti/Pt anode: Efficiency, mechanism and influencing factors[J]. Water Research, 2017, 116: 182-193. doi: 10.1016/j.watres.2017.03.035 [26] CHU W, WANG Y R, LEUNG H F. Synergy of sulfate and hydroxyl radicals in UV/S2O82−/H2O2 oxidation of iodinated X-ray contrast medium iopromide[J]. Chemical Engineering Journal, 2011, 178: 154-160. doi: 10.1016/j.cej.2011.10.033 [27] BUXTON G, GREENSTOCK C, HELMAN W, et al. Critical Review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (·OH/·O− in Aqueous Solution[J]. Journal of Physical and Chemical Reference Data, 1988, 17: 513-886. doi: 10.1063/1.555805 [28] YANG Y, BANERJEE G, BRUDVIG G W, et al. Oxidation of organic compounds in water by unactivated peroxymonosulfate[J]. Environmental Science & Technology, 2018, 52(10): 5911-5919. [29] PADMAJA S, ALFASSI Z B, NETA P, et al. Rate constants for reactions of SO42-radicals in acetonitrile[J]. International Journal of Chemical Kinetics, 1993, 25(3): 193-198. doi: 10.1002/kin.550250307 [30] MOHAMMAD M, KHAN A Y, SUBHANI M S, et al. Kinetics and electrochemical studies on superoxide[J]. Research on Chemical Intermediates, 2001, 27(3): 259-267. doi: 10.1163/156856701300356473 [31] YANG Y, JIANG J, LU X L, et al. Production of sulfate radical and hydroxyl radical by reaction of ozone with peroxymonosulfate: A novel advanced oxidation process[J]. Environmental Science & Technology, 2015, 49(12): 7330-7339. [32] ZHOU Y, JIANG J, GAO Y A, et al. Activation of peroxymonosulfate by benzoquinone: A novel nonradical oxidation process[J]. Environmental Science & Technology, 2015, 49(21): 12941-12950. [33] 陈军超. TEMPO捕获过氧自由基的机理研究[D]. 哈尔滨: 哈尔滨工业大学, 2018. CHEN J C. Study on the mechanism of TEMPO capturing peroxy free radicals[D]. Harbin: Harbin Institute of Technology, 2018 (in Chinese).
[34] ZHANG H, WANG Z, LIU C, et al. Removal of COD from landfill leachate by an electro/Fe2+/peroxydisulfate process[J]. Chemical Engineering Journal, 2014, 250: 76-82. doi: 10.1016/j.cej.2014.03.114 [35] WANG Y R, CHU W. Degradation of 2, 4, 5-trichlorophenoxyacetic acid by a novel Electro-Fe(Ⅱ)/Oxone process using iron sheet as the sacrificial anode[J]. Water Research, 2011, 45(13): 3883-3889. doi: 10.1016/j.watres.2011.04.034 [36] WANG S Z, WANG J L. Degradation of carbamazepine by radiation-induced activation of peroxymonosulfate[J]. Chemical Engineering Journal, 2018, 336: 595-601. doi: 10.1016/j.cej.2017.12.068 [37] 刘臻. 活性炭纤维阴极电活化过硫酸盐去除水中难降解有机污染物研究[D]. 重庆: 重庆大学, 2019. LIU Z. Study on removal of refractory organic pollutants from water by activated carbon fiber cathode electro-activated persulfate[D]. Chongqing: Chongqing University, 2019 (in Chinese).
[38] ZHU S S, LI X J, KANG J A, et al. Persulfate activation on crystallographic manganese oxides: Mechanism of singlet oxygen evolution for nonradical selective degradation of aqueous contaminants[J]. Environmental Science & Technology, 2019, 53(1): 307-315. [39] CHENG X, GUO H G, ZHANG Y L, et al. Non-photochemical production of singlet oxygen via activation of persulfate by carbon nanotubes[J]. Water Research, 2017, 113: 80-88. doi: 10.1016/j.watres.2017.02.016 [40] 阳海, 胡倩, 聂信, 等. UVC/过硫酸盐/乙腈反应体系的构建及对茜素类染料的降解[J]. 环境化学, 2023, 42(1): 327-336. doi: 10.7524/j.issn.0254-6108.2021090902 YANG H, HU Q, NIE X, et al. Construction of UVC/persulfate/acetonitrile reaction system and its degradation of alizarin dyes[J]. Environmental Chemistry, 2023, 42(1): 327-336 (in Chinese). doi: 10.7524/j.issn.0254-6108.2021090902
[41] 廖冬梅, 王正江. TMT药剂含量测定[J]. 热力发电, 2019, 48(1): 115-120. LIAO D M, WANG Z J. Detection of TMT concentration[J]. Thermal Power Generation, 2019, 48(1): 115-120 (in Chinese).
[42] 廉雨, 赖波, 周岳溪, 等. 电芬顿氧化法处理酸性橙Ⅱ模拟废水[J]. 环境科学研究, 2012, 25(3): 328-332. LIAN Y, LAI B, ZHOU Y X, et al. Treatment of acid orange Ⅱ simulated wastewater by electro-Fenton oxidation[J]. Research of Environmental Sciences, 2012, 25(3): 328-332 (in Chinese).
-



 下载:
下载: