-
含氮污染物广泛存在于工业废水与污泥中,如煤化工废水、制药废水、染料废水、城市污泥等,其可生化性差、难降解,为废物处置技术提出了很大难题. 据统计,2020年我国工业废水排放总量高达177.2亿吨,工业源总氮排放量为11.4万吨. 城镇生活污水排放量逐年上升,2020年已高达571.36亿吨,随着城镇污水处理厂处理规模的增大,污水处理产生的污泥量急剧增加,2020年我国干污泥产生量已达到
1162.8 万吨,污水中含有大量的氮元素,其中约有20%—30%的氮会转入污泥中. 当前,工业废水与污泥中含氮污染物的处理不当或者未经处理就直接排放,所引起的水体富营养化,已造成日益严重的地表水污染问题,同时严重威胁着我国人民的健康与安全. 因此,对废水及污泥中含氮污染物的高效、彻底处理已经成为当前面临的重要环境问题之一,妥善解决该问题,是十分艰巨而紧迫的任务.超临界水氧化(supercritical water oxidation,简称SCWO)技术是在水的临界点以上,可以安全、干净、有效地降解有机物含量低于20%wt的有机废液的水处理技术[1 − 2]. 在纯水的临界点附近或高于临界点,超临界水(SCW)的热物理性质相对于常温下的水发生了明显改变. 介电常数明显降低导致碳氢化合物和气体如O2、N2和CO2在SCW中的溶解度显著增加,氧化反应在均相环境中进行,进而避免了相界面对传质和传热的相间阻力. 相反地,无机盐在超临界水中的溶解度急剧下降. 另外,SCW的低黏度保证了反应物在其中的高扩散率,进而促进快速有效的氧化反应. 因此超临界水为有机物的氧化降解提供了理想的反应媒介[3]. SCWO已在高浓度有机废水(造纸、切削液、垃圾渗滤液等)、高能材料(推进剂、核废料等)、污泥(城市污泥、印染污泥、油泥等)的处理中表现出了优异的效果.
对于含氮污染物的SCWO处理研究发现,氮降解要比有机碳去除困难. 在600 ℃、氧化系数3.4和反应时间600 s时,垃圾渗滤液处理后出水的TOC去除率为92.5%,而NH4-N去除率仅50.9%[4]. 对于半焦废水,在600 ℃、氧化系数1.3 min和10 min时,COD和NH4-N去除率分别为99.02%和63.94%[5]. 城市污泥实验研究也得到了相同的结论[6],在550 ℃和600 ℃,反应20 min后,初始污泥中
4214 mg·L−1的NH4-N仅可分别降解到3000 mg·L−1和1100 mg·L−1. 含氮有机物分为氨基类、含氮杂环类、硝基类、复合基团类等. Yang等[7]进行了14种含氮有机物的SCWO研究,对于含氨基和含氮杂环有机物,在400—500 ℃温度范围内,NH4+是主要的含氮产物,另外还有N2、少量的NO3−和有机氮,说明氨是限制这两类化合物中氮元素降解的关键中间产物. 针对苯胺和喹唑啉的SCWO脱氮研究也得到了相同的结论[8]. 硝基类有机物中的硝基断键后进一步被氧化为NO2−、NO3−和N2;而对于同时含有硝基和氨基的复合基团化合物,由于NO3−也是一种主要的中间产物,与已生成的NH4+矿化而生成N2. 综上所述,顽固的氨是含氨基和含氮杂环有机物SCWO的重要中间产物[9],由于其高活化能的链初始反应,氨的进一步降解需要高水平的温度(大于700 ℃)[10],这对于设备材料、系统安全可靠运行及能量优化都提出了很高的要求. 已有研究通过添加催化剂[4]、活性助剂[11]、后续处理[12]等方式来改善这一问题.活性醇的SCWO反应会快速释放活性自由基与反应热,可为顽固组分的强化降解提供动力学与热效应[13]. Al-Duri等进行了异丙醇与含氮杂环化合物C9H16N2的超临界水共氧化反应实验与动力学研究[14 − 15],结果表明异丙醇的加入可以供给顽固的NH4+额外的OH∙自由基,而氨的SCWO反应起始于∙OH自由基的夺氢反应,进而促进了液相NH4+向气相的N2和N2O的转化. 另外,在450 ℃、IPA/NH4+=4时,异丙醇的放热作用与自由基快速释放,共同促进了NH4+转化率达到了98%. 本课题组前期采用连续管式超临界水反应器,完成了甲醇对氨SCWO的作用机制实验研究,在预热温度415 ℃条件下,800 mmol·L−1甲醇所产生的91.26 ℃反应温升及初始反应阶段提供活性自由基,协同促进氨在适当反应温度524.6 ℃达到了接近完全的分解率97.3%[16]. 因此,为了实现含氮污染物中C、N元素的有效协同降解,有必要探索活性醇对含氮污染物强化氧化降解作用机制.
喹啉是工业废水与污泥中一种典型的含氮杂环化合物,极难生化降解,对环境和生物体有害[17]. 选择喹啉作为含氮污染物超临界水氧化强化降解的模型化合物进行研究,具有代表性与指导意义. 因此,本文首先以甲醇为辅助醇类助剂,考察反应参数对喹啉强化降解的影响,对比多种活性醇(一元醇和多元醇)的强化降解作用,最后对喹啉的SCWO反应路径进行分析.
-
本次实验采用喹啉作为含氮模型化合物,通过去离子水来配制喹啉水溶液. 质量浓度为30%wt的双氧水作为氧化剂. 采用甲醇、乙二醇和丙三醇作为活性助剂.
-
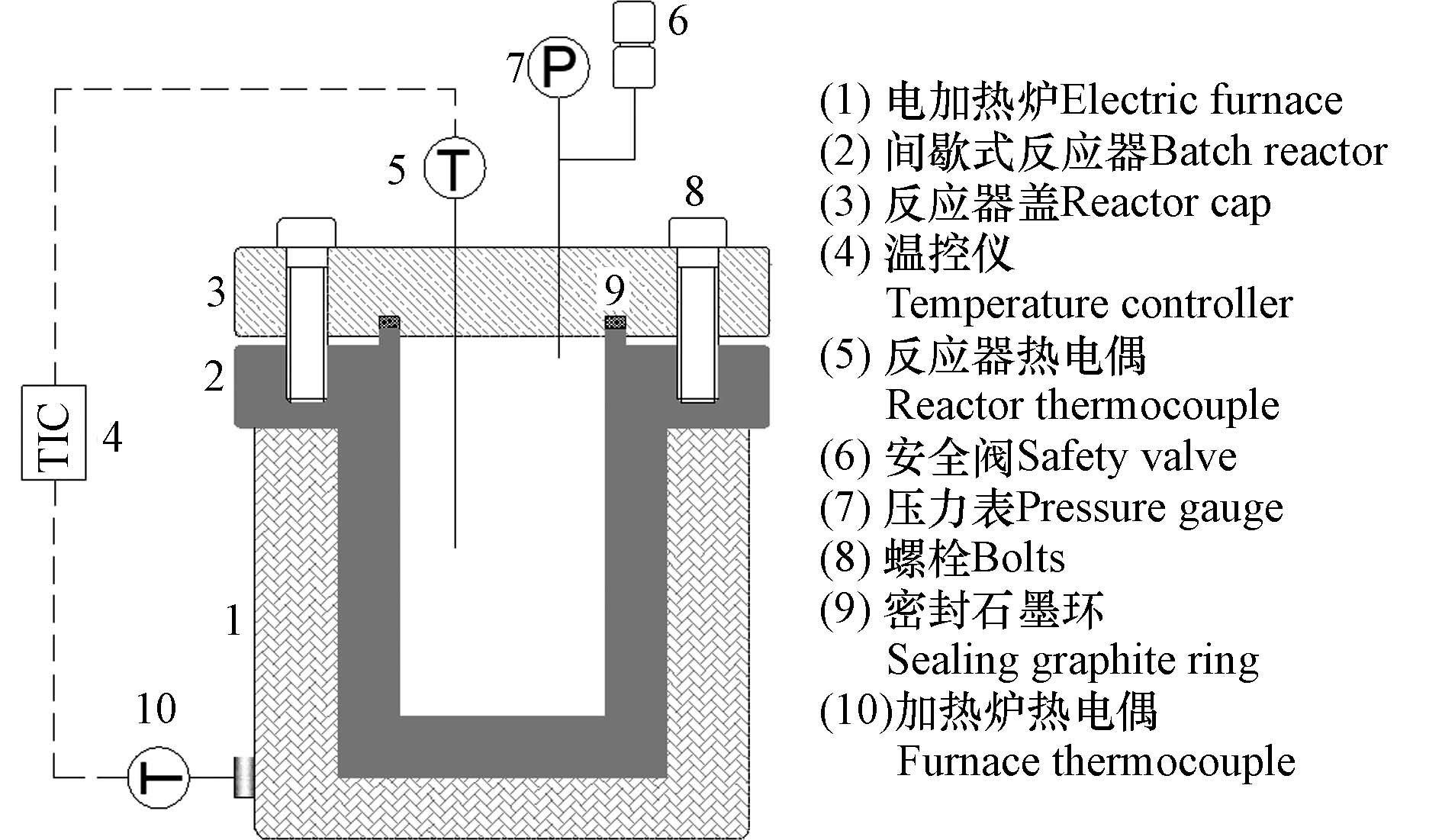
实验采用间歇式超临界水试验装置进行SCWO反应实验,具体装置流程图如图1所示. 间歇式反应器的容积为300 mL,材质为哈氏合金C276,设计参数为35 MPa、650 ℃. 反应器由功率为3.0 kW的电加热炉加热,反应器内流体温度和压力分别由热电偶和压力表监测. 通过温控仪来调节电加热炉与反应器流体温度,目的是保持反应流体温度在预期值±1 ℃范围内.
实验前,根据反应条件计算所需的反应物料体积. 将配制好的喹啉/醇混合溶液和30%wt双氧水依次加入反应器中,接下来对反应器密封、加热. 当达到反应压力和预热温度TP时开始计时,直至达到反应时间tR,本次实验中的反应时间tR都设定为5 min. 最后,关闭电加热器,使反应器快速冷却至室温. 取出反应后液体待测.
由于双氧水的稀释作用,实验中保证喹啉在混合物料中的浓度为1.125%wt,并且以下所述各个组分的浓度均为考虑双氧水稀释作用后的浓度值.
对SCWO反应氧化系数Φ的定义如式(1)所示. 其中[O2]need为所需氧化剂量,g;[O2]in为实际加入反应器的氧化剂量,g.
对反应后的总有机碳TOC和总氮TN去除率的定义分别如式(2)和(3)所示. 其中,X是去除率,下角标“0”和“f”分别指原样与出水中的浓度.
-
液相产物中的氨氮(NH4-N)浓度采用紫外分光光度计(DR6000)测定. TOC和TN浓度由总有机碳分析仪(Vario TOC)测定. 另外,通过气相色谱-质谱联用仪(GC-MS;Shimadzu,QP2010 Ultra)分析液相产物中的组分.
-
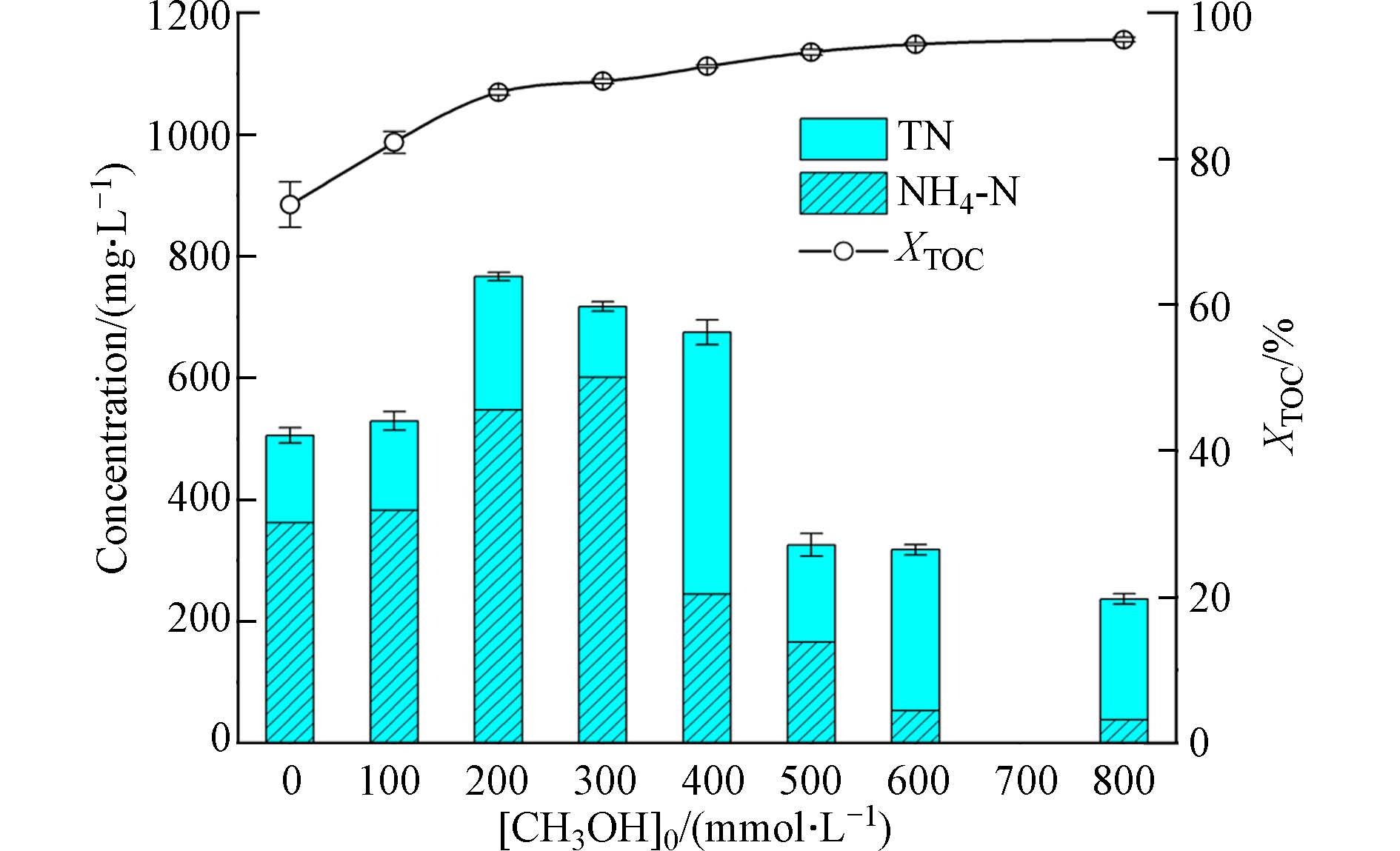
图2显示的是在反应温度450 ℃时,喹啉SCWO反应后的TN、NH4-N浓度和XTOC. 在初始甲醇浓度[CH3OH]0在0—800 mmol·L−1范围内,XTOC随着甲醇浓度的增加而明显上升,从71.7%上升至95.9%,表明甲醇对喹啉TOC降解的促进作用. 甲醇的促进作用可归因于其快速释放活性自由基的动力学效应,如反应式(4)—(7)所示. 羟基自由基∙OH是SCWO反应过程中最有效的氧化剂[18 − 19],甲醇的存在可以在反应初期加速∙OH的生成,有利于反应系统自由基池的积累,缩短顽固组分的反应诱导时间,进而加速有机碳的氧化分解.
另外,根据图2,反应后的TN和NH4-N浓度,均同时随着[CH3OH]0先增加后减少. 在[CH3OH]0为300 mmol·L−1时,TN和NH4-N达到最大值,分别为932.8 mg·L−1和782.9 mg·L−1,此时甲醇抑制了喹啉N元素的氧化降解. 直至甲醇添加量增加至600 mmol·L−1,出水的TN和NH4-N(511.2 mg·L−1和202.6 mg·L−1)才比纯喹啉反应的值(534.8 mg·L−1和470.3 mg·L−1)低. 这是因为活性助剂的动力学效应具有时效性,仅显著作用于甲醇发生反应的时间段内[20],而甲醇反应完全后,促使顽固组分分解的自由基只能来自于其本身,其反应即被抑制. NH3是喹啉SCWO的中间产物,对于较低浓度的甲醇(100—500 mmol·L−1),其产生的自由基在系统中存在时间与NH3生成不匹配. 甲醇反应完全后NH3才产生,无法为NH3的进一步氧化提供活性自由基,因而NH3限制氮元素的分解,甲醇对喹啉氮元素的氧化未起促进作用. 不仅如此,相对于纯喹啉反应,甲醇在较早时间的氧化消耗了一部分氧化剂,导致中间产物NH3反应时系统氧化剂浓度降低,因此出水TN和NH4-N浓度较纯喹啉反应高. 随着[CH3OH]0上升至600—800 mmol·L−1,甲醇才对氮元素的氧化分解起到促进作用. 高浓度甲醇不仅增加了自由基浓度,而且延长了自由基的存在时间,以致可参与中间产物NH3的链初始反应,如反应式(8)—(10)所示. 相对于纯喹啉反应,加入800 mmol·L−1甲醇,不仅可以使出水NH4-N浓度从470.3 mg·L−1下降至117.8 mg·L−1,XTN也从56.2%上升至62.7%. 然而,在甲醇浓度较高时,总氮中非氨氮形式的氮浓度在308—347 mg·L−1范围内. 已有研究表明,采用甲醇和异丙醇作为活性助剂时,增加醇浓度在促进氨分解的同时,出水硝酸根离子浓度也随之增加,原因在于醇在预热过程中分解形成了CO和自由基,而这些化合物在含氮化合物的氧化过程中会增加硝酸盐浓度[21 − 22]. 因此,在这一温度条件下,600—800 mmol·L−1甲醇可促进NH3分解,但其转化为硝酸氮,存在于液相产物中. 综上,600—800 mmol·L−1甲醇协同促进了喹啉中C、N元素的SCWO转化.
-
图3显示的是在反应温度500 ℃时的实验结果,相比于450 ℃,XTOC上升至73.7%—96.3%,TN和NH4-N浓度下降,说明提高温度加速了喹啉C、N元素的氧化降解. 并且三者随甲醇浓度的变化趋势与450 ℃一致. 不同的是,在500 ℃,TN和NH4-N浓度随[CH3OH]0变化曲线的峰值提前;并且500 mmol·L−1甲醇即开始起促进作用,相对于450 ℃时的600 mmol·L−1. 分析产生这一差异的原因,提高温度使喹啉向NH3的转化提前,进而使NH3的进一步反应与甲醇的自由基作用时间域有重叠. 当[CH3OH]0达到600 mmol·L−1和800 mmol·L−1时,出水NH4-N浓度已降低至53.4 mg·L−1和38.1 mg·L−1. 但是TN中非氨态氮的比例较高,为83%,高于450℃时的60%—74%. 这是因为在氨/甲醇混合反应系统中,提高反应温度有利于NO3−的生成[16].
-
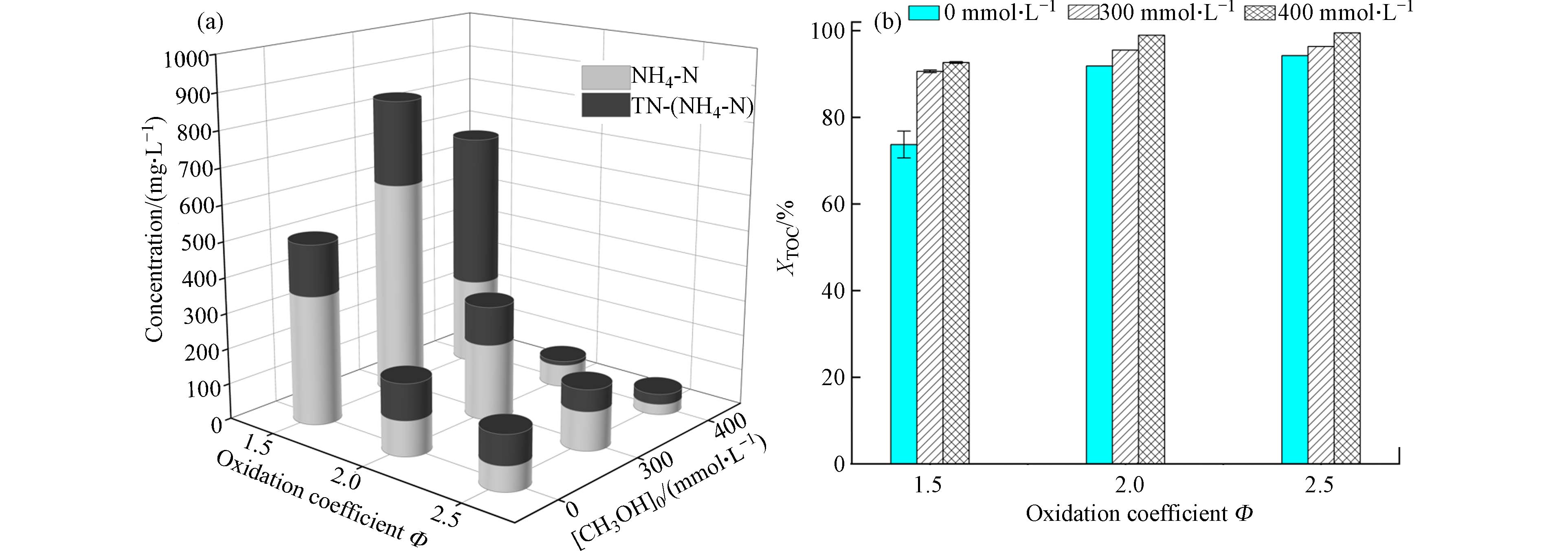
基于以上分析,喹啉氮元素的SCWO降解对活性组分浓度存在选择性,在添加300 mmol·L−1和400 mmol·L−1甲醇时,活性组分对TN和NH4-N的降解起抑制作用,所以接下来考察增加氧化剂量是否可改善这一负面影响,实验结果如图4所示. 可以得出,氧化系数Φ从1.5上升至2.5,喹啉中C、N元素的氧化降解均有所改善:1)对于纯喹啉反应,XTOC和XTN分别从73.7%和58.6%上升至94.2%和87.4%,NH4-N也从30.2 mg·L−1降低至22.9 mg·L−1;2)相对于Φ=1.5,在氧化系数2.0和2.5条件下,添加300 mmol·L−1甲醇对XTN和NH4-N依然起负面作用,然而当[CH3OH]0上升至400 mmol·L−1,XTN均比纯喹啉反应时高;3)在[CH3OH]0=400 mmol·L−1、Φ=2.5时,XTOC和XTN分别达到99.5%和95.1%,出水NH4-N浓度下降至9.8 mg·L−1. 综上所述,增加氧化剂量不仅可以促进有机物C、N元素的氧化分解,而且可以优化醇的动力学效应. 但在实际工程应用中,增加氧化剂量会导致处理费用显著提高,综合考虑各项因素后,氧化系数一般选择在1—2范围内.
-
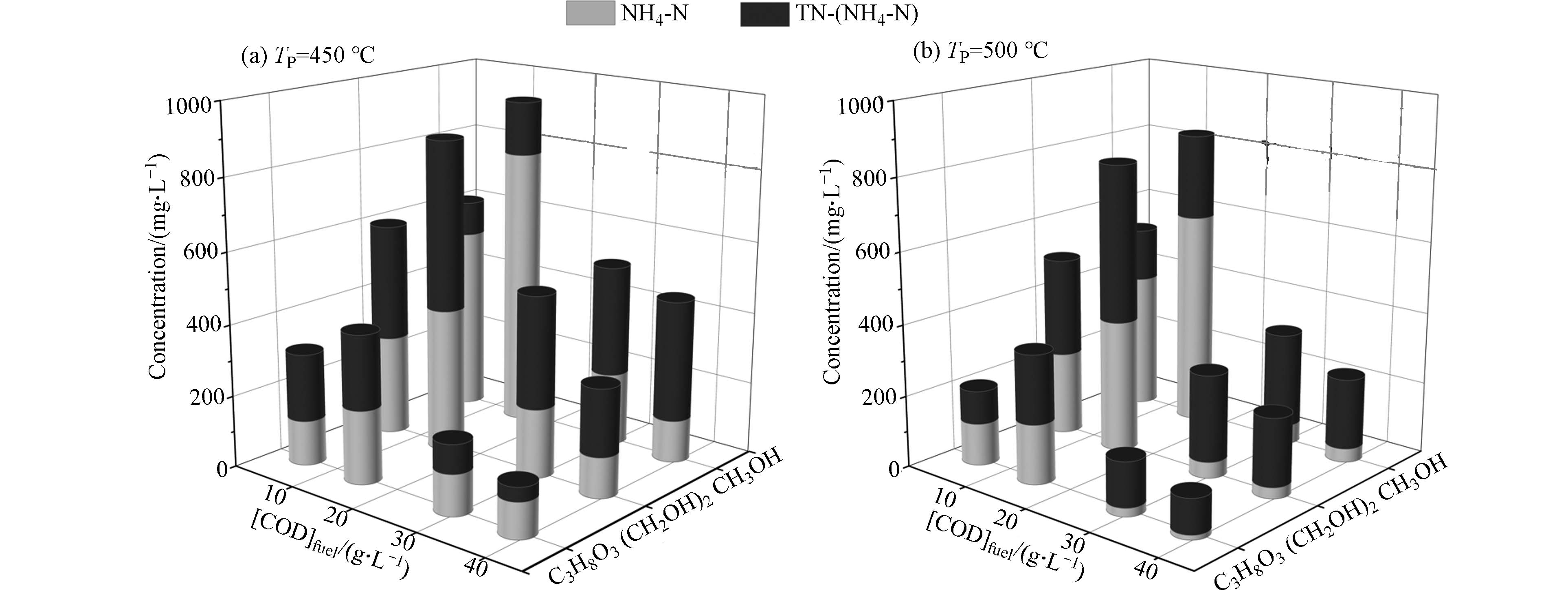
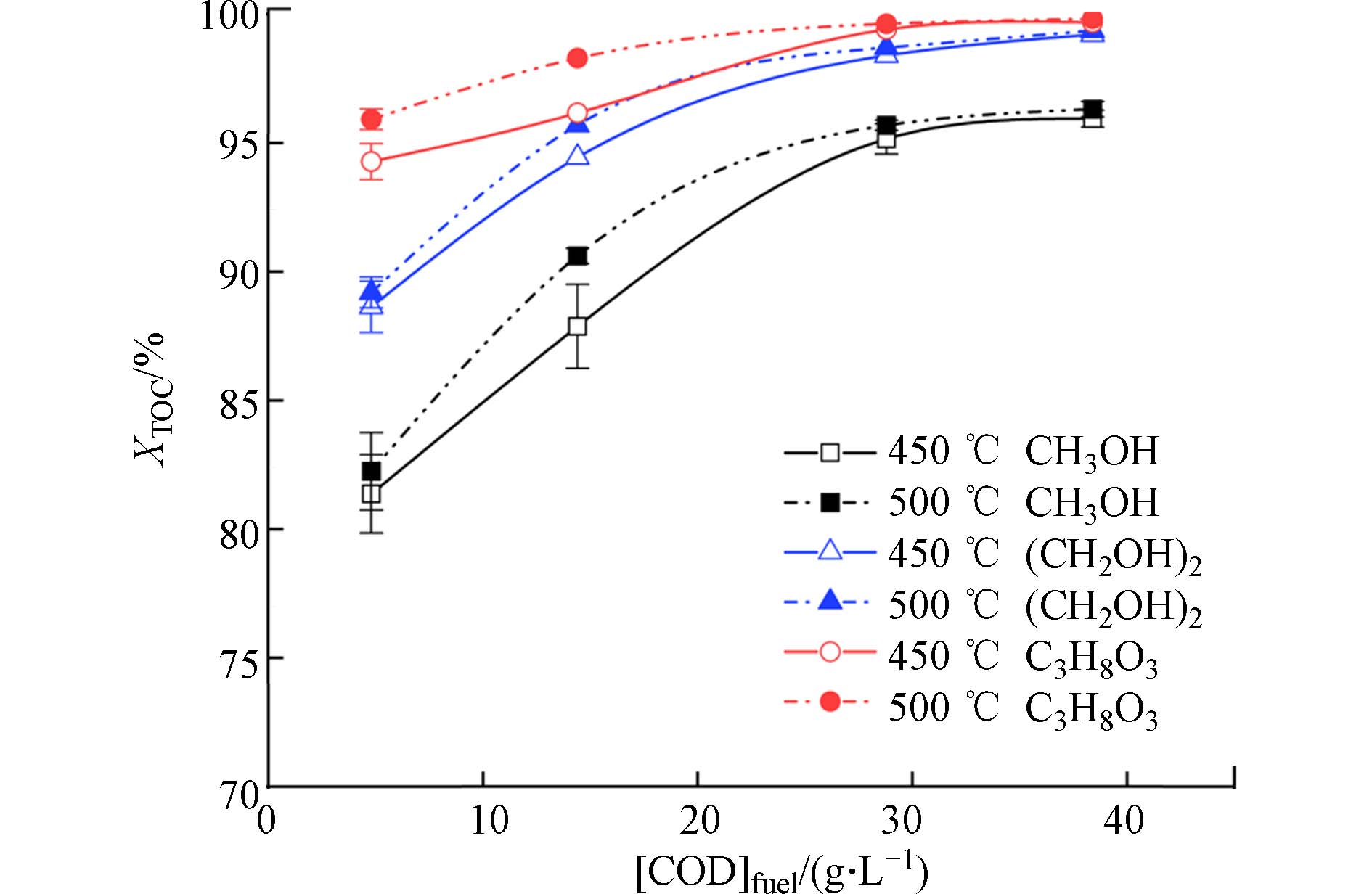
分别选择乙二醇和丙三醇这两种多元醇作为活性助剂,与甲醇实验结果进行对比,如图5和图6所示. 为了保证3种醇的理论氧化放热量一致,3种醇的实验COD浓度([COD]fuel)保持一致,在4.8—38.4 g·L−1范围内. 由图5得出,在反应温度为450 ℃和500 ℃时,添加的活性助剂从甲醇切换为乙二醇,反应后TN和NH4-N浓度有所降低,而随着丙三醇的加入,出水TN和NH4-N浓度显著下降. 并且在500 ℃时,2.37%wt丙三醇加入后,反应后出水的TN和NH4-N浓度仅为110.0 mg·L−1和12.9 mg·L−1. 不仅如此,在450 ℃时,甲醇存在时喹啉SCWO反应后XTOC在81.4%—95.9%范围内,乙二醇和丙三醇作为活性助剂时,反应的XTOC分别在88.6%—99.2%和94.3%—99.7%范围内. 对比结果表明,多元醇对喹啉SCWO分解的强化降解作用明显优于甲醇.
在含氮化合物/醇的混合SCWO反应初期,由于醇中C—O键断裂而形成∙OH自由基,攻击喹啉的吡啶环,使其中C—N键断裂而实现开环,接下来中间产物发生氧化、脱羧等反应,最终转化为简单小分子物质(H2O、CO2、CO、NH3、N2等)[23]. 醇类助剂所产生的剩余自由基参与了顽固反应物与中间产物的反应,进而加速整体反应进程. Chao等[24]将乙二醇作为钻井液废水SCWO的活性助剂,实验结果表明在580 ℃和10 min,添加150 mg·L−1乙二醇可使废水的COD去除率从82.50%上升至99.85%,由于乙二醇促进了OH∙自由基的生成,如反应式(11)所示. Reddy等[25]将丙三醇作为共氧化剂进行含氮化合物乙酰氨基酚的SCWO实验研究,在500 ℃、1 min、氧化系数1—3范围内,添加丙三醇可使TOC去除率从59.9%—89.3%上升至71.6%—96.2%. 基于以上分析,本实验所采用的3种醇释放自由基速率不同,而使其对喹啉的SCWO强化降解作用顺序为:CH3OH<(CH2OH)2<C3H8O3.
不仅如此,在醇浓度较高时,其氧化放热使反应体系温度增加,根据阿累尼乌斯反应速率方程,反应温度上升可明显地增加顽固组分的反应速率常数,进一步加速喹啉的氧化分解. 为了探究3种醇的放热特性,在管式反应器实验装置[26]上分别对甲醇、乙二醇、丙三醇进行SCWO实验,3种醇的浓度分别为2.56%wt、2.98 %wt和3.15 %wt,在预热温度440 ℃时的放热实验温度曲线如图7所示. 可以得出,甲醇在管式反应器0.0 m的汇点处未见温升,直至0.2 m温度才开始上升至498 ℃. 对于乙二醇,切换物料后,0.0 m处温度从440 ℃上升至500 ℃,0.2 m处温度从440 ℃上升至475 ℃. 对于丙三醇,反应温度在0.0 m处即从440 ℃上升至560 ℃,而在0.2 m处从440 ℃上升至493 ℃. 很明显,甲醇的放热滞后于乙二醇和丙三醇,并且其氧化放热达到的最高温度低于其他两种醇. 而乙二醇和丙三醇在有机物与氧化剂混合后即开始快速氧化,并放出热量. 实验结果表明,在SCWO条件下,3种醇的放热速率为:CH3OH<(CH2OH)2<C3H8O3. 多元醇在反应诱导期积累∙OH和HO2∙自由基的速率快,可在较短反应时间内快速释放,达到较高的峰值. 快速释放的自由基激发了醇类化合物的链初始反应,进而使放热提前. 反应体系温度的升高会使高温活化反应逐渐凸显,丰富自由基来源,进一步加速顽固组分降解.
-
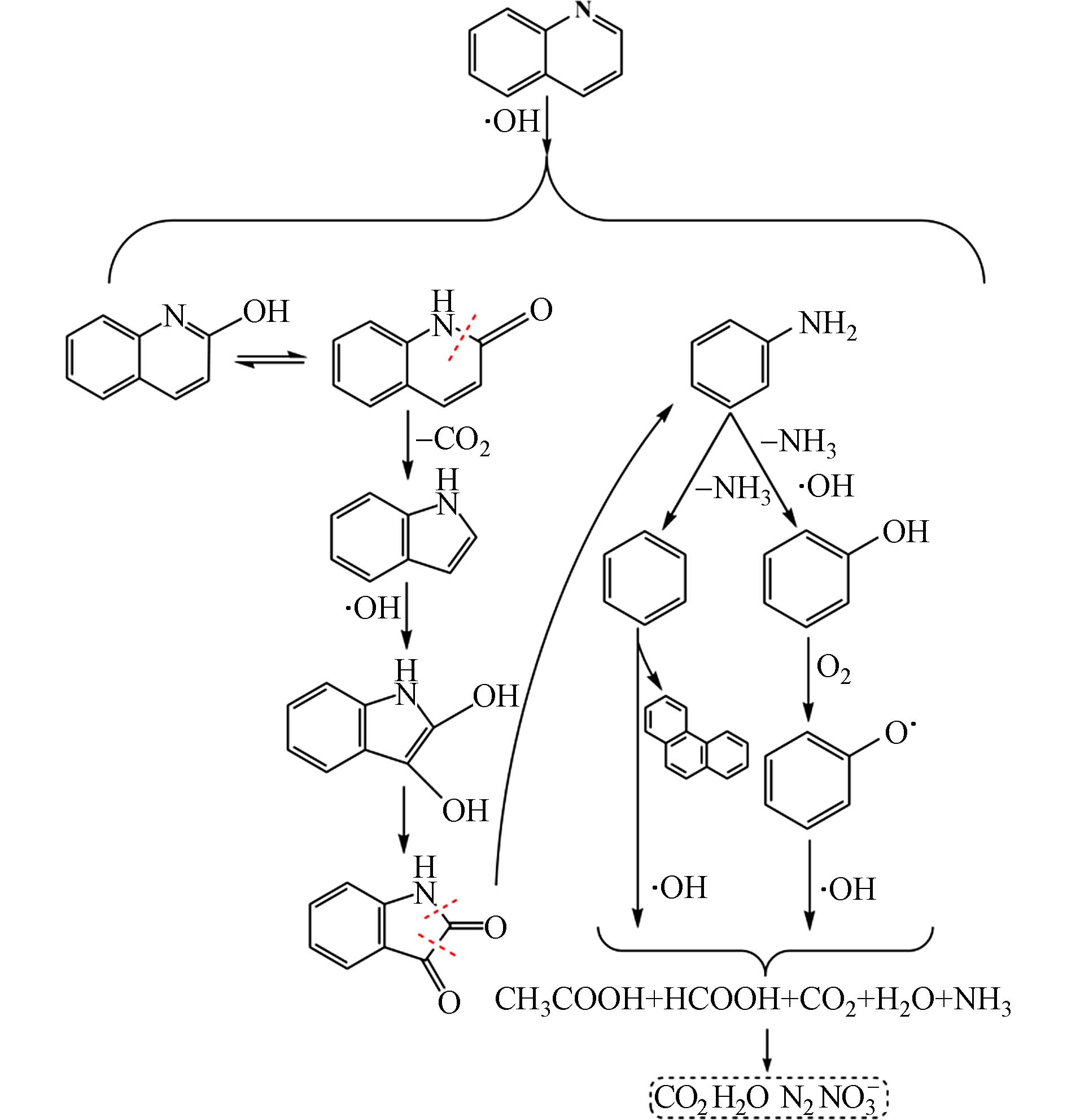
对喹啉在25MPa、500℃条件SCWO反应的液相产物进行GC-MS分析,结果如表1所示. Gong等推断在喹唑啉的SCWO路径中两种开环的可能性[23]. C—N的键能为305 kJ·mol·L−1,低于C—C的332 kJ·mol·L−1,因此可以认为C—N键断裂在N-杂环化合物的开环过程中起主导作用. 根据表1,检测到中间产物苯酚、苯胺、吲哚-2, 3-二酮,表明在实验条件下,喹啉的降解路径首先是吡啶环开环,其可能的反应路径如图8所示. 首先,喹啉被OH·攻击,发生羟基化而生成羟基喹啉,氧化生成羰基[27],此处的C—N键断裂后重整生成吲哚. 吲哚发生羟基化、氧化反应,而转化为吲哚-2, 3-二酮,进一步断键生成苯胺. 苯胺脱氨基转化为苯,过程中,被·OH攻击进一步生成苯酚[28]. 苯之间发生自由基偶联形成少量的多环中间体,如萘、菲等[29]. 苯酚与氧分子反应,形成酚氧自由基C6H5O·和过氧自由基HO2∙[30]. 苯与苯酚裂解开环形成羧酸,如草酸、乙酸、甲酸,进一步被矿化为CO2、H2O. 含氮中间产物NH3被氧化为N2、NO3−. 然而,在加入甲醇和丙三醇的喹啉SCWO反应后出水中仅检测到了羧酸类小分子物质,说明活性醇的加入增加了反应体系的∙OH自由基,而加速了喹啉及中间衍生物的脱氮、开环反应.
-
本文考察了活性醇对含氮化合物喹啉SCWO降解的作用规律. 在450 ℃和500 ℃,由于甲醇在较早反应时间快速释放∙OH自由基,可供给喹啉的氧化反应,100 mmol·L−1甲醇可加速二元混合反应的TOC降解,且甲醇浓度越高,促进作用越明显,即甲醇的动力学效应. 然而,由于喹啉中N元素的转化过程中生成了顽固中间产物NH3,其进一步氧化分解与甲醇释放自由基的进程之间关系密切,进而使反应后TN和NH4-N浓度随甲醇浓度的变化呈现为先增大后减少的趋势,直至[CH3OH]0达到500—600 mmol·L−1时,甲醇才对喹啉N元素降解起促进作用. 增加氧化剂量可改善甲醇的动力学效应,提高氧化系数至2.0和2.5,可使400 mmol·L−1甲醇在500 ℃对TN去除起促进作用. 通过对比甲醇和多元醇对喹啉SCWO强化降解作用得出,由于多元醇可增加反应初期活性自由基释放量与氧化放热量,3种醇的促进作用强弱遵循:CH3OH<(CH2OH)2<C3H8O3. 最后,对喹啉SCWO反应产物进行分析得出,喹啉的氧化降解路径起始于吡啶环开环.
醇对喹啉超临界水氧化的强化降解作用
Enhanced degradation of quinoline with alcohols in supercritical water oxidation
-
摘要: 对工业废水与污泥中含氮污染物的高效处理已成为一项重要的环境问题. 本研究以典型含氮化合物喹啉为研究对象,探索醇(甲醇、乙二醇和丙三醇)对喹啉超临界水氧化(SCWO)的强化降解机制,获得了反应参数对喹啉中碳、氮元素降解的影响规律,并且对喹啉的SCWO反应路径进行分析. 研究结果表明,在压力25 MPa、氧化系数1.5、反应温度450 ℃时,添加800 mmol·L−1甲醇,可使1.125%wt喹啉SCWO反应的XTOC和XTN分别达到95.9%和62.7%,比纯喹啉反应的71.6%和56.2%高得多. 提高反应温度和氧化系数可改善甲醇的动力学效应. 另外,对甲醇、乙二醇和丙三醇的强化降解效果进行对比得出,由于多元醇优异的动力学与热效应,三者对喹啉氧化的促进作用顺序为CH3OH<(CH2OH)2<C3H8O3. 喹啉的SCWO降解起始于吡啶环开环,发生羟基化、断键、开环等过程.Abstract: Effective treatment of nitrogen-containing pollutants in industrial wastewater and sludge has become an important environmental issue. The typical nitrogen-containing compound quinoline was employed to explore the enhanced degradation effects of active alcohols (methanol, ethylene glycol, and glycerol) during supercritical water oxidation (SCWO) of quinoline. The influences of reaction parameters on degradation of carbon and nitrogen in quinoline were studied. The SCWO reaction path of quinoline was analyzed. The results show that the XTOC and XTN for SCWO of 1.125%wt quinoline with 800 mmol·L−1 methanol were, respectively, 95.9% and 62.7% at pressure of 25 MPa, oxidation coefficient of 1.5, and reaction temperature of 450 °C, whereas only 71.6% and 56.2% were attained in the pure quinoline reaction. Increasing the reaction temperature and oxidation coefficient can improve the kinetic effect of methanol. In addition, the comparison of the enhanced degradation effects of methanol, ethylene glycol, and glycerol indicates that, due to the superior kinetic and thermal effects of polyols, the order of three alcohols’ promotion effects on quinoline oxidation was CH3OH < (CH2OH)2< C3H8O3. Finally, SCWO of quinoline was initiated by ring opening of the pyridine ring, and conducted hydroxylation, bond breaking and ring opening reactions.
-
Key words:
- supercritical water /
- quinoline /
- alcohol /
- oxidation.
-

-
表 1 喹啉SCWO产物GC-MS分析
Table 1. GC-MS analysis for SCWO products of quinoline
序号
No.出峰时间/min
Retention time化合物
Compounds化学结构式
Molecular structure1 10.76 苯酚 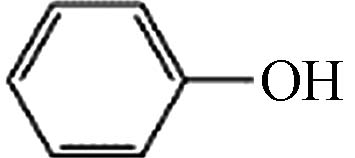
2 10.84 苯胺 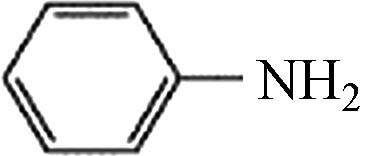
3 18.74 甲氧基乙酸 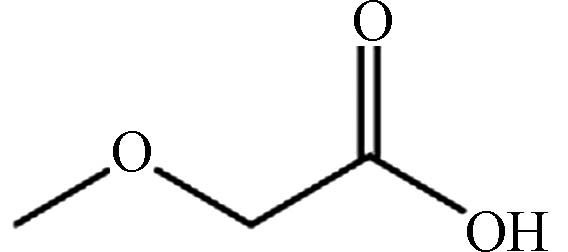
4 19.56 喹啉 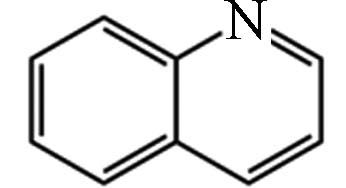
5 28.57 吲哚-2, 3-二酮 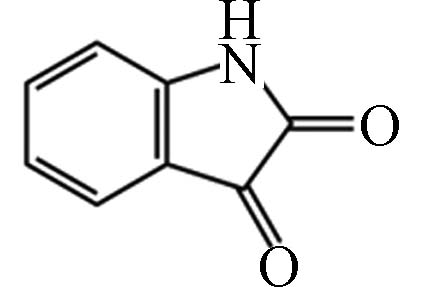
6 32.37 8-羟基喹啉 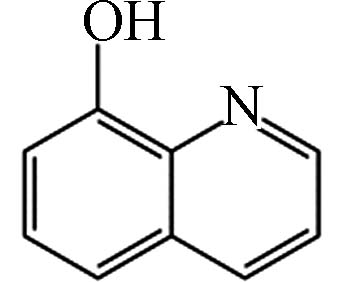
7 33.93 菲 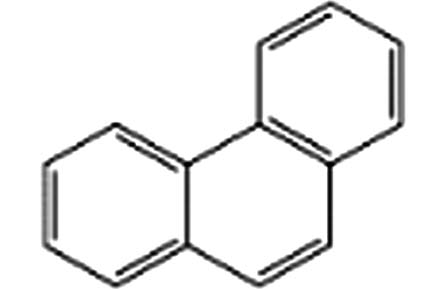
8 47.21 4-环己基苯酚 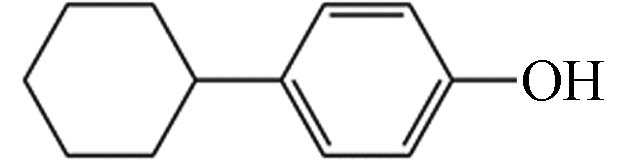
-
[1] HUANG Y F, ZHANG F M, LIANG Z J, et al. Effect of hydrothermal flame generation methods on energy consumption and economic performance of supercritical water oxidation systems[J]. Energy, 2023, 266: 126452. doi: 10.1016/j.energy.2022.126452 [2] REDDY S N, NANDA S, OKOLIE J A, et al. Hydrothermal flames for subaquatic, terrestrial and extraterrestrial applications[J]. Journal of Hazardous Materials, 2022, 424: 127520. doi: 10.1016/j.jhazmat.2021.127520 [3] XU T T, WANG S Z, LI Y H, et al. Review of the destruction of organic radioactive wastes by supercritical water oxidation[J]. Science of the Total Environment, 2021, 799: 149396. doi: 10.1016/j.scitotenv.2021.149396 [4] GONG Y M, GUO Y, SHEEHAN J D, et al. Oxidative degradation of landfill leachate by catalysis of CeMnOx/TiO2 in supercritical water: Mechanism and kinetic study[J]. Chemical Engineering Journal, 2018, 331: 578-586. doi: 10.1016/j.cej.2017.08.122 [5] LI J N, WANG S Z, LI Y H, et al. Supercritical water oxidation of semi-coke wastewater: Effects of operating parameters, reaction mechanism and process enhancement[J]. The Science of the Total Environment, 2020, 710: 134396. doi: 10.1016/j.scitotenv.2019.134396 [6] QIAN L L, WANG S Z, REN M M, et al. Co-oxidation effects and mechanisms between sludge and alcohols (methanol, ethanol and isopropanol) in supercritical water[J]. Chemical Engineering Journal, 2019, 366: 223-234. doi: 10.1016/j.cej.2019.02.046 [7] YANG B W, SHEN Z M, CHENG Z W, et al. Total nitrogen removal, products and molecular characteristics of 14N-containing compounds in supercritical water oxidation[J]. Chemosphere, 2017, 188: 642-649. doi: 10.1016/j.chemosphere.2017.08.069 [8] 王瀚, 徐东海, 王瑜, 等. 典型含氮有机化合物超临界水氧化脱氮过程[J]. 东北电力大学学报, 2021, 41(5): 1-8. WANG H, XU D H, WANG Y, et al. Denitrogenation processes of typical N-containing organic compounds in supercritical water oxidation[J]. Journal of Northeast Electric Power University, 2021, 41(5): 1-8 (in Chinese).
[9] SEGOND N, MATSUMURA Y, YAMAMOTO K. Determination of ammonia oxidation rate in sub- and supercritical water[J]. Industrial & Engineering Chemistry Research, 2002, 41(24): 6020-6027. [10] PLOEGER J M, GREEN W H, TESTER J W. Co-oxidation of ammonia and ethanol in supercritical water, part 2: Modeling demonstrates the importance of H[J]. International Journal of Chemical Kinetics, 2008, 40(10): 653-662. doi: 10.1002/kin.20345 [11] LI J N, WANG S Z, QIAN L L, et al. Supercritical water co-oxidation behavior in the different monohydric alcohol-ammonia reaction environment[J]. Chemosphere, 2022, 307(Pt 2): 135858. [12] LI J N, WANG S Z, LI Y H, et al. Experimental research and commercial plant development for harmless disposal and energy utilization of petrochemical sludge by supercritical water oxidation[J]. Chemical Engineering Research and Design, 2020, 162: 258-272. doi: 10.1016/j.cherd.2020.08.006 [13] ZHANG J, LI P, REN M M, et al. Effect of auxiliary fuel on degradation of ammonia in supercritical water: Kinetics analysis[J]. Fuel, 2021, 292: 120322. doi: 10.1016/j.fuel.2021.120322 [14] AL-DURI B, ALSOQYIANI F, KINGS I. Supercritical water oxidation (SCWO) for the removal of N-containing heterocyclic hydrocarbon wastes. Part I: Process enhancement by addition of isopropyl alcohol[J]. The Journal of Supercritical Fluids, 2016, 116: 155-163. doi: 10.1016/j.supflu.2016.05.002 [15] AL-DURI B, ALSOQYANI F. Supercritical water oxidation (SCWO) for the removal of nitrogen containing heterocyclic waste hydrocarbons. Part II: System kinetics[J]. The Journal of Supercritical Fluids, 2017, 128: 412-418. doi: 10.1016/j.supflu.2017.05.010 [16] ZHANG J, LI P, LU J L, et al. Supercritical water oxidation of ammonia with methanol as the auxiliary fuel: Comparing with isopropanol[J]. Chemical Engineering Research and Design, 2019, 147: 160-170. doi: 10.1016/j.cherd.2019.05.010 [17] 夏冬冬, 曹昉, 武琪, 等. 黄钾铁矾类Fenton法处理难降解有机物喹啉[J]. 工业水处理, 2019, 39(3): 46-50. doi: 10.11894/1005-829x.2019.39(3).046 XIA D D, CAO F, WU Q, et al. Treatment of refractory organic matter quinoline by jarosite Fenton-like method[J]. Industrial Water Treatment, 2019, 39(3): 46-50 (in Chinese). doi: 10.11894/1005-829x.2019.39(3).046
[18] AKIYA N, SAVAGE P E. Roles of water for chemical reactions in high-temperature water[J]. Chemical Reviews, 2002, 102(8): 2725-2750. doi: 10.1021/cr000668w [19] SAVAGE P E, YU J L, STYLSKI N, et al. Kinetics and mechanism of methane oxidation in supercritical water[J]. The Journal of Supercritical Fluids, 1998, 12(2): 141-153. doi: 10.1016/S0896-8446(97)00046-6 [20] SHIMODA E, FUJII T, HAYASHI R, et al. Kinetic analysis of the mixture effect in supercritical water oxidation of ammonia/methanol[J]. The Journal of Supercritical Fluids, 2016, 116: 232-238. doi: 10.1016/j.supflu.2016.05.052 [21] OE T, SUZUGAKI H, NARUSE I, et al. Role of methanol in supercritical water oxidation of ammonia[J]. Industrial & Engineering Chemistry Research, 2007, 46(11): 3566-3573. [22] CABEZA P, QUEIROZ J P S, ARCA S, et al. Sludge destruction by means of a hydrothermal flame. Optimization of ammonia destruction conditions[J]. Chemical Engineering Journal, 2013, 232: 1-9. doi: 10.1016/j.cej.2013.07.040 [23] GONG Y M, GUO Y, WANG S Z, et al. Supercritical water oxidation of Quinazoline: Effects of conversion parameters and reaction mechanism[J]. Water Research, 2016, 100: 116-125. doi: 10.1016/j.watres.2016.05.001 [24] CHAO M. Supercritical water oxidation of wastewater-based drilling fluid with glycol addition[J]. Journal of Advanced Oxidation Technologies, 2014, 17(2): 385-388. [25] PRASAD MYLAPILLI S V, REDDY S N. Supercritical water oxidation of recalcitrant acetaminophen with methanol, ethanol, n-propanol, isopropanol and glycerol as co-fuels[J]. Chemical Engineering Journal Advances, 2020, 3: 100028. doi: 10.1016/j.ceja.2020.100028 [26] ZHANG J, LI P, LU J L, et al. Supercritical hydrothermal combustion of nitrogen-containing compounds in a tubular reactor[J]. Fuel, 2020, 275: 117889. doi: 10.1016/j.fuel.2020.117889 [27] LIU S K, JIN H, WEI W W, et al. Gasification of indole in supercritical water: Nitrogen transformation mechanisms and kinetics[J]. International Journal of Hydrogen Energy, 2016, 41(36): 15985-15997. doi: 10.1016/j.ijhydene.2016.04.219 [28] GOPALAN S, SAVAGE P E. A reaction network model for phenol oxidation in supercritical water[J]. AIChE Journal, 1995, 41(8): 1864-1873. doi: 10.1002/aic.690410805 [29] LU Y J, JIN H, GUO L J, et al. Hydrogen production by biomass gasification in supercritical water with a fluidized bed reactor[J]. International Journal of Hydrogen Energy, 2008, 33(21): 6066-6075. doi: 10.1016/j.ijhydene.2008.07.082 [30] GOPALAN S, SAVAGE P E. Reaction mechanism for phenol oxidation in supercritical water[J]. The Journal of Physical Chemistry, 1994, 98(48): 12646-12652. doi: 10.1021/j100099a031 -



 下载:
下载: