-
生物炭特指为生物质在缺氧或有限氧气供应条件下,在相对较低温度下(<700 ℃)热解得到的富碳产物,通过施入土壤进行土壤管理,旨在改良土壤、提升地力、实现碳封存[1],2013年,国际生物炭协会(IBI)再次完善了生物炭的概念和内涵,指出生物炭是生物质在缺氧条件下通过热化学转化得到的固态产物,它可以单独或者作为添加剂使用,能够改良土壤、提高资源利用效率、改善或避免特定的环境污染,以及作为温室气体减排的有效手段。这一概念更侧重于在用途上区分生物炭与其他炭化产物,进一步突出其在农业、环境领域中的作用[2]。生物炭是一种多孔、高比表面积、难降解、含碳丰富的材料[3],在土壤中具有高度的稳定性,可以存在上千百万年[4-6]。研究表明生物炭对污染物具有高吸附性能,在土壤污染修复上具有很大的潜力[7-8]。近十年,研究者高度关注生物炭对土壤中重金属的影响,且多集中于生物炭固定土壤重金属[9]、影响重金属淋溶[10]和吸附-解吸[11]、改变重金属形态以及生物炭对重金属生物有效性影响[12-13]的研究。很多研究结果表明,生物炭可以有效吸附和固定土壤重金属,使重金属从有效态向稳定态转化,降低重金属的生物有效性,其机制有两方面:一方面,生物炭具有高电负性,高阳离子交换量,表面有丰富的官能团(—OH, —COOH, —C=O—和C=N等),并含有矿物质元素[14]。因此,它可以与重金属发生直接的相互作用,比如静电吸引、离子交换、络合、沉淀。另一方面,生物炭通过影响土壤理化性质间接影响土壤中的重金属形态[15],进而影响其生物有效性[16]。在近几年,基于生物炭对土壤重金属影响的大量报道中,有多位学者利用荟萃分析,从不同的角度总结了生物炭对植物吸收重金属的影响[17-19]。重金属形态是影响重金属生物有效性的重要指标,然而迄今为止还缺少生物炭对土壤中重金属形态影响的归纳。因此,我们系统总结了生物炭对土壤重金属形态特征的影响,并分别对生物炭影响土壤和植物中重金属生物有效性及其机制进行了较为详细的阐述,在此基础上提出了未来的研究方向。
-
土壤中重金属以不同的形态存在。Tessier等[20]在1979年提出土壤重金属连续提取法及改进方法。按提取顺序, 土壤中的重金属可被划分为5种形态:交换态(包括水溶态)、碳酸盐结合态(包括专性吸附结合态)、铁锰氧化物结合态、有机结合态、残渣态(硅酸盐结合态)。具体来说,交换态和碳酸盐结合态易于被生物利用。碳酸盐结合态对pH变化较为敏感。有机结合态中可溶性微量金属会缓慢释放。残渣态最稳定,包裹在原生和次生矿物晶格中[20-21],且与内球体有较强的结合[22]。而欧共体司(BCR)将土壤重金属形态分为4种:弱酸提取态、可还原态、可氧化态以及残渣态[23]。弱酸提取态对应交换态和碳酸盐结合态,可还原态对应铁锰氧化物结合态,可氧化态对应有机结合态。根据生物体吸收情况,可将重金属形态分为3部分:(1)交换态和碳酸盐结合态为最具流动性和生物有效性的部分;(2)铁锰氧化物结合态和有机结合态为生物有效性较低的部分;(3)残渣态为潜在不流动部分[24]。重金属的稳定机制包括物理吸附、阳离子交换、沉淀和表面络合,通过这些作用来降低其生物有效性[25]。以上3部分的不同也体现在重金属与生物炭的相互作用机制上,其中,具流动性和生物有效性的部分与生物炭进行物理吸附和发生阳离子交换;生物有效性较低的部分与生物炭阳离子-π相互作用;潜在不流动部分与生物炭发生表面络合反应[26]。
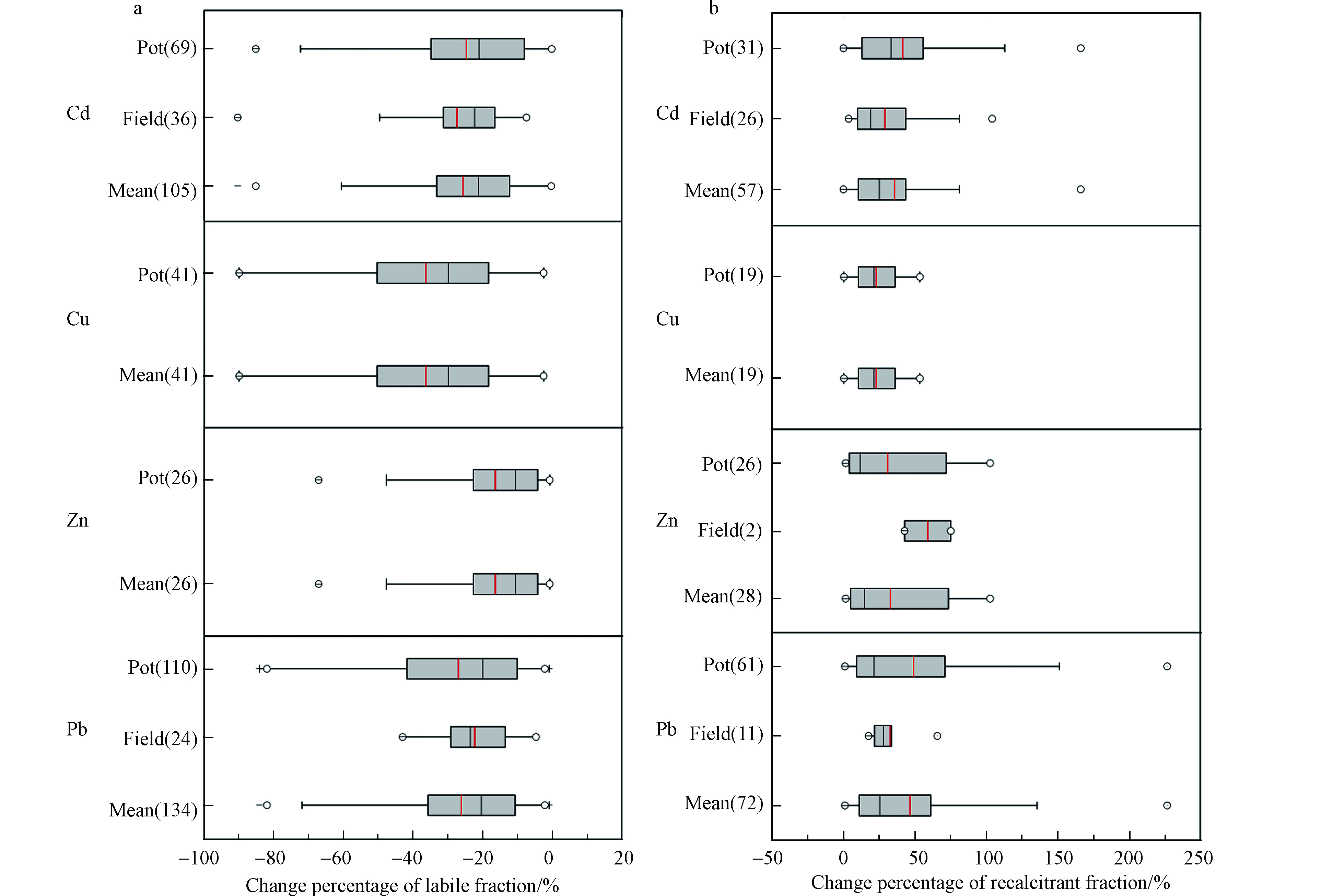
本文在web of science检索系统中以“biochar”、“soil”、“heavy metal speciation”为检索词查询了2014年—2020年的英文文献,筛选给出具体形态变化数据(>400个)的文献,并对数据进行整理及统计分析。本文选择该领域文献中常见的4种重金属(Cd、Cu、Zn和Pb)。由于其他重金属(Cr、As、Hg等)的数据较少,因此未对它们进行统计。图1显示了生物炭添加到土壤中后,土壤重金属的不稳定态(可交换态或酸溶态)总体降低的百分率和稳定态(残渣态)总体升高的百分率。在生物炭添加下,土壤中Cd、Cu、Zn和Pb的不稳定态百分率分别降低25.6%、36.4%、16.5%和26.1%(图1a),不同重金属不稳定态变化具有显著性差异(P<0.05)。Cd、Cu、Zn和Pb稳定态百分率分别升高35.9%、22.9%、32.8%和46.5%(图1b)。上述现象的具体机制为:一般,生物炭加入到土壤后经过一段时间的培养,土壤中的可交换态或弱酸提取态重金属会转化为有机结合态和残渣态,这意味着生物炭会使可溶性重金属趋于稳定。生物炭的自身特性和对土壤理化性质的改变影响重金属在土壤中的形态,进而影响重金属的固定。首先,生物炭的碱性使土壤中OH−、
${\rm{CO}}_3^{2-} $ 和${\rm{SiO}}_3^{2-} $ 增加,促进不溶性重金属的氢氧化物、硅酸盐和碳酸盐的形成,减少可交换态重金属含量[27]。其次,生物炭促使土壤中重金属的有机结合态和残渣态增加,是因为生物炭表面含氧官能团(—OH、—COOH等)的存在[28],也可能是由于${\rm{CO}}_3^{2-} $ 和${\rm{PO}}_4^{3-} $ 在生物炭表面与重金属形成沉淀造成的[29]。最后,生物炭含有矿物质成分,可与重金属发生吸附、络合和沉淀,将重金属由可交换态转化成残渣态[16]。其中,生物炭引起的土壤pH改变是导致重金属存在形态改变的主导机制。生物炭使土壤pH增加,氧化铁和氧化锰的吸附/络合作用增强,官能团增多会导致有机质的螯合作用,因此,弱酸提取态重金属含量降低[30]。另外,土壤pH增加,使得土壤粘土矿物表面负电荷、水合氧化物和有机质增加,加剧了对重金属的吸附,例如,Cd可能以CdCO3、Cd(OH)2和Cd(OH)PO3·H2O的形式存在,Cu以Cu(OH)2存在,Pb以PbCO3、2PbCO3·Pb(OH)2、PbSO4和5PbO·P2O5·SiO2的形式析出以及Zn以ZnCO3、ZnHCO3、Zn(OH)2和水锌矿的形式存在[22, 31-37]。此外,生物炭对Cd和Pb稳定态的影响总体上无显著性差异(P>0.05)。生物炭对Cd和Pb有较好的固定效果(图1b),尤其对Pb,可能是因为生物炭对两种重金属不同的结合机制。具体来说,生物炭使土壤pH值升高,导致Cd以氢氧化物或碳酸盐沉淀的形式析出,而Pb可以与生物炭表面官能团配合降低Pb的活性[38]。相比其他重金属,Pb更容易被固定(图1b),Wu等[39] 的研究发现了类似的结果。相反,图2显示生物炭添加后,土壤中Cd、Cu、Zn和Pb的不稳定态含量升高,稳定态含量降低,这说明生物炭的添加反而不利于重金属的稳定。例如Cd由可氧化组分转化为可还原组分,原因可能是生物炭上存在Fe、O、H等元素,这些元素为Cd形成铁锰氧化物或氢氧化物提供了有利条件[40]。因此,关于生物炭如何影响土壤重金属形态的转化及其机制有待于进一步深入研究。 -
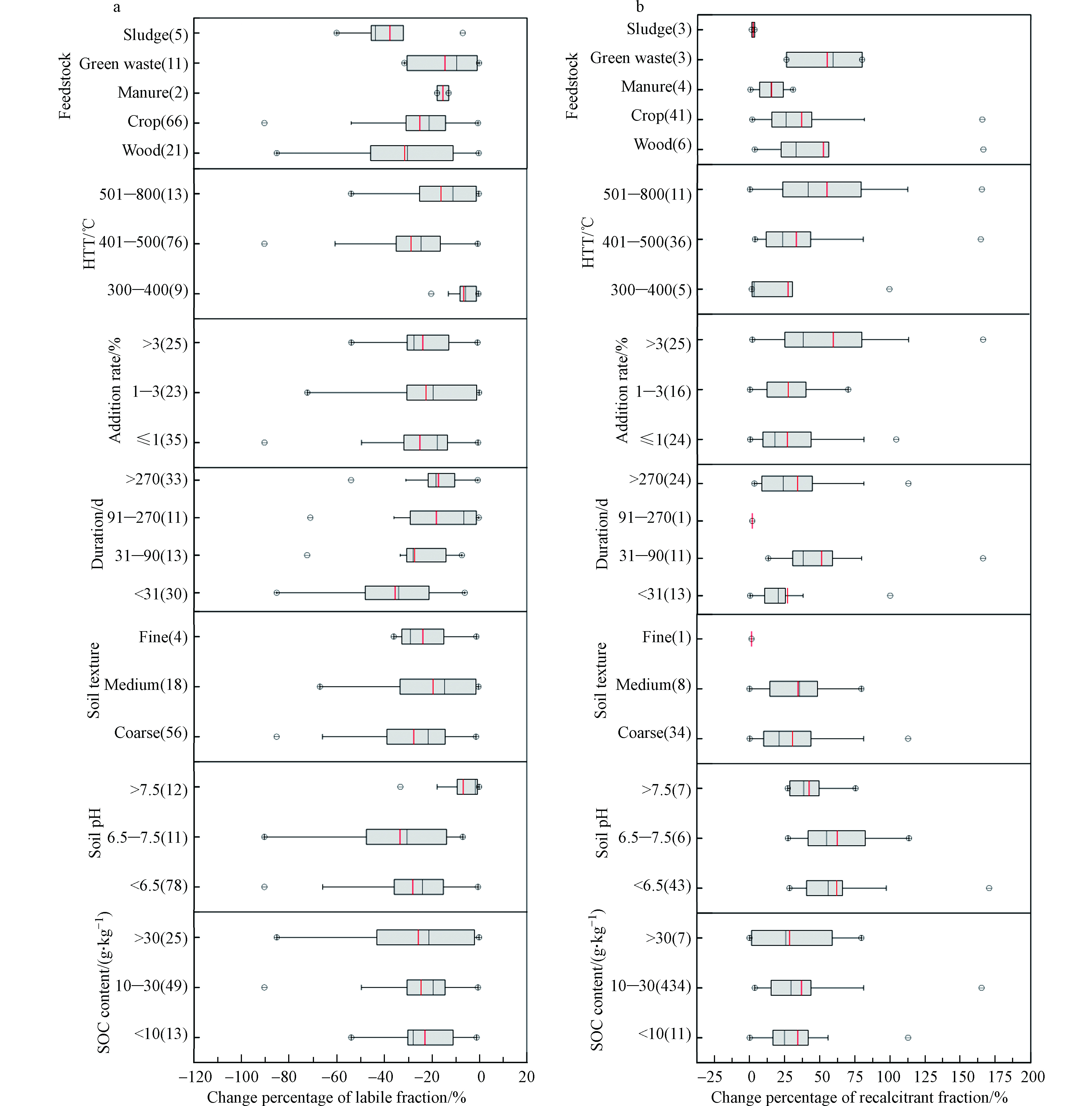
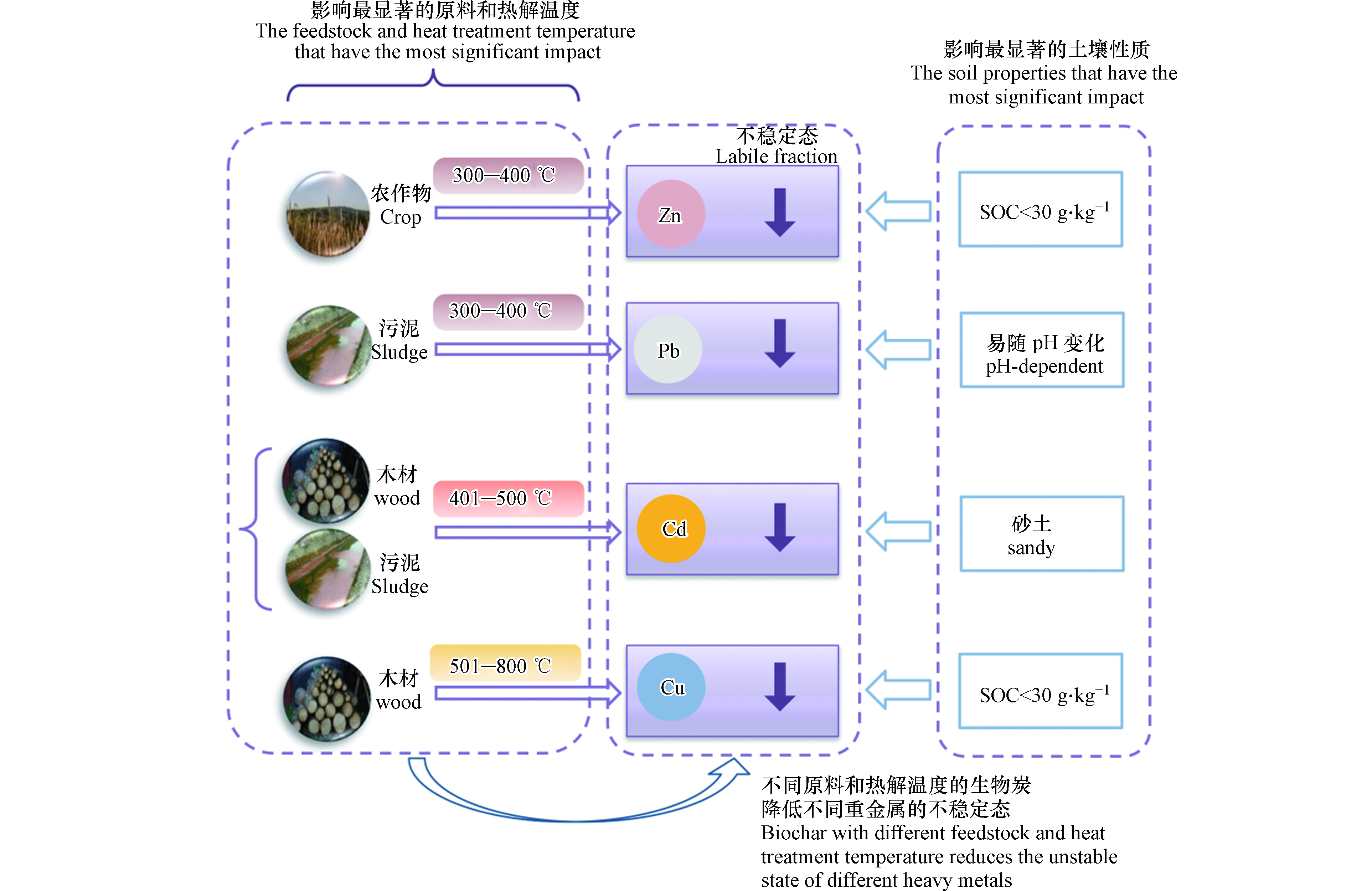
生物炭的原料和热解温度会影响重金属形态的变化。Lu等[41] 通过盆栽实验,发现不同原料生物炭对重金属生物有效性有差异。生物有效性改变主要受制于重金属形态的转化。总体来看,木材类、农作物类与其他原料的生物炭对重金属不稳定态的影响均有显著性差异(P<0.05),而粪便、绿肥和污泥类的生物炭对重金属不稳定态的影响无显著性差异(P>0.05)。不同热解温度(300—400 ℃、401—500 ℃和501—800 ℃)的生物炭对重金属不稳定态和稳定态的影响均无显著性差异(P>0.05)。图3为不同生物炭添加到土壤后,Cd不稳定态和稳定态的变化。从图中可以看出,木材和污泥在401—500 ℃热解制备的生物炭使Cd的不稳定态含量下降较多。并且有研究发现,相比于600 ℃热解制备的生物炭,400—450 ℃热解制备的生物炭可以有效降低Cd的生物有效性[42-43]。
不同生物炭添加到土壤后,Cu、Zn和Pb不稳定态和稳定态的变化如图4—图6所示。相比于其他原料和热解温度的生物炭,501—800 ℃热解制备的木材类生物炭可以有效降低土壤中Cu不稳定态的含量,增加了Cu稳定态的含量(图4)。很多研究者把Cu的迁移和固定与溶解性有机碳(DOC)联系在一起[38, 44-45]。Han等[46] 总结并比较了粪便、农作物和木质材料生物炭的DOC含量,发现木质材料类生物炭的DOC含量最低;而501—700 ℃热解制备的生物炭DOC含量远小于250—500 ℃热解制备的生物炭。DOC较多,会与Cu形成可溶的络合物[47],增加Cu的迁移。因此,501—800 ℃热解制备的木材类生物炭含有较少的DOC,降低了Cu的迁移性[48]。另外,如图5所示,以农作物为原料在300—400 ℃下热解制备的生物炭显著降低Zn的不稳定态含量。同样,300—400 ℃热解制备的污泥生物炭显著降低Pb的不稳定态含量(图6),这是因为相比于其他原料制备的生物炭,污泥生物炭含有的矿物质元素较多,低温热解的生物炭会释放更多的P、K和Ca等元素[48],这些元素和Pb的固定有关。值得注意的是,还有研究表明污泥生物炭含有较多的重金属[49],这一点也不可忽视。Cao等[50] 发现P元素可能与Pb的固定有关。P与Pb会形成Pb5(PO4)3Cl和Pb5(PO4)3(OH)稳定存在于土壤中[31, 50]。同时,Uchimiya等[51] 也报道了低温热解制备的生物炭更容易固定Pb。
-
生物炭的添加量及添加时间可以影响土壤重金属的形态。从生物炭的添加量对不同重金属形态转化情况来看,相比于生物炭添加量为1%,其添加量较高(>3%)时,土壤Cd、Cu、Zn和Pb的不稳定态含量以及稳定态含量均有显著性差异(P<0.05)。有研究者报道,相比于添加量为1%,添加量为5%的鸡粪生物炭和油菜秸秆生物炭可以显著降低Cd的植物有效性[52]。同样,也有研究者发现相比于1%的添加量,5%的生物炭添加比例可以显著降低重金属Cu和Pb的生物有效性。另外,从图3—6中可知,随着实验时间的不同,重金属的形态呈动态变化。例如,Cd不稳定态的变化随着实验时间的增加而降低;对于Pb,其不稳定态变化规律随着时间的增加先升高再减小。具体动态变化的原因,可能是因为不同的实验时间内,生物炭与重金属以及土壤的相互作用不同。例如,Hua等[53] 将500 ℃热解的小麦秸秆和苹果树生物炭添加到土壤后,进行为期130 d的培养实验,发现Sb的各个形态含量随培养时间交替变化,并指出添加小麦秸秆生物炭的前20 d和苹果树生物炭的前50 d,Sb的迁移增加,可能是由于生物炭中官能团的静电排斥。相反,添加小麦秸秆生物炭的后20 d和苹果树生物炭的后50 d,Sb的迁移降低,可能是因为Sb和生物炭形成络合物,次生矿物沉淀以及Sb和生物炭诱导的土壤中腐殖酸有机络合。可见,重金属形态在生物炭施入后随时间呈动态变化,并且其变化机制不同。
-
土壤质地、pH和有机碳含量会影响生物炭对土壤重金属形态的转化(图3—6)。在不同土壤中,生物炭在固定金属和活化金属方面的作用不尽相同[54]。
土壤质地分为三类:砂质、壤质和粘质。生物炭添加下,不同土壤质地对重金属不稳定态含量下降程度的影响有显著性差异(P<0.05)。对于Cd,砂质土壤中,其不稳定态百分率下降较多(27.4%),相应地,在砂质土壤中其稳定态百分率上升较多(30.6%)。一般而言,相对于粘质土,砂质土含有较少的有机碳和黏土矿物,因此对重金属的吸附较低[55],这意味着砂质土中有更多有效态重金属。生物炭的加入,增加了对有效态重金属的吸附,因此,对不稳定态重金属的降低起着更明显的作用。土壤pH对生物炭影响重金属不稳定态的变化有显著性差异(P<0.05)。Cd、Cu和Pb在酸性和碱性的土壤中不稳定态平均下降率分别为6.8%和33.4%、26.9%和35.0%和12.4%和42.4%(图3、4和6)。Ahmad等[54]发现在碱性靶场和酸性农业土壤中,影响重金属固定的因素是不同的。相比其他重金属,Pb对pH更为敏感(图6)。另外,不同土壤有机碳含量对生物炭影响重金属不稳定态的变化也有显著性差异(P<0.05)。在适中(10—30 g·kg−1)和低(<10 g·kg−1)含量有机碳的土壤中,生物炭添加更能增加Cu和Zn的稳定。
总体上,生物炭的添加能够明显降低大部分重金属的有效态,减少其生物有效性。以上所述详见图7。另外,除了土壤质地、pH和有机碳,土壤生物性质也可影响重金属形态变化。例如,Liu等[56]发现生物炭可以降低重金属钴的毒性,使其酸溶态含量与土壤酶活性(脲酶和碱性磷酸酶)呈负相关(P<0.01)。Cui等[57]指出生物炭添加到土壤后,土壤中可交换和还原态重金属(Zn、Cu、Cd、Cr和Pb)与土壤微生物(异常球菌、拟杆菌、厚壁菌、变形菌和革兰氏阴性细菌)多样性具有相关性(P<0.01)。
-
根据ISO 11074[58],生物有效性是衡量土壤中的化学物质可被人类或生物体吸收或代谢,或可与生物系统相互作用的程度。评价重金属的生物有效性有不同的指标。比如,土壤重金属总量、化学试剂(CaCl2、EDTA和DTPA等)一步法提取的重金属含量、重金属各个形态的含量。除重金属浓度外,生物学评价法也能预测土壤重金属的生物有效性,比如,动植物中重金属的含量,植物中重金属的富集系数和转运系数等[59]。近几年来,很多学者研究了土壤中施加生物炭后,化学试剂提取重金属含量、植物中重金属含量的变化,进而明确生物炭对重金属生物有效性的影响(表1)。本文引用该领域文献中使用的生物有效性评价方法,主要包括化学试剂提取法和生物学评价法。
-
不同原料以及热解温度制备的生物炭对重金属的固定以及生物有效性的影响效果不同。而重金属在土壤中被吸附或固定的潜力直接影响其生物有效性。首先,归纳了生物炭原材料和热解温度对土壤重金属的固定和吸附的影响。有研究发现鸡粪生物炭有利于降低Cu的生物有效性[60]。Yang等[61] 用一年的培养实验,证明了稻草生物炭在降低土壤中重金属(Cd、Cu、Pb、Zn)生物有效性方面比竹子生物炭具有更大的潜力。还有研究发现胡桃壳生物炭和小麦秸秆生物炭添加的土壤中Cd和Pb的生物有效性差异显著[34]。另外,厨余垃圾生物炭有较多的碱性金属(Na、K、Ca、Mg),因此有很好的离子交换能力,所以与玉米秸秆和花生壳生物炭相比,对Pb和Cd有更好的固着性能[38]。Awad等[42] 发现在酸性土壤中,600 ℃热解制备的园林废弃物生物炭对土壤Pb、Cu和Zn生物有效性的降低效果优于400 ℃生物炭。Qian等[36] 发现高温(550 ℃)热解制备的生物炭有较高的灰分含量,比低温(350 ℃)生物炭对Zn有更强的吸附固定能力。重金属与生物炭发生结合导致其生物有效性的改变。例如,有研究者认为金属碳酸盐的形成以及与生物炭表面官能团的相互作用是重金属生物有效性下降的机制[16]。目前,研究者基本上选取不同类型的生物炭研究土壤重金属生物有效性,但是对于不同原料以及不同热解温度的生物炭如何改变土壤重金属生物有效性还缺乏系统的研究,并且相应机制尚不清楚。
生物炭对土壤中不同重金属的固定以及生物有效性的改变有差异。Meng等[25] 研究发现生物炭处理对于降低4种重金属(Cd、Cu、Pb、Zn)的生物有效性并不是同等有效的,可能是由于生物炭降低有效态重金属的浓度不同,以及生物炭表面重金属有限的吸附位点的竞争。Arabyarmohammadi等[62]进行了生物炭与多种重金属污染土壤的吸附实验,发现重金属Cu主要与—NH2、—OH、—COOH基团形成化学键,Pb主要与不溶性氢氧化物、磷酸盐或碳酸盐相结合,Zn主要附着在残留的较难溶的组分上。另外,重金属与有机官能团形成的化合物的结构差异已被证明是导致重金属生物有效性降低的机制[16]。Zhao等[63] 通过量子计算证实不同种类重金属与生物炭—OH和—COOH的结合能有差异,相比于Zn,Pb的结合能更低,因此这些官能团更倾向于结合Pb,进而有效降低重金属Pb的生物有效性。
重金属生物有效性与改良后的土壤性质有一定的相关性。Zhang等[64] 将500 ℃制备的水稻秸秆生物炭施加到砂壤土3个月后,发现土壤有机碳和pH与生物有效Cd(EDTA萃取)浓度具有相关性,说明施用生物炭后土壤有机碳和pH的增加,导致土壤中Cd生物有效性的降低。Meng等[25]发现添加400 ℃热解水稻秸秆、猪粪以及水稻秸秆猪粪混合生物炭后,CaCl2溶液萃取的Cd、Cu、Pb和Zn浓度与土壤pH、电导率和DOC含量都呈显著的负相关(P<0.01),Chao等[33]的研究发现添加椰子壳生物炭进行盆栽试验117 d后,土壤中CaCl2溶液萃取的Pb和Zn分别与pH、阳离子交换量、水溶性
${\rm{SO}}_4^{2-} $ 、DOC均呈显著负相关(P<0.05)。Tang等[65] 的研究发现水稻秸秆生物炭添加后,土壤溶液DOC含量增加,并且通过梯度扩散薄膜技术(DGT)测定的Cd和As浓度(CDGT)与DOC浓度呈显著的相关性(P<0.05),表明DOC在土壤中重金属的有效性中起着关键作用。然而,添加生物炭引起的土壤孔隙水中DOM变化进而导致重金属生物有效性改变的机制还缺乏系统研究,尤其是缺少针对DOM结构变化与重金属生物有效性关系的研究。总之,一方面,重金属与生物炭的结合改变重金属的形态进而改变重金属的生物有效性;另一方面,生物炭添加下重金属形态转化可以使其生物有效性发生改变。另外,生物炭改变土壤性质进而影响重金属形态,导致其生物有效性发生变化。到目前为止,大多数生物炭固定重金属的实验室和田间实验基本都是在较短期内进行的。由于老化过程中,生物炭固定重金属的能力可能会随着时间的推移而降低[66],因此研究生物炭对金属固定化的长期影响很有必要。重金属能够在土壤中固定,本身依靠的是土壤腐殖质-矿物质、微生物-矿物质的界面反应[67]。粘土矿物和微生物由于粒径小,表面电荷大,在重金属结合中起着重要作用。微生物细胞中含有大量的磷基、羧基、氨基、羟基等官能团,对重金属离子具有静电和化学亲和力[67]。而生物炭施入土壤中,一般增加有机质含量,对微生物群落结构有明显的影响,还会与矿物质以及重金属发生结合。因此在生物炭添加下,重金属与腐殖质-矿物质-微生物体系作用的机理发生着怎样的变化?生物炭在这样的体系下的老化过程对重金属的固定有何影响?Dang等[68] 将水稻秸秆生物炭施入土壤中进行为期90 d的盆栽实验,发现2—4周后生物炭表面会形成一层有机矿物层,即微团聚体,并运用能谱分析(SEM-EDX)对老化后的生物炭表面进行了表征,结果表明,这些微团聚体中含有重金属,表明有少量的重金属与生物炭有机分子结合。而基于生物炭老化过程,关于微团聚体的形成对重金属在土壤中固定的影响的研究还较为少见。而且不同生物炭在一定时间的老化对重金属形态和稳定性有不同的影响[69],有待于进行系统的研究。
-
除了用土壤中的重金属浓度评价其生物有效性,生物学评价法也能预测土壤重金属的生物有效性。研究者们通过实验室模拟实验进行了大量关于生物炭降低动植物中重金属生物有效性的研究[52, 70-72]。生物炭的原料和热解温度会影响动植物中重金属的生物有效性。例如,Ali等[73] 探讨杏壳生物炭和苹果树生物炭对甘蓝型植物中Zn和Cd有效性的影响,结果发现:两种生物炭,特别是苹果树生物炭,均降低了甘蓝型植物对Zn和Cd的生物利用度、吸收和转运。苹果树生物炭的效果好于杏壳生物炭可能是由于其较高的碱度、比表面积和碳含量。低温生物炭,有利于降低碱性土壤重金属的植物有效性[64].
生物炭添加后,生物体中的重金属含量降低,即降低了土壤重金属的生物有效性,例如,Huang等[74] 研究用350 ℃制备的棉杆生物炭进行28 d的实验室培养实验,结果发现:蚯蚓对Cd、Cu、Zn和Pb的生物富集系数比对照组要低,说明生物炭降低了土壤重金属的生物有效性。将400 ℃热解的厨余垃圾、玉米秸秆和花生壳生物炭分别添加到土壤中进行3个月的盆栽实验,发现空心菜中Cd和Pb的浓度显著降低(P<0.05),且与土壤中可提取态重金属的浓度呈正相关关系[50]。Yang等[35]将烟草和病死猪生物炭添加到土壤中进行80 d的盆栽实验,发现烟草植株中重金属含量降低,且与CaCl2溶液可提取重金属浓度(Cd和Zn)呈显著正相关(P<0.01)。
关于生物炭添加影响生物体生物有效性的变化有着不同的机制。首先,生物炭添加后重金属由植物可利用部分转化为植物无法吸收的有机结合态和残渣态。其次,植物生物量的增加对其体内的重金属产生的稀释效应也是植物中重金属含量降低的原因之一[37, 64]。另外,生物炭添加还可以使土壤孔隙水中的重金属含量降低,进而减少植物中的重金属含量[37, 60, 75-76]。例如,有研究发现孔隙水中的重金属(Cd和Pb)含量随着培养时间的增加而降低,这可能是孔隙水pH的升高以及孔隙水中二氧化硅和磷酸盐的浓度升高导致的[77]。Beesley等[78] 研究发现生物炭改良土壤60 d使土壤孔隙水中Cd和Zn的含量降低,进而降低了黑麦草中重金属的毒性效应,然而生物炭使土壤孔隙水中As和Cu的浓度升高。而Karami等[79]添加橡树生物炭改良Cu和Pb污染的土壤并种植4个月的黑麦草,发现生物炭使土壤孔隙水中的Cu浓度降低。可见,不同的重金属污染的土壤以及同种重金属污染不同的土壤,在生物炭添加后,土壤孔隙水中重金属含量的变化存在差异性,针对这种差异还需要进一步的研究。也有研究表明植物中重金属生物有效性的降低并不归因于土壤孔隙水中重金属浓度的降低。例如,Beesley等[80] 用果园修剪残留物为原料500 ℃制备的生物炭施入As污染的土壤进行盆栽实验,发现生物炭显著提高孔隙水中As的浓度,同时显著降低番茄植物根、地上部As浓度。孔隙水中As浓度的增加是因为生物炭中的宏观、微观和纳米孔结构可能为土壤中的Fe和Mn的还原提供了条件,在这种还原条件下,As将不容易被土壤吸附,从而更具流动性。除了以上常见的机制,微生物的变化也是生物炭改变重金属生物有效性的机制。添加生物炭后,水稻土中Cd的生物有效性降低,研究者对水稻根际的微生物进行了检测,发现生物炭增加了促进植物生长的鞘脂单胞菌、根瘤菌以及促进重金属转化的β-变形菌,这些变化为Cd的生物有效性降低提供了可能的解释[81]。Meier等[60] 把Cu生物有效性降低的原因归为生物炭增加了土壤中的微生物活性和脱氢酶活性,将过量的Cu阻隔在丛枝菌根真菌的耐金属结构中促进植物生长,从而使Cu的生物有效性降低。生物炭可以改善土壤微生物群落,例如,谭凤娇[82] 研究发现生物炭增加了土壤外生菌根真菌物种数,使外生菌根真菌多样性显著增加。Tang等[83] 得出外生菌根真菌促进了植物对Cd和Cu的吸收。关于生物炭改良诱导的微生物促进/抑制机制尚不完全清楚,并且植物重金属生物有效性变化的微生物水平机制还有待于研究。由于微生物重要的作用,生物炭与微生物对重金属生物有效性的共同影响是近年来的研究热点。Tu等[84] 发现玉米生物炭和耐重金属菌株假单胞菌(Pseudomonas sp.)同时加入到土壤中后,可以显著降低Cd和Cu的DTPA萃取浓度。有研究发现木质素类生物炭与丛枝菌根共同处理会显著降低水稻籽粒Pb的浓度,该项研究还证明了生物炭与丛枝菌根共同处理会提高粮食生产的安全性[85]。但是,Qiao等[86]的研究结果表明丛枝菌根与生物炭之间没有相互作用,并且生物炭与接种丛枝菌根共同作用降低重金属生物有效性的益处仍不明确。可见,仍需要加深对菌剂与生物炭共同改变土壤重金属生物有效性的研究,并重点探讨其机制。
生物炭对不同重金属的生物有效性影响不同,这与重金属本身的性质有关。具体来说,发现生物炭对水稻植株籽粒中Cd的降低程度大于Pb。有两个原因,一方面,Pb形成金属羟基化合物的能力大于Cd,生物炭上形成的Pb析出量远高于Cd;另一方面,Pb在植物中的迁移性本身比较低[34]。Li等[87] 阐明了Pb在植物中低迁移性的机制,该研究者进行了稻草生物炭对土壤-水稻系统中Pb的吸附效应实验,利用X-射线吸收近边结构光谱(XANES)测定了水稻根中的Pb的种类,发现了Pb-果胶和Pb-半胱氨酸,其中Pb-果胶与根内Pb的络合作用减少了其从根向茎的迁移,Pb-半胱氨酸的形成抑制其从根向地上部的迁移,因此认为这些有机复合物可能是导致土壤中添加生物炭后水稻对Pb积累减少的原因。
生物炭除了降低土壤重金属生物有效性,还会产生一些负面影响。例如,Meier等[60] 将500 ℃制备的鸡粪生物炭与土壤混合后,发现月见草根系中会加剧Cu的积累。其机制为重金属与植物细胞壁中的生物聚合物结合,一旦穿过细胞壁,会在细胞膜上的表面固定化。有研究表明生物炭即使对Cd的吸附达到最大,也未降低生菜中Cd的含量,可能是因为生菜对Cd的吸收较强[64]。因此,在应用生物炭固定重金属时,应当了解生物炭的物化性质和前期实验,以减少应用生物炭会增加蔬菜吸收重金属的风险。Huang等[74] 发现生物炭使重金属污染土壤中蚯蚓的生物量下降。当向Cd污染的黄土中施加鸡粪和油菜秆生物炭三周后发现,玉米植株的高度低于对照组,认为生物炭添加增加了土壤pH,使其达到植物的耐受限度(pH=8.5),以及低添加量(1%和5%)的生物炭对抑制植物吸收Cd没有明显的效果[39]。Chao等[33]认为胡桃壳生物炭会降低Pb、Zn污染的酸性水稻土中水稻植株籽粒的生物量,因为生物炭会与土壤中植物的营养元素发生结合,并且生物炭含有的挥发性有机化合物可能对植物生长产生负面影响。一般,重金属胁迫诱导植物细胞内积累过多的活性氧(ROS),如超氧阴离子自由基(
${\rm{O}}_2^{-} \cdot $ )、羟基自由基(·OH)和过氧化氢(H2O2)[88],从而增加植物的衰老[89],由于这些ROS与生物分子发生反应,导致细胞膜损伤和酶失活,从而影响细胞活力[90]。生物炭本身具有持久性自由基,会产生ROS[91-92],生物炭添加在重金属污染的土壤-植物系统中后,由重金属、ROS参与的电子转移、芬顿反应等过程与生物炭产生的自由基的作用引发的植物代谢的变化还有待于研究。 -
近年来,生物炭修复重金属污染土壤研究的涌现,使人们对生物炭及其在重金属污染土壤中的应用有着更为深入的认识。比如:生物炭自身的性质(多孔结构、丰富的有机官能团和矿物质元素等)、生物炭影响重金属的存在形态和生物有效性。尽管取得了很多的研究成果,但是还有一些不足之处以及需解决的问题,因此提出以下的研究问题与展望。
(1)对于不同类型生物炭与重金属污染土壤的修复效果的构效关系认识不足。需要加强不同类型(原料、热解温度)的生物炭对土壤中重金属的归趋和生物有效性影响的系统性研究。并将研究重点放在不同生物炭产生不同效果的机制上。
(2)缺乏生物炭施入田间长期效应的研究。多数研究仅停留在实验室模拟研究,但是实际的田间会有更多不可控的因素,因此,进行田间实验很有必要。由于生物炭在土壤中培养时间的不同会导致其老化程度不同以及重金属的形态发生一系列的动态变化,因此需要进行长期的监测,并深入研究生物炭和重金属相互作用的老化过程。
(3)确定土壤性质变化以及生物炭表面的生物、非生物和结构变化对重金属固定影响的差异是当前研究的主要任务[16]。仍需加强生物炭添加后如何影响土壤孔隙水中不同种类重金属浓度变化的研究,探究其变化与DOM结构变化的关系。
(4)从微生物水平上进一步研究生物炭改变土壤重金属生物有效性的机制。例如,生物炭添加下土壤重金属生物有效性评价指标与微生物和酶等指标(例如微生物群落结构、脱氢酶活性等)的相关性,以及加强研究生物炭诱导下重金属对菌群的耐受性以及生物炭与菌群共同作用对动植物重金属有效性降低的机制。
(5)深入研究在重金属、ROS参与的微观反应等过程中,生物炭引发的植物代谢的变化。针对生物炭的负面影响,应尽可能全面辩证地考虑生物炭的缺点,防止重金属通过食物链富集到人体,并加快探究其可能的规避措施。
总之,关于生物炭在土壤重金属修复领域的研究还有很大的发展空间,有望带来新的进展。
生物炭对土壤重金属形态及生物有效性影响的研究进展
Effect of biochar on soil heavy metal speciation and bioavailability: A review
-
摘要:
考察生物炭施入土壤后重金属形态以及生物有效性的变化是土壤学近年来的研究热点。重金属形态变化是衡量其生物有效性的一个较为重要的指标。将生物炭添加到土壤-动植物系统中,并评估重金属生物有效性有利于推进生物炭应用于土壤改良及重金属修复。因此,本文首先收集了大量关于生物炭对土壤重金属形态含量变化的数据。统计发现,生物炭添加下土壤中重金属Cd、Cu、Zn和Pb的不稳定态(可交换态/酸溶态)下降的平均百分率分别为25.6%、36.4%、16.5%和26.1%,稳定态(残渣态)升高的平均百分率分别为35.9%、22.9%、32.8%和46.5%。生物炭的原料、热解温度和土壤质地是影响重金属形态变化的主要因素。探讨了生物炭的添加对土壤重金属形态转化的影响机制。其次,总结了生物炭对土壤和生物体中的重金属生物有效性的影响,以及阐述了相应的影响机制。最后,基于目前的研究现状提出了未来的研究方向。
Abstract:Investigation on the variations of soil heavy metal speciation and bioavailability with the application of biochar is becoming a hot research topic in the field of soil science in recent years. Heavy metal speciation is an important indicator of bioavailability. Evaluation of heavy metal bioavailability with the addition of biochar in soil-animal/plant system is beneficial to promote the application of biochar in soil improvement and soil heavy metal remediation. Therefore, data on the changes of the content of heavy metal speciation induced by biochar were collected. It was found that the mean decrease percentages of labile fraction (exchangeable fraction/acid-soluble fraction) of Cd, Cu, Zn, Pb were 25.6%, 36.4%, 16.5%, and 26.1%, respectively. The mean increase percentages of recalcitrant fraction (residue fraction) were 35.9%, 22.9%, 32.8% and 46.5%, respectively. The effect of biochar on soil heavy metal speciation mainly depended on the feedstock and heating treatment temperature of biochar as well as soil texture. The mechanisms of biochar-induced changes in soil heavy metal speciation were discussed. Then, the influences of biochar on heavy metal bioavailability in soil and animal/plant were summarized and the corresponding mechanisms were stated. Finally, potential research directions in the future were proposed based on current research status.
-
Key words:
- biochar /
- soil heavy metals /
- speciation /
- bioavailability
-

-
图 3 生物炭诱导的土壤重金属Cd不稳定态(a)和稳定态(b)含量随生物炭原料、热解温度、添加量、实验时间、土壤质地、土壤pH和土壤有机碳含量的变化(红线代表平均值)
Figure 3. Changes of the contents of labile (a) and recalcitrant fraction (b) of Cd induced by biochar with feedstock, pyrolysis temperature, addition rate, experiment time, soil texture, soil pH and soil organic carbon content (red line represents the mean value)
图 4 生物炭诱导的土壤重金属Cu不稳定态(a)和稳定态(b)含量随生物炭原料、热解温度、添加量、实验时间、土壤质地、土壤pH和土壤有机碳含量的变化(红线代表平均值)
Figure 4. Changes of the contents of labile (a) and recalcitrant fraction (b) of Cu induced by biochar with feedstock, pyrolysis temperature, addition rate, experiment time, soil texture, soil pH and soil organic carbon content (red line represents the mean value)
图 6 生物炭诱导的土壤重金属Pb不稳定态(a)和稳定态(b)含量随生物炭原料、热解温度、添加量、实验时间、土壤质地、土壤pH和土壤有机碳含量的变化(红线代表平均值)
Figure 6. Changes of the contents of labile (a) and recalcitrant fraction (b) of Pb induced by biochar with feedstock, pyrolysis temperature, addition rate, experiment time, soil texture, soil pH and soil organic carbon content (red line represents the mean value)
图 5 生物炭诱导的土壤重金属Zn不稳定态(a)和稳定态(b)含量随生物炭原料、热解温度、添加量、实验时间、土壤质地、土壤pH和土壤有机碳含量的变化(红线代表平均值)
Figure 5. Changes of the contents of labile (a) and recalcitrant fraction (b) of Zn induced by biochar with feedstock, pyrolysis temperature, addition rate, experiment time, soil texture, soil pH and soil organic carbon content (red line represents the mean value)
表 1 不同类型生物炭对重金属生物有效性影响的研究
Table 1. Studies on the effect of different types of biochar on heavy metal bioavailability
原料
Feedstock热解温度/℃
Heat
treatment
temperature添加量/%
Addition
rate实验时间
Experiment
time重金属
Heavy
metals受试生物
Tested
organisms生物有效性
Bioavailability参考文献
References玉米秸秆 350 2 28 d Cd、Cu、Pb — DTPA萃取Cd、Cu、Pb浓度分别降低11.9%、14.3%和23.8% [74] 鸡粪 500 5 90 d Cu — NH4NO3萃取Cu降低73% [60] 水稻秸秆 500 1、5 1年 Pb、Cd — CaCl2萃取Pb和Cd分别降低29%和17.7% [61] 竹材 750 1、5 1年 Cu — CaCl2萃取Cu降低26.8%、31.9% [61] 竹材 700—800 2 2个月 Cd — DTPA萃取Cd降低13.4% [42] 园林废弃物 400 6 2个月 Pb、Cd、Cu、Zn 芥菜 DTPA萃取Pb、Cd、Cu、Zn分别降低29.56%、46.04%、59.98%和48.29%;芥菜植株中Cd降低87.97% [42] 杏壳、苹果树 500 5、10 50 d Cd、Zn 芥菜 DTPA萃取Zn降低9.1%和11.2%;DTPA萃取Cd降低11.7%和19.1%;芥菜生物量增加29.35%、18.72%;芥菜生物量降低2.84%、4.48% [73] 胡桃壳 350—500 1、2、5 117 d Pb、Zn 水稻 CaCl2萃取Pb、Zn分别降低41.04%—98.66%、17.78%—96.87%;水稻根、茎、果皮和籽粒降低45.63%、86.4%、64.75%和60.32% [33] 南洋缨
(木本植物)900 1、2.5、5 9周 Cr、Ni、Mn 番茄 MgCl2萃取Cr、Ni、Mn降低95%、14%和19%;番茄植株中Cr、Ni、Mn降低83%、89%和67% [93] 竹材 400 0.5、1、1.5 6个月 Cd 卷心菜、玉米 CaCl2萃取Cd降低93.1%、96.77%;DTPA萃取Cd降低24.55%、63.72%;卷心菜植株中Cd变化为34.5%—23.88%、60.21%—44.57%、80.64%—62.63%;玉米植株中Cd变化为16.73%—27.68%、56.73%—38.4%、79.59%—56.31% [94] 苎麻根 350—550 0.5、1 2个月 Pb、Cd 烟草 NH4NO3萃取Pb降低26.09%、54.35%;烟草叶中Pb降低26.12%、7.22%;烟草茎中Pb降低24.03%、30.52%;烟草叶中Cd降低91.72%和87.01% [95] 注:表中列出均为实验室模拟实验. -
[1] LEHMANN J, JOSEPH S. Biochar for environmental management: Science and technology[M]. London: Earthscan, 2009. [2] CHEN W, MENG J, HAN X, et al. Past, present, and future of biochar [J]. Biochar, 2019, 1(1): 75-87. doi: 10.1007/s42773-019-00008-3 [3] MA Z, YANG Y, WU Y, et al. In-depth comparison of the physicochemical characteristics of bio-char derived from biomass pseudo components: Hemicellulose, cellulose, and lignin [J]. Journal of Analytical and Applied Pyrolysis, 2019, 140: 195-204. doi: 10.1016/j.jaap.2019.03.015 [4] 方婧, 金亮, 程磊磊, 等. 环境中生物质炭稳定性研究进展 [J]. 土壤学报, 2019, .56(5): 1034-1047. doi: 10.11766/trxb201808220426 FANG J, JIN L, CHENG LL, et al. Advancement in research on stability of biochar in the environment [J]. Acta Pedologica Sinica, 2019, .56(5): 1034-1047(in Chinese). doi: 10.11766/trxb201808220426
[5] SINGH B P, COWIE A L, SMERNLK R J. Biochar Carbon Stability in a Clayey Soil As a Function of Feedstock and Pyrolysis Temperature [J]. Environmental Science & Technology, 2012, 46(21): 11770-11778. [6] NGUYEN B T, LEHMANN J, KINYANGI J, et al. Long-term black carbon dynamics in cultivated soil [J]. Biogeochemistry, 2009, 92(1-2): 163-176. doi: 10.1007/s10533-008-9248-x [7] 张莹, 吴萍, 孙庆业, 等. 长期施用生物炭对土壤中Cd吸附及生物有效性的影响 [J]. 农业环境科学学报, 2020, 39(5): 1019-1025. doi: 10.11654/jaes.2020-0056 ZHANG Y, WU P, SUN Q Y, et al. Effect of long-term application of biochar on Cd adsorption and bioavailability in farmland soils [J]. Journal of Agro-Environment Science, 2020, 39(5): 1019-1025(in Chinese). doi: 10.11654/jaes.2020-0056
[8] 李晓娜, 宋洋, 贾明云, 等. 生物质炭对有机污染物的吸附及机理研究进展 [J]. 土壤学报, 2017, 54(6): 1313-1325. LI X N, SONG Y, JIA YM, et al. A review of researches on biochar adsorbing organic contaminantsand its mechanism [J]. Acta Pedologica Sinica, 2017, 54(6): 1313-1325(in Chinese).
[9] YOUNIS U, DANISH S, MALIK S A, et al. Role of cotton sticks biochar in immobilization of nickel under induced toxicity condition and growth indices of Trigonella corniculata L. [J]. Environmental Science and Pollution Research, 2020, 27(2): 1752-1761. doi: 10.1007/s11356-019-06466-3 [10] PENG Z, WEN J, LIU Y, et al. Heavy metal leachability in soil amended with zeolite- or biochar-modified contaminated sediment [J]. Environmental Monitoring and Assessment, 2018, 190(12): 751. doi: 10.1007/s10661-018-7124-2 [11] BOGUSZ A, OLESZCZUK P, DOBROWOLSKI R. Adsorption and desorption of heavy metals by the sewage sludge and biochar-amended soil [J]. Environmental Geochemistry and Health, 2019, 41(4SI): 1663-1674. [12] BASHIR S, RIZWAN M S, SALAM A, et al. Cadmium Immobilization Potential of Rice Straw-Derived Biochar, Zeolite and Rock Phosphate: Extraction Techniques and Adsorption Mechanism [J]. Bulletin of Environmental Contamination and Toxicology, 2018, 100(5): 727-732. doi: 10.1007/s00128-018-2310-z [13] JANUS A, WATERLOT C, HEYMANS S, et al. Do biochars influence the availability and human oral bioaccessibility of Cd, Pb, and Zn in a contaminated slightly alkaline soil? [J]. Environmental Monitoring and Assessment, 2018, 190(4): 218. doi: 10.1007/s10661-018-6592-8 [14] LIAN F, XING B. Black carbon (biochar) in water/soil environments: molecular structure, sorption, stability, and potential risk [J]. Environmental Science & Technology, 2017, 51(23): 13517-13532. [15] HE L, ZHONG H, LIU G, et al. Remediation of heavy metal contaminated soils by biochar: Mechanisms, potential risks and applications in China [J]. Environmental Pollution, 2019, 252(A): 846-855. [16] DAI S, LI H, YANG Z, et al. Effects of biochar amendments on speciation and bioavailability of heavy metals in coal-mine-contaminated soil [J]. Human and Ecological Risk Assessment, 2018, 24(7): 1887-1900. doi: 10.1080/10807039.2018.1429250 [17] ALBERT H A, LI X, JEYAKUMAR P, et al. Influence of biochar and soil properties on soil and plant tissue concentrations of Cd and Pb: A meta-analysis [J]. Science of the Total Environment, 2021, 755: 142582. doi: 10.1016/j.scitotenv.2020.142582 [18] CHEN D, LIU X, BIAN R, et al. Effects of biochar on availability and plant uptake of heavy metals – A meta-analysis [J]. Journal of Environmental Management, 2018, 222: 76-85. [19] PENG X, DENG Y, PENG Y, et al. Effects of biochar addition on toxic element concentrations in plants: A meta-analysis [J]. Science of the Total Environment, 2018, 616-617: 970-977. doi: 10.1016/j.scitotenv.2017.10.222 [20] TESSIER A, CAMPBELLl P G C, BISSON M. Sequential extraction procedure for the speciation of particulate trace metals [J]. Analytical Chemistry (Washington), 1979, 51(7): 844-851. doi: 10.1021/ac50043a017 [21] ZHANG R, LI Z, LIU X, et al. Immobilization and bioavailability of heavy metals in greenhouse soils amended with rice straw-derived biochar [J]. Ecological Engineering, 2017, 98: 183-188. doi: 10.1016/j.ecoleng.2016.10.057 [22] RIZWAN M S, IMTIAZ M, HUANG G, et al. Immobilization of Pb and Cu in polluted soil by superphosphate, multi-walled carbon nanotube, rice straw and its derived biochar [J]. Environmental Science and Pollution Research, 2016, 23(15): 15532-15543. doi: 10.1007/s11356-016-6695-0 [23] RAURET G, LOPEZ-SANCHEZ J F, SAHUQUILLO A, et al. Improvement of the BCR three step sequential extraction procedure prior to the certification of new sediment and soil reference materials [J]. J Environ Monit, 1999, 1(1): 57-61. doi: 10.1039/a807854h [24] BOGUSZ A, OLESZCZUK P. Effect of biochar addition to sewage sludge on cadmium, copper and lead speciation in sewage sludge-amended soil [J]. Chemosphere, 2020, 239: 124719. doi: 10.1016/j.chemosphere.2019.124719 [25] MENG J, TAO M, WANG L, et al. Changes in heavy metal bioavailability and speciation from a Pb-Zn mining soil amended with biochars from co-pyrolysis of rice straw and swine manure [J]. Science of the Total Environment, 2018, 633: 300-307. doi: 10.1016/j.scitotenv.2018.03.199 [26] SHEN Z, ZHANG Y, JIN F, et al. Qualitative and quantitative characterisation of adsorption mechanisms of lead on four biochars [J]. Science of the Total Environment, 2017, 609: 1401-1410. doi: 10.1016/j.scitotenv.2017.08.008 [27] ZHU Q, WU J, WANG L, et al. Effect of biochar on heavy metal speciation of paddy soil [J]. Water, Air, & Soil Pollution, 2015, 226(12): 429. [28] UCHIMIYA M, CHANG S, KLASSON K T. Screening biochars for heavy metal retention in soil: Role of oxygen functional groups [J]. Journal of Hazardous Materials, 2011, 190(1-3): 432-441. doi: 10.1016/j.jhazmat.2011.03.063 [29] BASHIR S, SHAABAN M, HUSSAIN Q, et al. Influence of organic and inorganic passivators on Cd and Pb stabilization and microbial biomass in a contaminated paddy soil [J]. Journal of Soils and Sediments, 2018, 18(9): 2948-2959. doi: 10.1007/s11368-018-1981-8 [30] RIZWAN M S, IMTIAZ M, CHHAJRO M A, et al. Influence of pyrolytic and non-pyrolytic rice and castor straws on the immobilization of Pb and Cu in contaminated soil [J]. Environmental Technology, 2016, 37(21): 2679-2686. doi: 10.1080/09593330.2016.1158870 [31] MUJTABA MUNIR M A, LIU G, YOUSAF B, et al. Bamboo-biochar and hydrothermally treated-coal mediated geochemical speciation, transformation and uptake of Cd, Cr, and Pb in a polymetal(iod)s-contaminated mine soil [J]. Environmental Pollution, 2020, 265: 114816. doi: 10.1016/j.envpol.2020.114816 [32] LEI S, SHI Y, QIU Y, et al. Performance and mechanisms of emerging animal-derived biochars for immobilization of heavy metals [J]. Science of the Total Environment, 2019, 646: 1281-1289. doi: 10.1016/j.scitotenv.2018.07.374 [33] CHAO X, QIAN X., ZHU H H , et al Effect of biochar from peanut shell on speciation and availability of lead and zinc in an acidic paddy soil [J]. Ecotoxicology and Environmental Safety, 2018, 164: 554-561. doi: 10.1016/j.ecoenv.2018.08.057 [34] XU C, CHEN H, XIANG Q, et al. Effect of peanut shell and wheat straw biochar on the availability of Cd and Pb in a soil–rice (Oryza sativa L.) system [J]. Environmental Science and Pollution Research, 2018, 25(2): 1147-1156. doi: 10.1007/s11356-017-0495-z [35] YANG X, LU K, MCGROUTHER K, et al. Bioavailability of Cd and Zn in soils treated with biochars derived from tobacco stalk and dead pigs [J]. Journal of Soils and Sediments, 2017, 17(3): 751-762. doi: 10.1007/s11368-015-1326-9 [36] QIAN T, WANG Y, FAN T, et al. A new insight into the immobilization mechanism of Zn on biochar: the role of anions dissolved from ash [J]. Scientific Reports, 2016, 6(1): 33630. [37] PARK J H, CHOPPALA G K, BOLAN N S, et al. Biochar reduces the bioavailability and phytotoxicity of heavy metals [J]. Plant and Soil, 2011, 348(1-2): 439-451. doi: 10.1007/s11104-011-0948-y [38] XU C, ZHAO J, YANG W, et al. Evaluation of biochar pyrolyzed from kitchen waste, corn straw, and peanut hulls on immobilization of Pb and Cd in contaminated soil [J]. Environmental Pollution, 2020, 261: 114133. doi: 10.1016/j.envpol.2020.114133 [39] WU J, HSU F C, CUNNINGHAM S D. Chelate-assisted Pb phytoextraction: Pb availability, uptake, and translocation constraints [J]. Environmental Science & Technology, 1999, 33(11): 1898-1904. [40] GONG X, HUANG D, LIU Y, et al. Nanoscale zerovalent iron, carbon nanotubes and biochar facilitated the phytoremediation of cadmium contaminated sediments by changing cadmium fractions, sediments properties and bacterial community structure [J]. Ecotoxicology and Environmental Safety, 2021, 208: 111510. doi: 10.1016/j.ecoenv.2020.111510 [41] LU K, YANG X, SHEN J, et al. Effect of bamboo and rice straw biochars on the bioavailability of Cd, Cu, Pb and Zn to Sedum plumbizincicola [J]. Agriculture, Ecosystems & Environment, 2014, 191: 124-132. [42] AWAD M, MOUSTAFA-FARAG M, WEI L, et al. Effect of garden waste biochar on the bioavailability of heavy metals and growth of Brassica juncea (L.) in a multi-contaminated soil [J]. Arabian Journal of Geosciences, 2020, 13(12): 439. doi: 10.1007/s12517-020-05376-w [43] HAN L, ZHAO X, JIN J, et al. Using sequential extraction and DGT techniques to assess the efficacy of plant- and manure-derived hydrochar and pyrochar for alleviating the bioavailability of Cd in soils [J]. Science of the Total Environment, 2019, 678: 543-550. doi: 10.1016/j.scitotenv.2019.05.039 [44] AHMAD M, RAJAPAKSHA A U, LIM J E, et al. Biochar as a sorbent for contaminant management in soil and water: A review [J]. Chemosphere, 2014, 99: 19-33. doi: 10.1016/j.chemosphere.2013.10.071 [45] BEESLEY L, DICKINSON N. Carbon and trace element fluxes in the pore water of an urban soil following greenwaste compost, woody and biochar amendments, inoculated with the earthworm Lumbricus terrestris [J]. Soil Biology and Biochemistry, 2011, 43(1): 188-196. doi: 10.1016/j.soilbio.2010.09.035 [46] HAN L, SUN K, YANG Y, et al. Biochar’s stability and effect on the content, composition and turnover of soil organic carbon [J]. Geoderma, 2020, 364: 114184. doi: 10.1016/j.geoderma.2020.114184 [47] BURTON E D, PHILLIPS I R, HAWKER D W, et al. Copper behaviour in a podosol. 1. pH-dependent sorption - desorption, sorption isotherm analysis, and aqueous speciation modelling [J]. Soil Research, 2005, 43(4): 491. doi: 10.1071/SR04117 [48] BOLAN N, KUNHIKRISHNAN A, THANGARAJAN R, et al. Remediation of heavy metal(loid)s contaminated soils – To mobilize or to immobilize? [J]. Journal of Hazardous Materials, 2014, 266: 141-166. doi: 10.1016/j.jhazmat.2013.12.018 [49] GUSIATIN Z M, KURKOWSKI R, BRYM S, et al. Properties of biochars from conventional and alternative feedstocks and their suitability for metal immobilization in industrial soil [J]. Environmental Science and Pollution Research, 2016, 23(21): 21249-21261. doi: 10.1007/s11356-016-7335-4 [50] CAO R X, MA L Q, CHEN M, et al. Phosphate-induced metal immobilization in a contaminated site [J]. Environmental pollution (1987), 2003, 122(1): 19-28. doi: 10.1016/S0269-7491(02)00283-X [51] UCHIMIYA M, BANNON D I, WARTELLE L H, et al. Lead retention by broiler litter biochars in small arms range soil: Impact of pyrolysis temperature [J]. Journal of Agricultural and Food Chemistry, 2012, 60(20): 5035-5044. doi: 10.1021/jf300825n [52] ZHAO B, XU R, MA F, et al. Effects of biochars derived from chicken manure and rape straw on speciation and phytoavailability of Cd to maize in artificially contaminated loess soil [J]. Journal of Environmental Management, 2016, 184: 569-574. doi: 10.1016/j.jenvman.2016.10.020 [53] HUA L, ZHANG H, WEI T, et al. Effect of biochar on fraction and species of antimony in contaminated soil [J]. Journal of Soils and Sediments, 2019, 19(6): 2836-2849. doi: 10.1007/s11368-019-02251-4 [54] AHMAD M, LEE S S, LEE S E, et al. Biochar-induced changes in soil properties affected immobilization/mobilization of metals/metalloids in contaminated soils [J]. Journal of Soils and Sediments, 2017, 17(3): 717-730. doi: 10.1007/s11368-015-1339-4 [55] BRADL H B. Adsorption of heavy metal ions on soils and soils constituents [J]. Journal of Colloid and Interface Science, 2004, 277(1): 1-18. doi: 10.1016/j.jcis.2004.04.005 [56] LIU B, HUANG Q, SU Y, et al. Rice busk biochar treatment to cobalt-polluted fluvo-aquic soil: Speciation and enzyme activities [J]. Ecotoxicology, 2019, 28(10): 1220-1231. doi: 10.1007/s10646-019-02134-x [57] CUI H, OU Y, WANG L, et al. The passivation effect of heavy metals during biochar-amended composting: Emphasize on bacterial communities [J]. Waste Management, 2020, 118: 360-368. doi: 10.1016/j.wasman.2020.08.043 [58] ISO17402.2008. Soil quality—requirements and guidance for the selection and application of methods for the assessment of bioavailability of contaminants in soil and soil materials. Geneva, Switzerland. [59] 窦磊, 周永章, 高全洲, 等. 土壤环境中重金属生物有效性评价方法及其环境学意义 [J]. 土壤通报, 2007(3): 576-583. doi: 10.3321/j.issn:0564-3945.2007.03.034 DOU L, ZHOU Y Z, GAO Q Z, et al. Methods and environmental implications of measuring bioavailability of heavy metals in soil environment [J]. Chinese Journal of Soil Science, 2007(3): 576-583(in Chinese). doi: 10.3321/j.issn:0564-3945.2007.03.034
[60] MEIER S, CURAQUEO G, KHAN N, et al. Chicken-manure-derived biochar reduced bioavailability of copper in a contaminated soil [J]. Journal of Soils and Sediments, 2017, 17(3): 741-750. doi: 10.1007/s11368-015-1256-6 [61] YANG X, LIU J, MCGROUTHER K, et al. Effect of biochar on the extractability of heavy metals (Cd, Cu, Pb, and Zn) and enzyme activity in soil [J]. Environmental Science and Pollution Research, 2016, 23(2): 974-984. doi: 10.1007/s11356-015-4233-0 [62] ARABYARMOHAMMADI H, DARBAN A K, ABDOLLAHY M, et al. Simultaneous immobilization of heavy metals in soil environment by pulp and paper derived nanoporous biochars [J]. Journal of Environmental Health Science and Engineering, 2018, 16(2): 109-119. doi: 10.1007/s40201-018-0294-6 [63] ZHAO M, DAI Y, ZHANG M, et al. Mechanisms of Pb and/or Zn adsorption by different biochars: Biochar characteristics, stability, and binding energies [J]. Science of the Total Environment, 2020, 717: 136894. doi: 10.1016/j.scitotenv.2020.136894 [64] ZHANG G, GUO X, ZHAO Z, et al. Effects of biochars on the availability of heavy metals to ryegrass in an alkaline contaminated soil [J]. Environmental Pollution, 2016, 218: 513-522. doi: 10.1016/j.envpol.2016.07.031 [65] TANG J, CAO C, GAO F, et al. Effects of biochar amendment on the availability of trace elements and the properties of dissolved organic matter in contaminated soils [J]. Environmental Technology & Innovation, 2019, 16: 100492. [66] PUGA A P, MELO L C A, de ABREU C A, et al. Leaching and fractionation of heavy metals in mining soils amended with biochar [J]. Soil and Tillage Research, 2016, 164: 25-33. doi: 10.1016/j.still.2016.01.008 [67] QU C, CHEN W, HU X, et al. Heavy metal behaviour at mineral-organo interfaces: Mechanisms, modelling and influence factors [J]. Environment International, 2019, 131: 104995. doi: 10.1016/j.envint.2019.104995 [68] DANG V M, JOSEPH S, Van H T, et al. Immobilization of heavy metals in contaminated soil after mining activity by using biochar and other industrial by-products: the significant role of minerals on the biochar surfaces [J]. Environmental Technology, 2019, 40(24): 3200-3215. doi: 10.1080/09593330.2018.1468487 [69] HE E, YANG Y, XU Z, et al. Two years of aging influences the distribution and lability of metal(loid)s in a contaminated soil amended with different biochars [J]. Science of the Total Environment, 2019, 673: 245-253. doi: 10.1016/j.scitotenv.2019.04.037 [70] XU W, HOU S, LI Y, et al. Bioavailability and speciation of heavy metals in polluted Soil as alleviated by different types of biochars [J]. Bulletin of Environmental Contamination and Toxicology, 2020, 104(4): 484-488. doi: 10.1007/s00128-020-02804-1 [71] KABIRI P, MOTAGHIAN H, HOSSEINPUR A. Effects of walnut leaves biochars on lead and zinc fractionation and phytotoxicity in a naturally calcareous highly contaminated soil [J]. Water, Air, & Soil Pollution, 2019, 230(11): 263. [72] MEIER S, MOORE F, GONZÁLEZ M, et al. Effects of three biochars on copper immobilization and soil microbial communities in a metal-contaminated soil using a metallophyte and two agricultural plants [J]. Environmental Geochemistry and Health, 2019: 1-16. [73] ALI A, SHAHEEN S M, GUO D, et al. Apricot shell- and apple tree-derived biochar affect the fractionation and bioavailability of Zn and Cd as well as the microbial activity in smelter contaminated soil [J]. Environmental Pollution, 2020, 264: 114773. doi: 10.1016/j.envpol.2020.114773 [74] HUANG C, WANG W, YUE S, et al. Role of biochar and Eisenia fetida on metal bioavailability and biochar effects on earthworm fitness [J]. Environmental Pollution, 2020, 263: 114586. doi: 10.1016/j.envpol.2020.114586 [75] CHEN X, HE H, CHEN G, et al. Effects of biochar and crop straws on the bioavailability of cadmium in contaminated soil [J]. Scientific Reports, 2020, 10(1): 9528. doi: 10.1038/s41598-020-65631-8 [76] MUNIR M A M, LIU G, YOUSAF B, et al. Contrasting effects of biochar and hydrothermally treated coal gangue on leachability, bioavailability, speciation and accumulation of heavy metals by rapeseed in copper mine tailings [J]. Ecotoxicology and Environmental Safety, 2020, 191: 110244. doi: 10.1016/j.ecoenv.2020.110244 [77] ZHENG R, CAI C, LIANG J, et al. The effects of biochars from rice residue on the formation of iron plaque and the accumulation of Cd, Zn, Pb, As in rice (Oryza sativa L.) seedlings [J]. Chemosphere, 2012, 89(7): 856-862. doi: 10.1016/j.chemosphere.2012.05.008 [78] BEESLEY L, MORENO-JIMÉNEZ E, GOMEZ-EYLES J L. Effects of biochar and greenwaste compost amendments on mobility, bioavailability and toxicity of inorganic and organic contaminants in a multi-element polluted soil [J]. Environmental Pollution, 2010, 158(6): 2282-2287. doi: 10.1016/j.envpol.2010.02.003 [79] KARAMI N, CLEMENTE R, MORENO-JIMÉNEZ E, et al. Efficiency of green waste compost and biochar soil amendments for reducing lead and copper mobility and uptake to ryegrass [J]. Journal of Hazardous Materials, 2011, 191(1-3): 41-48. doi: 10.1016/j.jhazmat.2011.04.025 [80] BEESLEY L, MARMIROLI M, PAGANO L, et al. Biochar addition to an arsenic contaminated soil increases arsenic concentrations in the pore water but reduces uptake to tomato plants (Solanum lycopersicum L.) [J]. Science of the Total Environment, 2013, 454-455: 598-603. doi: 10.1016/j.scitotenv.2013.02.047 [81] WANG R, WEI S, JIA P, et al. Biochar significantly alters rhizobacterial communities and reduces Cd concentration in rice grains grown on Cd-contaminated soils [J]. Science of the Total Environment, 2019, 676: 627-638. doi: 10.1016/j.scitotenv.2019.04.133 [82] 谭凤娇. 生物炭及外生菌根真菌群落对森林土壤有机碳分解的作用[D]. 济南, 济南大学,2017. TAN F J. The effects of biochar and ectomycorrhizal fungi on the decomposition of forest soil organic carbon [D]. Jinan: University of Jinan, 2017 (in Chinese).
[83] TANG Y, SHI L, ZHONG K, et al. Ectomycorrhizal fungi may not act as a barrier inhibiting host plant absorption of heavy metals [J]. Chemosphere (Oxford), 2019, 215: 115-123. doi: 10.1016/j.chemosphere.2018.09.143 [84] TU C, WEI J, GUAN F, et al. Biochar and bacteria inoculated biochar enhanced Cd and Cu immobilization and enzymatic activity in a polluted soil [J]. Environment International, 2020, 137: 105576. doi: 10.1016/j.envint.2020.105576 [85] KHAN M A, MAHMOOD-UR-RAHMAN, RAMZANI P M A, et al. Associative effects of lignin-derived biochar and arbuscular mycorrhizal fungi applied to soil polluted from Pb-acid batteries effluents on barley grain safety [J]. Science of The Total Environment, 2020, 710: 136294. doi: 10.1016/j.scitotenv.2019.136294 [86] QIAO Y, CROWLEY D, WANG K, et al. Effects of biochar and Arbuscular mycorrhizae on bioavailability of potentially toxic elements in an aged contaminated soil [J]. Environmental Pollution, 2015, 206: 636-643. doi: 10.1016/j.envpol.2015.08.029 [87] LI H, LIU Y, CHEN Y, et al. Biochar amendment immobilizes lead in rice paddy soils and reduces its phytoavailability [J]. Scientific Reports, 2016, 6(1): 31616. doi: 10.1038/srep31616 [88] GJORGIEVA ACKOVA D. Heavy metals and their general toxicity for plants [J]. Plant Science Today, 2018, 5(1): 14-18. doi: 10.14719/pst.2018.5.1.355 [89] DUBEY S, SHRI M, GUPTA A, et al. Toxicity and detoxification of heavy metals during plant growth and metabolism [J]. Environmental Chemistry Letters, 2018, 16(4): 1169-1192. doi: 10.1007/s10311-018-0741-8 [90] SHEN Z, CHEN Y, XU D, et al. Interactions between heavy metals and other mineral elements from soil to medicinal plant Fengdan (Paeonia ostii) in a copper mining area, China [J]. Environmental Science and Pollution Research, 2020, 27(27): 33743-33752. doi: 10.1007/s11356-020-09358-z [91] ODINGA, E S, WAIGI, M G, GUDDA, F O, et al. Occurrence, formation, environmental fate and risks of environmentally persistent free radicals in biochars [J]. Environment International, 2020, 134: 105172. doi: 10.1016/j.envint.2019.105172 [92] RUAN X, SUN Y, DU W, et al. Formation, characteristics, and applications of environmentally persistent free radicals in biochars: A review [J]. Bioresource Technology, 2019, 281: 457-468. doi: 10.1016/j.biortech.2019.02.105 [93] HERATH I, KUMARATHILAKA P, NAVARATNE A, et al. Immobilization and phytotoxicity reduction of heavy metals in serpentine soil using biochar [J]. Journal of Soils and Sediments, 2015, 15(1): 126-138. doi: 10.1007/s11368-014-0967-4 [94] MOHAMED I, ZHANG G, LI Z, et al. Ecological restoration of an acidic Cd contaminated soil using bamboo biochar application [J]. Ecological Engineering, 2015, 84: 67-76. doi: 10.1016/j.ecoleng.2015.07.009 [95] SHEN X, HUANG D, REN X, et al. Phytoavailability of Cd and Pb in crop straw biochar-amended soil is related to the heavy metal content of both biochar and soil [J]. Journal of Environmental Management, 2016, 168: 245-251. -



 下载:
下载: