-
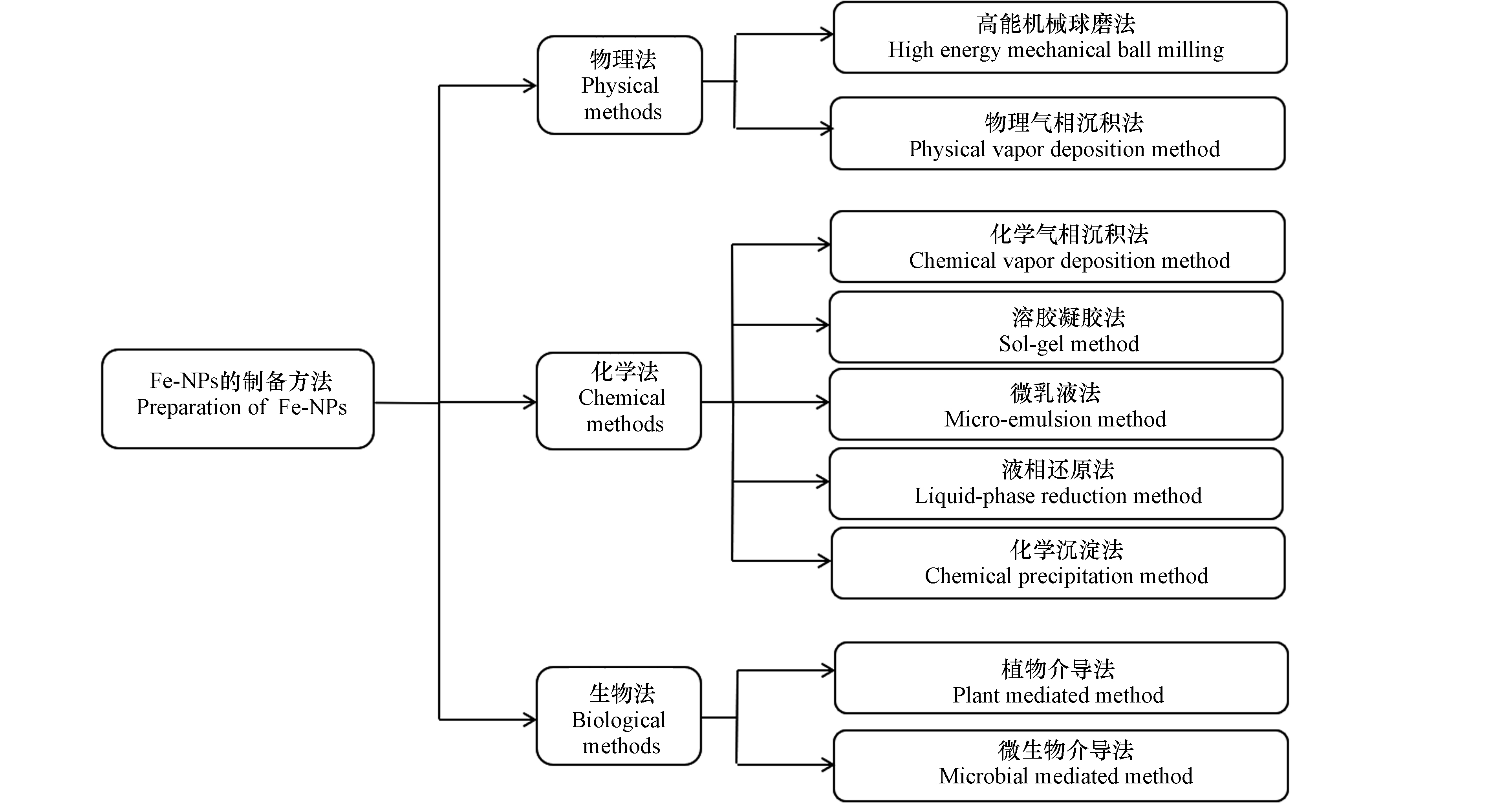
纳米技术是研究尺寸在1—100 nm范围内粒子性质和应用的技术。相较于其它未达到纳米级别的材料而言,金属纳米粒子具有高表面能与高反应活性[1-3],其中,铁基纳米粒子(Fe-NPs)以其独特的磁性和较低的环境迁移性而在环境污染修复领域表现出重要应用潜力[4-5]。在Fe-NPs的各种制备方法中(图1),传统物理和化学法面临着成本高、产物易团聚、实验条件及设备要求苛刻、生物毒性较强等瓶颈问题[1-2, 5-7]。近年来,“绿色”生物法制备的Fe-NPs用于环境污染修复受到众多学者关注。
生物法主要包括植物提取液法与微生物法,二者皆利用其本身具有的还原性与Fe2+或Fe3+溶液反应从而制得Fe-NPs。但是,微生物法存在局限性:制备过程需在无菌环境下进行,由此带来人员培训及实验室建设成本增加;另外,其制备速度较慢[8]。相较而言,制备植物提取液的原料多为常见树种的树叶,制备过程一般在环境条件下完成,其具备原料成本低,制备条件简单的优点[9]。植物提取液中富含具有还原性的多酚,可模仿传统化学液相还原原理制备Fe-NPs,同时,其中的其他生物分子可参与产物的包覆与稳定[10]。具备还原能力的植物提取液代替了传统液相还原法中的还原剂硼氢化钾,故Fe-NPs生物毒性降低的同时也可极大节约制备成本。由该法制得的Fe-NPs已被成功用于修复受有毒有机物[11-12]、重金属[13-15]以及无机阴离子[16-18]污染的水体,这种绿色化学方法为纳米技术应用提供了一条可持续道路。本文对植物提取液制备Fe-NPs的机理及关键影响因素进行总结分析,阐明了其在污染水体修复中的应用效果;明确提出了该法在制备及应用方面存在的关键问题,以期对今后Fe-NPs的大规模生产应用提供理论根基。
-
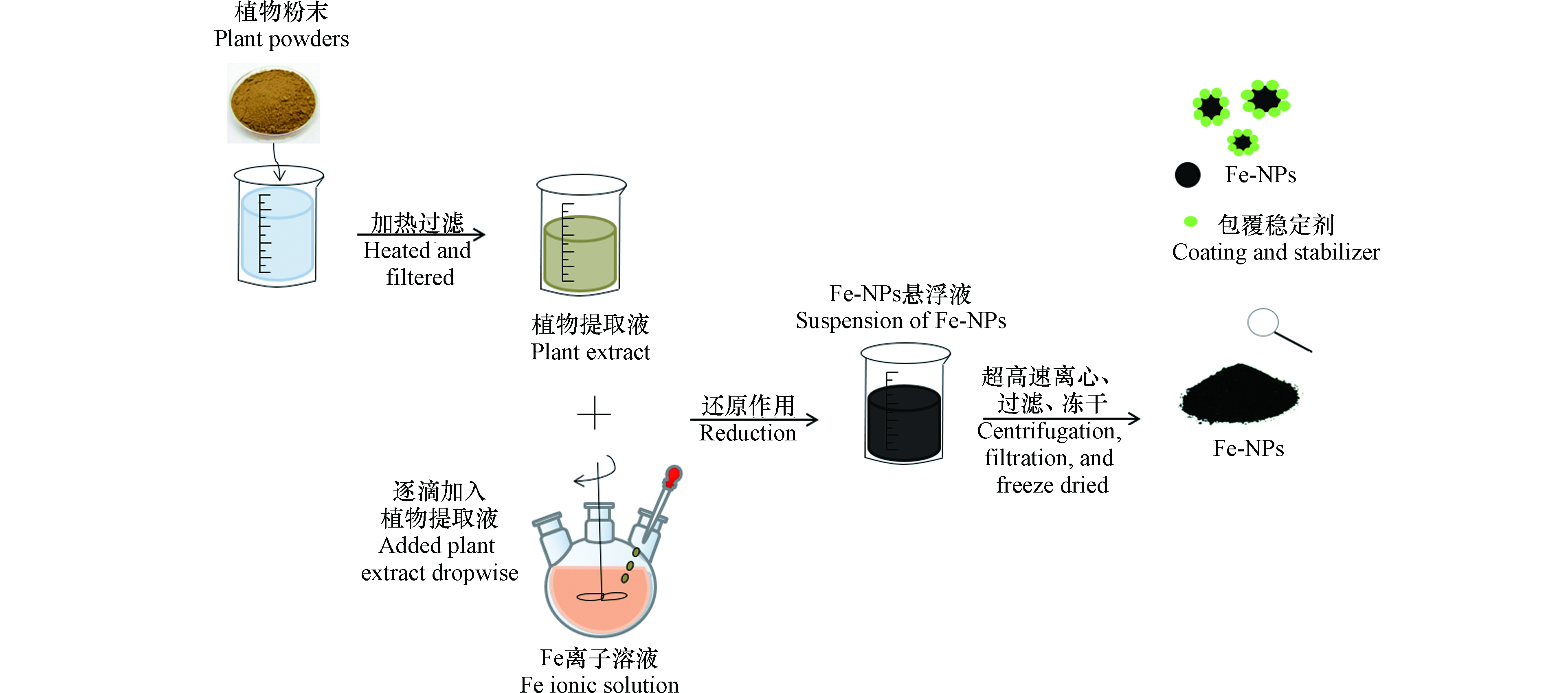
运用植物提取液法制备用于污水修复的Fe-NPs一般分为两个环节。第一步是植物提取液的制备。将洗净、干燥并研磨成粉末的植物叶片[17-19]、种子[10]、果实[13]或果皮[15, 20]等浸入水中,80 ℃浸提1 h后过滤获得植物提取液[9, 14, 18];第二步是运用植物提取液制备Fe-NPs:将其以特定体积比与Fe2+或Fe3+溶液混合后搅拌而得(图2)。植物提取液中含有多种功能型化合物:酚类化合物、单宁、生物碱、抗坏血酸、多糖、萜类和黄酮类物质。其中,酚类化合物、生物碱、萜类和黄酮类物质分别是植物体中莽草酸、氨基酸、甲羟戊酸中的一种或者多种参与形成的二次代谢产物[21]。这些功能型化合物具有不同的官能团,可据此将其划分为两类,分别在制备Fe-NPs的不同阶段发挥作用。其一,是含有—OH的功能型化合物,包括酚类、单宁、抗坏血酸及萜类。首先,Fe2+或Fe3+可与其中部分—OH络合,作为Fe-NPs制备过程中的靶点;其次,依托于—OH的强还原性,形成Fe-NPs核,构成Fe-NPs制备过程中的重要一环,如式(1),其中Ar是芳香族基团,n是被Fe2 +氧化的与—OH相连的C原子数[5, 22-28]。其二,生物碱、多糖及黄酮类物质含有—COOH、—C=O、—CHO等官能团,这些物质不仅可在初期与Fe作为靶点络合,而且具备包覆Fe-NPs核的能力,进而可制得粒径大小均一、分散性优良且不易团聚的Fe-NPs[29],其产物结构表现为类似于纳米零价铁(nano zero valent iron, nZVI)的核壳结构,即与未能完全还原的Fe2+或Fe3+共存的Fe0核以及外层被多糖等生物分子包覆的有机壳[21]。
在制备植物提取液的原料中,植物叶片更易获取,受到广泛关注(表1)。Fe-NPs中Fe的氧化还原状态影响其对水中污染物的去除活性[30],桉树叶、丁香叶、橡叶及绿茶中更加丰富的多酚含量使它们具备更强的还原能力而更常用于Fe-NPs的制备[9](图3)。但是诸如运用绿茶等植物成品作为绿色合成中的还原剂不仅面临提高成本的考验,同时也会造成食品浪费,未来研究中应进一步关注利用更加经济且易获取的本土植物或农业废弃物制备Fe-NPs。
评估植物提取液还原能力的传统检测手段,如Fe离子还原/抗氧化能力法(FRAP)、Folin-酚法、1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除测试等[38]无法精确分析植物提取液成分。近年来,气相色谱-质谱联用(GC-MS)技术为研究植物提取液有效成分提供了重要支撑[23, 28]:Weng等[12]利用GC-MS分析桉树叶提取物与Fe离子溶液混合前后的变化,结果表明,醛类、酚类、胺类和烷烃是参与Fe-NPs制备过程中的主要成分。Desalegn等[39]运用GC-MS分析芒果皮提取液中的活性成分,结果表明,4H-吡喃、2-呋喃甲醛、环丙烷-1-羧酸等物质参与了Fe-NPs的还原与包覆。GC-MS的应用有利于识别出不同种类植物提取液制备Fe-NPs过程中的关键活性成分,为未来优化植物提取液的还原性提供理论参考,进一步制得具有磁性的nZVI,借助其易于固液分离的特点,结合高梯度磁选技术可实现Fe-NPs的可循环规模化应用。
-
根据已有研究,利用不同种类植物以及植物体的不同部位所获得的提取液pH值范围为2.96—6.70[13],其中,具有较低pH、富含低分子量有机酸如草酸、柠檬酸的植物提取液有利于制备出粒径小且均一、分散性高、稳定性强且反应活性强的Fe-NPs[22, 40]。植物提取液pH一方面通过对反应体系中的zeta(ζ)电位产生影响进而显著影响植物提取液与Fe离子的结合能力与还原能力。反应体系中ζ>30 mV时可使胶体保持稳定,而pH<4.5时,满足该条件,但随着pH升高至中性,ζ电位逐渐下降至0 [41]。另一方面,植物提取液中的功能型化合物如生物碱、抗坏血酸、黄酮类等含—C=O,酸性环境下有利于其亲核加成反应生成—OH,不仅增加了Fe2+或Fe3+的结合位点,还可使植物提取液的还原能力提高[29]。
另外,绿色法中植物提取液的还原能力弱于传统化学法中的KBH4,植物提取液对Fe3+具有不完全还原特性,即植物提取液并非将Fe3+完全还原,而是Fe3+与Fe2+共存于反应体系中[10, 38]。可依据共沉淀原理,如式(2),通过向体系中加碱调节pH以获得磁性Fe-NPs [42],这种制备途径同样可结合高梯度磁选技术实现Fe-NPs的规模化循环应用。Martínez-Cabanas等[43]用冷凝回流法制备了桉树叶提取液,将其与0.1 mol·L−1 Fe(NO3)3按一定体积比混合后加入壳聚糖溶液,并滴加2 mol·L−1 NaOH溶液,最后水洗至中性得到磁性壳聚糖基纳米粒子。
-
植物提取液与Fe离子溶液的体积比对产物Fe-NPs的性能可产生重要影响,过量的还原剂(植物提取液)可键合在已形成的纳米Fe核表面,造成表面Fe2+的二次还原,形成粒径更大的Fe-NPs,降低其反应活性[40]。因此,在利用植物提取液制备Fe-NPs前,需探究提取液与Fe离子溶液的最佳体积比。对于桉树叶而言,Fe离子溶液与提取液体积比为1:2有利于获得粒径均一(20—80 nm)的Fe-NPs。Weng等[12]设置Fe离子和Ni离子溶液的混合液与桉树叶提取液体积之比为1∶2,成功制备出粒径为20—50 nm的球状Fe/Ni纳米粒子。Wang等[17, 44]也采用桉树叶提取液在该体积比下制备出Fe-NPs。此外,Mystrioti等[13]分别对比了Fe离子溶液与提取液体积比为1∶2、1∶1和2∶1时,石榴汁和红酒提取物对Fe-NPs的影响,结果表明,当体积比为1∶2时,所得悬浮液中Fe-NPs的含量最高。
-
利用植物提取液制备Fe-NPs的一般过程耗时1 h以上,且所得Fe-NPs的性能有待进一步提升。针对上述问题,部分学者致力于探索更为简便、快捷的植物提取液法辅助手段,它们在植物提取液法制备Fe-NPs的第二个环节中起重要作用。目前,运用这些手段辅助植物提取液法制备的Fe-NPs多用于医疗等领域。未来在污水处理中,应强化利用辅助手段制备Fe-NPs的修复效果与机理研究。
-
微波辅助手段可显著提高Fe-NPs的制备效率并优化Fe-NPs性能,其可在20 min内完成制备过程[45-46],这主要归因于微波通过离子传导与分子运动对溶剂(Fe离子前体及作为还原剂的植物提取液)的快速加热。利用该方法可实现植物提取液法制备Fe-NPs的低能耗规模化量产。
由于高温下高效的加热速率,微波辅助合成的纳米粒子具有更好的单分散性及结晶程度[47-48]。Kombaiah等[49]利用仙人掌提取液,通过微波辅助手段仅需在2.54 GHz 850 W恒定输出功率的微波炉中加热15 min即可制得49 nm、饱和磁化强度77.29 emu ·g−1的Fe-NPs。类似的,该作者运用微波辅助芙蓉提取液还原Fe(NO3)3制得粒径25—62 nm、饱和磁化强度34.09 emu ·g−1的Fe-Ns[50]。微波辅助植物提取液法不仅具备提高Fe-NPs制备效率的能力,其产物更强的磁性有助于实现实际污水修复中Fe-NPs的循环利用。
-
水热辅助手段是将植物提取液与前体物质Fe离子溶液置于四氟乙烯高压反应釜中,在>100 ℃且1K—3K bar压力下制备Fe-NPs,所得产物具有更高的结晶度,甚至更高的饱和磁化强度[42]。Ahmmad等[51]运用水热辅助手段,通过绿茶提取液制得α-Fe2O3:对比水热辅助手段在100—180 ℃下制得的α-Fe2O3的XRD图像,发现温度越高对应的产物特征峰越明显,可见制备温度与Fe-NPs的结晶程度呈正相关,且材料表面积达到商用α-Fe2O3的4倍。Phumying等[52]运用水热合成法,通过芦荟提取液得到粒径为6-30 nm Fe3O4 NPs,磁滞回线表明在180—220 ℃及2—12 h的条件下,制备温度越高和时间越长,所形成产物的饱和磁化强度越大。运用水热辅助植物提取液法可获得性能优良的Fe-NPs。但该辅助手段也存在相应缺陷:受限于反应容器大小,其单次制备Fe-NPs的数量有限,或成为规模化污水修复中的限制因素。
-
植物提取液法制备的Fe-NPs去除水体中重金属、有机污染物以及含氧阴离子的机理主要包括吸附、还原与催化氧化,在实际应用中存在多种作用共存的现象,其对水体中各类污染物的处理效果见表2。在对实际污染水体的修复应用中,具有磁性的Fe-NPs,如nZVI与Fe3O4 NPs均表现出优良的可再生性[15, 53]。需要说明的是,目前利用植物提取液法制备Fe-NPs去除水体污染物的应用局限于实验室模拟污水,现场中试及工业规模的应用较少,主要原因可能是实际污水处理中,不仅环境条件复杂,对污染物的去除受多方面因素影响,并且如何回收Fe-NPs,杜绝二次污染也是其大规模应用的瓶颈问题。今后应进一步探究如何增强植物提取液法制备Fe-NPs的磁性,同时侧重Fe-NPs对实际水体中污染物去除效果与机理研究。
-
在Fe-NPs去除水中重金属污染的过程中,pH是最显著的影响因素之一[53-54, 57],相对碱性的环境有利于Pb、Cd等重金属阳离子的去除,而具有较低pH的酸性水体环境有利于去除Cr、As等含氧阴离子。Lin等[39]运用绿茶提取液合成Fe-NPs,用于水中Pb2+的去除,其Langmuir等温吸附拟合结果表明,20 ℃时对Pb2+的最大单位吸附量为80 mg·g−1,Fe-NPs对Pb2+的主要去除机理是含氧官能团中O与Pb2+发生外层非专性吸附,在pH由5降至3的过程中,H+与Pb2+竞争吸附位点,去除效率由96.4%降低至55.2%,Fe-NPs对Pb2+的吸附效率依赖于反应体系pH。Sebastian等[34]运用椰子壳提取液合成磁性Fe-NPs用于水中Ca2+及Cd2+的吸附,研究表明,吸附效率随pH升高(由pH=2至pH=6)分别提升60%与40%,低pH环境不仅会造成质子与二者竞争吸附位点,并且吸附了质子的Fe-NPs与二者产生静电排斥。Guo等[60]运用植物提取液制备G-nZVI用于去除水中Cr(Ⅵ),为保证修复效率,反应体系pH=3,结果表明,G-nZVI对Cr2O72-的最大单位吸附量达166.7 mg·g−1;根据XRD、FTIR、XPS图谱等分析结果,G-nZVI对Cr2O72-的去除包括吸附作用和同步发生的还原过程。具有高毒性的无机As在水环境中的主要存在形态为As(Ⅲ)和As(Ⅴ),As(Ⅴ)在水环境中的存在形态均为含氧阴离子,而As(Ⅲ)在pH<9.2的环境中均以分子H3AsO3态存在[61],故pH对于Fe-NPs去除As(Ⅴ)的影响更为显著。对于水体中常见的分子态As(Ⅲ),其主要通过在Fe-NPs表面形成沉淀而去除[56]。Manquián-Cerda等[27]研究表明,随着pH由3增加至10的过程中,Fe-NPs对于As(Ⅴ)的去除效率降低了近30%。
影响Fe-NPs去除水体中重金属效率的因素除反应体系pH外,还包括:污染物初始浓度、Fe-NPs投加量与粒径、反应温度与时间等,其中某单一因素的变化对Fe-NPs去除水中重金属的效率有不同影响。初始污染物浓度的升高会提升Fe-NPs对重金属离子的吸附效率,直至Fe-NPs达到平衡饱和吸附量[62]。同理,在未达饱和吸附量时,增加Fe-NPs的投加量会使吸附活性位点增加,进而提升Fe-NPs对重金属的去除效率[31, 34]。更小粒径的Fe-NPs具备更高的比表面积和活性位点暴露数量,其在水中重金属污染修复中表现出优良性能。Nithya等[62]研究表明,使用植物提取液作为包覆剂合成1.9 nm的磁性Fe-NPs较未使用包覆剂合成的12.5 nm的Fe-NPs对水中Ni(Ⅱ)的吸附效率高35%—96%。反应温度与水中重金属的吸附效率成正相关。如Xiao等[63]利用合欢树叶提取液制备Fe-NPs,研究表明,反应体系温度由20 ℃上升至60 ℃的过程中,Fe-NPs对水中Cr(Ⅵ)的去除效率提升了15%。Guo等[60]运用葡萄籽提取液制备Fe-NPs,当温度由25 ℃升高至40 ℃的过程中,Fe-NPs对Cr(Ⅵ)的去除效率提高了10%。Fe-NPs对水中重金属的吸附效率随吸附时间的增加而提升直至达到平衡[39, 55]。此外,反应体系离子强度、Fe-NPs本身的pHpzc等因素也会影响其对污染物的去除效率[54]。
值得说明的是,对于可变价态的Cr和As,不同形态的毒性排序如下:Cr(Ⅵ)>Cr(Ⅲ)[13];As(Ⅲ)>As(Ⅴ)>As(0)[61]。植物提取液法制备Fe-NPs中Fe0的还原性对于水中Cr、As的去除具有重要意义。Samadi等[31]运用山莓叶提取液制备的Fe-NPs光催化去除水中Cr(Ⅵ)的过程中,Cr(Ⅵ)的还原占主导地位,这种现象在Cr(Ⅵ)初始浓度为50 mg·L−1时最为显著,此时Cr(Ⅵ)的还原对水体中Cr(Ⅵ)去除的贡献率超过95%。Soliemanzadeh等[54]运用绿茶提取液制备膨润土负载nZVI去除水中Cr(Ⅵ),去除机理包括吸附与还原,吸附机理中展现出对反应体系pH的依赖性。Poguberovi´c等[19]对比了像树叶、桑叶和樱桃叶提取液制备的Fe-NPs对水中As(Ⅲ)及Cr(Ⅵ)的修复效果,结果表明,桑叶提取液制备的Fe-NPs对As(Ⅲ)的修复效果最好,樱桃叶提取液制备的Fe-NPs对Cr(Ⅵ)的修复效果最好,准二级动力学模型可较好拟合(r2≥0.998)Fe-NPs对As(Ⅲ)和Cr(Ⅵ)的吸附过程,Fe-NPs参与二者的还原去除。因此,提高植物提取液还原能力,提升植物提取液法制备Fe-NPs的还原性对于处理此类污染物具有重要意义。
-
羟基自由基在(pH<4)时拥有较高的氧化电势(2.73 V)[64],pH影响Fe-NPs对水体中有机污染物尤其是有机染料的降解脱色。Truskewycz等[65]研究利用绿茶合成的无定型Fe-NPs通过芬顿反应降解偶氮染料和蒽醌染料,降解效率与pH呈显著相关关系;在70—90 ℃条件下,酸性环境更有利于两种染料的降解。除此之外,吸附作用也参与水体中有机污染物的修复中。Lin等[39]使用植物提取液制备Fe-NPs用于去除水中的利福平,其机理不仅包括芬顿反应,具有高比表面积的Fe-NPs对利福平物理吸附作用亦参与其中,该法已于实际污水修复中实践,其对利福平的修复效率可达68.8%。
近年来,为了提高Fe-NPs对有机污染物的降解能力,利用过渡金属元素具有引导自由基形成的特点,采用植物提取液制备铁基双金属纳米材料日益受到关注[59, 66]。如Luo等[66]运用葡萄叶提取液制得Fe/Pd-NPs用于水中橙红染料的去除,结果表明:由于Pd带来的催化性能,Fe/Pd-NPs较Fe-NPs的去除效率高82%。Chen等[59]运用绿茶提取液合成nZVI/Cu去除溶液中的环丙沙星,在反应起始20 min由物理吸附作用占主导地位,占总吸附量的48%;随着反应进行,材料的比表面积减小,反应进行20 min—90 min时,芬顿反应占总吸附量的50%。
-
水体中存在过量的磷酸盐及硝酸盐会导致水体富营养化,对二者的修复引发关注。其中,Fe-NPs主要通过非专性吸附过程实现水体中PO43-的去除。pH是影响吸附效率的首要原因,利用含低分子量有机酸的植物提取液制备Fe-NPs或降低反应体系pH均可显著提高带正电的Fe-NPs吸附PO43-的能力[18]。Fe-NPs对NO3−的去除是包括共沉淀在内的吸附过程,弱酸环境下并不能使NO3−的去除效率显著提升,其在弱碱性环境下可通过共沉淀实现对NO3−的去除[17]。
-
利用植物提取液还原制备Fe-NPs过程中,多酚是还原Fe2+或Fe3+的关键成分,生物碱、多糖及黄酮类物质参与Fe-NPs的包覆。利用富含低分子有机酸的植物提取液有利于制得具有更小粒径和更高稳定性的Fe-NPs。作为辅助手段的水热法与微波法均可使制得的Fe-NPs具有更小的粒径、更高的分散性及结晶度。另外,微波辅助手段的高效性可实现未来植物提取液法制备Fe-NPs的规模化应用。相较于传统液相还原法中使用的KBH4,植物提取液表现出更优越的经济性与环保性。目前,利用植物提取液制备的Fe-NPs在水体污染治理方面表现出较好的应用效果,其修复机理主要包括静电吸附、表面络合、共沉淀、还原以及Fenton反应。但是绿色植物提取液法的应用依然存在瓶颈,未来应解决的关键问题如下:
(1)需结合GC-MS等技术拓展对植物提取液中关键活性成分的识别,这有利于鉴别还原成分含量高的植物提取液种类;此外,或可通过人为添加该类活性成分提升植物提取液对Fe2+或Fe3+还原能力,提高Fe-NPs中具有磁性的Fe0占比,使Fe-NPs具备更高效的污水修复效果,达到其循环利用的目的,解决Fe-NPs存留于环境中的关键瓶颈。为规模化制备和应用Fe-NPs提供材料与技术支撑。
(2)制备植物提取液的原料需进一步优化。未来应更加侧重于农业加工过程产生的果皮或秸秆等植物废弃物提取液的还原能力研究;同时为了更加因地制宜地制备Fe-NPs,降低制备成本,不同地区本土植物提取液的特性研究成为必要。这些举措有利于进一步提高植物提取液法制备Fe-NPs的经济效益与环保效益。
(3)在水污染修复方面,目前的研究多为实验室机理探究阶段,未来研究应更加关注Fe-NPs对实际污水的处理。另外,Fe-NPs具有较高活性,使用后的不完善回收可能会导致新的环境风险。未来应明确植物提取液法制备的Fe-NPs在实际水环境中的迁移转化行为与生物毒理性,加强Fe-NPs的循环利用与安全处置研究。
利用植物提取液制备铁基纳米粒子及其在水污染处理中的研究进展
Production of iron-based nanoparticles using plant extracts and its application in contaminated water treatment
-
摘要: 铁基纳米粒子(iron-based nanoparticles, Fe-NPs)具有高表面能和高反应活性,这使其在水体污染修复领域受到广泛关注。然而,运用传统物理法或化学法制备的Fe-NPs存在易团聚、成本高、生物毒理性较大等重要缺陷,故探寻出一种更加高效和绿色的Fe-NPs制备方法非常必要。植物提取液中富含多酚、多糖等物质,其作为绿色还原剂与包裹剂制得的Fe-NPs在改善上述缺陷方面表现出重要潜力。本文旨在对采用植物提取液法制备Fe-NPs的国内外研究进展进行总结分析,阐明了该法制备Fe-NPs的机理、过程和影响因素,归纳了利用植物提取液制备Fe-NPs的高效辅助手段;讨论了Fe-NPs在水污染处理中的实际应用,并对其未来研究方向进行了展望,以期为绿色Fe-NPs的规模化应用提供理论基础和科学参考。Abstract: Iron-based nanoparticles (Fe-NPs) exhibit high surface energy and high reactivity which facilitate their wide application in remediation of contaminated water bodies. However, traditional physical and chemical methods for Fe-NPs preparation have critical shortcomings, such as strong tendency of particle aggregation, prohibitive cost, and high biological toxicity, and therefore a more simple, eco-friendly and low-cost synthetic method is much needed. Plant extracts with rich polyphenols and polysaccharides have exhibited important potential as reducer and stabilizer for Fe-NPs production with the above key defects being improved. This work aims to provide a full review at home and abroad regarding production of Fe-NPs using plant extracts, including the mechanisms, processes, and influencing factors. Assisting methods for more efficient production of Fe-NPs using plant extracts were also summarized. The application of Fe-NPs in contaminated water treatment and future research directions were further put forward and discussed in detail. Taken together, this review is expected to provide a theoretical basis and scientific reference for large scale application of Fe-NPs produced by plant extracts.
-
Key words:
- iron-based nanoparticles /
- plant extract /
- biological reduction /
- heavy metals /
- organic pollutants
-

-
表 1 植物提取液的制备及其所合成Fe-NPs的形貌、尺寸、结晶程度
Table 1. Preparation of plant extracts and the morphology, size and crystallinity of the synthesized Fe-NPs
植物种类
Plant
species前体物质
Precursor substances提取条件(植物
粉末与水的固液比、
提取温度、提取时间)
Extraction conditionsFe-NPs合成条件
(提取液与前体离子
溶液体积比、合
成温度、时间)
Synthesis conditions
of Fe-NPsFe-NPs形貌及
尺寸/nm
Morphology and
size of Fe-NPs是否形成
晶体
Whether
crystals
are formed参考文献
References山莓叶 0.1 mol·L−1 FeCl3 60 g·L−1、80 ℃、60 min 4∶1、室温、超声60 min 类球形 20—40 — [31] 桉树叶 0.1 mol·L−1 FeSO4·7H2O 60 g·L−1、80 ℃、60 min 2∶1、室温 搅拌、30 min 类球形 80—200 否 [17] 丁香叶 0.025 mol·L−1 FeCl3
0.025 mol·L−1 AlCl3333.3 g·L−1、65 ℃、
50 min8∶1∶1、70 ℃、
10—15 min纺锤状 — [29] 橡树叶 0.1 mol·L−1 FeCl3·6H2O 37 g·L−1、80 ℃、20 min 3∶1 球形 10—30 — [19] 玫瑰叶 0.01 mol·L−1 FeCl2·4H2O 70 ℃、5—6 min 1∶1、60—70 ℃ 加入1%PVP
类球形 59—4300是 [10] 印楝叶 0.01 mol·L−1 FeCl2·4H2O 70 ℃、5 min 1∶1、60—70 ℃ 加入1%PVP
类球形 38—5600是 [10] 芒果叶 0.01 mol·L−1 FeCl2·4H2O 70 ℃、7—10 min 1∶1、60—70 ℃ 加入1%PVP
不规则形状75—6500是 [10] 菠萝蜜皮 0.1 mol·L−1 FeCl2 60 g·L−1、60 ℃、30 min 3∶2、室温、搅拌 球形33 是 [32] 吊兰叶 0.1 mol·L−1 FeCl3·6H2O 50 g·L−1、80 ℃、60 min 9∶1、室温、1000 r·min−1
搅拌24 h球形 100 否 [33] 椰壳 0.01 mol·L−1 FeCl3 10 g·L−1、90 ℃、30 min 1∶1、室温(27 ℃) 不规则形状 10—100 — [34] 花椒果 0.001 mol·L−1 FeCl3·6H2O 166.5 g·L−1、室温、10 h 室温、搅拌10 min 片状Fe2O3 5—21 是 [35] 表 2 植物提取液法制备Fe-NPs于水污染修复中的应用
Table 2. Application of Fe-NPs produced by plant extracts in contaminated water
植物种类
Plant species合成方法
Synthesis methods纳米粒子种类
Types of
Nanoparticles污染物
Pollutants修复机理
Remediation
mechanisms修复效果
Renovation
effects参考文献
References茶叶 植物提取液法 TP-nZVI-OB Cr(Ⅵ) 吸附 还原 99.9% [54] 绿茶 植物提取液法 GT-nZVI/Cu Cr(Ⅵ) 吸附 还原 94.7% [55] 蓝莓叶 植物提取液法 Fe-NPs As(Ⅴ) 吸附 50.40 mg·g-1 [27] 茶叶 植物提取液法 Fe/Clay As(Ⅲ) 吸附 沉淀 99% [56] 石榴皮 水热法辅助植物
提取液法DMSA@Fe3O4 MNRs Pb (Ⅱ) 非专性吸附 46.18 mg·g-1 [15] 菠萝蜜皮 植物提取液法 Fe-NPs 品红 芬顿反应
吸附87.5% [32] 吊兰叶 植物提取液法 Fe-NPs 甲基橙 芬顿反应 77% [33] 香蕉皮 植物提取液法 生物炭/FexOy 亚甲基蓝 吸附 862 mg·g-1 [57] 葫芦叶 植物提取液法 NPsFeOA 柠檬黄
波尔多红吸附
吸附75.44 mg·g-1
55.16 mg·g-1[58] 甜菜茎 植物提取液法 NPsFeOB 柠檬黄
波尔多红吸附
吸附96.31 mg·g-1
66.7 mg·g-1[58] 绿茶 植物提取液法 GT-nZVI/Cu 环丙沙星 氧化 取代 64% [59] 桉树叶 植物提取液法 Fe-NPs 总氮
COD吸附
吸附71.7%
84.5%[44] 印楝 植物提取液法 Fe-NPs 磷酸盐
氨氮
COD非专性吸附
吸附 共沉淀
吸附98.08%
84.32%
82.35%[18] -
[1] HERLEKAR M, BARVE S, KUMAR R. Plant-mediated green synthesis of iron nanoparticles [J]. Journal of Nanoparticles, 2014, 2014: 1-9. [2] GOUTAM S P, SAXENA G, ROY D, et al. Green synthesis of nanoparticles and their applications in water and wastewater [M]. TreatmentBioremediation of Industrial Waste for Environmental Safety, 2020: 349-379. [3] WEI Y F, WEI S D, LIU C B, et al. Efficient removal of arsenic from groundwater using iron oxide nanoneedle array-decorated biochar fibers with high Fe utilization and fast adsorption kinetics [J]. Water Research, 2019, 167: 115107. doi: 10.1016/j.watres.2019.115107 [4] FAHMY H M, MOHAMED F M, MARZOUQ M H, et al. Review of green methods of iron nanoparticles synthesis and applications [J]. BioNanoScience, 2018, 8(2): 491-503. doi: 10.1007/s12668-018-0516-5 [5] BOLADE O P, WILLIAMS A B, BENSON N U. Green synthesis of iron-based nanomaterials for environmental remediation: A review [J]. Environmental Nanotechnology, Monitoring & Management, 2020, 13: 100279. [6] CRANE R A, SCOTT T B. Nanoscale zero-valent iron: Future prospects for an emerging water treatment technology [J]. Journal of Hazardous Materials, 2012, 211/212: 112-125. doi: 10.1016/j.jhazmat.2011.11.073 [7] BARAGAÑO D, ALONSO J, GALLEGO J R, et al. Zero valent iron and goethite nanoparticles as new promising remediation techniques for As-polluted soils [J]. Chemosphere, 2020, 238: 124624. doi: 10.1016/j.chemosphere.2019.124624 [8] SATHISHKUMAR M, SNEHA K, YUN Y S. Immobilization of silver nanoparticles synthesized using Curcuma longa Tuber powder and extract on cotton cloth for bactericidal activity [J]. Bioresource Technology, 2010, 101(20): 7958-7965. doi: 10.1016/j.biortech.2010.05.051 [9] MACHADO S, PINTO S L, GROSSO J P, et al. Green production of zero-valent iron nanoparticles using tree leaf extracts [J]. Science of the Total Environment, 2013, 445/446: 1-8. doi: 10.1016/j.scitotenv.2012.12.033 [10] AFSHEEN S, TAHIR M B, IQBAL T, et al. Green synthesis and characterization of novel iron particles by using different extracts [J]. Journal of Alloys and Compounds, 2018, 732: 935-944. doi: 10.1016/j.jallcom.2017.10.137 [11] WENG X L, HUANG L L, CHEN Z L, et al. Synthesis of iron-based nanoparticles by green tea extract and their degradation of malachite [J]. Industrial Crops and Products, 2013, 51: 342-347. doi: 10.1016/j.indcrop.2013.09.024 [12] WENG X L, GUO M Y, LUO F, et al. One-step green synthesis of bimetallic Fe/Ni nanoparticles by Eucalyptus leaf extract: Biomolecules identification, characterization and catalytic activity [J]. Chemical Engineering Journal, 2017, 308: 904-911. doi: 10.1016/j.cej.2016.09.134 [13] MYSTRIOTI C, XANTHOPOULOU T D, TSAKIRIDIS P, et al. Comparative evaluation of five plant extracts and juices for nanoiron synthesis and application for hexavalent chromium reduction [J]. Science of the Total Environment, 2016, 539: 105-113. doi: 10.1016/j.scitotenv.2015.08.091 [14] WENG X L, JIN X Y, LIN J J, et al. Removal of mixed contaminants Cr(Ⅵ) and Cu(Ⅱ) by green synthesized iron based nanoparticles [J]. Ecological Engineering, 2016, 97: 32-39. doi: 10.1016/j.ecoleng.2016.08.003 [15] VENKATESWARLU S, KUMAR B N, PRATHIMA B, et al. A novel green synthesis of Fe3O4 magnetic nanorods using Punica Granatum rind extract and its application for removal of Pb(Ⅱ) from aqueous environment [J]. Arabian Journal of Chemistry, 2019, 12(4): 588-596. doi: 10.1016/j.arabjc.2014.09.006 [16] CAO D, JIN X Y, GAN L, et al. Removal of phosphate using iron oxide nanoparticles synthesized by Eucalyptus leaf extract in the presence of CTAB surfactant [J]. Chemosphere, 2016, 159: 23-31. doi: 10.1016/j.chemosphere.2016.05.080 [17] WANG T, LIN J J, CHEN Z L, et al. Green synthesized iron nanoparticles by green tea and Eucalyptus leaves extracts used for removal of nitrate in aqueous solution [J]. Journal of Cleaner Production, 2014, 83: 413-419. doi: 10.1016/j.jclepro.2014.07.006 [18] DEVATHA C P, THALLA A K, KATTE S Y. Green synthesis of iron nanoparticles using different leaf extracts for treatment of domestic waste water [J]. Journal of Cleaner Production, 2016, 139: 1425-1435. doi: 10.1016/j.jclepro.2016.09.019 [19] POGUBEROVIĆ S S, KRČMAR D M, MALETIĆ S P, et al. Removal of As(Ⅲ) and Cr(Ⅵ) from aqueous solutions using “green” zero-valent iron nanoparticles produced by oak, mulberry and cherry leaf extracts [J]. Ecological Engineering, 2016, 90: 42-49. doi: 10.1016/j.ecoleng.2016.01.083 [20] EHRAMPOUSH M H, MIRIA M, SALMANI M H, et al. Cadmium removal from aqueous solution by green synthesis iron oxide nanoparticles with tangerine peel extract [J]. Journal of Environmental Health Science and Engineering, 2015, 13(1): 1-7. doi: 10.1186/s40201-015-0157-3 [21] KHAIRUL HANIF MOHD NAZRI M, SAPAWE N. A short review on green synthesis of iron metal nanoparticles via plants extracts [J]. Materials Today:Proceedings, 2020, 31: A48-A53. doi: 10.1016/j.matpr.2020.10.968 [22] MAKAROV V V, MAKAROVA S S, LOVE A J, et al. Biosynthesis of stable iron oxide nanoparticles in aqueous extracts of Hordeum vulgare and Rumex acetosa plants [J]. Langmuir, 2014, 30(20): 5982-5988. doi: 10.1021/la5011924 [23] GOUTAM S P, SAXENA G, SINGH V, et al. Green synthesis of TiO2 nanoparticles using leaf extract of Jatropha curcas L. for photocatalytic degradation of tannery wastewater [J]. Chemical Engineering Journal, 2018, 336: 386-396. doi: 10.1016/j.cej.2017.12.029 [24] AL-SHNANI F, AL-HADDAD T, KARABET F, et al. Chitosan loaded with silver nanoparticles, CS-AgNPs, using Thymus syriacus, wild mint, and rosemary essential oil extracts as reducing and capping agents [J]. Journal of Physical Organic Chemistry, 2017, 30(11): e3680. doi: 10.1002/poc.3680 [25] LUO F, CHEN Z L, MEGHARAJ M, et al. Biomolecules in grape leaf extract involved in one-step synthesis of iron-based nanoparticles [J]. RSC Adv, 2014, 4(96): 53467-53474. doi: 10.1039/C4RA08808E [26] XIAO Z L, YUAN M, YANG B, et al. Plant-mediated synthesis of highly active iron nanoparticles for Cr (Ⅵ) removal: Investigation of the leading biomolecules [J]. Chemosphere, 2016, 150: 357-364. doi: 10.1016/j.chemosphere.2016.02.056 [27] MANQUIÁN-CERDA K, CRUCES E, ANGÉLICA RUBIO M, et al. Preparation of nanoscale iron (oxide, oxyhydroxides and zero-valent) particles derived from blueberries: Reactivity, characterization and removal mechanism of arsenate [J]. Ecotoxicology and Environmental Safety, 2017, 145: 69-77. doi: 10.1016/j.ecoenv.2017.07.004 [28] ATAROD M, NASROLLAHZADEH M, MOHAMMAD SAJADI S. Green synthesis of Pd/RGO/Fe3O4 nanocomposite using Withania coagulans leaf extract and its application as magnetically separable and reusable catalyst for the reduction of 4-nitrophenol [J]. Journal of Colloid and Interface Science, 2016, 465: 249-258. doi: 10.1016/j.jcis.2015.11.060 [29] MONDAL P, PURKAIT M K. Preparation and characterization of novel green synthesized iron-aluminum nanocomposite and studying its efficiency in fluoride removal [J]. Chemosphere, 2019, 235: 391-402. doi: 10.1016/j.chemosphere.2019.06.189 [30] TANG S C N, LO I M C. Magnetic nanoparticles: Essential factors for sustainable environmental applications [J]. Water Research, 2013, 47(8): 2613-2632. doi: 10.1016/j.watres.2013.02.039 [31] SAMADI Z, YAGHMAEIAN K, MORTAZAVI-DERAZKOLA S, et al. Facile green synthesis of zero-valent iron nanoparticles using barberry leaf extract (GnZVI@BLE) for photocatalytic reduction of hexavalent chromium [J]. Bioorganic Chemistry, 2021, 114: 105051. doi: 10.1016/j.bioorg.2021.105051 [32] JAIN R, MENDIRATTA S, KUMAR L, et al. Green synthesis of iron nanoparticles using Artocarpus heterophyllus peel extract and their application as a heterogeneous Fenton-like catalyst for the degradation of Fuchsin Basic dye [J]. Current Research in Green and Sustainable Chemistry, 2021, 4: 100086. doi: 10.1016/j.crgsc.2021.100086 [33] SHAKER ARDAKANI L, ALIMARDANI V, TAMADDON A M, et al. Green synthesis of iron-based nanoparticles using Chlorophytum comosum leaf extract: Methyl orange dye degradation and antimicrobial properties [J]. Heliyon, 2021, 7(2): e06159. doi: 10.1016/j.heliyon.2021.e06159 [34] SEBASTIAN A, NANGIA A, PRASAD M N V. A green synthetic route to phenolics fabricated magnetite nanoparticles from coconut husk extract: Implications to treat metal contaminated water and heavy metal stress in Oryza sativa L [J]. Journal of Cleaner Production, 2018, 174: 355-366. doi: 10.1016/j.jclepro.2017.10.343 [35] SAIKIA I, HAZARIKA M, HUSSIAN N, et al. Biogenic synthesis of Fe2O3@SiO2 nanoparticles for ipso-hydroxylation of boronic acid in water [J]. Tetrahedron Letters, 2017, 58(45): 4255-4259. doi: 10.1016/j.tetlet.2017.09.075 [36] MONDAL P, PURKAIT M K. Green synthesized iron nanoparticles supported on pH responsive polymeric membrane for nitrobenzene reduction and fluoride rejection study: Optimization approach [J]. Journal of Cleaner Production, 2018, 170: 1111-1123. doi: 10.1016/j.jclepro.2017.09.222 [37] LIN Z, WENG X L, OWENS G, et al. Simultaneous removal of Pb(Ⅱ) and rifampicin from wastewater by iron nanoparticles synthesized by a tea extract [J]. Journal of Cleaner Production, 2020, 242: 118476. doi: 10.1016/j.jclepro.2019.118476 [38] 刘妍君, 李剑锋, 陈祖亮, 等. 纳米铁的绿色合成及其去除水中污染物研究进展 [J]. 水处理技术, 2019, 45(1): 6-11,16. LIU Y J, LI J F, CHEN Z L, et al. Research progress of green synthesis of iron nanoparticle and its application on contaminants removal from water [J]. Technology of Water Treatment, 2019, 45(1): 6-11,16(in Chinese).
[39] DESALEGN B, MEGHARAJ M, CHEN Z L, et al. Green synthesis of zero valent iron nanoparticle using mango peel extract and surface characterization using XPS and GC-MS [J]. Heliyon, 2019, 5(5): e01750. doi: 10.1016/j.heliyon.2019.e01750 [40] HUANG L L, LUO F, CHEN Z L, et al. Green synthesized conditions impacting on the reactivity of Fe NPs for the degradation of malachite green [J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2015, 137: 154-159. doi: 10.1016/j.saa.2014.08.116 [41] WANG N, HSU C, ZHU L H, et al. Influence of metal oxide nanoparticles concentration on their Zeta potential [J]. Journal of Colloid and Interface Science, 2013, 407: 22-28. doi: 10.1016/j.jcis.2013.05.058 [42] SCHWERTMANN U, CORNELL R M, Iron oxides in the laboratory: preparation and characterization[M]. John Wiley & Sons. 2008. [43] MARTÍNEZ-CABANAS M, LÓPEZ-GARCÍA M, BARRIADA J L, et al. Green synthesis of iron oxide nanoparticles. Development of magnetic hybrid materials for efficient As(V) removal [J]. Chemical Engineering Journal, 2016, 301: 83-91. doi: 10.1016/j.cej.2016.04.149 [44] WANG T, JIN X Y, CHEN Z L, et al. Green synthesis of Fe nanoparticles using Eucalyptus leaf extracts for treatment of eutrophic wastewater [J]. Science of the Total Environment, 2014, 466/467: 210-213. doi: 10.1016/j.scitotenv.2013.07.022 [45] YÜRÜM A, KOCABAŞ-ATAKLı Z Ö, SEZEN M, et al. Fast deposition of porous iron oxide on activated carbon by microwave heating and arsenic (Ⅴ) removal from water [J]. Chemical Engineering Journal, 2014, 242: 321-332. doi: 10.1016/j.cej.2014.01.005 [46] MAHMOUD M E, AMIRA M F, ZAGHLOUL A A, et al. High performance microwave-enforced solid phase extraction of heavy metals from aqueous solutions using magnetic iron oxide nanoparticles-protected-nanosilica [J]. Separation and Purification Technology, 2016, 163: 169-172. doi: 10.1016/j.seppur.2016.02.039 [47] WILLIAMS M J, SÁNCHEZ E, ALURI E R, et al. Microwave-assisted synthesis of highly crystalline, multifunctional iron oxide nanocomposites for imaging applications [J]. RSC Advances, 2016, 6(87): 83520-83528. doi: 10.1039/C6RA11819D [48] LIANG J J, ZHUO M, GUO D, et al. Green and rapid synthesis of 3D Fe2(MoO4)3 by microwave irradiation to detect H2S gas [J]. Materials Letters, 2016, 168: 171-175. doi: 10.1016/j.matlet.2016.01.048 [49] KOMBAIAH K, VIJAYA J J, KENNEDY L J, et al. Self heating efficiency of CoFe2O4 nanoparticles: A comparative investigation on the conventional and microwave combustion method [J]. Journal of Alloys and Compounds, 2018, 735: 1536-1545. doi: 10.1016/j.jallcom.2017.11.279 [50] KOMBAIAH K, VIJAYA J J, KENNEDY L J, et al. Conventional and microwave combustion synthesis of optomagnetic CuFe2O4 nanoparticles for hyperthermia studies [J]. Journal of Physics and Chemistry of Solids, 2018, 115: 162-171. doi: 10.1016/j.jpcs.2017.12.024 [51] AHMMAD B, LEONARD K, SHARIFUL ISLAM M, et al. Green synthesis of mesoporous hematite (α-Fe2O3) nanoparticles and their photocatalytic activity [J]. Advanced Powder Technology, 2013, 24(1): 160-167. doi: 10.1016/j.apt.2012.04.005 [52] PHUMYING S, LABUAYAI S, THOMAS C, et al. Aloe vera plant-extracted solution hydrothermal synthesis and magnetic properties of magnetite (Fe3O4) nanoparticles [J]. Applied Physics A, 2013, 111(4): 1187-1193. doi: 10.1007/s00339-012-7340-5 [53] ZHANG Y T, JIAO X Q, LIU N, et al. Enhanced removal of aqueous Cr(Ⅵ) by a green synthesized nanoscale zero-valent iron supported on oak wood biochar [J]. Chemosphere, 2020, 245: 125542. doi: 10.1016/j.chemosphere.2019.125542 [54] SOLIEMANZADEH A, FEKRI M. The application of green tea extract to prepare bentonite-supported nanoscale zero-valent iron and its performance on removal of Cr(Ⅵ): Effect of relative parameters and soil experiments [J]. Microporous and Mesoporous Materials, 2017, 239: 60-69. doi: 10.1016/j.micromeso.2016.09.050 [55] ZHU F, MA S Y, LIU T, et al. Green synthesis of nano zero-valent iron/Cu by green tea to remove hexavalent chromium from groundwater [J]. Journal of Cleaner Production, 2018, 174: 184-190. doi: 10.1016/j.jclepro.2017.10.302 [56] TANDON P K, SHUKLA R C, SINGH S B. Removal of arsenic(III) from water with clay-supported zerovalent iron nanoparticles synthesized with the help of tea liquor [J]. Industrial & Engineering Chemistry Research, 2013, 52(30): 10052-10058. [57] ZHANG P, O’CONNOR D, WANG Y N, et al. A green biochar/iron oxide composite for methylene blue removal [J]. Journal of Hazardous Materials, 2020, 384: 121286. doi: 10.1016/j.jhazmat.2019.121286 [58] de LIMA BARIZÃO A C, SILVA M F, ANDRADE M, et al. Green synthesis of iron oxide nanoparticles for tartrazine and Bordeaux red dye removal [J]. Journal of Environmental Chemical Engineering, 2020, 8(1): 103618. doi: 10.1016/j.jece.2019.103618 [59] CHEN L S, NI R, YUAN T J, et al. Effects of green synthesis, magnetization, and regeneration on ciprofloxacin removal by bimetallic nZVI/Cu composites and insights of degradation mechanism [J]. Journal of Hazardous Materials, 2020, 382: 121008. doi: 10.1016/j.jhazmat.2019.121008 [60] GUO B, LI M L, LI S. The comparative study of a homogeneous and a heterogeneous system with green synthesized iron nanoparticles for removal of Cr(VI) [J]. Scientific Reports, 2020, 10: 7382. doi: 10.1038/s41598-020-64476-5 [61] SIDDIQUI S I, NAUSHAD M, CHAUDHRY S A. Promising prospects of nanomaterials for arsenic water remediation: A comprehensive review [J]. Process Safety and Environmental Protection, 2019, 126: 60-97. doi: 10.1016/j.psep.2019.03.037 [62] NITHYA K, SATHISH A, SENTHIL KUMAR P, et al. Fast kinetics and high adsorption capacity of green extract capped superparamagnetic iron oxide nanoparticles for the adsorption of Ni(II) ions [J]. Journal of Industrial and Engineering Chemistry, 2018, 59: 230-241. doi: 10.1016/j.jiec.2017.10.028 [63] XIAO Z L, ZHANG H D, XU Y, et al. Ultra-efficient removal of chromium from aqueous medium by biogenic iron based nanoparticles [J]. Separation and Purification Technology, 2017, 174: 466-473. doi: 10.1016/j.seppur.2016.10.047 [64] 徐向荣, 王文华, 李华斌. 比色法测定Fenton反应产生的羟自由基及其应用 [J]. 生物化学与生物物理进展, 1999, 26(1): 67-68. doi: 10.3321/j.issn:1000-3282.1999.01.019 XU X R, WANG W H, LI H B. Determination of hydroxyl radicals in Fenton reaction by colorimetric assay and its application [J]. Progress in Biochemistry and Biophysics, 1999, 26(1): 67-68(in Chinese). doi: 10.3321/j.issn:1000-3282.1999.01.019
[65] TRUSKEWYCZ A, SHUKLA R, BALL A S. Iron nanoparticles synthesized using green tea extracts for the Fenton-like degradation of concentrated dye mixtures at elevated temperatures [J]. Journal of Environmental Chemical Engineering, 2016, 4(4): 4409-4417. doi: 10.1016/j.jece.2016.10.008 [66] LUO F, YANG D, CHEN Z L, et al. One-step green synthesis of bimetallic Fe/Pd nanoparticles used to degrade Orange II [J]. Journal of Hazardous Materials, 2016, 303: 145-153. doi: 10.1016/j.jhazmat.2015.10.034 -



 下载:
下载: