-
滇重楼(Paris polyphylla var. yunnanensis)为百合科重楼属多年生植物,其干燥的根茎是重楼药材的基原植物之一,具有消肿止痛、凉肝定惊、清热解毒等功效[1]。近年来,随着制药工业的需求量逐年增加,重庆、贵州、云南等地种植滇重楼的面积不断增加以缓解市场的供需矛盾,人工栽培滇重楼成了实现资源可持续发展的有效途径[2]。因此,通过农业生物技术来提高滇重楼产量、改善其品质已成为国内研究滇重楼规范化栽培体系的热点领域。
磷作为植物生长发育不可或缺的营养元素之一,植物缺磷会导致其生长发育不良且产量降低。土壤全磷含量虽然较高,但植物仅可以吸收其总量的1%—5%[3],农业生产主要通过施入磷肥来解决土壤缺磷问题,但长期施用磷肥,不仅耗竭有限的磷矿资源,不合理施用磷肥还会引起水体富营养化。解磷菌也称之为溶磷菌,作为一类新型的微生物肥料,能够将土壤中不易被植物吸收的难溶性磷酸盐转化为可被利用的形式。前期研究表明,植物生长过程中接种解磷菌可以促进植物的生长,如增加植物体内的磷含量[4-5],促进干物质的积累[6],提高植物体内铜(Cu)和铁(Fe)含量[7]等。接种解磷菌之所以能够促进植物对磷的吸收,是由于解磷菌不仅可以释放少量的磷,还能分泌一些生长调节物质来促进根系的生长[8],所以解磷菌具有解磷和促进生长的双重作用[9]。
目前为止,解磷菌对土壤难溶性磷的溶解作用已经逐渐引起了国内外学者的重视,利用植物与解磷菌的相互作用来调节植物根际磷的有效性,将无效磷转化为有效磷已成为当前的研究热点,但有关解磷菌对植物的促生效应研究多以农作物为主,如小麦[5,7]、水稻[10]、大豆[11]和玉米[4,12]等,且研究指标主要集中在株高、生物量以及磷含量等方面。有关解磷菌对药用植物生长发育以及药用品质的影响研究尚不多见,关于解磷菌对滇重楼生长发育状况鲜见报道。
本研究以接种不同剂量的解磷菌为处理,研究了不同剂量的解磷菌对滇重楼生长发育的影响,以便寻找出滇重楼最适接种剂量,为解磷菌在滇重楼生产上的应用提供理论依据。
-
溶磷菌(有效活菌数≥2×1010 cfu·g−1)由广州市微元生物科技有限公司提供。供试植株为滇重楼(Paris polyphylla var. yunnanensis)实生苗,由重庆三峡学院提供,经周浓教授鉴定为延龄草科重楼属植物滇重楼,实验材料选用新鲜根茎。
供试土壤取自重庆三峡学院菜园的黄壤土,去除草根后掺入干净的河砂,按体积比3∶1混合,作为栽培基质,用2 mm筛子过筛,121 ℃高压灭菌锅内灭菌2 h,黑暗条件下保存1 周后装盆,每盆装土量为16.0 kg。每处理10个重复,每重复1盆,栽种大小基本一致的滇重楼5株,生长期间按常规管理,隔天浇水至田间持水量 70%—80% ,温室光照时间为每天14 h,光强为 280 μmol·m−2·s−1。
采用室温盆栽方法进行单因素随机区组设计,试验设不接种解磷菌作为对照和接菌处理,于2015年6月(T1期,滇重楼处于旺盛生长初期)、7月(T2期,滇重楼处于旺盛生长中期)和8月(T3期,滇重楼处于旺盛生长末期)依次接种解磷菌剂,接菌处理包括:接种5.83 g解磷菌(P1)、接种8.75 g解磷菌(P2)、接种17.50 g解磷菌(P3)、接种35.00 g解磷菌(P4)。
-
TAS-990AFG型原子吸收分光光度计(北京普析通用仪器有限责任公司);AFS-230E原子荧光光度计(北京科创海光有限公司);C-MAG HP10型数显加热板(德国IKA集团);DZF-6050MBE型电热恒温真空干燥箱(上海博讯实业有限公司);镉(Cd)、Cu、铅(Pb)空心阴极灯(北京曙光明电子光源仪器有限公司);AE-240型分析天平(梅特勒-托利多仪器上海有限公司)。
Cd、Cu、Pb标准贮备液(购自国家环境保护总局标准样品研究所,批号分别为:103110、100609、100808),其他试剂均为优级纯,水为去离子水。
-
于2015年12月依次采取滇重楼的根系和叶片作为待测样品。采用TTC染色法测定根系活力;叶绿素含量采用Lichtenthaler[13]的方法进行测定,并根据公式计算叶绿素 a(Chl a)、叶绿素 b(Chl b)、总叶绿素(Chl a+b)、叶绿素a/b比值(Chl a/b)以及类胡萝卜素(Car)含量;采用硫代巴比妥酸法测定丙二醛(MDA)和可溶性糖含量[14];采用考马斯亮蓝比色法测定可溶性蛋白含量[15];采用氮蓝四唑法测定超氧化物歧化酶(SOD)活性[16];采用愈创木酚显色法测定过氧化物酶(POD)活性[17];采用紫外分光光度法测定过氧化氢酶(CAT)活性[18]。采用原子吸收光谱法测定解磷菌处理下滇重楼药用部分磷(P)、钾(K)、钙(Ca)、镁(Mg)、锌(Zn)、Cu、Cd、Pb以及锰(Mn)的含量[19]。
-
试验数据的统计分析采用Excel 2003软件,数据方差分析采用SPSS 22.0统计,绘图采用Origian 9.0软件进行。
-
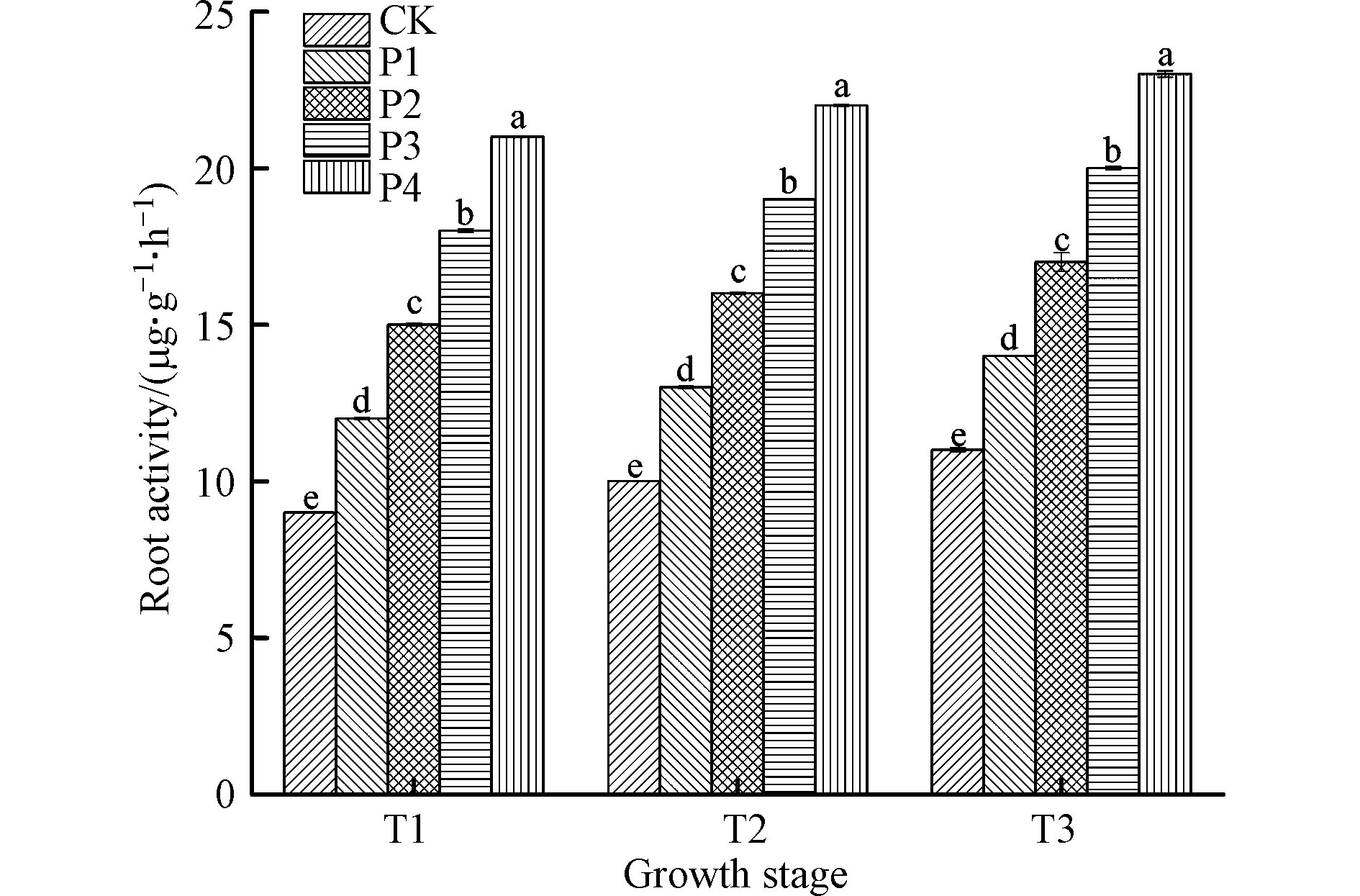
根系作为植物吸收养分的主要器官,其根系活力的强弱可以综合反映植物根系吸收养分的能力。试验表明,不同时期接种不同剂量的解磷菌均可显著提高滇重楼根系活力(图1),同一接种时期,随着解磷菌剂量的增加,其根系活力逐渐升高,其中P4处理的调控效果最好,分别比对照依次提高了133.25%、119.93%和109.03%(P<0.05);同一解磷菌剂,随着接种时期的延长,其根系活力逐渐升高。总之,正常供磷条件下,滇重楼根系活力的增强可以促进根系对磷元素的吸收和运输功能,其中T3期施用35.00 g(P4)解磷菌的调控效果最佳,这与张彦丽等[10]在水稻幼苗上的调节效果相同。
-
叶绿素(Chl)和Car作为植物光合作用的主要色素,其含量变化与植物的生长、发育和生存密切相关,是评价植物光合作用效率的重要指标,植物叶片内Chl含量的增加可使其光合作用加强,光能利用率有所提高,从而提高作物产量。如表1所示,各时期接种解磷菌均能不同程度地提高滇重楼叶片内的Chl a、Chl b、 Chl a+b以及Car含量;随着接种时期的延长,Chl和Car含量逐渐升高,其中,T3期各处理的Chl a含量增长幅度为6.51%—80.55%、Chl b含量增长幅度为25.01%—117.71%、Chl a+b含量增长幅度为7.15%—86.90%、Car含量增长幅度为6.60%—75.95%,方差分析可知,处理与对照之间差异显著。其中,T3期施用5.83 g(P1)和8.75 g(P2)解磷菌的调控效果较好。在一定的土壤肥力或施肥条件下,当解磷菌作为生物肥施用可以促进植物叶片内的Chl合成,延缓叶片内Chl的降解,进而提高Chl含量,本研究结果也说明了这个问题。相似的研究结果在玉米[12]以及鸡毛菜[20]等植物中也均得到了证实。
-
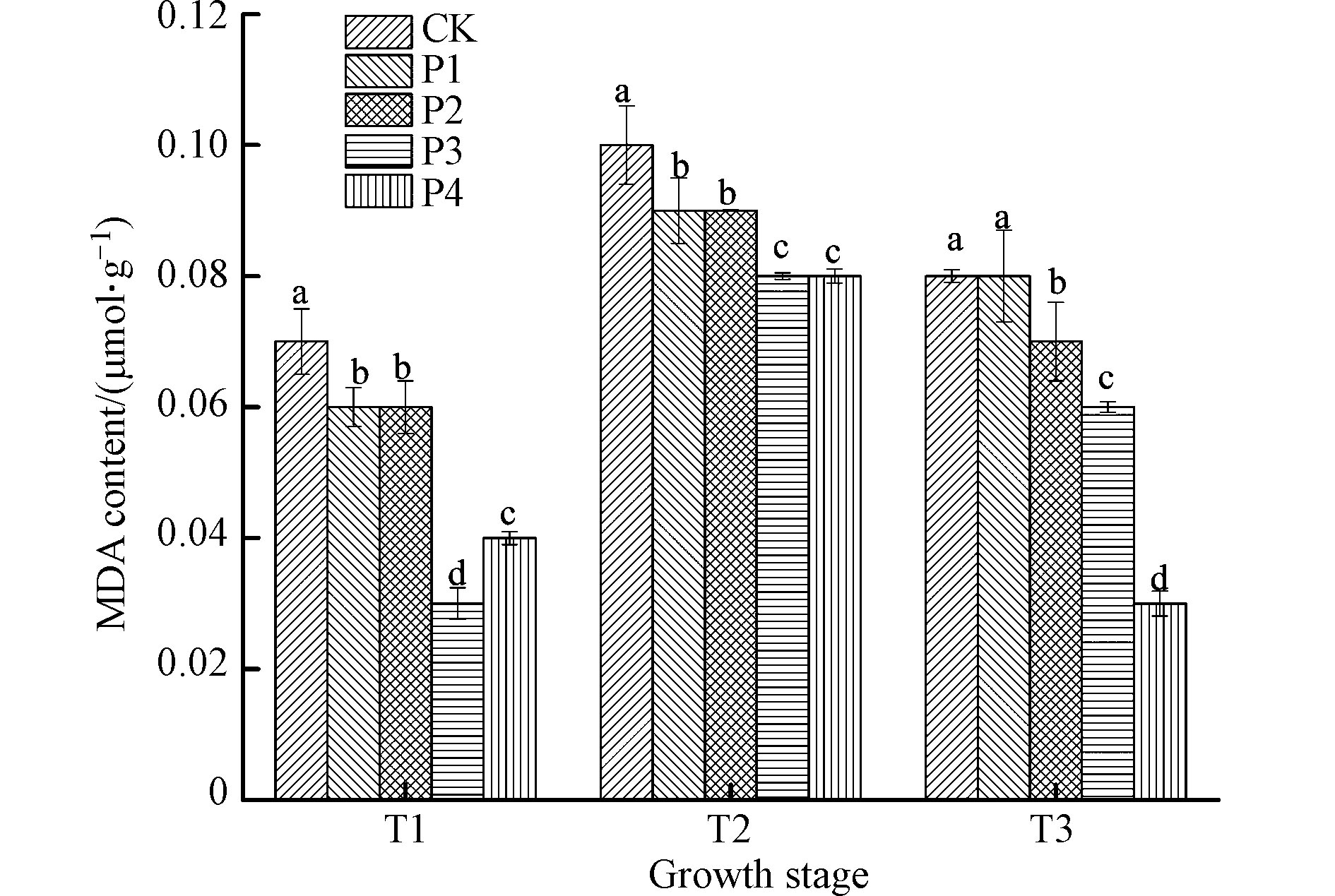
不同时期接种不同剂量的解磷菌对滇重楼叶片内MDA含量的调控效果如图2所示,随着接种解磷菌剂量的增加,滇重楼叶片内MDA含量逐渐降低,T1、T2和T3期各处理MDA含量下降幅度依次为4.35%—36.71%、1.06%—21.07%和6.34%—68.01%,方差分析可知,除T3期P1处理外,其余处理植株叶片内MDA含量与未接种植株间差异均达到显著水平,其中,T3期施用35.00 g(P4)解磷菌的调控效果最佳,可见,滇重楼苗期接种解磷菌可以不同程度地延缓叶片的衰老。此外,滇重楼叶片内MDA含量的减少说明了细胞脂质过氧化程度较低,细胞膜系统比较稳定,这有利于提高植物叶片内细胞的生理活性,进而促进滇重楼植株的生长,与韦正鑫等[21]和黄艳萍等[22]对滇重楼叶片 MDA 含量变化的研究结果一致。
-
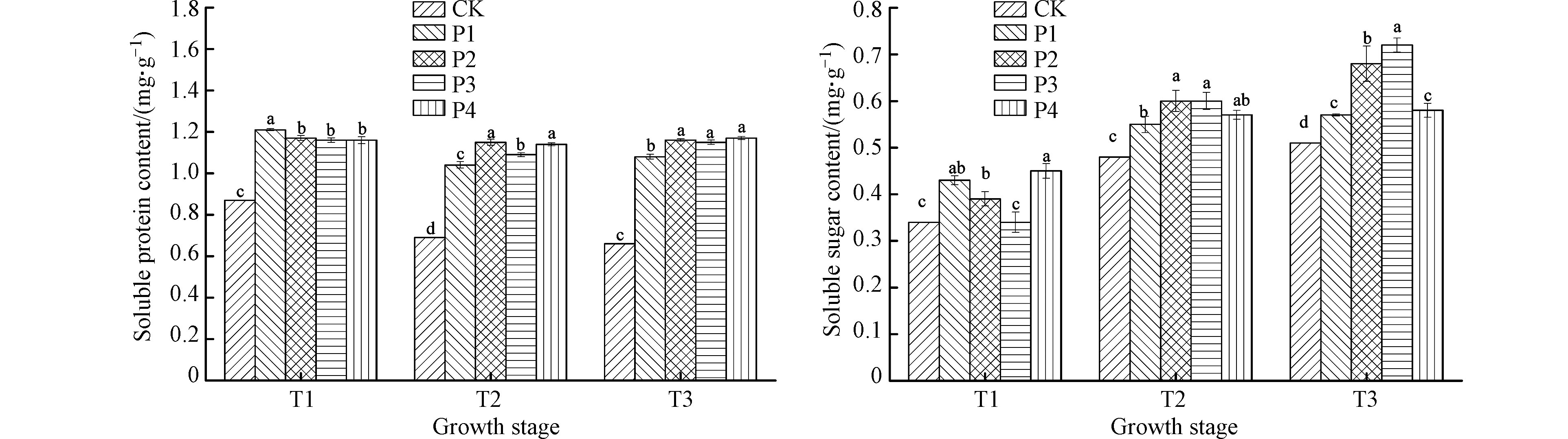
如图3所示,不同时期接种不同剂量的解磷菌对滇重楼叶片内可溶性蛋白和可溶性糖含量的调控效果不同,其中,T3期接种解磷菌的调控效果最好,T2期次之。与未接种植物相比,T3期滇重楼叶片内可溶性蛋白含量增长幅度为62.95%—76.58%,可溶性糖含量增长幅度为11.14%—41.63%。在一定的土壤肥力或施肥条件下,当解磷菌作为生物肥施用可以促进植物叶片内渗透调节物质含量的增加,加快了细胞代谢速度,有利于植物的生长。现已证实外源接种丛枝菌根真菌可以间接地促进植株光合产物的形成,在宿主的生理代谢上通过渗透调节来提高植物的抗逆性[21]。本试验结果也说明了这点,滇重楼幼苗接种解磷菌后,叶片内的可溶性蛋白和可溶性糖含量均有不同程度地增长,可见,外源接种解磷菌可培育具有较强生理活性和较好抗逆性的健壮幼苗。
-
由表2分析可知,不同时期接种不同剂量的解磷菌导致叶片内抗氧化酶活性(SOD、POD和CAT)不同程度地降低,其中,T1期CAT酶活性下降幅度为14.92%—51.96%、SOD酶活性下降为3.60%—78.78%、POD酶活性下降幅度为30.29%—60.71%,方差分析可知,除P3处理的滇重楼叶片内SOD酶活性与对照间差异不显著外,其余处理与对照之间差异均达显著水平。T2期CAT酶活性下降幅度为2.09%—41.63%、SOD酶活性下降为16.69%—63.62%、POD酶活性下降幅度为9.95%—31.28%,方差分析可知,除P4处理的滇重楼叶片内CAT酶活性与对照间差异不显著外,其余处理与对照之间差异均达显著水平。T3期CAT酶活性下降幅度为1.88%—29.16%、SOD酶活性下降为14.41%—84.86%、POD酶活性下降幅度为0.49%—50.49%,方差分析可知,除P2和P4处理的滇重楼叶片内CAT酶活性以及P4期的滇重楼叶片内POD酶活性与对照间差异不显著外,其余处理与对照之间差异均达显著水平。SOD和POD作为植物细胞内清除活性氧的主要抗氧化酶,其活性高低可以衡量植物在逆境条件下适应能力的强弱,植物体内保护酶活性降低有利于抑制细胞内活性氧的大量积累,减轻不利环境带来的氧化伤害,进而促进植株的生长发育[22-23]。
-
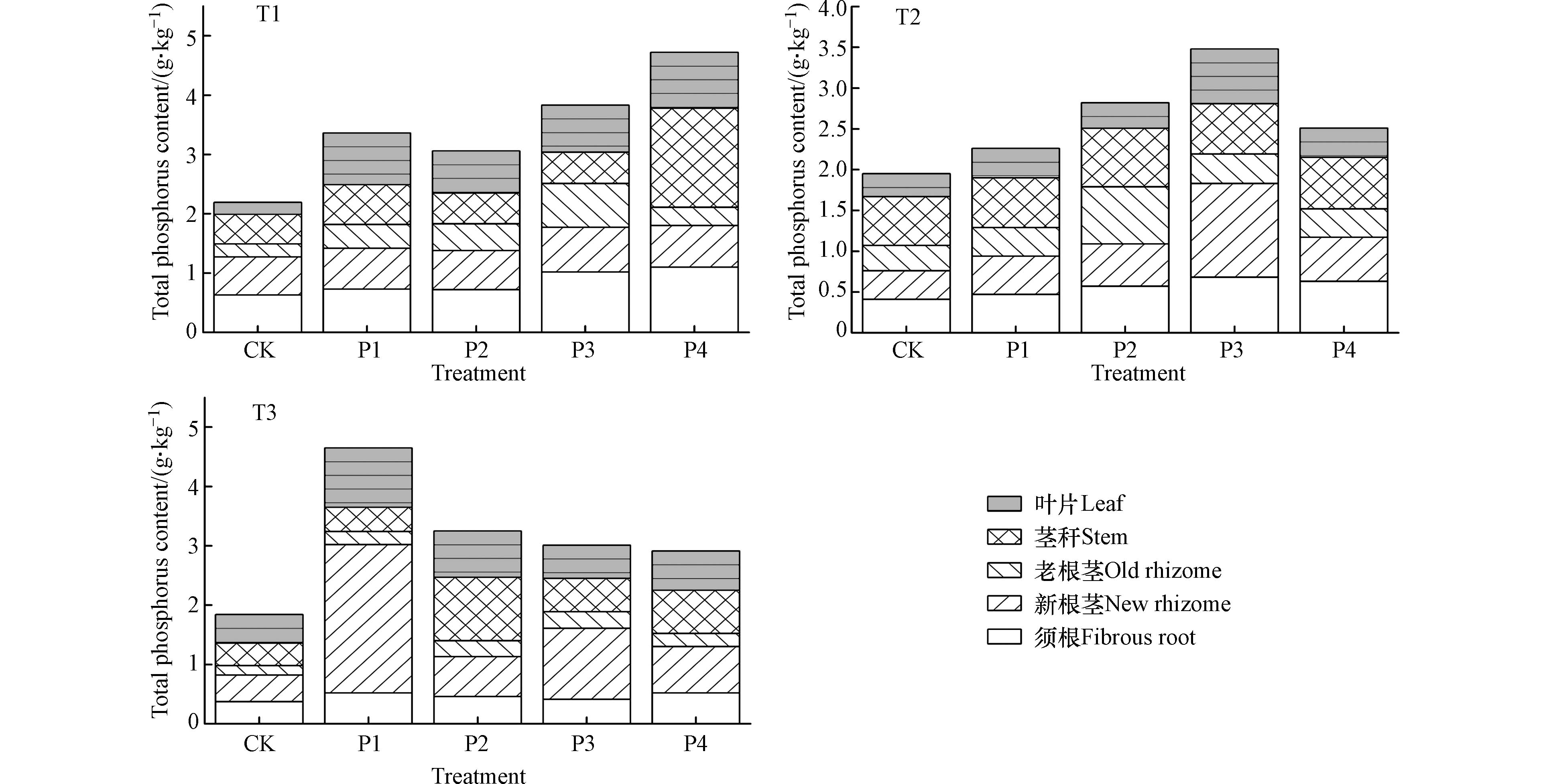
磷不仅是植物必需的大量营养元素之一,还是植物体内许多重要化合物的组分,能够参与植物体内的多种代谢过程,故植株中含磷量的高低对植物生长有十分重要的意义。从图4的结果来看,与未接种植株相比,各处理都显著地提高了滇重楼叶片、茎秆、老根茎、新根茎以及须根内的磷含量(P<0.05),其中,地下部分(老根茎+新根茎+须根)的磷增长幅度大于地上部分(叶片+茎秆),如T1期接种不同剂量的解磷菌可使滇重楼须根内的磷含量较未接种植物升高三倍之多。从接种时期来看,T1期接种解磷菌对滇重楼地下部分的磷含量调控效果好于T2期和T3期,而T3期接种解磷菌对滇重楼地上部分的全磷含量调控效果最好。总体而言,T1期接种施用35.00 g(P4)解磷菌的调控效果最佳。巨尾桉幼苗接种混合解磷菌对叶片内磷含量的调控效果好于单一解磷菌处理[24],因为不同菌株的分泌物不同,当不同菌株混合时的协同作用更有利于土壤中难溶性磷的降解,分泌的多种分泌物也更有利于菌株的繁殖生长[25];而高浓度解磷菌液中解磷菌的数量较多,对土壤中难溶性磷酸盐的转化效率较高,因而使植株体内的磷含量相对升高。
-
滇重楼根茎内的Ca和Zn 含量可能与重楼的止血、生肌、消炎作用有关,高含量的 Mg 能提高机体免疫力,促进抗毒素的合成,这说明重楼药材根茎内的矿质营养元素含量与多种药理活性有一定的关系。从表3可知,不同时期接种不同剂量的解磷菌对滇重楼新根系内K、Ca、Mg和Zn含量的调控效果好于老根茎,其中,T2期接种5.83 g解磷菌(P1)可使滇重楼新根茎内的上述营养元素较未接种植株依次增加17.71%、71.83%、200.89%和173.68%,T2期接种8.75 g解磷菌(P2)可使滇重楼新根茎内的上述营养元素较未接种植株依次增加6.17%、153.38%、9.45%和70.62%,T2期接种17.50 g解磷菌(P3)可使滇重楼新根茎内的上述营养元素较未接种植株依次增加87.61%、612.02%、470.87%和356.22%,T2期接种35.00 g解磷菌(P4)可使滇重楼新根茎内的上述营养元素较未接种植株依次增加44.37%、128.56%、332.26%和15.20%,方差分析可知,处理与对照间差异显著。
中药材内的重金属超标问题已成为中药国际化过程的重要障碍而广受国内外的普遍关注,使用重金属药材会直接影响患者临床用药的安全和疗效,土壤中的重金属经药用植物吸收后通过食物链进入体内,进而危害人体健康[1]。由表3分析可知,不同时期接种不同剂量解磷菌后,滇重楼新根茎和老根茎内的重金属Cu和Mn含量普遍低于对照,而Cb和Pb含量普遍高于对照,其中,滇重楼新根茎内Cb和Pb最大含量依次为0.79 mg·kg−1(T2-P3处理)和4.07 mg·kg−1(T2-P3处理),老根茎内Cb和Pb最大含量依次为0.13 mg·kg−1(T2-P3处理)和0.62 mg·kg−1(T3-P1处理),接种解磷菌虽导致新根茎和老根茎内Cb和Pb含量增加,但根据中国对外贸易绿色行业标准《药用植物及制剂进出口绿色行业标准》和2015年版《中国药典》限量标准规定,滇重楼药材限量标准为Cd≤0.3 mg·kg−1和Pb≤5.0 mg·kg−1[26],外源接种解磷菌虽导致新根茎和老根茎内Cb和Pb含量升高,但并未超过行业标准。外源接种解磷菌提高滇重楼药用价值的报道屡见不鲜[2,27],本研究研究结果与前人研究结果相似[1,2],滇重楼苗期接种解磷菌可以促进其根茎内有益营养元素的积累,降低重金属Cu和Mn含量,根茎内重金属元素含量均符合行业标准,可见,外源接种解磷菌有利于提高滇重楼根茎的药用价值。
-
(1)与未接种植株相比,滇重楼苗期接种解磷菌可提高根系活力,增加叶片内Chl、Car、可溶性蛋白和可溶性糖含量,降低叶片内保护酶(SOD、POD和CAT)活性以及MDA含量,可见,滇重楼苗期接种解磷菌可以不同程度地延缓叶片的衰老,维持细胞膜系统的稳定性,进而促进滇重楼植株的生长。其中,接种35.00 g(P4)解磷菌对滇重楼幼苗生长的促进效果最佳。
(2)与未接种植物相比,滇重楼苗期接种解磷菌可以使植株内的磷含量显著升高,并且植株地下部分的磷增长幅度大于地上部分,此外,接种解磷菌的植株新根茎和老根茎内的Ca、Mg和Zn含量呈增加趋势,而重金属 Cu和Mn含量普遍降低,这说明滇重楼苗期接种解磷菌可以促进其根茎内有益营养元素的积累,降低重金属元素含量,提高滇重楼根茎的药用价值。
不同剂量解磷菌对滇重楼生长发育的影响
Effect of different dosage of dissolving phosphorus bacteria on growth and development in Paris polyphylla var. yunnanensis
-
摘要: 为了明确解磷菌在滇重楼生产上最适剂量,本文通过盆栽接种试验研究了在灭菌土壤中,不同剂量解磷菌处理对滇重楼生长发育的影响,为解磷菌在滇重楼生产中的应用提供理论依据。结果表明,与未接种对照相比,滇重楼苗期接种解磷菌可提高根系活力,增加叶片内叶绿素、类胡萝卜素、可溶性蛋白和可溶性糖含量,降低叶片内保护酶(超氧化物歧化酶、过氧化物酶和过氧化氢酶)活性以及丙二醛含量;接种解磷菌可以显著地提高滇重楼各器官内的磷含量,尤其是地下部分(老根茎+新根茎+须根),还可以促进新根茎和老根茎内钙(Ca)、镁(Mg)和锌(Zn)含量的增加,普遍降低重金属铜(Cu)和锰(Mn) 含量。这说明不同时期接种解磷菌均可延缓滇重楼幼苗叶片的衰老,维持细胞膜系统的稳定性,促进滇重楼植株的生长,进而促进其根茎内有益元素的积累,降低重金属元素含量,提高滇重楼根茎的药用价值。其中,接种35.00 g(P4)解磷菌对滇重楼幼苗生长的促进效果最佳。Abstract: In order to clarify the optimum dosage of phosphate solubilizing bacteria and provide a theoretical basis for the application of phosphate solubilizing bacteria in the production of Paris polyphylla var. yunnanensis, this experiment studied the effect of different doses dissolving phosphorus bacteria on growth and development in sterilized soil through pot inoculation experiments. The result showed that, compared with the control group, root vigor, chlorophyll, carotenoids, soluble protein and soluble sugar contents were increased, and protective enzymes (superoxide dismutase, peroxidase and catalase) activities and malondialdehyde content were reduced by inoculation of phosphate-dissolving bacteria in Paris polyphylla var. yunnanensis leaves. Inoculation of phosphate solubilizing bacteria significantly increased the phosphorus content in the organs of Paris polyphylla var. yunnanensis, especially the underground part (old rhizome + new rhizome + fibrous root). Calcium (Ca), magnesium (Mg) and zinc (Zn) content in the new rhizomes and old rhizomes of the plants inoculated with phosphorus solubilizing bacteria were increased, while the heavy metals copper (Cu) and manganese (Mn) were generally decreased. It is said that the seedling stage of Paris polyphylla var. yunnanensis inoculation with phosphorus-dissolving bacteria can delay leaf senescence, maintain the stability of the cell membrane system, promote the growth and development, and then enhance the accumulation of beneficial nutrient elements in its rhizomes, reduce the content of heavy metals and improve the medicinal value. Among them, inoculation 35.00 g (P4) of dissolving phosphorus bacteria has the best effect on growth in Paris polyphylla var. yunnanensis seedlings.
-

-
表 1 不同剂量解磷菌对滇重楼叶光合色素含量的影响
Table 1. The effect of different dosages phosphate solubilizing bacteria on photosynthetic pigment content in P. polyphylla var. yunnanensis
处理方式
Treatments时间
Times叶绿素a含量/ (mg·g−1)
Chl a content叶绿素b含量/ (mg·g−1)
Chl b content总叶绿素含量/ (mg·g−1)
Total Chl content叶绿素 a/b
Chl a/b类胡萝卜素含量/ (mg·g−1)
Car contentCK T1 2.13 ± 0.01 b 0.54 ± 0.03 c 2.68 ± 0.01 c 3.92 ± 0.02 ab 197.53 ± 0.71 c T2 1.89 ± 0.03 d 0.50 ± 0.47 b 2.39 ± 0.08 e 3.77 ± 0.10 c 171.57 ± 2.39 c T3 1.51 ± 0.01 e 0.31 ± 0.02 e 1.83 ± 0.01 e 4.85 ± 0.01 a 141.92 ± 0.40 e P1 T1 2.18 ± 0.01 b 0.55 ± 0.02 c 2.73 ± 0.01 c 3.92 ± 0.01 ab 197.79 ± 0.41 c T2 2.88 ± 0.01 a 0.68 ± 0.04 a 3.56 ± 0.01 a 4.24 ± 0.01 a 248.76 ± 0.37 a T3 2.39 ± 0.01 b 0.54 ± 0.01 b 2.93 ± 0.01 b 4.45 ± 0.01 b 209.43 ± 0.18 b P2 T1 2.48 ± 0.01 a 0.70 ± 0.03 a 3.18 ± 0.01 a 3.52 ± 0.02 b 233.20 ± 0.57 a T2 1.94 ± 0.01 d 0.52 ± 0.02 b 2.45 ± 0.01d 3.74 ± 0.01 c 174.86 ± 0.34 c T3 2.73 ± 0.01 a 0.68 ± 0.05 a 3.41 ± 0.02 a 4.03 ± 0.03 c 250.36 ± 0.70 a P3 T1 2.15 ± 0.02 b 0.54± 0.09 c 2.69 ± 0.02 c 3.96 ± 0.04 ab 198.11 ± 0.93 c T2 2.04 ± 0.01 c 0.51 ± 0.02 b 2.54 ± 0.01 c 4.03 ± 0.01 b 184.89 ± 0.34 b T3 1.83 ± 0.01 c 0.39 ± 0.03 c 2.22 ± 0.01 c 4.70 ± 0.01 a 173.15 ± 0.40 c P4 T1 2.47 ± 0.01 a 0.62 ± 0.04 b 3.09 ± 0.01 b 4.01 ± 0.02 a 213.77 ± 0.36 b T2 2.73 ± 0.01 b 0.70 ± 0.03 a 3.43 ± 0.01 b 3.89 ± 0.02 c 247.33 ± 0.77 a T3 1.61 ± 0.01 d 0.34 ± 0.04 d 1.96 ± 0.02 d 4.69 ± 0.03 a 151.98 ± 0.70 d 注:每组同列不同的小写字母代表0.05水平上显著性差异;表2—表3同. Note:Different lowercase letters on the same column of each group represented significant difference at P<0.05; The same were applied in Table 2—Table 3. 表 2 不同剂量解磷菌对滇重楼叶片保护酶活性的影响
Table 2. The effect of different dosages phosphate solubilizing bacteria on protect enzyme activity in P. polyphylla var. yunnanensis
处理方式
Treatments时间
TimesSOD活性/ (U·g−1)
SOD activityPOD活性/ (U·g−1)
POD activityCAT活性/ (U·g−1)
CAT activityCK T1 187.94 ± 13.73 b 6000.33 ± 60.40 a 171.51 ± 20.55 ab T2 355.08 ± 19.84 b 3237.00 ± 37.54 b 59.92 ± 0.81 b T3 885.37 ± 4.75 a 3024.51 ± 13.06 b 134.59 ± 0.74 c P1 T1 69.77 ± 9.34 c 2357.82 ± 6.43 d 145.93 ± 2.66 bc T2 295.83 ± 40.92 a 2221.33 ± 35.03 e 53.39 ± 4.12 a T3 698.98 ± 22.33 b 2242.79 ± 9.34 c 125.80 ± 5.62 b P2 T1 147.93 ± 12.40 b 4183.06 ± 24.90 b 120.22 ± 2.72 cd T2 261.04 ± 30.54 c 2465.20 ± 19.53 d 52.54 ± 4.46 a T3 134.05 ± 14.04 c 1497.42 ± 3.28 e 136.06 ± 0.58 a P3 T1 181.17 ± 43.77 a 2730.84 ± 39.00 c 101.35 ± 3.69 d T2 129.18 ± 4.26 d 2617.12 ± 4.97 c 34.98 ± 1.74 c T3 735.35 ± 45.28 b 2060.42 ± 8.47 d 95.34 ± 0.61 d P4 T1 39.89 ± 3.77 c 2802.00 ± 17.52 c 82.40 ± 4.55 a T2 214.36 ± 28.23 cd 2915.05 ± 7.93 a 58.67 ± 2.78 b T3 757.84 ± 43.60 b 3009.70 ± 10.49 a 127.99 ± 3.47 ab 表 3 不同剂量解磷菌对滇重楼根茎内金属元素含量的影响(mg·kg−1)
Table 3. The effect of different dosages phosphate solubilizing bacteria on metallic element in P. polyphylla var. yunnanensis
处理方式
Treatments时间
Times部位 Location K Ca Mg Zn Cu Cd Pb Mn
CKT1 新根茎 4.57 b 46.85 a 5.65 d 0.93 a 0.98 a 0.03 a 0.17 b 0.21 a 老根茎 4.35 d 25.85 c 12.08 b 0.46 c 0.21 c 0.04 b 0.12 b 0.51 b T2 新根茎 3.46 d 17.58 d 4.53 d 0.36 d 0.57 c 0.09 b 0.15 c 0.24 c 老根茎 4.13 a 41.24 a 4.62 b 0.54 b 0.25 b 0.13 a 0.37 a 0.34 a T3 新根茎 3.58 d 28.02 c 1.92 c 1.97 a 0.81 a 0.08 b 0.04 c 0.11 b 老根茎 12.54 a 15.06 c 3.90 c 0.21 c 0.45 a 0.01 b 0.01 d 0.26 c P1 T1 新根茎 4.06 b 32.99 b 18.09 a 0.39 c 0.32 b 0.02 a 0.25 a 0.08 c 老根茎 5.65 c 38.75 b 5.32 c 0.39 d 0.09 d 0.04 b 0.07 c 0.33 c T2 新根茎 4.07 c 30.21 c 13.63 c 0.99 b 0.67 b 0.10 b 0.51 b 0.21 d 老根茎 3.99 b 0.00 c 1.57 c 1.50 a 0.37 a 0.09 b 0.09 c 0.27 b T3 新根茎 11.46 a 46.91 a 9.04 b 0.36 b 0.15 b 0.05 b 0.09 c 0.11 b 老根茎 3.61 d 44.64 a 10.77 a 0.36 b 0.26 d 0.10 a 0.62 a 0.32 b
P2T1 新根茎 12.35 a 24.56 d 7.42 c 0.30 d 0.16 c 0.02 a 0.17 b 0.12 b 老根茎 4.35 d 39.86 b 6.30 c 0.38 d 0.20 c 0.04 b 0.08 c 0.38 c T2 新根茎 3.67 d 44.54 b 4.96 d 0.61 c 0.46 d 0.10 b 0.50 b 0.33 b 老根茎 3.56 b 32.47 b 9.13 a 0.47 b 0.22 b 0.12 a 0.40 a 0.35 a T3 新根茎 4.17 c 0.00 d 7.21 bc 0.28 c 0.10 b 0.06 b 0.08 c 0.09 b 老根茎 4.59 c 33.59 b 4.96 c 0.42 a 0.29 c 0.10 a 0.53 b 0.42 a
P3T1 新根茎 4.73 b 28.25 c 5.48 d 0.62 b 0.37 b 0.03 a 0.26 a 0.14 b 老根茎 7.40 b 41.56 b 16.73 a 0.77 a 0.58 a 0.05 b 0.08 c 0.61 a T2 新根茎 6.49 a 125.17 a 25.86 a 1.64 a 0.97 a 0.79 a 4.07 a 0.68 a 老根茎 4.62 a 42.38 a 3.69 b 0.39 b 0.11 c 0.13 a 0.21 b 0.34 a T3 新根茎 3.63 d 32.31 b 8.39 b 0.41 b 0.19 b 0.07 b 0.43 b 0.13 b 老根茎 3.72 d 40.41 a 7.13 b 0.35 b 0.22 e 0.11 a 0.48 c 0.34 b P4 T1 新根茎 4.35 b 31.84 b 10.54 b 0.30 d 0.04 d 0.03 a 0.04 c 0.15 b 老根茎 15.07 a 51.84 a 6.11 c 0.62 b 0.37 b 0.06 a 0.19 a 0.45 bc T2 新根茎 4.99 b 40.18 b 19.58 b 0.41 d 0.38 e 0.00 b 0.00 c 0.16 d 老根茎 4.68 a 0.74 c 8.69 a 0.39 b 0.24 b 0.13 a 0.20 b 0.22 c T3 新根茎 5.68 b 0.00 d 46.24 a 1.69 a 0.60 a 0.70 a 2.53 a 0.56 a 老根茎 7.02 b 35.44 b 2.36 d 0.47 a 0.36 b 0.11 a 0.52 b 0.36 b -
[1] 杨敏, 张杰, 沈昱翔, 等. 滇重楼与丛枝菌根的共生对重金属元素吸收的影响 [J]. 环境化学, 2018, 37(4): 860-870. doi: 10.7524/j.issn.0254-6108.2017081405 YANF M, ZHANG J, SHEN Y X, et al. Effects of symbiosis of Paris polyphylla var. yunnanensis with arbuscular mycorrhizal fungi on absorption of heavy metals ( Cd, Hg, As, Cu, Pb) [J]. Environmental Chemistry, 2018, 37(4): 860-870(in Chinese). doi: 10.7524/j.issn.0254-6108.2017081405
[2] 张海珠, 李杨, 张彦如, 等. 菌根真菌处理下滇重楼对营养元素的吸收和积累 [J]. 环境化学, 2019, 38(3): 615-625. doi: 10.7524/j.issn.0254-6108.2018042804 ZHANG H Z, LI Y, ZHANG Y R, et al. Absorption and accumulation of mineral elements by Paris polyphylla var. yunnanensis with different arbuscular mycorrhizal fungi [J]. Environmental Chemistry, 2019, 38(3): 615-625(in Chinese). doi: 10.7524/j.issn.0254-6108.2018042804
[3] ABUBAKAR G A. Influence of Bacillus megateriumand pH on the solubility of Sokoto rock phosphate in soil[J]. Bayero Journal of Pure and Applied Sciences, 2016, 8(2). [4] HAMEEDA B, HARINI G, RUPELA O P, et al. Growth promotion of maize by phosphate-solubilizing bacteria isolated from composts and macrofauna [J]. Microbiological Research, 2008, 163(2): 234-242. doi: 10.1016/j.micres.2006.05.009 [5] RAJ J, BAGYARAJ D J, MANJUNATH A. Infouence of soil inoculation with vesicular-arbuscular mycorrhiza and a phosphate dissolving bacterium on plant growth and 32p-up take [J]. Soil Biology and Biochemistry, 1981, 13(1): 105-108. [6] KOBUS J. The distributi on of microorganisms mobilizing phosphorus in different soils [J]. Acta Microbiologia Plolonica, 1962, 11(7): 255-264. [7] BASHAN Y, KAMNEV A A, DE-BASHAN L E. Tricalcium phosphate is inappropriate as a universal selection factor for isolating and testing phosphate-solubilizing bacteria that enhance plant growth: a proposal for an alternative procedure [J]. Biology and Fertility of Soils, 2013, 49(4): 465-479. doi: 10.1007/s00374-012-0737-7 [8] BERENDSEN R L, CORNE M J P, BAKKER P A H M. The rhizosphere microbiome and plant health [J]. Trends in Plant Science, 2012, 17(8): 478-486. doi: 10.1016/j.tplants.2012.04.001 [9] YADAV B K, TARAFDAR J C. Penicillium purpurogenum, Unique P Mobilizers in Arid Agro-Ecosystems [J]. Arid Soil Research and Rehabilitation, 2011, 25(1): 87-99. [10] 张彦丽, 王伟鹏, 闫琰, 等. 施用接种解磷真菌的壮秧剂对水稻秧苗生长特性及磷素吸收的影响 [J]. 中国土壤与肥料, 2008, 1(1): 69-72. doi: 10.3969/j.issn.1673-6257.2008.01.019 ZHANG Y L, WANG W P, YAN D, et al. Using sturdy-seeding agent which inoculates fungi of dissolving phosphorus to the inlluence of rice seedling growth char acteristic and phosphorus absorption [J]. Chinese soil and fertilizer, 2008, 1(1): 69-72(in Chinese). doi: 10.3969/j.issn.1673-6257.2008.01.019
[11] 武志海, 刘晶晶, 杨美英, 等. 外源溶磷菌对不同土壤条件下大豆生长特性的影响 [J]. 大豆科学, 2017, 36(1): 78-86. WU Z H, LIU J J, YANG M Y, et al. Effects of Exogenous Phosphate-Solubilizing Bacteria on Growth Characteristics of Soybean Under Different Soil Condition [J]. Soybean Science, 2017, 36(1): 78-86(in Chinese).
[12] 白文娟, 胡蓉蓉, 章家恩, 等. 溶磷菌对玉米苗期生长和磷素吸收的影响 [J]. 生态科学, 2014, 33(3): 401-407. BAI W J, HU R R, ZHANG J E, et al. Effects of phosphate-solubilizing bacteria on growth and phosphorus uptake of corn seedling [J]. Ecological Science, 2014, 33(3): 401-407(in Chinese).
[13] LICHTENTHALER H K. Chlorophylls and carotenoids-pigments of photosynthetic biomembranes [J]. Methods in Enzymology, 1987(148): 350-382. [14] DHINDSA R S, PLUMB-DHINDSA P, THORPE T. Leaf senescence: correlated with increased levels of membrane permeability and lipid peroxidation, and decreased levels of superoxide dismutase and catalase [J]. Journal of Experimental Botany, 1981, 32: 93-101. doi: 10.1093/jxb/32.1.93 [15] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976, 72: 248-254. doi: 10.1016/0003-2697(76)90527-3 [16] GIANNOPOLITIS C N, RIES S K. Superoxide dismutases: I. Occurrence in higher plants [J]. Plant Physiology, 1977, 59: 309-314. doi: 10.1104/pp.59.2.309 [17] CHOUDHARY D K. Plant growth-promotion (PGP) activities and molecular characterization of rhizobacterial strains isolated from soybean (Glycine max L. Merril) plants against charcoal rot pathogen Macrophomina phaseolina [J]. Biotechnol Lett, 2011, 33: 2287-2295. doi: 10.1007/s10529-011-0699-0 [18] FU J, HUANG B. Involvement of antioxidants and lipid peroxidation in the adaptation of two cool-season grasses to localized drought stress [J]. Environmental and Experimental Botany, 2001, 45(2): 105-124. doi: 10.1016/S0098-8472(00)00084-8 [19] 刘彦明. 原子吸收光谱法测定中成药中微量元素 [J]. 光谱学与光谱分析, 2000, 20(3): 373-375. doi: 10.3321/j.issn:1000-0593.2000.03.038 LIU Y M. Determination of ten trace elements in chinese traditional medicines by atomic absorption spectrometry [J]. Spectroscopy and Spectral Analysis, 2000, 20(3): 373-375(in Chinese). doi: 10.3321/j.issn:1000-0593.2000.03.038
[20] 赵国杰, 牛世全, 达文燕, 等. 四株无机解磷菌处理碱化土壤的理化性质及质量评价 [J]. 土壤通报, 2014, 45(4): 157-163. ZHAO G J, NIU S Q, DA W Y, et al. Assessment of soil quality and physicochemical properties of the alkaline soil amended with four inorganic phosphate-dissolving microbial inoculants [J]. Chinese Journal of Soil Science, 2014, 45(4): 157-163(in Chinese).
[21] 韦正鑫, 郭冬琴, 李海峰, 等. AM真菌对滇重楼光合参数及生理指标的影响 [J]. 中国中药杂志, 2015, 40(20): 3945-3952. WEI Z X, GUO D Q, LI H F, et al. Photosynthetic parameters and physiological indexes of Paris polyphylla var. yunnanensis influenced by arbuscular mycorrhizal fungi [J]. China Journal of Chinese Materia Medica, 2015, 40(20): 3945-3952(in Chinese).
[22] 黄艳萍, 张杰, 杨敏, 等. 接种时期对丛枝菌根真菌侵染的滇重楼幼苗生长发育及甾体皂苷含量的影响 [J]. 中草药, 2019, 50(18): 4438-4448. doi: 10.7501/j.issn.0253-2670.2019.18.025 HUANG Y P, ZHANG J, YANG M, et al. Effects of different inoculation periods on seedling growth and steroidal saponin content of Paris polyphylla var. yunnanensis [J]. Chinese Traditional and Herbal Drugs, 2019, 50(18): 4438-4448(in Chinese). doi: 10.7501/j.issn.0253-2670.2019.18.025
[23] 程丽丽, 潘樱, 林艳, 等. 低氮胁迫对不同光皮桦基因型苗期生长及生理生化特征的影响 [J]. 核农学报, 2020, 34(11): 2435-2443. doi: 10.11869/j.issn.100-8551.2020.11.2435 CHENG L L, PANG Y, LIN Y, et al. Effect of low nitrogen stress on the growth, physiological and biochemical characteristics of different Betula luminifera genotypes [J]. Journal of Nuclear Agricultural Sciences, 2020, 34(11): 2435-2443(in Chinese). doi: 10.11869/j.issn.100-8551.2020.11.2435
[24] 林凤莲, 张亮, 林勇明, 等. 不同解磷菌处理下巨尾桉幼苗不同部位干质量及氮、磷、钾含量的变化 [J]. 植物资源与环境学报, 2016, 25(2): 23-32,116. doi: 10.3969/j.issn.1674-7895.2016.02.03 LIN F L, ZHANG L, LIN Y M, et al. Changes in dry weight and contents of nitrogen, phosphorus and potassium in different parts of Eucalyptus grandis × E. urophylla in different treatments of phosphate-solubilizing bacterium [J]. Journal of Plant Resources and Environment, 2016, 25(2): 23-32,116(in Chinese). doi: 10.3969/j.issn.1674-7895.2016.02.03
[25] 崔邢, 张亮, 林勇明, 等. 不同土壤条件下解磷菌处理对巨尾桉土壤有效磷含量的影响 [J]. 应用与环境生物学报, 2015, 21(4): 740-746. CUI X, ZHANG L, LIN Y M, et al. Effects of phosphate-solubilizing bacteria treatment under different soil conditions on Eucalyptus grandis × E. Urophylla soil available phosphorus content [J]. Chinese Journal of Applied Environment Biology, 2015, 21(4): 740-746(in Chinese).
[26] 齐耀东, 张志鹏, 张昭, 等. 关黄柏产区土壤重金属污染及药材安全性评价 [J]. 中国中药杂志, 2016, 41(3): 383-389. QI YD, ZHANG ZP, ZHANG S, et al. Evaluation for heavy metal pollution of soil and herb from main producing area of Phellodendron amurense in China [J]. China Journal of Chinese Materia Medica, 2016, 41(3): 383-389(in Chinese).
[27] 周浓, 张德全, 孙琴, 等. 真菌诱导子对滇重楼中次生代谢产物甾体皂苷的影响 [J]. 药学学报, 2012, 47(9): 1237-1242. ZHOU N, ZHANG D Q, SUN Q, et al. Effects of fungal elicitors on the secondary metabolite steroidal saponin in Paris polyphylla var. yunnanensis [J]. Acta Pharmaceutica Sinica, 2012, 47(9): 1237-1242(in Chinese).
-



 下载:
下载: