-
对于人类和动植物来说,硒(selenium,Se)是一种不可或缺的微量元素。它积极参与了生命活动中的化学反应,与动物体内的免疫机制相关,在抵抗癌症、二型糖尿病等方面有着重要的作用。但是,Se摄入过量又会导致重度腹水、贫血、呼吸困难、神经过敏等中毒现象,严重时会致人死亡[1-3]。因此,严格控制水体中Se的含量就显得十分重要。美国、加拿大等国家将饮用水中的Se控制在50 μg·L−1以下[4-5],而世界卫生组织(WHO)建议水体中Se的含量应当低于40 μg·L−1[6]。
Se进入水体的方式主要有两种:一是通过火山运动、煤炭燃烧、工业活动、动植物及微生物活动等方式,形成气态SeO2和有机硒,经氧化溶解作用形成Se(Ⅳ)(
$ {\rm{SeO}}_{\rm{3}}^{\rm{2}-} $ )和Se(Ⅵ)($ {\rm{SeO}}_{\rm{4}}^{\rm{2}-} $ ),伴随降水或降尘进入土壤、地表和地下水体[7-8];二是Se作为电解工业、材料制造业、医药产业和农业等行业中的重要元素,随着这些行业排放的工农业废水进入环境水体[8]。Se主要价态有-Ⅱ、0、Ⅳ和Ⅵ的4种。其中,Se(-Ⅱ)主要存在于各类硒矿物中,如Fe、Cu、Pb的硒矿物[9-10]。另外,有机硒中的Se,也以Se(-Ⅱ)存在[11]。Se(0)具有两种主要的形态,包括单质晶态Se和红色无定型Se[12]。Se(0)和Se(-Ⅱ)都难溶于水,毒性低,对环境影响较小。$ {\rm{SeO}}_{\rm{3}}^{\rm{2}-} $ 和$ {\rm{SeO}}_{\rm{4}}^{\rm{2}-} $ 这两种离子均具有溶解性好、迁移能力强、毒性高等特点,是水体中Se污染的主要存在形式[13-15]。水体中Se(Ⅳ)/(Ⅵ)去除方法主要有沉淀法[16]、吸附法[17]、反渗透膜过滤法[18]、离子交换法[19]、电化学法[20]、微生物法[21-22]等。上述方法均存在各自的优势与不足,例如沉淀法和吸附法操作简单,但得到的固体危废较难处理,容易产生二次污染;电化学法虽然去除效率高,但设备、工艺复杂,维护和运营成本高;反渗透膜过滤法和离子交换法的选择性好,但材料和运行成本也比较高;微生物法具有绿色安全、选择性好、符合自然去除过程的特点,但反应时间比较长。因此,开发简单高效、绿色环保的修复材料去除水中的Se是近年来的研究热点。
零价铁(zero valent iron, ZVI)是一种储量丰富、廉价易得、绿色安全、活性较高(Eθ(Fe/Fe2+)= −0.44 V)的环境修复材料[23],广泛应用于氯代有机物[24]、硝基苯类化合物[25]、染料[26]、类金属和重金属离子(包括Cr、U、Zn、Ni、As、Pb等)的去除[27-32]。20世纪80年代,Baldwin等[33]首次利用ZVI去除水中的Se,之后ZVI用于污染水体中Se的修复处理受到更多的关注。与微米ZVI相比,纳米零价铁( nano-zero valent iron, nZVI )比表面积更大、吸附能力更强、活性更强,去除水体中Se的效果更好[34-35]。本文总结了ZVI去除Se的反应机理,ZVI、nZVI还原Se的路径和效率,以及各种因素对ZVI去除Se的影响,并对ZVI去除Se的研究应用进行了展望。
-
ZVI对水体中Se的还原属于异相反应,当Se与ZVI表面接触时才会发生电子的转移。因此,ZVI去除Se的第一步,是硒酸盐在ZVI表面的吸附富集。Liang等[37]研究发现,在相同条件下,d50为7.4 μm和32.0 μm的ZVI可在60 min内将96%以上的Se(Ⅳ)去除,且d50=7.4 μm的ZVI的反应速率是d50=32.0 μm的ZVI的2倍。相比之下,d50为56.3 μm的ZVI在180 min内对Se(Ⅳ)基本没有去除。Andrew[38]发现,2 g细铁丝在66 h内仅仅去除了10%左右的Se(Ⅵ),而相同质量的零价铁粉和五羰基铁对Se(Ⅵ)的去除率分别达到了80%和100%。
产生上述Se去除效率显著差别的原因在于这些不同ZVI材料的比表面积存在显著差异。文献表明[39-40],d50 = 7.4 μm的ZVI比表面积约为0.3015 m2·g−1,相当于d50 = 108.2 μm的ZVI比表面积(0.01 m2·g−1)30倍左右。可见随着粒径的减小,材料的比表面积显著增加,材料对Se的吸附富集能力也随之提高,从而促进了ZVI对Se的还原去除。
-
ZVI还原Se的活性组分主要包括ZVI本身、吸附态Fe(Ⅱ)以及绿锈等活性矿物。ZVI作为主要电子供体,可将Se(Ⅵ)/(Ⅳ)还原为Se(0)和Se(-Ⅱ)[41-44]。在无氧和有氧反应体系中,ZVI对Se的还原作用机理有所不同。
-
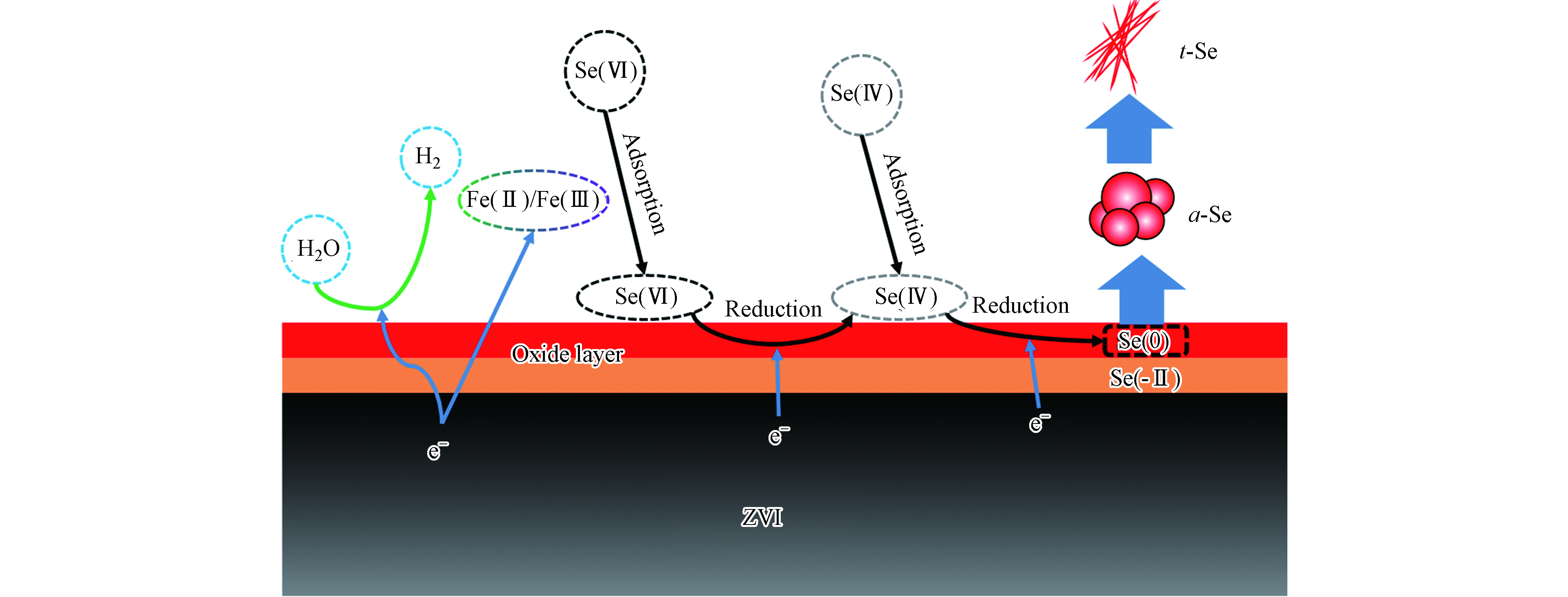
梁丽萍[45]等发现,ZVI主要通过以下3条途径将水体中的Se(Ⅳ)还原为Se(0)。1、ZVI直接将电子传递给表面吸附的Se(Ⅳ),从而将其还原为Se(0),这是无氧条件下Se(Ⅳ)还原的主要途径(方程1);2、ZVI通过无氧腐蚀产生吸附在ZVI表面的Fe(Ⅱ),也可以将Se(Ⅳ)还原为Se(0)(方程2);3、ZVI可以与水体中的H+产生H2,H2也能将水体中的Se(Ⅳ)还原为Se(0)(方程3-4)。此外,Xu等[46]发现,反应体系中Fe(Ⅱ)的浓度也会影响Se的还原产物价态以及ZVI表面的铁矿物形态。当Fe(Ⅱ)与ZVI之比大于1时,最终会形成磁铁矿和FeSe(方程5),当Fe(Ⅱ)与ZVI之比小于0.8时,最终会形成磁赤铁矿和Se(0)(方程6)。
无氧条件下,ZVI对Se(Ⅵ)的去除效率非常低。Yoon等[47]发现,ZVI对Se(Ⅵ)的去除率仅为10%。Qin等[39]发现,无氧条件下ZVI对Se(Ⅵ)的去除率接近于0。导致ZVI去除Se(Ⅵ)效率很低的原因主要来源于以下三方面 [43, 45, 47-48]:(1)ZVI还原Se(Ⅵ)(方程7)的反应活化能为89 kJ·mol−1,明显高于ZVI还原Se(Ⅳ)(方程1)的活化能(26.26 kJ·mol−1);(2)
$ {\rm{SeO}}_{\rm{3}}^{\rm{2}-} $ 相对于$ {\rm{SeO}}_{\rm{4}}^{\rm{2}-} $ 更容易被ZVI吸附,使得ZVI更容易将电子传给$ {\rm{SeO}}_{\rm{3}}^{\rm{2}-} $ ;(3)在无氧环境中,ZVI发生析氢腐蚀的速度比较慢,产生的Fe(Ⅱ)量比较少。与ZVI去除Se(Ⅳ)类似,吸附态的Fe(Ⅱ)同样也可以促进ZVI去除Se(Ⅵ)。Tang等[49]发现,Fe(Ⅱ)加入后,ZVI对Se(Ⅵ)的去除能力明显提升,反应10 h即可将Se(Ⅵ)完全去除。进一步研究表明,Se(Ⅵ)逐步被还原为Se(Ⅳ)、Se(0)和Se(-Ⅱ),详见方程8-10所示。反应至10 h时,还原产物Se(Ⅳ)占总Se的比例为41%。进一步反应至24 h时,Se(Ⅳ)的占比降至27%,Se(0)的含量则上升至68%,硒化物占比11%。反应过程中,ZVI逐渐形成磁铁矿,磁铁矿是一种良好的电子传递介质,也有利于ZVI核向表面吸附污染物的电子传递。
-
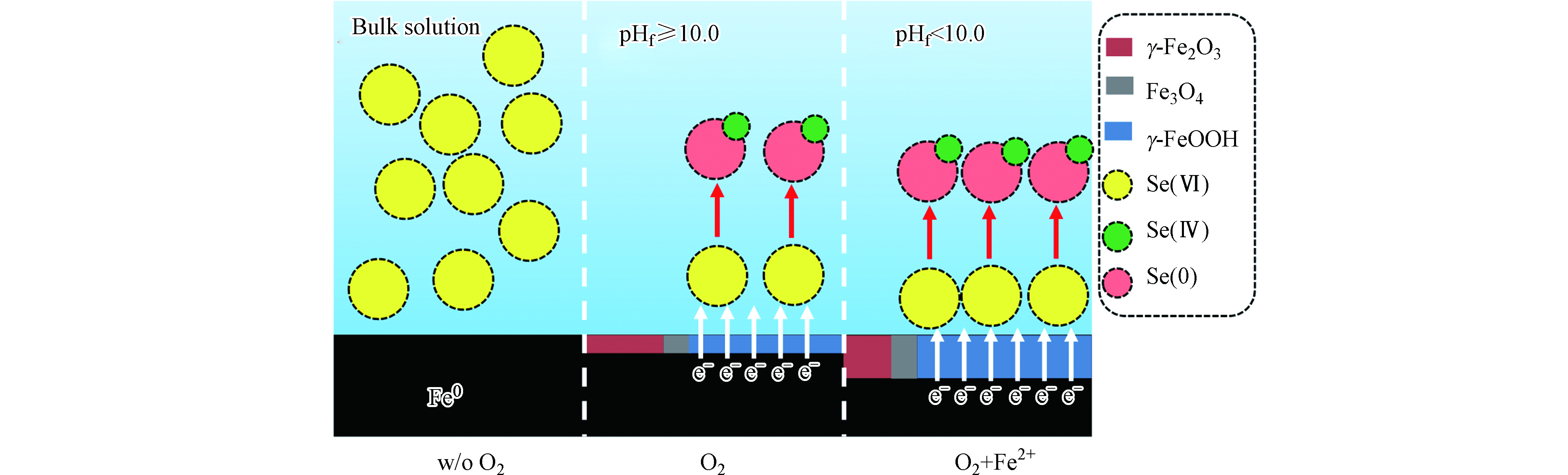
Yoon等[47]发现,有氧条件下,ZVI对Se(Ⅵ)的去除率为92.6%;Qin等[39]发现,在通入N2∶O2=1∶1的混合气体的条件下,ZVI对Se(Ⅵ)的去除率几近100%。Liang等[37]也发现了有氧条件下ZVI完全去除Se(Ⅳ)的时间为7 min,比无氧条件下10 min的去除时间更短。由此可见,有氧条件下ZVI对Se的去除活性明显增强。
产生这种现象的原因主要为:在溶解氧的作用下,ZVI吸氧腐蚀明显加快,表面被氧化形成纤铁矿、磁赤铁矿等多种铁矿物,纤铁矿可进一步转化为磁铁矿,反应如方程11-15所示。覆盖在ZVI表面的磁铁矿大大加速了ZVI向表面吸附Se(Ⅵ)的电子转移,从而提升了ZVI对Se(Ⅵ)的还原效率[50]。此外,ZVI的吸氧腐蚀会产生大量Fe(Ⅱ),使得有氧体系中吸附态的Fe(Ⅱ)浓度明显高于无氧体系,从而进一步促进了Se(Ⅵ)的还原去除。
除磁铁矿外,纤铁矿是另一种影响Se(Ⅵ)的还原去除的重要矿物。Qin等[39]发现,当体系中通入的O2含量不变时,Fe(Ⅱ)浓度的提高使ZVI表面的纤铁矿含量明显提高,Se(Ⅵ)的去除率也发生了明显的上升。这是因为纤铁矿虽然不能起到传递电子的作用,也不直接参与化学反应,但它能够将水体中的Se(Ⅵ)快速富集至ZVI表面,从而促进ZVI核对Se(Ⅵ)的还原去除。上述过程的反应机理如图2所示。
绿锈(green rust, GR)被认为是ZVI去除污染物过程中产生的活性矿物,它也可以将Se(Ⅳ)/(Ⅳ)还原为Se(0)[51-53]。Klas等[54]发现,在有氧条件下,ZVI的腐蚀产物与
$ {\rm{SeO}}_{\rm{4}}^{\rm{2}-} $ 能形成GR($ {\rm{SeO}}_{\rm{4}}^{\rm{2}-} $ )(方程16),GR可将$ {\rm{SeO}}_{\rm{4}}^{\rm{2}-} $ 还原为Se(0),同时GR转变为磁铁矿(方程17)。该反应过程可用方程18表示。Li等[55]发现,在ZVI去除Se(Ⅳ)的体系中引入H2O2、KMnO4、NaClO等氧化剂也能够使ZVI表面产生多种铁矿物,从而达到快速去除Se(Ⅳ)的目的。不同的氧化剂会使ZVI表面的次生矿物组成发生改变,但几乎都由磁铁矿、纤铁矿、GR和针铁矿组成。而在Se的价态方面,Se(0)和Se(-Ⅱ)是主要的产物,Se(0)的占比在36.2%—59.8%,Se(-Ⅱ)的占比可达到30.8%—63.8%,而Se(Ⅳ)和Se(Ⅵ)的占比分别在0—10.5%和0—2.8%。这说明采用合适的氧化剂,也可以起到促进ZVI表面腐蚀的作用,加快ZVI对Se的去除。
-
通过对ZVI去除水体中Se的机理研究,发现了这一过程极大的受限于ZVI的比表面积。比表面积大的ZVI能吸附更多的Se,其反应速率更快,而比表面积小的ZVI反应速率低,甚至难以去除水体中的Se。因此,制备粒径更小、比表面积更大的nZVI,是提高Se去除效率的有效方法。
-
Olegario等[56]采用硼氢化钠还原法制备得到nZVI,通过对比nZVI和100目ZVI对Se(Ⅵ)的去除效果,发现nZVI可在80 min内去除90%以上的Se(Ⅵ),而100目的ZVI在同等条件下只能去除50%的Se(Ⅵ),说明nZVI具有更高的去除效果。通过比较这两种材料对Se的吸附性能,发现nZVI 对Se(Ⅵ)的最大吸附量可达到1.75 mmol·g−1,远高于ZVI 对Se(Ⅵ)的最大吸附量(0.3 mmol·g−1)。除此之外,nZVI和ZVI去除Se(Ⅵ)的还原产物也有显著差别。nZVI还原Se(Ⅵ)的最终产物为Se(0)(26%)和Se(-Ⅱ)(74%),而ZVI将Se(Ⅵ)主要还原为Se(0)。通过XRD等分析,反应后nZVI表面的次生矿物组成与ZVI相似。
Xia等[57]研究发现,在无氧条件下,pH0=7时,1.5 g·L−1的nZVI可在1 min以内将120 mg·L−1的Se(Ⅳ)去除99.6%以上,说明nZVI对Se(Ⅳ)的去除更为迅速。Se(Ⅳ)在nZVI的作用下,首先形成球状的ɑ-Se(0)胶体,随后ɑ-Se(0)自发转化为t-Se(0)针状纳米晶体,最后少量Se(0)进一步被还原为Se (-Ⅱ)。
与ZVI相比,nZVI可以更高效地去除水中的Se,并且可以将Se(Ⅵ)/(Ⅳ)还原为Se(-Ⅱ),充分体现了nZVI的高活性[56-58]。但是,nZVI也存在以下不足[59-60]:(1)nZVI的表面能很大,且其本身具有磁性,导致nZVI 的团聚和活性下降;(2)nZVI的迁移性能强,对生物具有较高的潜在毒性;(3)nZVI活性很高,导致其在储存、运输过程中有一定的危险。
-
为解决nZVI易团聚、易迁移的问题,研究者们将nZVI负载于无机粘土、生物炭等载体上[61-63],制备得到的负载型nZVI分散性好、活性更高,迁移能力和毒性也明显降低。此外,载体材料具有较强的吸附、稳定pH、传递电子等特性,进一步增强了nZVI对水体中Se的去除。
Li等[64]通过Al(Ⅲ)离子交换将钠基膨润土改性得到铝基膨润土(Al-bent),将其作为载体负载纳米零价铁(Al-bent/nZVI)。pH0=6时,Al-bent/nZVI对Se(Ⅵ)的去除率高达95.7%以上,远高于相同条件下nZVI对Se(Ⅵ)的去除率(62.1%)。这主要是由于Al-bent/nZVI具有以下几个方面的优势:(1)Al-bent表面带正电,通过静电吸附可将
$ {\rm{SeO}}_{4}^{2-} $ 富集到载体表面;(2)Al-bent可以稳定反应体系pH,反应过程中nZVI体系的pH从6迅速上升到8.9,而Al-bent/nZVI体系的pH稳定在7.9左右;(3)反应产生的Fe(Ⅱ)可以吸附在Al-bent表面,吸附态Fe(Ⅱ)比游离Fe(Ⅱ)具有更强的还原活性,是Al-bent/nZVI去除Se(Ⅵ)的重要活性组分。魏雪等[65]制备了一种生物炭负载纳米零价铁(BC/nZVI),快速去除水体中的硒酸盐。在无氧环境、pH0=6.8时,1 g·L−1 BC/nZVI在5 h内将10 mg·L−1的Se(Ⅳ)完全去除,3 g·L−1 BC/nZVI在5 h内可以去除70%的Se(Ⅵ)(10 mg·L−1)。究其原因,主要是生物炭对Se(Ⅳ)较高的吸附性能,以及生物炭对反应体系pH的稳定作用。当反应体系初始pH升高时,生物炭表面呈更多的负电荷,导致BC/nZVI与硒酸盐相互排斥,不利于BC/nZVI对Se的去除。
Qiu等[66]设计了一种动态MnO2纳米线膜负载纳米零价铁(NM/nZVI)。作为载体的MnO2纳米线膜具有高柔性,使得NM/nZVI在微观层面上形成了一种三维立体网状结构,nZVI均匀分布在MnO2纳米线的表面,该结构拥有足够的孔隙让溶液通过,因此有利于流动溶液中Se(Ⅳ)的去除。MnO2载体本身不与强酸强碱反应,使得NM/nZVI的回收和再生比较方便。
-
在ZVI去除Se的实际应用中,实际环境体系远比实验体系复杂,体系中的无机盐离子、缓冲盐、反应pH等对ZVI的活性也会产生影响。因此,研究各种实际因素对ZVI去除水中Se的影响显得非常必要。
-
工业废水和生活废水中存在的杂质可能会形成缓冲溶液,从而影响ZVI去除Se的反应活性。Qin等[67]研究了常用缓冲溶液:吗啉乙磺酸(MES)、4-羟乙基哌啶乙磺酸(HEPES)、醋酸盐缓冲液(HAc/NaAc)对ZVI去除Se的影响。研究表明,缓冲盐对ZVI去除Se的过程影响明显。首先是迟滞时间的延长,相较于无缓冲体系的5.2—22.4 min的迟滞时间,缓冲体系的迟滞时间有1.5—180 min。其次,除pH0=4.0时,缓冲体系中ZVI对Se的反应速率kobs(101.4×10−3 min−1)大于无缓冲体系(46.4×10−3 min−1)外,其他各种初始pH下缓冲体系的反应速率均低于无缓冲体系。其中,去除Se(Ⅵ)的kobs从2.8×10−3—9.1×10−3 min−1下降到0.0—1.7×10−3 min−1,去除Se(Ⅳ)的kobs从12.0×10−3—31.3×10−3 min−1下降到1.0×10−3—20.2×10−3 min−1。其原因主要是:缓冲盐与Se在ZVI表面存在竞争吸附,更多的缓冲盐吸附在ZVI表面,阻碍了ZVI向Se的电子转移,改变了ZVI表面正常的腐蚀行为,从而降低了ZVI对Se的去除能力。
-
Liang等[40, 68]研究表明,弱磁场促进了ZVI对水体中Se的去除。弱磁场存在下,ZVI在120 min可以去除96.3%的Se(Ⅵ)。相比之下,无弱磁场条件下,Se(Ⅵ)在72 h内仅被去除4%。弱磁场也加快了ZVI对Se(Ⅳ)的去除,反应时间从60 min缩短到40 min。弱磁场促进Se去除的主要原因是:ZVI在弱磁场中产生感应磁场,在外加磁场和感应磁场的共同作用下,引起水溶液的对流。这一过程加强了ZVI表面离子的传质能力,迫使Fe(Ⅱ)难以停留在在ZVI表面,减少钝化层的产生和积累,使H+能够迅速传质到ZVI表面,促进ZVI的腐蚀。此外,ZVI形成的感应磁场高度不均匀,在磁场梯度力的作用下,Fe(Ⅱ)在ZVI表面的分布也非常不均匀,有助于形成较强的局部腐蚀,促进了ZVI对Se的去除。
-
无机盐离子对ZVI去除Se的情况较为复杂,常见的一些无机盐离子的影响如表1所示。
$ {\rm{SO}}_{\rm{4}}^{\rm{2}-} $ 、$ {\rm{PO}}_{\rm{4}}^{\rm{3}-} $ 、$ {\rm{HCO}}_{\rm{3}}^{-} $ 和$ {\rm{NO}}_{\rm{3}}^{-} $ 对ZVI去除Se具有明显的抑制作用,其影响机制各不相同。S与Se同族,$ {\rm{SO}}_{4}^{2-} $ 和$ {\rm{SeO}}_{4}^{2-} $ 除性质相似外,结构也具有一定的相似性,$ {\rm{SO}}_{\rm{4}}^{\rm{2}-} $ 与$ {\rm{SeO}}_{\rm{4}}^{\rm{2}-} $ 竞争ZVI表面的吸附位点,从而抑制ZVI对Se(Ⅵ)的去除。$ {\rm{PO}}_{\rm{4}}^{\rm{3}-} $ 一方面可以与反应中产生的Fe(Ⅱ)产生沉淀,阻止Fe(Ⅱ)进一步参与反应,另一方面$ {\rm{PO}}_{\rm{4}}^{\rm{3}-} $ 也能占据ZVI表面的吸附位点,从而抑制Se(Ⅵ)的去除。$ {\rm{HCO}}_{\rm{3}}^{-} $ 的抑制则主要是由于与Fe(Ⅱ)生成无活性的FeCO3沉淀,覆盖在ZVI表面,阻止反应进一步进行。$ {\rm{NO}}_{\rm{3}}^{-} $ 易被ZVI还原生成$ {\rm{NH}}_{\rm{4}}^{\rm{+}} $ (方程19),与ZVI还原Se(Ⅵ)的过程产生竞争,从而抑制了ZVI对Se的去除。Mg2+、
$ {\rm{HSO}}_{\rm{3}}^{-} $ 、Mn2+、Co2+能够促进ZVI对Se的去除,它们的增强机制也各不相同。Mg2+的存在可以提高ZVI对Se(Ⅵ)的电子选择性(ES),相比于没有共存离子的体系,ES上升了50.3%。Mn2+、Co2+能与ZVI反应,形成Mn/Fe、Co/Fe的双金属体系,增强ZVI对Se的去除。$ {\rm{HSO}}_{\rm{3}}^{-} $ 的促进作用具有多种原因。首先,$ {\rm{HSO}}_{\rm{3}}^{-} $ 可将反应过程中产生的Fe(Ⅲ)还原为Fe(Ⅱ)(方程20),减少了Fe(Ⅲ)和Fe(Ⅲ)(氢)氧化物的累积。其次,$ {\rm{HSO}}_{\rm{3}}^{-} $ 在被氧化的过程中持续地释放氢离子,稳定反应体系的pH,维持ZVI的反应活性(方程20—21)。此外,还原形成的Fe(Ⅱ)吸附在氧化层表面,可以进一步去除溶液中的Se(Ⅳ)(方程22—23)。除此之外,$ {\rm{Cl}}^{-} $ 、$ {\rm{SiO}}_{\rm{3}}^{\rm{2}-} $ 、Ca2+对ZVI去除Se影响较少。 -
通常认为,较低的pH有利于ZVI的腐蚀,从而促进污染物的去除。但Qiao等[70]研究发现,较低的pH也不利于ZVI对Se的去除。在空气中,pH0=5.0,且反应过程中pH保持不变,ZVI可将61.5%的Se(Ⅵ)去除。pH升高或降低,ZVI对Se(Ⅵ)的去除率均会降到40%以下。pH较高时,ZVI表面会形成不利于电子传导的钝化膜;并且ZVI在去除Se的过程中消耗大量H+(方程1、方程7、方程22、方程24),而较高pH溶液难以提供足量的H+。较低pH时,H+与ZVI的反应剧烈(方程3),与Se(Ⅵ)争夺ZVI表面的活性位点,不利于ZVI对Se(Ⅵ)的去除。
-
ZVI能够有效去除水中的
$ {\rm{SeO}}_{\rm{3}}^{\rm{2}-} $ 和$ {\rm{SeO}}_{\rm{4}}^{\rm{2}-} $ ,并将其还原为低毒性的Se(0)或Se(-Ⅱ),具有很好的应用前景。但是,目前的研究大多局限于实验室单一体系。环境中的各种因素,包括无机盐离子、缓冲溶液以及pH波动易对ZVI去除Se的活性产生影响,从而降低了ZVI在实际环境中的应用效果。将来如果要将ZVI应用于实际含Se废水的修复处理,还需进一步加强理论基础研究和工艺优化,例如以下一些问题的研究:(1)实际废水中同时存在Se(Ⅳ)和Se(Ⅵ),ZVI对Se(Ⅳ)的去除能力很强,但对Se(Ⅵ)的反应活性较低,除制成nZVI外,其他提高ZVI去除Se(Ⅵ)的方法和材料还需进一步开发。
(2)目前虽对环境中一些共存离子的影响有了初步的研究,但对实际环境体系中各种因素的综合影响认识还不足,ZVI在实际体系中的腐蚀行为、微观结构变化及对其活性的影响还需进一步研究,如何提高ZVI在实际应用过程中的电子选择性、稳定性还需进一步研究优化。
(3)ZVI和其他材料相结合去除Se的相关研究较少,例如ZVI与微生物、含铁矿物等材料联合修复含Se废水,各种材料之间可能会产生很好的协同作用,有望提高ZVI的使用效率,减少ZVI的使用量,从而减少实际修复中铁泥的产生量,降低处理成本。
零价铁去除水中硒的研究进展
Research progress of removal selenium from aqueous solution by zero-valent iron
-
摘要: 硒(Se)在水中主要以
$ {\rm{SeO}}_{\rm{3}}^{\rm{2}-} $ 和$ {\rm{SeO}}_{\rm{4}}^{\rm{2}-} $ 离子形式存在,具有溶解度高、迁移能力强、毒性高等特点,过量摄入会对生命健康造成严重危害。零价铁(ZVI)是一种绿色、安全、高效且廉价的环境修复材料,通过表面氧化层的吸附作用,以及ZVI、吸附态Fe(Ⅱ)以及绿锈等活性次生矿物的还原作用,将Se(Ⅳ)和Se(Ⅵ)主要还原为低毒性、低溶解度的Se(0),从而去除水中高毒性的$ {\rm{SeO}}_{\rm{3}}^{\rm{2}-} $ 和$ {\rm{SeO}}_{\rm{4}}^{\rm{2}-} $ 。纳米零价铁(nZVI)比表面积大、活性更高,去除Se的速率更快、效率更高,可以将$ {\rm{SeO}}_{\rm{3}}^{\rm{2}-} $ 和$ {\rm{SeO}}_{\rm{4}}^{\rm{2}-} $ 更多地还原为Se(-Ⅱ)。利用无机粘土、生物炭等材料负载nZVI,不仅可以解决nZVI易团聚、易迁移、潜在毒性风险高等问题,还可以通过载体材料的吸附、pH稳定、电子传递等作用,进一步增强nZVI对水体中Se的去除效果。实际环境中的缓冲离子、无机离子以及pH、弱磁场等各种因素易对ZVI去除Se的活性产生影响,这些都将影响ZVI在处理实际含Se废水中的应用效果。因此,未来通过研究阐明环境各种因素对ZVI去除Se的影响机理,对ZVI去除工艺进一步优化,有望解决ZVI处理实际含Se废水的瓶颈问题。Abstract: Selenium (Se) exists in aqueous environment as two oxyanion species:$ {\rm{SeO}}_{\rm{3}}^{\rm{2}-} $ and$ {\rm{SeO}}_{\rm{4}}^{\rm{2}-} $ , which have the characteristics of good mobility, high solubility and strong toxicity. The excessive intake of Se will do serious harm to the life health of human. Zero valent iron (ZVI) is a green, safe, efficient and low-cost environment remediation material. Se(Ⅳ) and Se(Ⅵ) can be adsorbed onto the surface oxidation layer of ZVI firstly, then the sorbed Fe(Ⅱ), green rust and ZVI itself reduce them into Se(0) with low toxicity and low solubility. Nano-zero valent iron (nZVI) has the advantages of larger specific surface area and higher reactivity, to remove Se faster and with higher efficiency than micron-sized ZVI, and it can reduce Se(Ⅳ) and Se(Ⅵ) further to Se(-Ⅱ). Clay and biochar are used to support nZVI to solve its problems of easy aggregation, easy mobility and potentially toxic risk. Through the effects of clay and biochar including adsorption, pH buffering, electron mediation, the removal of Se will be enhanced by supporting nZVI on these carriers. The buffer ions, inorganic ions in natural aqueous environment, pH and low-intensity magnetic field are summarized to show different effects on the reactivity of ZVI towards Se, and further influence the practical effect of ZVI in the remediation to real Se-bearing wastewater. Therefore, if future studies are focused to understand the effect mechanism of each factor in environment on the removal of Se by ZVI, to further optimize the removal technology by ZVI, the bottleneck problems in the remediation on the real Se-bearing wastewater by ZVI will be resolved.-
Key words:
- zero-valent iron /
- selenium /
- adsorption /
- reduction /
- coexisting ions /
- environment remediation
-

-
表 1 常见无机盐离子对ZVI去除Se的影响
Table 1. The influence of common inorganic ions on the removal of Se by ZVI.
-
[1] RAYMAN M P. Selenium and human health [J]. The Lancet, 2012, 379(9822): 1256-1268. doi: 10.1016/S0140-6736(11)61452-9 [2] RAYMAN M P. Food-chain selenium and human health: Emphasis on intake [J]. British Journal of Nutrition, 2008, 100(2): 254-268. doi: 10.1017/S0007114508939830 [3] GUILLIN O M, VINDRY C, OHLMANN T, et al. Selenium, selenoproteins and viral infection [J]. Nutrients, 2019, 11(9): 1-33. [4] HEALTH CANADA. Guidelines for Canadian drinking water quality Summary Table [M]. Ottawa: Water and Air Quality Bureau. 2014: 7. [5] Office of Water. 2018 edition of the drinking water stamdards and health adbisories [M]. Washington DC: United States Environmental Protection Agency (U. S. EPA). 2018: 9. [6] WHO. Selenium in drinking-water, background document for development of WHO guidelines for drinking-water quality [M]. Geneva: WHO. 2011: 9. [7] 李家熙, 张光弟, 葛晓立, 等. 人体硒缺乏与过剩的地球化学环境特征及其预测[M]. 北京: 地质出版社, 2000: 2-10. LI J X, ZHANG G D, GE X L, et al. Prediction and geochemical environmental character of human selenium imbalances [M]. Beijing, Geology Press, 2000: 2-10 (in Chinese).
[8] WINKEL L H, JOHNSON C A, LENZ M, et al. Environmental selenium research: From microscopic processes to global understanding [J]. Environmental Science & Technology, 2012, 46(2): 571-579. [9] SIMON G, KESLER S E, ESSENE E. Phase relations among selenides, sulfides, tellurides, and oxides: II. Applications to selenide-bearing ore deposit [J]. Economic Geology, 1997, 92(4): 468-484. doi: 10.2113/gsecongeo.92.4.468 [10] 樊海峰, 温汉捷, 凌宏文, 等. 表生环境中硒形态研究现状 [J]. 地球与环境, 2006, 34(2): 19-26. FAN H F, WEN H J, LING H W, et al. Research status of selenium morphology in superorganism environmen [J]. Earth and Environment, 2006, 34(2): 19-26(in Chinese).
[11] ZHANG Y, MOORE J N, FRANKENBERGER W T. Speciation of soluble selenium in agricultural drainage waters and aqueous soil-sediment extracts using hydride generation atomic absorption spectrometry [J]. Environmental Science & Technology, 1999, 33: 1652-1656. [12] GAO X, LI X, MU J, et al. Preparation, physicochemical characterization, and anti-proliferation of selenium nanoparticles stabilized by polyporus umbellatus polysaccharide [J]. International Journal of Biological Macromolecules, 2020, 152: 605-615. doi: 10.1016/j.ijbiomac.2020.02.199 [13] CHAKRABORTY S, BARDELLI F, CHARLET L. Reactivities of Fe(Ⅱ) on calcite selenium reduction [J]. Environmental Science & Technology, 2010, 44(4): 1288-1294. [14] HAN D S, BATCHELOR B, ABDEL-WAHAB A. Sorption of selenium(Ⅳ) and selenium(Ⅵ) to mackinawite (FeS): Effect of contact time, extent of removal, sorption envelopes [J]. Journal of Hazardous Materials, 2011, 186(1): 451-457. doi: 10.1016/j.jhazmat.2010.11.017 [15] LIANG L, YANG W, GUAN X, et al. Kinetics and mechanisms of pH-dependent selenite removal by zero valent iron [J]. Water research, 2013, 47(15): 5846-5855. doi: 10.1016/j.watres.2013.07.011 [16] KALAITZIDOU K, BAKOUROS L, MITRAKAS M. Techno-economic evaluation of iron and aluminum coagulants on Se(Ⅳ) removal [J]. Water, 2020, 12(3): 1-10. [17] HAN D S, BATCHELOR B, ABDEL-WAHAB A. Sorption of selenium(Ⅳ) and selenium(Ⅵ) onto synthetic pyrite (FeS2): Spectroscopic and microscopic analyses [J]. Journal of Colloid and Interface Science, 2012, 368(1): 496-504. doi: 10.1016/j.jcis.2011.10.065 [18] LIN L, XU X, PAPELIS C, et al. Sorption of metals and metalloids from reverse osmosis concentrate on drinking water treatment solids [J]. Separation and Purification Technology, 2014, 134: 37-45. doi: 10.1016/j.seppur.2014.07.008 [19] SHARMA S, DESAI A V, JOARDER B, et al. A water-stable ionic MOF for the selective capture of toxic oxoanions of Se(Ⅵ) and As(Ⅴ) and crystallographic insight into the ion-exchange mechanism [J]. Angewandte Chemie International Edtion. in English, 2020, 59(20): 7788-7792. doi: 10.1002/anie.202000670 [20] BAEK K, KASEM N, CIBLAK A, et al. Electrochemical removal of selenate from aqueous solutions [J]. Chemical Engineering Journal, 2013, 215-216: 678-684. doi: 10.1016/j.cej.2012.09.135 [21] LI D B, CHENG Y Y, WU C, et al. Selenite reduction by Shewanella oneidensis MR-1 is mediated by fumarate reductase in periplasm [J]. Scientific Reports, 2014, 4: 1-7. [22] LEE M R F, FLEMING H R, COGAN T, et al. Assessing the ability of silage lactic acid bacteria to incorporate and transform inorganic selenium within laboratory scale silos [J]. Animal Feed Science and Technology, 2019, 253: 125-134. doi: 10.1016/j.anifeedsci.2019.05.011 [23] 马建伟, 任淑鹏, 宋亚瑞, 等. 零价铁技术在废水处理领域的应用研究进展 [J]. 化学通报, 2019, 82(1): 3-11. MA J W, REN S P, SONG Y R, et al. Advances in the application of zero-valent iron technology in the field of wastewater treatment [J]. Chemistry Bulletin, 2019, 82(1): 3-11(in Chinese).
[24] LI Y, ZHANG Y, LI J, et al. Enhanced removal of pentachlorophenol by a novel composite: Nanoscale zero valent iron immobilized on organobentonite [J]. Environmental Pollution, 2011, 159(12): 3744-3749. doi: 10.1016/j.envpol.2011.07.016 [25] LU H, DONG J, ZHANG M, et al. SiO2-coated zero-valent iron nanocomposites for aqueous nitrobenzene reduction in groundwater: Performance, reduction mechanism and the effects of hydrogeochemical constituents [J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2018, 558: 271-279. doi: 10.1016/j.colsurfa.2018.08.081 [26] LI Y, LU Y, ZHU X. Photo-fenton discoloration of the azo dye X-3B over pillared bentonites containing iron [J]. Journal of Hazardous Materials, 2006, 132(2/3): 196-201. [27] LEE T, LIM H, LEE Y, et al. Use of waste iron metal for removal of Cr(Ⅵ) from water [J]. Chemosphere, 2003, 53(5): 479-485. doi: 10.1016/S0045-6535(03)00548-4 [28] NOUBACTEP C, SCHONER A, MEINRATH G. Mechanism of uranium removal from the aqueous solution by elemental iron [J]. Journal of Hazardous Materials, 2006, 132(2/3): 202-212. [29] XI Y, MALLAVARAPU M, NAIDU R. Reduction and adsorption of Pb2+ in aqueous solution by nano-zero-valent iron—a SEM, TEM and XPS study [J]. Materials Research Bulletin, 2010, 45(10): 1361-1367. doi: 10.1016/j.materresbull.2010.06.046 [30] BANG S, KORFIATIS G P, MENG X. Removal of arsenic from water by zero-valent iron [J]. Journal of Hazardous Materials, 2005, 121(1/3): 61-67. [31] BILARDI S, CALABRO P S, MORACI N. The removal efficiency and long-term hydraulic behaviour of zero valent iron/lapillus mixtures for the simultaneous removal of Cu2+, Ni2+ and Zn2+ [J]. Science of the Total Environment, 2019, 675: 490-500. doi: 10.1016/j.scitotenv.2019.04.260 [32] STATHAM T M, MUMFORD K A, STARK S C, et al. Removal of copper and zinc from ground water by granular zero-valent iron: A mechanistic study [J]. Separation Science and Technology, 2015, 50(16): 2427-2435. [33] BALDWIN R J, ACRES W, STATUTER J, et al. Process for the removel of selenium aqueous system [P]. US Patent 4405464, 1983. [34] GUAN X, SUN Y, QIN H, et al. The limitations of applying zero-valent iron technology in contaminants sequestration and the corresponding countermeasures: The development in zero-valent iron technology in the last two decades(1994-2004) [J]. Water Reasarch, 2015, 75: 224-248. doi: 10.1016/j.watres.2015.02.034 [35] REN C, LI Y, LI J, et al. Immobilization of nanoscale zero valent iron on organobentonite for accelerated reduction of nirtobenzene [J]. Journal of Chemical Technology and Biotechnology, 2014(89): 1961-1966. [36] 夏雪芬, 滑熠龙, 黄潇月, 等. 纳米零价铁对水中砷和硒的去除的比较研究 [J]. 化学学报, 2017, 75(6): 594-601. doi: 10.6023/A17030099 XIA X, HUA Y, HUANG X, et al. Removal of arsenic and selenium with nanoscale zero-valent iron (nZVI) [J]. Acta Chimica Sinica, 2017, 75(6): 594-601(in Chinese). doi: 10.6023/A17030099
[37] LIANG L, JIANG X, YANG W, et al. Kinetics of selenite reduction by zero-valent iron [J]. Desalination and Water Treatment, 2013, 53(9): 2540-2548. [38] ANDREW P M. Removal of selenate from water by chemical reduction [J]. Industrial & Engineering Chemistry Research, 1988, 27(1): 187-191. [39] QIN H, LI J, YANG H, et al. Coupled effect of ferrous ion and oxygen on the electron selectivity of zerovalent iron for selenate sequestration [J]. Environmental Science & Technology, 2017, 51(9): 5090-5097. [40] LIANG L, GUAN X, HUANG Y, et al. Efficient selenate removal by zero-valent iron in the presence of weak magnetic field [J]. Separation and Purification Technology, 2015, 156: 1064-1072. doi: 10.1016/j.seppur.2015.09.062 [41] YOON I H, BANG S, KIM K W, et al. Selenate removal by zero-valent iron in oxic condition: the role of Fe(Ⅱ) and selenate removal mechanism [J]. Environmental Science and Pollution Research, 2016, 23(2): 1081-1090. doi: 10.1007/s11356-015-4578-4 [42] QIU S R, LAI H F, ROBERSON M J, et al. Removal of contaminants from aqueous solution by reaction with iron sufaces [J]. Langmuir, 2000, 16(5): 2230-2236. doi: 10.1021/la990902h [43] ZHANG Y Q, WANG J F, AMRHEIN C, et al. Removal of selenate from water by zerovalent iron [J]. Journal of Environmental Quality, 2005, 34(2): 487-495. doi: 10.2134/jeq2005.0487 [44] ZHANG Y, AMRHEIN C, CHANG A, et al. Effect of zero-valent iron and a redox mediator on removal of selenium in agricultural drainage water [J]. Science of the Total Environment, 2008, 407(1): 89-96. doi: 10.1016/j.scitotenv.2008.09.009 [45] 梁丽萍, 杨文君, 关小红. 纳米零价铁去除地下水中亚硒酸盐的动力学即机理 [J]. 哈尔滨工程大学学报, 2014, 46(6): 20-24. LIANG L, YANG W, GUAN X. Reductive removak of Se(Ⅳ) by nanoscale zero-valent iron under anoxic conditions: kinetics and mechnism [J]. Journal of Harbin Institute of Technology, 2014, 46(6): 20-24(in Chinese).
[46] XU L, HUANG Y. Kinetics and mechanism of selenite reduction by zero valent iron under anaerobic condition activated and enhanced by dissolved Fe(Ⅱ) [J]. Science of the Total Environment, 2019, 664: 698-706. doi: 10.1016/j.scitotenv.2019.02.044 [47] YOON I-H, KIM K-W, BANG S, et al. Reduction and adsorption mechanisms of selenate by zero-valent iron and related iron corrosion [J]. Applied Catalysis B:Environmental, 2011, 104(1/2): 185-192. [48] TWIDWELL L, MCCLOSKEY J, JOYCE H, et al. Removal of selenium oxyanions from mine waters utilizing elemental iron and galvanically coupled metals [C/OL]. [2020-11-8]https://www.researchgate.net/publication/235348992 [49] TANG C, HUANG Y, ZHANG Z, et al. Reductive removal of selenate by zero-valent iron: The roles of aqueous Fe2+ and corrosion products, and selenate removal mechanisms [J]. Water Research, 2014, 67: 166-174. doi: 10.1016/j.watres.2014.09.016 [50] TANG C, HUANG Y, ZHANG Z, et al. Rapid removal of selenate in a zero-valent iron/Fe3O4/Fe2+ synergetic system [J]. Applied Catalysis B:Environmental, 2016, 184: 320-327. doi: 10.1016/j.apcatb.2015.11.045 [51] BORSIG N, SCHEINOST A C, SHAW S, et al. Retention and multiphase transformation of selenium oxyanions during the formation of magnetite via iron(Ⅱ) hydroxide and green rust [J]. Dalton Transactions, 2018, 47(32): 11002-10015. doi: 10.1039/C8DT01799A [52] ONOGUCHI A, GRANATA G, HARAGUCHI D, et al. Kinetics and mechanism of selenate and selenite removal in solution by green rust-sulfate [J]. Royal Society Open Science, 2019, 6(4): 1-13. [53] LI Z, HUANG D, MCDONALD L M. Heterogeneous selenite reduction by zero valent iron steel wool [J]. Water Science and Technology, 2017, 75(3-4): 908-915. [54] KLAS S, KIRK D W. Understanding the positive effects of low pH and limited aeration on selenate removal from water by elemental iron [J]. Separation and Purification Technology, 2013, 116: 222-229. doi: 10.1016/j.seppur.2013.05.044 [55] LI Y, GUO X, DONG H, et al. Selenite removal from groundwater by zero-valent iron (ZVI) in combination with oxidants [J]. Chemical Engineering Journal, 2018, 345: 432-440. doi: 10.1016/j.cej.2018.03.187 [56] OLEGARIO J T, YEE N, MILLER M, et al. Reduction of Se(Ⅵ) to Se(-Ⅱ) by zerovalent iron nanoparticle suspensions [J]. Journal of Nanoparticle Research, 2009, 12(6): 2057-2068. [57] XIA X, LING L, ZHANG W-X. Genesis of pure Se(0) nano- and micro-structures in wastewater with nanoscale zero-valent iron (nZVI) [J]. Environmental Science:Nano, 2017, 4(1): 52-59. doi: 10.1039/C6EN00231E [58] LING L, PAN B, ZHANG W X. Removal of selenium from water with nanoscale zero-valent iron: mechanisms of intraparticle reduction of Se(Ⅳ) [J]. Water research, 2015, 71: 274-281. doi: 10.1016/j.watres.2015.01.002 [59] LIU H, CAI Z, ZHAO X, et al. Reductive removal of selenate in water using stabilized zero-valent iron nanoparticles [J]. Water Environment Research, 2016, 88(8): 694-703. doi: 10.2175/106143016X14609975746929 [60] SUN Y P, LI X Q, CAO J, et al. Characterization of zero-valent iron nanoparticles [J]. Advances in Colloid and Interface Science, 2006, 120(1-3): 47-56. doi: 10.1016/j.cis.2006.03.001 [61] SUGANYA S,SENTHIL KUMAR P. An investigation of adsorption parameters on ZVI-AC nanocomposite in the displacement of Se(Ⅳ) ions through CCD analysis [J]. Journal of Industrial and Engineering Chemistry, 2019, 75: 211-223. doi: 10.1016/j.jiec.2019.03.026 [62] TAN G, MAO Y, WANG H, et al. Comparison of biochar- and activated carbon-supported zerovalent iron for the removal of Se(Ⅳ) and Se(Ⅵ): influence of pH, ionic strength, and natural organic matter [J]. Environmental Science and Pollution Research, 2019, 26(21): 21609-21618. doi: 10.1007/s11356-019-05497-0 [63] YU K, GU C, BOYD S A, et al. Rapid and extensive debromination of decabromodiphenyl ether by smectite clay-templated subnanoscale zero-valent iron [J]. Environmental Science & Technology, 2012, 46(16): 8969-8975. [64] LI Y, CHENG W, SHENG G, et al. Synergetic effect of a pillared bentonite support on Se(Ⅵ) removal by nanoscale zero valent iron [J]. Applied Catalysis B:Environmental, 2015, 174-175: 329-335. doi: 10.1016/j.apcatb.2015.03.025 [65] 魏雪. 生物炭包覆纳米铁去除水中硒的研究[D]. 长沙: 湖南大学, 2016. WEI X. Biochar supported nano scale zero valent iron for selenium removal [D]. Changsha: Hunan University, 2016(in Chinese).
[66] QIU Z, TIAN Q, ZHANG T, et al. Fabrication of dynamic zero-valent iron/MnO2 nanowire membrane for efficient and recyclable selenium separation [J]. Separation and Purification Technology, 2020, 230: 1-10. [67] QIN H, SUN Y, YANG H, et al. Unexpected effect of buffer solution on removal of selenite and selenate by zerovalent iron [J]. Chemical Engineering Journal, 2018, 334: 296-304. doi: 10.1016/j.cej.2017.10.025 [68] LIANG L, SUN W, GUAN X, et al. Weak magnetic field significantly enhances selenite removal kinetics by zero valent iron [J]. Water research, 2014, 49: 371-380. doi: 10.1016/j.watres.2013.10.026 [69] QIAO J, SONG Y, SUN Y, et al. Effect of solution chemistry on the reactivity and electron selectivity of zerovalent iron toward Se(Ⅵ) removal [J]. Chemical Engineering Journal, 2018, 353: 246-253. doi: 10.1016/j.cej.2018.07.113 [70] DAS S, LINDSAY M B J, ESSILFIE-DUGHAN J, et al. Dissolved selenium (Ⅵ) removal by zero-valent iron under anoxic conditions: influence of sulfate and nitrate [J]. ACS Omega, 2017, 2(4): 1513-1522. doi: 10.1021/acsomega.6b00382 [71] DAS S, LINDSAY M B J, HENDRY M J. Selenate removal by zero-valent iron under anoxic conditions: Effects of nitrate and sulfate [J]. Environmental Earth Sciences, 2019, 78(16): 1-10. [72] LING J, QIAO J, SONG Y, et al. Influence of coexisting ions on the electron efficiency of sulfidated zerovalent iron toward Se(Ⅵ) removal [J]. Chemical Engineering Journal, 2019, 378: 1-8. [73] TANG C, HUANG Y H, ZENG H, et al. Promotion effect of Mn2+ and Co2+ on selenate reduction by zero-valent iron [J]. Chemical Engineering Journal, 2014, 244: 97-104. doi: 10.1016/j.cej.2014.01.059 [74] LI J, WANG C, QIAO J, et al. Enhancing the effect of bisulfite on sequestration of selenite by zerovalent iron [J]. RSC Advances, 2015, 5(93): 76032-76039. doi: 10.1039/C5RA14659C -











 下载:
下载: