-
由于寡糖分子的极性非常大,化学结构类似,无论反相还是正向色谱柱,保留表现都不是很理想,尤其存在大量的位置异构体和差向异构体时,不能实现较好分离[1]。离子色谱对糖类物质具有很好的保留和分离效果,已有很多相关报道,越来越多糖测定标准方法也首选离子色谱法[2-5]。相较于传统的检测手段,质谱具有高灵敏度、高通量和高选择性等优势,也是在糖类物质检测中的重要分析方法[6]。鉴于离子色谱的分离及质谱检测器的特点,离子色谱和质谱联用进行糖类等强极性化合物的分析具有无可比拟的优势,目前尚属于较新的应用技术,鲜有文献报道,因此本实验建立了基于IC-TSQ Altis的不同聚合度的褐藻寡糖样本的分析,为糖类样本的分离分析提供可靠、前沿的分析方法。
-
Thermo Scientific™ TSQ Altis三重四极杆质谱(赛默飞世尔科技,美国);Thermo Scientific™ Dionex ICS-5000+型离子色谱仪(赛默飞世尔科技,美国);纯水机(密理博,美国); 50%氢氧化钠水溶液(默克,美国);乙腈(色谱纯,美国Fisher Chemical公司);混合标准品:各聚合度甘露糖醛酸(M)和古罗糖醛酸(G)组成(由西宝生物科技提供),分子式、分子量及m/z如表1所示。褐藻寡糖样本购自市场。
-
取混合标准品0.05 g,用20 mmol·L−1的NaOH溶解并定容至100 mL,得500 mg·L−1混合标准溶液。依次用20 mmol·L−1的NaOH逐级稀释,配制系列标准溶液,浓度分别为25 μg·L−1、50 μg·L−1、 100 μg·L−1、200 μg·L−1、 500 μg·L−1、 1 mg·L−1、 2 mg·L−1、 5 mg·L−1、 10 mg·L−1、50 mg·L−1、100 mg·L−1、 500 mg·L−1。
-
色谱条件:Thermo Scientific Dionex IonPacTM AS19-4 µm(2 mm×250 mm)色谱柱及Thermo Scientific Dionex IonPacTM AG19-4 µm(2 mm×50 mm)保护柱;柱温30 ℃;检测器温箱30 ℃;进样体积25 μL;抑制器:Thermo Scientific Doinex ASRS300 (2 mm),抑制器外接水流速2 mL·min−1;电导检测器后加乙腈流速0.30 mL·min−1;梯度洗脱,梯度条件如下:0—20 min,NaOH浓度由10 mmol·L−1 升至90 mmol·L−1;25—50 min,NaOH浓度由90 mmol·L−1升至130 mmol·L−1;50—50.1 min,淋洗液浓度由130 mmol·L−1升至200 mmol·L−1;50.1—55 min,淋洗液浓度保持200 mmol·L−1;55—55.1 min,淋洗液浓度由200 mmol·L−1降至10 mmol·L−1;55.1—65 min, 淋洗液浓度保持10 mmol·L−1。
质谱条件:电离方式:负离子;扫描模式:SRM;喷雾电压:2500 W;毛细管加热温度:320℃;鞘气流速:45 Arb;辅助气流速:10 Arb;雾化器温度:450 ℃;Q1分辨率:0.7 FWHM;Q3分辨率:1.2 FWHM;CID碰撞能:2 mTorr;10种不同寡糖的SRM参数见表2。 数据分析采用ThermoFisher TraceFinder 5.0 软件。
-
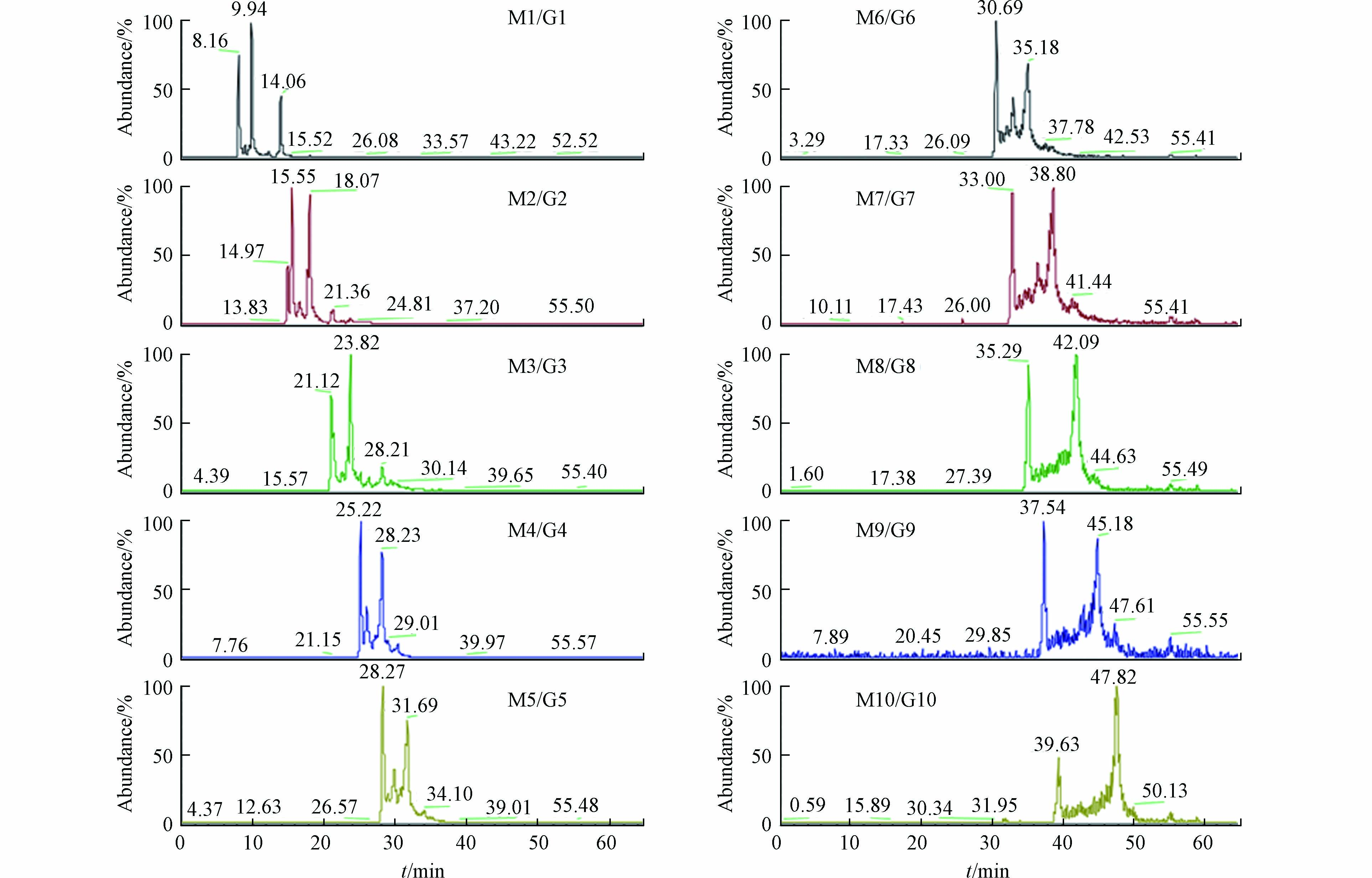
实验考察了CarboPac PA20、CarboPac PA200和IonPac AS19-4 µm不同色谱柱的分离效果。其中,CarboPac PA20和CarboPac PA200是专用的糖分析柱,在氢氧化钠和醋酸钠梯度洗脱条件下,高聚合度寡糖(M4/G4以上聚合度)仍然无法洗脱。虽然可以尝试提高醋酸钠的浓度洗脱高聚合度寡糖,但高浓度醋酸(醋酸钠经过抑制器后变为醋酸)对质谱并不友好。鉴于糖类物质在常规阴离子色谱柱保留较弱的特点,尝试采用常规阴离子色谱柱进行分离,在IonPac AS19-4 µm常规阴离子色谱柱上采用NaOH梯度淋洗的方式,能够将上述10种不同聚合度的寡糖完全洗脱分离,色谱行为良好,并且NaOH淋洗液经过抑制器后变为中性的水与质谱兼容性更好。在质谱条件下可利用分子量的不同,选择不同的离子通道对10种不同聚合度的寡糖进行定性和定量。10种不同聚合度寡糖的提取离子流色谱图见图1。
-
将系列溶液由低到高依次进入IC-TSQ Altis系统分析,以标准品溶液的浓度为横坐标,选定定量子强度为纵坐标,建立标准曲线(表3)。对25 μg·L−1标准溶液逐级稀释,以S/N=3作为本方法的检出限,各化合物检出限见表3。
-
将浓度为500 μg·L−1标准品溶液重复进样5次,依据标准及选定定量离子强度进行定量,并计算其结果的RSD值,得到其RSD值均小于6.08%,具体结果如表4所示。
-
取褐藻寡糖样本0.10 g,用20 mmol·L−1 NaOH溶解,并定容至100 mL,然后加入标注溶液、混匀后用20 mmol·L−1 NaOH定容水相滤膜过滤后;上机检测,折算最终加标浓度分别为0.5%、2.0%、4.0%低中高三水平,每加标浓度测定3次,计算其平均回收率,具体结果见表5。
-
离子色谱在糖类物质的研究中应用非常广泛,在强碱性溶液中,糖类可呈现离子化状态,可以采用离子交换色谱柱将具有不同pKa值的糖类进行分离,并且分离能力非常好,色谱表现十分稳定。氢氧化钠淋洗液在经过抑制器后,其中的钠离子被交换到废液中,进入质谱的流动相基本为水,与质谱具有很好的兼容性;并且在连接质谱之前,可通过三通阀引入部分乙腈以提高质谱的雾化效率,从而获得较高的灵敏度和较宽的线性范围。
离子色谱与三重四极杆质谱TSQ Altis联用实现10种寡糖的同时分析检测
Simultaneous analysis and detection of 10 oligosaccharides by ion chromatography coupled with triple quadrupole mass spectrometry TSQ Altis
-
摘要: 本文建立了针对10种寡糖,包括甘露糖醛酸(M)和古罗糖醛酸(G)的离子色谱串联三重四极杆质谱的分析方法。优化后的离子色谱条件:Thermo Scientific Dionex IonPacTM AS19-4 μm (2 mm× 250 mm, Analytical),200 mmol·L−1氢氧化钠-水为淋洗液,流速0.3 mL·min−1,柱温30 ℃,电导检测器后连外接泵,三通阀加0.25 mL·min−1乙腈。采用ESI源,扫描方式为选择反应检测。结果表明,离子色谱对不同聚合度的甘露糖醛酸和古罗糖醛酸有很好的保留和分离效果,三重四极杆质谱相比传统检测手段具有优异的灵敏度和高选择性;稳定性良好,连续进样5针,RSD均小于6.08%;标曲线性关系良好,R2≥0.9990;方法检出限0.34 μg·L−1;加标回收率均≥90.2%,本方法可用于寡糖的定性及定量分析。Abstract: In this paper, an ion chromatography coupled with triple quadrupole mass spectrometry method was developed for 10 oligosaccharides, including mannuronic acid (M) and guluronic acid (G). Optimized ion chromatographic conditions: Thermo Scientific Dionex IonPacTM AS19-4 μm (2 mm × 250 mm, Analytical), 200 mmol·L−1 sodium hydroxide-water as eluent, flow rate 0.3 L·min−1, column temperature 30 °C, conductivity detector connected to the back External pump, add 0.25 mL·min−1 acetonitrile. The ESI source was used, and the scanning method was selective reaction detection (SRM). The results show that: ion chromatography had good retention and separation effects on mannuronic acid and guluronic acid with different degrees of polymerization, triple quadrupole mass spectrometry has excellent sensitivity and high selectivity compared with traditional detection methods; continuous in 5 injections, the RSDs were all less than 6.08%. The calibration curve has a good linear relationship, R2≥0.9990; the detection limit of the method is 0.34 μg·L−1; the detection results are accurate, and the recovery of the low, middle and high levels of the standard is greater than or equal to 90.2, so this method can be used for the qualitative analysis of oligosaccharides and quantitative analysis.
-

-
表 1 不同聚合度的甘露糖醛酸和古罗糖醛酸的分子式、分子量、m/z值及其对应的加和离子
Table 1. Molecular formulas, molecular weights, m/z values and their corresponding additive ions of Oligomannuronate and Oligoguluronate with different degrees of polymerization
化合物 分子式 分子量 m/z 加和离子 M1/G1 C6H10O7 194 192.9 [M-H]- M2/G2 C12H18O13 370 368.8 [M-H]- M3/G3 C18H26O19 546 544.8 [M-H]- M4/G4 C24H34O25 722 359.8 [M-2H]2- M5/G5 C30H42O31 898 447.9 [M-2H]2- M6/G6 C36H50O37 1074 535.9 [M-2H]2- M7/G7 C42H58O43 1250 623.9 [M-2H]2- M8/G8 C48H66O49 1426 474.3 [M-3H]3- M9/G9 C54H74O55 1602 532.9 [M-3H]3- M10/G10 C60H82O61 1778 443.5 [M-4H]4- 表 2 10种不同寡糖的SRM参数
Table 2. SRM parameters for 10 different oligosaccharides
化合物 母离子(m/z) 子离子(m/z) 碰撞能量/V 最小驻留时间/ms RF透镜电压/V M1/G1 192.89 72.99/112.92/130.99 13.49/10.23/10.23 16.45 42 M2/G2 368.79 131/174.99/192.92 16.48/12.43/14.09 16.45 69 M3/G3 544.83 174.99/192.92/368.97 21.49/24.41/17.17 16.45 155 M4/G4 359.81 174.99/368.97/544.97 10.23/10.23/10.23 16.45 49 M5/G5 447.95 174.99/369/544.97/721 14.85/15.23/13.37/10.23 16.45 65 M6/G6 535.86 544.99/720.99/878.96/896.99 18.15/15.95/13.34/12.96 16.45 122 M7/G7 623.86 527.04/536.07/88/1072.93 15.65/15.08/17.58/15.16 16.45 164 M8/G8 474.31 415.67/536.04/544.99/624.11 10.23/10.23/11.52/10.23 16.45 60 M9/G9 532.91 474.38/527.01/652.30/712.11 10.23/13.75/11.14/10.23 16.45 73 M10/G10 443.48 533.11/624.08/712.09/743 10.23/11.74/10.23/10.23 16.45 49 表 3 线性及检出限
Table 3. Linearity and detection limits
化合物 线性方程 R2 检出限(S/N=3)/(μg·L−1) M1/G1 Y=2.429×104X+1.837×104 0.9999 0.53 M2/G2 Y=3.524×104X+2.035×104 0.9993 0.47 M3/G3 Y=1.835×104X+2.998×104 0.9997 0.65 M4/G4 Y=2.504×104X+1.678×104 0.9994 0.44 M5/G5 Y=1.964×104X+1.995×104 0.9992 0.68 M6/G6 Y=2.587×104X+1.946×104 0.9990 0.54 M7/G7 Y=3.785×104X+3.298×104 0.9995 0.37 M8/G8 Y=2.125×104X+1.986×104 0.9991 0.65 M9/G9 Y=1.843×104X+1.378×104 0.9994 0.77 M10/G10 Y=3.892×104X+2.333×104 0.9999 0.34 表 4 标准品溶液重复进样5次的RSD
Table 4. RSD of 5 replicate injections of standard solution
化合物 M1/G1 M2/G2 M3/G3 M4/G4 M5/G5 M6/G6 M7/G7 M8/G8 M9/G9 M10/G10 保留时间/min 9.94 15.55 23.82 25.22 28.27 30.69 33.00 35.29 37.54 39.63 RSD/% 2.38 2.35 2.28 2.15 4.30 4.60 6.08 4.36 3.83 1.62 表 5 样品加标回收率
Table 5. Sample recovery rate spiking
化合物 本底含量/% 0.5%加标
含量/%0.5%加标
平均回收/%2.0%加标
含量/%2.0%加标
平均回收/%4.0%加标
含量/%4.0%加标
平均回收/%M1/G1 2.53 2.99 91.4 4.44 95.5 6.47 98.5 M2/G2 1.46 1.91 90.2 3.34 93.8 5.23 94.3 M3/G3 4.77 5.26 98.7 6.72 97.6 8.46 92.2 M4/G4 8.62 9.09 93.5 10.51 94.3 12.34 93.1 M5/G5 9.88 10.34 92.1 11.86 98.8 13.86 99.4 M6/G6 7.64 8.10 91.2 9.64 99.9 11.66 100.4 M7/G7 8.32 8.79 93.3 10.32 100.2 12.04 93 M8/G8 6.45 6.95 99.1 8.36 95.6 10.28 95.7 M9/G9 3.27 3.74 94.5 5.22 97.6 6.95 92.1 M10/G10 5.43 5.90 93.8 7.33 94.8 9.07 91.1 -
[1] 刘妍妍, 刘建飞, 邢连喜, 等. 中药中寡糖分离分析方法研究进展[J/OL]. [2022-3-14].天然产物研究与开发. https://k ns.cnki.net/kcms/detail/51.1335.q.20220128.1310.002.html [2] 陈修红, 冀鹏, 何国亮, 等. 离子色谱-脉冲安培法同时测定牛肉水解产物中6 种糖组分的含量[J/OL].[2022-3-14] 食品工业科技. https://doi.org/10.13386/j.issn1002-0306.2021070122 [3] 黄伟乾, 覃天福, 吴俊, 等. 发酶水解-阴离子色谱法联用测定婴幼儿配方奶粉中果聚糖的总含量及平均聚合度 [J]. 食品安全质量检测学报, 2021, 12(23): 9117-9123. [4] 徐诺, 姚哲渊, 车金水, 等. 离子色谱-积分脉冲安培法检测黄酒中的阿拉伯糖、半乳糖、甘露糖、葡萄糖、核糖、乳糖 [J]. 食品工业科技, 2022, 43(3): 254-259. [5] 宋卫得, 王 凯, 胡首鹏, 等. 离子色谱同时测定果汁中22 种糖、糖醇和醇 [J]. 食品安全质量检测学报, 2020, 11(19): 6983-6989. [6] 何金霞, 贾晓晨, 王文霞. 植物N-糖链检测技术研究进展 [J]. 生物技术进展, 2018, 8(6): 500-508. -



 下载:
下载:

