-
近几十年来,河流水体受到的污染越来越严重[1],逐渐威胁到我们的生活,而底泥作为河流水体中污染物最大的“汇”与最大的“源”,其危害巨大。美国的大湖地区、德国的汉堡港、莱茵河流域以及荷兰的阿姆斯特丹港口等地区的底泥中含有大量的污染物,对环境造成严重污染[2],并且该污染为二次污染,不仅威胁水体中的植物和动物,甚至会危害人类健康[2-4]。随着国家对水体污染的治理越来越重视,河流水体环境得到改善,但底泥中大量的污染物仍是一个巨大的隐患[5]。现阶段有越来越多针对河流底泥污染物治理的措施与方法,如传统底泥污染治理方法中的物理方法、化学方法及生物生态方法等,这些方法有一定的适用性,但成本较高。考虑到目前能源危机不断凸显,更加节能、有效、适用的治理方法成为底泥污染治理的研究热点。
沉积型微生物燃料电池(SMFC)是将阳极置于厌氧的底泥中,阴极悬在底泥上方的好氧水体中,通过阳极表面微生物的代谢作用,使得底泥中的有机物发生厌氧降解,产生电子和质子,电子通过外接导线传递给阴极附近水体中的氧化性物质。同时,产生的质子通过底泥和上覆水体传递到阴极,阴极附近的氧化性污染物得到电子后会与质子反应,从而有效去除底泥及上覆水体中污染物。由于阴阳极之间形成了闭合回路,因此SMFC还可以产生电能用于其他方面,节约成本[6-8]。
SMFC作为近十几年发展的技术,特殊的结构使其在河流湖泊底泥原位修复上有较大的潜力。Han et al用SMFC实现了上覆水体中硝酸盐和Cr(Ⅵ)的同步去除[9]用SMFC实现了上覆水体中硝酸盐和Cr(Ⅵ)的同步去除。目前的研究还集中在利用SMFC去除各类重金属,关于优化SMFC参数去除Cr(Ⅵ)的研究内容较少。基于此,本文通过探讨盐酸预处理后的SMFC在不同阴极材料、不同外接电阻下对Cr(Ⅵ)去除的影响,以期望得到底泥中Cr(Ⅵ)的去除机制。
-
实验材料:PAN基碳毡、碳刷、电阻、污泥(取自武汉东湖底泥)等。
试剂:盐酸、磷酸氢二钠、磷酸二氢钠、氯化铵、重铬酸钾等。
主要仪器:电化学工作站(CHI604e);数据采集仪(2700);生化培养箱(SPX-250BⅢ);原子吸收光谱仪(contrAA700);X射线电子能谱仪(ESCALAB250Xi);扫描式电子显微镜(QUANTA)。
-
将钛丝来回穿插所需要的碳材料,用ABS塑料棒固定好阴阳极,使得阳极在下方,阴极在上方,阳极与ABS塑料棒近端的距离为1 cm,将阴阳极之间的间距设为6 cm,中间接入1 000 Ω电阻。将制作好的SMFC骨架放置到1 L烧杯中,加入底泥和PBS缓冲液,使SMFC的阳极被底泥完全淹没,构建厌氧环境,其中底泥厚度为4 cm,缓冲液液面距烧杯上沿1 cm。
-
实验首先利用盐酸对碳毡、碳刷预处理。盐酸处理可显著提高碳毡、碳刷表面的N含量、比表面积、孔径体积以及输出功率,减少启动时间[10]。
本实验设置6组对照,见表1。
碳毡直径为7.5 cm,厚度为0.5 cm,碳刷长度为3 cm,半径1.5 cm。鉴于所取的东湖底泥Cr含量较低,加入140 mg Cr/(kg干污泥)重铬酸钾溶液,搅拌均匀后放置一天,测得底泥中Cr的含量为182.4 mg Cr/(kg干污泥)。将处理后东湖底泥与PBS缓冲液加入烧杯中,PBS缓冲液的成分为11.55 g/L Na2HPO4•12H2O,2.77 g/L NaH2PO4•2H2O,0.31 g/L NH4Cl,0.13 g/L KCl。将组装好的SMFC装置置于25 ℃的恒温培养箱中运行60 d,每天加入纯水以补偿蒸发的水量。在SMFC启动过程中,3、4、5、6组所接电阻均为1 000 Ω,待SMFC启动后,再将5、6组外接电阻换成100 Ω。
-
SMFC运行中输出电压以标准Ag/AgCl电极为参比采用keithley2700实时监测;各电极电势采用电化学工作站CHI604e监测;底泥与上覆水体总铬浓度分别采用国家环境保护标准HJ 491—2009、HJ 757—2015中方法测定。
极化曲线获取方法:将SMFC开路5 h,使外接电阻依次为开路状态,2 000、1 000 、500、200、100、50和20 Ω,每种电阻保持30 min后测得电阻两端电压,依据所接电阻大小,测得电流密度和功率密度,得到极化曲线和功率密度曲线[11-12]。
取SMFC一部分阳极材料经脱水后进行扫描电镜能谱分析;利用X射线电子能谱仪测定阴极上Cr的价态;底泥有机质采用烧失量测定,见式(1):
式中:LOI为烧失量,%;cw105为底泥在105 ℃下烘干并冷却至室温后的恒重,g;cw550为底泥在550 oC下煅烧后冷却至室温的恒重,g。
微生物群落分析方法:取SMFC部分阳极材料,用MIO-BIO PowerSoil DNA Isolation Kit(MOBIO Laboratories, Carlsbad, CA, USA)进行DNA抽提。选择特异引物序列为细菌16S rRNA上V4-V5区域的515F(5’-GTGCCAGCMGCCGCGGTAA-3’)和926R(5’-CCGTCAATTCMTTTGAGTTT-3’)[13-15]。采用两步PCR扩增的方法构建文库。待二次PCR扩增后,将PCR扩增产物于2%琼脂糖凝胶电泳切胶回收。回收采用AxyPrepDNA凝胶回收试剂盒(AXYGEN),回收产物在FTC-3000TM real-time PCR仪上进行定量,均一化混匀后文库制备结束。
-
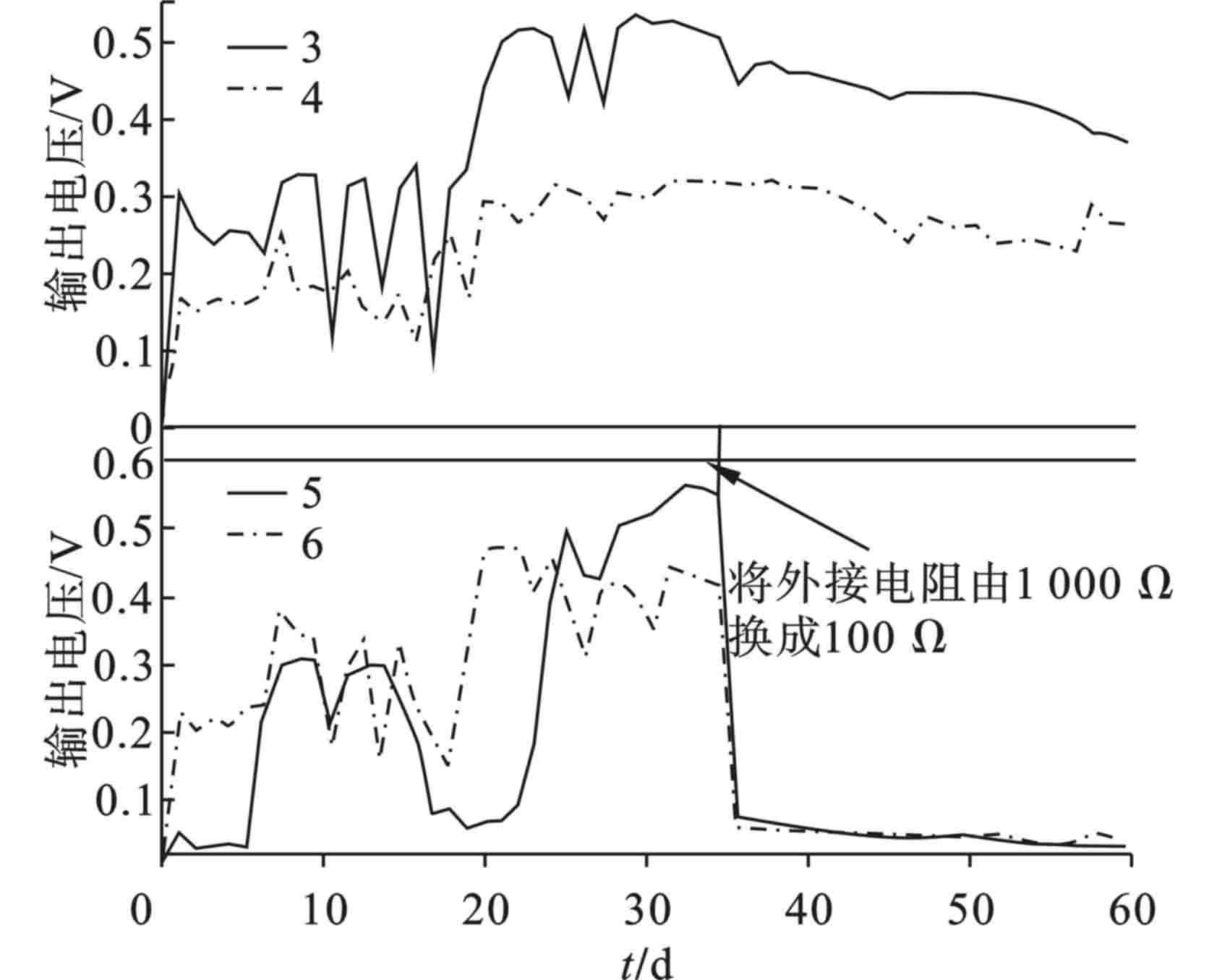
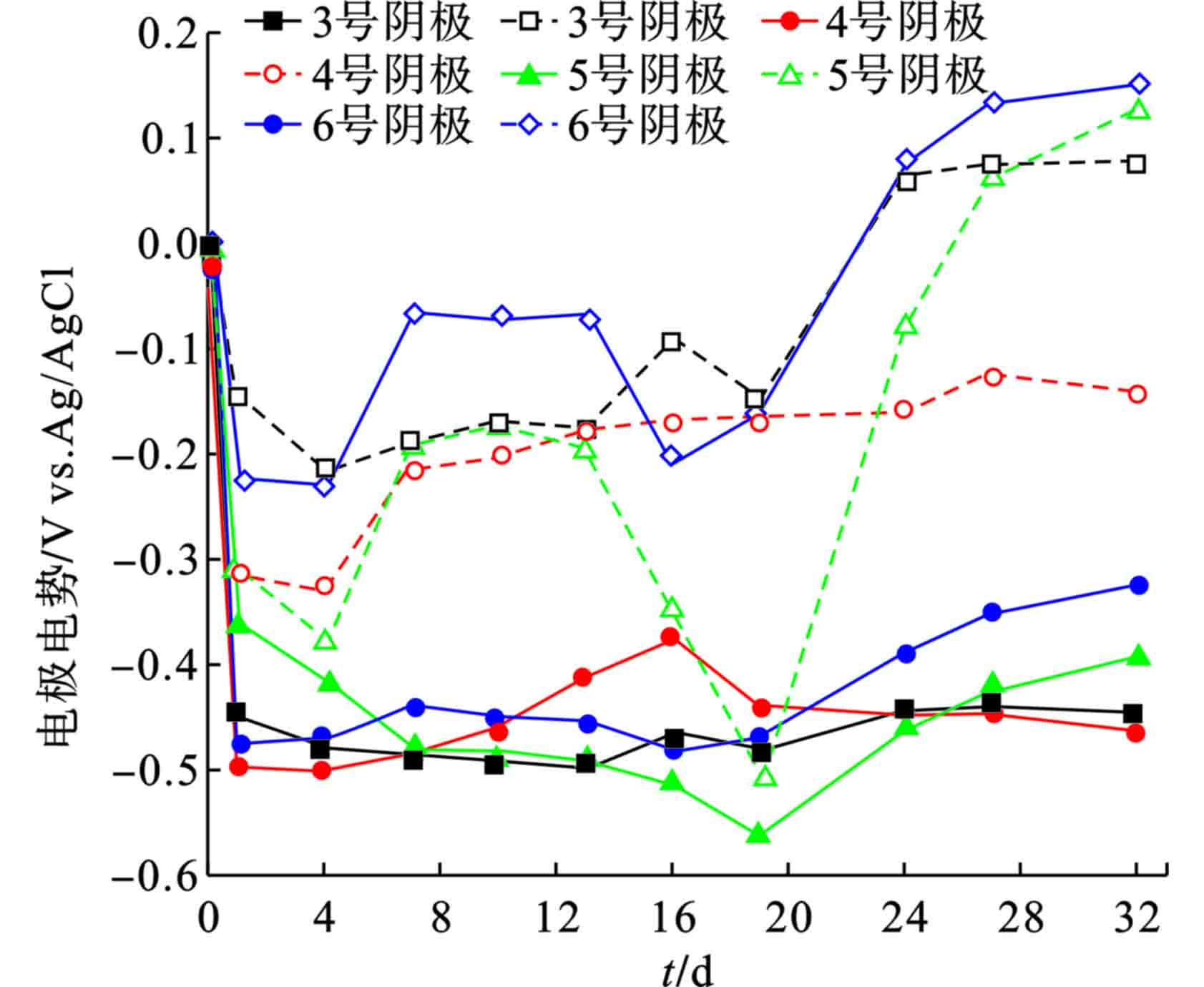
3-6号SMFC在第32 d均启动,各阳极电势稳定在−0.35 V以下。其中4号阴极电势较低,位于−0.15 V左右,其他SMFC的阴极电势稳定在0.1 V左右,见图1。SMFC电能的输出会受限于阴极电势[16],从而使4号SMFC输出电压较低,见图2。
观察各SMFC在整个运行期间输出电压分布情况,待SMFC启动后,3号与6号SMFC的输出电压均稳定在0.4 V以上,5号SMFC的输出电压稳定在0.5 V左右,4号SMFC的输出电压则稳定在0.3V左右,这是由于其阴极电势较低导致。在第34 d将5号与6号SMFC的外接电阻从1 000 Ω换成100 Ω,其输出电压快速下降,最后稳定在0.05 V左右。
-
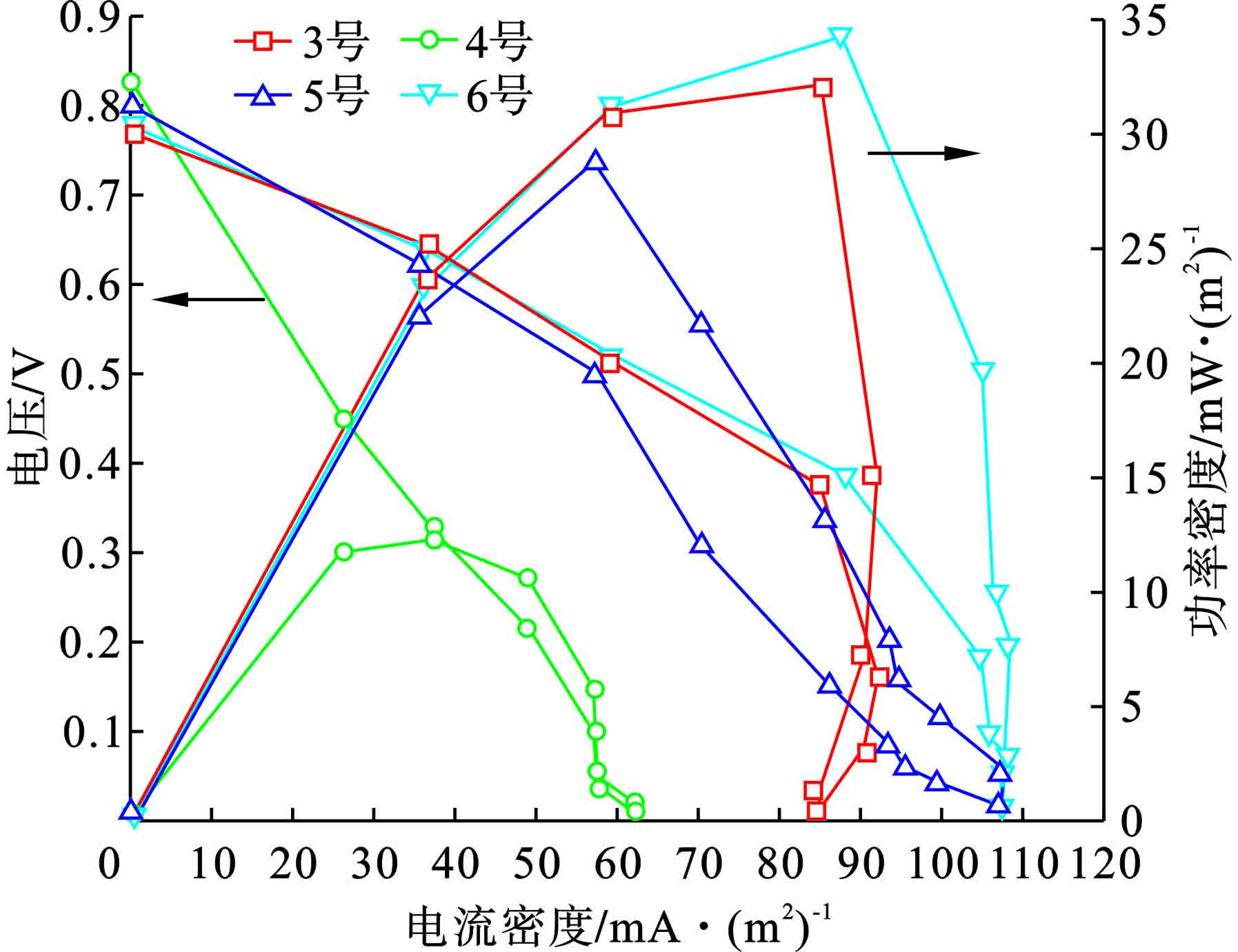
在第32 d测定各个SMFC的极化曲线,此时各个SMFC均已启动,外阻为1000 Ω,可通过比较各个SMFC的极化曲线,来反映其电化学性能的优劣。各SMFC开路电压均分布在0.8 V左右,其中4号SMFC的电压随电流密度增加时下降较快,导致其输出功率密度较小。6号SMFC的输出功率密度最大,其最大输出功率密度为34 mW/m2,其次是3号SMFC,最大输出功率密度为32 mW/m2。4号由于启动时阴极电势较低,整体电化学性能较差。对比6号、3号与5号SMFC,6号SMFC的最大输出功率密度最大,但差距较小,这可能是因为电极经盐酸处理,各个SMFC电化学性能得到一定提升,使阴极材料不同带来的差距减小,见图3。
-
SMFC上覆水体为PBS缓冲液,初始不含重金属Cr,经实验后上覆水体中Cr浓度均小于15 μg/L,浓度变化较小,故本文不考虑上覆水体中Cr浓度。
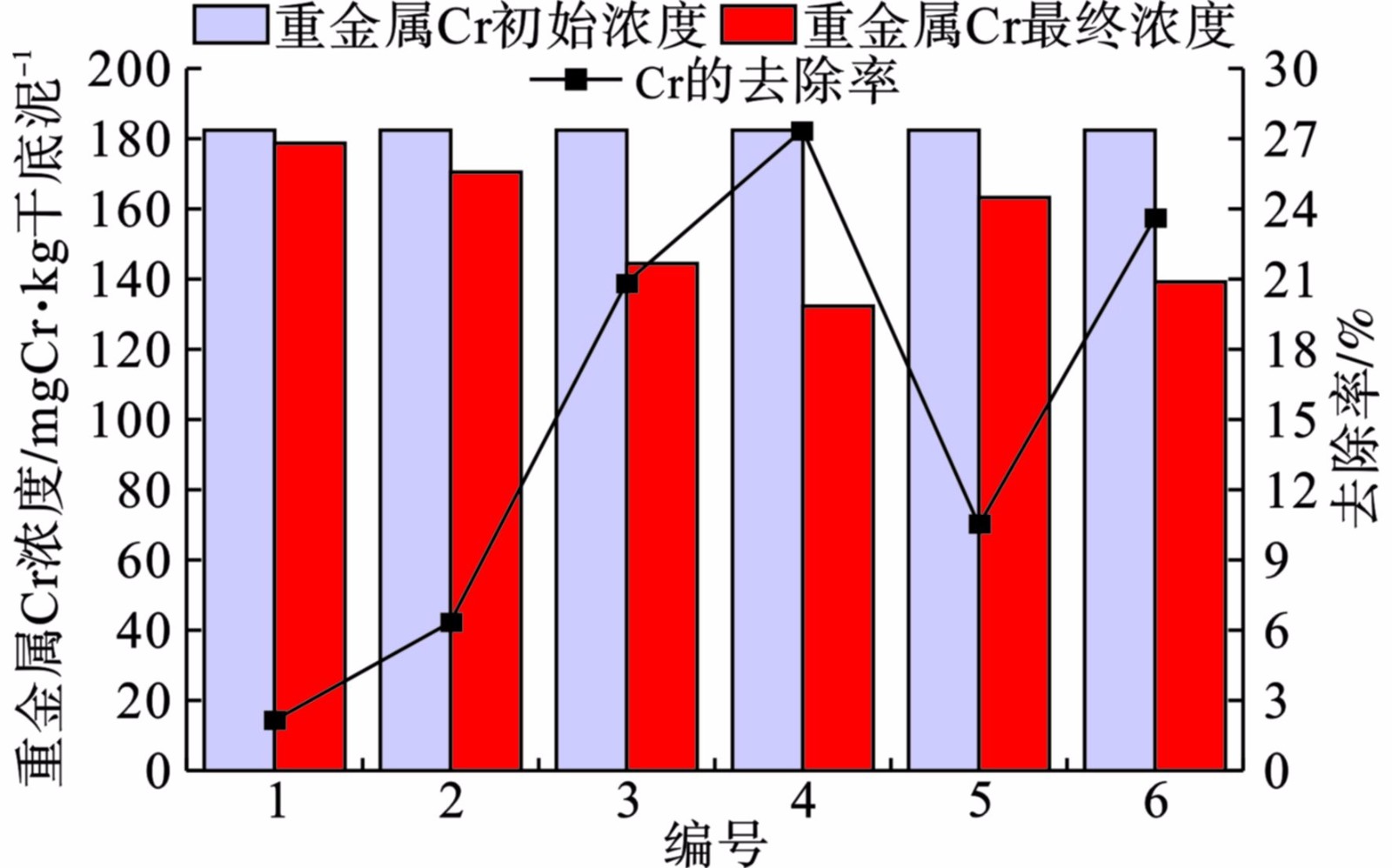
经SMFC作用后,底泥中Cr的浓度均出现不同程度的下降,见图4。
图4可知,4号SMFC中Cr的去除率最大为27.4%,1号SMCF中Cr去除率最低,为2.1%。对比不同阴极材料的SMFC重金属Cr的去除率,可知阴极为碳刷的SMFC更有利于Cr的去除。这是因为碳刷中碳纤维束比较分散,导致其比表面积大,更有利微生物的生长繁殖,从而利于Cr的去除[16]。对比3号与5号以及4号与6号SMFC中Cr的去除率,发现采用相同的阴阳极材料时,外电阻为1000 Ω相对于100 Ω更有利于Cr的去除,这可能是因为SMFC在外接电阻为1000 Ω时的输出电压大于外接电阻为100 Ω时的输出电压,从而驱动更多的Cr从阳极迁移到阴极上,进而被去除。4号SMFC中重金属Cr的去除率最高,但其电化学性能最差,说明SMFC是一个复杂的系统,需要更深层次的研究。
-
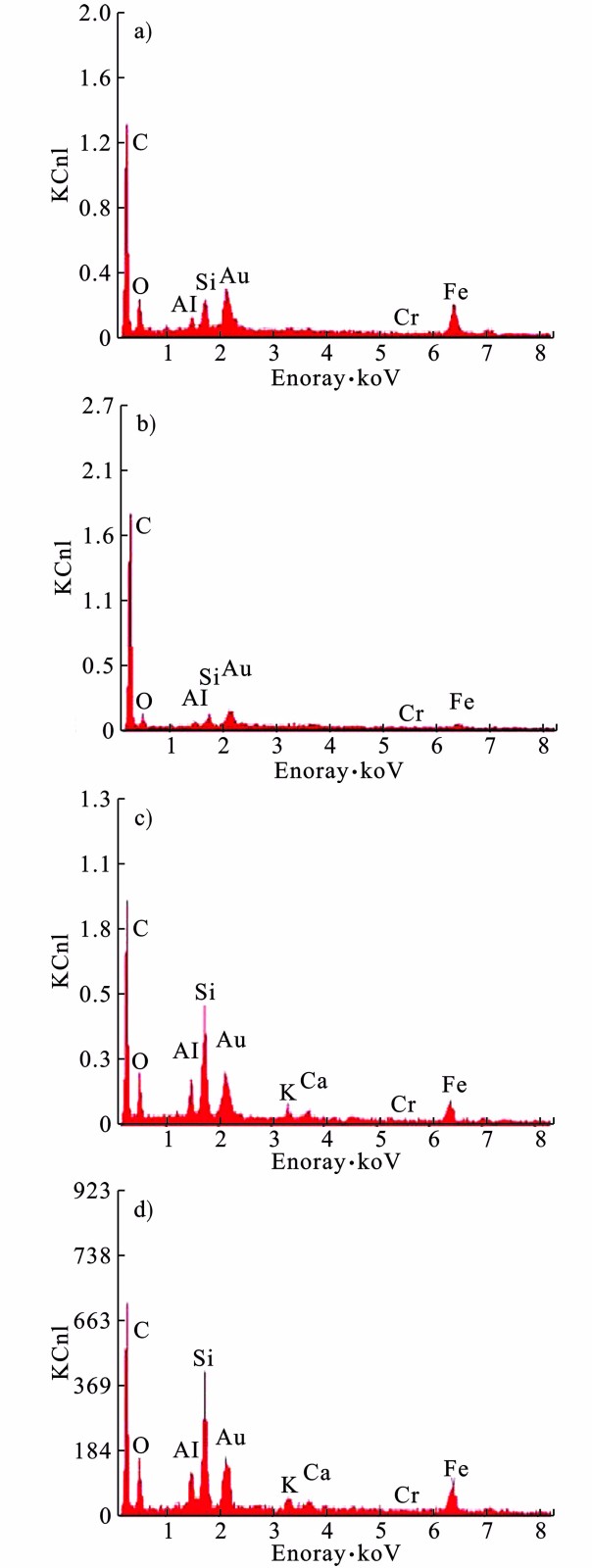
SMFC阳极上C、O、Al、Si、Au元素含量较高,见图5。
C、O元素来自碳毡;Al、Si元素来自附着于碳毡的底泥;Au元素来自扫描电镜能谱分析前镀金;Cr含量较少,这部分Cr可能是电极材料对底泥中Cr的吸附所产生的,相较于底泥中Cr含量,电极材料吸附的量可以忽略不计,表明Cr的去除不发生在阳极上。
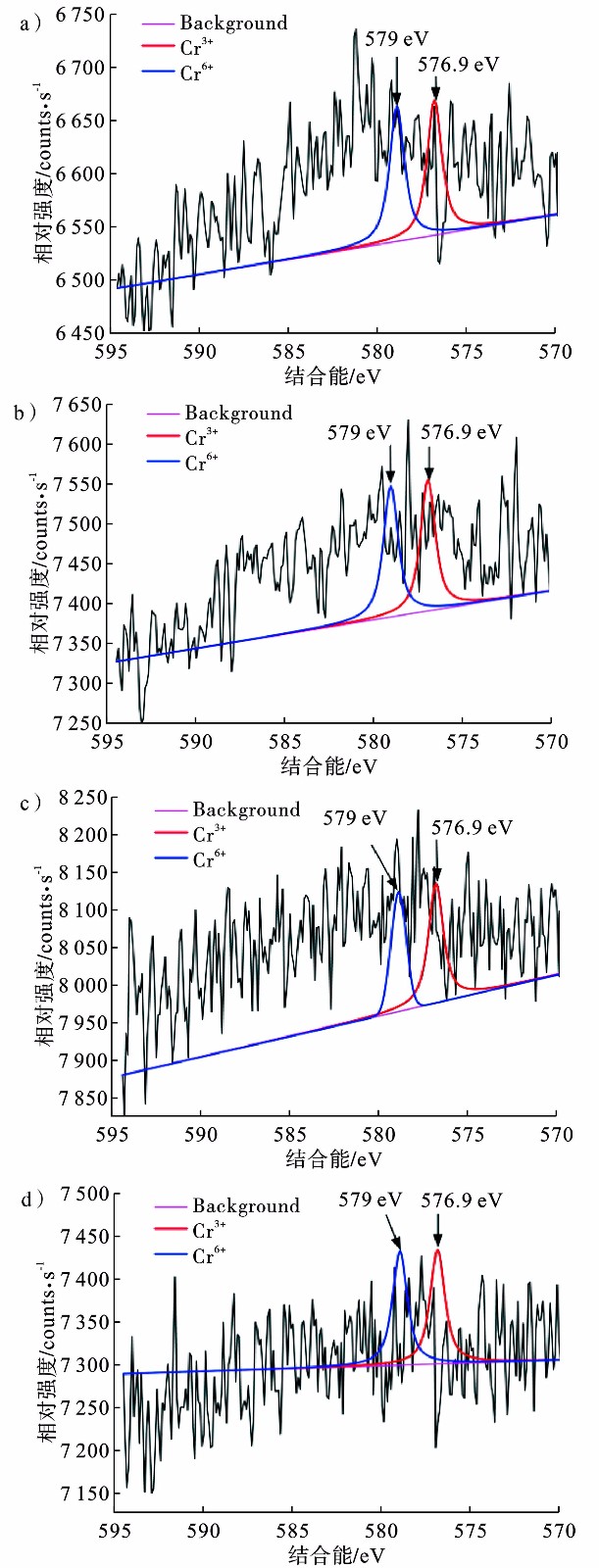
对SMFC阴极进行X射线能谱分析,观察Cr的价态,判断Cr的去除机制,见图6。
结合能为576.9 eV与579 eV处的峰分别为Cr(Ⅲ)、Cr(Ⅵ)的典型峰[17]。3-6号SMFC的X射线能谱图上均可观察到Cr(Ⅲ)、Cr(Ⅵ)的典型峰,表明4个SMFC阴极上同时存在Cr(Ⅵ)与Cr(Ⅲ)。基于此,底泥中的Cr(Ⅵ)从阳极迁移到阴极后接受电子从而被还原成Cr(Ⅲ),Cr(Ⅲ)易沉淀进而被去除[17]。
-
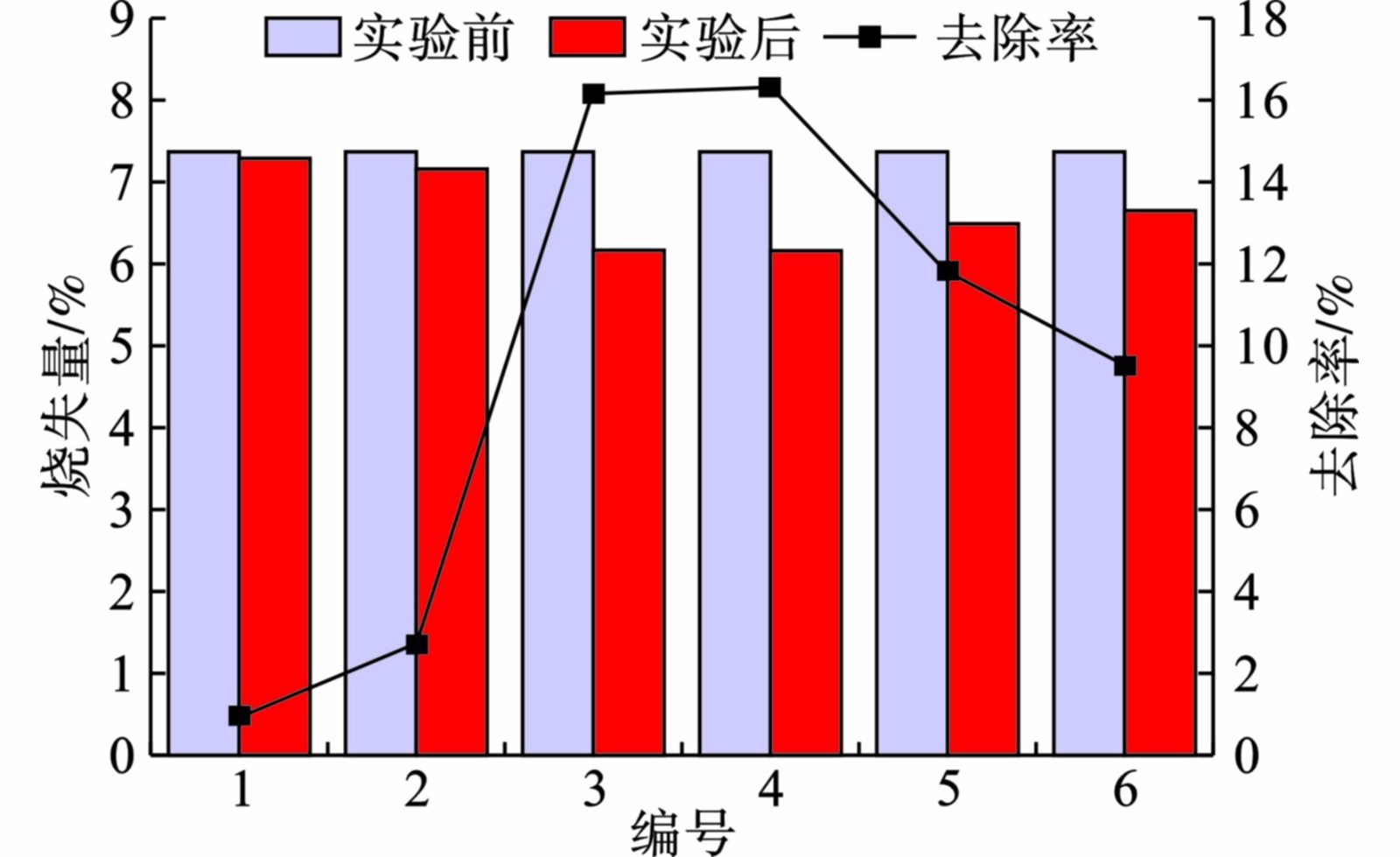
通过底泥烧失量的变化情况可反映底泥中有机质的消耗情况,见图7。
实验前底泥烧失量为7.26%,经处理后,各底泥中烧失量均有所下降,表明底泥中有机质被消耗。分别对比3号与5号、4号与6号SMFC中底泥有机质去除率,发现外接电阻为1000 Ω时SMFC底泥有机质去除量较多,这与一些研究的结论相悖[18-20],具体原因需进一步研究。将闭路与开路的SMFC中底泥有机质去除率进行对比,发现在SMFC中形成闭路,更有利于阳极有机质的消耗,这是由于闭路发生电子传递转移。
-
SMFC阳极生物膜中变形菌门含量(Proteobacteria)超过30%、绿弯菌门(Chloroflexi)约20%,两者含量最多,见图8。将1号与其他SMFC对比,发现连有外阻的SMFC阳极上变形菌门的含量增多,这是由于闭路的SMFC能够产电,有利于此类产电菌繁殖。从纲水平对变形菌门进行细分,发现1号SMFC上Y-变形菌纲(Gammaproteobacteria)含量最多,为12.3%,其次是δ-变形菌纲(Deltaproteobacteria),为12.0%。在3-6号SMFC上δ-变形菌纲含量最高,分别为15.5%、13.5%、18.0%以及22.3%,一些研究认为δ-变形rong菌纲为SMFC阳极上的优势菌[21-22],这与文章结果一致,表明阳极上优势产电菌的生长繁殖有利于SMFC稳定运行。3号与4号,5号与6号SMFC对比结果表明不同阴极材料不会显著影响阳极上微生物的群落分布。对比3号与5号,4号与6号SMFC,观察到外电阻的不同对阳极上微生物的群落分布影响较小,这可能是由于启动期间外接电阻相同,启动后各SMFC阳极上的微生物群落趋于稳定,更换电阻对阳极微生物群落的影响较小。
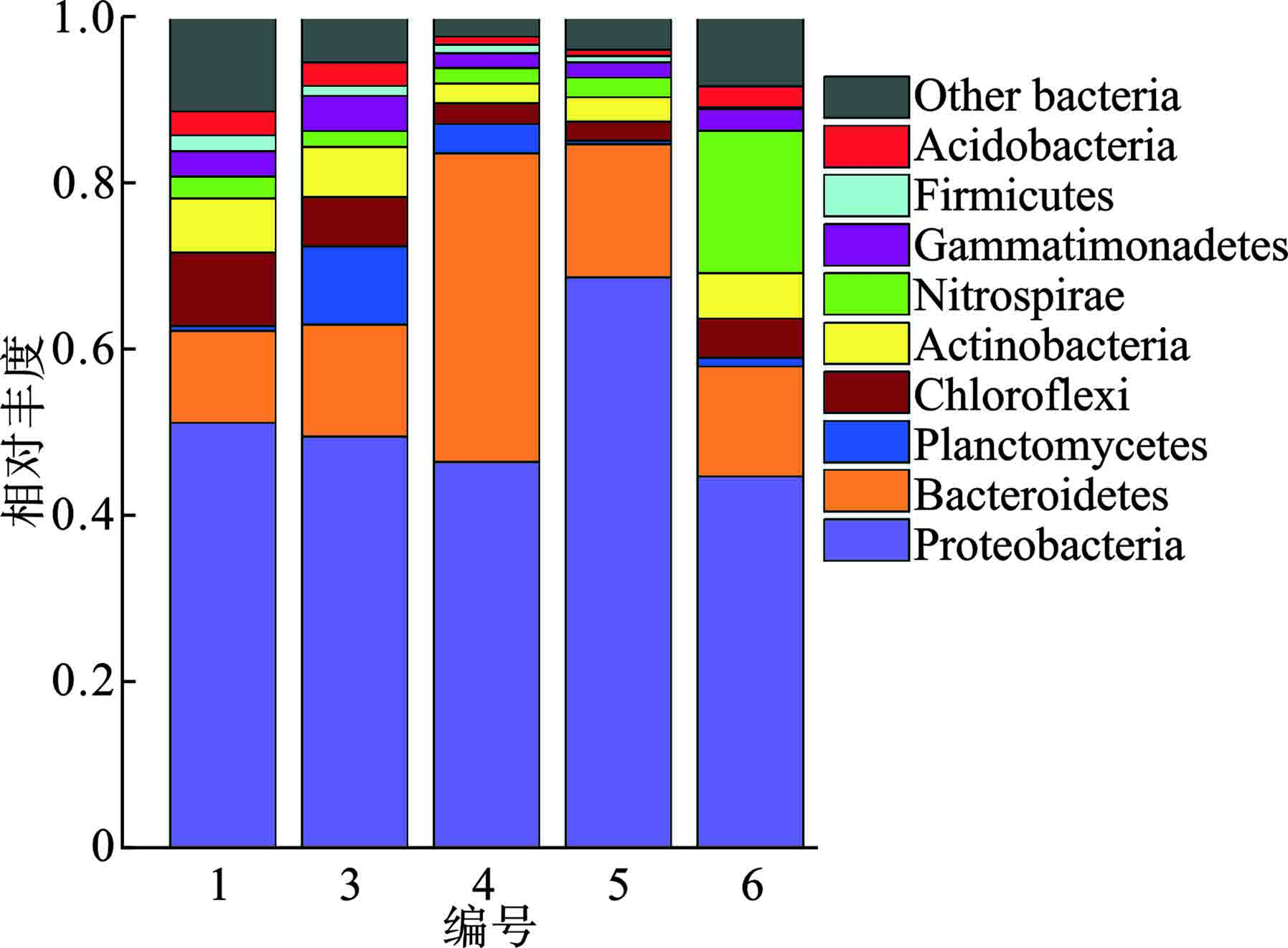
对阴极生物膜上的微生物群落进行分析,见图9。
基于门水平上分析,各个样品中变形菌门(Proteobacteria)含量最多,分别为51.1%、49.5%、46.4%、68.7%与44.7%。其次为拟杆菌门(Bacteroidetes),分别为11.1%、13.4%、37.2%、16.0%与13.2%,这与安众一[23]研究结果相似。本实验中Cr的去除率较低可能与阴极生物膜上厚壁菌门(Firmicutes)含量较低有关,说明厚壁菌门(Firmicutes)等与Cr(Ⅵ)还原相关的菌类含量越高越有利于阴极上Cr(Ⅵ)的还原[24]。
-
(1)底泥中的Cr(Ⅵ)主要是在阴极上被去除,阳极材料会对底泥中的Cr(Ⅵ)产生吸附作用,但吸附量较小。
(2)碳刷相较碳毡更有利于Cr(Ⅵ)的去除。外接电阻为1 000 Ω时,整个SMFC的输出电压较高,相较于外接电阻为100 Ω时,可产生更大的电驱动力,驱使更多的Cr(Ⅵ)从底泥中迁移到上覆水体中,有利于Cr(Ⅵ)的去除。
(3)SMFC在阴极去除Cr(Ⅵ)的同时可在阳极去除底泥中的有机质。外接电阻为1 000 Ω时,SMFC可去除底泥中更多的有机质。
(4)SMFC阳极生物膜上部分产电菌含量较高,利于SMFC稳定运行。阴极区域由于营养物质缺乏,导致阴极微生物膜上部分与Cr(Ⅵ)还原相关的菌类,如厚壁菌门(Firmicutes)含量较低,不利于Cr(Ⅵ)的还原,使阳极底泥中Cr(Ⅵ)去除率较低。
沉积型微生物燃料电池对污染底泥中重金属Cr(Ⅵ)去除的研究
Research of heavy metal Cr(Ⅵ) removal in contaminated sediment by sediment microbial fuel cells
-
摘要: 文章探究了沉积型微生物燃料电池(sediment microbial fuel cells, SMFC)对阳极底泥中Cr(Ⅵ)的去除效果。通过设置对照试验,比较不同阴极材料、不同外接电阻对Cr(Ⅵ)去除的影响,探究底泥中Cr(Ⅵ)的去除机制。结果表明:底泥中Cr的去除主要发生在阴极上,其主要机制为 Cr(Ⅵ)从阳极迁移到阴极,并在阴极上作为电子受体被还原成Cr(Ⅲ);当阴极为碳刷,外电阻为1 000 Ω时,底泥中Cr的去除率最高,为27.4%。当阴极为碳毡,外电阻为100 Ω时,底泥中Cr的去除率只有10.5%,但其都大于自然状态下底泥中Cr的去除率; SMFC在阴极去除Cr(Ⅵ)的同时可在阳极去除底泥中的有机质。因此用SMFC来去除Cr等重金属的方法值得进一步研究。
-
关键词:
- 沉积型微生物燃料电池 /
- 重金属去除 /
- 铬 (Ⅵ)
Abstract: This article mainly investigates the removal effect of sediment microbial fuel cells (SMFC) on Cr(Ⅵ) in the anode sediment. According to the comparison experiment, the effects of different cathode materials and different external resistances on the removal of Cr(Ⅵ) and the mechanism of Cr(Ⅵ) removal in sediments are analyzed. The results show that the removal of Cr in the sediment mainly occurs on the cathode, and the main mechanism is that Cr(Ⅵ) migrates from the anode to the cathode. Cr(Ⅵ) is reduced to Cr(Ⅲ) as an electron acceptor on the cathode. The removal rate of Cr is the highest with the carbon brush cathode and a 1 000 Ω external resistance, and the rate is 27.4%. When the cathode is carbon felt and the external resistance is 100 Ω, the removal rate is only 10.5%. However, they are greater than the removal rate of Cr under natural conditions. SMFC can also remove the organic matters in the anode sediment. Therefore, the method of using SMFC to remove heavy metals such as Cr is worthy of a further study.-
Key words:
- sediment microbial fuel cell /
- removal of heavy metal /
- Cr(Ⅵ)
-

-
表 1 对照试验各参数
组别 阳极材料 阴极材料 外接电阻 1 碳毡 碳毡 开路 2 碳毡 碳刷 开路 3 碳毡 碳毡 1 000 Ω 4 碳毡 碳刷 1 000 Ω 5 碳毡 碳毡 100 Ω 6 碳毡 碳刷 100 Ω -
[1] 蒲思川, 冯启明. 我国水体污染的现状及防治对策[J]. 中国资源综合利用, 2008, 26(5): 31 − 34. doi: 10.3969/j.issn.1008-9500.2008.05.014 [2] 陈华林, 陈英旭. 污染底泥修复技术进展[J]. 农业环境保护, 2002, 21(2): 179 − 182. [3] SOWERS K R, MAY H D. In situ treatment of PCBs by anaerobic microbial dechlorination in aquatic sediment: are we there yet?[J]. Current Opinion in Biotechnology, 2013, 24(3): 482 − 488. doi: 10.1016/j.copbio.2012.10.004 [4] FERRARESE E, ANDREOTTOLA G, OPREA I A. Remediation of PAH-contaminated sediments by chemical oxidation[J]. Journal of Hazardous Materials, 2008, 152(1): 128 − 139. doi: 10.1016/j.jhazmat.2007.06.080 [5] 许炼烽, 邓绍龙, 陈继鑫, 等. 河流底泥污染及其控制与修复[J]. 生态环境学报, 2014, 23(10): 1708 − 1715. doi: 10.3969/j.issn.1674-5906.2014.10.021 [6] SONG T, YAN Z, ZHAO Z, et al. Construction and operation of freshwater sediment microbial fuel cell for electricity generation[J]. Bioprocess and Biosystems Engineering, 2011, 34(5): 621 − 627. doi: 10.1007/s00449-010-0511-x [7] REIMERS C E, TENDER L M, FERTIG S, et al. Harvesting energy from the marine sediment− water interface[J]. Environmental Science & Technology, 2001, 35(1): 192 − 195. [8] LI H, HE W, QU Y, et al. Pilot-scale benthic microbial electrochemical system (BMES) for the bioremediation of polluted river sediment[J]. Journal of Power Sources, 2017, 356: 430 − 437. doi: 10.1016/j.jpowsour.2017.03.066 [9] HAN L, LIU R, LI M, et al. Construction of a self-powered system for simultaneous in situ remediation of Nitrate and Cr(VI) contaminated synthetic groundwater and river sediment[J]. Sustainability, 2018, 10(8): 2806. doi: 10.3390/su10082806 [10] WANG Z, LIU Y, LI K, et al. The influence and mechanism of different acid treatment to activated carbon used as air-breathing cathode catalyst of microbial fuel cell[J]. Electrochimica Acta, 2017, 246: 830 − 840. doi: 10.1016/j.electacta.2017.05.086 [11] WANG A, CHENG H, REN N, et al. Sediment microbial fuel cell with floating biocathode for organic removal and energy recovery[J]. Frontiers of Environmental Science & Engineering, 2012, 6(4): 569 − 574. [12] WANG X, GAO N, ZHOU Q, et al. Acidic and alkaline pretreatments of activated carbon and their effects on the performance of air-cathodes in microbial fuel cells[J]. Bioresource Technology, 2013, 144: 632 − 636. doi: 10.1016/j.biortech.2013.07.022 [13] LIU Z, DESANTIS T Z, ANDERSEN G L, et al. Accurate taxonomy assignments from 16S rRNA sequences produced by highly parallel pyrosequencers[J]. Nucleic Acids Research, 2008, 36(18): e120. doi: 10.1093/nar/gkn491 [14] WANG Y, QIAN P Y. Conservative fragments in bacterial 16S rRNA genes and primer design for 16S ribosomal DNA amplicons in metagenomic studies[J]. PLoS One, 2009, 4(10): e7401. doi: 10.1371/journal.pone.0007401 [15] BAKER G C, SMITH J J, COWAN D A. Review and re-analysis of domain-specific 16S primers[J]. Journal of Microbiological Methods, 2003, 55(3): 541 − 555. doi: 10.1016/j.mimet.2003.08.009 [16] PEIRAVI M, MOTE S R, MOHANTY M K, et al. Bioelectrochemical treatment of acid mine drainage (AMD) from an abandoned coal mine under aerobic condition[J]. Journal of Hazardous Materials, 2017, 333: 329 − 338. doi: 10.1016/j.jhazmat.2017.03.045 [17] KIM C, LEE C R, SONG Y E, et al. Hexavalent chromium as a cathodic electron acceptor in a bipolar membrane microbial fuel cell with the simultaneous treatment of electroplating wastewater[J]. Chemical Engineering Journal, 2017, 328: 703 − 707. doi: 10.1016/j.cej.2017.07.077 [18] KATURI K P, SCOTT K, HEAD I M, et al. Microbial fuel cells meet with external resistance[J]. Bioresource Technology, 2011, 102(3): 2758 − 2766. doi: 10.1016/j.biortech.2010.10.147 [19] JADHAV G S, GHANGREKAR M M. Performance of microbial fuel cell subjected to variation in pH, temperature, external load and substrate concentration[J]. Bioresource Technology, 2009, 100(2): 717 − 723. doi: 10.1016/j.biortech.2008.07.041 [20] SAJANA T K, GHANGREKAR M M, MITRA A. Effect of operating parameters on the performance of sediment microbial fuel cell treating aquaculture water[J]. Aquacultural Engineering, 2014, 61: 17 − 26. doi: 10.1016/j.aquaeng.2014.05.004 [21] HOLMES D E, BOND D R, O NEIL R A, et al. Microbial communities associated with electrodes harvesting electricity from a variety of aquatic sediments[J]. Microbial Ecology, 2004, 48(2): 178 − 190. doi: 10.1007/s00248-003-0004-4 [22] EWING T, HA P T, BABAUTA J T, et al. Scale-up of sediment microbial fuel cells[J]. Journal of Power Sources, 2014, 272: 311 − 319. doi: 10.1016/j.jpowsour.2014.08.070 [23] 安众一. 微生物电化学系统利用重金属离子产电特性研究[D]. 哈尔滨: 哈尔滨工业大学, 2015. [24] HABIBUL N, HU Y, WANG Y, et al. Bioelectrochemical Chromium(VI) removal in plant-microbial fuel cells[J]. Environmental Science & Technology, 2016, 50(7): 3882 − 3889. -



 下载:
下载: