-
生物炭是一种由生物质在无氧条件下高温热解制成的富碳材料,具有环保、固碳、提升肥力等多重功能,因此近年来在污染控制、土壤改良和生物能源等多个领域有着广泛应用[1 − 3]. 生物炭独特的孔隙结构能够增加土壤表面积,提高土壤保水能力,改善土壤团聚体结构,为微生物提供优良的生存环境,其自身含有的氮、磷等营养成分,还可以为农作物提供养分[4]. 此外,生物炭还具有丰富的含氧官能团、芳香结构和比表面积,可以通过π-π-电子供体-受体相互作用(π-π-EDA)、氢键、孔隙填充、静电吸附和疏水性分配作用等去除环境中的有机污染物[5 − 6]. 近年来研究表明,生物炭不仅能吸附固定污染物,还能利用自身的氧化还原活性降解部分有机污染物[7]. 例如,其含氧官能团和持久性自由基可将电子传递给O2生成活性氧自由基(ROS),从而直接或间接地促进对硝基苯酚(p-nitrophenol,PNP)等有机污染物的降解[8 − 9];或者作为催化剂参加高级氧化反应(AOP)降解废硫酸中含有的有机物[10]和磺胺甲恶唑[11].
O2是生物炭间接降解有机污染物的重要因素之一. 生物炭表面的氧化还原活性基团可以将电子传递给O2,实现单电子或多电子传递两种不同的降解途径. 单电子传递途径是指生物炭上释放出来的电子被激发态单线态氧(O1)捕获并生成超氧阴离子(·O2−),·O2−可以将PNP还原成对氨基苯酚(p-aminophenol,PAP)[12]. 多电子传递途径是指激发态O1得到两个电子生成H2O2,H2O2在生物炭催化作用下生成羟基自由基(·OH),·OH具有强氧化性能将PNP完全氧化成CO2和NO3−[13 − 14]. 此外,O2不仅是生物炭间接降解污染物的重要电子受体,也是影响生物炭直接降解污染物效率的关键因素. 一方面,O2可以与生物炭表面的活性基团发生电子传递反应,生成活性氧自由基介导污染物的氧化降解. 另一方面,O2也会竞争性地吸附在生物炭表面,减少生物炭对污染物的吸附量和直接还原作用[15]. 因此,在评估生物炭对有机污染物的降解能力时,不能忽视其活性位点对直接还原过程的贡献. 在没有光介导产生O1时,提高生物炭活性位点数量或暴露程度以增强对有机污染物的吸附效果也是提高其还原效率的有效方法之一,例如曾等指出Fe(Ⅲ)离子可以促进生物炭表面对污染物直接吸附作用,从而增强其直接还原效果[16].
一般来说,矿山废水中含有大量的金属离子和硫化物,这些物质在空气中氧化后会生成硫酸和金属盐,使得废水呈现强酸性[17]. 这类酸性矿山废水会对环境和生态造成严重的污染和破坏. 并且,含铁废水中的有机污染物处理更是难上加难. 因此,需要对酸性矿山废水进行有效的处理,如回收利用、浓缩、中和等方法[17]. 但这些方法过程复杂,成本高,效率低. 相比之下,生物炭是一种廉价的环境友好型功能材料,具有丰富的官能团、芳香烃和自由基等物质,能够转移出一个电子来催化高级氧化反应. 生物炭还可以有效地激活H2O2、S2O82−和O3等氧化剂,生成强氧化性能的羟基自由基(·OH)和超氧自由基(·O2− )等活性氧(ROS),可以快速无选择性地氧化降解大部分有机污染物[18 − 22]. 并且生物炭拥有较大的比表面积,对重金属离子有着极强的吸附固定作用. 因此生物炭在复杂环境中治理难降解有机污染物具有广泛的应用前景. 然而,在含金属离子和有机污染物的环境中使用生物炭时,金属离子对其降解效果可能产生影响. 本文以环境中普遍存在的三价铁离子(Fe(Ⅲ))为干扰因素,探讨Fe(Ⅲ)离子对生物炭降解典型农药成分对硝基苯酚(PNP)的影响机制. Fe(Ⅲ)可能通过以下途径影响生物炭降解PNP:(1)Fe(Ⅲ)离子可能竞争生物炭传递给O1的电子,导致有氧条件下,生物炭通过产生·O2−还原污染物的途径被屏蔽;(2)厌氧条件下,由于Fe(Ⅲ)阳离子的桥接作用,有可能促进了生物炭对污染物的直接还原作用;(3)被还原的Fe(Ⅱ)离子还可能通过芬顿作用直接促进污染物的降解. 此外,在含金属离子较多的环境中使用生物炭时还需考虑以下问题:生物炭表面含氧官能团可能会与金属离子形成稳定的络合物,并且含氧官能团与金属离子之间存在离子交换促进生物炭对于金属离子的吸附作用;另外金属离子还可能与生物炭产生的活性氧发生反应,消耗掉部分自由基,降低其对有机污染物的氧化作用. 那么在生物炭应用到含有大量Fe(Ⅲ)的有机污染物的土壤或水体中时,这些问题在生物炭的实际应用方面可能存在一定的风险,需要进一步研究和解决.
目前针对酸性条件下Fe(Ⅲ)离子和含氧量对生物炭降解有机污染物的影响机制仍缺乏系统研究,因此本研究比较了不同含氧条件下生物炭对有机污染物PNP的降解效果,探究了在不同含氧条件下存在Fe(Ⅲ)离子时,Fe(Ⅲ)离子对生物炭降解有机污染物的影响机制. 本研究揭示了生物炭与Fe(Ⅲ)离子、含氧量以及有机污染物之间的相互作用机制,为评估生物炭在酸性废水中去除有机污染物的潜力和范围提供了理论基础.
-
实验采用昆明市呈贡区某木材加工场的松木木屑作为本实验生物炭热解的原材料. 将收集的松木木屑使用粉碎装置粉碎成粉末,利用100目筛网对粉末进行筛分,再将筛下的粉末用容器收集起来置于60 ℃的烘箱中烘干12 h,烘干后用干燥的自封袋包装备用.
实验所用药品如下:六水合氯化铁(FeCl3·6H2O)、对硝基苯酚(PNP)、乙酸(CH3COOH)、盐酸(HCl)、1-10菲啰啉(无水)(C12H8N2)、乙酸钠(CH3COONa)、六水合硫酸亚铁铵((NH4)2Fe(SO4)2·6H2O)、浓硝酸(HNO3)、吡啶(C5H5N)和N,O-双(三甲基硅烷基)三氟乙酰胺(C8H18F3NOSi2)(BESTFA)这些样品均为分析纯,乙腈(CH3CN)、甲醇(CH4O)、正己烷(C6H14)和溴化钾(KBr)为色谱纯,购自Aladdin,按规定的标准使用.
-
生物炭在马弗炉(KSW,北京市永光明医疗仪器有限公司,中国)中热解烧制而成. 热解前先向马弗炉中通入30 min的N2以去除炉中O2. 然后以20 ℃·min−1的升温速率升温至500 ℃并保持4 h,在此期间持续通入N2. 反应结束后,继续通入N2直到马弗炉内温度降至60 °C以下,取出样品并标记为BC500. 本实验选择500 ℃作为热解温度,因为较低的温度可能导致生物炭碳化不完全,其表面酚类和醌类基团难以生成,而过高的温度可能导致生物炭内部有机结构的破坏和重组,从而导致自由基信号的消失[22].
-
BC500的C、N、H、S 和O等元素使用元素分析仪(vario MICRO cube,Germany)进行测定. 比表面积通过比表面积测定仪(BET,Micromeritics TriStar Ⅱ Plus 2.02,America)测定,称量 100 mg 左右生物炭固体粉末,放于机器内150 °C下脱气2 h,然后降温在液氮中测定[23]. 使用傅里叶变换红外光谱(Varian 640-IR,Thermo Fisher,America)测定反应前后BC500表面官能团. 将BC500和KBr按1:400均匀混合,于120 ℃烘干水分,在镁光灯下使用玛瑙研钵将混合样研磨均匀,对混合样品压片后进行测定,扫描步长为1 cm−1,扫描范围为400—4000 cm−1. 使用X射线光电子能谱仪(Thermo Scientific K-Alpha,America)测定有氧条件下反应前后BC500表面Fe(Ⅱ)、Fe(Ⅲ)和官能团的种类和含量. X射线源为单色Al K-alpha辐射阳极靶,测试区域为500 μm,步长0.05 eV,样品测定深度约为0.5—7.5 nm. 数据用Avantage校准,用XPSPEAK分峰拟合,得到C、O和Fe元素分布情况.
-
在无氧条件下,要求氧气含量低于0.3%. 为了研究Fe(Ⅲ)和BC500对PNP的降解效果,首先称取300 mg BC500放入15 mL安瓿瓶中,然后分别加入5 mL 10 mmol·L−1 Fe(Ⅲ)溶液和5 mL 800 mg·L−1 PNP溶液,用1 mol·L−1 HCl调节反应体系的pH值,并将安瓿瓶置于150 r·min−1的恒温振荡箱中反应48 h. 在无铁实验中,改变PNP溶液的浓度为400 mg·L−1,并加入10 mL. 反应结束后,在3500 r·min−1下离心5 min,取上清液测定PNP残留量. 取完上清液后称量并记录安瓿瓶的质量,以便计算瓶中未被取出的PNP量. 对生物炭残渣用乙腈萃取吸附态PNP,每次加入10 mL乙腈并振荡2 h,重复萃取至少5次,萃取出PNP总量即为BC500总吸附量,降解量为总添加量与总吸附量和残留量的差值. 所有操作均在厌氧手套箱内完成.
在有氧实验条件下进行相同的实验步骤. 不同Fe(Ⅲ)浓度对BC500降解PNP的影响实验使用现配现用的浓度梯度为2.8—280 mg·L−1的Fe(Ⅲ)溶液,PNP的初始浓度为800 mg·L−1. 生物炭对不同浓度梯度PNP的降解实验中,PNP降解浓度分别为200、400、800、1200 mg·L−1,如果加入Fe(Ⅲ),则将PNP溶液的初始浓度提高1倍,并与Fe(Ⅲ)溶液等体积混合. 所有实验均用1 mol·L−1 HCl将pH值调为2.5. 每组实验设置3组平行,并以平均值表示数据.
-
反应后液相残留和BC500表面萃取所得PNP浓度用高清液相色谱仪(HPLC, Agilent Technologies 1260)测定. 紫外检测器波长设定为318 nm,流动相为甲醇: 水: 乙酸=70:29.8:0.2,流速1 mL·min−1,进样量10 μL,单个测样时间6 min[15].
用1-10菲罗啉比色法测定反应体系液相中的Fe(Ⅱ),先离心样品取上清液0.5 mL放入40 mL安瓿瓶中,并加乙酸-乙酸钠缓冲溶液5 mL以防水解,然后加入0.5 mL 1-10菲啰啉溶液,用紫外可见分光光度计(UV-2600,日本岛津公司)在510 nm处测定吸光度求出Fe(Ⅱ)含量. 在测定Fe(Ⅱ)浓度之前,配置不同浓度梯度Fe(Ⅱ)溶液作为标线,Fe(Ⅱ)的浓度根据吸光度与标准曲线所得方程算出. 液相中总铁浓度用火焰原子吸收光谱仪(ZA-2000,日本日立公司)测定. 样品离心后,取0.5 mL上清液加入到40 mL透明安瓿瓶中,加入0.5 mL浓硝酸进行酸化,稀释60倍测定总铁浓度. 在上机测定前,配置不同浓度的Fe(Ⅲ)溶液作为标线,总铁浓度由标线计算所得. 溶液中的Fe(Ⅲ)浓度为总铁与Fe(Ⅱ)浓度的差值.
-
在有氧条件下测定了PNP与BC500的反应产物,PNP初始浓度为800 mg·L−1. 反应2 d后取出上清液在氮气流下蒸干,并用90 μL吡啶和10 μL BESTFA对样品进行衍生化处理. 在60 ℃下反应15 min后,将样品装入1.5 mL的液相小瓶中,用气相色谱-质谱联用仪(GC/MS,7890A-5975C,Agilent,USA)进行分析. 气相色谱柱在80 ℃保持2 min后以2 ℃·min−1的升温速率升温至180 ℃. 其他参数如下: EI碰撞电离为70 eV;载气为氦气;注射温度280 ℃;源温度为100 ℃. 用NIST 17库对检测到的产物进行鉴定. 并根据分子量推测产物[15,24].
-
松木木屑原生质与BC500的理化性质如表1所示. BC500的H/C比原生质低了1.25,表明其芳香性更强[25]. BC500的(O+N)/C值较原生质低了0.37,表明其极性更弱,憎水性更强[26]. 此外,BC500的比表面积达到了351.90 m2·g−1,孔体积为0.83 cm3·g−1,孔径为10.34 nm,这有利于生物炭对污染物的吸附[27].
-
O2在生物炭降解有机污染物过程中起着重要作用. 一方面,O2能够接受生物炭释放的电子,生成ROS来降解有机污染物;另一方面,O2也可能占据生物炭表面的活性位点,影响生物炭对污染物的吸附效果. 为了探究O2对BC500降解PNP的影响,本研究在无Fe(Ⅲ)条件下进行了有氧和无氧两种实验,结果如图1(a)所示. 结果表明,在无氧条件下,PNP的降解量仅为0.68 mg·g−1BC,这主要归因于BC500对PNP的直接降解作用;在有氧条件下,PNP的降解量增加到0.92 mg·g−1BC,为无氧条件下的1.35倍,表明O2能够促进BC释放电子生成ROS来降解有机污染物,这一结果与Li等的研究结果一致[28]. 通过GC-MS检测了PNP的降解产物,并发现对氨基苯酚(PAP)是PNP主要的还原产物(图1(b)),进一步证实了BC500对PNP具有直接还原作用[12].
为了探究Fe(Ⅲ)在BC500降解PNP过程中的作用机制,本研究在有氧条件下加入Fe(Ⅲ)离子后测定了BC500对PNP的降解量,并将其与有氧条件下无Fe(Ⅲ)离子时的降解量进行了比较. 如图1(a)所示,在有氧条件下加入Fe(Ⅲ)后,PNP的降解量为0.45 mg·g−1BC,低于无Fe(Ⅲ)时(0.92 mg·g−1BC)的降解量,这表明Fe(Ⅲ)在酸性有氧下能够抑制BC500对PNP的降解效果. 这是因为低pH下Fe(Ⅲ)的氧化还原电位高,而BC500表面丰富的含氧官能团能与Fe(Ⅲ)离子以配位键形式形成螯合物[29],同时还可能把电子传递给Fe(Ⅲ)生成Fe(Ⅱ),导致BC500能够给出的电子被Fe(Ⅲ)捕获,而不能进一步传递给O1生成ROS降解PNP.
此外,本研究还探究了在无氧条件下加入Fe(Ⅲ)后BC500对PNP的降解量与无Fe(Ⅲ)时的降解量. 如图1(a)所示,在无氧有Fe(Ⅲ)时,PNP的降解量达到1.79 mg·g−1BC,显著高于无Fe(Ⅲ)时(0.68 mg·g−1BC)的降解量. 这表明在无氧条件下Fe(Ⅲ)能够增强生物炭对PNP的降解效果. 这是因为在无氧条件下,Fe(Ⅲ)可以通过阳离子桥接作用与BC500表面形成复合体,从而拉近PNP与BC500之间的距离,使得生物炭上电子能够直接传递给污染物而实现其还原[30].
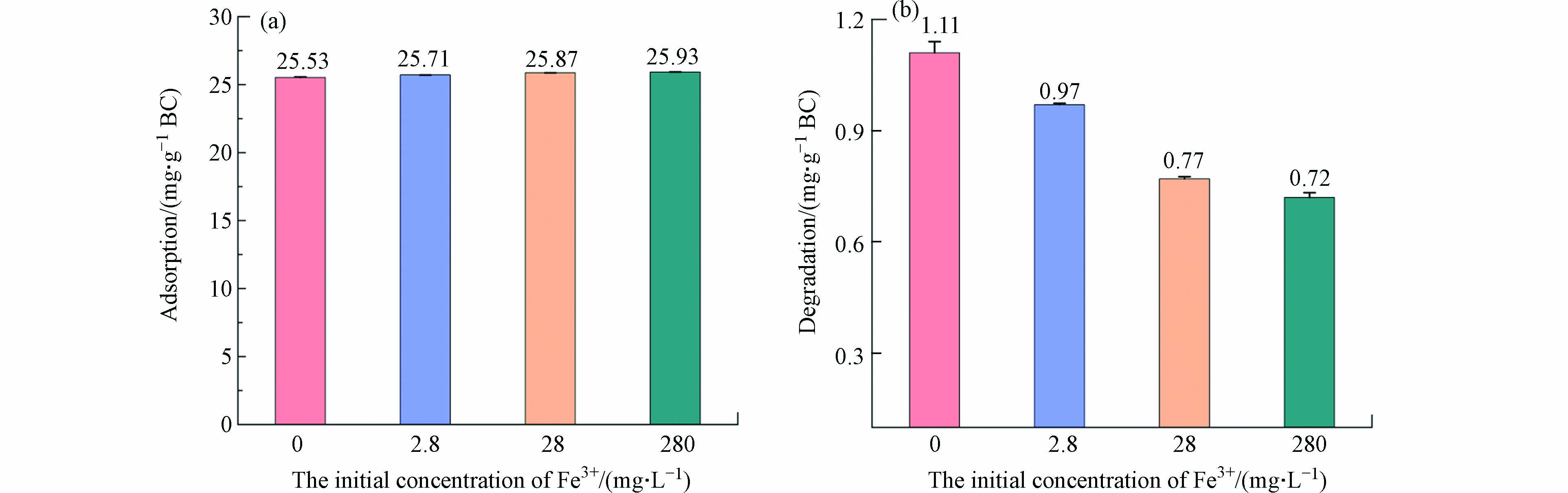
为了进一步明确有氧条件下Fe(Ⅲ)对BC500降解PNP的抑制效果,本研究在酸性条件下加入0—280 mg·L−1Fe(Ⅲ),并观察BC500对800 mg·L−1PNP的降解量变化. 结果如图2所示,随着Fe(Ⅲ)浓度的增加,BC500对PNP的降解量呈明显的下降趋势,从1.11 mg·g−1BC减少到0.72 mg·g−1BC,这表明Fe(Ⅲ)对BC500降解PNP有明显的抑制作用. 前人研究表明,Fe(Ⅲ)在酸性条件下得电子生成Fe(Ⅱ)的标准电极电势为0.771 V,O2在酸性条件下得电子生成H2O2的标准电极电势为0.695 V[31]. 因此,在酸性体系中,Fe(Ⅲ)更容易从BC500上获得电子,并与O2形成竞争作用,导致体系中·O2−和·OH的生成量减少,从而抑制了PNP的降解量. 结果表明,随着Fe(Ⅲ)浓度的增加,其与O2形成的电子竞争作用就越强,但随着Fe(Ⅲ)浓度的增加,PNP降解量逐渐趋于平稳,这表明BC500能够给出的电子已被O2和Fe(Ⅲ)耗尽,因此即使继续升高溶液中Fe(Ⅲ)离子浓度也不会进一步抑制PNP的降解. 此外,Fe(Ⅲ)还会与PNP争夺吸附位点或形成络合物降低吸附性能,间接影响降解效果[32].
-
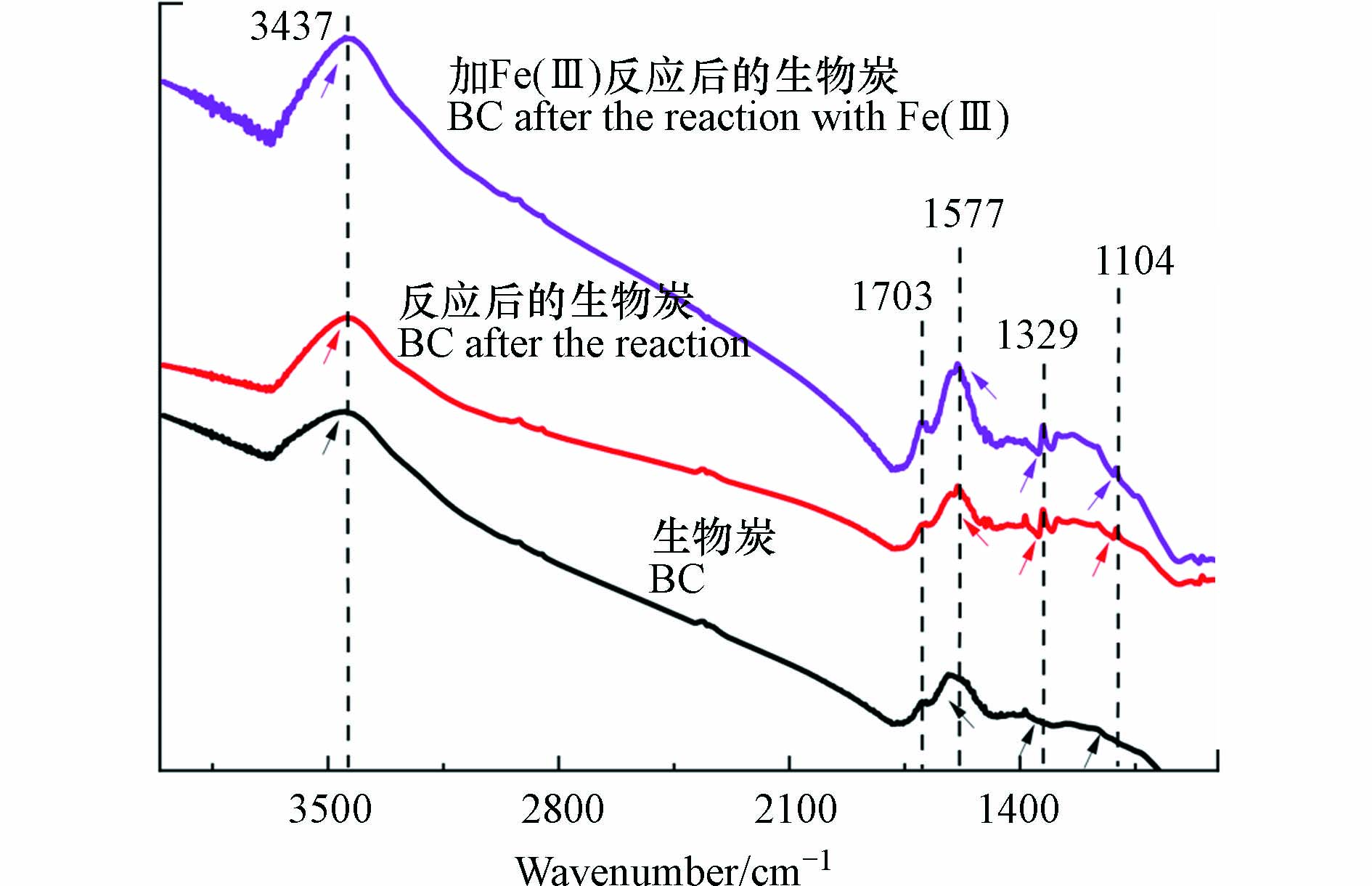
本研究通过分析BC500上官能团的差异探究BC500表面含氧官能团与不同条件下PNP降解量的关系,图3显示了BC500及其在有Fe(Ⅲ)和无Fe(Ⅲ)的有氧条件下与PNP反应后的FT-IR光谱. 从图中可以看出,在3437、1703、1577、1329 cm−1以及1104 cm−1处分别出现了—OH、C=O、C=C和C—O的振动拉伸峰[33]. BC500与PNP反应后,BC500表面吸附了PNP,导致C=C(1577 cm−1)的振动拉伸峰增强. 在加入Fe(Ⅲ)后,代表—OH(3437 cm−1)和C=C(1577 cm−1)的峰强度明显增强,表明吸附在BC500表面的Fe(Ⅲ)通过配合作用桥接了PNP,这也说明Fe(Ⅲ)的加入可提高PNP在BC500上的吸附效果[34].
-
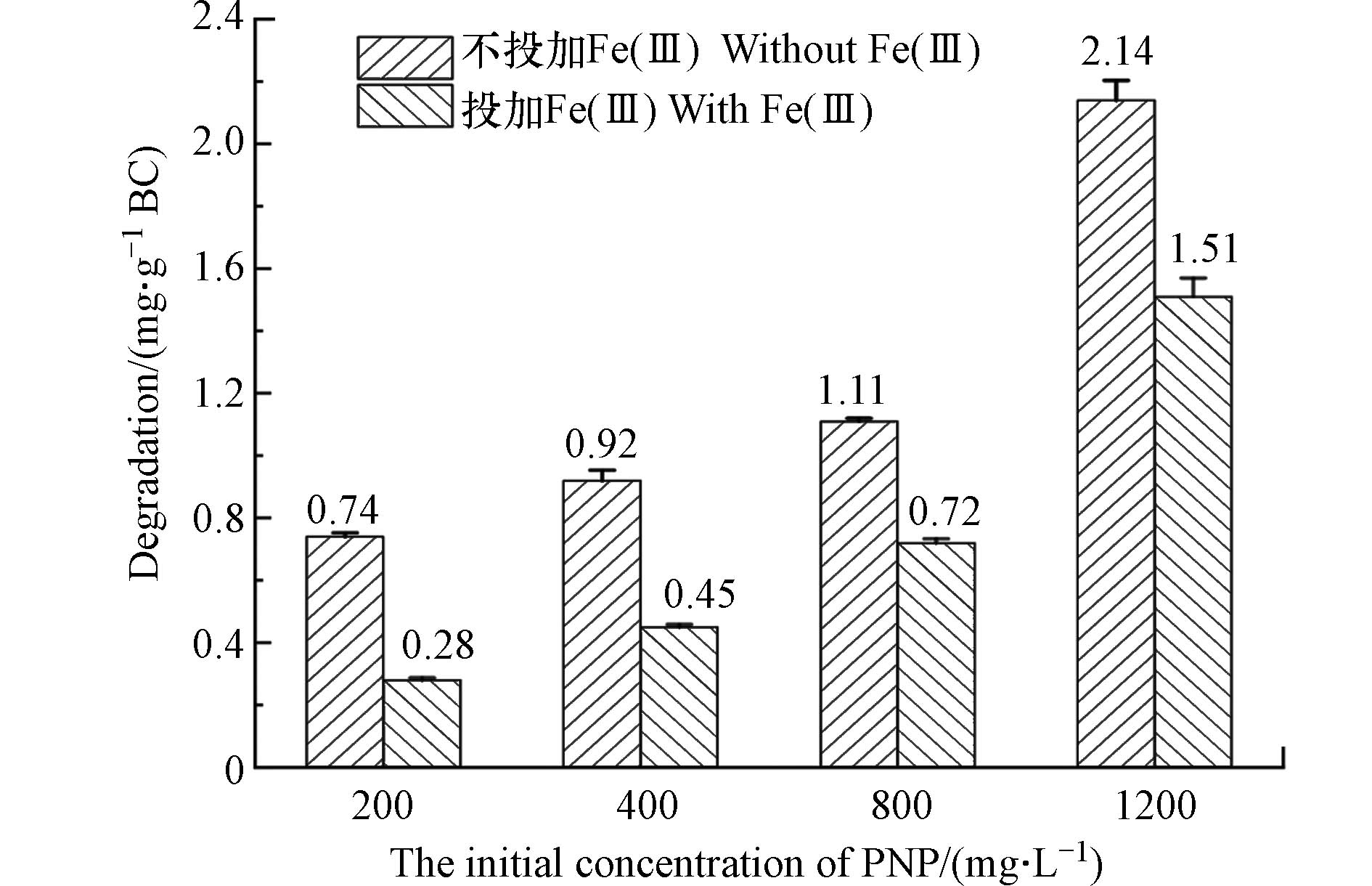
如图4所示,BC500对不同初始浓度PNP(0—1200 mg·L−1)的降解率随PNP浓度的升高而增加,在280 mg·L−1Fe(Ⅲ)的存在下,BC500对PNP的降解也呈上升趋势,但不同初始浓度下PNP的降解量均受到了抑制. 在PNP低浓度下,Fe(Ⅲ)对生物炭的抑制作用明显,PNP浓度为200 mg·L−1时,Fe(Ⅲ)抑制了接近64%的降解. 而当PNP的初始浓度从400 mg·L−1上升到1200 mg·L−1时,Fe(Ⅲ)对PNP降解的抑制程度从54%下降为30%. 这是因为,随着PNP的浓度增加,显著提高了BC500与PNP的直接接触几率,从而提高了BC500对PNP的直接降解作用,这一结果也从另一个角度证实了PNP与Fe(Ⅲ)离子的形成的竞争关系.
-
图5显示了在有氧条件下,BC500和Fe(Ⅲ)离子协同降解不同浓度PNP后,Fe(Ⅲ)和Fe(Ⅱ)离子在生物炭表面的吸附含量变化. 结果表明,随着PNP浓度的增加,生物炭表面的Fe(Ⅱ)占比呈下降趋势,从25.62%下降到17.19%;而Fe(Ⅲ)比例逐渐增加,从74.38%上升到82.81%. 这表明高浓度PNP会沉积在BC500表面,覆盖活性位点,降低BC500的电子转移效率,增强了PNP对BC500上电子的竞争能力,导致Fe(Ⅲ)得电子数量减少,相应地BC500表面生成的Fe(Ⅱ)也减少[35 − 37].
表2显示了BC500、BC500和Fe(Ⅲ)以及BC500和Fe(Ⅲ)与PNP在厌氧和有氧条件下反应后的C—O、C=O以及Fe—O含量. 当反应体系中没有PNP时,有氧条件下加入Fe(Ⅲ)离子后,生成了12.78%的Fe—O键,而C=O含量明显降低,这表明BC500与Fe(Ⅲ)之间发生了螯合作用[34],使Fe(Ⅲ)被稳定在BC500表面. 从表中还可以看出,无氧状态较有氧状态生成的Fe—O多7.8%,这是因为氧气的存在会抑制BC500对Fe(Ⅲ)离子的吸附作用. 氧气的化学吸附会增加生物炭表面的亲水性,水分子通过氢键聚集在生物炭极性官能团周围,从而减少了可用于吸附的表面积和孔体积[15,38 − 40]. 在表3中,有氧条件下溶液中总Fe含量高于无氧条件下的总Fe含量也证实了这一结论. 此外,Fe(Ⅲ)在BC500的作用下被还原为Fe(Ⅱ),降低了与PNP螯合的能力,提高了还原性,这也使得由Fe(Ⅱ)/Fe(Ⅲ)桥接的PNP更容易被直接降解,进一步证明了厌氧条件下加入Fe(Ⅲ)后对污染物的降解效果更好.
另外,在有氧和无氧条件下,加入PNP后, Fe—O在官能团中的比例均有所减少,尤其是无氧条件下降较为明显,这是因为PNP会与生物炭中的含氧官能团发生反应,从而减少Fe—O键的生成量[41]. 表3显示对PNP降解是C=O含量均有所下降,而生物炭的降解与其表面的醌基团(C=O)有着紧密的关联[42 − 43]. 因此这也证实了Fe—O键减少跟含氧官能团的变化有着密切的关系.
-
表3显示了不同价态铁离子在固液两相中的分布. 结果显示,无氧条件下,液相中只存在Fe(Ⅲ),这表明BC500通过螯合作用将Fe(Ⅲ)吸附在表面,其表面含氧官能团将Fe(Ⅲ)还原成Fe(Ⅱ)后将其固定在表面. 有氧条件下,O2抑制了Fe(Ⅲ)的还原和吸附,导致溶液中Fe(Ⅲ)和Fe(Ⅱ)含量增加,固相中Fe含量减少,这说明了BC500对不同价态的吸附机制.
在有氧条件下,虽然Fe(Ⅱ)含量低,但Fe(Ⅱ)在有O2存在的条件下可以活化O2促进·OH自由基的形成,涉及反应有以下几个反应式[30].
然而实验结果表明,在有Fe(Ⅱ)和O2的存在下PNP降解仍然受到抑制,这是因为,在pH值为酸性的条件下,反应式(4)和(6)反应速率极低[44 − 45],Fe(Ⅱ)很难与O2反应生成·O2−,或发生芬顿反应. Fe(Ⅱ)含量在O2的作用下易被氧化为Fe(Ⅲ),进一步消耗活性氧降解途径中重要的中间体O2,导致生物炭对PNP的降解受到明显抑制.
-
本研究探究了在酸性条件下氧含量对BC500降解PNP的影响机制,以及Fe(Ⅲ)离子在有氧和无氧反应体系中的作用. 主要结论如下:
(1)BC500对PNP的降解包括BC500的直接降解作用和氧气介导生成活性氧自由基的间接降解作用.
(2)FTIR和XPS等表征表明,BC500丰富的含氧官能团可以和Fe(Ⅲ)形成稳定的螯合物. 在有氧条件下,Fe(Ⅲ)与O2形成电子竞争,减少ROS的产量,从而抑制PNP的降解.
(3)在无氧条件下,Fe(Ⅲ)增强了BC500对PNP的吸附能力,促进了BC500对PNP的直接降解作用.
综上所述,在酸性废水中,有氧条件下,生物炭可以通过给出电子生成活性氧自由基的方式降解污染物;在无氧条件下,生物炭可以通过与金属阳离子形成螯合物提高直接电子转移效率,促进生物炭对污染物的直接讲解作用.
氧含量和Fe(Ⅲ)对生物炭降解对硝基苯酚的影响机制
Effect mechanism of oxygen content and Fe(Ⅲ) on biochar degradation on P-nitrophenol
-
摘要: 生物炭因其丰富的比表面积和独特的理化性质在污染物治理方面具有广泛的应用潜力,但其降解污染物过程受环境因素影响的机制尚不清楚. 本文以松木木屑为原料制备松木生物炭(BC500),探讨了氧气和Fe(Ⅲ)离子对BC500降解有毒有机农药对硝基苯酚(PNP)的影响. 结果表明,在酸性有氧条件下,BC500对PNP的降解量是无氧条件的1.35倍,这表明除了自身直接降解作用外,生物炭还能通过氧气介导生成活性氧自由基间接降解PNP. 此外,通过XPS、AAS 和 FTIR等表征显示,在有氧条件下,不同浓度的Fe(Ⅲ)离子(2.8—280 mg·L−1)对BC500降解PNP均起抑制作用. 这是由于Fe(Ⅲ)离子在环境pH较低时具有较强的氧化能力,通过竞争BC500传递给氧气的电子导致超氧阴离子(·O2−)生成途径被屏蔽. 而在无氧条件下加入Fe(Ⅲ)则促进了PNP降解,从0.68 mg·g−1 BC增加到1.79 mg·g−1 BC,因为Fe(Ⅲ)能增强BC500对PNP的吸附,并进一步促进其直接降解作用. 结果表明,BC500施用于酸性含铁废水中时,无氧环境更利于PNP的降解,而有氧环境下Fe(Ⅲ)会抑制PNP的降解. 本研究为生物炭应用于酸性含铁废水环境中的有机污染物治理提供了理论依据.Abstract: Biochar has wide application potential in pollutant control due to its rich specific surface area and unique physicochemical properties, but the mechanism of its degradation process affected by environmental factors is unclear. In this paper, pine biochar (BC500) was prepared from pine wood chips, and the effects of oxygen and Fe(Ⅲ) ions on BC500’s degradation of toxic organic pesticides and nitrophenol (PNP) were discussed. The results showed that under acidic aerobic conditions, the degradation of PNP by BC500 was 1.35 times that of anaerobic conditions, which indicated that in addition to its own direct degradation, biochar could also indirectly degrade PNP through oxygen-mediated formation of reactive oxygen radicals. In addition, characterization by XPS, AAS and FTIR showed that under aerobic conditions, Fe(Ⅲ) ions at different concentrations (2.8—280 mg· L−1) inhibited the degradation of PNP by BC500. This is due to the strong oxidation capacity of Fe(Ⅲ) ions at low ambient pH, and the electrons transferred to oxygen by competing BC500 cause the superoxide anion(·O2−) production pathway to be shielded. The addition of Fe(Ⅲ) under oxygen-free conditions promoted PNP degradation, from 0.68 mg·g−1 BC to 1.79 mg·g−1 BC, because Fe(Ⅲ) could enhance the adsorption of PNP by BC500 and further promote its direct degradation. The results showed that when BC500 was applied to acidic iron-containing wastewater, the anaerobic environment was more conducive to the degradation of PNP, while Fe(Ⅲ) inhibited the degradation of PNP in the aerobic environment. This study provides a theoretical basis for the application of biochar to the treatment of organic pollutants in acidic iron-containing wastewater environment.
-
Key words:
- p-nitrophenol /
- redox degradation /
- sawdust biochar /
- acidic wastewater.
-

-
表 1 木屑原生质和BC500的理化性质
Table 1. The characteristic of wood chips protoplasm and BC500
材料
Materials元素组成(V/V)/%
Elemental composition原子比
Atomic ratio灰分/%
Ash比表面积/(m2·g−1)
SSApH N C H O H/C (O+N)/C 木屑 0.16 50.07 6.97 41.19 1.67 0.62 0.89 — — BC500 0.38 79.57 2.78 15.85 0.42 0.15 3.18 315.90 8.02 表 2 BC500、BC500+Fe(Ⅲ)、BC500+Fe(Ⅲ)+PNP在厌氧和有氧条件下反应后C—O、C=O、Fe—O含量(%)
Table 2. C—O、C=O and Fe—O contents of BC500、BC500 reacting with Fe(Ⅲ) and BC500 reacting with PNP in the presence of Fe(Ⅲ) under oxygen-limited and anaerobic conditions(%)
无氧
No Oxygen有氧
Limited OxygenBC500 BC500+Fe(Ⅲ) BC500+Fe(Ⅲ)+PNP BC500 BC500+Fe(Ⅲ) BC500+Fe(Ⅲ)+PNP C—O 36.20 42.05 53.38 45.05 44.18 45.99 C=O 63.80 37.38 32.80 54.95 43.03 42.69 Fe—O — 20.58 13.82 — 12.78 11.32 表 3 在有氧和厌氧条件下BC500+Fe(Ⅲ)及PNP+BC500+Fe(Ⅲ)反应后液相和固相中Fe种类的比例(%)
Table 3. The proportion of Fe species in liquid and solid phases after the reaction of BC500 with Fe(Ⅲ) under oxygen-limited and anaerobic conditions and after the reaction of BC500 with Fe(Ⅲ) in the presence of PNP(%)
有氧
Limited oxygen无氧
No oxygenBC500+Fe(Ⅲ) BC500+Fe(Ⅲ)+PNP BC500+Fe(Ⅲ) BC500+Fe(Ⅲ)+PNP 液相 Fe(Ⅱ) 38.67 14.04 0 1.79 Fe(Ⅲ) 36.52 63.96 30.00 36.31 固相 Fe(Ⅱ) 11.97 5.55 30.62 29.11 Fe(Ⅲ) 12.19 16.11 38.77 32.08 -
[1] LEHMANN J, JOSEPH S. Biochar for environmental management: science, technology and implementation[M]. New York: Routledge, 2015. [2] 李经涵, 张建强, 夏丽琼, 等. 生物炭影响抗生素在土壤中环境行为的Meta分析[J]. 环境科学, 2023, 44(1): 531—539. LI J H, ZHANG J Q, XIA L Q, et al. Effects of biochar on antibiotic environmental behaviors in soil: A meta-analysis[J]. Environmental Science, 2023, 44(1): 531-539 (in Chinese).
[3] BUSS W, HILBER I, GRAHAM M C, et al. Composition of PAHs in biochar and implications for biochar production[J]. ACS Sustainable Chemistry & Engineering, 2022, 10(20): 10. [4] ISLAM T, LI Y L, CHENG H F. Biochars and engineered biochars for water and soil remediation: A review[J]. Sustainability, 2021, 13(17): 9932. doi: 10.3390/su13179932 [5] TAN X, ZHU S, SHOW P L, et al. Sorption of ionized dyes on high-salinity microalgal residue derived biochar: Electron acceptor-donor and metal-organic bridging mechanisms[J]. Journal of Hazardous Materials, 2020, 393: 122435. doi: 10.1016/j.jhazmat.2020.122435 [6] WANG Q, WEN J, YANG L S, et al. Exploration on the role of different iron species in the remediation of As and Cd co-contamination by sewage sludge biochar[J]. Environmental Science and Pollution Research, 2023, 30(13): 39154-39168. doi: 10.1007/s11356-022-24952-z [7] 吴丹萍, 陈全, 李东梅, 等. 生物炭含氧官能团的生成溯源及其在污染物吸附-降解过程中的作用[J]. 环境化学, 2021, 40(10): 3190—3198. doi: 10.7524/j.issn.0254-6108.2020062301 WU D P, CHEN Q, LI D M, et al. Traceability of oxygen-containing functional groups in biochars and their roles in the adsorption-degradation of contaminants[J]. Environmental Chemistry, 2021, 40(10): 3190-3198 (in Chinese). doi: 10.7524/j.issn.0254-6108.2020062301
[8] FENG S H, ZHANG P, DUAN W Y, et al. P-nitrophenol degradation by pine-wood derived biochar: The role of redox-active moieties and pore structures[J]. Science of the Total Environment, 2020, 741: 140431. doi: 10.1016/j.scitotenv.2020.140431 [9] LYU H H, ZHANG Q R, SHEN B X. Application of biochar and its composites in catalysis[J]. Chemosphere, 2020, 240: 124842. doi: 10.1016/j.chemosphere.2019.124842 [10] ZHANG J L, JIN X, YANG C H. Efficient removal of organic pollutants in waste sulfuric acid by an advanced oxidation process using coconut shell-derived biochar to produce qualified poly aluminium sulfate[J]. Separation and Purification Technology, 2022, 293: 121057. doi: 10.1016/j.seppur.2022.121057 [11] GONG H, CHU W, XU K H, et al. Efficient degradation, mineralization and toxicity reduction of sulfamethoxazole under photo-activation of peroxymonosulfate by ferrate (Ⅵ)[J]. Chemical Engineering Journal, 2020, 389: 124084. doi: 10.1016/j.cej.2020.124084 [12] ZHANG C W, LI T Y, ZHANG J Y, et al. Degradation of p-nitrophenol using a ferrous-tripolyphosphate complex in the presence of oxygen: The key role of superoxide radicals[J]. Applied Catalysis B: Environmental, 2019, 259: 118030. doi: 10.1016/j.apcatb.2019.118030 [13] GLIGOROVSKI S, STREKOWSKI R, BARBATI S, et al. Environmental implications of hydroxyl radicals (·OH)[J]. Chemical Reviews, 2015, 115(24): 13051-13092. doi: 10.1021/cr500310b [14] FANG G D, ZHU C Y, DIONYSIOU D D, et al. Mechanism of hydroxyl radical generation from biochar suspensions: Implications to diethyl phthalate degradation[J]. Bioresource Technology, 2015, 176: 210-217. doi: 10.1016/j.biortech.2014.11.032 [15] LI J, LI Q Q, STEINBERG C E W, et al. Reaction of substituted phenols with lignin char: Dual oxidative and reductive pathways depending on substituents and conditions[J]. Environmental Science & Technology, 2020, 54(24): 15811-15820. [16] 曾亮. 生物炭氧化还原性质及其介导外源Fe(Ⅲ)降解2, 4-二氯苯酚的作用机制[D]. 昆明: 昆明理工大学, 2021. ZENG L. Redox properties of biochar and its mechanism of mediating the degradation of 2, 4- dichlorophenol by exogenous Fe(Ⅲ)[D]. Kunming: Kunming University of Science and Technology, 2021(in Chinese).
[17] 田发荣, 高佳丽, 朱周彩霞, 等. 利用生物炭技术处理酸性矿山废水的研究进展[J]. 环境化学, 2022, 41(8): 2712—2728. doi: 10.7524/j.issn.0254-6108.2021042004 TIAN F R, GAO J L, ZHU Z, et al. Progress on treatment of acid mine drainage by biochar technology[J]. Environmental Chemistry, 2022, 41(8): 2712-2728 (in Chinese). doi: 10.7524/j.issn.0254-6108.2021042004
[18] REY A, ZAZO J A, CASAS J A, et al. Influence of the structural and surface characteristics of activated carbon on the catalytic decomposition of hydrogen peroxide[J]. Applied Catalysis A General, 2011, 402(1-2): 146-155. doi: 10.1016/j.apcata.2011.05.040 [19] KHACHATRYAN L, VEJERANO E, LOMNICKI S, et al. Environmentally persistent free radicals (EPFRs). 1. Generation of reactive oxygen species in aqueous solutions[J]. Environmental Science & Technology, 2011, 45(19): 8559-8566. [20] TU Y T, PENG Z P, HUANG J C, et al. Preparation and characterization of magnetic biochar nanocomposites via a modified solvothermal method and their use as efficient heterogeneous Fenton-like catalysts[J]. Industrial & Engineering Chemistry Research, 2020, 59(5): 1809-1821. [21] FANG G D, LIU C, GAO J, et al. Manipulation of persistent free radicals in biochar to activate persulfate for contaminant degradation[J]. Environmental Science & Technology, 2015, 49(9): 5645-5653. [22] YANG J, PAN B, LI H, et al. Degradation of p-nitrophenol on biochars: Role of persistent free radicals[J]. Environmental Science & Technology, 2016, 50(2): 694-700. [23] 杨海君, 邓蓉蓉, 易勇, 等. 加拿大一枝黄花茎秆生物炭的制备及其对吡啶的吸附[J]. 环境化学, 2021, 40(6): 1922—1932. doi: 10.7524/j.issn.0254-6108.2020012701 YANG H J, DENG R R, YI Y, et al. Preparation of biochar from Solidago canadensis l. stalk and its pyridine adsorption performance[J]. Environmental Chemistry, 2021, 40(6): 1922-1932 (in Chinese). doi: 10.7524/j.issn.0254-6108.2020012701
[24] ZHANG P, ZHANG P J, FENG S H, et al. The mechanism of p-nitrophenol degradation by dissolved organic matter derived from biochar[J]. The Science of the Total Environment, 2023, 868: 161693. doi: 10.1016/j.scitotenv.2023.161693 [25] BENBI D K, BRAR K. Pyrogenic conversion of rice straw and wood to biochar increases aromaticity and carbon accumulation in soil[J]. Carbon Management, 2021: 1-13. [26] 许天星, 高甫威, 于梦梦, 等. 花生壳生物炭降解对硝基苯酚的机制探究[J]. 昆明理工大学学报(自然科学版), 2022, 47(1): 118—127. doi: 10.16112/j.cnki.53-1223/n.2022.01.162 XU T X, GAO F W, YU M M, et al. Mechanism of degradation of P-nitrophenol by peanut shell biochar[J]. Journal of Kunming University of Science and Technology (Natural Science Edition), 2022, 47(1): 118-127 (in Chinese). doi: 10.16112/j.cnki.53-1223/n.2022.01.162
[27] 宋泽峰, 石晓倩, 刘卓, 等. 芦苇生物炭的制备、表征及其吸附铜离子与双酚A的性能[J]. 环境化学, 2020, 39(8): 2196—2205. doi: 10.7524/j.issn.0254-6108.2019052001 SONG Z F, SHI X Q, LIU Z, et al. Synthesis and characterization of reed-based biochar and its adsorption properties for Cu2+ and bisphenol A (BPA)[J]. Environmental Chemistry, 2020, 39(8): 2196-2205 (in Chinese). doi: 10.7524/j.issn.0254-6108.2019052001
[28] LI Y Y, PAN Y H, LIAN L S, et al. Photosensitized degradation of acetaminophen in natural organic matter solutions: The role of triplet states and oxygen[J]. Water Research, 2017, 109: 266-273. doi: 10.1016/j.watres.2016.11.049 [29] 段浩楠, 吕宏虹, 王夫美, 等. 生物炭/铁复合材料的制备及其在环境修复中的应用研究进展[J]. 环境化学, 2020, 39(3): 774—790. doi: 10.7524/j.issn.0254-6108.2019103109 DUAN H N, LV H H, WANG F M, et al. Preparation of biochar/iron composite and its application in environmental remediation[J]. Environmental Chemistry, 2020, 39(3): 774-790 (in Chinese). doi: 10.7524/j.issn.0254-6108.2019103109
[30] RODRÍGUEZ-VILA A, ASENSIO V, FORJÁN R, et al. Chemical fractionation of Cu, Ni, Pb and Zn in a mine soil amended with compost and biochar and vegetated with Brassica juncea L[J]. Journal of Geochemical Exploration, 2015, 158: 74-81. doi: 10.1016/j.gexplo.2015.07.005 [31] 李淑妮, 崔斌, 唐宗薰. 元素电势图及其应用[J]. 宝鸡文理学院学报(自然科学版), 2001, 21(1): 6. LI S N, CUI B, TANG Z X. Potential diagram of elements and its application[J]. Journal of Baoji College of Arts and Sciences (Natural Science Edition), 2001, 21(1): 6(in Chinese).
[32] TAN X F, LIU Y G, ZENG G M, et al. Application of biochar for the removal of pollutants from aqueous solutions[J]. Chemosphere, 2015, 125: 70-85. doi: 10.1016/j.chemosphere.2014.12.058 [33] CHEN Q, MA C R, DUAN W Y, et al. Coupling adsorption and degradation in p-nitrophenol removal by biochars[J]. Journal of Cleaner Production, 2020, 271: 122550. doi: 10.1016/j.jclepro.2020.122550 [34] LI M H, GUO X L, WEI Y, et al. Adsorption mechanism and structure-performance relationship of chromium ions by biochar[J]. Water, Air, & Soil Pollution, 2020, 231: 1-12. [35] HU Y, CHEN D Z, ZHANG R, et al. Singlet oxygen-dominated activation of peroxymonosulfate by passion fruit shell derived biochar for catalytic degradation of tetracycline through a non-radical oxidation pathway[J]. Journal of Hazardous Materials, 2021, 419: 126495. doi: 10.1016/j.jhazmat.2021.126495 [36] WANG H Z, GUO W Q, LIU B H, et al. Edge-nitrogenated biochar for efficient peroxydisulfate activation: An electron transfer mechanism[J]. Water Research, 2019, 160: 405-414. doi: 10.1016/j.watres.2019.05.059 [37] ZHU F, WU Y Y, LIANG Y K, et al. Degradation mechanism of norfloxacin in water using persulfate activated by BC@nZVI/Ni[J]. Chemical Engineering Journal, 2020, 389: 124276. doi: 10.1016/j.cej.2020.124276 [38] FRANZ M, ARAFAT H A, PINTO N G. Effect of chemical surface heterogeneity on the adsorption mechanism of dissolved aromatics on activated carbon[J]. Carbon, 2000, 38(13): 1807-1819. doi: 10.1016/S0008-6223(00)00012-9 [39] LI L, QUINLIVAN P A, KNAPPE D R U. Effects of activated carbon surface chemistry and pore structure on the adsorption of organic contaminants from aqueous solution[J]. Carbon, 2002, 40(12): 2085-2100. doi: 10.1016/S0008-6223(02)00069-6 [40] PENDLETON P, WONG S H, SCHUMANN R, et al. Properties of activated carbon controlling 2-Methylisoborneol adsorption[J]. Carbon, 1997, 35(8): 1141-1149. doi: 10.1016/S0008-6223(97)00086-9 [41] YU L P, YUAN Y, TANG J, et al. Biochar as an electron shuttle for reductive dechlorination of pentachlorophenol by Geobacter sulfurreducens[J]. Scientific Reports, 2015, 5: 16221. doi: 10.1038/srep16221 [42] KEMPER J M, AMMAR E, MITCH W A. Abiotic degradation of hexahydro-l, 3, 5-trinitro-1, 3, 5-triazine in the presence of hydrogen sulfide and black carbon[J]. Environmental Science & Technology, 2008, 42(6): 2118-2123. [43] ZEE F P V D, BISSCHOPS I A E, LETTINGA G, et al. Activated carbon as an electron acceptor and redox mediator during the anaerobic biotransformation of azo dyes[J]. Environmental Science & Technology, 2003, 37(2): 402-408. [44] PHAM A N, WAITE T D. Oxygenation of Fe(Ⅱ) in natural waters revisited: Kinetic modeling approaches, rate constant estimation and the importance of various reaction pathways[J]. Geochimica et Cosmochimica Acta, 2008, 72(15): 3616-3630. doi: 10.1016/j.gca.2008.05.032 [45] JONES A D, SHRINIVAS A, BEZNER-KERR R. Farm production diversity is associated with greater household dietary diversity in Malawi: Findings from nationally representative data[J]. Food Policy, 2014, 46: 1-12. doi: 10.1016/j.foodpol.2014.02.001 -




 下载:
下载: