-
尘螨(house dust mites,HDMs)是过敏性鼻炎和哮喘最常见的诱因之一,大约85%的过敏性哮喘是由尘螨引起的[1]. 屋尘螨(Dermatophagoides pteronyssinus,Der p)分布最广,广泛分布在全球85%的地区[2]. 目前,人们发现了20种来自于屋尘螨的过敏原,其中,2组过敏原Der p 2是最重要的过敏原之一. 研究表明,90%以上的宿舍和家庭环境灰尘中都能检测到Der p 2[3],80%的尘螨过敏患者都对其有过敏反应[4]. 在10岁以下儿童中,Der p 2是屋尘螨过敏原中患病率最高的过敏原[5]. Der p 2由129个氨基酸组成,其中包括3个酪氨酸残基[6]. Der p 2引起的过敏属于Ⅰ型超敏反应,主要是由IgE介导. 当机体初次接触过敏原蛋白时,机体产生特异性IgE,IgE可以吸附在嗜碱性粒细胞、T细胞和B细胞等细胞表面的IgE受体上. 当机体再次接触过敏原蛋白时,过敏原与细胞表面的IgE特异性结合,诱导释放组胺、白三烯等活性物质,引发各种过敏症状[7]. 整个致敏、激发和效应过程中,过敏原蛋白与细胞表面的IgE结合是关键环节. 过敏原蛋白与细胞表面IgE结合的部分叫做表位. 表位分为线性表位和构象表位,线性表位包含可以与IgE结合的一个连续氨基酸序列,构象表位是由在序列上相距较远但是因为蛋白质立体结构而相邻的几个氨基酸残基组成[8 − 9]. 目前,以线性表位为基础合成的表位肽可以作为生物标志物,用于过敏原的致敏性研究,酶联免疫吸附测定(epitope-ELISA)被广泛应用于临床诊断[10].
近年来的研究表明,空气污染物O3和NO2可引起过敏原的硝基化,即蛋白质中的酪氨酸被硝基化形成3-硝基酪氨酸(3-NT),从而促进其致敏性的增强[11 − 14]. 例如,暴露于NO2和O3的白桦花粉过敏原蛋白Bet v
1.0101 可发生硝基化作用[15],硝基化后的桦树花粉蛋白与桦树花粉过敏患者血清中IgE结合能力显著增强[16]. 此外,也有报道称,NO2和O3 可以改变法国梧桐花粉过敏原Pla a 3的结构,从而提高其与IgE结合能力,加重花粉引起的BALB/c小鼠肺炎[17]. 先前研究已经证实了环境中硝基化Der p 2的存在,并且能定位Der p 2每个酪氨酸位点的硝基化程度,在居家环境中,Der p 2的3个酪氨酸硝化位点Y92、Y103和Y107的硝化率分别为19.12%—95.12%、2.02%—78.39%和1.92%—79.75%,整体呈现Y92>Y107>Y103的趋势[3,18 − 19]. 然而,每个酪氨酸位点的硝基化对于Der p 2的致敏性的影响,尤其对于IgE结合力的影响还未可知.Der p 2包含3个酪氨酸,分别位于其两条线性表位肽上. 本研究通过分析两条线性表位肽及其硝基化产物与特异性IgE的结合能力,鉴别线性表位肽在硝基化前后与IgE结合能力的变化及其与酪氨酸位点的相关性,以此揭示硝基化对Der p 2致敏性的影响.
-
Recombinant House Dust Mite Der p 2(0.62 μg·μL−1,纯度>95%)购自美国RayBiotech;屋尘螨过敏原特异性IgE抗体血清国家参考品(白色冻干粉末,4级阳性,17.51—50.00 IU·mL−1)购自中国食品药品检定研究院;Anti Der p 2 Human IgE monoclonal antibody(
50000 IU·mL−1)购自美国Indoor Biotechnologies;小鼠单克隆抗体[B3102E8]抗人IgE Fc (HRP)(B3102E8)购自英国Abcam. ELISA相关试剂,如1×包被缓冲液(0.05 mol·L−1,pH 9.6,碳酸盐溶液)、牛血清白蛋白(组分Ⅴ,Biotech Grade)、10× PBST缓冲液(0.1 mol·L−1,pH 7.2—7.4,0.5% Tween 20)、TMB显色液(A液:3,3′,5,5′-四甲基联苯胺溶液,B液:过氧化物溶液)分别购自中国Coolaber、生工生物、Solarbio、Macklin. -
尘螨过敏原Der p 2(UniProt编号:Q1H8P8)含有3个酪氨酸残基,Y92、Y103和Y107. 以前的研究已经鉴别出了Der p 2的两条线性表位多肽[20 − 23],即本研究中的EP1(氨基酸序列为82—95)和EP2(氨基酸序列为101—117). Der p 2含有的3个酪氨酸均位于这两条表位多肽上,EP1和EP2分别含有1个和2个酪氨酸. 两条表位多肽及其硝基化产物通过吉尔生化(上海)有限公司合成,相关信息如表1所示.
-
(1)包被:每孔加入100 μL包被缓冲液稀释的不同浓度的Der p 2溶液(0.5 μg·mL−1、1 μg·mL−1和5 μg·mL−1),同时设置包被缓冲液每孔100 μL作为空白对照,4 ℃包被过夜.
(2)洗板:弃去包被液,每孔加入300 μL的PBST洗涤液,轻拍振荡,弃去洗涤液,在吸水纸上拍干,重复5遍.
(3)封闭:每孔加入200 μL封闭液(含3%BSA的PBST溶液),置于37 ℃恒温箱孵育2 h.
(4)洗板:5遍.
(5)一抗:每孔加入100 μL用PBST洗涤液稀释不同倍数的一抗(血清稀释倍数:1:20、1:50和1:100;单克隆抗体IgE稀释倍数:1:500、1:600、1:
1000 、1:5000 、1:10000 和1:50000 ),置于37 ℃恒温箱孵育1 h.(6)洗板:5遍.
(7)二抗:每孔加入100 μL用PBST洗涤液稀释不同倍数的二抗(1:2000、1:
5000 和1:10000 ),置于37 ℃恒温箱孵育1 h.(8)洗板:5遍.
(9)显色:每孔加入显色液A和B依次各加50 μL,黑暗条件置于37 ℃恒温箱孵育15 min.
(10)终止:每孔加入50 μL终止液(2 mol·L−1 H2SO4溶液).
(11)测定:使用酶标仪测定450 nm处的吸光度;比较OD450与空白对照OD0的比值,OD450/OD0最大时即为最佳包被浓度、一抗稀释倍数和二抗稀释倍数.
-
采用1.3.1中筛选出的最佳工作浓度和稀释倍数,具体步骤的前面部分与1.3.1节相同,在一抗孵育之前,先将相同摩尔浓度的表位多肽、硝基化表位多肽和Der p 2(最佳包被浓度的两倍)分别与等体积一抗(最佳浓度两倍)混合,置于37 ℃恒温箱孵育1 h,同时设置最佳浓度的一抗作为阳性对照,PBST洗涤液作为阴性对照. 得出吸光度值,通过计算得出抑制率和IgE相对结合率,公式如下:
式中,
$ \mathrm{O}\mathrm{D} $ 表示样本吸光度,$ {\mathrm{O}\mathrm{D}}_{p} $ 表示阳性对照的吸光度,$ I $ 表示样品抑制率,$ {I}_{0} $ 表示Der p 2的抑制率. -
数据以各组均值或均值±SD值表示,使用GraphPad Prism version 9.0进行单因素方差分析和作图. 当P < 0.05时,认为组间存在显著性差异.
-
如表2所示,当包被Der p 2浓度为5 μg·mL−1,血清稀释倍数为1:20,二抗稀释倍数为1:2000时,OD450/OD0的值最大,将此条件设为最佳工作条件,用于后续IgE相对结合率的测定.
为保持统一,选取和血清IgE实验相同的包被溶液和二抗稀释倍数,即5 μg·mL−1 Der p 2包被液和二抗稀释1:2000,进行单克隆抗体IgE实验. 设置不同梯度的一抗稀释倍数,进行筛选,结果如表3所示,当一抗稀释倍数为1:600时,OD450/OD0的值最大,此时为最佳工作条件,用于后续IgE相对结合率的测定.
-
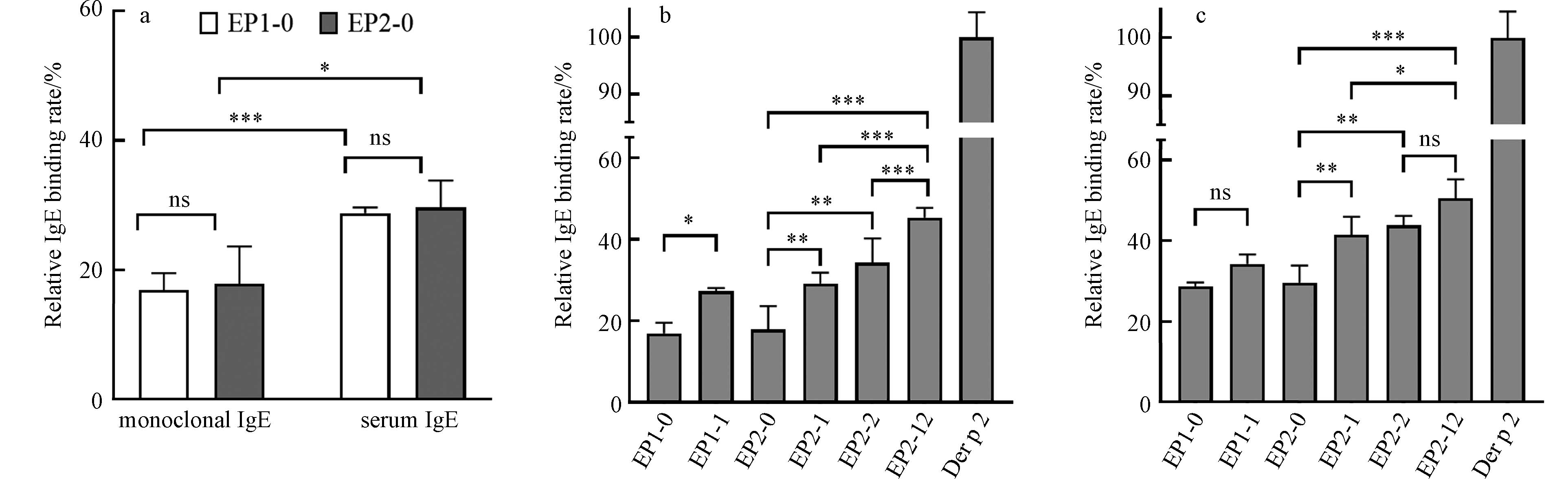
由图1a可知,EP1-0和EP2-0可以有效地结合IgE,因此可以用于致敏性的研究,此外两个表位肽的相对结合能力没有显著差异. 两个表位多肽与血清IgE的结合能力显著高于与单克隆抗体IgE的结合能力,这可能是因为本实验中选取的血清来源于对屋尘螨过敏的患者,血清中含有Der p 2的特异性IgE(多克隆),也含有其它抗体和非抗体的其它蛋白. 血清中特异性IgE多克隆抗体与Der p 2表位多肽的结合能力与小鼠单克隆IgE抗体存在差异. 此外,由于血清中还存在其它抗体和非抗体的其它蛋白,Der p 2表位多肽与抗血清的结合除了特异性结合之外,还可能存在与其它抗体的交叉反应和非特异性结合. 例如Der p 2可与其他2组尘螨过敏原发生IgE交叉免疫反应,Der f 2、Eur m 2与Der p 2具有84%—87%的同源性[24],Lep d 2与Der p 2具有37%的同源性,Gly d 2与Der p 2具有41%的同源性,同源性越高,表位之间越易发生交叉反应[25].
-
Der p 2的立体结构是β桶形结构,由2个3组反平行β折叠片组成,EP1-0和EP2-0分别包含Y92、Y103和Y107 3个酪氨酸,其中Y103和Y107位于β折叠结构,Y92位于环状结构[26],EP1-1、EP2-1和EP2-2,分别对应Y92、Y103和Y107 3个位点酪氨酸单独硝基化的表位多肽. 由图1b可以看出,单位点硝基化的表位肽与单克隆抗体IgE结合率显著高于未硝基化的表位多肽,即EP1-1 > EP1-0,EP2-1 > EP2-0和EP2-2 > EP2-0,说明硝基化的表位肽因为硝基酪氨酸的存在可能具有更高的致敏性. 表位多肽与IgE的结合依赖于氨基酸残基的疏水性,疏水性高会导致与IgE结合能力下降,当酪氨酸被硝基化成3-硝基酪氨酸,疏水性降低,可能会导致表位多肽与IgE结合能力增强[27]. 由于实验中采用抗Der p 2的单克隆抗体IgE,说明硝基化作用通过提高表位多肽与IgE的结合能力,增强过敏原的致敏性. 血清IgE更能真实地反映实际情况下,表位多肽与IgE的结合能力. 本实验中使用屋尘螨过敏原特异性IgE抗体血清国家参考品进行IgE结合实验更具有代表性,结果如图1c所示. 硝基化表位多肽与血清IgE结合率高于未硝基化表位多肽,EP2-1和EP2-2的血清IgE结合率显著高于EP2-0的血清IgE结合率,EP1-1的血清IgE结合率也略高于EP1-0的血清IgE结合率(尽管没有显著性差异). 此外,同一条表位肽上两个酪氨酸位点都硝基化的EP2-12的IgE结合率显著高于单位点硝基化的EP2-1和EP2-2的IgE结合率,且显著高于未硝基化的EP2-0的IgE结合率,说明多位点发生硝基化,更利于表位多肽与IgE的结合.
Y92、Y103和Y107 3个酪氨酸位点单独硝基化的表位多肽与单克隆抗体IgE的结合率和其对应的未硝基化的表位多肽与单克隆抗体IgE的结合率相比,分别提高了61%、63%和92%,说明Y107的硝基化对表位肽IgE结合率的影响程度高于Y103和Y92的硝基化的硝基化对表位肽IgE结合率的影响(图1b、c). 这是因为硝基化使表位肽与IgE的结合力增强,不仅依赖于酪氨酸本身的硝基化,还与酪氨酸位点附近的氨基酸序列有关,酪氨酸Y107的N端为带正电的赖氨酸(Lysine,K),而Y103的N和端为不带电的谷胱酰胺(Glntamine,Q),N端为带正电荷的氨基酸残基具有更高的IgE亲和力[28],因此与Y103硝基化相比,Y107硝基化具有更强的IgE结合能力. 另外,由图1c可以看出血清IgE结合实验也证明不同酪氨酸位点的硝基化对与血清IgE的结合率的影响不同,Y92、Y103和Y107 3个酪氨酸位点单独硝基化的表位多肽与血清IgE的结合率和其对应的未硝基化的表位多肽与血清IgE的结合率相比,分别提高了22%、13%和26%,Y92的硝基化对于IgE结合率的提高程度大于Y103硝基化对于IgE结合率提高的程度可能是因为距离位点2个残基的位置为赖氨酸,有利于表位多肽与IgE的结合[27].
-
Der p 2的两个线性表位多肽EP1和EP2能够有效结合单克隆抗体IgE和血清IgE,硝基化表位多肽与IgE的结合率高于未硝基化多肽与IgE的结合率,其中酪氨酸Y107的硝基化对于IgE结合率增强的影响程度高于Y92和Y103,说明Der p 2的硝基化具有通过增强IgE结合能力增强其致敏性的潜力,且不同位点对于致敏性增强的影响程度不同. 研究结果表明,硝基化能够位点特异性地增强Der p 2的致敏性.
尘螨过敏原Der p 2线性表位肽及其硝基化产物与IgE结合能力
The IgE binding capability of the linear epitope peptides and their nitration products of house dust mite allergy Der p 2
-
摘要: 许多过敏原可以介导Ⅰ型超敏反应,通过与IgE特异性结合,引起过敏症状. 过敏原与细胞表面的特异性IgE结合的部分叫做表位,其与IgE的结合能力可以表征过敏原致敏性的强弱. Der p 2是一种重要的屋尘螨过敏原,其线性表位中含有的酪氨酸可被空气中的NO2和O3硝基化,从而影响线性表位与IgE的结合能力. 本实验研究了Der p 2的线性表位及其硝基化产物与IgE的结合能力. 研究发现,Der p 2的两条表位多肽可以有效地结合IgE,硝基化表位多肽的IgE结合能力显著高于未硝基化的表位多肽,且不同位点的硝基化对于IgE结合能力的增强程度也不同. 结果表明,硝基化能够位点特异性地增强Der p 2的致敏性.Abstract: Many allergies can cause type I hypersensitivity, through binding to specific-IgE and leading the allergic symptoms. The binding ability of epitope, which is the portion of an allergen protein that binds with specific IgE on cell surface, to IgE can indicate the allergenicity of allergen. Der p 2 is an important house dust mite allergic protein. The tyrosine residues in the epitopes of Der p 2 can be nitrated by airborne NO2 and O3, which could subsequently promote the allergenicity. In this study, the abilities of the epitopes and their nitrated products to bind to the specific IgE were investigated. The results reveal that the two epitope peptides effectively bound to the specific IgE, and the IgE binding capacities of the nitrated epitope peptides were significantly higher than the non-nitrated forms. Besides, the contribution of nitration to the enhancement of IgE binding capacity depended on the location of tyrosine. These findings suggest that nitration can enhance the allergenicity of Der p 2 in a tyrosine site-specific manner.
-
Key words:
- Der p 2 /
- linear epitope /
- nitration /
- site-specific /
- IgE /
- allergenicity.
-

-
表 1 Der p 2表位多肽和硝基化表位多肽相关信息
Table 1. The information about the linear epitope peptides and nitrated epitope peptides of Der p 2
表位多肽
Epitope peptide氨基酸序列及硝基酪氨酸位置
Amino acid sequence and position of tyrosine纯度/%
PurityEP1-0 VPGIDPNACHY92MKC 98 EP1-1 VPGIDPNACHY(3-NO2)MKC 98 EP2-0 QQY103DIKY107TWNVPKIAPK 98 EP2-1 QQY(3-NO2)DIKYTWNVPKIAPK 98 EP2-2 QQYDIKY(3-NO2)TWNVPKIAPK 98 EP2-12 QQY(3-NO2)DIKY(3-NO2)TWNVPKIAPK 98 注:Y(3-NO2)表示3-硝基酪氨酸(3-NT). Note: Y(3-NO2) means 3- nitrotyrosine (3-NT). 表 2 间接性ELISA血清实验不同工作条件下OD450/OD0
Table 2. OD450/OD0 under different conditions by indirect ELISA with serum IgE
0.5 μg·mL−1 1 μg·mL−1 5 μg·mL−1 1:20 1:2000 2.87 3.49 5.15 1: 5000 2.70 3.30 4.04 1: 10000 2.04 2.84 3.28 1:50 1:2000 1.95 2.38 3.57 1: 5000 1.87 2.24 2.90 1: 10000 1.84 2.67 2.84 1:100 1:2000 2.03 2.28 3.40 1: 5000 1.80 2.38 3.12 1: 10000 1.47 1.78 2.29 注:包被浓度为0.5 μg·mL−1、1 μg·mL−1和5 μg·mL−1,血清稀释倍数为1:20、1:50和1:100,二抗稀释倍数为1:2000、1: 5000 和1:10000 ;n=3,数据以均值表示.
Note: The concentrations of coated solution were 0.5, 1 and5 μg·mL−1. The rates of dilution of the serum IgE were 1:20, 1:50 and 1:100. The rates of dilution of the secondary antibody were 1:2000, 1:5000 , and 1:10000. The data were expressed as mean (n=3).表 3 间接性ELISA单克隆抗体IgE实验不同工作条件下OD450/OD0
Table 3. OD450/OD0 under different conditions by indirect ELISA with monoclonal IgE
一抗稀释倍数 1:500 1:600 1: 1000 1: 5000 1: 10000 1: 50000 OD450/OD0 13.82 30.40 6.93 2.68 2.29 1.63 注:包被浓度为5 μg·mL−1,二抗稀释倍数为1:2000,单克隆抗体IgE稀释倍数为1:500、1:600、1: 1000 、1:5000 、1:10000 和1:50000 ,n=3,数据以均值表示.
Note: The concentration of coated solution was 5 μg·mL−1. The rate of dilution of the secondary antibody was 1:2000. The rates of dilution of the monoclonal IgE were 1:500, 1:600, 1:1000 , 1:50000 , 1:10000 and 1:50000. The data were expressed as mean (n=3). -
[1] PLATTS-MILLS T A E, WOODFOLK J A. Allergens and their role in the allergic immune response[J]. Immunological Reviews, 2011, 242(1): 51-68. doi: 10.1111/j.1600-065X.2011.01021.x [2] CALDERÓN M A, LINNEBERG A, KLEINE-TEBBE J, et al. Respiratory allergy caused by house dust mites: What do we really know?[J]. Journal of Allergy and Clinical Immunology, 2015, 136(1): 38-48. doi: 10.1016/j.jaci.2014.10.012 [3] 田婧宜. 典型尘螨过敏原位点特异性的硝基化及其对致敏性的影响[D]. 杭州: 浙江大学, 2022. TIAN J Y. Site-specific nitration of typical house dust mite allergens and effect on allergenicity[D]. Hangzhou: Zhejiang University, 2022(in Chinese).
[4] TROMBONE A P F, TOBIAS K R C, FERRIANI V P L, et al. Use of a chimeric ELISA to investigate immunoglobulin E antibody responses to Der p 1 and Der p 2 in mite-allergic patients with asthma, wheezing and/or rhinitis[J]. Clinical and Experimental Allergy, 2002, 32(9): 1323-1328. doi: 10.1046/j.1365-2745.2002.01455.x [5] POSA D, PERNA S, RESCH Y, et al. Evolution and predictive value of IgE responses toward a comprehensive panel of house dust mite allergens during the first 2decades of life[J]. Journal of Allergy and Clinical Immunology, 2017, 139(2): 541-549. e8. [6] KEBER M M, GRADISAR H, JERALA R. MD-2 and Der p 2 - a tale of two cousins or distant relatives?[J]. Journal of Endotoxin Research, 2005, 11(3): 186-192. [7] DULLAERS M, de BRUYNE R, RAMADANI F, et al. The who, where, and when of IgE in allergic airway disease[J]. Journal of Allergy and Clinical Immunology, 2012, 129(3): 635-645. doi: 10.1016/j.jaci.2011.10.029 [8] GALLI S J, TSAI M. IgE and mast cells in allergic disease[J]. Nature Medicine, 2012, 18(5): 693-704. doi: 10.1038/nm.2755 [9] CUI Y B. Immunoglobulin E-binding epitopes of mite allergens: From characterization to immunotherapy[J]. Clinical Reviews in Allergy & Immunology, 2014, 47(3): 344-353. [10] YESTE A, QUINTANA F J. Antigen microarrays for the study of autoimmune diseases[J]. Clinical Chemistry, 2013, 59(7): 1036-1044. doi: 10.1373/clinchem.2012.194423 [11] FRANK U, ERNST D. Effects of NO2 and ozone on pollen allergenicity[J]. Frontiers in Plant Science, 2016, 7: 91. [12] FRANZE T, WELLER M G, NIESSNER R, et al. Protein nitration by polluted air[J]. Environmental Science & Technology, 2005, 39(6): 1673-1678. [13] SHIRAIWA M, SELZLE K, YANG H, et al. Multiphase chemical kinetics of the nitration of aerosolized protein by ozone and nitrogen dioxide[J]. Environmental Science & Technology, 2012, 46(12): 6672-6680. [14] REINMUTH-SELZLE K, KAMPF C J, LUCAS K, et al. Air pollution and climate change effects on allergies in the anthropocene: Abundance, interaction, and modification of allergens and adjuvants[J]. Environmental Science & Technology, 2017, 51(8): 4119-4141. [15] REINMUTH-SELZLE K, ACKAERT C, KAMPF C J, et al. Nitration of the birch pollen allergen Bet v 1.0101: Efficiency and site-selectivity of liquid and gaseous nitrating agents[J]. Journal of Proteome Research, 2014, 13(3): 1570-1577. doi: 10.1021/pr401078h [16] GRUIJTHUIJSEN Y K, GRIESHUBER I, STÖCKLINGER A, et al. Nitration enhances the allergenic potential of proteins[J]. International Archives of Allergy and Immunology, 2006, 141(3): 265-275. doi: 10.1159/000095296 [17] ZHOU S M, WANG X Z, LU S L, et al. Characterization of allergenicity of Platanus pollen allergen a 3 (Pla a 3) after exposure to NO2 and O3[J]. Environmental Pollution, 2021, 278: 116913. doi: 10.1016/j.envpol.2021.116913 [18] 田婧宜, 杨方星. 尘螨过敏原硝基化的位点选择性分析[J]. 环境化学, 2023, 42(7): 2273-2281. TIAN J Y, YANG F X. Analysis of site-selective nitration in house dust mite allergens[J]. Environmental Chemistry, 2023, 42(7): 2273-2281(in Chinese).
[19] LIU F B, LAKEY P S J, BERKEMEIER T, et al. Atmospheric protein chemistry influenced by anthropogenic air pollutants: Nitration and oligomerization upon exposure to ozone and nitrogen dioxide[J]. Faraday Discussions, 2017, 200: 413-427. doi: 10.1039/C7FD00005G [20] VAN'T HOF W, DRIEDIJK P C, van den BERG M, et al. Epitope mapping of the Dermatophagoides pteronyssinus house dust mite major allergen Der p Ⅱ using overlapping synthetic peptides[J]. Molecular Immunology, 1991, 28(11): 1225-1232. doi: 10.1016/0161-5890(91)90009-9 [21] O'HEHIR R E, VERHOEF A, PANAGIOTOPOULOU E, et al. Analysis of human T cell responses to the group Ⅱ allergen of Dermatophagoides species: Localization of major antigenic sites[J]. Journal of Allergy and Clinical Immunology, 1993, 92(1): 105-113. doi: 10.1016/0091-6749(93)90044-G [22] VERHOEF A, HIGGINS J A, THORPE C J, et al. Clonal analysis of the atopic immune response to the group 2 allergen of Dermatophagoides spp. : Identification of HLA-DR and-DQ restricted T cell epitopes[J]. International Immunology, 1993, 5(12): 1589-1597. doi: 10.1093/intimm/5.12.1589 [23] CRACK L R, CHAN H W, McPHERSON T, et al. Identification of an immunodominant region of the major house dust mite allergen Der p 2 presented by common human leucocyte antigen alleles[J]. Clinical and Experimental Dermatology, 2012, 37(3): 266-276. doi: 10.1111/j.1365-2230.2011.04227.x [24] SMITH A M, BENJAMIN D C, HOZIC N, et al. The molecular basis of antigenic cross-reactivity between the group 2 mite allergens[J]. Journal of Allergy and Clinical Immunology, 2001, 107(6): 977-984. doi: 10.1067/mai.2001.115629 [25] SZALAI K, FUHRMANN J, PAVKOV T, et al. Mimotopes identify conformational B-cell epitopes on the two major house dust mite allergens Der p 1 and Der p 2[J]. Molecular Immunology, 2008, 45(5): 1308-1317. doi: 10.1016/j.molimm.2007.09.012 [26] MUELLER G A, SMITH A M, WILLIAMS D C, et al. Expression and secondary structure determination by NMR methods of the major house dust mite allergen der p 2[J]. Journal of Biological Chemistry, 1997, 272(43): 26893-26898. doi: 10.1074/jbc.272.43.26893 [27] SHIN D S, COMPADRE C M, MALEKI S J, et al. Biochemical and structural analysis of the IgE binding sites on Ara h1, an abundant and highly allergenic peanut protein[J]. Journal of Biological Chemistry, 1998, 273(22): 13753-13759. doi: 10.1074/jbc.273.22.13753 [28] GUŞANU M D, PETRE B A, PRZYBYLSKI M. Epitope motif of an anti-nitrotyrosine antibody specific for tyrosine-nitrated peptides revealed by a combination of affinity approaches and mass spectrometry[J]. Journal of Peptide Science, 2011, 17(3): 184-191. doi: 10.1002/psc.1298 -



 下载:
下载:





