-
金霉素(chlortetracycline, CTC)是一种四环素类抗生素,化学名为氯四环素,是一种广谱抗生素[1],作为抗生素中生产和使用量较大的一类,在全球各地水环境中被频繁检出[2]。抗生素在环境中的高残留浓度对动物和人类的健康均有危害,因此,如何高效去除这些抗生素是一个迫切需要解决的问题[3]。目前,去除抗生素的方法包括高级氧化工艺[4]、透析[5]、纳滤[6]和吸附法[7]等。其中,吸附法具有成本低、操作简单、可靠性高和高效益等优点[8]。高效吸附剂被认为是吸附技术中最重要的因素[9],目前使用较多的吸附剂有纳米材料[10]、生物质吸附剂[11]、碳气凝胶[12]等。ZHANG等[13]通过简单的一步傅-克反应(friedel-craft)反应合成了具有分级孔结构的苯并咪唑基超高交联聚合物,并将其应用于吸附水溶液中的金霉素,对金霉素的吸附容量可达到456 mg·g−1。CHEN等[14]采用简单的热处理方法制备了一种具有良好吸附和催化性能的杂原子掺杂废茶叶基生物炭,他们研究了吸附促进过硫酸盐基高级氧化工艺(PS-AOP)对金霉素的去除效果,结果表明,所制备的废茶叶基生物炭对金霉素具有良好的吸附性能,最大吸附容量可达627 mg·g−1。WANG等[15]在原始P-BNFs的基础上,通过钴盐溶液浸渍、熟化和退火等方法成功制备了CoO/P-BNFs,并用于水生环境中抗生素污染物的吸附和去除。实验结果表明,初始浓度为150 mg·L−1时,CoO/ P-BNFs对金霉素的吸附量达655 mg·g−1。活性炭由于其高效、绿色、操作简单等优势,在环境修复和污染物处理领域受到了广泛的关注。煤沥青含碳量高,在高温下具有一定的流动性,通过模板剂可以实现形貌和孔结构的定向控制。在这些已报道的材料中,有的成本较高,有的对金霉素的吸附能力较低。因此,需要研究出一种成本较低且吸附性能较好的抗生素吸附材料。
本研究使用煤沥青为碳源,三聚氰胺为氮源,MgO为模板耦合KOH活化制备掺氮多孔炭,考察其对金霉素的吸附性能,并采用扫描电子显微镜(SEM)、比表面积及孔径分布(BET)、傅里叶变换红外光谱(FTIR)、X射线光电子能谱(XPS)等表征方法对多孔炭进行表征,阐明吸附机理。
-
三聚氰胺、金霉素、盐酸、氢氧化钾、氧化镁(阿拉丁试剂有限公司),所用试剂均为分析纯;煤沥青(马钢集团有限公司);去离子水(安徽工业大学实验中心)。
-
GSL-1600X型高温真空管式炉(合肥科晶材料技术有限公司);Nanosem 430型扫描电子显微镜(SEM,美国FEI公司);3H-2000PS1型自动氮气吸附仪(BET,贝士德仪器科技(北京)有限公司);Nicolet iS 50型傅立叶红外光谱仪(FTIR,美国Thermo ESCALAB公司);ESCALAB25型X-射线光电子能谱(XPS,美国Thermo ESCALAB公司);Zetasizer Nano ZS90型ZETA电位仪(日本JEOL公司)。
-
将煤沥青块用电动破碎机研磨至可过100 目筛的粉末,按照质量比为1:5(煤沥青:氧化镁)、1:7.5(煤沥青:氢氧化钾)、1∶0.5、1∶2、1∶4(煤沥青∶三聚氰胺)的比例将氧化镁与氢氧化钾和三聚氰胺加入研磨机并一同破碎混合均匀,将混合均匀的原料放入瓷舟中,将其放于高温真空管式炉中,通入流速为30 mL·min−1的氮气作为升温气氛,以5 ℃·min−1的升温速率从室温升温到800 ℃,保温60 min,然后冷却至室温,取出瓷舟中的炭材料,加入盛有蒸馏水的烧杯中,并少量多次加入适量盐酸溶液,搅拌16 h后,用去离子水抽滤炭材料直至滤出液pH到7左右,收集炭材料并置于烘箱100 ℃干燥6 h,冷却后过100目筛,得到的煤沥青基炭材料记为MCCx,其中x代表三聚氰胺与煤沥青的质量比。
-
在50 mL不同初始质量浓度(25~350 mg·L−1)的金霉素溶液中分别加入10 mg的MCCx,放入气浴恒温振荡器中以160 r·min−1振荡24 h后,使用紫外分光分度计测试吸附后金霉素溶液的浓度,画出MCCx吸附等温线。MCCx对金霉素的吸附量[16]qt根据式(1)进行计算。
式中: qt为t时吸附剂已吸附的吸附质的量,mg·g−1;C0为吸附质的初始质量浓度,mg·L−1;Ct为t时吸附质的质量浓度,mg·L−1;V为吸附质溶液的体积,mL;m为吸附剂的质量,mg。
吸附等温线是用来评估吸附量和平衡浓度之间关系的有效方法,Langmuir等温线(式(2))是一种理想情况下的吸附模型[17],假设表面完全光滑,吸附在进行在单分子层,且分子间不产生相互作用,各吸附位点的结合能无差异,每个位点被占据后,不能继续吸附。Freundlich等温线[18]用来描述吸附剂和吸附质表面浓度关系的经验公式(式(3)),适用于多分子层的吸附应用和粗糙的表面。
式中:qe为吸附反应达到平衡时的吸附容量,mg·g−1;qm为Langmuir模型计算出的最大吸附容量,mg·g−1;KL为Langmuir等温线常数,L·mg−1。
式中:qe为单位吸附剂吸附金霉素的最大容量,mg·g−1;KF为Freundlich等温线常数,(mg) 1-n·g−1Ln;1/n为吸附强度的量度。
-
在室温条件下,在质量浓度为100 mg·L−1的金霉素溶液中添加10 mg的MCCx,将其放入气浴恒温振荡器(160 r·min−1)中,每隔一段时间进行取样,使用紫外分光光度计测试吸附后金霉素溶液的浓度。通过准二级动力学模型(式(4))[19]探究煤沥青基掺氮多孔炭对水中金霉素的吸附的动力学过程。
式中:qt为吸附反应在t时的吸附容量,mg·g−1;qe为达到平衡吸附时的最大吸附容量,mg·g−1;t为吸附剂与溶液的接触时间,min;K2为准二级动力学吸附模型常数,g·(mg·min)−1。
吸附动力学可以用来探究吸附剂使用过程中不同因素对吸附速率的影响。吸附速率是判断吸附剂性能的重要指标,因此,吸附动力学的研究可获得吸附平衡时间且可探索吸附过程中速率的决定步骤[20]。
-
图1是MCC0.5、MCC2.0、MCC4.0的扫描电镜图。由图1可知,MCC0.5表面呈现多处褶皱和孔隙结构,MCC2.0表面为较平整的坑和孔结构,没有褶皱的片层状结构。MCC4.0表面少见有孔道结构,多为块状结构堆积,很有可能是孔道被较多的三聚氰胺堵塞,使得其孔道结构不如MCC0.5和MCC2.0明显。上述结果表明,即使在相同的活化程度下,不同的氮源添加量会使得材料的物理结构差异较大。
-
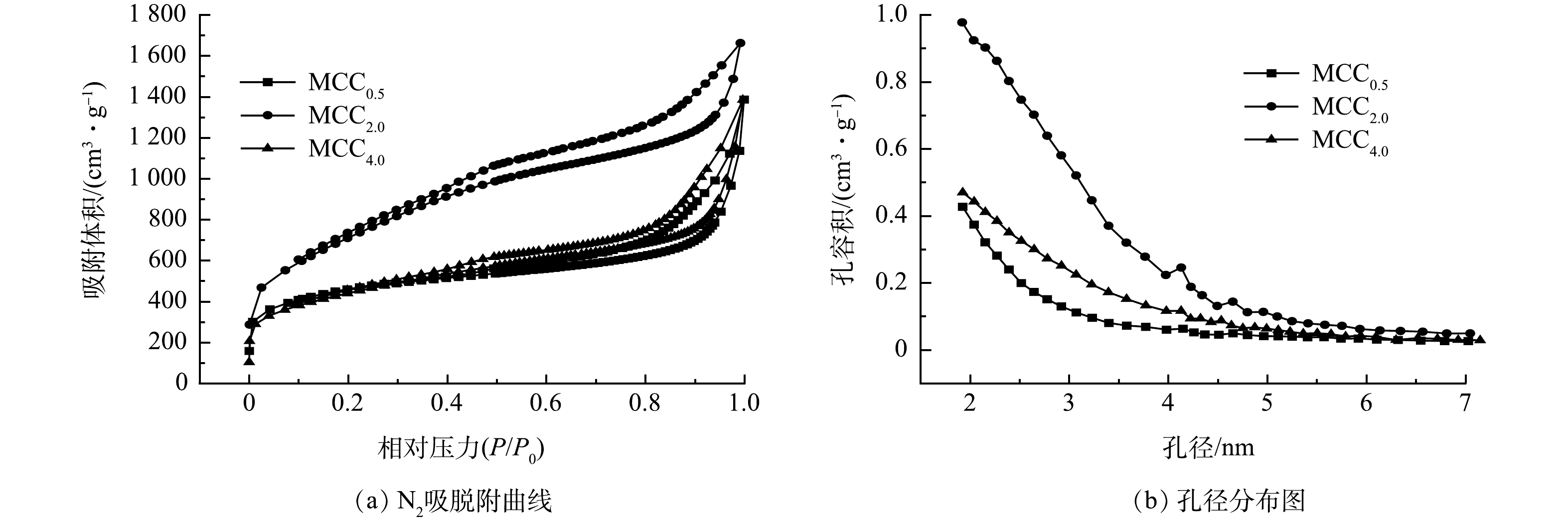
图2为MCCx的氮气吸脱附曲线和孔径分布图。可见,在较低的相对压力下,3种吸附材料吸附量均有快速提升,这种现象的出现是由于大量的微孔导致的。当相对分压为0.1~0.3时,吸附量缓慢上升,说明有小于3.5 nm的中孔;当相对压力为0.4~1.0时,出现较明显的滞后环,表明有大量的中孔存在,其均为IV型吸附等温线。MCC0.5在相对压力为0.1~0.5时的曲线斜率比MCC2.0和MCC4.0更陡,说明其微孔含量明显更高。由孔径分布图可以看出MCCx的孔径分布(由BJH法计算),可见MCCx的孔径(1.8~7 nm)分布较宽,表明MCCx具有分层多孔结构。
由BET方程计算得3种材料的比表面积及孔结构参数(表1)。其中MCC0.5比表面积最大,达2 574 m2·g−1,其中,微孔部分比表面积2 042 m2·g−1,表明该材料的微孔对比表面积贡献较大,MCC2.0和MCC4.0比表面积分别为1 519 m2·g−1和1 510 m2·g−1,微孔容量明显小于MCC0.5。
-
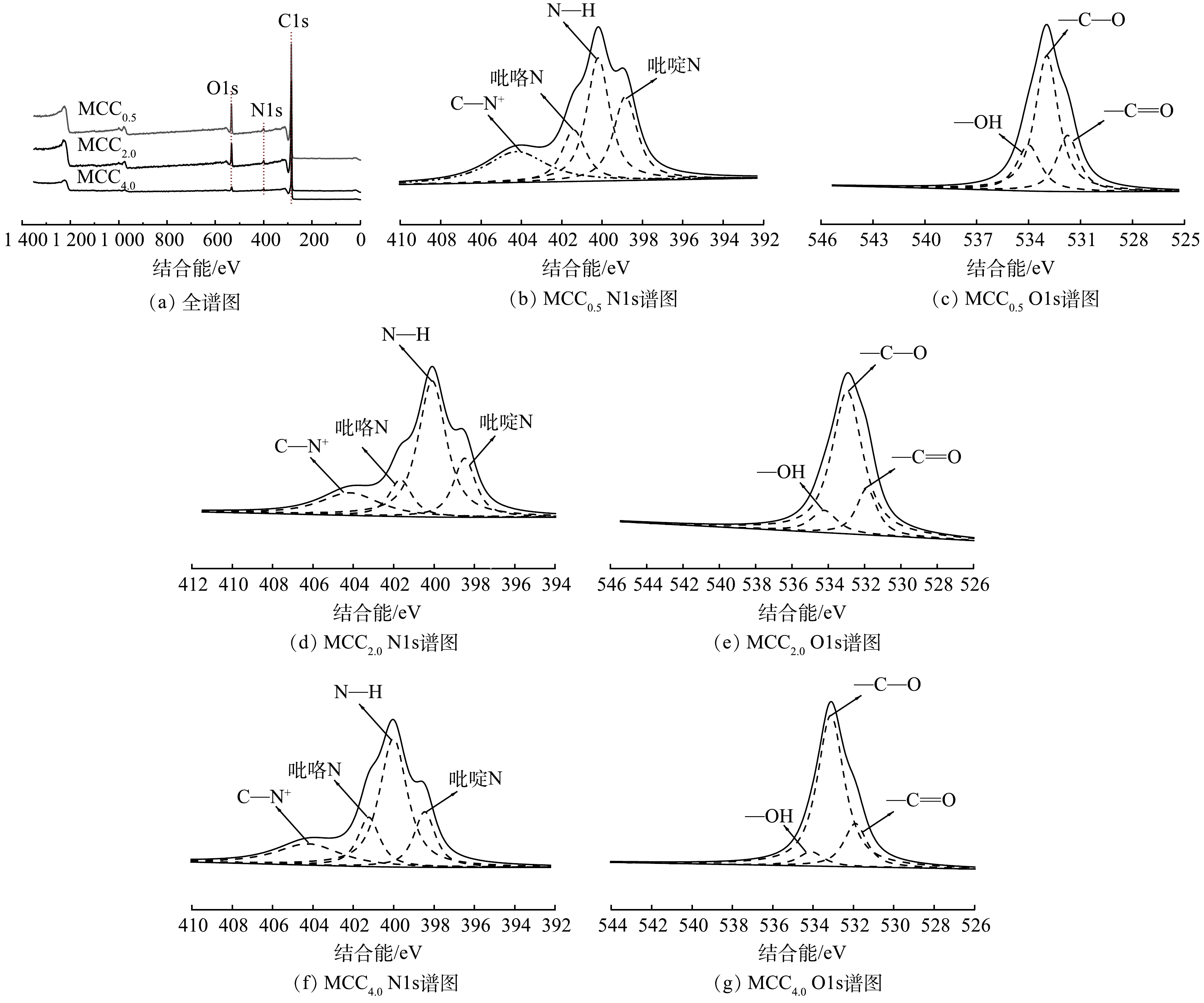
图3为MCC0.5、MCC2.0、MCC4.0的XPS全谱图及O1s、N1s的分峰拟合图。由图3(a)可知,C1s、N1s、O1s的峰均出现,说明三聚氰胺的添加成功为材料引入氮元素。此外,没有其他杂质元素的峰出现,说明所制备的碳材料较纯净。
为了探究材料元素含量对吸附性能的影响,对O和N元素进行了拟合分析,表2和表3中列出了元素含量分析结果。3种材料均在同一温度活化,除添加的氮源含量不同,无其他区别。O1s图中,结合能位于531.87、533.13、534.13 eV分别对应于—C=O、—C—O、—OH。从实验结果来看,MCC0.5的—C=O和—OH含量最多,—C=O提供的孤对电子具有结合共轭分子金霉素的能力,—OH可以与金霉素分子形成分子间氢键,有利于多层吸附的进行。MCCx的N1s分峰图谱,可分峰为4个键能的峰,分别为398.43、399.99、401.21、404.40 eV,分别对应吡啶氮、N—H、吡咯氮和季胺中C—N+。在3种材料中,MCC0.5中吡啶N含量最高,吡啶N作为活性官能团,有利于材料的吸附性能。
-
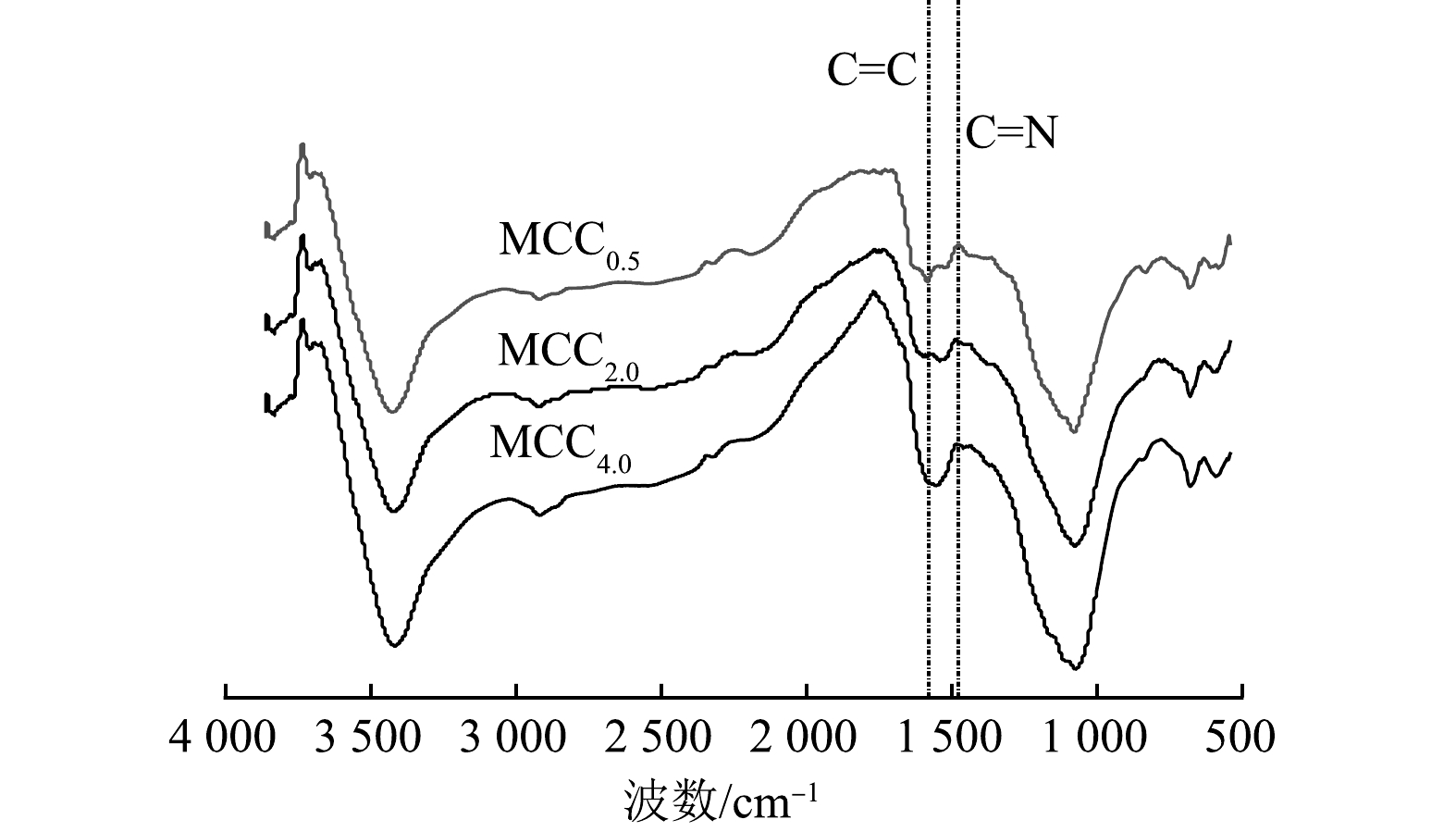
图4是MCC0.5、MCC2.0和MCC4.0的傅立叶红外光谱图。在3 300~3 500 cm−1处的宽吸收带可归因于—OH的伸缩振动,峰值2 800~3 000 cm−1的弱、宽带峰是由脂肪基团的—CH的伸缩振动引起的[21],在1 580 cm−1附近的吸收峰对应于芳香环C=C键的伸缩振动。MCCx在1 476 cm−1附近出现的特征峰意味着三聚氰胺掺杂带来芳香族化合物的C=N键的拉伸振动。通过三聚氰胺进行氮掺杂对炭材料成功进行了修饰,有利于金霉素分子被π—π静电吸引在MCCx的表面。
-
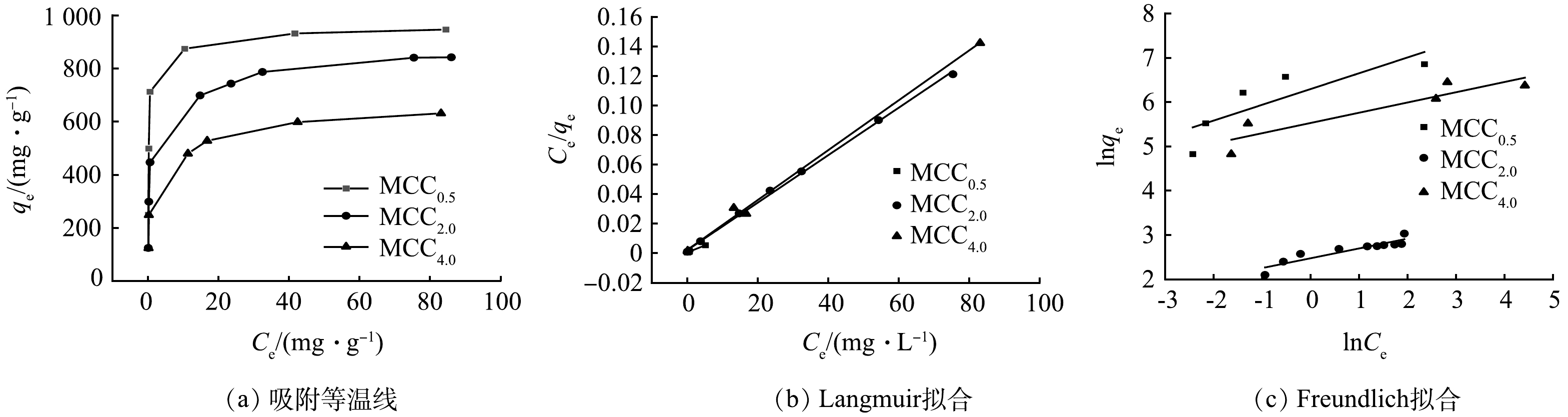
图5(a)~(c)为MCCx对金霉素的吸附等温线、Langmuir拟合和Freundlich拟合结果。从图5(a)可以看出,3种碳材料对金霉素都有着较强的吸附能力。从表4中 Langmuir 和 Freundlich 模型的拟合参数可知,Langmuir 模型拟合效果优于 Freundlich 模型。 Langmuir吸附模型拟合的相关性系数(R)皆大于0. 995,说明MCCx对金霉素主要为单分子层吸附, 即吸附以化学吸附为主,也存在层间扩散的多分子层吸附。 MCC0.5对金霉素的吸附容量最高可达1 056 mg·g−1,明显高于MCC2.0的814 mg·g−1和MCC4.0的597 mg·g−1的最大吸附容量,这是材料孔隙结构、表面化学、原子掺杂等方面的差异导致的。综合BET测试结果可知,MCC0.5的比表面积和微孔数量最高,这是金霉素分子接触并吸附在材料上的有利条件,由于金霉素分子可进入微孔孔道,微孔孔容较高也有利于材料的吸附进程进行,此外,MCC0.5表面含有较多的吡啶N官能团,也有利于吸附的进行。
-
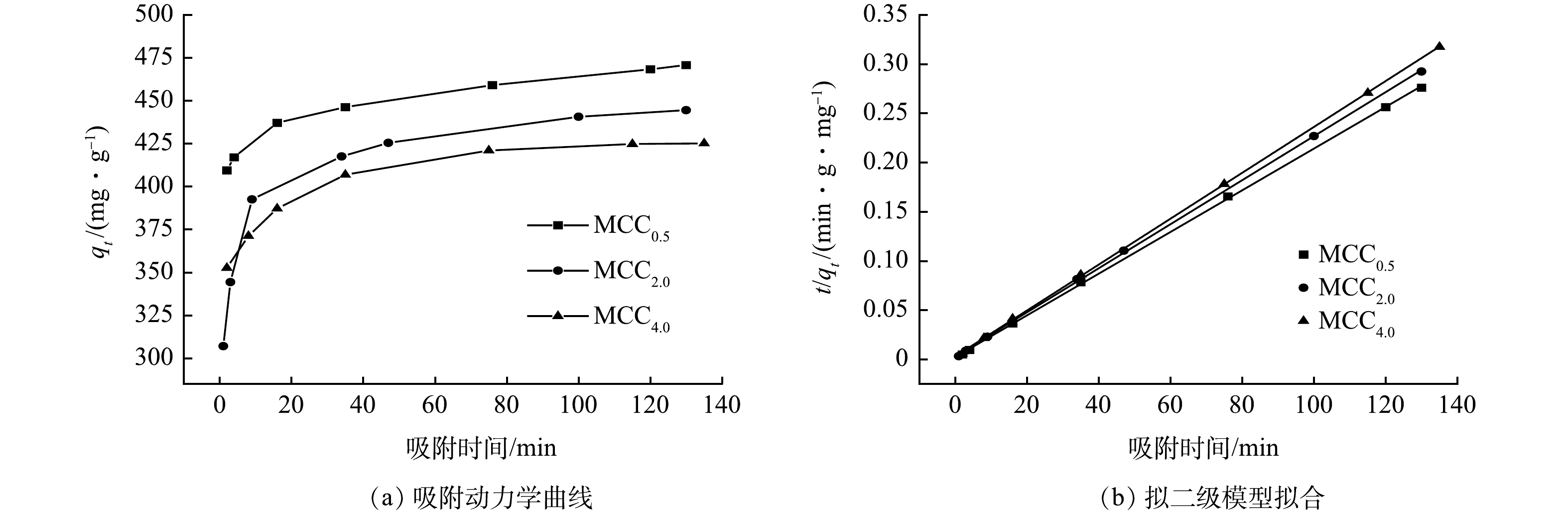
图6是3种吸附剂对金霉素的吸附动力学曲线(a)和拟二级模型拟合图(b)。金霉素水溶液的初始质量浓度(C0)为100 mg·L−1。从图6(a)能够看出,在前10 min时,3种不同形貌的吸附剂(MCC0.5,MCC2.0,MCC4.0)对金霉素的吸附速率都很高。这是由于吸附刚开始时,金霉素在吸附剂孔道、表面的浓度梯度引起的,此时推动力最大。随着吸附的进行,吸附剂活性位点逐渐减少,同时,剩余溶液中的浓度驱动力也降低,导致3种吸附剂的吸附速率逐渐降低。3种材料中MCC0.5的平衡吸附量更大,MCC2.0和MCC4.0吸附效果稍弱于MCC0.5。
表5列出了根据准二级吸附动力学计算的数据和平衡时间。由表5可知,MCC0.5、MCC2.0、MCC4.0到达平衡浓度的时间分别约是60、65、70 min。根据拟二级动力学计算得出MCC0.5、MCC2.0、MCC4.0的最大吸附量分别为472、446、429 mg·g−1。从吸附速率、吸附平衡时间及最大吸附量能够发现当MCC0.5作为吸附剂时吸附性能最好,这可能仍归因于其表面的物理多孔结构。这也与BET测试结果相符,大量的微孔对吸附起了很关键的作用。由图6可以清晰地发现MCCx对金霉素的吸附符合准二级吸附动力学模型,相关系数均能达到0.99。
-
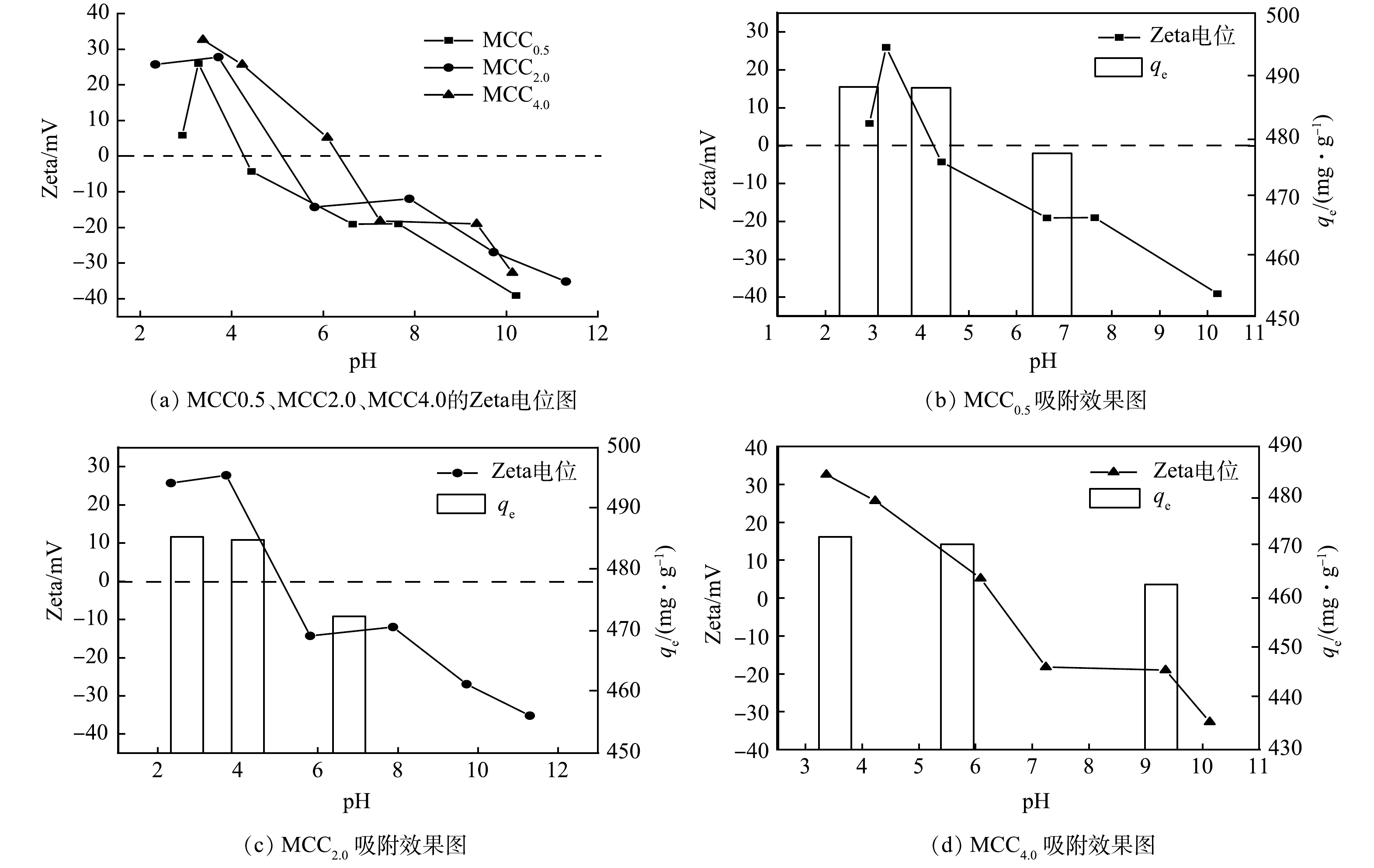
图7显示了MCC0.5、MCC2.0、MCC4.0在pH为2~10时样品的Zeta电位,MCC0.5、MCC2.0、MCC4.0的零电荷点(pHpzc)分别为4.27、5.11、6.36,这意味着3种材料在pH为2~pHpzc的环境中表面电荷为正值。当pH大于零电荷点时,吸附剂表面电荷为负值。
由于溶液pH对现有的金霉素的结构有明显的影响,所以pH是研究金霉素吸附反应的一个重要因素。在2-10的广泛的pH范围内,MCC0.5均展现出较高的吸附能力,在吸附过程中,MCC0.5和金霉素分子之间的π-π相互作用、静电吸附占主导地位。在pH小于pHpzc时,MCCx表面带正电荷,此时金霉素分子以CTCH3+形式存在,带同性电荷,导致吸附能力下降。随着pH增大,吸附剂表面呈负电性,而金霉素分子以CTCH2+形式存在,此时吸附剂和吸附质表面为相反电荷,产生静电吸引力,吸附性能有所提升。当pH达到7时,金霉素分子开始以阴离子形式存在,此时也与带负电的吸附剂表面相互排斥,导致吸附性能的降低。MCCx在广泛的pH范围内表现出的优异吸附能力,证明了对实际废水处理的广泛适用性。
-
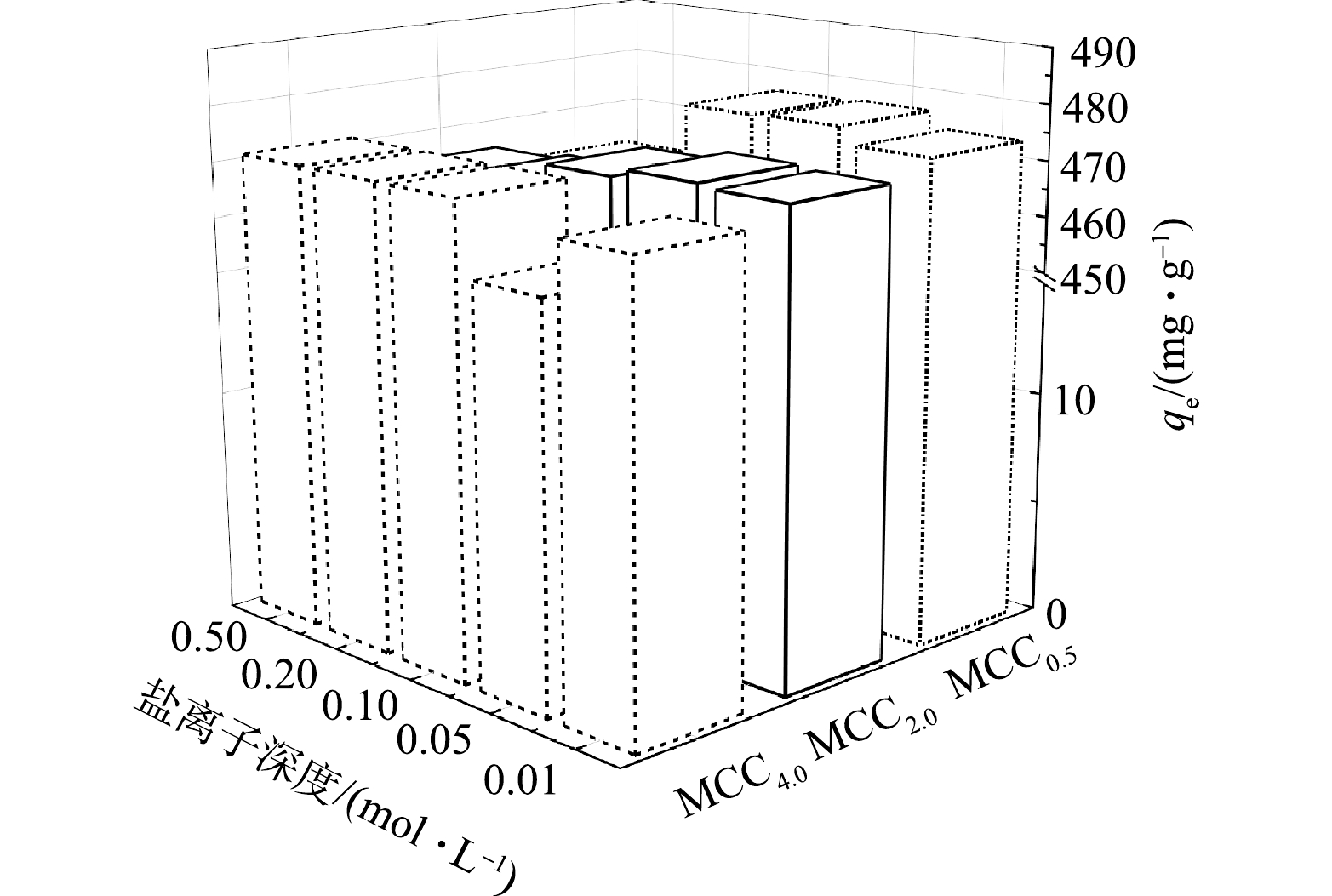
在水环境中经常存在着多重离子成分,金霉素会与其他物质同时存在于环境中,其中离子强度能反映溶液中电性强弱程度。可以通过观测离子浓度来考察吸附机理,因此本实验以NaCl来研究离子强度对吸附的影响。由图8可知,在本研究中,不同的NaCl离子强度条件对水中金霉素的吸附产生了影响,对于吸附性能较弱的MCC4.0,离子浓度不同时,吸附性能会在一定范围内波动,没有观察到明显的线性关系。这可能是由于材料本身吸附性能较弱,且以物理吸附为主,离子强度造成的表面化学差异不是影响吸附剂最终吸附效果的主要因素。而对于吸附性能较好的MCC0.5和MCC2.0,其在离子浓度由小到大的环境中,吸附性能变化的趋势较为明显,0.01 mol·L−1质量浓度时,会有一定的抑制作用,随着浓度的提升,吸附性能先增加后大幅减弱。说明当盐离子浓度超过一定范围后,一定会对吸附过程产生抑制作用,这可能是由于金霉素溶液中含有的氯离子和钠离子浓度高,使得吸附剂表面产生屏蔽效应,降低了吸附剂与金霉素之间的静电吸引力,从而降低了金霉素与吸附剂进行化学吸附的程度。这也侧面说明,MCC0.5和MCC2.0的吸附过程是物理吸附和化学吸附的综合作用。不同于吸附性能较弱的MCC4.0,由于表面结构的影响,物理吸附性能与化学吸附性能均较弱,环境中微弱的离子浓度变化,未造成明显的吸附能力的差异,说明MCC4.0适用于高离子浓度环境中的吸附。
-
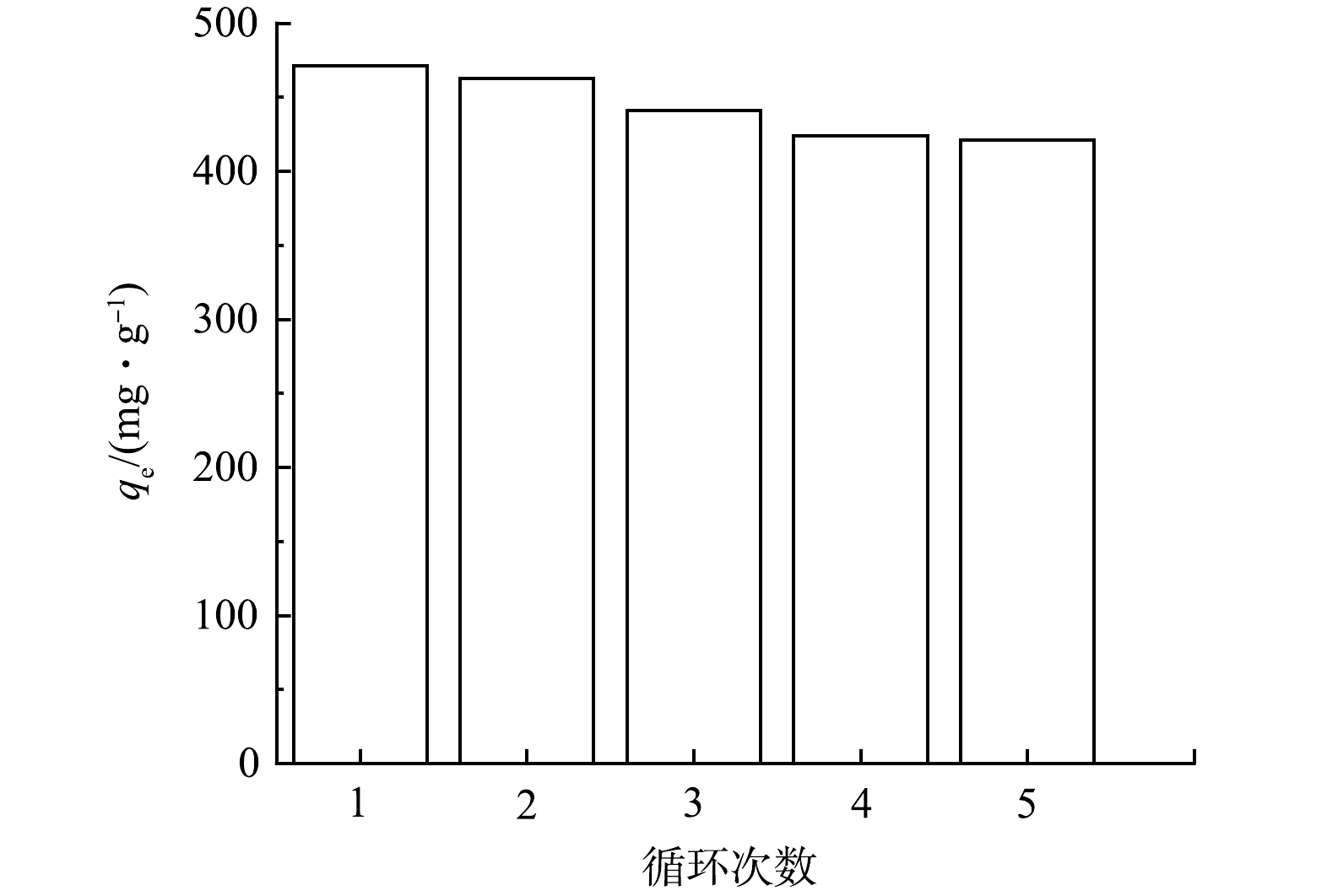
为了了解材料的可持续使用能力,将MCC0.5结合再生手段,用进行了5次吸附实验。由图9可见,MCC0.5循环吸附金霉素溶液5次后,MCC0.5的吸附量下降了10.5%,由471 mg·g−1下降至421 mg·g−1。吸附能力下降的原因可能是由于吸附位点在多次使用后失活,或是由于高温再生的方法导致了微小的孔隙结构的改变,从而降低了吸附性能。综合而言,经过5次循环使用后,MCC0.5仍具有很好的吸附能力,优于大部分已报道的现有吸附剂。且该再生手段不需要甲醇、盐酸等溶液洗脱,因此,此种材料可以降低使用成本,是一种很好的绿色吸附剂。
-
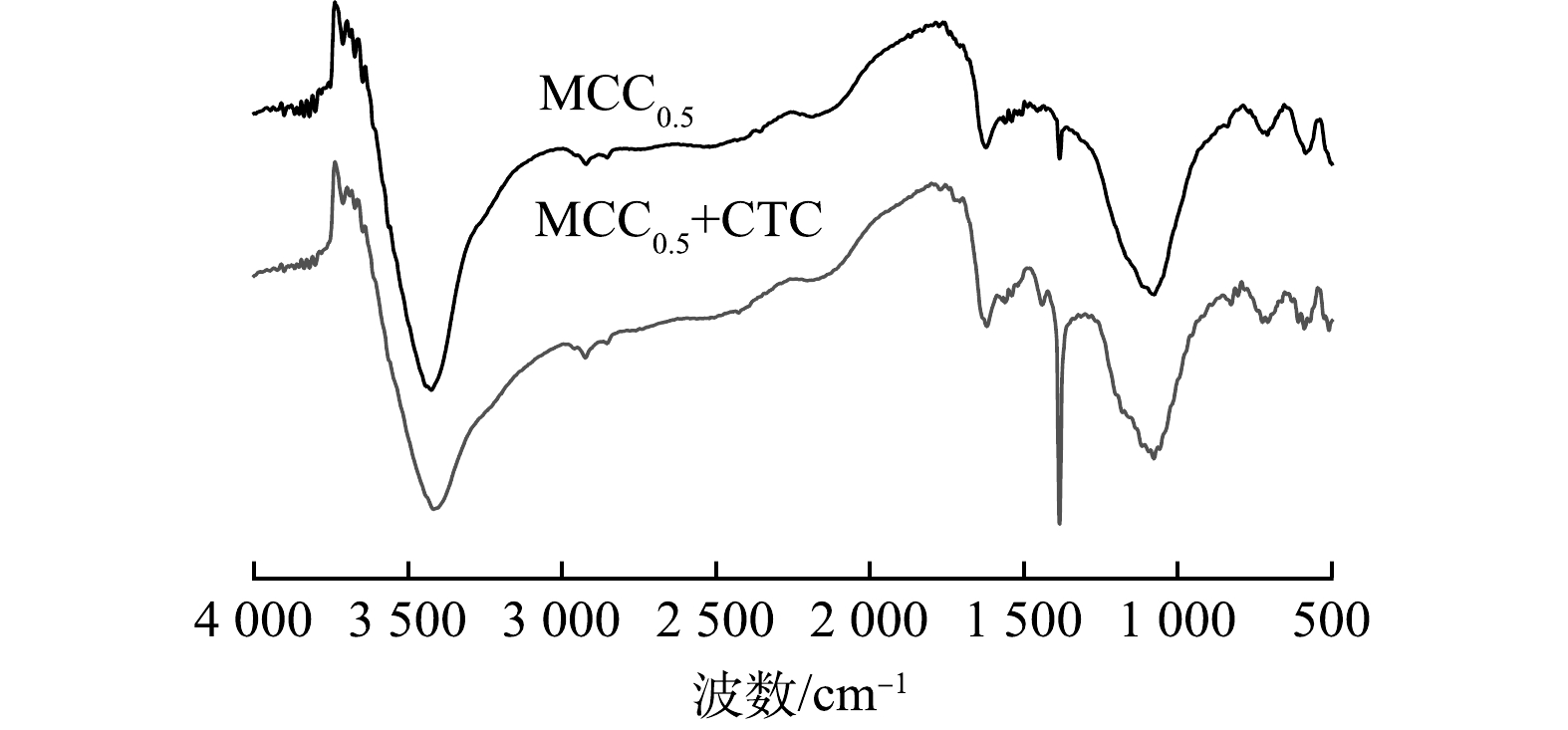
1) FTIR傅立叶红外光谱表征。图10为MCC0.5吸附盐酸金霉素前后的傅立叶红外光谱图。由图10可知,吸附盐酸金霉素前后的特征峰基本相似。对比吸附前后,吸附盐酸金霉素后的MCC0.5在1 380cm−1处—OH特征峰振动频率的增强归因于MCC0.5吸附抗生素分子中的羧基或者内酯官能团,吸附盐酸金霉素后的MCC0.5在1 476 cm−1处的特征峰振动频率增强归因于芳香族化合物的C=N键与盐酸金霉素分子之间实现π—π堆积[22]的弱相互作用吸附。
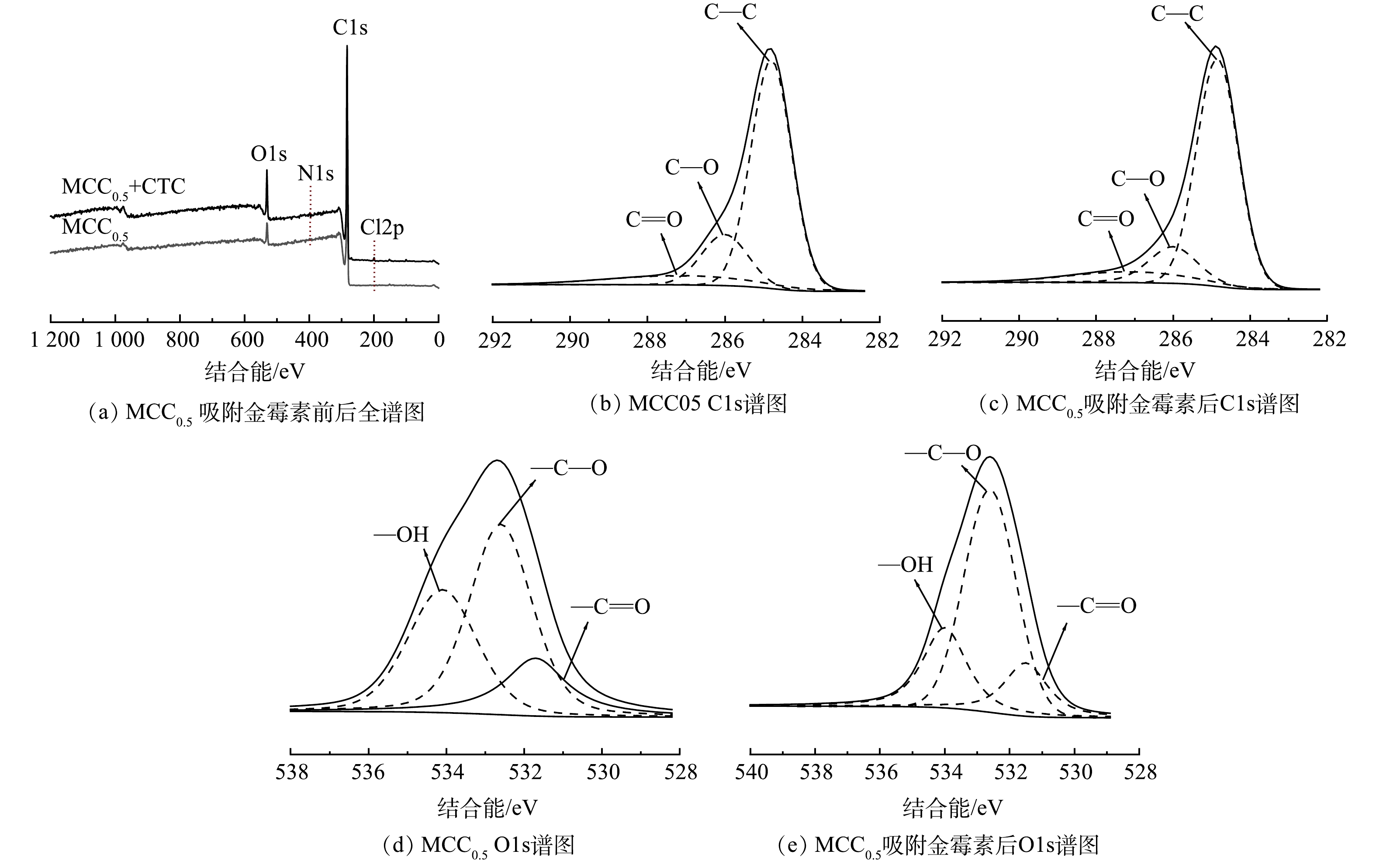
2) XPS分析。通过XPS分析MCC0.5吸附盐酸金霉素后元素和官能团变化结果如图11所示。对比吸附前MCC0.5的XPS分析结果,吸附盐酸金霉素后MCC0.5的全谱图出现了Cl2p的能谱图,由此说明MCC0.5成功地吸附了盐酸金霉素。通过表6可知,MCC0.5吸附盐酸金霉素后C1s能谱中C—O键含量从18.24%减少到15.50%;C=O键含量从10.51%减少到10.40%;能谱O1s中—OH官能团含量减少了9.48%,表明盐酸金霉素的吸附主要通过结合MCC0.5表面的羧基和羟基进行。
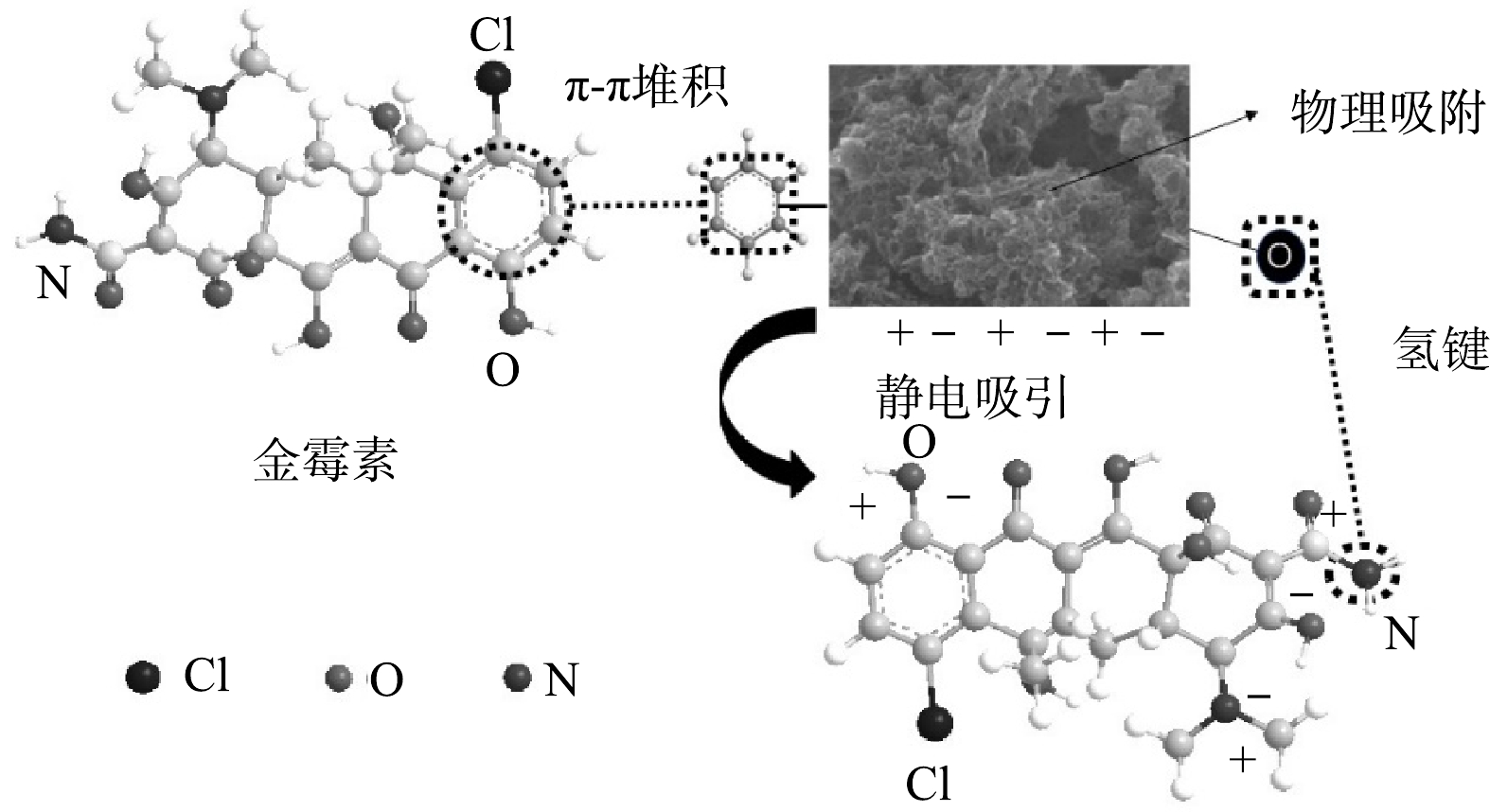
3)吸附机理。图12给出了MCCx对金霉素的吸附机理。吸附过程机理是孔隙结构位点和静电吸附、π—π偶联在吸附过程中共同作用[23]。前人研究表明[24],当碳材料的平均孔径小于抗生素分子第二宽尺寸的1.7倍时,由于尺寸排斥效应,目标抗生素分子不能被有效吸附。将金霉素分子假设为球形的话,其直径大约在0.6~0.9 nm范围内,因此拥有分层多孔结构的MCCx有利于金霉素的扩散和吸附。
MCCx的褶皱片层状和富孔的结构为金霉素的吸附提供了大量的吸附位点。XPS分析结果表明,MCCx含有的大量吡啶氮活性官能团,有利于提高材料的吸附性能。另外,MCCx较多的—C=O和—OH含氧官能团能够分别提供孤电子对结合共轭分子金霉素和金霉素分子形成分子间氢键[25],有利于多层吸附的进行。芳香族化合物的C=N键在吸附金霉素的过程中发挥了重要的作用,可与吸附质之间实现π—π堆积的弱相互作用吸附。在吸附过程中,MCC0.5和金霉素分子之间的π—π相互作用、静电吸附占主导地位。
-
1)本研究以煤沥青为碳源,三聚氰胺为氮源,使用MgO为模板剂耦合KOH活化,通过调节煤沥青与三聚氰胺的质量比制备了MCCx。MCCx具有很大的比表面积,其中MCC0.5的微孔比表面积可达到2 042 m2·g−1,从扫描电镜图上可以看出其表面富含大量孔道,且伴随堆积褶皱片层。
2) Langmuir吸附等温线模型能很好的描述MCC0.5对金霉素的吸附过程,最大理论吸附量达到1 056 mg·g−1。动力学研究结果表明,MCCx对金霉素的吸附符合准二级吸附动力学模型。
3)MCCx对金霉素的主要吸附机理为π—π相互作用、静电吸附和氢键作用。
高比表面积掺氮多孔炭的制备及其对金霉素的吸附性能研究
Preparation of N-doped porous carbon with high specific surface area and its adsorption performance for chlortetracycline
-
摘要: 以煤沥青为碳源,三聚氰胺为氮源,MgO模板耦合KOH活化一步法热解制备具有高比表面积的掺氮多孔炭MCCx,其中x代表不同的氮源添加含量。采用比表面积及孔径分布(BET)、扫描电子显微镜(SEM)、傅立叶变换红外光谱(FTIR)、X射线光电子能谱(XPS)等表征方法对MCCx进行了表征分析,并考察了MCCx对金霉素的吸附性能。结果表明,当煤沥青与三聚氰胺的质量比为0.5时,制得的MCC0.5表面富含大量孔道,且伴随堆积褶皱片层,其微孔比表面积可达到2 042 m2·g−1。傅立叶变换红外光谱图表明MCCx出现了芳香族化合物的C=N键的伸缩振动。XPS分析结果表明三聚氰胺的添加成功为材料引入氮元素,MCC0.5吡啶N含量最高。Langmuir吸附等温线模型能很好的描述MCC0.5对金霉素的吸附过程,最大理论吸附量达到1 056 mg·g−1。Abstract: Coal pitch and melamine were taken as carbo source and nitrogen source, respectively, the nitrogen-doped porous carbon (MCCx) with high specific surface area was prepared by one-step pyrolysis method with MgO template coupled with KOH activation. The MCCx was characterized by BET、SEM、FTIR and XPS, and its adsorption capacity for chlortetracycline (CTC) was investigated. The results showed that when the mass ratio of coal bitumen to melamine was 0.5, the obtained MCC0.5 contained a large number of pores with accumulated fold laminates. The micropores specific surface area of MCC0.5 could reach 2 042 m2·g−1. The FTIR spectra of MCCx showed that the stretching vibration of the C=N of aromatic compounds appeared. XPS results showed that N element was successfully introduced in MCCx with the addition of melamine, and MCC0.5 had the highest pyridine N content. Langmuir adsorption isotherm model could well describe the adsorption process of CTC on MCC0.5, with the maximum theoretical adsorption capacity of 1 056 mg·g−1.
-
Key words:
- melamine /
- chlortetracycline /
- nitrogen doping /
- porous carbon /
- chemical adsorption
-

-
表 1 MCCx比表面积和孔结构参数
Table 1. Specific surface area and pore structure parameters of MCCx
样品 Dap/
nmSBET/
(m2·g−1)Smic/
(m2·g−1)Vt/
(cm3·g−1)Vmic/
(cm3·g−1)MCC0.5 3.99 2 574 2 042 2.57 1.09 MCC2.0 5.64 1 519 1 156 2.14 0.68 MCC4.0 5.68 1 510 1 175 2.15 0.71 注:表中Dap为平均孔径,SBET为比表面积,Smic为微孔比表面积,Vt为总孔容,Vmic为微孔总孔容 表 2 XPS分析元素摩尔分数
Table 2. Mole fractions of elements obtained by XPS analysis
样品 C1s/% O1s/% N1s/% MCC0.5 89.84 7.61 2.55 MCC2.0 89.36 6.19 4.45 MCC4.0 88.59 9.01 2.4 表 3 XPS分析中O1s和N1s谱图的官能团摩尔分数
Table 3. Functional group mole fractions of O1s spectra and N1s spectra in XPS analysis
% 样品 -OH C=O C—O 氧化 N 石墨 N 吡咯 N 吡啶 N MCC0.5 0.20 0.22 0.58 0.23 0.16 0.36 0.25 MCC2.0 0.10 0.16 0.74 0.18 0.13 0.52 0.18 MCC4.0 0.07 0.18 0.75 0.19 0.15 0.49 0.16 表 4 CTC在MCCx上吸附的Langmuir和Freundlich拟合参数
Table 4. Parameters of Langmuir and Freundlich model fitting CTC adsorption onto MCCx
样品 Langmuir模型 Freundlich模型 qm KL /(L·mg−1) R2 1/n KF/((mg) 1-n·g−1Ln) R2 MCC0.5 1056 2.51 0.99 0.16 449 0.69 MCC2.0 814 0.86 0.99 0.15 655 0.85 MCC4.0 597 0.83 0.99 0.17 375 0.84 表 5 MCCx对金霉素吸附的拟二级动力学模型参数
Table 5. Parameters of pseudo-second order reaction kinetics model for CTC onto MCCx
样品 Qm/(mg·g−1)−1) K2/(g·(mg.min)−1) R2 平衡时间/min MCC0.5 472 1.97×10−2 0.99 60 MCC2.0 446 1.66×10−2 0.99 65 MCC4.0 429 1.82×10−2 0.99 70 表 6 XPS分析中C1s和O1s谱图的官能团
Table 6. Functional group of C1s spectra and O1s spectra in XPS analysis
样品 官能团 结合能/eV 峰面积 比例/% MCC0.5-C1s C—C 284.8 106 955.9 71.25 C—O 286.0 27 381.77 18.24 C=O 287.1 15 769.2 10.51 MCC0.5-CIP-C1s C—C 284.9 110 967 74.10 C—O 286.0 23 210.53 15.50 C=O 287.1 15 578.19 10.40 MCC0.5-O1s C=O 531.7 3 486.5 18.86 C—O 532.6 8 829.33 47.76 —OH 534.1 6 171.96 33.38 MCC0.5-CIP-O1s C=O 531.5 5 541.02 16.10 C—O 532.6 20 645.33 60.00 —OH 534.0 8 222.33 23.90 -
[1] TIAN Y J, ZOU J R, FENG L, et al. Chlorella vulgaris enhance the photodegradation of chlortetracycline in aqueous solution via extracellular organic matters (EOMs): Role of triplet state EOMs[J]. Water Research, 2019, 149: 35-41. doi: 10.1016/j.watres.2018.10.076 [2] 陈小平, 王萌, 杨长明, 等. 四环素类抗生素在我国水环境污染现状及其对水生生物的毒性研究进展[J]. 应用化工, 2021, 50(10): 2780-2785. doi: 10.3969/j.issn.1671-3206.2021.10.033 [3] INYINBOR A A, BELLO O S, FADIJI A E, et al. Threats from antibiotics: A serious environmental concern[J]. Journal of Environmental Chemical Engineering, 2018, 6(1): 784-793. doi: 10.1016/j.jece.2017.12.056 [4] GONG H, CHU W. Photodegradation of sulfamethoxazole with a recyclable catalyst[J]. Industrial & Engineering Chemistry Research, 2015, 54(51): 12763-12769. [5] ALTURKI A A, MCDONALD J A, KHAN S J, et al. Removal of trace organic contaminants by the forward osmosis process[J]. Separation and Purification Technology, 2013, 103: 258-266. doi: 10.1016/j.seppur.2012.10.036 [6] NGHIEM L D, COLEMAN P J, ESPENDILLER C. Mechanisms underlying the effects of membrane fouling on the nanofiltration of trace organic contaminants[J]. Desalination, 2010, 250(2): 682-687. doi: 10.1016/j.desal.2009.03.025 [7] MANGLA D, ANNU, SHARMA A, et al. Critical review on adsorptive removal of antibiotics: Present situation, challenges and future perspective[J]. Journal of Hazardous Materials, 2022, 425: 127946. doi: 10.1016/j.jhazmat.2021.127946 [8] CHOWDHURY A, KUMARI S, KHAN A A, et al. Activated carbon loaded with Ni-Co-S nanoparticle for superior adsorption capacity of antibiotics and dye from wastewater: Kinetics and isotherms[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2021, 611: 125868. doi: 10.1016/j.colsurfa.2020.125868 [9] CHENG J, GU J J, TAO W, et al. Edible fungus slag derived nitrogen-doped hierarchical porous carbon as a high-performance adsorbent for rapid removal of organic pollutants from water[J]. Bioresource Technology, 2019, 294: 122149. doi: 10.1016/j.biortech.2019.122149 [10] AWAD A M, JALAB R, BENAMOR A, et al. Adsorption of organic pollutants by nanomaterial-based adsorbents: An overview[J]. Journal of Molecular Liquids, 2020, 301: 112335. doi: 10.1016/j.molliq.2019.112335 [11] SHARMA A, KUMAR N, MUDHOO A, et al. Phytobiomass-based nanoadsorbents for sequestration of aquatic emerging contaminants: An Overview[J]. Journal of Environmental Chemical Engineering, 2023, 11(2): 109506. doi: 10.1016/j.jece.2023.109506 [12] MA P Y, YAO S W, WANG Z Q, et al. Preparation of nitrogen-doped hierarchical porous carbon aerogels from agricultural wastes for efficient pollution adsorption[J]. Separation and Purification Technology, 2023, 311: 123250. doi: 10.1016/j.seppur.2023.123250 [13] ZHANG L L, YAO L, YE L F, et al. Benzimidazole-based hyper-cross-linked polymers for effective adsorption of chlortetracycline from aqueous solution[J]. Journal of Environmental Chemical Engineering, 2020, 8(6): 104562. doi: 10.1016/j.jece.2020.104562 [14] CHEN Y P, ZHENG C H, HUANG Y Y, et al. Removal of chlortetracycline from water using spent tea leaves-based biochar as adsorption-enhanced persulfate activator[J]. Chemosphere, 2022, 286(2): 131770. [15] WANG B Z, BAI W J, WANG G X, et al. CoO modified porous boron nitride fibers for the adsorption and removal of chlortetracycline from aqueous solution[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2022, 632: 127749. doi: 10.1016/j.colsurfa.2021.127749 [16] TAHERAN M, NAGHDI M, BRAR S K, et al. Adsorption study of environmentally relevant concentrations of chlortetracycline on pinewood biochar[J]. Science of the Total Environment, 2016, 571: 772-777. doi: 10.1016/j.scitotenv.2016.07.050 [17] ASLAN S, ŞIRAZI M. Adsorption of sulfonamide antibiotic onto activated carbon prepared from an agro-industrial by-product as low-cost adsorbent: Equilibrium, thermodynamic, and kinetic studies[J]. Water, Air, & Soil Pollution, 2020, 231(5) : 222-241. [18] XU Q, ZHOU Q, PAN M M, et al. Interaction between chlortetracycline and calcium-rich biochar: Enhanced removal by adsorption coupled with flocculation[J]. Chemical Engineering Journal, 2020, 382: 122705. doi: 10.1016/j.cej.2019.122705 [19] MOHAMAD K, SAAD J, SAJAB S, et al. Comparative adsorption mechanism of rice straw activated carbon activated with NaOH and KOH[J]. Sains Malaysiana, 2020, 49(11): 2723-2736. [20] PEZOTI O, CAZETTA A L, SOUZA I P. A. F. , et al. Adsorption studies of methylene blue onto ZnCl2-activated carbon produced from buriti shells (Mauritia flexuosa L. )[J]. Journal of Industrial and Engineering Chemistry, 2014, 20(6): 4401-4407. [21] HU Q L, LIU H Y, ZHANG Z Y, et al. Nitrate removal from aqueous solution using polyaniline modified activated carbon: Optimization and characterization[J]. Journal of Molecular Liquids, 2020, 309: 113057. doi: 10.1016/j.molliq.2020.113057 [22] XIANG Y J, XU Z Y, WEI Y Y, et al. Carbon-based materials as adsorbent for antibiotics removal: Mechanisms and influencing factors[J]. Journal of Environmental Management, 2019, 237: 128-138. [23] HAMADEEN H M, ELKHATIB E A. New nanostructured activated biochar for effective removal of antibiotic ciprofloxacin from wastewater: Adsorption dynamics and mechanisms[J]. Environmental Research, 2022, 210: 112929. doi: 10.1016/j.envres.2022.112929 [24] ZHU X X, LI C Y, LI J F, et al. Thermal treatment of biochar in the air/nitrogen atmosphere for developed mesoporosity and enhanced adsorption to tetracycline[J]. Bioresource Technology, 2018, 263: 475-482. doi: 10.1016/j.biortech.2018.05.041 [25] ÁLVAREZ-TORRELLAS S, RODRÍGUEZ A, OVEJERO G, et al. Comparative adsorption performance of ibuprofen and tetracycline from aqueous solution by carbonaceous materials[J]. Chemical Engineering Journal, 2016, 283: 936-947. doi: 10.1016/j.cej.2015.08.023 -




 下载:
下载: